T4 DNA Ligase产品说明书
T4 DNA 连接酶 #EL0011 Thermo scientific

T4 DNA Ligase ——Thermo scientific #EL0011产品信息特点快速–室温下10分钟内完成粘末端的连接反应。
•该酶在Fermentas公司限制酶、PCR和RT缓冲液(添加ATP)中活性。
•配套提供聚乙二醇溶液以有效进行平末端连接。
应用克隆酶切产生的DNA片段。
•克隆PCR产物。
•连接双链寡聚核苷酸街头或连接物。
•定点诱变。
•扩增片段长度多态性(AFLP)。
•连接酶介导的RNA 检测(3)。
•双链DNA,RNA 或DNA/RNA 复合体中缺口的修复。
•线性DNA自身环化。
说明T4� DNA Ligase催化双链DNA或RNA中毗邻的5’ -磷酸基团和3’-羟基末端之间形成磷酸二酯键。
酶还可以修复双链DNA、RNA或DNA/RNA复合体中的单链切口,连接DNA 的粘性和平末端,但是该酶对单链核酸无酶活性(1, 2)。
T4 DNA Ligase需要辅因子ATP。
浓度1 Weiss u/µl = 200 CEU*/µl5 Weiss u/µl = 1000 CEU*/µl30 Weiss u/µl = 6000 CEU*/µl*一个粘性末端连接单位的是指在16°C 、30分钟内50%连接HindIII酶切的lamda DNA产物所需要的酶的量。
来源含有T4噬菌体克隆基因30的大肠杆菌。
分子量55.3 kDa,单体。
活性单位定义1个活性单位是指在ATP-PPi交换反应中,37°C、20分钟内将1nmol [32PPi]转换为Norit 可吸收形式所需的酶量(Weiss单位**(4)。
酶活性分析混合物:66 mM Tris-HCl (pH 7.6), 6.6 mM MgCl2, 0.066 mM ATP, 10 mM DTT, 3.3�µM [32PP i].** 1个Weiss单位相当于约200个粘性末端连接单位。
t4dna连接酶的作用原理

t4dna连接酶的作用原理T4DNA连接酶(T4 DNA ligase)属于酶类的连接酶,它主要作用是将DNA链的断裂连接起来。
T4DNA连接酶在DNA修复、重组以及基因工程领域有着广泛的应用。
T4DNA连接酶的作用主要包括两个基本步骤:底物DNA识别和连接。
在底物DNA识别和连接之前,需要通过一系列的步骤将底物DNA进行处理。
首先,T4DNA连接酶会与ATP结合形成活化复合物,这一步骤可以增加酶的活性。
活化复合物可以与底物DNA发生作用。
接下来,T4DNA连接酶需要依靠其5'磷酸化底物的末端组成碱基对,与空穴或3'末端的OH基团结合。
连接酶与底物DNA的连接主要是通过底物DNA端的5'磷酸基团的负责寻找配对。
如果5'末端的磷酸基团没有找到环状底物DNA,连接酶就会断裂。
接着,连接酶识别合适的连接底物,并在此处将两个底物的DNA链连接起来。
连接酶利用酶的活性位点上的核苷酸串,并与待连接的DNA产生磷酸二酯键连接,同时释放出底物DNA链的磷酸化基团。
这个连接过程消耗了一个分子的ATP,而T4DNA连接酶可以使用外源的ATP来实现底物的连接。
总结起来,T4DNA连接酶的作用原理可以归纳为以下几个步骤:酶与ATP形成活化复合物,连接酶与底物DNA的5'极末端磷酸化基团或3'极末端的OH基团结合,连接酶将两个底物DNA链的连接位点负责与连接酶上的核苷酸串连接,从而实现底物的连接。
此外,T4DNA连接酶还具有一些特殊的特性和应用。
连接酶可以在无ATP的存在下进行连接反应,但此时反应速率较慢。
连接酶还需要适宜的反应条件,如适宜的温度和pH值。
在基因工程领域,T4DNA连接酶被广泛应用于构建重组DNA载体和进行基因克隆。
通过连接酶的作用,可以将DNA的片段连接在一起,从而构建出预期的DNA载体。
T4dna连接酶使用说明

Certificate of AnalysisProduct name/Description:T4 DNA Polymerase Cat. #:2040A Lot #:K314BA Storage Condition:-20 degrees C Shipping Condition:-20 degrees C Expiration Date:Specified on product label Package Size:100 U Package Contents: 1. T4 DNA Polymerase5 U/μl 100 U 2. 10X T4 DNA Polymerase Buffer (BSA free)1 ml 3. 0.1% BSA 10X 1 mlProduct Documents:Documents for Takara Bio products are available for download at Source: Unit Definition: Quality Control Data:Nuclease contamination test:Endonuclease activity was not detected by agarose gel electrophoresis after incubation of 1 μg ofsupercoiled pBR322 DNA with 2 units of this product for 16 hours at 37°C.Escherichia coli carrying the plasmid containing phage T4 DNA polymerase gene One unit of the enzyme is defined as the amount that incorporates 10 nmol of total nucleotides intoacid-insoluble products in 30 minutes at 37°C and pH 8.8, with heat-denatured calf thymus DNAas the template-primer.It is certified that this product meets above specifications.Manager, Quality AssuranceTAKARA BIO INC.Safety Information :Please refer to our website for safety information :Notice To Purchaser :This product is for research use only. It is not intended for use in therapeutic or diagnostic procedures for humans or animals. Also, do not use this product as food, cosmetic, or household item, etc.Takara products may not be resold or transferred, modified for resale or transfer, or used to manufacture commercial products without written approval from TAKARA BIO INC.If you require licenses for other use, please contact us by phone at +81 77 543 7247 or from our website.Your use of this product is also subject to compliance with any applicable licensing requirements described on the product web page. It is your responsibility to review, understand and adhere to any restrictions imposed by such statements.All trademarks are the property of their respective owners. Certain trademarks may not be registered in all jurisdictions.。
T4 DNA Ligase使用说明书

T4 DNA Ligase使用说明书T4 DNA Ligase是一种重要的酶类工具,广泛应用于分子生物学领域中DNA拼接和连接的实验中。
本文将为您详细介绍T4 DNA Ligase的使用方法及注意事项。
一、T4 DNA Ligase的简介T4 DNA Ligase是一种DNA连接酶,能够嫁接DNA链断裂处的末端,形成磷酸二酯键,完成DNA片段的连接。
它在分子克隆、基因工程以及测序等领域具有重要作用。
二、T4 DNA Ligase的用途1. DNA连接:T4 DNA Ligase可用于连接DNA片段,如重组DNA、插入DNA载体等。
2. 测序修饰:在测序实验中,T4 DNA Ligase可用于修饰DNA片段,方便后续测序操作。
三、T4 DNA Ligase的使用方法1. 实验准备:将T4 DNA Ligase取出放置于冰上解冻,配制工作液。
2. 反应体系:按照实验要求配制反应体系,包括DNA片段、缓冲液、T4 DNA Ligase等。
3. 反应条件:根据实验要求确定适宜的反应温度和时间,一般在16-25摄氏度下进行反应。
4. 加酶条件:将适量T4 DNA Ligase加入反应体系中,轻轻混匀后,放置于适宜温度反应。
5. 反应终止:加入终止液终止反应,如热处理或添加酶失活液。
四、T4 DNA Ligase的注意事项1. 避免反复冻融:为保证酶活性,避免T4 DNA Ligase的反复冻融操作。
2. 注意保存条件:将T4 DNA Ligase储存在-20摄氏度干燥冰箱中,远离酶解冻或受潮。
3. 酶活检测:使用T4 DNA Ligase前应对其酶活进行检测,确保反应的准确性和可靠性。
4. 实验操作注意:在操作过程中应注意消耗性品的消耗量,避免浪费。
综上所述,T4 DNA Ligase作为一种重要的DNA连接酶,在分子生物学实验中起着关键作用。
了解并熟练掌握其使用方法,对于科研工作者来说至关重要。
希望本文所提供的使用说明书能够帮助您顺利完成实验,并取得预期的研究成果。
T4 DNA 连接酶

T4 DNA Ligase即T4 DNA连接酶,可以催化粘端或平端双链DNA或RNA的5’-P末端和3’-OH末端之间以磷酸二酯键结合,该催化反应需A TP作为辅助因子。
同时T4 DNA连接酶可以修补双链DNA、双链RNA 或DNA/RNA杂合物上的单链缺刻(single-strand nicks)。
用途:T4 DNA Ligase常用于DNA片段和载体、linker或adaptor等的连接。
也可以用于缺刻修复及Ligase 介导的RNA检测。
来源:本T4 DNA Ligase由大肠杆菌表达,表达基因的来源为T4嗜菌体。
活性定义:One unit is defined as the amount of enzyme required to give 50% ligation of HindIII fragments of lambda DNA in 30 min at 16℃in 20 μl of the assay mixture containing 50 mM Tris, pH 7.5, 10 mM MgCl2, 10 mM DTT, 1 mM ATP, 25 μg/ml BSA and a 5'-DNA termini concentration of 0.12 μM(300 μg/ml)。
200U等于1个Weiss unit,以Weiss unit计,本产品共1000单位。
纯度:不含DNA内切酶、外切酶和磷酸酯酶,不含RNA酶,满足常规连接反应要求。
酶储存溶液:20 mM Tris, pH 7.5, 50 mM KCl, 1 mM DTT, 0.1 mM EDTA and 50%(v/v)glycerol。
10X Ligation Buffer:400 mM Tris, pH 7.8, 100 mM MgCl2, 100 mM DTT, 5 mM A TP。
失活或抑制:65℃孵育10分钟可以导致T4 DNA Ligase失活;NaCl或KCl浓度大于200mM时强烈抑制T4 DNA Ligase。
PH0642 T4连接酶 T4 DNA Ligase 实验操作手册与方法
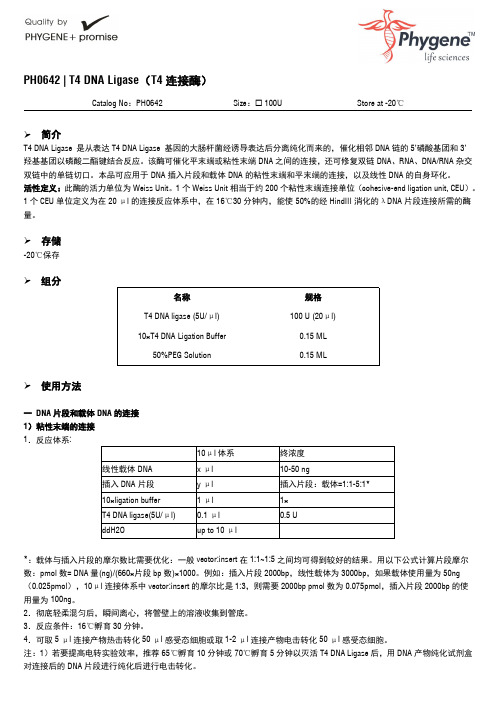
10μl 体系 x μl y μl 1 μl 0.1 μl up to 10 μl
终浓度 10-50 ng 插入片段:载体=1:1-5:1* 1× 0.5 U
*:载体与插入片段的摩尔数比需要优化:一般 vector:insert 在 1:1~1:5 之间均可得到较好的结果。用以下公式计算片段摩尔 数:pmol 数= DNA 量(ng)/(660×片段 bp 数)×1000。例如:插入片段 2000bp,线性载体为 3000bp,如果载体使用量为 50ng (0.025pmol),10μl 连接体系中 vector:insert 的摩尔比是 1:3,则需要 2000bp pmol 数为 0.075pmol,插入片段 2000bp 的使 用量为 100ng。 2.彻底轻柔混匀后,瞬间离心,将管壁上的溶液收集到管底。 3.反应条件:16℃孵育 30 分钟。 4.可取 5 μl 连接产物热击转化 50 μl 感受态细胞或取 1-2 μl 连接产物电击转化 50 μl 感受态细胞。 注:1)若要提高电转实验效率,推荐 65℃孵育 10 分钟或 70℃孵育 5 分钟以灭活 T4 DNA Ligase 后,用 DNA 产物纯化试剂盒 对连接后的 DNA 片段进行纯化后进行电击转化。
2.彻底轻柔混匀后,瞬间离心,将管壁上的溶液收集到管底。 3.反应条件:16℃孵育 30 分钟。 4.65℃孵育 10 分钟或 70℃孵育 5 分钟灭活 T4 DNA Ligase。连接产物可以直接进行限制性内切酶酶切反应。
注意事项
1. T4 DNA Ligase 的最终用量不要超过推荐的用量,否则影响连接效率。 2. PEG 可以极大提高平末端的连接效率,我们推荐加入终浓度为 5% PEG Solution 以提高平末端的连接效率。 3. 为了提高转化效率,转化时建议所加入连接产物的量不要超过感受态细胞体积的 10%。 4. 由于 T4 DNA Ligase 中含有甘油,比较粘稠容易挂壁,建议使用前短暂离心将液体收集到管底,取样时枪头尽量不要深入 液面太深以免粘在枪头上造成损失。
T4 DNA Ligase使用说明

T4DNA Ligase使用说明货号:T1410储存条件:-20℃保存,避免反复冻融,10×T4DNA Ligase Buffer建议分装使用。
浓度:3U/μL来源:重组大肠杆菌产品内容:T4DNA Ligase60U10×T4DNA Ligase Buffer30μL产品说明:该酶在以ATP做辅酶的情况下,可以催化相邻DNA链的5'-磷酸集团和3'-羟基之间的链接反应。
平末端和粘性末端均可。
此酶液可以催化双链RNA与双链DNA连接,但不能催化单链核酸的连接。
活性单位定义:1个Weiss活性单位是指在ATP-PPi交换反应中,37℃、20min内将1nmol[32PPi]转换为Norit 可吸收形式所需的酶量。
1个Weiss活性单位相当于约200个粘性末端连接单位。
1个粘性末端连接单位:20μL反应体系(50mM Tris-HCl pH7.5),10mM MgCl2,10mM DTT,1mM ATP,25μg/ml BSA,0.12μM(300μg/ml的5'DNA末端)中,在16℃、30min内50%连接Hind III 酶切的Lambda DNA产物所需要的酶量。
使用示例:1、先将10×T4DNA Ligase Buffer在冰上融化,并进行短暂的离心。
2、以10μL连接体系示例,在微量离心管中加入以下各种成分:组成成分体积目的DNA片段约0.1pmol载体DNA约0.01pmol10×T4DNA Ligase Buffer1μLT4DNA Ligase0.5-1μLddH2O补足至10μL3、16℃连接过夜。
4、将3-5μL连接产物转化至100μL感受态细胞中。
注意事项:1、载体DNA和连接片段的摩尔比:对于不同的载体和DNA片段,要取得成功的连接,应分别建立具有不同摩尔数比例的连接反应,在大多数情况下,DNA片段的摩尔数应控制在载体DNA摩尔数的3-10倍。
T4dna连接酶使用说明

Certificate of AnalysisProduct name/Description:T4 DNA Polymerase Cat. #:2040A Lot #:K314BA Storage Condition:-20 degrees C Shipping Condition:-20 degrees C Expiration Date:Specified on product label Package Size:100 U Package Contents: 1. T4 DNA Polymerase5 U/μl 100 U 2. 10X T4 DNA Polymerase Buffer (BSA free)1 ml 3. 0.1% BSA 10X 1 mlProduct Documents:Documents for Takara Bio products are available for download at Source: Unit Definition: Quality Control Data:Nuclease contamination test:Endonuclease activity was not detected by agarose gel electrophoresis after incubation of 1 μg ofsupercoiled pBR322 DNA with 2 units of this product for 16 hours at 37°C.Escherichia coli carrying the plasmid containing phage T4 DNA polymerase gene One unit of the enzyme is defined as the amount that incorporates 10 nmol of total nucleotides intoacid-insoluble products in 30 minutes at 37°C and pH 8.8, with heat-denatured calf thymus DNAas the template-primer.It is certified that this product meets above specifications.Manager, Quality AssuranceTAKARA BIO INC.Safety Information :Please refer to our website for safety information :Notice To Purchaser :This product is for research use only. It is not intended for use in therapeutic or diagnostic procedures for humans or animals. Also, do not use this product as food, cosmetic, or household item, etc.Takara products may not be resold or transferred, modified for resale or transfer, or used to manufacture commercial products without written approval from TAKARA BIO INC.If you require licenses for other use, please contact us by phone at +81 77 543 7247 or from our website.Your use of this product is also subject to compliance with any applicable licensing requirements described on the product web page. It is your responsibility to review, understand and adhere to any restrictions imposed by such statements.All trademarks are the property of their respective owners. Certain trademarks may not be registered in all jurisdictions.。
T4 DNA Ligase中文使用说明 Thermo
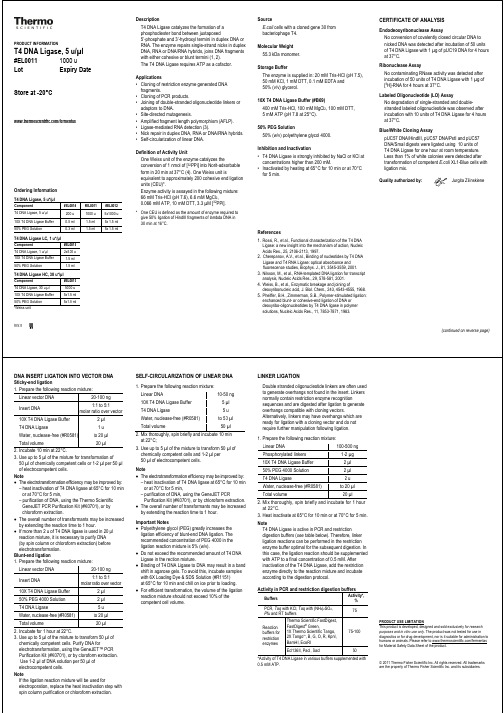
PRODUCT INFORMATIONT4 DNA Ligase, 5 u/µl#EL00111000 uLot Expiry DateStore at -20°C/fermentasOrdering InformationT4 DNA Ligase, 5 u*/µlComponent #EL0014 #EL0011 #EL0012 T4 DNA Ligase, 5 u/µl 200 u 1000 u 5x1000 u10X T4 DNA Ligase Buffer 0.5 ml 1.5 ml 5x 1.5 ml 50% PEG Solution0.3 ml 1.5 ml 5x 1.5 mlT4 DNA Ligase LC, 1 u*/µlComponent #EL0016T4 DNA Ligase, 1 u/µl 2x500 u10X T4 DNA Ligase Buffer 1.5 ml50% PEG Solution 1.5 mlT4 DNA Ligase HC, 30 u*/µlComponent #EL0013T4 DNA Ligase, 30 u/µl 5000 u10X T4 DNA Ligase Buffer 5x1.5 ml50% PEG Solution5x1.5 ml*Weiss unitRev.8 V DescriptionT4 DNA Ligase catalyzes the formation of aphosphodiester bond between juxtaposed5’-phosphate and 3’-hydroxyl termini in duplex DNA orRNA. The enzyme repairs single-strand nicks in duplexDNA, RNA or DNA/RNA hybrids, joins DNA fragmentswith either cohesive or blunt termini (1, 2).The T4 DNA Ligase requires ATP as a cofactor.Applications•Cloning of restriction enzyme generated DNAfragments.•Cloning of PCR products.•Joining of double-stranded oligonucleotide linkers oradaptors to DNA.•Site-directed mutagenesis.•Amplified fragment length polymorphism (AFLP).•Ligase-mediated RNA detection (3).•Nick repair in duplex DNA, RNA or DNA/RNA hybrids.•Self-circularization of linear DNA.Definition of Activity UnitOne Weiss unit of the enzyme catalyzes theconversion of 1 nmol of [32PPi] into Norit-adsorbableform in 20 min at 37°C (4). One Weiss unit isequivalent to approximately 200 cohesive end ligationunits (CEU)*.Enzyme activity is assayed in the following mixture:66 mM Tris-HCl (pH 7.6), 6.6 mM MgCl2,0.066 mM ATP, 10 mM DTT, 3.3 µM [32PPi].*One CEU is defined as the amount of enzyme required togive 50% ligation of HindIII fragments of lambda DNA in30 min at 16°C.SourceE.coli cells with a cloned gene 30 frombacteriophage T4.Molecular Weight55.3 kDa monomer.Storage BufferThe enzyme is supplied in: 20 mM Tris-HCl (pH 7.5),50 mM KCl, 1 mM DTT, 0.1 mM EDTA and50% (v/v) glycerol.10X T4 DNA Ligase Buffer (#B69)400 mM Tris-HCl, 100 mM MgCl2, 100 mM DTT,5 mM ATP (pH 7.8 at 25°C).50% PEG Solution50% (w/v) polyethylene glycol 4000.Inhibition and Inactivation• T4 DNA Ligase is strongly inhibited by NaCl or KCl atconcentrations higher than 200 mM.• Inactivated by heating at 65°C for 10 min or at 70°Cfor 5 min.References1.Rossi, R., et al., Functional characterization of the T4 DNALigase: a new insight into the mechanism of action, NucleicAcids Res., 25, 2106-2113, 1997.2.Cherepanov, A.V., et al., Binding of nucleotides by T4 DNALigase and T4 RNA Ligase: optical absorbance andfluorescence studies, Biophys. J., 81, 3545-3559, 2001.3.Nilsson, M., et al., RNA-templated DNA ligation for transcriptanalysis, Nucleic Acids Res., 29, 578-581, 2001.4.Weiss, B., et al., Enzymatic breakage and joining ofdeoxyribonucleic acid, J. Biol. Chem., 243, 4543-4555, 1968.5.Pheiffer, B.H., Zimmerman, S.B., Polymer-stimulated ligation:enchanced blunt- or cohesive-end ligation of DNA ordeoxyribo-oligonucleotides by T4 DNA ligase in polymersolutions, Nucleic Acids Res., 11, 7853-7871, 1983.CERTIFICATE OF ANALYSISEndodeoxyribonuclease AssayNo conversion of covalently closed circular DNA tonicked DNA was detected after incubation of 50 unitsof T4 DNA Ligase with 1 µg of pUC19 DNA for 4 hoursat 37°C.Ribonuclease AssayNo contaminating RNase activity was detected afterincubation of 50 units of T4 DNA Ligase with 1 µg of[3H]-RNA for 4 hours at 37°C.Labeled Oligonucleotide (LO) AssayNo degradation of single-stranded and double-stranded labeled oligonucleotide was observed afterincubation with 10 units of T4 DNA Ligase for 4 hoursat 37°C.Blue/White Cloning AssaypUC57 DNA/HindIII, pUC57 DNA/PstI and pUC57DNA/SmaI digests were ligated using 10 units ofT4 DNA Ligase for one hour at room temperature.Less than 1% of white colonies were detected aftertransformation of competent E.coli XL1-Blue cells withligation mix.Quality authorized by: Jurgita Zilinskiene(continued on reverse page)。
T4 DNA ligase说明书

活性定义 在20 μl的连接反应体系中,6 μg的λDNA-Hind Ⅲ的分解物在16℃ 下反应30分钟时,有90%以上的DNA片段被连接所需要的酶量定义 为1个活性单位(U)。 本酶的 1 U 相当于 ATP-PPi 交换反应中 0.008 Weiss Unit。
纯度 1. 2,000 U的本酶和1 μg的λ-Hind Ⅲ片段在37℃下反应16小时,
T4 Dakara Code : D2011A
包装
T4 DNA Ligase(350 U/μl) 10×T4 DNA Ligase Buffer
25,000 Units 1 ml
保 存 : -20℃
制品说明 本酶催化相邻 DNA 链的 5’-P 末端和 3’-OH 末端以磷酸二酯键结合 的反应,需 ATP 作辅酶。本酶不仅可以催化粘性末端之间或平滑末 端之间的 DNA 的连接,也可以催化 DNA 与 RNA 之间以及少数 RNA 之间的连接。
V2012.01
DNA的电泳谱带不发生变化。。 2. 2,000 U的本酶和1 μg的Supercoiled pBR322 DNA在37℃下反
应16小时,DNA的电泳谱带不发生变化。 3. 2,000 U的本酶和1 μg的16S,23S rRNA在37℃下反应16小时,
RNA的电泳谱带不发生变化。
用途 1. DNA 片段和载体 DNA 的连接。 2. DNA 片段和 Linker 或 Adaptor DNA 的连接。
去磷酸化处理,以防止其自身环化。 2. 16℃过夜反应。 3. 加入 2.5 μl(1/10 量)的 3 M CH3COONa(pH5.2)。 4. 加入 62.5 μl(2.5 倍量)的冷无水乙醇,-20℃放置 30~60 分
T4连接酶

产品பைடு நூலகம்途:
DNA片段和载体DNA的连接。(参见欣百诺实验方 案)。
DNA片段和Linker或Adaptor DNA的连接。
使用建议:
粘末端的连接反应: 插入片段和载体的摩尔浓度比特别重 要,此比例在2-6之间最好,低于2:1就会导致较低的连接效 率,高于6:1则会导致多个插入。摩尔比请按载体与插入片段 DNA浓度及分子大小来计算。
1ml
质量保证:
经多次柱纯化,SDS-PAGE胶检测仅可见清晰单一的目的 条带;PCR方法检测无大肠杆菌DNA残留,无核酸内、外 切酶污染。
活性定义:
在20 ml的连接反应体系中, 6 mg的λDNA-Hind III的分解 物在16℃下反应30分钟时, 有90%以上的DNA片段被连接 所需要的酶量定义为1个单位。
仅供科研使用,不能应用于人体
技术咨询电话:400-600-0940
近岸蛋白质科技有限公司
地址:上海市浦东新区张江高科技园区蔡伦路720号2号楼 电话:021-50798060 邮箱:product@
保存温度:-20oC 产品包装:
T4 DNA连接酶 (350U/μl)
80μl
2×Quick Ligation Buffer
1ml
10×T4 DNA Ligation Buffer
M5 T4 DNA Ligase 使用说明书

101422-186M5T4DNA Ligase 使用说明书产品名称单位货号M5T4DNA ligase 10000u MF016-T M5T4DNA ligase 20000u MF016-01M5T4DNA ligase 5×20000uMF016-05【储存条件】长期保存,请置于-20˚C ,有效期24个月。
经常使用,也请置于-20˚C 保存,聚合美建议客户将M5T4DNA Ligase Buffer 分装保存,以保证缓冲液中的活性物质稳定。
【产品简介】M5T4DNA ligase 是将源于T4噬菌体的T4DNA 连接酶基因在大肠杆菌中高效表达,经过多次柱层析纯化而获得的高效率、高纯度、高活性的DNA 连接酶。
该酶具有催化双链DNA 或RNA 上相邻的5´-磷酸末端和3´-羟基末端形成磷酸二酯键的特性。
不仅能够催化平齐末端或粘性末端之间的连接,还可以修复双链DNA 、RNA 或DNA/RNA 杂交双链中的单链切刻。
M5T4DNA 连接酶经过严格的质控检测,确保该产品具有最高的活性和纯度。
【单位定义】(以粘性末端活性单位)1单位是指在20μl 1×M5T4DNA ligase 反应缓冲液中,16˚C 反应条件下,30分钟能使50%经HindIII 消化的λDNA 片段[5’端浓度为0.12μM (300μg/ml)]连接所需要的酶量。
【产品组分】MF016-TMF016-01M5T4DNA Ligase25μl 50μl 10×M5T4DNA Ligase Buffer125ul2x125ul【反应条件】1X M5T4DNA Ligase 反应缓冲液:50mM Tris-HCl (pH7.5@25˚C),10mM MgCl 2,10mM DTT,1mM ATP 。
推荐DNA 5’末端浓度为0.1-1.0μM,16˚C 温育。
热失活:65˚C 10分钟。
CSB-DEM049 T4 DNA 连接酶 使用说明书

产品说明书产品名称T4DNA连接酶来源大肠杆菌重组表达货号CSB-DEM049产品形态液体储存条件-20±5°C分子量55.3kDa质量控制无核酸外切酶和核酸内切酶残留有效期24个月产品说明T4DNA Ligase(T4DNA连接酶),可以催化平末端或粘性末端双链DNA或RNA的5'-P末端和3'-OH 末端之间以磷酸二酯键结合,该催化反应需ATP作为辅助因子。
同时T4DNA连接酶可以修补双链DNA、双链RNA或DNA/RNA杂合物上的单链缺刻。
本品适用于限制性内切酶酶切片段、Linker或Adapter等的连接,也可以用于切刻修复及Ligase介导的RNA检测。
产品组分组分编号组分名称规格规格规格1T4DNA ligase(400U/μL)40KU80KU400KU210×T4DNA Ligase Buffer300μL600μL 1.5mL*2使用方法1.组分使用量ddH2O Up to20μL10×T4DNA Ligase Buffer2μLT4DNA ligase(400U/μL)1μL载体DNA约50-100ng插入片段约载体摩尔数的3倍注:平末端载体与DNA片段进行连接时,应先将载体进行去磷酸化处理,以防发生自连接现象。
为提高连接效率,每20µL反应体系中可以加2µL50%PEG4000。
2.16℃反应过夜。
3.转化实验1)将连接产物加入到100µL感受态细胞中(连接产物不应超过感受态细胞的1/10),轻弹混匀,冰上孵育30min。
2)将离心管于42℃,热激90sec,之后立刻置于冰水浴静置2-3min。
3)向离心管中加入900µL LB或SOC培养基,37℃,220rpm,振荡培养1h。
4)2500g离心5min,吸去900µL上清,用剩余培养基重悬菌体,用无菌涂布棒将剩余菌体在正确抗性的平板上涂布均匀,待菌液被平板吸收后,37℃倒置培养过夜。
T4 DNA Ligase说明书

T4 DNA Ligase, 5 u/µl#EL0011 1000 u Lot Expiry Date Store at -20°C Ordering InformationT4 DNA Ligase, 5 u*/μl Component #EL0014 #EL0011 #EL0012 T4 DNA Ligase, 5 u/µl 200 u 1000 u 5x1000 u 10X T4 DNA Ligase Buffer 0.5 ml 1.5 ml 5x 1.5 ml 50% PEG Solution 0.3 ml1.5 ml5x 1.5 mlT4 DNA Ligase LC, 1 u*/μl Component #EL0016 T4 DNA Ligase, 1 u/µl 2x500 u 10X T4 DNA Ligase Buffer 1.5 ml 50% PEG Solution 1.5 mlT4 DNA Ligase HC, 30 u*/μl Component #EL0013 T4 DNA Ligase, 30 u/µl 5000 u 10X T4 DNA Ligase Buffer 5x1.5 ml 50% PEG Solution 5x1.5 ml*Weiss unit Rev.7Description T4 DNA Ligase catalyzes the formation of a phosphodiester bond between juxtaposed5’-phosphate and 3’-hydroxyl termini in duplex DNA or RNA. The enzyme repairs single-strand nicks in duplex DNA, RNA or DNA/RNA hybrids, joins DNA fragments with either cohesive or blunt termini (1, 2). The T4 DNA Ligase requires ATP as a cofactor. Applications•Cloning of restriction enzyme generated DNA fragments. •Cloning of PCR products. •Joining of double-stranded oligonucleotide linkers or adaptors to DNA. •Site-directed mutagenesis. •Amplified fragment length polymorphism (AFLP). •Ligase-mediated RNA detection (3). • Nick repair in duplex DNA, RNA or DNA/RNA hybrids.• Self-circularization of linear DNA.Definition of Activity UnitOne Weiss unit of the enzyme catalyzes theconversion of 1 nmol of [32PPi] into Norit-adsorbableform in 20 min at 37°C (4). One Weiss unit isequivalent to approximately 200 cohesive end ligation units (CEU)*.Enzyme activity is assayed in the following mixture:66 mM Tris-HCl (pH 7.6), 6.6 mM MgCl 2,0.066 mM ATP, 10 mM DTT, 3.3 µM [32PPi].* One CEU is defined as the amount of enzyme required to give 50% ligation of HindIII fragments of lambda DNA in 30 min at 16°C.SourceE.coli cells with a cloned gene 30 frombacteriophage T4. Molecular Weight55.3 kDa monomer.Storage BufferThe enzyme is supplied in: 20 mM Tris-HCl (pH 7.5),50 mM KCl, 1 mM DTT, 0.1 mM EDTA and50% (v/v) glycerol.10X T4 DNA Ligase Buffer (#B69)400 mM Tris-HCl, 100 mM MgCl 2, 100 mM DTT,5 mM ATP (pH 7.8 at 25°C). 50% PEG Solution50% (w/v) polyethylene glycol 4000.Inhibition and Inactivation• T4 DNA Ligase is strongly inhibited by NaCl or KCl atconcentrations higher than 200 mM.•Inactivated by heating at 65°C for 10 min or at 70°Cfor 5 min.References1. Rossi, R., et al., Functional characterization of the T4 DNALigase: a new insight into the mechanism of action, NucleicAcids Res., 25, 2106-2113, 1997.2. Cherepanov, A.V., et al., Binding of nucleotides by T4 DNA Ligase and T4 RNA Ligase: optical absorbance and fluorescence studies, Biophys. J., 81, 3545-3559, 2001.3. Nilsson, M., et al., RNA-templated DNA ligation for transcript analysis, Nucleic Acids Res., 29, 578-581, 2001.4. Weiss, B., et al., Enzymatic breakage and joining of deoxyribonucleic acid, J. Biol. Chem., 243, 4543-4555, 1968.5. Pheiffer, B.H., Zimmerman, S.B., Polymer-stimulated ligation: enchanced blunt- or cohesive-end ligation of DNA or deoxyribo-oligonucleotides by T4 DNA ligase in polymer solutions, Nucleic Acids Res., 11, 7853-7871, 1983. QUALITY CONTROL Endodeoxyribonuclease AssayNo conversion of covalently closed circular DNA to nicked DNA was detected after incubation of 50 unitsof T4 DNA Ligase with 1 µg of pUC19 DNA for 4 hoursat 37°C.Ribonuclease AssayNo contaminating RNase activity was detected afterincubation of 50 units of T4 DNA Ligase with 1 µg of[3H]-RNA for 4 hours at 37°C.Labeled Oligonucleotide (LO) AssayNo degradation of single-stranded and double-stranded labeled oligonucleotide was observed afterincubation with 10 units of T4 DNA Ligase for 4 hoursat 37°C.Blue/White Cloning AssaypUC57 DNA/HindIII, pUC57 DNA/PstI and pUC57 DNA/SmaI digests were ligated using 10 units of T4 DNA Ligase for one hour at room temperature.Less than 1% of white colonies were detected aftertransformation of competent E.coli XL1-Blue cells withligation mix.Quality authorized by:Jurgita Zilinskiene (continued on reverse page)DNA INSERT LIGATION INTO VECTOR DNA Sticky-end ligation1. Prepare the following reaction mixture:Linear vector DNA 20-100 ngInsert DNA1:1 to 5:1 molar ratio over vector10X T4 DNA Ligase Buffer 2 µlT4 DNA Ligase 1 u Water, nuclease-free (#R0581) to 20 µlTotal volume 20 µl2. Incubate 10 min at 22°C.3. Use up to 5 µl of the mixture for transformation of50 µl of chemically competent cells or 1-2 µl per 50 µl of electrocompetent cells.Note∙The electrotransformation efficiency may be improved by: – heat inactivation of T4 DNA ligase at 65°C for 10 min or at 70°C for 5 min,– purification of DNA, using the GeneJET™ PCRPurification Kit (#K0701), or by chloroform extraction. ∙The overall number of transformants may be increased by extending the reaction time to 1 hour.∙ If more than 2 u of T4 DNA ligase is used in 20 μl reaction mixture, it is necessary to purify DNA (by spin column or chloroform extraction) before electrotransformation.Blunt-end ligation1. Prepare the following reaction mixture:Linear vector DNA 20-100 ngInsert DNA1:1 to 5:1 molar ratio over vector10X T4 DNA Ligase Buffer 2 µl50% PEG 4000 Solution 2 µlT4 DNA Ligase 5 u Water, nuclease-free (#R0581) to 20 µl Total volume 20 µl2. Incubate for 1 hour at 22°C.3. Use up to 5 µl of the mixture to transform 50 µl of chemically competent cells. Purify DNA for electrotransformation, using the GeneJET™ PCR Purification Kit (#K0701), or by cloroform extraction. Use 1-2 µl of DNA solution per 50 µl of electrocompetent cells.NoteIf the ligation reaction mixture will be used for electroporation, replace the heat inactivation step with spin column purification or chloroform extraction. SELF-CIRCULARIZATION OF LINEAR DNA1. Prepare the following reaction mixture:Linear DNA 10-50 ng10X T4 DNA Ligase Buffer 5 µlT4 DNA Ligase 5 uWater, nuclease-free (#R0581) to 50 µlTotal volume 50 µl2. Mix thoroughly, spin briefly and incubate 10 minat 22°C;3. Use up to 5 µl of the mixture to transform 50 µl ofchemically competent cells and 1-2 µl per50 µl of electrocompetent cells.Note∙The electrotransformation efficiency may be improved by:– heat inactivation of T4 DNA ligase at 65°C for 10 minor at 70°C for 5 min,– purification of DNA, using the GeneJET™ PCRPurification Kit (#K0701), or by chloroform extraction.∙ The overall number of transformants may be increasedby extending the reaction time to 1 hour.Important Notes∙ Polyethylene glycol (PEG) greatly increases theligation efficiency of blunt-end DNA ligation. Therecommended concentration of PEG 4000 in theligation reaction mixture is 5% (w/v).∙ Do not exceed the recommended amount of T4 DNALigase in the rection mixture.∙ Binding of T4 DNA Ligase to DNA may result in a bandshift in agarose gels. To avoid this, incubate sampleswith 6X Loading Dye & SDS Solution (#R1151)at 65°C for 10 min and chill on ice prior to loading.∙ For efficient transformation, the volume of the ligationreaction mixture should not exceed 10% of thecompetent cell volume.LINKER LIGATIONDouble stranded oligonucleotide linkers are often usedto generate overhangs not found in the insert. Linkersnormally contain restriction enzyme recognitionsequences and are digested after ligation to generateoverhangs compatible with cloning vectors.Alternatively, linkers may have overhangs which areready for ligation with a cloning vector and do notrequire further manipulation following ligation.1. Prepare the following reaction mixture:Linear DNA 100-500 ngPhosphorylated linkers 1-2 µg10X T4 DNA Ligase Buffer 2 µl50% PEG 4000 Solution 2 µlT4 DNA Ligase 2 uWater, nuclease-free (#R0581) to 20 µlTotal volume 20 µl2. Mix thoroughly, spin briefly and incubate for 1 hourat 22°C.3. Heat inactivate at 65°C for 10 min or at 70°C for 5 min.NoteT4 DNA Ligase is active in PCR and restrictiondigestion buffers (see table below). Therefore, linkerligation reactions can be performed in the restrictionenzyme buffer optimal for the subsequent digestion. Inthis case, the ligation reaction should be supplementedwith ATP to a final concentration of 0.5 mM. Afterinactivation of the T4 DNA Ligase, add the restrictionenzyme directly to the reaction mixture and incubateaccording to the digestion protocol.Activity in PCR and restriction digestion buffersBuffersActivity*,%PCR, Taq with KCl, Taq with(NH4)2SO4, Pfu and RT buffers75Reactionbuffers forrestrictionenzymesFastDigest®,FastDigest® Green,1X Tango™, 2XTango™, B, G, O, R,KpnI, BamHI, EcoRI75-100Ecl136II, SacI 50*Activity of T4 DNA Ligase in various buffers supplemented with0.5 mM ATP.PRODUCT USE LIMITATION.This product is developed, designed and sold exclusively for researchpurposes and in vitro use only. The product was not tested for use indiagnostics or for drug development, nor is it suitable for administration tohumans or animals. Please refer to for MaterialSafety Data Sheet of the product.。
NEB-T4 DNA Lagase注意事项

一、关于NEB M0202 T4 DNA 连接酶的使用方法和常见问题及解答1、产品特性和使用方法产品说明:该酶催化契合的双链DNA或RNA的5'-磷酸末端和3'-羟基末端形成磷酸二酯键。
该酶不仅能够催化平滑末端或粘性末端DNA之间的连接,还可以修复双链DNA、RNA或DNA/RNA杂交双链中的单链切口(1)。
--------------------------------------------------------------------------------来源:源于E.coli C600 pcl857 pPLc28 lig8 (2)。
应用:限制性酶切片段的克隆 (3)。
将linker或adapters 连接到DNA片段的平滑末端。
反应缓冲液: 1X T4 DNA Ligase Buffer:[50 mM Tris-HCl, 10 mM MgCl2, 10 mM DTT, 1 mM ATP, 25 µg/ml BSA, (pH 7.5 @ 25°C)]。
推荐DNA浓度(0.1 - 1 µM 的5′末端)。
使用注意:ATP是反应必须的辅因子。
这一点与要求NAD作辅因子的大肠杆菌DNA连接酶不同。
如在反应体系中补加1 mM的ATP,连接反应还可以在NEB提供的四种限制性内切酶缓冲液(NEBuffers)或在T4 DNA多聚核苷酸激酶缓冲液中进行。
质量保证:无核酸内、外切酶污染。
每批T4 DNA连接酶均通过模拟克隆实验进行检测,该实验可以检测出待连接DNA末端的任何破坏。
结果表明>99.9%的DNA末端未受任何降解。
单位定义(粘性末端活性单位):在20µl连接反应体系、0.12µM(300µg/ml)的5'-末端浓度条件下,16°C反应30分钟,能使50% 的经Hind Ⅲ消化的λDNA片段连接所需的酶量定义为一个NEB单位。
T4 DNA Ligase
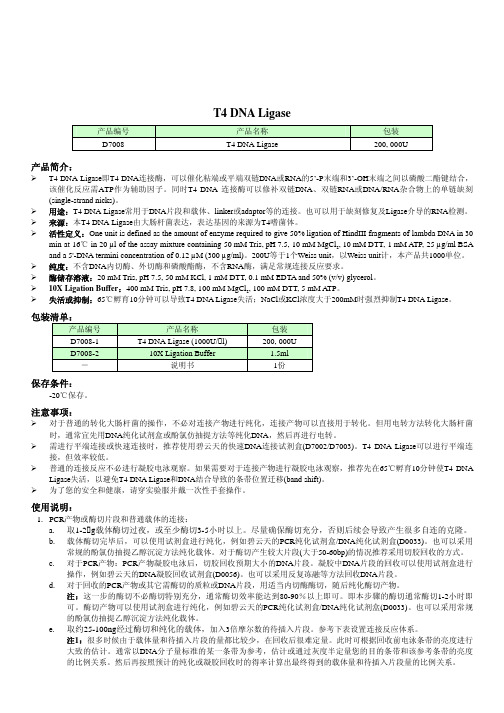
e. 随后即可直接取连接产物用于转化感受态细菌。 3. Linker或RNAi片段和载体的连接:
a. 载体的酶切和纯化同步骤1a和1b。 b. Linker或RNAi片段的退火可以选择适当的DNA退火缓冲液,例如碧云天的Annealing Buffer for DNA Oligos (5X)
(D0251), 进行退火反应。 c. 长度大于8bp的Linker或退火的RNAi片段,可以按照5:1至10:1的比例和载体进行连接反应。例如载体为0.03pmol,则
注2:通常每个反应使用0.2-0.5µl连接酶已经足够,如果希望进一步提高连接效率,可以把连接酶的用量提高至1µl。
载体
约50-100ng
待插入片段
约载体摩尔数的3倍
10X Ligation Buffer
2µl
双蒸水或MilliQ水
至20µl
T4 DNA ligase
0.2-0.5µl
总体积
约20µl
2. PCR产物和T载体的连接:
a. PCR产物凝胶电泳后,切胶回收预期大小的DNA片段。凝胶中DNA片段的回收可以使用试剂盒进行操作,例如碧云
天的DNA凝胶回收试剂盒(D0056)。也可以采用反复冻融等方法回收DNA片段。
b. 按照T载体的说明书取适量T载体,加入3倍摩尔数的待插入片段。参考下表设置连接反应体系。
¾ 用途:T4 DNA Ligase常用于DNA片段和载体、linker或adaptor等的连接。也可以用于缺刻修复及Ligase介导的RNA检测。 ¾ 来源:本T4 DNA Ligase由大肠杆菌表达,表达基因的来源为T4嗜菌体。 ¾ 活性定义:One unit is defined as the amount of enzyme required to give 50% ligation of HindIII fragments of lambda DNA in 30
T4 DNA Ligase说明书

T4DNA Ligase说明书货号:T1410储存条件:-20℃保存,避免反复冻融,10×T4DNA Ligase Buffer建议分装使用。
浓度:3U/μL来源:重组大肠杆菌产品内容:T4DNA Ligase60U10×T4DNA Ligase Buffer30μL产品说明:该酶在以ATP做辅酶的情况下,可以催化相邻DNA链的5'-磷酸集团和3'-羟基之间的链接反应。
平末端和粘性末端均可。
此酶液可以催化双链RNA与双链DNA连接,但不能催化单链核酸的连接。
活性单位定义:1个Weiss活性单位是指在ATP-PPi交换反应中,37℃、20min内将1nmol[32PPi]转换为Norit可吸收形式所需的酶量。
1个Weiss活性单位相当于约200个粘性末端连接单位。
1个粘性末端连接单位:20μL 反应体系(50mM Tris-HCl pH7.5),10mM MgCl2,10mM DTT,1mM ATP,25μg/ml BSA,0.12μM(300μg/ml 的5'DNA末端)中,在16℃、30min内50%连接Hind III酶切的Lambda DNA产物所需要的酶量。
使用示例:1、先将10×T4DNA Ligase Buffer在冰上融化,并进行短暂的离心。
2、以10μL连接体系示例,在微量离心管中加入以下各种成分:组成成分体积目的DNA片段约0.1pmol载体DNA约0.01pmol10×T4DNA Ligase Buffer1μLT4DNA Ligase0.5-1μLddH2O补足至10μL3、16℃连接过夜。
第1页,共2页4、将3-5μL连接产物转化至100μL感受态细胞中。
注意事项:1、载体DNA和连接片段的摩尔比:对于不同的载体和DNA片段,要取得成功的连接,应分别建立具有不同摩尔数比例的连接反应,在大多数情况下,DNA片段的摩尔数应控制在载体DNA摩尔数的3-10倍。
T4 DNA Ligase使用说明书

T4 DNA Ligase使 用 说 明 书TaKaRa Code: D2011A包 装 :T4 DNA Ligase(350 U/μl) 25,000 Units10×T4 DNA Ligase Buffer 1 ml保 存 : -20℃●制品说明本酶催化相邻DNA链的5’-P末端和3’-OH末端以磷酸二酯键结合的反应,需ATP作辅酶。
本酶不仅可以催化粘性末端之间或平滑末端之间的DNA的连接,也可以催化DNA与RNA之间以及少数RNA之间的连接。
●酶贮存溶液Tris-HCl(pH 7.5) 10 mMKCl 50 mMDTT 1 mMEDTA 0.1 mMGlycerol 50 %●起 源: Escherichia coli carrying the plasmid that enable highly expression of T4 DNALigase gene。
●活性定义在20 μl的连接反应体系中,6 μg的λDNA-Hin d III的分解物在16℃下反应30分钟时,有90%以上的DNA片段被连接所需要的酶量定义为1个活性单位(U)。
本酶的1 U相当于ATP-PPi交换反应中0.008 Weiss Unit。
●纯 度1)2,000 U的本酶和1 μg的λ-Hin d III片段在37℃下反应16小时,DNA的电泳谱带不发生变化。
2)2,000 U的本酶和1 μg的Supercoiled pBR322 DNA在37℃下反应16小时,DNA的电泳谱带不发生变化。
3)2,000 U的本酶和1 μg的16S,23S rRNA在37℃下反应16小时,RNA的电泳谱带不发生变化。
●用 途1)DNA片段和载体DNA的连接。
2)DNA片段和Linker或Adaptor DNA的连接。
●使用注意连接反应因末端碱基顺序的不同而反应速度各异,一般有下列倾向:突出末端:Hin d III>Pst I>Eco R I>Bam H I>Sal I平滑末端:Hae III>Alu I>Hin c II>Sma IEco R V>Sca I>Pvu II>Nru I其中连接Hin d III末端的速度约为连接Sal I末端速度的10~40倍;而连接Hae III末端的速度约为连接Sma I末端速度的5~10倍。
T4连接酶说明书

T4 DNA 连接酶SinoBio目录号:M001近岸蛋白质科技有限公司地址:上海市浦东新区张江高科技园区蔡伦路720号2号楼电话:产品描述:T4 DNA连接酶常用于催化双链DNA平末端或互补粘性末端之间的连接反应,也能催化双链RNA 5'-磷酸末端和3'-羟基末端间的连接。
还可以修复双链DNA、RNA或DNA/RNA杂交双链中的单链切口。
以上反应均需消耗ATP。
保存温度:-20oC 产品包装:T4 DNA连接酶(350U/μl)2×Quick Ligation Buffer 10×T4 DNA Ligation Buffer 80μl 1ml 1ml特点:随酶附带10×T4 DNA Ligation Buffer及独特配方的2× Quick Ligation Buffer提供给您更多的选择:而使用10×T4 DNA Ligation Buffer,16℃过夜连接可获得最高的连接效率;使用快连buffer在室温(25℃)下,仅需5分钟即可完成粘性末端或平滑末端DNA片段的连接反应。
质量保证:经多次柱纯化,SDS-PAGE胶检测仅可见清晰单一的目的条带;PCR方法检测无大肠杆菌DNA残留,无核酸内、外切酶污染。
活性定义:在20 ml的连接反应体系中, 6 mg的λDNA-Hind III的分解物在16℃下反应30分钟时, 有90%以上的DNA片段被连接所需要的酶量定义为1个单位。
产品用途:DNA片段和载体DNA的连接。
(参见欣百诺实验方案)。
DNA片段和Linker或Adaptor DNA的连接。
快速连接步骤:1)取50 ng载体和3倍摩尔量的插入片段,用双蒸水调整总体积为10 μl。
2)加入10 μl 2×Quick Ligation Bu ffer,混匀。
3)加入μl T4 DNA连接酶,充分但轻柔混匀(切勿剧烈震荡,可能导致酶部分失活)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
T4 DNA Ligase
使 用 说 明 书
包 装 量:
浓度: 5U/μl
储运温度:-20℃(保存6个月)
制品说明:T4 DNA Ligase 是从表达T4 DNA Ligase 基因的大肠杆菌经诱导表后分离纯化而来的。
它催化
相邻DNA 链的的5’-磷酸末端和3’羟基末端以磷酸二酯键结合反应。
该酶催化平滑末端或粘性末端DNA 的连接,修复双链DNA 、RNA 、DNA/RNA 杂交中的单链中的单链切口。
适用范围:(1)DNA 片段和载体DNA 快速连接;
(2)限制酶切片段的克隆;
(3)将DNA 片段与Linker 或Adaptor 连接。
酶贮存缓冲液:
20mM Tris-HCl (pH7.5), 0.1 mM EDTA , 1mM DTT , 50 mM KCl , 50% glycerol 。
10×Ligation Buffer :
400 mM Tris-HCl , 100 mM MgCl 2, 100 mM DTT ,5 mM ATP(PH7.8),其他成分。
建议连接反应体系: (以 10 μl 反应体系为例)
反应循环的设置:
粘端连接:20~25o C 反应2~5分钟;
平端连接:20~25o C 反应2小时或16 o C 过夜。
NOT FOR HUMAN OR DRUG USE
完。
