人工胃液(USP,无菌)
人工胃液(CHP,无菌)

组成:
名称 人工胃液(ChP,无菌) 使用说明书
编号 CZ0213
Storage
500ml
-20℃
1份
操作步骤(仅供参考):
1、 如果是检测胶囊剂、肠溶片、滴丸剂等,一般采用升降式崩解仪,主要由金属支架、带 有挡板的吊篮组成。将待测的胶囊剂、肠溶片、滴丸剂 6 粒或片浸于人工胃液中,1 小 时内完全崩解,如有 1 粒或片不能完全崩解,应另取 6 粒或片复试,均应符合要求。
相关:
编号 CS0001 DM0007 PW0053 TC0699
名称 ACK 红细胞裂解液(ACK Lysis Buffer) 瑞氏-姬姆萨复合染色液 Western 抗体洗脱液(碱性) 植物总糖和还原糖检测试剂盒(硝基水杨酸法)
北京雷根生ene 人工胃液(ChP,无菌)其英文表述为 Simulated Gastric Fluid,是模拟胃液的 组分和 pH 值的一种溶液。本试剂采用中国药典表述,人工胃液主要由稀酸、胃蛋白酶等 组成,经无菌处理,可用于胶囊剂、肠溶片、滴丸剂等检测,尤其适用于以明胶为基质的 软胶囊和滴丸的检测。
2、 如果进行其他实验,应根据具体实验要求操作。
注意事项:
1、 人工胃液为无菌溶液,如有无菌要求,注意无菌操作。 2、 人工胃液避免反复冻融,以免效率下降。 3、 本产品为强酸性溶液,注意做好安全防护。 4、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: -20℃保存 12 个月有效。4℃可保存 2 个月。
口服固体制剂仿制药一致性评价体内外相关性研究进展

磅賜诗件砒礼Drug Evaluation Research第43卷第12期2020年12月・2565・口服固体制剂仿制药一致性评价体内外相关性研究进展刘湾,涂亮星,杨世林•,金一.江西中医药大学中药固体制剂制造技术国家工程研究中心,江西南昌330004摘要:目前仿制药在我国医药市场占据很大规模,口服固体制剂一致性评价得到的关注最多。
其中药品的体内外相关性一直是研究者关注的重点及难点,如何通过控制再评价品种与参比制剂体外某些特性(如溶出、制剂学因素等)的相似,达到两者体内生物等效,对于缩短药品的一致性评价进度,降低研究成本具有重大的意义。
就目前口服固体制剂一致性评价体内外相关性的相关研究进展进行综述,以期为开展口服固体制剂一致性评价研究工作提供参考。
关键词:口服固体制剂;一致性评价:溶出;制剂学因素中图分类号:R944.2文献标志码:A文章编号:1674-6376(2020)12-2565-06DO1:10.7501/j.issn.l674-6376.2020.12.039Research progress of in vitro and in vivo correlation evaluation method for generic oral solid preparationsLIU Wan,TU Liangxing,YANG Shilin,JIN YiNational Engineering Research Center for Manufacturing Technology of Traditional Chinese Medicine Solid Preparations, Jiangxi University of Traditional Chinese Medicine,Nanchang330004,ChinaAbstract:At present,generic drugs occupy a large scale in Chinese pharmaceutical market,and the consistency evaluation of oral solid preparations gained the most attention.The in vitro-in vivo correlation(IVIVC)study is the hot point and difficulty on researches about evaluation of oral preparations,it is benefit for decreasing the research progress and cost of drug consistency evaluation that how to control the similarity of some vitro characteristics(such as dissolution and formulation factors,etc.)of the reevaluate preparation and the reference preparation to achieve the vivo bioequivalence of them.This article will review the current research progress on the IVIVC of oral solid drug consistency evaluation,in order to provide reference for the study on the consistency evaluation of oral solid preparations.Key words:oral solid preparations;consistency evaluation;dissolution;formulation factors中国是仿制药生产大国,总体仿制药市场规模达到5000亿元,占总药品消费市场的约40%,然而在现有的18.9万个药品批文中,其中95%是仿制药批文,制药企业绝大部分以仿制药为主⑴。
在人工胃液中溶出量

在人工胃液中溶出量
人工胃液是模拟人体胃酸制成的一种液体,在实验中经常用于测定药物在胃内的稳定性和药效。
人工胃液主要由盐酸、胃蛋白酶和胆汁酸等成分组成,能够模拟人体胃酸的酸度和酶的作用,有效模拟了药物在胃内的情况。
在药物研究中,人工胃液可以用来测试药物的溶出量。
药物在胃中的溶出量是指不同时间点内药物在胃液中的溶解度,可以反映出药物在胃中的释放速度和药效。
因此,测试药物在人工胃液中的溶出量具有重要意义。
实验中,将药物样品与人工胃液混合,并在一定时间内的不同时间点采集样品,经过离心、过滤处理后,利用高效液相色谱对其进行检测。
根据药物在不同时间点的检测值,可计算出药物在胃液中的溶出量。
通过测试药物在人工胃液中的溶出量,可以了解药物在胃中的释放规律,为有效控制药物在胃中的释放提供科学依据。
同时,也可以为药物的研究和开发提供重要的实验数据和理论基础。
总之,人工胃液溶出量实验是一项重要的药物研究实验方法,通过测试药物在人工胃液中的溶出量,可以更好地了解药物在胃中的释放规律和药效,为药物的研究和开发提供参考依据。
胃液及十二指肠引流液的检验ppt课件

一般由临床医师或有经验的护士采集。采 用插胃管法,检验前12小时禁食,禁水和禁服抗 酸分泌的药物,插管成功后抽胃液,连续抽1小 时的胃液,全部作为空腹胃液送检,然后再给五 肽胃泌素刺激剂连续采胃液1小时,(每15分 钟留一份,共4份)用于测MAO与PAO。
在日常生活中,随处都可以看到浪费 粮食的 现象。 也许你 并未意 识到自 己在浪 费,也 许你认 为浪费 这一点 点算不 了什么
在日常生活中,随处都可以看到浪费 粮食的 现象。 也许你 并未意 识到自 己在浪 费,也 许你认 为浪费 这一点 点算不 了什么
❖ 2、胃液检查的禁忌症有:
(1)食管V曲张,食管狭窄,食管肿瘤等; (2)严重心脏病,高血压,主动脉瘤等; (3)休克或妊娠晚期; (4)胃大出血患者。
在日常生活中,随处都可以看到浪费 粮食的 现象。 也许你 并未意 识到自 己在浪 费,也 许你认 为浪费 这一点 点算不 了什么
在日常生活中,随处都可以看到浪费 粮食的 现象。 也许你 并未意 识到自 己在浪 费,也 许你认 为浪费 这一点 点算不 了什么
3 粘液 正常胃液有少量分布均匀的粘 液.若出现大量粘液提示胃有炎症,特别是 慢性胃炎.
4 气味 正常胃液可略带酸味。 5 食物残渣 正常胃液在12小时后胃内无食
物残渣.若有食物残渣或呈食糜样,表示胃 蠕动功能减退,幽门狭窄或梗阻,胃扩张, 胃下垂等引起的胃排空延长,有胃滞留.
在日常生活中,随处都可以看到浪费 粮食的 现象。 也许你 并未意 识到自 己在浪 费,也 许你认 为浪费 这一点 点算不 了什么
胃液及十二指肠引流液的检验
❖ 要求: 1、了解胃液和十二指肠引流液的含义,标本 的采集、适应症与禁忌症 2、熟悉检验的项目、检验方法及临床意义
人工胃液(无菌)
注意事项:
1、 人工胃液(无菌)为无菌溶液,如有无菌要求,注意无菌操作。 2、 人工胃液(无菌)避免反复冻融,以免效率下降。 3、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: 12 个月有效。4℃可保存 3 个月。
相关:
编号 CS0001 DM0007 PW0053 TC0699
北京雷根生物技术有限公司
人工胃液(无菌)
简介:
Leagene 人工胃液(无菌)其英文表述为 Simulated Gastric Fluid,是模拟胃液的组分 和 pH 值的一种溶液。本试剂采用中国药典表述,人工胃液主要由稀酸、胃蛋白酶等组成, 经无菌处理,可用于胶囊剂、肠溶片、滴丸剂等检测,尤其适用于以明胶为基质的软胶囊 和滴丸的检测。
组成:
名称 人工胃液(无菌) 使用说明书
编号 CZ0211
Storage
500ml-20℃1份 Nhomakorabea操作步骤(仅供参考):
1、 如果是检测胶囊剂、肠溶片、滴丸剂等,一般采用升降式崩解仪,主要由金属支架、带 有挡板的吊篮组成。将待测的胶囊剂、肠溶片、滴丸剂 6 粒或片浸于人工胃液中,1 小 时内完全崩解,如有 1 粒或片不能完全崩解,应另取 6 粒或片复试,均应符合要求。
名称 ACK 红细胞裂解液(ACK Lysis Buffer) 瑞氏-姬姆萨复合染色液 Western 抗体洗脱液(碱性) 葡植物总糖和还原糖检测试剂盒(硝基水杨酸法)
肠溶包衣技术

肠溶包衣技术一、肠溶包衣的配方和工艺(1)概述许多制剂因药物性质而带有刺激性,也有些制剂因胃液或酶的作用会遭失效。
尤特奇® (丙烯酸共聚物)可用于这些制剂的包衣,同时还可控制制剂在胃肠道定位释放。
(2)产品尤特奇® L,尤特奇® S,尤特奇® FS这三种丙烯酸聚合物含有羧基,因此具有阴离子化合物的性质。
用这类尤特奇®包衣,药物在pH5.5和>pH7的环境中释放,起到在小肠和结肠定位释放的作用。
药物释放还取决于包衣厚度和生理环境中药物的溶解性质。
这些尤特奇®聚合物以水分散体,粉末和有机溶剂溶液等形式供应。
尤特奇®聚合物可作为常见的口服剂型,片剂,胶囊和颗粒的包衣材料。
尤特奇®聚合物化学组成溶解≥PHL 30D-55,L 100-55甲基丙烯酸5.5丙烯酸乙酯L 100,L12.5甲基丙烯酸6.0甲基丙烯酸甲酯(50:50)S 100甲基丙烯酸7.0甲基丙烯酸甲酯(30:70)FS 30D甲基丙烯酸7.0丙烯酸甲酯甲基丙烯酸甲酯(3)药物因素及溶解机制十二指肠溶解:尤特奇®L 100-55或水分散体尤特奇®L 30D-55在大于pH5.5的介质中溶解。
优点:有效而稳定的肠溶包衣成膜剂在小肠上段可迅速溶解。
空肠和回肠中溶解:尤特奇®L在大于pH6.0介质中溶解。
尤特奇®L和尤特奇®S混合物在pH6.0-7.0介质中溶解。
优点:药物和粉末状尤特奇®混合制粒可控制药物释放速率。
结肠给药:尤特奇®S和尤特奇®FS 30D在大于pH7.0介质中溶解。
优点:可制备安全的pH触发型结肠给药制剂。
这几种不同类型的聚合物可按不同比例相互混合,以控制不同的释放速率。
体外试验得到的溶出度曲线必须由临床试验验证。
(4)肠溶包衣的其它辅料增塑剂增塑剂可降低玻璃化温度和最低成膜温度。
抑制副溶血性弧菌的乳酸菌筛选鉴定及其生物学特性研究

基金项目:浙江省基础公益研究计划(编号:LGN22D060003);浙江省生物工程重中之重学科项目(编号:ZS2017005);浙江省“生物工程”一流学科(A类)学生创新计划项目(编号:SZ1000012005050)作者简介:于晨,女,浙江万里学院在读硕士研究生。
通信作者:袁勇军(1976—),男,浙江万里学院教授,硕士生导师,博士。
E mail:yuan2007019@163.com收稿日期:2022 09 13 改回日期:2023 01 07犇犗犐:10.13652/犼.狊狆犼狓.1003.5788.2022.80796[文章编号]1003 5788(2023)06 0012 07抑制副溶血性弧菌的乳酸菌筛选鉴定及其生物学特性研究Screening,identificationandbiologicalcharacteristicsoflacticacidbacteriainhibiting犞犻犫狉犻狅狆犪狉犪犺犪犲犿狅犾狔狋犻犮狌狊于 晨犢犝犆犺犲狀 杨 露犢犃犖犌犔狌 管 峰犌犝犃犖犉犲狀犵 张 捷犣犎犃犖犌犑犻犲 袁勇军犢犝犃犖犢狅狀犵 犼狌狀(浙江万里学院生物与环境学院,浙江宁波 315100)(犆狅犾犾犲犵犲狅犳犅犻狅犾狅犵犻犮犪犾犪狀犱犈狀狏犻狉狅狀犿犲狀狋犪犾犛犮犻犲狀犮犲狊,犣犺犲犼犻犪狀犵犠犪狀犾犻犝狀犻狏犲狉狊犻狋狔,犖犻狀犵犫狅,犣犺犲犼犻犪狀犵315100,犆犺犻狀犪)摘要:目的:丰富功能性乳酸菌资源库,寻找具有副溶血性弧菌拮抗能力的优良乳酸菌出发菌株。
方法:采用牛津杯抑菌试验筛选具有广谱抑菌潜力的乳酸菌菌株,通过生长代谢性能、胃肠液耐受性能、耐盐性、抗生素敏感性、抑菌谱等指标探讨其生物学特性。
结果:以副溶血性弧菌为指示菌,筛选得到6株乳酸菌,经形态学、生理生化、分子生物学鉴定,分别归类于类干酪乳酪杆菌、发酵黏液乳杆菌和植物乳植物杆菌。
其中,类干酪乳酪杆菌A1抑菌活性最佳,24h内菌落总数超过1×109CFU/mL,发酵液pH值稳定在4.1左右,经人工模拟胃液处理2h后,存活率为54.61%,再经人工模拟肠液处理8h后,存活率仍可达45.46%,经10%NaCl胁迫处理24h后,活菌总数>1×105CFU/mL。
人工胃液(USP,无菌)
北京雷根生物技术有限公司
人工胃液(USP ,无菌)
简介:
Leagene 人工胃液(USP ,无菌)其英文表述为Simulated Gastric Fluid ,是模拟胃液的组分和pH 值的一种溶液。
本试剂采用美国药典表述,人工胃液主要由氯化钠、稀酸、胃蛋白酶等组成,经无菌处理,可用于胶囊剂、肠溶片、滴丸剂等检测,尤其适用于以明胶为基质的软胶囊和滴丸的检测。
组成:
操作步骤(仅供参考):
1、 如果是检测胶囊剂、肠溶片、滴丸剂等,一般采用升降式崩解仪,主要由金属支架、带有挡板的吊篮组成。
将待测的胶囊剂、肠溶片、滴丸剂6粒或片浸于人工胃液中,1小时内完全崩解,如有1粒或片不能完全崩解,应另取6粒或片复试,均应符合要求。
2、 如果进行其他实验,应根据具体实验要求操作。
注意事项:
1、 人工胃液为无菌溶液,如有无菌要求,注意无菌操作。
2、 人工胃液避免反复冻融,以免效率下降。
3、 本产品为强酸性溶液,注意做好安全防护。
4、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: -20℃保存12个月有效。
4℃可保存2个月。
相关:
编号 名称 CZ0211 Storage 人工胃液(USP ,无菌) 500ml -20℃ 使用说明书 1份
编号 名称 CS0001 ACK 红细胞裂解液(ACK Lysis Buffer) DM0007 瑞氏-姬姆萨复合染色液 PW0053 Western 抗体洗脱液(碱性) TC0699 植物总糖和还原糖检测试剂盒(硝基水杨酸法)。
人工肠液
北京雷根生物技术有限公司
人工肠液(无菌)
简介:
Leagene 人工肠液又称人工小肠液(无菌),其英文表述为Artificial Intestinal Juice ,是模拟肠液的组分和pH 值的一种溶液。
本试剂采用中国药典表述,人工小肠液主要由磷酸盐、胰蛋白酶等组成,pH 值为6.8,经无菌处理,可用于胶囊剂、肠溶片、滴丸剂等检测,尤其适用于肠溶胶囊的检测。
组成:
操作步骤(仅供参考):
1、 如果是检测胶囊剂、肠溶片、滴丸剂等,一般采用升降式崩解仪,主要由金属支架、带有挡板的吊篮组成。
将待测的胶囊剂、肠溶片、滴丸剂6粒或片浸于人工胃液中,1小时内完全崩解,如有1粒或片不能完全崩解,应另取6粒或片复试,均应符合要求。
2、如果进行其他实验,应根据具体实验要求操作。
注意事项:
1、 人工小肠液(无菌)为无菌溶液,如有无菌要求,注意无菌操作。
2、 人工小肠液(无菌)避免反复冻融,以免效率下降。
3、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: 12个月有效。
4℃可保存3个月。
相关:
编号 名称 CZ0201 Storage 人工小肠液(无菌) 500ml -20℃ 使用说明书 1份
编号 名称 CS0001 ACK 红细胞裂解液(ACK Lysis Buffer) DM0007 瑞氏-姬姆萨复合染色液 PW0053 Western 抗体洗脱液(碱性) TC0699 葡植物总糖和还原糖检测试剂盒(硝基水杨酸法)。
L-a17在体外血浆和人工胃肠液中的稳定性研究

第49卷第8期2021年4月广州化工Guangzhou Chemical IndustryVol. 49 No. 8Apr. 2021L-al7在体外血浆和人工胃肠液中的稳定性研究**基金项目:贵州省科技支撑计划(黔科合支撑[2019]2761号)。
第一作者:李爱红,女,硕士研究生,主要研究方向药代动力学。
通讯作者:廖伟科,男,主要研究方向药代动力学。
李爱红张 宇廖伟科2(1贵州医科大学药学院,贵州贵阳 550004;2贵州省化学合成药物研发利用工程技术研究中心,贵州 贵阳550004)扌商 要:考察L-al7在体外血浆和人工胃/肠液中的稳定性,有助于针对性的进行药物结构优化,提高药物的吸收率,更有 效的指导药物制剂的开发。
采用高效液相色谱法,检测L-H17在大鼠血浆和空白人工胃/肠液、人工胃/肠液中孵育不同时间的含 量变化,计算剩余百分含量。
结果表明L-H17在大鼠血浆及空白人工胃/肠液、人工胃/肠液中孵育不同时间的剩余百分比均在(84. 01 ±0. 51) %〜(105. 57 ±0. 84) %范围内。
L-al7在大鼠体外血浆及模拟人工胃/肠液中稳定性良好。
关键词:L-al7;体外血浆;人工胃液;人工肠液;稳定性中图分类号:R96 文献标志码:A 文章编号:1001-9677(2021)08-0060-04Study on Stability of L-al7 in Plasma in Vitro and SimulatedGastric/Intestinal Fluid *LI Ai-hong 1^, ZHANG Yu^2, LIAO Wei-ke 2(1 School of Pharmacy , Guizhou Medical University , Guizhou Guiyang 550004 ; 2 Guizhou Provincial Engineering Technology Research Center for Chemical Drug R&D, Guizhou Guiyang 550004, China)Abstract : Observing the stability of L-al7 in plasma in vitro and simulated gastric/intestinal fluidswill help to optimize the structure of drugs, improve the absorption rate of drugs, and guide the development of pharmaceutical preparations more effectively. The content changes of L-al7 in rat plasma , blank simulated gastric/intestinal fluids and simulated gastric/intestinal fluids at different incubation time were detected by HPLC , and the remaining percentage content was calculated. The results showed that the remaining percentages of L-al7 in rat plasma and blank simulated gastric/intestinal fluid, and simulated gastric/intestinal fluid for different time were in the range of (84. 01 ±0. 51) % to (105. 57±0. 84)%. L-al7 was stable in plasma in vitro and simulated gastric/intestinal fluids.Key words : L-al7 ; plasma ; simulated gastric fluid ; simulated intestinal fluid ; stability磷脂酰肌醇3-激酶(PI3K )是一类具有双重酶活性的脂类 信使⑴。
溶出度试验国内外-讲课

依据
人体内对药物的吸收部位主要是消化道。 体内环境正常者或体质强壮者,胃肠道内 存在有正常量和正常pH 值的胃酸和肠液; 体内环境非正常者或体质虚弱者,胃酸和 肠液的量及pH 值会各种各样。据文献报道, 随年龄的增长,胃酸缺乏人群的比例会逐 渐增多,50 岁人群中有约50%,60、70 岁 人群中则有近70%,因此,人体内环境各 异,不能一概而论。
日本在进行药品质量再评价中拟定以 下四种基本溶出介质来涵盖消化道内的体 液,且要求在以下四种溶出介质中均应有 “一定弧度”的溶出曲线,以便能保证该 药品用于任何患者时,均有一定的疗效。
(1) pH = 1.2 溶液(取氯化钠2.0g,加水适量使溶解, 加HCl7ml,再加水稀释至1000ml,即得)。Chp通常采 用的0.1mol/L HCl液。 (2) pH = 4.0 醋酸盐缓冲液(0.05mol/L 醋酸0.05mol/L 醋酸钠=16.4:3.6;且若参比制剂在6 h内 仍未能达到85%以上的溶出,则可追加其他pH 值的缓冲 液)。该介质的离子浓度较我国药典附录中记载得低, 且在该介质里的溶出度试验研究,我国目前还进行得比 较少。 (3) pH = 6.8 磷酸盐缓冲液。(取磷酸二氢钾3.4g 和无 水磷酸氢二钠3.55g,加水适量使溶解后,定容至 1000ml,再稀释一倍,即得。离子浓度较Chp附录中记 载的低)。 (4) 水
三、近年来溶出度测定的进展
1.日本于1998 年推出的“药品品质再評价工程” 主要目的是保证口服固体制剂对于不同患者均能具有 较高的生物利用度; 使同一制剂的不同产品均能具有 相同的生物等效性。 采用的手段是“在严格的溶出度试验条件下,在各种 介质中均具有较高的、一定的溶出曲线”来提高体内 外相关性,从而推动对药品对制剂工艺的研究。
usp美国药典结构梳理

USP35-NF-30结构整理vivi2010-10-02USP总目录:1 New Official Text修订文件加快修订过程包括勘误表,临时修订声明(IRAS),修订公告。
勘误表,临时修订声明,修订公告在USP网站上New Official Text部分刊出,勘误表,临时修订公告也会在PF上刊出2front matter前言药典与处方集增补删减情况,审核人员,辅料收录情况3凡例药典,1标题和修订2 药典地位和法律认可3标准复合性4专论和通则5 专论组成6 检验规范和检验方法7 测试结果8 术语和定义9 处方和配药10 包装存储与标签4通则4.1章节列表4.2一般检查和含量测定(章节编号小于1000)检查和含量分析的一般要求检查和含量分析的仪器,微生物检查,生物检查和含量测定,化学检查和含量测定,物理检查和测定4.3一般信息(章节号大于1000)5食物补充剂通则6试剂(试剂,指示剂,溶液等)7参考表性状描述和溶解性查询表(按字母顺序)8食品补充剂各论(字母顺序)9NF各论(辅料标准)10 USP各论11术语附件:通则的章节中文目录(使用起来比较方便,直接找对应章节号即可)一、通用试验和检定(1)试验和检定的总要求1 注射剂11 参比标准物(2)试验和检定的装置16 自动分析方法21 测温仪31 容量装置,如容量瓶、移液管、滴定管,各种规格的误差限度41 砝码和天平(3)微生物学试验51 抗菌效力试验55 生物指示剂:耐受性能试验61 微生物限度试验61 非灭菌制品的微生物检查:计数试验62 非灭菌制品的特定菌检查,如大肠杆菌、金葡菌、沙门氏菌等71 无菌试验(4)生物学试验和检定81 抗生素微生物检定85 细菌内毒素试验87 体外生物反应性试验:检查合成橡胶、塑料、高聚物对哺乳类细胞培养的影响88 体内生物反应性试验:检查上述物质对小鼠、兔iv、ip或肌内植入的影响91 泛酸钙检定111 生物检定法的设计和分析115 右泛醇检定121 胰岛素检定141 蛋白质——生物适应试验,用缺蛋白饲料大鼠,观察水解蛋白注射液和氨基酸混合物的作用151 热原检查法161 输血、输液器及类似医疗装置的内毒素、热原、无菌检查171 维生素B12 活性检定(5)化学试验和检定A 鉴别试验181 有机含氮碱的鉴别191 一般鉴别试验193 四环素类鉴别197 分光光度法鉴别试验201 薄层色谱鉴别试验B 限量试验206 铝211 砷221 氯化物和硫酸盐223 二甲基苯胺226 4-差向脱水四环素231 重金属241 铁251 铅261 汞271 易炭化物试验281 炽灼残渣291 硒C 其他试验和检定301 中和酸能力311 藻酸盐检定331 苯丙胺检定341 多剂量容器注射剂中所加防腐剂含量的气相色谱或极谱法测定345 枸橼酸与其盐以及磷酸盐检定351 甾体检定361 巴比妥酸盐检定371 维生素B12放射示踪物检定381 注射剂橡胶塞检查391 肾上腺素检定401 脂肪和固定油检查411 叶酸检定425 抗生素碘量法检定429 微粒大小的光衍射测量431 甲氧基测定441 烟酸或烟酰胺检定451 亚硝酸盐滴定461 氮测定466 普通杂质的薄层色谱法检查467 有机挥发性杂质检查法467 残留溶剂测定471 氧瓶燃烧法481 核黄素检定501 有机含氮碱的盐511 单一甾醇检定521 磺胺类的色谱法检定531 硫胺检定541 滴定法554 α-生育酚检定561 植物来源物品的一般检查项目563 植物来源物品的各种鉴别项目(植物学部分、显微鉴别、化学鉴别)565 植物提取物的一般提取方法和要求571 维生素A检定:化学法、色谱法581 维生素D检定:色谱法、化学法、生物法591 锌测定(6)物理试验和测定601 气雾剂、鼻喷雾剂、计量吸入剂和干粉吸入剂的各项检测611 乙醇含量测定:蒸馏法、气一液色谱法616 固体的疏松密度和叩击密度测定621 色谱法631 色度检查和标准641 溶解的完全性检查643 总有机炭测定645 水导电性测定651 冻凝温度的测定661 药用容器的检测项目要求671 盛装胶囊和片剂容器加盖后对湿气的通透性试验691 棉花吸附性和纤维长度测定695 结晶性检查696 用溶液测热法测定结晶度698 装量检查699 固体密度(粉粒密度测定法)701 崩解试验711 溶出试验721 蒸馏温度范围(馏程)测定724 通过透皮转运系统药物的释放726 电泳727 毛细管电泳730 等离子体光谱化学检查法731 干燥失重733 炽灼失重736 质谱法741 熔点范围或温度的测定751 眼膏中的金属颗粒测定755 最低装量检查法761 核磁共振771 眼用软膏的要求776 光学显微镜微粒检查法781 旋光度检查785 渗透压摩尔浓度测定法786 用分析筛测量颗粒大小的分布788 注射液中微粒物质测定法789 眼用溶液中微粒物质测定法791 PH测定法795 非灭菌制剂的药物配制要求797 灭菌制剂的药物配制要求801 极谱法811 粉末细度测定821 放射活性药物823 正电子发射层析X线摄影(PET)所用放射性药物的配制831 折光指数测定841 比重测定846 粉末的比表面积测定851 分光光度法与光散射861 外科缝合线直径检查871 附有针的缝合线检查881 外科缝合线、纺织品与膜片的弹力强度检查891 热分析:温度变化、热解重量分析、易熔杂质分析等905 剂量单位的均匀性检查(含量均匀度、装量差异)911 黏度测定921 药品含水量的测定941 结晶型药物的X线衍射分析二、通用资料1010 数据分析方法1015 诊断用放射药的自动合成装置1031 药用容器、医用装置和植入物所用材料的生物相容性检查1035 灭菌用生物指示剂1041 生物制品的批签发1043 细胞、基因和组织工程产品的辅助材料1045 生物技术产品1046 细胞和基因治疗产品1047 生物技术产品的检验法1048 生物技术产品的质量——重组DNA蛋白质产品生产所用细胞表达构成的分析1049 生物技术产品的稳定性试验1050 人或动物来源的细胞系所得生物技术产品的病毒安全性评价1051 玻璃仪器清洗方法1061 颜色的仪器测量1065 离子色谱1072 消毒剂与防腐剂1074 赋形剂生物学安全性评价指导原则1075 复方药物配制质量规范1078 大批量药用赋形剂的生产质量规范1079 储存与运输的质量规范1081 明胶的凝胶强度1086 药品中的杂质来源1087 特性溶出1088 剂型的体外和体内评价1090 体内生物等效性试验指导原则1091 剂型中含有无活性组分的标示1092 溶出试验方法的发展和验证1101 药用滴管1111 非灭菌药品的微生物特征1111 非灭菌药品的微生物特征检查:药用原料和药物制剂的判定标准1112 非灭菌药品中的水活性测定,即在同一温度时,药品中水的蒸气压与纯水蒸气压之比,它等于药品在密闭系统中产生相对湿度的1%1116 清洁室和其他受控环境的微生物评价1117 微生物实验室的质量规范(GLP)1118 监控装置:时间、温度、湿度1119 近红外分光光度法1120 拉曼(Raman)分光光度法1121 药品命名法1136 药品包装:应用单元1146 口服固体药分装在单疗程剂量容器中的检查方法1150 药物剂型的稳定性1151 药物剂型1160 处方调配的药学计算1171 原料药的位相溶解度分析1174 粉末流动性测定1176 处方天平和容量装置1177 包装质量规范1178 分装质量规范1181 扫描电子显微镜1191 调剂工作中的药品稳定性保持1196 药典协调(指欧洲药典、美国药典、日本药局方三方机构讨论协调的原则和方法)1207 灭菌产品包装:完整性评价1208 灭菌试验:隔离系统的验证1209 灭菌:化学和物理化学的指示剂与积分仪1211 药典收载品种的灭菌和灭菌保证1216 片剂脆性检查1221 茶匙(家用标准为5 ml,可作为病人口服液体药物的量具,误差应小于10%)1222 药品灭菌终点的放行参数1223 微生物替代方法的验证1225 药典方法的验证1227 在抗菌效力、微生物限度、灭菌等试验中,微生物的恢复验证1230 血液透析用水1231 药用水的制备和要求1241 在制药系统中,水—固体的相互作用1251 用分析天平称量的要求1265 书写药物处方的指导原则三、饮食增补剂2021 营养和饮食增补剂的微生物计数试验2022 营养和饮食增补剂中不允许存在的微生物(如金葡菌、沙门氏菌、大肠杆菌、梭状芽胞杆菌属)检查法2023 非灭菌的营养和饮食增补剂中的微生物特征2030 植物来源物品的增补资料2040 饮食增补剂的崩解和溶出检查2091 饮食增补剂的重(装)量差异检查2750 饮食增补剂的生产条件与质量要求(与药品有别)。
口服固体制剂的体外溶出试验及体内外相关性研究进展

口服固体制剂的体外溶出试验及体内外相关性研究进展目的:为口服固体制剂的体外溶出试验和体内外相关性(IVIVC)研究的进一步开展提供参考。
方法:以“体外溶出试验”“体内外相关性”“滞后时间”“时間校正因子”“Dissolution test”“IVIVC”“Lag time”“Time scaling”等为关键词,组合检索中国知网、PubMed、Elsevier、Springer等数据库中收录的1990年1月-2017年12月期间发表的相关研究文献,结合笔者自身的研究经验和认识,进行归纳和总结,重点探讨了不同分级IVIVC尤其是A级IVIVC的建立方法。
结果与结论:共获得有效文献39篇。
影响口服固体制剂在体内吸收的主要限制因素为药物活性成分的溶出和跨膜吸收性质,当前的IVIVC主要建立在药物体内吸收符合胃排空或溶出限速特征的基本前提下。
与口服固体制剂的体内药动学研究相比,其体外溶出研究尚未实现严格的标准化,为使体外溶出试验与体内溶出/吸收过程具有更好的相关性,生物相关介质和仿生溶出系统等将是今后的发展方向。
常见的各级IVIVC中,A级IVIVC可以提供最多的信息,优先推荐建立和使用A级IVIVC,此时药物的体外溶出行为往往可以准确反映其体内吸收过程;其次是多重C级以及B级、C级和D级IVIVC。
而随着仿生溶出系统和计算机数据拟合技术等的发展,将来的IVIVC研究并不会局限于缓控释制剂或生物药剂学分类属Ⅱ类药物的速释制剂,可能会有更多关于生物药剂学分类属Ⅲ、Ⅳ类药物的IVIVC研究。
关键词体外溶出试验;体内外相关性;滞后时间;时间校正因子体外溶出试验和溶出行为研究不仅在口服固体制剂的研发和终产品的质量控制中发挥着不可替代的作用,而且是建立体内外相关性(in vitro-in vivo correlations,IVIVC)的基础。
IVIVC是用以描述药物体外溶出特征(通常是药物的体外溶出速率或程度)与体内反应(如血浆药物浓度或吸收的药物总量)间相关关系的一种预测性数学模型。
人工胃液(ChP)

北京雷根生物技术有限公司
人工胃液(ChP)
简介:
Leagene 人工胃液(ChP)其英文表述为Simulated Gastric Fluid ,是模拟胃液的组分和pH 值的一种溶液。
本试剂采用中国药典表述,人工胃液(ChP)主要由稀酸、胃蛋白酶等组成,未经无菌处理,可用于胶囊剂、肠溶片、滴丸剂等检测,尤其适用于以明胶为基质的软胶囊和滴丸的检测。
组成:
操作步骤(仅供参考):
1、 如果是检测胶囊剂、肠溶片、滴丸剂等,一般采用升降式崩解仪,主要由金属支架、带有挡板的吊篮组成。
将待测的胶囊剂、肠溶片、滴丸剂6粒或片浸于人工胃液中,1小时内完全崩解,如有1粒或片不能完全崩解,应另取6粒或片复试,均应符合要求。
2、 如果进行其他实验,应根据具体实验要求操作。
注意事项:
1、 人工胃液(ChP) 为非无菌溶液,如有无菌要求,应注意0.22μm 过滤除菌操作。
2、 人工胃液(ChP)避免反复冻融,以免效率下降。
3、 本产品为强酸性溶液,注意做好安全防护。
4、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: 12个月有效。
4℃可保存2个月。
相关:
编号 名称 CZ0212 Storage 人工胃液(ChP) 500ml -20℃ 使用说明书 1份
编号 名称 CS0001 ACK 红细胞裂解液(ACK Lysis Buffer) DM0007 瑞氏-姬姆萨复合染色液 PW0053 Western 抗体洗脱液(碱性) TC0699 植物总糖和还原糖检测试剂盒(硝基水杨酸法)
TO1013 丙二醛(MDA)检测试剂盒(TBA 比色法)。
中国药典人工胃液的配制方法

中国药典人工胃液的配制方法配制SGF所需材料:1. 0.2M盐酸(Hydrochloric Acid,HCl)溶液2. 0.2M硝酸(Nitric Acid,HNO3)溶液3. 0.2M葡萄糖(Glucose)溶液4. 0.2M胆盐(Sodium Taurocholate,NaTC)溶液5. 脱氧胆酸(Deoxycholic Acid,DCA)6. 胃蛋白酶(Pepsin)配制方法:1.将500mL去离子水放入500mL锥形瓶中并预先加热到约37℃。
2.用0.2M盐酸溶液和0.2M硝酸溶液调节pH至1.2±0.1、取适量的0.2M盐酸溶液加入锥形瓶中,并用pH计测定pH值。
如pH值偏高,则逐滴加入0.2M硝酸溶液,同时用pH计不断测定pH值,直到达到所需的pH 值范围。
3.将0.2M葡萄糖溶液加入锥形瓶中,浓度为0.2M。
4.将0.2M胆盐溶液加入锥形瓶中,浓度为0.2M。
5.将脱氧胆酸加入锥形瓶中至给定的最终浓度(通常为0.03%)。
6.使用蛋白浓度计,测定胃蛋白酶的浓度。
将适量的胃蛋白酶加入锥形瓶中,至给定的最终活性浓度(通常为2500个消化活性单位/毫升)。
7. 使用0.1M氯化钠(Sodium Chloride,NaCl)溶液或其他适当的溶液调整体积,将溶液体积调整至500mL。
8.使用适当的方法,对配制好的人工胃液进行灭菌处理。
9.灭菌后,将人工胃液保存在4℃低温环境中,保持其活性和稳定性。
备注:1.在制备过程中,所有的步骤都需要在无尘室中进行,并确保所使用的仪器、试剂和容器的清洁度。
2.若需要调整pH值,应使用盐酸溶液和硝酸溶液来进行调节,而不是使用NaOH溶液,以避免高浓度钠离子的影响。
总结:。
不同干燥方法对草鱼片品质及消化特性的影响
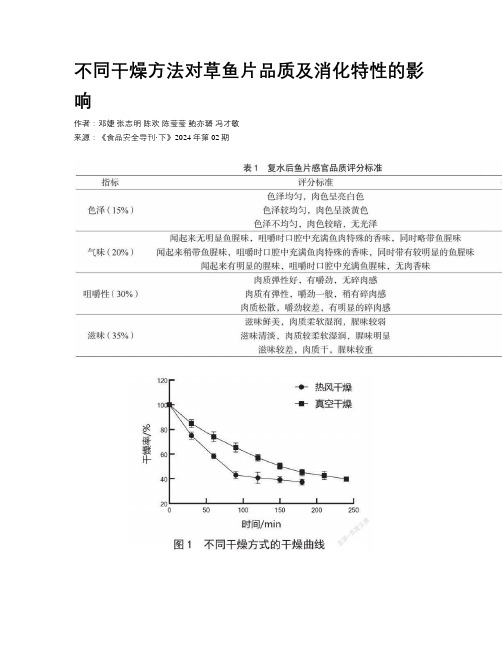
不同干燥方法对草鱼片品质及消化特性的影响作者:邓婕张志明陈欢陈莹莹鲍亦璐冯才敏来源:《食品安全导刊·下》2024年第02期摘要:采用不同方法干燥草鱼片,测定干燥草鱼片的干燥率、色泽、质构和感官得分,分析不同干燥方法对干燥草鱼片蛋白质消化特性的影响。
结果表明,与热风干燥相比,真空干燥草鱼片的干燥耗时较长,但色泽较好,且组织结构较为疏松,能够较好地保持草鱼片原有品质。
其中,硬度为124.33 g,咀嚼性为6.43 g,弹性为0.78,并且复水后综合感官得分较高。
经过体外模拟消化,真空干燥后的草鱼片蛋白质消化率高于热风干燥,表明真空干燥鱼片更容易被人體胃肠道消化。
综合分析,真空干燥草鱼片能够较好地保留鱼肉组织结构、感官评价高,并且易于消化,可为鱼肉制品的加工提供理论依据。
关键词:真空干燥;热风干燥;质构;感官评价;消化特性Abstract: Different methods were used to determine the drying rate, color, texture and sensory score, and the effects of different drying methods on the protein digestion characteristics of dried grass carp fillets were analyzed. The results showed that compared with hot air drying,vacuum drying grass carp fillet takes longer time to dry, but the color is better, and the tissue structure is more loose, can better maintain the original quality of grass carp fillet. Among them,the hardness was 124.33 g, the chewiness was 6.43 g, the elasticity was 0.78, and the comprehensive sensory score was higher since rehydration. After simulated digestion, the protein digestibility of vacuum-dried grass carp fillets is higher than that of hot air drying, indicating that vacuum-dried fish fillet was more likely to be digested by the human gastrointestinal tract. Comprehensive analysis, the vacuum dried grass carp fillet can better retain the fish tissue structure, high sensory evaluation, and easy to digest, which can provide a theoretical basis for the processing of fish meat products.Keywords: vacuum drying; heated-air drying; texture; sensory evaluation; digestive properties草鱼富含蛋白质和多不饱和脂肪酸,营养价值高[1]。
一致性评价重磅USP溶出度试验的开发和验证

一致性评价重磅参考资料:(USP1092)溶出度试验的开发和验证2015-12-25刘建华医药信息新药开发译者:刘建华国药集团工业有限公司前言目的:溶出度试验的开发和验证(1092)目的是为溶出度的测定提供了全面的开发和验证的方法以及相应的分析技术。
本指导原则贯穿溶出度测定的全部过程,并对方法验证提供了指导和验证标准。
同时它还涉及对普通制剂和缓释制剂产生的数据和接受标准进行说明。
范围:本指导原则讨论了溶出度试验的开发和验证,重点是固体口服剂型。
所提出的概念也可能适用于其他剂型和给药途径。
对于一些不同于USP章节中的设备和程序均已给出合适的解释。
本指导原则的基本框架如下:1.前期评估(对产品开发以及溶出度方法开发的前期研究评估)1.1滤膜相容性研究(PerformingFilterCompatibility)1.2原料药在不同溶媒中溶解度和稳定性的测定1.3选择溶出介质和体积1.4选择溶出设备(桨法和篮法以及其他方法)2.方法开发2.1脱气2.2沉降2.3搅拌2.4研究设计2.4.1取样时间点2.4.2观察2.4.3取样2.4.4清洗2.5数据处理2.6溶出度试验的评估3.分析整理3.1样品的处理3.2过滤3.3离心3.4分析过程3.5光谱分析3.6HPLC分析4.程序化4.1溶出介质的准备4.2样品的选择和取样时间的设计4.3取样和过滤4.4清洗4.5使用软件和计算机处理结果4.6找出需要验证的存在偏差的过程5.验证5.1专属性/安慰剂的干扰5.2线性和范围5.3准确度/回收率5.4精密度试验5.4.1重复性试验5.4.2中间精密度试验5.4.3重现性试验5.5耐用性试验5.6对照品和供试品的稳定性试验5.7程序化验证6.接受标准6.1普通速释制剂6.2缓释制剂6.3控释制剂6.4多重溶出度试验6.5溶出度结果的解释6.5.1普通速释制剂6.5.2缓释制剂6.5.3控释制剂7.参考文献1.前期评估(对产品发展以及溶出度方法开发的前期研究评估)在方法开发之前,对用以评价剂型的溶出行为的滤膜、溶出介质、介质体积和溶出设备进行筛选是非常重要的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注意事项:
1、 人工胃液为无菌溶液,如有无菌要求,注意无菌操作。 2、 人工胃液避免反复冻融,以免效率下降。 3、 本产品为强酸性溶液,注意做好安全防护。 4、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: -20℃保存 12 个月有效。4℃可保存 2 个月。
北京雷根生物技术有限公司
人工胃液(USP,无菌)
简介:
Leagene 人工胃液(USP,无菌)其英文表述为 Simulated Gastric Fluid,是模拟胃液的 组分和 pH 值的一种溶液。本试剂采用美国药典表述,人工胃液主要由氯化钠、稀酸、胃 蛋白酶等组成,经无菌处理,可用于胶囊剂、肠溶片、滴丸剂等检测,尤其适用于以明胶 为基质的软胶囊和滴丸的检测。
相关:
编号 CS0001 DM0007 PW0053 TC0699
名称 ACK 红细胞裂解液(ACK Lysis Buffer) 瑞氏-姬姆萨复合染色液 Western 抗体洗脱液(碱性) 植物总糖和还原糖检测试剂盒(硝基水杨酸法)
组成:
名称 人工胃液(USP,无菌) 使用说明书
编
-20℃
1份
操作步骤(仅供参考):
1、 如果是检测胶囊剂、肠溶片、滴丸剂等,一般采用升降式崩解仪,主要由金属支架、带 有挡板的吊篮组成。将待测的胶囊剂、肠溶片、滴丸剂 6 粒或片浸于人工胃液中,1 小 时内完全崩解,如有 1 粒或片不能完全崩解,应另取 6 粒或片复试,均应符合要求。
