肺癌免疫治疗的新策略文献阅读
五种非小细胞肺癌免疫治疗策略
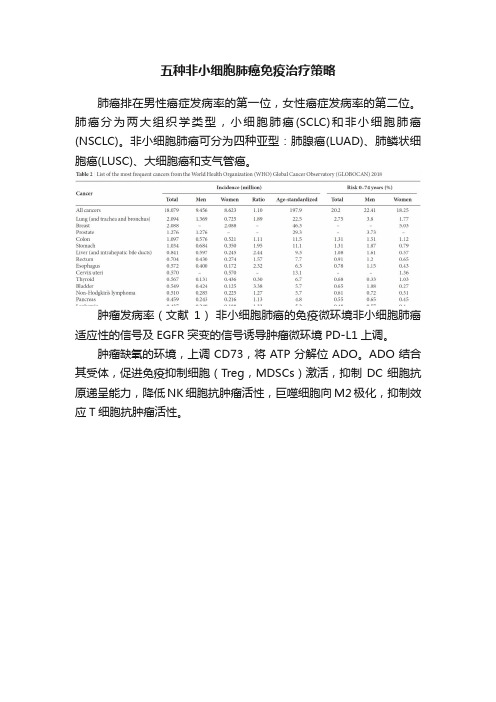
五种非小细胞肺癌免疫治疗策略
肺癌排在男性癌症发病率的第一位,女性癌症发病率的第二位。肺癌分为两大组织学类型,小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。非小细胞肺癌可分为四种亚型:肺腺癌(LUAD)、肺鳞状细胞癌(LUSC)、大细胞癌和支气管癌。
肿瘤发病率(文献1)非小细胞肺癌的免疫微环境非小细胞肺癌适应性的信号及EGFR突变的信号诱导肿瘤微环境PD-L1上调。
肿瘤缺氧的环境,上调CD73,将ATP分解位ADO。ADO结合其受体,促进免疫抑制细胞(Treg,MDSCs)激活,抑制DC细胞抗原递呈能力,降低NK细胞抗肿瘤活性,巨噬细胞向M2极化,抑制效应T细胞抗肿瘤活性。
非小细胞肺癌的免疫微环境(文献2)
NSCLC免疫治疗的五种策略
策略1:EGFR-TKI酪氨酸激酶抑制剂
•第一代吉非替尼( Gefitinib,易瑞沙)、厄洛替尼特罗凯(Erlotinib,特罗凯)、埃克替尼( Icotinib,凯美纳)
•第二代阿法替尼(Afatinib,吉泰瑞),达克替尼(Dacomitinib)
•第三代奥希替尼(osimertinib,泰瑞莎)
•第四代正大天晴TQB3804,阿斯利康AZD9291
临床前和临床数据显示TKI可以通过以下方式调节抗肿瘤免疫
•增强诱导MHC I类和MHC II类分子
•促进FoxP3降解,抑制Treg活性及Treg向肿瘤微环境浸润
•促进细胞毒性T细胞浸润及抗肿瘤活性
•抑制T细胞凋亡
•抑制免疫检查点分子(PD-1,PD-L1,CTLA-4,TIM-3)表达
EGFR-TKI免疫调节作用(文献2)
免疫学论文

关于肿瘤免疫研究的新进展及其应用前景的讨论
【摘要】肿瘤免疫治疗早已成为全球关注的热点,近年来各国科学家在相关方面的研究都取得了一定的成果。本文将主要针对stat3信号和B7—H3分子的相关研究所取得的阶段性成果作简单介绍及个人评述。
【关键词】肿瘤免疫,进展,应用前景,stat3信号,B7—H3分子
肿瘤可谓是人类健康和生命的头号杀手,尽管现代生物科学技术和医疗条件不断进步、不断突破,但是这一现状仍然没有大的改观,人们依旧受到各种肿瘤的威胁。因此,找到彻底治愈肿瘤的有效方法和药物是十分迫切的,这已成为医学界和生命科学界万分紧迫的任务,无数科学家也正为此努力不懈,近年来取得了诸多具有潜在价值的成果。
1 stat3信号在肿瘤免疫治疗方面的研究进展
stat3作为一种信号转导和转录活化因子,在正常细胞内发挥快速而短暂的生理功能,但在肿瘤细胞中往往会异常活化。
1.1 肿瘤微环境与stat3信号的作用
肿瘤在其发生发展过程中所处的内环境叫做肿瘤微环境,包括肿瘤细胞、间质细胞、微血管、微淋巴管、众多细胞因子及少量浸润细胞等。肿瘤微环境在促进肿瘤细胞生长、增殖的同时,为也肿瘤细胞的侵袭转移及逃避机体免疫系统的攻击提供了必要条件。尤其是肿瘤微环境中异常活化的stat3对肿瘤的发生发展具有重要作用。stat3在多种实体瘤的肿瘤细胞、基质细胞甚至是浸润的白细胞中均高水平表达。高水平的stat3可利于肿瘤细胞的存活、增殖及播散。
stat3的促肿瘤生长作用,部分是由于其下调P53表达而表现出的抗凋亡作用;stat3还是导致肿瘤组织白细胞浸入的重要原因,因为已发现高表达stat3的肿瘤细胞可通过释放多种细胞因子和趋化因子,并诱导白细胞表达这些因子的受体。另外,肿瘤细胞及基质细胞释放的多种因子均可诱导stat3表达水平,这些因子的表达也受到stat3转录因子的调节。[1]
晚期非小细胞肺癌免疫治疗最新进展

晚期非小细胞肺癌免疫治疗最新进展
蔚晓勇;李晓凤;张志宇;赵晓飞;史婉婷
【期刊名称】《中国实用医药》
【年(卷),期】2022(17)14
【摘要】近年来,非小细胞肺癌(NSCLC)患者应用以免疫检查点抑制剂为代表的免疫治疗后生存情况不仅得到明显好转,且改变了非小细胞肺癌的治疗模式。本文以免疫治疗联合化疗的机制、免疫治疗有效性相关因素以及免疫相关预测因素为主进行综述,旨在为提高患者生存时间和质量、改善患者预后提供更多的理论依据。【总页数】4页(P181-184)
【作者】蔚晓勇;李晓凤;张志宇;赵晓飞;史婉婷
【作者单位】巴彦淖尔市医院肿瘤内科;包头市肿瘤医院胸部肿瘤科;包头医学院(研究生学院)
【正文语种】中文
【中图分类】R73
【相关文献】
1.非小细胞肺癌免疫治疗的最新进展
2.非小细胞肺癌免疫治疗最新进展与挑战
3.外周血中性粒细胞与淋巴细胞比值预测晚期非小细胞肺癌免疫治疗疗效的价值
4.《中国肿瘤临床》文章推荐:驱动基因阴性晚期非小细胞肺癌脑转移免疫微环境及免疫治疗的研究进展
5.免疫治疗对晚期非小细胞肺癌患者循环肿瘤细胞水平与免疫功能的影响
因版权原因,仅展示原文概要,查看原文内容请购买
【肺癌进展报告2021】肺癌免疫新辅助治疗在探索中前行

【肺癌进展报告2021】肺癌免疫新辅助治疗在探索中前行
非小细胞肺癌(NSCLC)免疫治疗一直是最“耀眼的明星”。尤其以程序性死亡分子受体1(PD-1)或其配体PD-L1抑制剂单抗为主的免疫检查点抑制剂在晚期肺癌治疗中的成功应用,激发了研究者评估其在更早阶段作为免疫新辅助治疗的热情。
随着肺癌筛查技术、筛查流程、筛查组织要求及筛查结果管理等方面不断推进,分期为可手术治疗患者占比不断增加是必然的趋势。因此,如何进一步提高这部分患者的治疗效果更加重要。
早期NSCLC患者的5年生存率随着临床分期的上升而下降,从IA 期的80%~90%下降到ⅢA期的40%,并且30%~60%早期NSCLC 患者术后仍面临肿瘤复发转移的问题[1]。传统的术前新辅助治疗,改善5年生存率大约只有5%[2];而且3~4级毒副作用高达66%[3]。
寻找更有效和毒副作用更小的肺癌围手术期辅助或新辅助治疗途径是当前可切除NSCLC治疗中亟待解决的课题。
新辅助免疫治疗备受瞩目
▲▲▲
近年来,免疫检查点抑制剂在肿瘤治疗中的作用日益凸显,并极大改变了多种肿瘤的晚期治疗模式。在晚期NSCLC中已有多个研究证实,包括纳武利尤单抗、帕博利珠单抗和阿替利珠单抗在内的PD-1/PD-L1抑制剂在晚期NSCLC中显示出比化疗更好的疗效和更低的毒性。免疫检查点抑制剂已经成为晚期NSCLC患者的重要治疗选择。
免疫治疗在晚期肺癌患者中的成功应用激发了研究者将免疫治疗应用于局部晚期,甚至是早期肺癌患者的信心。与传统新辅助化(放)疗力求缩小肿瘤病灶,获得术前降期的目的略有不同,新辅助免疫疗法不仅在于晚期或局部晚期患者降期以便手术切除,而且对于早期可切除的肺癌患者,免疫新辅助的目的是提高患者的病理缓解率和长期治愈率。
文献解读冷热肿瘤免疫治疗策略的选择

文献解读冷热肿瘤免疫治疗策略的选择
肿瘤免疫治疗基于肿瘤免疫监视机制,通过干预免疫检查点受体将机体原有的免疫功能释放出来,从而实现杀伤和清除肿瘤细胞。临床应用发现,不同肿瘤对免疫治疗具有不同的反应性,通常反应性良好的肿瘤被称为“热肿瘤”,反应性欠佳的肿瘤被称为“冷肿瘤”。因此,针对不同性质的肿瘤需要采取不同的治疗策略,而且,如何将冷肿瘤转变成热肿瘤以提高疗效是尤为关键。
肿瘤免疫分类
冷肿瘤和热肿瘤是根据肿瘤的免疫结构进行划分的,包括肿瘤类型、肿瘤密度、机体免疫功能、肿瘤内免疫细胞分布情况等免疫学参数,这些参数均与肿瘤患者的生存期和疗效相关。根据肿瘤免疫逃逸机制及对免疫治疗的反应性,可以将肿瘤分成热肿瘤(hot tumor)、免疫排斥型肿瘤(altered-excluded tumor)、免疫抑制型肿瘤(altered-immunosuppressed tumor)和冷肿瘤(cold tumor),如图1。
•热肿瘤(hot tumor):肿瘤内部可见淋巴细胞浸润,还可能具有PD-L1高表达、基因不稳定性、抗肿瘤免疫反应等特征。
•免疫排斥型肿瘤(altered-excluded tumor):肿瘤边缘可见T 淋巴细胞浸润,而肿瘤内部未见免疫细胞浸润。其本质是肿瘤通过形成物理屏障阻碍T细胞浸润,但机体免疫系统功能不被抑制如机体可启动T细胞介导的免疫反应。
•免疫抑制型肿瘤(altered-immunosuppressed tumor):肿
瘤内部及边缘的免疫细胞浸润程度低,其本质是肿瘤微环境抑制了机体免疫反应导致免疫细胞的招募和扩增受阻。
新辅助免疫治疗联合化疗治疗局部晚期非小细胞肺癌的有效性及安全性探讨

新辅助免疫治疗联合化疗治疗局部晚期非小细胞肺癌的有效性
及安全性探讨
蔡蓓蓓
(南京鼓楼医院集团宿迁医院肿瘤科,江苏 宿迁 210008)
【摘要】目的:探讨分析新辅助免疫治疗联合化疗治疗局部晚期非小细胞肺癌的有效性及安全性。方法:此次研究对象,源于院内收治局部晚期非小细胞肺癌患者,共计76例,2020年1月-2022年6月,随机电脑筛选下分组。对照组36例接受局部晚期非小细胞肺癌术,研究组40例则在术前采取新辅助免疫治疗联合化疗。对两组治疗效果、免疫功能、血清血管新生指标含量、生活质量评分进行对比与分析。结果:对比两组治疗前免疫功能指标,无统计学差异(P>0.05);研究组术后免疫功能指标,优于对照组(P<0.05);对比两组治疗前血清血管新生指标含量,无统计学差异(P>0.05);研究组术后血清血管新生指标含量,优于对照组(P<0.05);对比两组治疗前生活质量评分,无统计学差异(P>0.05);研究组术后生活质量评分,优于对照组(P<0.05);研究组治疗有效率,高于对照组(P<0.05)。结论:对局部晚期非小细胞肺癌患者,术前采取新辅助免疫治疗联合化疗,可改善患者免疫功能、血清血管新生指标含量,提高治疗有效率,改善患者生活质量,临床价值较高。
【关键词】局部晚期非小细胞肺癌;新辅助免疫治疗;治疗效果;血清血管新生指标含量
[中图分类号]R [文献标识码]A [文章编号]2096-5249(2023)22-0001-04
晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)是一种比较常见的肺癌,以老年为主,大部分患者在早期没有任何征兆,一旦发现就错过了最佳的治疗时机。由于局部非小细胞肺癌的发展,其手术困难、术后复发、病死率高[1]。一般采用化疗方案,以杀灭局部肿瘤细胞,但其不良反应严重,疗效不佳。新辅助免疫治疗(neoadjuvant chemotherapy,NCT)是一种新的辅助免疫疗法,它是一种针对特定疾病的综合疗法,希望能减少病情发展,缓解病情分期[2]。早期的癌症可以做根治性手术,但对于中后期的NSCLC来说,则治疗方案首选新辅助免疫疗法[3]。本次研究,主要针对新辅助免疫治疗联合化疗治疗局部晚期非小细胞肺癌的有效性及安全性进行调查和研究。详细内容见下文:
一文回顾免疫治疗时代广泛期小细胞肺癌的系统治疗

一文回顾免疫治疗时代广泛期小细胞肺癌的系统治疗
编译:肿瘤资讯来源:肿瘤资讯
2019年3月,基于IMpower133研究的结果,FDA批准抗PD-L1抗体阿替利珠单抗联合依托泊苷+卡铂(EP)方案用于广泛期小细胞肺癌(ES-SCLC)的一线治疗,2020年2月,阿替利珠单抗的该适应证在中国正式获批。2020年3月,基于CASPIAN研究结果,FDA 又批准了抗PD-L1抗体度伐利尤单抗联合依托泊苷+卡铂或顺铂用于ES-SCLC的一线治疗。此前,纳武利尤单抗和帕博利珠单抗被批准用于复发性ES-SCLC患者的三线治疗,ES-SCLC已经全面进入免疫时代。现将ES-SCLC免疫治疗的临床数据进行总结。
ES-SCLC的一线治疗
目前共有2项大型Ⅲ期研究发现ES-SCLC中,免疫治疗联合EP 一线治疗具有总生存(OS)获益。一项研究是IMpower133研究,403名患者随机接受EP+阿替利珠单抗或单纯EP化疗,首要终点是OS。研究发现阿替利珠单抗+EP组和EP组的OS分别是12.3个月和10.3个月(HR=0.7,95%CI 0.54-0.91,P=0.007),中位无进展生存期(PFS)分别是5.2个月和4.3个月(HR=0.77,95%CI 0.62-0.96,P=0.02)。阿替利珠单抗组的严重不良事件(SAE)发生率是37%,和其他肿瘤类型免疫治疗的研究报道一致。这些良好结果促使FDA批准阿替利珠单抗联合EP用于ES-SCLC患者的一线治疗,为ES-SCLC的一线治疗带来重大突破。2019年3月,FDA批准阿替利珠单抗联合化疗一线治疗ES-SCLC,2020年2月,中国国家药品监督管理局正式批准阿替利珠单抗的该适应证。
小细胞肺癌的新纪元免疫治疗

2020年6月第20卷第3期
循证医学
The Journal of Evidence -Based Medicine
Jun.2020Vol.20No.3
[关键词]Atezolizumab ;小细胞肺癌;免疫治疗[中图分类号]R734.2[文献标识码]A
DOI :10.12019/j.issn.1671⁃5144.2020.03.005
New Era of Small ⁃Cell Lung Cancer —Immunotherapy //Reviewers :FAN Yun 1,YU Si ⁃zhe 1,Literature Co ⁃worker :
SUN Yue⁃li 2Key
words :Atezolizumab ;small
cell
lung
cancer ;
immunotherapy
Reviewers address :Department of Chemotherapy ,Zhejiang
Cancer Hospital ,Cancer Hospital of The University of Chinese Academy of Sciences ,Hangzhou 310022,China
1文献来源
Horn L ,Mansfield AS ,Szczesna A ,et al.First⁃
line atezolizumab plus chemotherapy in extensive ⁃stage small⁃cell lung cancer [J ].N Engl J Med ,2018,
肺癌文献整理

肺癌文献整理
CIK治疗肺癌
一、CIK维持治疗中晚期肺癌的临床观察及影响因素分析(第三军医大学西南医院)
对象:2011年7月至2012年7月来第三军医大学西南医院呼吸内科就诊的42例三到四晚期肺癌患者为CIK治疗组(CIK最佳支持治疗) ,患者年龄30~77岁,中位年龄59岁,其中鳞癌12例、腺癌20例、小细胞癌10例,三A、三B、四期分别为6、10、26例,其中合并肝或脑转移共8例。选择同期行最佳支持治疗的38例患者作为对照组,患者年龄31~75岁,中位年龄59岁,其中鳞癌11例、腺癌18例、小细胞癌9例,三A、三B、四期期分别为4、8、26例,治疗组与对照组基线水平具有可比性。
方法:选取42例中晚期肺癌患者,并根据性别、年龄、病理类型选择同期行最佳支持治疗的38例患者作为对照组。统计分析应用CIK细胞治疗前后免疫学指标(T细胞亚群、免疫球蛋白等) 变化特点,评估其治疗的近期疗效( 有效率、控制率) ,并分析影响CIK治疗效果的因素,比较患者在治疗前后的生活质量变化(KPS评分) ,观察细胞治疗的安全性。结果:
CIK治疗组有效率及疾病控制率均高于对照组(P0.05)见表2截至最后1次随访,CIK治疗组死亡7例,中位生存时间5.1个月; 对照组死亡6例,中位生存时间4.9个月。
在CIK治疗过程中,观察肺癌患者治疗前后体力、睡眠、食欲等生活质量,结果显示61.90%(26/42)患者在接受CIK治疗后纳差、乏力、睡眠等情况好转明显。
本研究CIK治疗有效率(42.9%)。
二、CIK细胞对A549肺癌细胞株的抗增殖及诱导凋亡作用
非小细胞肺癌的免疫治疗现状

中外医疗China &Foreign Medical Treatment
肺癌是临床治疗过程中最常见的恶性肿瘤之一。据统计,每年被确诊的肺癌患者高达160万,每年有大约140万人死于该病,其中约80%的肺癌患者的病理分型为非小细胞肺癌(NSCLC )。近几十年来,NSCLC 的治疗除了传统的手术、放疗、化疗之外,出现的针对性强、副作用小的靶向治疗、免疫治疗等新兴疗法,在肿瘤的临床治疗中逐渐普及。对于特定患者可以通过服用间变性淋巴瘤激酶(ALK)抑制剂、表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKI)等可有效延长生存时间[1],但是这些治疗存在共同且难以回避的问题,即发生耐药问题,大多数靶向治疗后期会出现耐药现象[2]。与此同时,随着技术的发展,肺癌的免疫治疗取得了突破性的发展,免疫治疗已经成为肺癌治疗的新方法[3]。该文就目前免疫治疗的相关文献,对肺癌的免疫治疗进行综述。现报
道如下。
1肿瘤免疫治疗的渊源
肿瘤免疫治疗近来备受关注,是肿瘤治疗领域的焦点。目前已在一些肿瘤类型如黑色素瘤,非小细胞肺癌等的治疗中展示出了强大的抗肿瘤活性,并已有肿瘤免疫治疗药物获得美国FDA 批准临床应用。虽然肿瘤免疫治疗是目前肿瘤领域的研发热点,但肿瘤免疫治疗并不是新鲜话题。几乎早在100多年前免疫学创建之初,科学家就提出了利用机体自身免疫功能去攻击肿瘤细胞消灭肿瘤的设想,并进行了各种尝试。1950年代Burnet 和Thomas 提出了“免疫监视”理论,认为机体中经常会出现的突变的肿瘤细胞可被免疫系统所识别而清除,为肿瘤免疫治疗奠定了理论基础。2肺癌的免疫治疗
关于免疫治疗的文献

关于免疫治疗的文献综述
摘要
免疫疗法是一种通过调控和增强患者自身的免疫系统来对抗疾病的治疗方法。近年来,随着生物技术和医学研究的深入,免疫治疗在肿瘤、自身免疫疾病等众多领域展现出了巨大潜力。本文综述了免疫治疗的基本原理、应用领域、最新进展以及面临的挑战和前景。
一、引言
免疫系统是机体防御外界病原体和异常细胞的第一道防线。通过识别和攻击这些“非己”成分,免疫系统维持着机体的内环境稳定。然而,在某些情况下,如肿瘤和自身免疫疾病,免疫系统的功能可能会受到限制或失控。免疫治疗旨在通过调控免疫系统的反应,恢复或增强其对抗疾病的能力。
二、免疫治疗的基本原理
免疫治疗的基本原理包括激活免疫系统的效应细胞、增强抗原呈递、抑制免疫抑制因素等。具体方法包括使用单克隆抗体、细胞因子、免疫检查点抑制剂等。此外,基于细胞的治疗方法,如CAR-T细胞疗法,通过基因工程改造患者自身的免疫细胞,使其能够特异性地识别和攻击肿瘤细胞。
三、免疫治疗的应用领域
1. 肿瘤治疗:免疫治疗在肿瘤治疗中取得了显著成效。例如,PD-1和
PD-L1免疫检查点抑制剂已用于治疗多种实体瘤,显著提高了患者生存率。CAR-T细胞疗法在治疗某些血液系统恶性肿瘤中展现出惊人的疗效。
2. 自身免疫疾病:通过抑制过度活跃的免疫系统,免疫治疗可以有效缓解类风湿关节炎、系统性红斑狼疮等自身免疫疾病的症状。
3. 抗感染治疗:针对特定病原体的免疫治疗,如疫苗和抗体疗法,可以预防和治疗感染性疾病。
四、最新进展与挑战
近年来,免疫治疗领域的研究取得了显著进展,包括新型免疫检查点抑制剂的发现、CAR-T细胞疗法的优化以及基因编辑技术在免疫治疗中的应用等。然而,免疫治疗仍面临许多挑战,如治疗个体差异、免疫相关不良事件的管理、治疗成本等。
中国肺癌治疗新方案(全文版)

中国肺癌治疗新方案(全文版)中国肺癌治疗新方案(全文版)
前言
肺癌是我国最常见的恶性肿瘤之一,严重威胁人民的健康和生活质量。为了提高肺癌的治愈率和生存率,我国不断探索和更新肺癌治疗方案。本文将详细介绍中国肺癌治疗的新方案,包括诊断、分期、手术、放疗、化疗、靶向治疗和免疫治疗等方面的内容。
一、肺癌的诊断与分期
1. 诊断
肺癌的诊断主要依赖于临床症状、体征、影像学检查和组织病理学检查。
(1)临床症状:咳嗽、痰中带血、胸痛、呼吸困难等。
(2)体征:肺部肿块、胸腔积液、肺不张等。
(3)影像学检查:胸部X线、CT、MRI等。
(4)组织病理学检查:支气管镜检查、经皮穿刺活检、胸水检查等。
2. 分期
肺癌的分期对于选择治疗方案具有重要意义。目前广泛采用的美国东部肿瘤协作组(AJCC)分期系统将肺癌分为四个期别。
(1)第Ⅰ期:肿瘤限于肺脏,无淋巴结转移。
(2)第Ⅱ期:肿瘤限于肺脏,伴有局部淋巴结转移。
(3)第Ⅲ期:肿瘤侵犯肺脏及邻近器官,伴有区域淋巴结转移。
(4)第Ⅳ期:肿瘤远处转移或侵犯多个器官。
二、肺癌治疗方案
1. 手术治疗
手术治疗是肺癌治疗的首选方法,适用于大多数非小细胞肺癌患者。
(1)全肺切除术:适用于局限性肺癌。
(2)肺叶切除术:适用于肺叶内肿瘤。
(3)袖状切除术:适用于肺段支气管肿瘤。
(4)肺段切除术:适用于肺段内肿瘤。
2. 放疗
放疗是肺癌重要的局部治疗手段,可单独或联合手术、化疗使用。
(1)术前放疗:可缩小肿瘤体积,提高手术切除率。
(2)术后放疗:用于术后残留病灶的治疗。
(3)根治性放疗:适用于不能手术的患者。
PD-1_PD-L1免疫检查点抑制剂在肺癌中的研究进展

PD-1/PD-L1免疫检查点抑制剂在肺癌中的研究进展
发布时间:2023-02-22T02:14:09.594Z 来源:《中国医学人文》2022年31期作者:吕明
[导读] 目前免疫治疗的研究成果较为突出,已取得较大的突破。
吕明
十堰市太和医院湖北医药学院附属医院湖北十堰 442000
【摘要】目前免疫治疗的研究成果较为突出,已取得较大的突破。其中PD-1/PD-L1免疫检查点抑制剂在临床中的应用效果较好。为此,本文就PD-1/PD-L1免疫检查点抑制剂在肺癌中的研究作简要分析。
【关键词】PD-1/PD-L1;免疫检查点抑制剂;肺癌
在临床疾病中,肺癌是恶性肿瘤中最常见的一种,同时也是导致癌症患者死亡的主要因素之一。据有关数据显示,在癌症患者中,死亡人数占比18.4%,而肺癌的发病率就高达11.6%,从数据上就可看出,肺癌对人们身体健康的威胁程度非常高。近几年来,随着医疗水平和检测技术的提升,在晚期肺癌的治疗上已经取得了较大的突破。目前,晚期肺癌的临床治疗中,免疫治疗已然成为不可或缺的内容,尤其是PD-1/PD-L1免疫检查点抑制剂的应用。为此,本文针对PD-1/PD-L1免疫检查点抑制剂在肺癌中的应用进行综述。
1.肿瘤免疫治疗的概述
肿瘤细胞在发生基因突变后,其能否突变成肿瘤,和免疫系统有着莫大的关系。免疫系统,对“非己”成分有着识别功能和清除功能[1]。在免疫治疗的作用下,能够激活人体的免疫功能,利用其免疫状态,来完成控制肿瘤细胞、消灭肿瘤细胞的目的。免疫周期,主要由几个步骤构成:肿瘤抗原释放;处理肿瘤抗原;T细胞启动、激活,转移、渗透肿瘤部位,识别肿瘤细胞并杀死。而在免疫周期各种发挥作用的因素,能为免疫治疗提供较广的治疗靶点。
【课题申报】肺部肿瘤的新免疫治疗联合疗法

肺部肿瘤的新免疫治疗联合疗法
《肺部肿瘤的新免疫治疗联合疗法》
一、课题背景与意义
肺部肿瘤是全球范围内最常见的恶性肿瘤之一,其发病率和死亡率均居于恶性肿瘤的前列。虽然目前肺癌的治疗手段已经发展到了手术切除、放化疗等多种方式,但是肺癌的治疗效果仍然不尽人意,患者的生存率和生活质量都受到严重影响。因此,寻找一种新的、有效的治疗肺癌的方法成为紧迫的任务。
近年来,免疫治疗成为癌症治疗领域的一大热点。免疫治疗通过增强机体的免疫系统功能,使免疫系统能更好地攻击和抑制肿瘤细胞的生长和转移。肺癌患者的免疫功能常常受到一定程度的损害,因此通过免疫治疗来增强机体的免疫能力,可以为肺癌的治疗带来新的希望和突破。但是,独立的免疫治疗在治疗实践中也存在一定的局限性,因此,寻找一种新的免疫治疗联合疗法,可以提高治疗的效果,减轻患者的负担,具有重要的理论和临床意义。
二、主要研究内容和目标
本课题的主要研究内容是探索一种新的肺部肿瘤免疫治疗联合疗法,并对其治疗机制进行深入的研究探讨。具体研究内容包括:
1. 筛选适用于肺部肿瘤的免疫治疗药物。
结合前期的研究和文献,筛选适用于肺部肿瘤的具有免疫治疗潜力的药物,并进行相关的实验验证。
2. 改善肺癌患者的免疫功能。
通过免疫治疗药物的应用,提高肺癌患者的免疫功能,增强机体的抗肿瘤能力。
3. 选择合适的联合疗法。
结合免疫治疗的特点和肺癌的临床表现,选择适用于肺癌的免疫治疗联合疗法,并进行相关的实验验证。
4. 对联合疗法的治疗效果进行评估。
通过临床观察和实验数据的统计分析,对联合疗法的治疗效果进行评估,并与传统的单一疗法进行比较。
CASPIAN研究:广泛期小细胞肺癌一线免疫治疗新突破

CASPIAN,中文名“里海”,世界上最大的咸水湖,位于亚洲和欧洲的交界处,古希腊语是对其西南岸高加索人的称呼。而对于PD-L1抑制剂:Durvalumab(商品名:英飞凡,IMFINZI)的研究都是以江河湖海命名,自古诗云“海纳百川,有容乃大”,因此足可彰显公司命名时的霸气,包括之前称之为免疫治疗海啸的PACIFIC研究,以及目前又一波震撼的CASPIAN研究也确实实现了其宏图。
肺癌一直以来发病率和死亡率都处于双高,病理类型分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)两类。SCLC约占肺癌的15-20%,病理形态上细胞小而DNA丰富,因此生长迅速,极易早期发生远处转移,60%以上患者发现时已是晚期,主要的治疗手段就是放疗、化疗,目前全球每年新发病例>20万,目前一线治疗ORR:60-70%,中位OS约7-10个月,1年OS率:35%,2年OS率:5%。对于广泛期SCLC来说,不单是疾病来势凶猛,更是二十余年来治疗的“药荒”。免疫治疗打破了这个僵局,从西方给患者带来了福音;由于98%的小细胞肺癌病人与吸烟有关,因此没有明确的驱动基因,但具有更高的肿瘤突变负荷(TMB):平均7.37mut/Mb,因此为免疫检查点抑制剂的获益夯实了基础。
时间追溯到2016年,放眼望去,各瘤种免疫治疗的地位都已经如日中天,尤其黑色素瘤和NSCLC都是汹涌而来的数据狂潮,不仅成为二线基石,一线选择,更是向早期围术期进军。
但SCLC的春天似乎来得稍晚一些,Nivolumab(简称“O药”)和Pembrolizumab(简称“K药”)在SCLC大于二线治疗的星星点点似乎并没有燎原之势,二线失败,维持失败,而一线免疫治疗则仍是一片空白。罗氏率先开展了免疫治疗在SCLC的探索,撕开了青
【肺常盘点】非小细胞肺癌免疫治疗进展一文览

【肺常盘点】非小细胞肺癌免疫治疗进展一文览
上周小编为大家汇总了肺癌常见靶点及靶向药物,今天我们就来对非小细胞肺癌的免疫治疗进展进行汇总,希望通过这一篇文章,能够让各位有所收获。
一
新辅助免疫治疗
01l CheckMate-159
一项在未治、可切除的NSCLC(I- IIIA期)中开展的I期临床研究,术前给予2周期纳武利尤单抗治疗,主要研究终点是纳武利尤单抗在NSCLC新辅助治疗中安全性和可行性。结果证实,使用新辅助纳武利尤单抗治疗NSCLC毒性可控,不会导致手术延期。45%的接受手术切除的患者达到了病理学显著缓解率(MPR)。
02LCMC3研究
一项II期研究,阿替利珠单抗用于初治可手术的IB-IIIA和选择性IIIB期NSCLC。该研究在2019年ASCO上更新了疗效的中期分析结果:MPR为19%,病理完全缓解(pCR)为5%;安全性也较好。
03MK3475-223研究
一项单臂、I期、剂量递增和扩展队列试验,研究新辅助帕博利珠单抗治疗早期可切除NSCLC患者的安全性和可行性。2019年ASCO 上更新的有限数据显示,4例患者获得MPR(4/10接受2周期帕博利珠单抗;40%;95% C.I. 16.7-68.8%)。
04ChiCTR-OIC-17013726研究
这是一项在中国开展,旨在评估信迪利单抗单药用于可切除NSCLC新辅助治疗的开放性、单中心、Ib期研究,结果显示:45.5%的患者达到MPR,其中18.2%的患者达到了pCR。
05NEOSTAR研究
一项II期临床研究,比较了纳武利尤单抗vs 纳武利尤单抗联合ipilimumab对I-IIIA期可手术切除的早期NSCLC患者的疗效。研究结果在2019ASCO会上公布,在总人群中,MPR+pCR的比例为25%,
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Part 2
相关文献介绍
文献概况
文献概况
文献 解析
肺癌目前批准的免疫抗肿瘤药是抗PD1抑制剂与抗PD-L1抑制剂。 虽然免疫检查 点抑制剂的上市是令人鼓舞的,在一些情况下效果很好,但不是所有治疗的患者都适 用。 为了优化利用免疫疗法,我们必须更好地了解癌症和免疫系统和逃逸机制之间的 相互作用。 在这篇综述中,将提供对免疫系统和肿瘤的概述,并查看促进免疫系统的 检测肿瘤抗原释放,激活效应T细胞应答的新疗法,和反向抑制抗肿瘤的信号。
抗PD1抑制剂与抗PD-L1抑制剂的区别
---同一通路,不同靶点
Anti-PD1
靶向抑制PD-1,能够阻断肿瘤细胞与 PD-1之间的抑制信号,但仍保留肿瘤细 胞与B7.1之间的交互作用 1,2,3
Anti-PDL1
靶向抑制PD-L1,能够阻断肿瘤细胞和PD1/B7.1的协同抑制信号,从而防止其下调T 细胞活性 1,2,3
潜在目标
T细胞反应的激活
activation of the T-cell response
2
肿瘤抗原的释放
the release of cancer antigens
1
癌症和
免疫系统
抑制性免疫反应的调节
regulation of the inhibitory immune response.
3
肿瘤标记物 Tumor biomarkers
一、促进肿瘤抗原的释放
肿瘤疫苗单一疗法的一个明显的局限 性是TME的抑制信号,例如Tregs,MDSC 和其他免疫检查点。鉴于目前肿瘤疫苗疗 法的反应有限,目前的策略侧重于通过将 其与其他免疫疗法相结合来增强抗肿瘤反 应。临床前研究为组合PD-1 / PD-L1或 CTLA-4抑制剂的肿瘤疫苗提供了证据。
PD-L1
PD-1
X
T 细胞
肿瘤细胞
B7.1 B7.1
PD-1
X
阻断PD-L2/PD-1交互作
用会影响免疫稳态,有 增加自身免疫反应的潜 PD-L1
PD-L2
在可能 1,4
巨噬细胞
X PD-L1
肿瘤细胞
PD-1
T 细胞
B7.1 B7.1
PD-1
保留PD-L2/PD-1交互 作用,最小限度保持免 疫稳态,这种交互可能 有助于预防自身免疫性 反应,尤其是在肺部 1
免疫检验点抑制剂已全面进入中国临床实践
T细胞免疫检查点和共刺激通路
刺激 刺激 刺激 刺激
抑制 抑制 抑制 抑制
这些通路经免疫制剂 可被激活,对抗肿瘤 介导的免疫抑制
这些通路经免疫制剂 可被阻断,对抗肿瘤 介导的免疫抑制
6
Pardoll DM. Nat Rev Cancer. 2012;12:252–264.
•
5. Latchman, et al. Nat Immunol 2001;6. Matsumoto, et al. Biochem Biophys Res Commun 2008.
文献阅读背景
肺癌是导致癌症死亡的主要原因在美国(美国)和全世界。近60%的肺癌患者被诊断为发生转移,5年生存率低于5%。然而,随着改善戒烟,早期发现和治疗肺癌,死亡率有在过去二十年中稳步下降。可能提高生存率的一种治疗方式是免疫疗法。 2015年,两种PD-1抑制剂,nivolumab和pembrolizumab是美国食品和药物管理局(FDA)批准用于转移性非小细胞肺癌(NSCLC) 患者,这些患者在一线铂类治疗后进展。 2016年,第一个程序性死亡配体-1(PD-L1)抑制剂atezolizumab也被批准用于相同的适应症。 不幸的是,二线整体的客观响应率(ORR)仍然在14-20%之间,并且总体中位数生存期(OS)报告为9-13个月。
1896年coley毒素 应用于临床
免疫治疗
1899年放疗治愈 第1例病人
放疗
1946年氮芥治疗Βιβλιοθήκη Baidu淋巴瘤获得成功
化疗
靶向治疗
肿瘤免疫治疗具有特异性和靶向性,一直为临床医师高度关注, 近年进一步显著,使得免疫治疗成为更具期待的领域
文献阅读背景
Checkpoint inhibitors in NSCLC Key milestones
二、T细胞反应的激活
超家族肿瘤坏死因子受体 (TNFR)是一组高度保守的1型 跨膜糖蛋白,具有富含半胱氨酸的 结构域,具有共抑制和刺激反应。 OX40,CD27,糖皮质激素诱导 的肿瘤坏死因子(GITR),41BB和CD40是五类具有刺激作用 的成员。
T细胞免疫检查点和共刺激通路
刺激 刺激 刺激 刺激
X PD-L1
PD-L2
巨噬细胞
7
•
1.Herbst, et al. Nature 2014; 2. Chen, et al. Clin Cancer Res 2012;
3. Brown, et al. J Immunol 20034. Akbari, et al. Mucosal Immunol 2010;
肺癌免疫治疗的新策略
New strategies in immunotherapy for lung cancer: beyond PD-1/PD-L1
汇报人:绿野仙踪
目录
CONTENT
01 文献阅读背景 02 相关文献介绍 03 文献分析总结
Part 1
文献阅读背景
文献阅读背景
人类抗击肿瘤的历史
4
一、促进肿瘤抗原的释放
肿瘤定向的免疫应答首先依赖于肿瘤特异 性抗原的存在。 肿瘤疫苗通过引入肿瘤抗 原来引发宿主免疫系统以产生抗原特异性 效应子和记忆T细胞应答来弥补这一差距。 目前研究的疫苗可以大致分为靶向特定肿 瘤抗原(抗原特异性)或多种肿瘤细胞 (全细胞)的疫苗。 全细胞疫苗的目的是 扩大肿瘤相关抗原的暴露。
抑制 抑制 抑制 抑制
这些通路经免疫制剂 可被激活,对抗肿瘤 介导的免疫抑制
这些通路经免疫制剂 可被阻断,对抗肿瘤 介导的免疫抑制
19
Pardoll DM. Nat Rev Cancer. 2012;12:252–264.
《呼吸系统疾病治疗进展》 IF:3.592
免疫疗法现状
免疫疗法现状
免疫系统与TME
免疫系统与TME(肿瘤微环境) 相互作用,可能无法通过单独 抑制PD-1/PD-L1轴来简单地 解决。这种复杂免疫系统还有 许多其他调节因子。这篇综述 将总结免疫系统和癌症微环境 之间复杂的相互作用以及PD-1 / PD-L1轴外的潜在目标。
