陕西省西安市临潼区马额中学高中化学人教版:第一章第一节元素周期表课件(共14张PPT)
合集下载
高中化学第一章第一节第1课时元素周期表课件新人教版必修2

A.第三周期第ⅤA族 B.第四周期第ⅢA族 C.第五周期第ⅢA族 D.第四周期第ⅤA族 答案:B 解析:据化学式RN知N为-3价,则R为+3价,所以R的原子序数为 28+3=31;与31最邻近的稀有气体元素原子序数为36(氪位于第四周 期),所以31-36=-5,因此R元素也在第四周期,8-|-5|=3,则R在第ⅢA族, 故选B。
第ⅠB 族、第
个纵行 副族 为一族
ⅡB 族、第ⅢB 族、第ⅣB 族、 1~2 第ⅤB 族、第ⅥB 族、第ⅦB 族
族序数= 最外层电 子数 ②同一主 族元素的 原子最外 层电子数 相同,且 自上而下 电子层数 递增
第 8、9、10 三个纵行为第Ⅷ族 1~2(Pd 除外)
一二
3.过渡元素 元素周期表中从第ⅢB族到第ⅡB族共10个纵行,共68种元素,全 部为金属元素,统称为过渡元素。 族序数为Ⅱ、Ⅲ的地方是主族和副族的分界线,第一次分界时主 族在副族的前面,第二次分界时副族在主族的前面。“第一次”是指 ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ族依次排列。“第二 次”是指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0族依次排列。 特别提醒一般来说在同一周期中,相邻元素的原子序数相差1,但 是由于过渡元素特别是镧系和锕系元素的存在,使得同周期第ⅡA 族和第ⅢA族元素的原子序数之差变为11(第四、五周期)或25(第 六、七周期)。
一二
3.实例 (1)53号元素。 由于36<53<54,则53号元素位于第五周期,54-53=1,所以,53号元 素位于54号元素左侧第一格,即第ⅦA族,所以,53号元素位于第五 周期第ⅦA族。 (2)88号元素。 由于86<88<118,则88号元素位于第七周期,88-86=2,所以,88号元 素位于第七周期的第二格,即第ⅡA族,所以,88号元素位于第七周 期第ⅡA族。
第ⅠB 族、第
个纵行 副族 为一族
ⅡB 族、第ⅢB 族、第ⅣB 族、 1~2 第ⅤB 族、第ⅥB 族、第ⅦB 族
族序数= 最外层电 子数 ②同一主 族元素的 原子最外 层电子数 相同,且 自上而下 电子层数 递增
第 8、9、10 三个纵行为第Ⅷ族 1~2(Pd 除外)
一二
3.过渡元素 元素周期表中从第ⅢB族到第ⅡB族共10个纵行,共68种元素,全 部为金属元素,统称为过渡元素。 族序数为Ⅱ、Ⅲ的地方是主族和副族的分界线,第一次分界时主 族在副族的前面,第二次分界时副族在主族的前面。“第一次”是指 ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ族依次排列。“第二 次”是指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0族依次排列。 特别提醒一般来说在同一周期中,相邻元素的原子序数相差1,但 是由于过渡元素特别是镧系和锕系元素的存在,使得同周期第ⅡA 族和第ⅢA族元素的原子序数之差变为11(第四、五周期)或25(第 六、七周期)。
一二
3.实例 (1)53号元素。 由于36<53<54,则53号元素位于第五周期,54-53=1,所以,53号元 素位于54号元素左侧第一格,即第ⅦA族,所以,53号元素位于第五 周期第ⅦA族。 (2)88号元素。 由于86<88<118,则88号元素位于第七周期,88-86=2,所以,88号元 素位于第七周期的第二格,即第ⅡA族,所以,88号元素位于第七周 期第ⅡA族。
人教版高中化学第一章第一节 《元素周期表 》(共15张PPT)教育课件
3、相邻周期同一主族元素序数相差多少?
答:①、若为Ⅰ、ⅡA族元素,原子序数相差等于上周期 元素所在的元素种类数。 ②、若为Ⅲ到ⅦA族元素,原子序数相差等于下周期 元素所在的元素种类
四、应用
1、根据位置推断元素及其性质 2、利用元素周期表与族序数关系推断元素 例.如图是元素周期表的一部分,其中X、Y、Z、W的 原子序数都小于18,下列说法正确的是
:
那
你
的
第
一
部
戏
有
没
有
胆
怯
,
像
费
里
尼
拍
第
一
部
戏
时
就
穿
戴
得
口
罗
没
有
我
和
他
不
同
。
我
是
从
ቤተ መጻሕፍቲ ባይዱ
底
层
爬
上
来
的
我
清
楚
怎
么
运
作
这
个
东
西
(
电
影
拍
摄
)
所
以
为
什
么
很
多
时
候
在
现
场
我
不
想
等
。
你
可
以
但
是
当
我
拍
完
一
个
镜
头
,
下
一
个
镜
头
试
完
镜
后
我
希
但
是
我
年
轻
时
有
一
个
想
答:①、若为Ⅰ、ⅡA族元素,原子序数相差等于上周期 元素所在的元素种类数。 ②、若为Ⅲ到ⅦA族元素,原子序数相差等于下周期 元素所在的元素种类
四、应用
1、根据位置推断元素及其性质 2、利用元素周期表与族序数关系推断元素 例.如图是元素周期表的一部分,其中X、Y、Z、W的 原子序数都小于18,下列说法正确的是
:
那
你
的
第
一
部
戏
有
没
有
胆
怯
,
像
费
里
尼
拍
第
一
部
戏
时
就
穿
戴
得
口
罗
没
有
我
和
他
不
同
。
我
是
从
ቤተ መጻሕፍቲ ባይዱ
底
层
爬
上
来
的
我
清
楚
怎
么
运
作
这
个
东
西
(
电
影
拍
摄
)
所
以
为
什
么
很
多
时
候
在
现
场
我
不
想
等
。
你
可
以
但
是
当
我
拍
完
一
个
镜
头
,
下
一
个
镜
头
试
完
镜
后
我
希
但
是
我
年
轻
时
有
一
个
想
陕西省西安市临潼区马额中学高中化学人教版:第一章第一节元素周期表课件(共18张PPT)

第一章 物质结构 元素周期律 第一节 元素周期表
2020/5/26
1
一、元素周期表
1869年门捷列夫在继承和分析了前人工作 的基础上,对大量实验事实进行了订正、 分析和概括,成功地对元素进行了科学分 类。将化学性质相似的元素放在一个纵行 制出了第一张元素周期表,揭示了化学元 素的内在联系,使其构成一个完整的体系 成为化学发展史上重要的里程碑之一。
5 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
6
55
56
5771
72
73
74
75 76
77 78 79
80 81
82
83
84 85 86
7
87
88
89103
104
105
106
107
108
109
110
111
112
过渡元素
镧系
57
58
59
60
A. X+2 B. X+4
C. X+8
D. X+18
[习题2] 若元素A为第17号元素,则下列元素不可能处在 它下一个周期的是…….( D ) A、20号元素 B、26号元素 C、31号元素 D、37号元素
2020/5/26
12
一、元素周期表
③族的特点:
Na +11 2 8 1
P +15 2 8 5
61
62
63
64
65
66
67
68
69
70
71
锕系
2020/5/26
89
90
2020/5/26
1
一、元素周期表
1869年门捷列夫在继承和分析了前人工作 的基础上,对大量实验事实进行了订正、 分析和概括,成功地对元素进行了科学分 类。将化学性质相似的元素放在一个纵行 制出了第一张元素周期表,揭示了化学元 素的内在联系,使其构成一个完整的体系 成为化学发展史上重要的里程碑之一。
5 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
6
55
56
5771
72
73
74
75 76
77 78 79
80 81
82
83
84 85 86
7
87
88
89103
104
105
106
107
108
109
110
111
112
过渡元素
镧系
57
58
59
60
A. X+2 B. X+4
C. X+8
D. X+18
[习题2] 若元素A为第17号元素,则下列元素不可能处在 它下一个周期的是…….( D ) A、20号元素 B、26号元素 C、31号元素 D、37号元素
2020/5/26
12
一、元素周期表
③族的特点:
Na +11 2 8 1
P +15 2 8 5
61
62
63
64
65
66
67
68
69
70
71
锕系
2020/5/26
89
90
人教版必修2化学:1.1 元素周期表 课件(共20张PPT)

思考
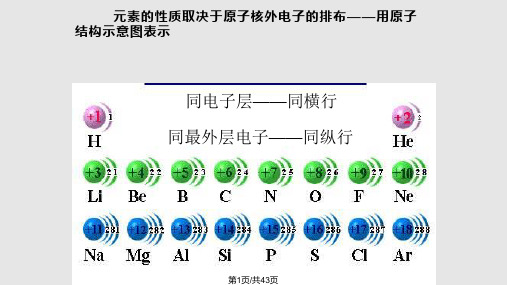
已知碳元素、镁元素和溴元素的原子结构示意图:
它们分别位于第几周期?为什么?
• 请周 叫同期做学表第有V们I1I阅8I个族读纵外课行,本,其P除余5,第每8回个、纵答9行、以各1下0为三问一个题个纵:族行。
1.什么叫做族? 2.族序数后标A的表示什么族?共有几个? 3.族序数后标B的又表示什么族?共有几个? 4.除此之外,还有什么族?在什么位置? 5.同一主族的元素,在原子结构上有何特点?
第一节 元素周期表
1869年俄国化学家门捷列夫在继 承和分析了前人工作的基础上,对大 量实验事实进行了订正、分析和概括, 成功地对元素进行了科学分类。将化 学性质相似的元素放在一个纵行,按 相对原子质量由小到大的顺序制出了 第一张元素周期表,揭示了化学元素 的内在联系,使其构成一个完整的体 系成为化学发展史上重要的里程碑之 一。
周七
期主
表 里
七 副 和
数零
周族
期,
,
最 后
1莫
2忘
3第
4 5
族 。
6
7
Ⅷ
随堂检测
B 1.主族元素在周期表中的位置取决于该元素的( )
A. 相对原子质量和核外电子数 B. 电子层数和最外层电子数 C. 相对原子质量的最外层电子数 D. 电子层数的次外层电子数
随堂检测
2.关于元素周期表的说法正确的是( D )
A.元素周期表中第I A 族全部都是金属元素 B.元素周期表共有18个族 C.元素周期表共有8个周期 D.元素周期表中第1、2、3周期是短周期
随堂检测
3.已知碳元素、镁元素和溴等主族元素的原子 结构示意图:
它们分别位于周期表的什么位置?
• 三、元素周期表的结构
高中化学 第一章物质结构 元素周期律 第一节素周期表(第1课时)元素周期表课件新人教版必修

答案:D
元素符号 原子序数 周期序数 族序数 C O
13
三 ⅦA
解析:6 号元素碳,位于元素周期表第二周期、第Ⅳ A 族;8 号元素氧,位于元素周期表第二周期、第ⅥA 族; 13 号元素铝,位于元素周期表第三周期、第ⅢA 族;17 号元素氯,位于元素周期表第三周期、第ⅦA 族。
答案:
元素符号 原子序数 周期序数 族序数
第一章
物质结构
元素周期律
第一节 元素周期表 第 1 课时 元素周期表
[学习目标] 1.简单了解元素周期表的发展历程。2. 了解元素周期表的编排原则及结构。3.能描述元素在元素 周期表中的位置。
知识衔接 1.元素是具有相同核电荷数(即质子数)的同一类原 子的总称。 2.原子中的质子数=核电荷数=核外电子数。
问题 3:你明确同主族相邻元素原子序数之间的关系 吗? 提示:(1)若为ⅠA、ⅡA 族元素,则原子序数之差等 于上周期的元素种类数。 (2)若为ⅢA 至 0 族元素,则原子序数之差等于下周 期的元素种类数。
问题 4:你会利用“0 族定位法”确定元素在周期表 中的位置吗? 提示:(1)0 族元素的周期序数和原子序数。
(3)元素周期表有 7 个横行,即 7 个周期;有 18 个纵 行, 但有 16 个族, 其中第Ⅷ族占据 3 个纵行。 (4)依据“周 期序数=电子层数, 主族序数=最外层电子数”判断。 (5) 第一周期中是氢元素开始,氢元素不是碱金属元素。 答案:(1)× (2)× (3)× (4)√ (5)×
1.以下关于元素周期表结构的叙述正确的是( A.元素周期表有 7 个主族,8 个副族 B.元素周期表有 3 个长周期和 3 个短周期 C.第ⅢA 族位于元素周期表的第三列(从左往右) D.0 族位于元素周期表的第 18 列(从左往右)
陕西省西安市临潼区马额中学人教版高中化学必修二课件:第一章第一节元素周期表(3)(共22张PPT)

IBe 5B
锂铍硼 11Na 12Mg 13Al
钠镁铝
A:主族
IVA VA
6C
7N
碳氮 14Si 15P
硅磷
0
2He
VIA VIIA 氦
8O
9F 10Ne
氧氟氖 16S 17Cl 18Ar
硫氯氩
三、元素的位置与结构的关系
元素在周期表中的位置与原子结构的关系
氟 电子,它是___元素。
周期的结构『周期』
短 周 期
周期的结构『周期』
长周期
周期的结构『周期』
不完全周期
元素周期表的结构『周期』 1、周期
周期 一 二 三 四 五 六
七
元素 种数
2
8
8 18 18 32
……
分类 短周期
长周期 不完全周期
(结构:三长、三短、一不全)
元素周期表的结构『族』
主族:A
1
2
1H
氢
3Li 4Be 5B
6C
7N
8O
9F
锂 周铍期序硼 数碳=电氮子层氧 数氟
11Na 12Mg 13Al 14Si 15P 16S 17Cl
钠镁铝硅磷硫氯
2He 氦 10Ne 氖 18Ar 氩
3
三、元素的位置与结构的关系
1
2
1H
2He
氢
氦
3Li 4Be 5B
6C
7N
8O
9F 10Ne
锂主族铍 序硼数=碳最外氮 层氧电子氟 数氖
周期
具有相同的电子层数的元素按照原子 周期 序数递增的顺序排列的一个横行
1
2
1H
2He
氢
氦
第一章 第一节 第1课时 元素周期表(优秀经典公开课比赛课件)

人教版化学·必修2
返回导航
上页
下页
人教版化学·必修2
返回导航
上页
下页
第 1 课时 元素周期表
人教版化学·必修2
返回导航
上页
下页
1.简单了解元素周期表的发展历程。 2.了解元素周期表的编排规则及结构。 3.能描述元素在元素周期表中的位置。
人教版化学·必修2
返回导航
上页
下页
知识点一
知识点二
演练 课时作业
人教版化学·必修2
返回导航
上页
下页
[典例剖析]
[典例 1] 已知元素的原子序数,不可以推断元素原子的( A.质子数 C.核外电子数
[解析]
)
B.核电荷数 D.离子所带的电荷数
根据原子序数=核电荷数=质子数=核外电子数,A、B、C 均能推断。
不能确定离子的电荷数。
[答案]
D
人教版化学·必修2
返回导航答案:C人教化学·必修2返回导航上页
下页
[微知识点] “原子序数=核电荷数=质子数=核外电子数”的关系 只有原子中存在上述关系,如果是离子,核外电子数与原子序数不相等。阳 离子的质子数大于其核外电子数, 阴离子的质子数小于其核外电子数。 如 Na: 质子数=核外电子数,Na+:质子数>核外电子数,Cl-:质子数<核外电子数。
人教版化学·必修2
返回导航
上页
下页
2.族 (1)概念:把不同横行中 最外层电子数 相同的元素,按 电子层数递增 的顺序 由上而下排成纵行。 (2)与原子结构的关系:元素周期表中主族元素的族序数等于其 最外层电子数 。
人教版化学·必修2
(3)分类:
在族序数后标A,如周期表中第14纵行表示 主族 — 为第ⅣA族,第16纵行表示为ⅥA族。
返回导航
上页
下页
人教版化学·必修2
返回导航
上页
下页
第 1 课时 元素周期表
人教版化学·必修2
返回导航
上页
下页
1.简单了解元素周期表的发展历程。 2.了解元素周期表的编排规则及结构。 3.能描述元素在元素周期表中的位置。
人教版化学·必修2
返回导航
上页
下页
知识点一
知识点二
演练 课时作业
人教版化学·必修2
返回导航
上页
下页
[典例剖析]
[典例 1] 已知元素的原子序数,不可以推断元素原子的( A.质子数 C.核外电子数
[解析]
)
B.核电荷数 D.离子所带的电荷数
根据原子序数=核电荷数=质子数=核外电子数,A、B、C 均能推断。
不能确定离子的电荷数。
[答案]
D
人教版化学·必修2
返回导航答案:C人教化学·必修2返回导航上页
下页
[微知识点] “原子序数=核电荷数=质子数=核外电子数”的关系 只有原子中存在上述关系,如果是离子,核外电子数与原子序数不相等。阳 离子的质子数大于其核外电子数, 阴离子的质子数小于其核外电子数。 如 Na: 质子数=核外电子数,Na+:质子数>核外电子数,Cl-:质子数<核外电子数。
人教版化学·必修2
返回导航
上页
下页
2.族 (1)概念:把不同横行中 最外层电子数 相同的元素,按 电子层数递增 的顺序 由上而下排成纵行。 (2)与原子结构的关系:元素周期表中主族元素的族序数等于其 最外层电子数 。
人教版化学·必修2
(3)分类:
在族序数后标A,如周期表中第14纵行表示 主族 — 为第ⅣA族,第16纵行表示为ⅥA族。
高中化学必修2课件全集:第1章 第1节《元素周期表》

表中的各元素之间又有怎样的内在联系?究竟还有多少种 元素没有被发现?元素周期表的终点又在哪里呢?下面让我们 一起走进教材第一节元素周期表的学习吧!
请同学阅读“一、元素周期表”的教材内容,时间5 分钟
原子序数 核电荷数 质子数 核外电子数
Na
11
11
11
11
Cl
17
17
17
17
1.什么是原子序数?一个原子的原子序数、核电荷 数、质子数、核外电子数之间有什么关系?
18 13 14 15 16 17 0
IIIA IVA VA VIA VIIA
11 12
IB IIB
列序 1 2 13 14 15 16 17
主族
族序 IA ⅡA ⅢA IVA VA VIA VIIA
列序 3 4 5
6
7 11 12
副主族族序族序数 =ⅢB最外ⅣB层电VB子数VI=B 最VI高IB正化ⅠB合价IIB
第VIII 族
第
8、9、10
,共3个纵行
0族
第 18 纵行
① 除9、10、18纵行(列序)外,族序数=列序个位数。(记忆方法) ②18个纵行,只16个族;0族和第VIII族不属主族,也不属副族。
族的别称
第ⅠA族称为 碱金_属_ 元素 ; 第ⅡA族称为 碱土金_属__元素; 第ⅣA族称为 碳族 元素; 第ⅤA族称为 氮族 元素; 第ⅥA族称为 氧族 元素; 第ⅦA族称为 卤 元素; 零族称为 稀有族气体__元素.
2.我们把ⅠA 族(除氢)称为碱金属,为什么要把它们 编在一个族呢?
1.碱金属元素 观察碱金属元素的原子结构示意图有何异同?
元素 元素 核电荷 原子结构示意图 名称 符号 数
锂 碱
请同学阅读“一、元素周期表”的教材内容,时间5 分钟
原子序数 核电荷数 质子数 核外电子数
Na
11
11
11
11
Cl
17
17
17
17
1.什么是原子序数?一个原子的原子序数、核电荷 数、质子数、核外电子数之间有什么关系?
18 13 14 15 16 17 0
IIIA IVA VA VIA VIIA
11 12
IB IIB
列序 1 2 13 14 15 16 17
主族
族序 IA ⅡA ⅢA IVA VA VIA VIIA
列序 3 4 5
6
7 11 12
副主族族序族序数 =ⅢB最外ⅣB层电VB子数VI=B 最VI高IB正化ⅠB合价IIB
第VIII 族
第
8、9、10
,共3个纵行
0族
第 18 纵行
① 除9、10、18纵行(列序)外,族序数=列序个位数。(记忆方法) ②18个纵行,只16个族;0族和第VIII族不属主族,也不属副族。
族的别称
第ⅠA族称为 碱金_属_ 元素 ; 第ⅡA族称为 碱土金_属__元素; 第ⅣA族称为 碳族 元素; 第ⅤA族称为 氮族 元素; 第ⅥA族称为 氧族 元素; 第ⅦA族称为 卤 元素; 零族称为 稀有族气体__元素.
2.我们把ⅠA 族(除氢)称为碱金属,为什么要把它们 编在一个族呢?
1.碱金属元素 观察碱金属元素的原子结构示意图有何异同?
元素 元素 核电荷 原子结构示意图 名称 符号 数
锂 碱
人教版高一化学课件-元素周期律

A兩l(O性H氫)3 ( 氧化物 )
所以: Na Mg Al
金屬性逐漸 減弱 .
3. 閱讀
比較第三週期非金屬與氫氣反應條件及含氧酸的酸性強 弱 (P16)
4. 結論
上述實驗證明,第三週期元素金屬性、非金屬性的遞變 規律:
Na Mg Al Si P S Cl
金屬性逐漸 減弱 ,非金屬性逐漸 增強 。
結構
位置
決定
反映
反映
反映
決定
決定
性質
元素週期表及週期律具體又有哪些應用呢?
一、元素的位、構、性三者之間的關係應用
1. 結構決定位置 原子序數=核電荷數 週期序數=電子層數 主族序數=最外層電子數
2. 結構決定性質
最外層電子數=主族元素的最高正價數=8-負價數
最外層電 子數和原 子半徑
原子得 失電子 的能力
性性半 逐逐徑 漸漸逐 增增漸 強強增
屬 性 逐 漸
大
增
金屬性逐漸增強
強
非金屬性依次增強
得電子能力依次增強
原子半徑依次減小
金 屬 性 依 次 增 強
失 電 子 能 力 依 次 增 強
原 子 半 徑 依 次 增 大
原 子 半 徑 依 次 減 小
得 電 子 能 力 依 次 增 強
非 金 屬 性 依 次 增 強
1. 硒是人體肝臟和腎臟的組成元素之一,現在含有元 素硒(Se) 的保健品已經進入市場, 已知它與氧元素同
族, 與K同週期, 關於硒的說法中不正確的是( D )
A.原子序數為34
B.最高價氧化物的水化物的分子式為H2SeO4 C.Se的非金屬性比Br弱
D.氣態氫化物的穩定性比硫化氫氣體強
2. 有V、W、X、Y、Z五種元素,它們的核電荷數依次增 大,且均小於20,其中X、Z是金屬元素,V和Z元素原子 的最外層都只有一個電子,W和Y元素原子的最外層電子 數相等,且W元素原子L層電子數是K層電子數的3倍,X 元素原子的最外層電子數是Y元素原子最外層電子數的 一半。
高一年级化学元素周期表PPT课件
第9页/共43页
第10页/共43页
相
邻
2
8周
期
8元
18 素
原
18 子
32 序
数
之
差
第11页/共43页
二 .元素的性质和元素周期表的位置 关系
2.同周期元素的性质变化规律
第12页/共43页
原子半径示意图
H
He
Li Be B
CN
OF N
e
N M Al Si P
S Cl Ar
a
g
K
Ca Ga
Ge As Se
磷蒸气 须 光照或 有
与H2能 反应
加 热
点燃爆 气 炸化合 体
最高价氧化 物对应水化 物的酸碱性
NaOH
强碱
Mg(OH)2 Al(OH)3
中强碱 两性氢 氧化物
H4SiO4
弱酸
H3PO4 H2SO4 HClO4
中强 强酸 最强
酸
酸
元 素
金属性和非 金属性递变
金属性逐渐减弱,非金属性逐渐增强
第39页/共43页
盐酸 较快
Mg(OH)2 Al(OH)3
中强碱
?
金属性 Na > Mg > Al
第31页/共43页
取少量1mol/L AlCl3溶液注入试管中,加入3mol/L 的NaOH 溶液至产生大量Al(OH)3白色絮状沉淀为止。
NaOH溶液
AlCl3溶液
Al(OH)3
AlCl3 溶液和NaOH溶液的反应
第32页/共43页
随着原子序数的递增
元素原子的核外电子排布呈现周期性变化 元素原子半径呈现周期性变化 元素化合价呈现周期性变化 元素的化学性质呈现周期性变化
陕西省西安市临潼区马额中学人教版高中化学必修二课件:第一章第一节元素周期表(2)(共27张PPT)

2. 周期序数与电子层数的关系,族序数与最外层电子数 的关系
二、元素周期表的结构
[学生活动]:请同学们完成下列表格
类别
短周期 长周期
周期序数 起止元素 元素种类 电子层数
1
H—He
2
1
2
Li—Ne
8
2
3 Na—Ar 8
3
4
K—Kr
18
4
5
Rb—Xe
18
5
6
Cs—Rn
32
6
7 Fr—112 32
7
纪念他,将101号元素命名为钔。
现在使用的元素周期表:
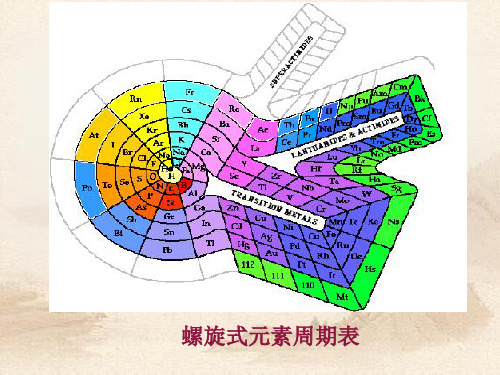
环式周期表
层式周期表
扇形元素周期表
放射式周期表
螺旋型周期表
现在使用的元素周期表:
这么多种元素,是按 照怎样的规律排布在
周期表中的呢?
[学与问] 阅读课本P4,回答下列问题
1、回忆原子的结构,画出钠的原子结构示意图
2、 什么叫原子序数?
ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB
VIII
ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0
1 2A 3 4 5 6 7B
3.哪族元素种类最多?
8 1 2B 3 4
ⅢB
5 6 7A 0
16族
4.观察元素周期表中,从ⅢB到ⅡB之间的元素之间存在哪 些共同特征?
都是金属元素,统称作过渡金属。且只包括Ⅷ族、副族元 素;非金属元素都属于主族和零族。
周期
把——电—子——层—数——相—同--------
的元素排成一个横行
横行 按——原—子——序—数——递—增—-----------的顺序从左到右排列
族 纵行
把——最—外——层—电——子—数——相—同-------的元素排成一个纵行(He例外) 按———电——子—层——数—递—-增-----------的顺序从上到下排成
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.周期
2.族 (1)概念:把不同横行中 最外层电子数 相同的元素,按 电子层数递增 的 顺序由上而下排成纵行。 (2)与原子结构的关系:元素周期表中主族元素的族序数等于其最外层电子数。
2.族(前七周期)
• 三短三长一不全 , 七主七副零捌叁, • 左二右五加零族 , 中间镧锕和过渡。
• 注意:
第一节 元素周期表
1.简单了解元素周期表的发展历程。
2.了解元素周期表的编排原则及结构。
3.能描述元素在元素周期表中的位置。(重点)
4.了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理 论解释。(重难点)
一、元素周期表的结构
1.周期 (1)概念:具有相同的电子层数 而又按原子序数递增的顺序排列 的一横行,叫做一个周期。 (2)与原子结构的关系:周期的序数就是该周期元素具有的 电子层数 。 (3)分类:
写出该化合物的名称及化学式------------
课后作业:
完成P13~15相关习题
• 1. 同一周期 ⅡA 与 ⅢA 序数之差为
•
1 , 11 , 25
• 2.同一主族相邻周期原子序数之差
• a. ⅠA 下一周期所含元素种类
•
3.主族的排列顺序
• ⅠA ⅡA Ⅲ A ⅣA ⅤA Ⅵ A ⅦA O族
•1
2
13 14 15 16 17 18
(3)C的单质的化学式为________,其氢化物的水溶液可用于雕刻玻璃, 其原因是_________________________________(用化学方程式表示)。
3. X Y Z 和 W代表原子序数依次增大的四种短周期元素,它们满足 以下条件:
. 元素周期表中,Z与Y相邻,Z与W也相邻: . Y Z 和W三种元素的原子最外层电子数之和为17 请填空: (1). Y Z 和 W 三种元素是否位于同一周期(填“是”或“否”):------------,理由是 --------------------------------------------------------------------------------------------(2). Y是 --------- , Z是--------- , W是----------; (3). X Y Z 和 W 可组成一化合物,其原子个数之比为8 : 2 :4 : 1
2.短周期元素A、B、C在元素周期表中的位置如图所示,已知A、B、 C三种元素的原子核外电子数之和等于B的质子数的2倍。据此回答下列问 题:
(1)A的最高价氧化物的化学式为________,写出实验室制取A的气态氢 化物的化学方程式:_______________________。
(2)B的元素符号为__________,在周期表中位于第________周期第 ________族。
二、 判断元素周期表位置的方法
1.画原子结构示意图
例. 31号 Ga
50号Sn
2.用稀有气体序数确定
所求元素原子序数—离它最近且比它序数小的稀有气体序数
=差
小于18 为列数
大于18 差—14 = 列数 周期数 :比稀有气 体周期数大 1
族数: 用列数确定
三 、练习
1.下列说法中,错误的是( )
A.原子及其离子的核外电子层数等于该元素所在的周期序 数 B.元素周期表中从第ⅢB族到第ⅡB族10个纵行的元素都是 金属元素 C.除He外的稀有气体元素原子的最外层电子数都是8 D.第四周期中,第ⅡA族与第ⅢA族之间隔着10个纵行
