★试卷5套汇总★河北省衡水市2021年新高考化学质量跟踪监视试题
河北衡水中学2021届高三调研试题 化学 Word版含答案

绝密★启用前河北衡水中学2021届高三调研试题化学全卷满分100分,考试时间90分钟。
★祝考试顺利★注意事项:1.答题前,考生务必将自己的姓名、准考证号填写在答题卡上。
并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题作答用2B铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其它答案标号。
答在试卷和草稿纸上无效。
3.非选择题作答用0.5毫米黑色墨水签字笔直接答在答题卡上对应的答题区域内。
答在试卷和草稿纸上无效。
考生必须保持答题卡的整洁。
考试结束后,只需上交答题卡4.可能用到的相对原子质量:H1 C12 O16 Na23 Mg24 Fe56 Cu64第I卷(选择题共40分)一、选择题:本题共10小题,每小题2分,共20分。
每小题只有一个选项符合题目要求。
1.“84”消毒液、消毒酒精、口罩、体温计是抗击新型冠状肺炎期间常用的物资。
下列说法中正确的是A.口罩的原材料聚丙烯熔喷布属于有机高分子材料B.医用消毒酒精的浓度越大越好,最好使用无水乙醇C.为增强消毒效果,可将“84”消毒液与洁厕灵混合后使用D.家用水银体温计中的水银属于合金2.若将N的电子排布式写成1s2s22p x22p y1),它违背了A.能量守恒原理B.泡利原理C.能量最低原理D.洪特规则3.下列关于晶体的说法中正确的是A.含有金属阳离子的晶体定是离子晶体B.共价键的强弱可决定分子晶体的熔、沸点C.晶体尽可能采取紧密堆积方式,以使其变得比较稳定D.氯化钠晶体中,一个Na+与8个Cl-紧邻4.研究发现,Pd2团簇可催化CO的氧化[2CO(g)+O2(g)=2CO2(g) △H],在催化过程中可能生成不同的过渡态和中间产物(过渡态已标出),催化时的能量变化如图所示。
下列有关该催化过程的说法正确的是A.若使用不同的催化剂,则△H 不同B.每一步都是吸热反应C.该过程中的最大能垒为1.77eVD.△H =+6.28eV5.下列反应对应的离子方程式不正确的是A.将铁粉投入硫酸铜溶液中:2Fe +3Cu 2+=2Fe 3++3CuB.用过量稀盐酸去除水垢(主要成分为CaCO 3):CaCO 3+2H +=Ca 2++H 2O +CO 2↑C.将过量CO 2通入NaOH 溶液中:CO 2+OH -=HCO 3-D.将氯气通入NaOH 溶液中:Cl 2+2OH -=Cl -+ClO -+H 2O6.已知19ClO 4-+8Cr 3++4H 2O =8CrO 2(ClO 4)2+3Cl -+8H +,下列说法不正确的是A.ClO 4-中Cl 元素显+7价B.CrO 2(ClO 4)2为还原产物C.该反应中氧化剂为ClO 4-D.反应后溶液pH 减小7.设N A 为阿伏加德罗常数的值。
河北省衡水中学2021年高考押题理综化学试题Word版含解析

河北省衡水中学2021年高考押题理综化学试题Word版含解析 2021年普通高等学校招生全国统一考试模拟试题科学综合能力测试(一)注意事项:1.本试卷分为两部分:第一卷(选择题)和第二卷(非选择题)。
答题前,考生必须在答题卡上填写自己的姓名和录取证号码。
2.回答第ⅰ卷时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。
写在本试卷上无效。
3.回答第二卷时,将答案写在答题纸上。
写在这张试卷上是无效的。
4.考试结束后,将试卷和答题纸一起退回。
可能用到的相对原子质量:h1c12n14o16ni59第一卷一、选择题:本题共13小题,每小题6分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生产和生活密切相关。
以下与化学有关的陈述是正确的a.水泥、水玻璃、水晶均属于硅酸产品b.医用酒精和葡萄糖注射液可用丁达尔效应区分c.氯水和食盐水消毒杀菌的原理相同d.铵态氮肥和草木灰混合使用会降低肥效8.利用h2和o2制备h2o2的原理①h2(g)+a(1)b(1)?h1②o2(g)+b(1)a(1)+h2o2(1)?h2已知:a、b均为有机物,两个反应均能自发进行。
下列说法正确的是a.?h2>0b、 b是从H2和O2制备H2O2的催化剂c.反应①的正反应的活化能大于逆反应的活化能d.h2(g)+o2(g)H2O2(1)?h<09.下列关于有机物的说法正确的是a、乙烷和新戊烷分子中所含的甲基数之比为1:1b。
甲苯可进行加成反应、氧化反应和取代反应c.聚乙烯能使酸性kmno4溶液和溴水褪色,但二者原理不同d、和C4H10的二氯化合物数量相同(不包括立体异构)10.短周期主族元素x、y、z、w的原子序数依次增大,x、w同主族;y、z同周期;x、y、z三种元素形C(OH)在25℃的0.1mol溶液中变成化合物m?1.0? 以下陈述正确吗?c(h)-1a.简单离子半径:y<z<wb、由X、Z和W形成的化合物的化学键类型是相同的yc.x、y形成最简单化合物的电子式为x:??:x除息的。
[合集5份试卷]2021河北省衡水市新高考化学质量跟踪监视试题
![[合集5份试卷]2021河北省衡水市新高考化学质量跟踪监视试题](https://img.taocdn.com/s3/m/dff4e1cc7fd5360cbb1adb16.png)
2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.常温下,下列各组离子一定能在指定溶液中大量共存的是()A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-B.=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-2.化学与人们的日常生活密切相关,下列叙述正确的是A.二氧化硅是制造玻璃、光导纤维的原料B.纤维素、油脂是天然有机高分子化合物C.白菜上洒少许福尔马林,既保鲜又消毒D.NO x、CO2、PM2.5颗粒都会导致酸雨3.下列叙述正确的是A.24 g 镁与27 g铝中,含有相同的质子数B.同等质量的氧气和臭氧中,电子数相同C.1 mol重水与1 mol水中,中子数比为2∶1D.1 mol乙烷和1 mol乙烯中,化学键数相同4.某反应过程能量变化如图所示,下列说法正确的是A.反应过程a有催化剂参与B.该反应为吸热反应,热效应等于∆HC.改变催化剂,可改变该反应的活化能D.有催化剂的条件下,反应的活化能等于E1+E25.如图所示,电化学原理与微生物工艺相组合的电解脱硝法,可除去引起水华的NO3-原理是将NO3-还原为N2。
下列说法正确的是()A .若加入的是3NaNO 溶液,则导出的溶液呈碱性B .镍电极上的电极反应式为:2Ni 2e Ni -+-=C .电子由石墨电极流出,经溶液流向镍电极D .若阳极生成0.1mol 气体,理论上可除去0.04mol 3NO -6.下列属于电解质的是( )A .铜B .葡萄糖C .食盐水D .氯化氢 7.环己酮()在生产生活中有重要的用途,可在酸性溶液中用环己醇间接电解氧化法制备,其原理如图所示。
河北省衡水市2021年高考化学质量跟踪监视试题
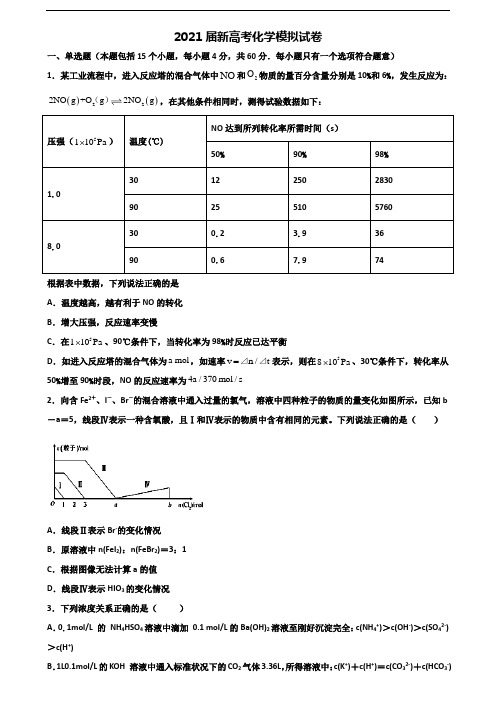
2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.某工业流程中,进入反应塔的混合气体中NO 和2O 物质的量百分含量分别是10%和6%,发生反应为:()()222NO g +O g 2NO g (),在其他条件相同时,测得试验数据如下:压强(5110Pa ⨯) 温度(℃)NO 达到所列转化率所需时间(s )50%90% 98% 1.03012250283090 25 510 5760 8.0300.23.936900.67.974根据表中数据,下列说法正确的是 A .温度越高,越有利于NO 的转化 B .增大压强,反应速率变慢C .在5110Pa ⨯、90℃条件下,当转化率为98%时反应已达平衡D .如进入反应塔的混合气体为a mol ,如速率v n /t =⊿⊿表示,则在5810Pa ⨯、30℃条件下,转化率从50%增至90%时段,NO 的反应速率为4a /370mol /s2.向含Fe 2+、I -、Br -的混合溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b -a =5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。
下列说法正确的是( )A .线段Ⅱ表示Br -的变化情况B .原溶液中n(FeI 2):n(FeBr 2)=3:1C .根据图像无法计算a 的值D .线段Ⅳ表示HIO 3的变化情况 3.下列浓度关系正确的是( )A .0.1mol/L 的 NH 4HSO 4溶液中滴加 0.1 mol/L 的Ba(OH)2溶液至刚好沉淀完全:c(NH 4+)>c(OH -)>c(SO 42-)>c(H +)B .1L0.1mol/L 的KOH 溶液中通入标准状况下的CO 2气体3.36L ,所得溶液中:c(K +)+c(H +)=c(CO 32-)+c(HCO 3-)+c(OH-)C.0.1mol/L 的NaOH 溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(HCN)>c(Na+)>c(CN-)>c(OH-)>c(H+)D.同温下pH相同的NaOH 溶液、CH3COONa 溶液、Na2CO3溶液、NaHCO3溶液的浓度:c(NaOH)<c(CH3COONa)<c(NaHCO3)<c(Na2CO3)4.硅及其化合物在材料领域中应用广泛。
2021年全国新高考化学真题试卷(河北卷)(Word版+答案+解析)

2021年高考化学真题试卷(河北卷)一、单选题(共9题;共27分)1.“灌钢法”是我国古代劳动人民对钢铁冶炼技术的重大贡献,陶弘景在其《本草经集注》中提到“钢铁是杂炼生鍒作刀镰者”。
“灌钢法”主要是将生铁和熟铁(含碳量约0.1%)混合加热,生铁熔化灌入熟铁,再锻打成钢。
下列说法错误的是()A. 钢是以铁为主的含碳合金B. 钢的含碳量越高,硬度和脆性越大C. 生铁由于含碳量高,熔点比熟铁高D. 冶炼铁的原料之一赤铁矿的主要成分为Fe2O32.高分子材料在生产生活中应用广泛。
下列说法错误的是()A. 芦苇可用于制造黏胶纤维,其主要成分为纤维素B. 聚氯乙烯通过加聚反应制得,可用于制作不粘锅的耐热涂层C. 淀粉是相对分子质量可达几十万的天然高分子物质D. 大豆蛋白纤维是一种可降解材料3.下列操作规范且能达到实验目的的是()A. 图甲测定醋酸浓度B. 图乙测定中和热C. 图丙稀释浓硫酸D. 图丁萃取分离碘水中的碘4.硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法正确的是()A. NO2和SO2均为红棕色且有刺激性气味的气体,是酸雨的主要成因B. 汽车尾气中的主要大气污染物为NO、SO2和PM2.5C. 植物直接吸收利用空气中的NO和NO2作为肥料,实现氮的固定D. 工业废气中的SO2可采用石灰法进行脱除5.用中子轰击X原子产生α粒子(即氮核He)的核反应为:X+ n→ Y+ He。
已知元素Y在化合物中呈+1价。
下列说法正确的是()A. H3XO3可用于中和溅在皮肤上的NaOH溶液B. Y单质在空气中燃烧的产物是Y2O2C. X和氢元素形成离子化合物D. 6Y和7Y互为同素异形体6.BiOCl是一种具有珠光泽的材料,利用金属Bi制备BiOCl的工艺流程如图:下列说法错误的是()A. 酸浸工序中分次加入稀HNO3可降低反应剧烈程度B. 转化工序中加入稀HCl可抑制生成BiONO3C. 水解工序中加入少量CH3COONa(s)可提高Bi3+水解程度D. 水解工序中加入少量NH4NO3(s)有利于BiOCl的生成7.N A是阿伏加德罗常数的值,下列说法错误的是()A. 22.4L(标准状况)氟气所含的质子数为18N AB. 1mol碘蒸气和1mol氢气在密闭容器中充分反应,生成的碘化氢分子数小于2N AC. 电解饱和食盐水时,若阴阳两极产生气体的总质量为73g,则转移电子数为N AD. 1L1mol•L-1溴化铵水溶液中NH 与H+离子数之和大于N A8.苯并降冰片烯是一种重要的药物合成中间体,结构简式如图。
河北省衡水中学2021届高三化学上学期第四次调研考试试题(含解析)

河北省衡水中学2021届高三化学上学期第四次调研考试试题(含解析)本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分。
共12页,满分100分,考试时间110分钟。
可能用到的相对原子质量:H 1 D 2 C 12 N 14 O 16 Al 27 S 32 Fe 56 Cu 64 Zn 65 Br 80第I卷(选择题共40分)一、选择题(1~20每小题1分,21~30每小题2分,共40分。
从每小题给出的四个选项中,选出最佳选项,并在答题纸上将该项涂黑)1.化学与生产、生活、科技、环境等密切相关。
下列说法正确的是 ( )A. “华为麒麟980”手机中芯片的主要成分是二氧化硅B. 豆腐有“植物肉”之美称,“卤水点豆腐”是胶体的聚沉过程C. 港珠澳大桥为了防腐蚀可以在钢铁中增加含碳量D. 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是碳酸钠【答案】B【解析】【详解】A. 手机中芯片的主要成分是硅,而不是二氧化硅, A错误;B.豆浆属于胶体,向豆浆中加入卤水(含有电解质溶液)会引发胶体的聚沉,形成豆腐,B 正确;C. 钢铁中增加含碳量,更容易形成原电池,形成原电池造成铁的腐蚀速率加快,C错误;D. 草木灰的主要成分是碳酸钾,碳酸钾水解显碱性,可洗衣服,故D错误;答案选B。
2.ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。
下列说法不正确的是A. 步骤a的操作包括过滤、洗涤和干燥B. 吸收器中生成NaClO2的离子方程式:2ClO2+H2O2=2C1O2-+O2↑+2H+C. 工业上可将ClO2制成NaClO2固体,便于贮存和运输D. 通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收【答案】B【解析】A. 步骤a中,由溶液得到NaClO2固体,进行的操作为:过滤、洗涤和干燥,A正确;B. 吸收器中发生反应:2ClO2+2NaOH+H2O2═2NaClO2+O2+2H2O,离子方程式为:2ClO2+2OH−+H2O2=2ClO2-+O2+2H2O,B错误;C. 固体比气体便于贮存和运输,工业上可将ClO2制成NaClO2固体,C正确;D. 反应结束后,发生器中仍有少量ClO2,用空气可以将其排出,确保其在吸收器中被充分吸收,D正确。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2021届新高考化学模拟试卷一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.硅元素在地壳中的含量非常丰富。
下列有关说法不正确的是A.晶体硅属于共价晶体B.硅原子的电子式为C.硅原子的核外电子排布式为1s22s22p63s23p2D.硅原子的价电子排布图为2.关于石油和石油化工的说法错误的是A.石油大体上是由各种碳氢化合物组成的混合物B.石油分馏得到的各馏分是由各种碳氢化合物组成的混合物C.石油裂解和裂化的主要目的都是为了得到重要产品乙烯D.实验室里,在氧化铝粉末的作用下,用石蜡可以制出汽油3.设N A为阿伏加德罗常数的值。
下列说法正确的是()A.20 g D2O和18 g H2O中含有的质子数均为10N AB.2 L 0.5 mol·L-1亚硫酸溶液中含有的H+数为2N AC.标准状况下,22.4 L水中含有的共价键数为2N AD.50 mL 12 mol·L-1的浓盐酸与足量MnO2共热,转移的电子数为0.3N A4.已知:①H2 (g) + Se (g) H2Se (g) +87.48kJ②Se (g) → Se (s) +102.17kJ;下列选项正确的是A.H2 (g) + Se (s)的总能量对应图中线段bB.相同物质的量的Se,Se(s)的能量高于Se(g)C.1mol Se (g)中通入1mol H2(g),反应放热87.48kJD.H2 (g) + S (g) H2S (g) +QkJ ,Q< 87.48kJ5.下列反应中,水作氧化剂的是()A.SO3+H2O→H2SO4B.2K+2H2O→2KOH+H2↑C.2F2+2H2O → 4HF+O2D.2Na2O2+2H2O→ 4NaOH+O2↑6.化学与生活密切相关,下列说法错误的是()A.乙醇汽油可以减少汽车尾气污染B.化妆品中添加甘油可以起到保湿作用C.有机高分子聚合物不能用于导电材料D .葡萄与浸泡过高锰酸钾溶液的硅藻土放在一起可以保鲜7.下列物质名称和括号内化学式对应的是( )A .纯碱(NaOH )B .重晶石(BaSO 4)C .熟石膏(CaSO 4•2H 2O )D .生石灰[Ca(OH)2]8.一种治疗感冒咳嗽的药物结构简式是。
下列关于该有机物的说法正确的是( )A .分子中所有碳原子可在同一平面上B .该有机物的分子式是C 10H 16OC .该有机物能发生加成和氧化反应D .该有机物与互为同分异构体 9.下列说法正确的是( )A .分子式为C 2H 6O 的有机化合物性质相同B .相同条件下,等质量的碳按a 、b 两种途径完全转化,途径a 比途径b 放出更多热能途径a :C 2H O −−−→高温CO+H 22O −−−→燃烧CO 2+H 2O 途径b :C 2O−−−→燃烧CO 2 C .食物中可加入适量的食品添加剂,如香肠中可以加少量的亚硝酸钠以保持肉质新鲜D .生石灰、铁粉、硅胶是食品包装中常用的干燥剂10.Q 、W 、X 、Y 、Z 是原子序数依次增大的短周期元素,X 的焰色反应呈黄色。
Q 元素的原子最外层电子数是其内层电子数的2倍。
W 、Z 最外层电子数相同,Z 的核电荷数是W 的2倍。
元素Y 的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是A .原子半径的大小顺序:r Y > r X >r Q >r WB .X 、Y 的最高价氧化物的水化物之间不能发生反应C .Z 元素的氢化物稳定性大于W 元素的氢化物稳定性D .元素Q 和Z 能形成QZ 2型的共价化合物11.下列各组物质由于温度不同而能发生不同化学反应的是( )A .纯碱与盐酸B .NaOH 与AlCl 3溶液C .Cu 与硫单质D .Fe 与浓硫酸12.设N A 为阿伏伽德罗常数。
下列说法不正确的是A .常温常压下,35.5g 的氯气与足量的氢氧化钙溶液完全反应,转移的电子数为0.5N AB .60g 甲酸甲酯和葡萄糖的混合物含有的碳原子数目为2N AC .同温下,pH=1体积为1L 的硫酸溶液所含氢离子数与pH=13体积为1L 的氢氧化钠溶液所含氢氧根离子数均为0.1N AD .已知合成氨反应:N 2(g)+3H 2(g)2NH 3(g);△H=-92.4kJ/mol ,当该反应生成N A 个NH 3分子时,反应放出的热量为46.2kJ13.化学与人类生活、生产和社会可持续发展密切相关,下列说法错误的是A.84消毒液具有强氧化性,可用于居家环境杀菌消毒B.加强生活垃圾分类与再生资源回收有利于践行“绿水青山就是金山银山”的理念C.中国华为自主研发的5G芯片巴龙5000的主要材料是SiD.太阳能光催化环境技术技术可以将二氧化碳转化为燃料,该燃料属于一次能源14.第三周期X、Y、Z、W四种元素的最高价氧化物溶于水可得到四种溶液,0.010 mol/L的这四种溶液在25℃时的pH与该元素原子半径的关系如图所示。
下列说法正确的是A.简单离子半径:X>Y>Z>WB.W的氧化物对应的水化物一定是强酸C.气态氢化物的稳定性:W<Z<YD.W与Z可形成一种各原子均达到8电子稳定结构的化合物Z2W2,其结构式为:W-Z-Z-W15.下列离子方程式或化学方程式正确的是( )A.向Na2S2O3溶液中加入稀HNO3:S2O32-+2H+=SO2↑+S↓+H2OB.向Al2(SO4)3溶液中滴加Na2CO3溶液:2Al3++3CO32-=Al2(CO3)3↓C.“侯德榜制碱法”首先需制备碳酸氢钠:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl D.CuSO4溶液中加入过量NaHS溶液:Cu2++HS-=CuS↓+H+二、实验题(本题包括1个小题,共10分)16.实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:+CH3OH+H2O已知甲基丙烯酸甲酯受热易聚合;甲基丙烯酸甲酯在盐溶液中溶解度较小;CaCl2可与醇结合形成复合物;实验步骤:①向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;②在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热烧瓶。
在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中;③当,停止加热;④冷却后用试剂X 洗涤烧瓶中的混合溶液并分离;⑤取有机层混合液蒸馏,得到较纯净的甲基丙烯酸甲酯。
请回答下列问题:(1)A装置的名称是_____。
(2)请将步骤③填完整____。
(3)上述实验可能生成的副产物结构简式为_____(填两种)。
(4)下列说法正确的是______A.在该实验中,浓硫酸是催化剂和脱水剂B.酯化反应中若生成的酯的密度比水大,不能用分水器提高反应物的转化率C.洗涤剂X是一组试剂,产物要依次用饱和Na2CO3、饱和CaCl2溶液洗涤D.为了提高蒸馏速度,最后一步蒸馏可采用减压蒸馏;该步骤一定不能用常压蒸馏(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_____。
实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是_____。
A.分水器收集的水里含甲基丙烯酸甲酯B.实验条件下发生副反应C.产品精制时收集部分低沸点物质D.产品在洗涤、蒸发过程中有损失三、推断题(本题包括1个小题,共10分)17.石油裂解气用途广泛,可用于合成各种橡胶和医药中间体。
利用石油裂解气合成CR橡胶和医药中间体K的线路如下:已知:Ⅰ.氯代烃D的相对分子质量是113,氯的质量分数约为62.8%,核磁共振氢谱峰面积之比为2:1. Ⅱ. 。
(1)A中官能团的结构式为__________________,D的系统名称是________________.(2)反应②的条件是_____________,依次写出①和③的反应类型___________、_________.(3)写出F→G过程中第一步反应的化学方程式____________________________.(4)K的结构简式为____________________.(5)写出比G多2个碳原子的同系物的所有同分异构体的结构简式_________________.(6)已知双键上的氢原子很难发生取代反应。
以A为起始原料,选用必要的无机试剂合成B_______。
合成路线流程图示如下:。
四、综合题(本题包括2个小题,共20分)18.沼气的主要成分是CH4,还含有CO2、H2S等。
Jo De Vrieze等设计了利用膜电解法脱除沼气中的CO2和H2S,并将阴极处理后气体制成高纯度生物甲烷,其流程如图所示。
(1) 需控制电解槽中阴极室pH>7,其目的是________________。
(2) 阳极室逸出CO2和________(填化学式);H2S在阳极上转化为SO42-而除去,其电极反应式为___________________。
(3) 在合成塔中主要发生的反应为:反应Ⅰ:CO2(g)+4H2(g)=CH4(g)+2H2O(g)ΔH1反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g)ΔH2调节22n(H)n(CO)=4,充入合成塔,当气体总压强为0.1 MPa,平衡时各物质的物质的量分数如图1所示;不同压强时,CO2的平衡转化率如图2所示:①反应CO2(g)+CH4(g)=2CO(g)+2H2(g)的△H=________(用ΔH1、ΔH2表示)。
②图1中,200~550 ℃时,CO2的物质的量分数随温度升高而增大的原因是__________。
③图2中,相同温度下,压强越大,CO2的平衡转化率越大,其原因是___________________;在压强为10 MPa时,当温度在200~800 ℃范围内,随温度升高,CO2的平衡转化率始终减小,其原因是________________________。
19.(6分)无机物可根据其组成和性质进行分类。
现有Cl2、Na、CO2、Na2O、Na2O2、NH3六种物质,完成下列填空:(1)由分子构成的单质是____________,属于极性分子的是____________。
(2)既有离子键又有共价键的物质的电子式为____________。
(3)上述化合物中组成元素的原子半径由大到小的顺序是____________。
(4)根据与水反应的不同,上述物质可分成A组(CO2、Na2O和NH 3)和B组(Cl2、Na和Na2O2),分组的依据是________________________。
(5)在酸性高锰酸钾溶液中加入Na2O2,溶液褪色,发生反应242222MnO H Na O Mn Na O H O(未配平),配平该反应的离子方程式并标出电子转移方向与数目。
