柱后电化学衍生测定四种黄曲霉毒素 5990-9125CHCN
超高效液相色谱-串联质谱法同时检测地龙药材中4种黄曲霉毒素含量及阳性结果确证

分析测试经验介绍 (104 ~ 109)超高效液相色谱-串联质谱法同时检测地龙药材中4种黄曲霉毒素含量及阳性结果确证郭 晶1,张 进1,李文君1,李正刚2(1. 通化市食品药品检验所,吉林 通化 134000;2. 四平市食品药品检验所,吉林 四平 136000)摘要:建立超高效液相色谱-串联质谱法同时测定地龙药材中黄曲霉毒素B 1、B 2、G 1、G 2的含量,并对阳性结果进行确证. 样品经70%甲醇提取、免疫亲和柱净化、超高效液相色谱柱分离、三重四极杆质谱检测,并采用离子峰度比进行阳性结果确证. 结果表明,4种黄曲霉毒素的线性关系良好(r >0.999 5),回收率在91.2%~95.6%范围内.黄曲霉毒素B 1、B 2、G 1、G 2的检出限分别为0.10、0.038、0.11、0.038 µg/kg. 方法专属性好,灵敏度高,准确性好,可以进行最终阳性检出的判定. 15批地龙药材中6批黄曲霉毒素确证阳性检出, 证明地龙药材较易被黄曲霉毒素污染.关键词:地龙;超高效液相色谱-串联质谱;黄曲霉毒素;阳性结果确证中图分类号:O657. 63 文献标志码:B 文章编号:1006-3757(2024)02-0104-06DOI :10.16495/j.1006-3757.2024.02.005Simultaneous Determination of Four Aflatoxins in Pheretima by Ultra Performance Liquid Chromatography Tandem Mass Spectrometry andConfirmation of Positive ResultsGUO Jing 1, ZHANG Jin 1, LI Wenjun 1, LI Zhenggang2(1. Tonghua Institute for Food and Drug Control , Tonghua 134000, Jilin China ;2. Siping Institute for Food andDrug Control , Siping 136000, Jilin China )Abstract :A method for simultaneous determination of aflatoxins B 1, B 2, G 1, and G 2 in pheretima was been established by ultra performance liquid chromatography tandem mass spectrometry (UPLC-MS/MS), and the positive results was confirmed. The samples were extracted by 70% methanol, purified by a immunoaffinity columns, separated by UPLC-MS/MS, detected by triple quadrupole mass spectrometry, and confirmed by ion peak ratio. The results showed that the linear relationship of the four aflatoxins were good (r >0.999 5), and the recoveries ranged from 91.2% to 95.6%. The limits of detection for aflatoxin B 1, B 2, G 1, and G 2 were 0.10, 0.038, 0.11, 0.038 µg/kg, respectively. The method has a good specificity, high sensitivity, good accuracy, and can be used to determine the final positive detection. Aflatoxin were positively detected in 6 out of 15 batches of pheretima , which proved that the Pheretima were more susceptible to contamination by aflatoxins.Key words :Pheretima ;UPLC-MS/MS ;aflatoxin ;confirmation of positive results收稿日期:2024−01−10; 修订日期:2024−03−05.基金项目:吉林省中药材标准及中药饮片炮制规范(项目编号:JLPZGF-2020-052)作者简介:郭晶(1979−),女,副主任药师,研究方向为药品质量标准通信作者:李正刚(1982−),男,硕士,医药工程师,研究方向为中药质量标准,E-mail :*****************.第 30 卷第 2 期分析测试技术与仪器Volume 30 Number 22024年3月ANALYSIS AND TESTING TECHNOLOGY AND INSTRUMENTS Mar. 2024黄曲霉毒素(aflatoxins, AF)是一种毒性极强的剧毒物质,被各个国家的癌症研究机构列为Ⅰ类致癌物. 黄曲霉毒素主要是由黄曲霉、寄生曲霉产生的次生代谢产物,是一组化学结构类似的化合物[1-2],主要包括AFB1、AFB2、AFG1、AFG2,多存在于土壤、动植物、各种坚果中[3],在湿热环境下出现黄曲霉毒素污染的概率最高. 黄曲霉毒素的危害性在于对人及动物肝脏组织的慢性毒性作用,长期积累可导致肝癌甚至死亡[4-5]. 各国药典均对黄曲霉毒素在中药材或中草药中的限量作了规定,如《欧洲药典》规定AFB1、AFB2、AFG1、AFG2总量在中草药中的限量不得高于4 µg/kg,《美国药典》规定AFB1、AFB2、AFG1、AFG2总量在中草药中的限量不得高于20µg/kg,《中华人民共和国药典》规定其总量在中药材中的限量不得高于10 µg/kg[6].地龙药材标准收载在《中华人民共和国药典》2020版一部[7]. 采收时需要及时剖开腹部,除去内脏和泥沙. 由于地龙生长在土壤环境中,故其被AF污染的风险较大. 目前AF测定的方法主要有液相色谱-柱后碘衍生化法或光化学衍生化法-荧光检测器以及酶联免疫法,但以上方法均存在假阳性的误判可能性,当超出标准限值时均需要采用质谱检测器进行阳性确证[8]. 本研究采用超高效液相色谱-串联质谱法(UPLC-MS/MS)同时测定不同产地多批次地龙药材中AFB1、AFB2、AFG1、AFG2的含量,并对阳性结果进行确证,从而准确的判定检出情况,为地龙药材中AF污染情况提供参考.1 试验部分1.1 仪器和试剂BT125D型电子天平(北京赛多利斯仪器天平有限公司),TDL-5-A型离心机(上海安亭科学仪器厂),AB SCIEX QTRAP® 5500型超高效液相色谱-三重四极杆质谱(美国AB SCIEX公司). 超高压液相色谱柱(岛津科技有限公司),免疫亲和柱(青岛普瑞邦生物工程有限公司,规格:3 mL,批号:2J1J24-4).AF混合对照品溶液:AFB1、AFB2、AFG1、AFG2标示质量浓度分别为1.04、0.38、1.08、0.38µg/mL,批号:610001-202006,来源于中国食品药品检定研究院. 氯化钠和醋酸铵(国药集团化学试剂有限公司,分析纯),甲醇和乙腈(Flsher Scientific,色谱纯),纯化水为自制.本次收集到不同产地和批次的地龙药材共15批,基本信息如表1所列.表 1 地龙药材样品基本信息Table 1 Basic informations of Pheretima samples药材编号样品名称产地DL1广地龙海南文昌DL2广地龙广东肇庆DL3广地龙广东韶关DL4广地龙广东韶关DL5广地龙广西玉林DL6广地龙广西北海DL7沪地龙湖北襄阳DL8沪地龙河南濮阳DL9沪地龙河南安阳DL10沪地龙浙江嘉兴DL11沪地龙河南焦作DL12沪地龙浙江金华DL13沪地龙江西赣州DL14沪地龙江西九江DL15沪地龙江西宜春1.2 仪器工作条件1.2.1 色谱条件色谱柱:Shim-pack XR-ODS,3.0 mm×75 mm (1.8 µm);以10 mmol/L醋酸铵溶液为流动相A,甲醇为流动相B;柱温:25 ℃;流速:0.3 mL/min. 按表2中的程序进行梯度洗脱.表 2 梯度洗脱程序Table 2 Gradient elution procedure时间/min流动相A/%流动相B/%0~4.565~1535~854.5~615~085~1006~6.50~65100~356.5~1065351.2.2 质谱条件离子源:电喷雾离子源(ESI源);监测模式:正离子扫描下的多反应监测模式(MRM);喷雾压强:0.21 MPa;干燥气流速:8 L/min;干燥气温度:550 ℃;毛细管电压:5 500 V;三重四极杆离子对及相关电压参数设定如表3所列.第 2 期郭晶,等:超高效液相色谱-串联质谱法同时检测地龙药材中4种黄曲霉毒素含量及阳性结果确证1051.3 标准曲线绘制分别精密量取AF混合对照品溶液100、50、25µL于10 mL容量瓶中,用甲醇稀释至刻度,摇匀,即得标准曲线溶液1、2、3. 分别精密量取1 mL标准曲线溶液2、0.1 mL标准曲线溶液1于10 mL容量瓶中,用甲醇稀释至刻度,摇匀,即得标准曲线溶液4、5. 精密量取1 mL标准曲线溶液4于10 mL 容量瓶中,用甲醇稀释至刻度,摇匀,即得标准曲线溶液6.1.4 供试品溶液制备取供试品粉末约15 g(过四号筛网),精密称定,置于均质瓶中,加入氯化钠3 g、70%甲醇溶液75 mL,12 000 r/min高速搅拌2 min,4 500 r/min离心5 min,取上清液15.0 mL,置于50 mL量瓶中,用水稀释至刻度,摇匀,4 500 r/min离心10 min,取续滤液20.0 mL. 通过免疫亲合柱,流速3 mL/min,用20 mL水洗脱,洗脱液弃去,使空气进入免疫亲合柱,将水挤出,再用适量甲醇洗脱,收集洗脱液,置于2 mL量瓶中,加甲醇稀释至刻度,摇匀,用微孔滤膜(0.22 µm)滤过,取续滤液,即得.2 结果与讨论2.1 免疫亲和柱技术和质谱测定法的优势免疫亲和柱技术是利用抗原、抗体之间高度特异性结合对目标物进行净化富集的一种实验技术,预置在柱体内的特异性抗体选择性结合样本中的待测物,杂质不被结合流出柱外,柱上结合的目标物再被洗脱液洗脱,从而实现目标物的高效净化和浓缩[9].质谱法是使待测化合物产生气态离子,再按质荷比(m/z)将离子分离、检测的分析方法,检测限可达10−15~10−12 mol数量级. 相比较液相色谱法,测试样品需要的量较少,其检测灵敏度也大幅度提高,且其较好的专属性可以作为液相色谱检出情况的进一步确证,大大降低误判阳性检出的情况[10-13]. 2.2 线性范围和检出限分别精密吸取1.3项下系列混合对照品溶液5µL,注入液相色谱仪,测定峰面积,以进样质量浓度(ng/mL)为横坐标,峰面积为纵坐标,绘制标准曲线.结果如表4所列,4种黄曲霉毒素的线性关系良好(r>0.999 5).取不含AF的样品15 g,加入0.15 mL标准曲线溶液1,余下操作同1.4项下供试品溶液制备,1.2项下仪器工作条件测定,以信噪比(S/N)为3作为4种黄曲霉毒素的检出限(limit of detection,LOD),结果如表4所列,AFB1、AFB2、AFG1、AFG2的LOD分别为0.10、0.038、0.11、0.038 µg/kg,表明方法灵敏度较高.表 4 回归方程、线性范围和检出限Table 4 Regression equations, linear ranges and limits of detection组分名称回归方程r线性范围/(ng/mL)LOD/(µg/kg)S/N AFB1y=33 600x –1 3600.999 90.104~10.4000.10 4.5AFB2y=30 900x – 4 8800.999 80.038~3.8000.038 3.1AFG1y=26 150x – 6 3400.999 80.108~10.8000.11 4.2AFG2y=21 200x + 2 9200.999 80.038~3.8000.038 3.32.3 精密度考察取5 µL 1.3项下标准曲线溶液1,在1.2项下仪器条件及测定方法下分别连续进样6次,测定各组分的色谱峰面积. 测试结果:AFB1、AFB2、AFG1、表 3 质谱条件Table 3 Conditions of mass spectrometer序号组分名称母离子/(m/z)子离子/(m/z)碎裂电压/V碰撞能量/eV1AFB1313.1285.1*16034241.0207512AFB2315.1287.1*18937259.1200393AFG1329.1243.1*16338311.1180314AFG2331.1313.1*18535245.118842注:*定量离子对106分析测试技术与仪器第 30 卷AFG2色谱峰面积相对标准偏差(RSD)分别为1.3%、2.2%、1.8%和2.2%,表明仪器的精密度良好.2.4 稳定性试验取1.3项下标准曲线溶液1,分别于0、4、8、16、18、24 h 按1.2项下仪器条件进样5 µL,记录所测各组分峰面积. 测试结果:AFB1、AFB2、AFG1、AFG2色谱峰面积RSD分别为2.6%、2.2%、2.5%和2.3%,结果表明在24 h内测定结果稳定.2.5 重复性和回收率试验由于15批次地龙药材中仅部分检出AFB1、AFB2,故在加标回收试验中进行方法的重复性考察.称取不含AF的地龙药材(编号:DL1)粉末约15 g,各6份,分别精密加入AF混合对照品溶液75 µL,其余操作同2.1.2项下供试品溶液制备,按2.2项下条件分别测定各组分的色谱峰面积,结果如表5所列. 由表5可见,AFB1、AFB2、AFG1、AFG2的平均回收率分别为95.6%、93.4%、93.2%、91.2%,加标测定值的RSD分别为1.9%、2.0%、1.7%和2.6%,表明该方法的回收率满足要求,方法的重复性良好.2.6 样品测定取15批次地龙药材,按照1.4项下方法制备供试品溶液,1.2项下仪器条件进行测定,结果如表6所列,结果表明在6批地龙样品中检测出AFB1和AFB2,质谱总离子流图如图1所示.表 6 样品测定结果Table 6 Determination results of samples/(µg/kg)样品编号AFB1质量分数AFB2质量分数AFG1质量分数AFG2质量分数总质量分数DL1/////DL2/////DL3/////DL4 6.80.53//7.33 DL5/////DL6/////DL77.80.35//8.15 DL8 6.50.31// 6.81 DL9 4.30.24// 4.54 DL10/////DL11/////DL12/////DL13 3.10.43// 3.53 DL14 2.50.31// 2.81 DL15/////注:“/”:未检出2.7 阳性结果确证中药组成成分相较于西药组成成分复杂多样,三重四极杆质谱是以母离子及子离子组成的离子对进行检测,由于样品基质成分的复杂性,单个离子对出现干扰的情况在试验过程中偶有发生. 然而一个化合物在质谱检测器的离子源中被固定碰撞电压击碎产生的多个碎片离子之间具有相对固定的比例,故采用离子对峰面积的比值进行比较更具有专属性,UPLC-MS/MS法通常采用离子峰度比对结果进一步确证阳性检出,即:如果样品检出色谱峰的保留时间与对照品一致,并且在扣除背景后的表 5 方法的重复性和回收率试验结果Table 5 Experimental results of repeatability andrecovery of method添加质量分数加入质量/ng实测质量/ng回收率/%平均回收率/%RSD/%AFB1 (5 µg/kg)78.0074.2195.1495.6 1.9 78.0073.1193.7378.0075.5396.8378.0076.5298.1078.0072.9993.5878.0075.2396.45AFB2 (2 µg/kg)28.5026.1291.6593.4 2.0 28.5025.2390.7728.5026.7893.9628.5027.0194.7728.5027.3295.8628.5026.5593.16AFG1 (5 µg/kg)81.0077.4495.6093.2 1.7 81.0075.2692.9181.0075.3693.0481.0074.8292.3781.0076.3594.2681.0073.7891.09AFG2 (2 µg/kg)28.5025.1591.0591.2 2.6 28.5026.2292.0028.5025.4789.3728.5025.1188.1128.5027.0194.7728.5026.2892.21第 2 期郭晶,等:超高效液相色谱-串联质谱法同时检测地龙药材中4种黄曲霉毒素含量及阳性结果确证107质谱图中,所选择的监测离子对均出现,而且所选择的监测离子对峰面积比与对照品的监测离子对峰面积比一致,则可判定样品中存在该真菌毒素.经计算本试验检出的6批阳性样品的离子峰度比AFB 1分别为75.3%、75.2%、75.1%、75.3%、75.2%、75.1%,相对平均偏差均小于0.2%. AFB 2分别为85.0%、85.1%、85.1%、85.2%、85.3%、85.0%,相对平均偏差均小于0.2%. 均在允许偏差±20%内,确证样品阳性检出.3 结论由多批次样品检验情况可以初步得出,地龙药材中黄曲霉毒素的污染主要为黄曲霉毒素B 1和B 2.地龙药材在产地初加工过程中需去除泥沙,而泥沙为黄曲霉毒素污染的重要来源,如果泥沙去除不净、保存不当、遇湿热环境,则黄曲霉毒素含量容易超标[14-17]. 因此地龙药材的黄曲霉毒素监测检验非常必要[18-21]. 试验结果表明,UPLC-MS/MS 法操作简便、专属性好、灵敏度高、重复性好,能够对地龙药材的阳性结果作出准确判定,故将在中药材的黄曲霉毒素污染检测中发挥重要作用.参考文献:刘丽娜, 李海亮, 李耀磊, 等. 中药真菌毒素质量控制概况、限量标准制定及有关问题的思考[J ]. 中草药,2023,54(19):6197-6207. [LIU Lina, LI Hailiang, LI Yaolei, et al. Overview on quality control of mycotox-ins in traditional Chinese medicine, limit requirements and discussion on related issues [J ]. Chinese Tradition-al and Herbal Drugs ,2023,54 (19):6197-6207.][ 1 ]沈立, 汤燕, 陈铁柱, 等. 固相萃取液质联用测定川产道地药材黄精、麦冬中10种真菌毒素[J ]. 药物分析杂志,2023,43(8):1369-1380. [SHEN Li, TANG[ 2 ]Yan, CHEN Tiezhu, et al. Determination of 10 my-cotoxins in Polygonati Rhizoma and Ophiopogonis Radix as a genuine regional drug of Sichuan by solid-phase extraction coupled with LC-MS/MS [J ]. Chinese Journal of Pharmaceutical Analysis ,2023,43 (8):1369-1380.]徐晓艳, 王宇, 王梦瑶, 等. 中药材中真菌毒素的检测与脱毒研究进展[J ]. 中草药,2024,55(2):657-669.[XU Xiaoyan, WANG Yu, WANG Mengyao, et al.Research progress on detection and detoxification of mycotoxins in Chinese medicinal materials [J ].Chinese Traditional and Herbal Drugs ,2024,55 (2):657-669.][ 3 ]李正刚, 程焱, 王丹彧, 等. 地龙药材中黄曲霉毒素B 1、B 2、G 1、G 2的含量检测[J ]. 化学工程师,2023,37(8):34-37. [LI Zhenggang, CHENG Yan, WANG Danyu, et al. Detection of aflatoxins B 1、B 2、G 1、G 2 in Pheretima materials [J ]. Chemical Engineer ,2023,37(8):34-37.][ 4 ]莫紫梅. 黄曲霉毒素B 1降解产物及其安全性评价研究进展[J/OL ]. 中国油脂, 2023:1-12[2024-02-29].https:///10.19902/ki.zgyz.1003-7969.230329. [MO Zimei. Research progress on degrada-tion products of aflatoxin B 1 and its safety evaluation [J/OL ]. China Oils and Fats, 2023:1-12[2024-02-29]. https:///10.19902/ki.zgyz.1003-7969.230329.][ 5 ]孙艳杰, 李正刚, 赵磊, 等. 制貂肾中黄曲霉毒素的测定方法研究及暴露风险评估[J ]. 中国药物评价,2023,40(3):249-252. [SUN Yanjie, LI Zhenggang,ZHAO Lei, et al. Determination method of aflatoxin in processed mustela and risk assessment [J ]. Chinese Journal of Drug Evaluation ,2023,40 (3):249-252.][ 6 ]国家药典委员会. 中华人民共和国药典(一部)[S ].北京: 中国医药科技出版社, 2020: 127.[ 7 ]许晓辉, 李晨曦, 吴福祥, 等. QuEChERS-分散固相萃取-液质联用法快速测定地龙中黄曲霉毒素[J ].分析测试技术与仪器,2021,27(1):18-23. [XU[ 8 ]1×1042×1043×104(a)(b)4×1045×1046×1047×104t /minI n t e n s i t y /c p sI n t e n s i t y /c p st /min1×1042×1043×1044×1045×1046×104AFB 2AFB 1AFG 2AFB 2AFB 1AFG 1图1 样品测定图谱(a )对照品质谱总离子流图,(b )样品质谱总离子流图Fig. 1 Total ion flow diagrams of samples108分析测试技术与仪器第 30 卷Xiaohui, LI Chenxi, WU Fuxiang, et al. QuEChERS-dispersed solid phase extraction-ultra performance li-quid chromatography-tandem mass spectrometry for rapid determination of aflatoxin in pheretima [J ]. Ana-lysis and Testing Technology and Instruments ,2021,27 (1):18-23.]马彧, 李正刚, 程焱, 等. 超声萃取-免疫亲和柱净化-柱后光化学衍生高效液相色谱法同时测定蜂房药材中4种黄曲霉毒素[J ]. 化学分析计量,2023,32(2):20-23, 56. [MA Yu, LI Zhenggang, CHENG Yan, et al. Simultaneous determination of four aflatox-ins in Nidus Vespae by ultrasonic extraction-immun-oaffinity column purification-post column photochem-ical derivatization HPLC [J ]. Chemical Analysis and Meterage ,2023,32 (2):20-23, 56.][ 9 ]龚敏, 陈明亮, 金鹏, 等. QuEChERS 结合UPLC-MS/MS 测定水产品中4种黄曲霉毒素及其裂解规律研究[J ]. 热带农业科学,2023,43(10):35-40.[GONG Min, CHEN Mingliang, JIN Peng, et al. De-termination of four aflatoxins in aquatic product by QuEChERS combine UPLC-MS/MS method and study on fragmentation pathway [J ]. Chinese Journal of Tropical Agriculture ,2023,43 (10):35-40.][ 10 ]袁正宁, 李梁子涵, 王艳敏, 等. 黄曲霉毒素对肝脏和脾脏的毒理作用研究[J ]. 中国畜禽种业,2023,19(4):91-95. [YUAN Zhengning, LI Liangzihan,WANG Yanmin, et al. Toxicological effects of aflatoxin on liver and spleen [J ]. The Chinese Live-stock and Poultry Breeding ,2023,19 (4):91-95.][ 11 ]何洁, 余婷婷, 梁松, 等. 高通量高效快速净化方法结合UPLC-MS/MS 测定粮食中黄曲霉毒素[J/OL ]. 中国测试, 2023:1-12 [2024-02-29]. https:///kcms/detail/51.1714.TB.20230421.1514.008.html.[HE Jie, YU Tingting, LIANG Song, et al. Determina-tion of aflatoxins in grains using the high-throughput high efficient flow-through clean-up method and ultra-high performance liquid chromatography tandem mass spectrometry [J/OL ]. China Measurement & Test,2023:1-12 [2024-02-29]. https:///kcms/de-tail/51.1714.TB.20230421.1514.008.html.][ 12 ]李正刚, 谢秋红, 邵大志, 等. 高效液相色谱-荧光检测法同时测定人参归脾丸中4种黄曲霉毒素[J ]. 中国卫生工程学, 2022, 21(5):714-716. [LI Zhenggang,XIE Qiuhong, SHAO Dazhi, et al. Simultaneous de-termination of content of four Aflatoxins Ginseng spleen-invigorating bolus by HPLC-FLD [J ]. Chinese Journal of Public Health Engineering, 2022, 21(5):714-716.][ 13 ]陈莉. 超高效液相色谱串联三重四极杆质谱法同时测定舒眠胶囊(片)中4种黄曲霉毒素含量[J ]. 中国药业,2022,31(22):77-80. [CHEN Li. Simultaneous[ 14 ]determination of four aflatoxins in Shumian capsules(tablets) by UPLC-QQQ/MS [J ]. China Phar-maceuticals ,2022,31 (22):77-80.]夏仕青, 李晓慧, 吴桃丽. 超高效液相色谱-串联质谱法测定辣椒粉中4种黄曲霉毒素的含量[J ]. 微量元素与健康研究,2023,40(1):57-60. [XIA Shiqing, LI Xiaohui, WU Taoli. Determination of four aflatoxins in Chili Powder by UPLC-MS/MS [J ]. Studies of Trace Elements and Health ,2023,40 (1):57-60.][ 15 ]淦露. 黄曲霉毒素检测技术研究进展[J ]. 现代食品,2022,28(15):114-117. [GAN Lu. Research progress of aflatoxin detection technology [J ]. Modern Food ,2022,28 (15):114-117.][ 16 ]杨昊, 公丕学, 王骏, 等. 基于石墨烯净化的超高效液相色谱串联质谱快速测定乳制品中黄曲霉毒素[J ].中国食品卫生杂志,2023,35(3):396-402. [YANG Hao, GONG Pixue, WANG Jun, et al. Fast determina-tion of aflatoxin in dairy products by ultra-high per-formance liquid chromatography-tandem mass spec-trometry based on purification of graphene [J ].Chinese Journal of Food Hygiene ,2023,35 (3):396-402.][ 17 ]赵飞. QuEChERS 结合超高效液相色谱-三重四极杆质谱法测定坚果中黄曲霉毒素[J ]. 当代化工,2022,51(3):752-756. [ZHAO Fei. Determination of aflatoxins in nuts by QuEChERS coupled with ultra-li-quid chromatography-mass spectrometry [J ]. Contem-porary Chemical Industry ,2022,51 (3):752-756.][ 18 ]谭丽盈. 超高效液相色谱-串联质谱法同时测定醋延胡索药材中4种黄曲霉毒素[J ]. 化学分析计量,2021,30(10):27-32. [TAN Liying. Simultaneous de-termination of four kinds of aflatoxins in vinegar cory-dalis by UPLC-MS/MS [J ]. Chemical Analysis and Meterage ,2021,30 (10):27-32.][ 19 ]周颖, 祝清岚, 马临科, 等. 免疫亲和柱净化-柱后光化学衍生-高效液相色谱法检测蜚蠊中的黄曲霉毒素[J ]. 中国药物评价,2020,37(5):358-361.[ZHOU Ying, ZHU Qinglan, MA Linke, et al. De-termination of aflatoxins in periplaneta Americana by immunoaffinity column and high performance liquid chromatography coupled with post-column photo-chemical derivatization [J ]. Chinese Journal of Drug Evaluation ,2020,37 (5):358-361.][ 20 ]刘宁, 王萌萌, 金红宇, 等. 高效液相色谱-柱后光化学衍生法测定参苓白术散中黄曲霉毒素G 2、G 1、B 2、B 1[J ]. 中国药事,2012,26(5):442-445. [LIU Ning,WANG Mengmeng, JIN Hongyu, et al. Determination of aflatoxin G 2, G 1, B 2, B 1 in Shenling Baizhu Powder by HPLC with post column photochemical derivatiza-tion [J ]. Chinese Pharmaceutical Affairs ,2012,26 (5):442-445.][ 21 ]第 2 期郭晶,等:超高效液相色谱-串联质谱法同时检测地龙药材中4种黄曲霉毒素含量及阳性结果确证109。
黄曲霉的检测方法

黄曲霉的检测方法黄曲霉是一种常见的真菌,它能够在多种环境中生存并繁殖,包括食物、土壤和空气中。
黄曲霉产生的黄曲霉毒素对人体健康有一定的威胁,因此对黄曲霉的检测非常重要。
下面将介绍几种常用的黄曲霉检测方法。
1. 气相色谱法:气相色谱法是一种常用的检测黄曲霉毒素的方法。
该方法将样品中的黄曲霉毒素提取出来,然后使用气相色谱仪进行分析。
由于不同的黄曲霉毒素具有不同的化学性质,所以可以通过检测毒素的特定化合物来确定样品中是否存在黄曲霉毒素。
2. 高效液相色谱法:高效液相色谱法也是一种常用的检测黄曲霉毒素的方法。
该方法将样品中的黄曲霉毒素提取出来,然后使用高效液相色谱仪进行分析。
与气相色谱法相比,高效液相色谱法对样品的处理过程相对简单,分离效果较好。
3. 免疫学方法:免疫学方法是一种常用的检测黄曲霉的方法。
该方法使用特异性抗体与样品中的黄曲霉结合,然后通过标记物的信号来检测黄曲霉的存在。
常见的免疫学方法包括酶联免疫吸附试验(ELISA)和免疫荧光法。
免疫学方法具有操作简单、灵敏度高的特点,可以用于大规模的样品检测。
4. PCR法:PCR(聚合酶链式反应)是一种常用的检测黄曲霉的方法。
该方法利用黄曲霉的DNA进行扩增,并通过特定的引物和探针进行检测。
PCR法具有高灵敏度、高特异性和高快速性的特点,可以快速检测出样品中的黄曲霉。
5. 传统培养法:传统培养法是一种直接检测黄曲霉的方法。
该方法将样品培养在含有特定营养物质的培养基上,然后通过观察菌落形态、颜色和特点来确定是否存在黄曲霉。
尽管传统培养法操作相对简单,但其结果需要较长时间才能得到。
除了以上提到的方法,还有其他一些新兴的检测黄曲霉的方法,如纳米技术、蛋白质质谱法等。
这些方法在样品处理、快速性、灵敏度和特异性等方面都有所改进和突破,可以更好地用于黄曲霉的检测。
总之,对于黄曲霉的检测,可以选择适合的方法进行,根据需要和实际情况选择不同的方法。
不同的方法有其优缺点,需要根据实际应用需求进行选择。
光化学衍生器-黄曲霉毒素检测-柱后衍生15版药典专用3页

普瑞邦PriboFast® KRC 光化学柱后衍生反应器PriboFast®KRC光化学柱后衍生反应器广泛应用于液相色谱检测分析, 使用时置于色谱柱和检测器之间,进行柱后连续光化学衍生反应提高荧光、紫外、电化学检测和化学发光检测器的灵敏度和响应的选择性。
采取液相色谱-荧光法检测黄曲霉毒素时,使用光化学衍生器进行柱后衍生,不需要任何化学试剂, 能有效增强黄曲霉毒素B1和G1的荧光强度,黄曲霉毒素B1和G1灵敏度能够达到0.1ppb以上;1、运行环境:温度5℃~40℃;相对湿度≤85%;适用电压220V(±10%),50Hz(±2%)2、技术参数2.1与HPLC-荧光检测器配套使用在线对黄曲霉毒素B1、G1进行衍生,不需要任何化学试剂2.2黄曲霉毒素B1、B2、G1、G2的检测限低于0.1ppb.2.3符合15版中国药典,AOAC 2005.08, AOCS Aa 11-05和欧盟药典 2.8.18标准分析方法。
3、配置要求3.1 KRC柱后衍生光化学反应池(还包括10米透明质化线圈,254 纳米灯管,抛光反应池架,电源控制器)1套3.2塑料漏斗(10 个/包)1包3.3玻璃微纤维滤纸(1.5um,100张/盒)1盒3.4一次性测试管(250个/包)1包3.4 Peek 两通(客户自备)4、技术资料3.1提供仪器设备的中文安装操作说明书。
3.2提供仪器设备的英文说明书。
3.3 仪器设备须经中国政府批准在中国境内销售,适合中国国家标准,或通用国际标准。
3.4 仪器设备的保修期为一年。
在保修期内,供货厂商在接到用户要求对所购仪器设备进行维修时,应在24小时之内给予答复以及后续维修服务。
5、技术特点:1. 在线对黄曲霉毒素B1、G1进行衍生,重现性好;不需要任何化学衍生试剂,减少了液相系统的清洗工作,延长了其使用寿命。
2.黄曲霉毒素B1、B2、G1、G2的检测限在0.1ppb以下。
高效液相色谱碘试剂柱后衍生测定粮油样品中黄曲霉毒素B_(1)的条件优化

160!"与油%2021346食品安全与检测效液试后定样品中黄曲B1的条件优化刘倩,马饪(上海科茂粮油食J质量检测有限公司,上海200333)摘要:优化了高效液相色谱测定粮油样J中黄曲霉毒素B1含量的检测方法&粮油样J中的黄曲霉毒素B1用甲醇:水体积比70德0的混合溶液提取,提取液经免疫亲和柱净化和富集,净化液稀释和过滤后,以甲醇:水体积比50:50为流动相,等梯度洗脱,通过高效液相色谱-碘试剂柱后衍生-荧光检测器进行测定,外标法定量。
结果表明:黄曲霉毒素B[在质量浓度0.03~5ny/mL范围内与响应峰面积呈现良好的线性关系,线性回归方程为==2.47x106X+1.39x105%相关系数r=0.9994、加标回收率为93.0%-101.0%、相对标准偏差(relative standard deviation,RSD)为0.41%-3.15%、方法检出限和定量限分别为0.018"g/ky和0.06"g/ky。
该方法相对于GB5009.22—2016第三法处理更简化,且未降低灵敏度,好,靠,为检测机构日常粮油样晶中黄曲霉毒素B1的检测方法&关键词:高液相色谱;粮油样J;黄曲霉毒素B1Optimization of conditions for determination of afatoxin B1 in grain and ot samples by high performancc linuin chromatography wit iodine reagent derivatization after columnLIU Qian,MA Yu(Shanghai Kemao Cereals,Oils and Foodstuffs Quality Testing Co.,Lid,Shanghai200333,China) Abstract:A method for Ox determination of aUatoxin B[in grain and oil samples by high performance liquid chromatography was optimized.The aUatoxin B[in grain and oil samples was extracted with mixed solution of methanol:water70:30by volume.The extracted solution was puffied and enfched by immu-noa e onotycoiumn.Thepueoeoed6oiutoon wa6doiuted and eoite eed.The mob oie pha6e wa6methano i:wate e 50:50by volume.The content of aUatoxin B[was determined by HPLC with iodine reagent post-column derivatization and quantified by extemal standard method.The results showed that the—was a good linear relationship between aUatoxin B[concentration and response peak area in the range of0.03〜5ng/mL.The linear mg—ssion equation was as follows:==2.47x106E+1.39x105,the cot—1/Wn coefficient r=0.9994,We standard recove—rate was93.0%〜101.0%,the relative standard deviation(RSD) was0.41%〜3.15%,The limits of detection and limits of quantification we—0.018"g/kg and0.06"g/kg,pared with the third method of GB5009.22—2016,the method was sim-pie,had good eepeataboioty,accueateand eeioabie,and couid beused asthedetectoon method oeaeiatoton B1on daoiygeaon and ooisampiesoedetectoon onstotutoons.Key words:high performance liquid ch—mUoymphy;grain and oil samples;aUatoxin B[中图分类号:TS207.5文献标志码:A文章编号:1008-9578(2021)06-0160-03黄曲霉毒素是一类由黄曲霉和寄生曲霉等真菌产生的次级代谢产物,主要包括黄曲霉毒素'1%收稿日期:2020-10-23作者简介:刘倩(1992—),女,本科,学士,研究方向为食J检测。
高效液相色谱法检测农产品中黄曲霉毒素B1的含量

分析检测高效液相色谱法检测农产品中黄曲霉毒素B1的含量韩 宇(四川省甘孜藏族自治州食品药品检验所,四川康定 626000)摘 要:目的:建立高效液相色谱法联合免疫磁固相萃取法测定农产品食品中黄曲霉毒素B1(Aflatoxin B1,AFB1)含量的分析方法。
方法:采用70%乙腈溶液提取花生、玉米、大豆、小麦、豌豆和绿豆样品中的AFB1,然后利用免疫磁珠净化、萃取和富集提取液中的AFB1,采用高效液相色谱法进行定量分析。
结果:方法的检出限为0.03~0.92 μg·kg-1,回收率为79.52%~97.53%。
利用该方法对市场上购买的20份花生、玉米、大豆、小麦、豌豆、绿豆样品中的AFB1进行检测,除了玉米和绿豆中未检测出AFB1外,其余实验样品中均检测出一定含量的AFB1。
结论:该方法简便、快速、准确,适用于复杂样品中黄曲霉毒素B1的测定。
关键词:高效液相色谱法;免疫磁固相萃取;黄曲霉毒素B1Determination of Aspergillus Flavus B1 in Agricultural Products by High-Performance Liquid ChromatographyHAN Yu(Ganzi Tibetan Autonomous Prefecture Institute for Food and Drug Control, Kangding 626000, China)Abstract: Objective: To establish a method for the determination of Aflatoxin B1 (AFB1) in agricultural products by high performance liquid chromatography combined with immunomagnetic solid phase extraction. Method: AFB1 was extracted from samples of peanuts, corn, soybeans, wheat, peas, and mung beans using a 70% acetonitrile solution, and then AFB1 was purified, extracted and enriched by immunomagnetic beads, and quantitative analysis was performed by HPLC. Result: The limits of detection were 0.03~0.92 μg·kg-1, and the recoveries were 79.52%~97.53%. AFB1 in 20 samples of peanut, corn, soybean, wheat, pea and mung bean purchased from the market was detected by this method. AFB1 content was detected in all the other samples except corn and mung bean. Conclusion: The method is simple, rapid, accurate and suitable for the determination of aflatoxin B1 in complex samples.Keywords: high-performance liquid chromatography; immunomagnetic solid-phase extraction; aspergillus flavus B1黄曲霉毒素是一种由黄曲霉菌产生的有毒代谢产物,在自然界中分布广泛,在粮食和饲料等农产品中广泛存在。
柱后衍生应用

38 Lysine
赖氨酸
39 Histidine
组胺酸
40 3-Methyl-histidine
3-甲基组氨酸
41 1-Methyl-histidine
1-甲基组氨酸
Sarcosine 12
肌氨酸
-Aminoadipic acid 13
α-氨基己二酸
Proline
14 脯氨酸
Glycine 15
仪器: z 二元液相 z 荧光检测器 z 钾盐阳离子交换柱,4.0 x 150 mm z 钾盐阳离子交换保护柱 3.0 x 20 mm z SPE 小柱,阳离子交换
衍生剂: z 钾盐洗脱液 z 钾盐再生试剂 z 次氯酸盐 z 邻苯二甲醛稀释液(o-Phthalaldehyde) z 巯基乙醇 (Thiofluor) z 邻苯二甲醛 z 5%次氯酸钠溶液 z 二氯甲烷 z 酸性调节剂
λex: 365 nm λem: 430 nm
黄曲霉毒素 B1,B2,G1,G2,M1,和 M2
荧光检测和柱后衍生法测定氨基甲酸酯类(Carbamate)农药多残留
柱后衍生条件: 衍生剂 1: 0.05mol/L NaOH 水解衍生剂 衍生剂 2: 100 mg 邻苯二甲醛 (O-Phthaladehyde,OPA), 巯基乙醇 (Thiofluor) 反应器 1(水解温度): 100 °C, 0.5 mL 反应器 2(衍生温度): 室温,0.1ml 衍生剂流速: 0.3ml/min
0 0 0 0 0
Li375 % 0 0 0 0
100 100 80 80
0
RG003 % 0 0 0 0 0 0 20 20 0
λem: 465nm
步骤
0 1 2 3
GPC SEC标准品产品指南5990-7996CHCN

30
PL2010-0300
30
PL2010-0401
30
PL2010-0400
90
PL2080-0202
90
PL2080-0203
90
PL2070-0202
90
PL2070-0203
90
PL2020-0202
90
PL2020-0203
90
PL2010-0202
90
PL2010-0203
90
PL2010-0302
9. 915,000 10. 60,450 11. 3,370 12. 162
图 1. EasiVial PS-H
ԍା้क़/ 图 2. 由 EasiVials 获得的聚苯乙烯校准曲线
5
EasiVial
产品说明 EasiVial 颜色 红色
黄色
绿色
EasiVial PS-H EasiVial PS-M
聚苯乙烯 PS-2 部件号 PL2010-0601 (1 包) 部件号 PL2010-0605 (5 包)
刮片 A,各种聚合物的标称分子量 (g/mol)
3,000
1,300
30,000
5,000
150,000
20,000
850,000
100,000
7,500,000
400,000
刮片 B,各种聚合物的标称分子量 (g/mol)
标称分子量 (g/mol)
1,300
780
20,000
6,000
500,000
50,000
6,000,000
400,000
580
370
8,500
2,500
超高效液相色谱法检测食品黄曲霉毒素

超高效液相色谱法检测食品黄曲霉毒素发表时间:2012-11-05T16:24:47.420Z 来源:《中外健康文摘》2012年第24期供稿作者:全德甫王晖孙华杰[导读] 黄曲霉毒素(Aflatoxin)是常见霉菌黄曲霉(AspergiUusflavus)和寄生曲(A.parasiticus)中产毒菌株的代谢产物。
全德甫王晖孙华杰(深圳市宝安区观澜预防保健所广东深圳 518110)【中图分类号】R445【文献标识码】A【文章编号】1672-5085(2012)24-0021-03 黄曲霉毒素(Aflatoxin)是常见霉菌黄曲霉(AspergiUusflavus)和寄生曲(A.parasiticus)中产毒菌株的代谢产物。
主要毒素AFB1、AFB2、AFG1、AFG2,其中AFB1是毒性和危害最大的一种,AFB2和AFG2是AFB1和AFG1的双羟基衍生物[1]。
黄曲霉毒素是目前所知致癌性最强的化合物,广泛存在于花生、花生油、大米、玉米、糕点等粮油食品和动物饲料中,严重影响人们的健康,甚至威胁着人们的生命安全[2]。
对黄曲霉毒素的检测方法主要有薄层色谱法(TLC)、高效液相色谱法(HPLC)、酶联免疫吸附测定法(ELISA)、二维薄层色谱法等。
近年来,由于超高压液相色谱技术的引进,色谱分析效率、分析时间、灵敏度得到了比较大的提高。
本文建立用超高效液相色谱法(UPLC)同时测定食品中AFB1、AFB2、AFG1、AFG2分析时间短、灵敏度高,特异性强,结果满意。
1 材料和方法1.1仪器和试剂超高效液相色谱系统:WATERS ACQUITY UPLC型超高效液相色谱仪;色谱柱:WATERS ACQUITY UPLC BEH C18(直径1.7μm,宽×长为2.1mm×50mm);Mycosep?228黄曲霉毒素多功能净化柱(美国Romer Labs);LV型自动蒸发浓缩仪;烘干箱;电动振荡器;漩涡混合器;电子天平。
柱后衍生-高效液相色谱法测定青稞黄酒中的18种氨基酸

柱后衍生-高效液相色谱法测定青稞黄酒中的18种氨基酸诸葛庆;李博斌;周牡艳;葛乐勇【摘要】采用茚三酮柱后衍生,高效液相色谱法测定了青稞黄酒中的18种氨基酸.结果表明,18种氨基酸回收率为95.1 %~102.5 %,相关系数0.9962~0.9999,检出限0.25~4.00 μmol/L.在所分析的4种青稞黄酒样品中,氨基酸含量为456.10~760.18 mg/L.青稞黄酒中的呈味氨基酸以甜味氨基酸和涩味氨基酸为主,占76 %以上.【期刊名称】《酿酒科技》【年(卷),期】2010(000)006【总页数】3页(P94-96)【关键词】分析检测;柱后衍生;高效液相色谱法;氨基酸;青稞黄酒【作者】诸葛庆;李博斌;周牡艳;葛乐勇【作者单位】国家黄酒产品质量监督检验中心,浙江,绍兴,312071;国家黄酒产品质量监督检验中心,浙江,绍兴,312071;国家黄酒产品质量监督检验中心,浙江,绍兴,312071;国家黄酒产品质量监督检验中心,浙江,绍兴,312071【正文语种】中文【中图分类】TS261.7;TS262.4;O657.72青稞也叫元麦、淮麦、米麦、米大麦,是大麦的一种特殊类型,因其内外颖壳分离,籽粒裸露,故称裸大麦,青稞主要分布在我国西藏、青海等地高海拔高寒地区[1-2]。
青稞富含蛋白质、碳水化合物,并含有较丰富的矿物质及维生素,是一种很好的酿酒原料,青稞黄酒是以青稞为原料,采用黄酒酿造工艺酿制而成的发酵酒,其酒度低,营养价值丰富,富含多种氨基酸[3-4]。
氨基酸不仅是青稞黄酒的主要营养成分之一,也是酒的风味物质或风味物质的前驱物质,对酒的风味有着重要的贡献[5],因此,准确测定青稞黄酒中氨基酸的含量对研究黄酒的营养价值和风味及对酒质的控制都具有极其重要的意义。
常用的氨基酸分析方法有离子交换色谱法[6]、氨基酸自动分析仪法[7]、高效液相色谱法[8]、液质联用法[9]。
考虑到成本及一机多用,本研究采用柱后衍生-高效液相色谱法测定青稞黄酒中的氨基酸,其原理是氨基酸经钠离子交换柱分离后与茚三酮反应,在570 nm进行测定。
食品中黄曲霉毒素B1、B2、G1、G2的测定

食品中黄曲霉毒素B1、B2、G1、G2的测定本标准参考GB/T 5009.23-2006《食品中黄曲霉毒素B1、B2、G1、G2的测定》制定,适用于三河汇福生科技有限公司化验室测定原料中黄曲霉毒素B1、B2、G1、G2的含量。
高效液相色谱法1 原理试样经乙腈-水提取,提取液过滤后,经装有反相离子交换吸附剂的多功能净化柱,去除脂肪、蛋白质、色素及碳水化合物等干扰物质。
净化液中的黄曲霉毒素以三氟乙酸衍生,用带有荧光检测器的液相色谱系统分析,外标法定量。
2 试剂和材料2.1 黄曲霉毒素B1、B2、G1、G2标准品,纯度>99%。
2.2 乙腈,色谱纯、分析纯。
2.3 三氟乙酸,分析纯。
2.4 正己烷,分析纯。
2.5 水,电导率(25℃)≤0.01mS/m。
2.6 乙腈-水(84+16)提取液:量取乙腈(分析纯)840mL,加水160mL,混匀。
2.7 水-乙腈(85+15)溶液:量取乙腈(色谱纯)150mL,加三蒸水850mL,混匀。
2.8 标准储备液:分别准确称取黄曲霉毒素B1、B2、G1、G2 0.2000g、0.0500g、0.2000g、0.0500g(精确至0.001g),置10mL容量瓶中,加乙腈(分析纯)溶解,并稀释至刻度。
此溶液密封后避光-30℃保存,两年有效。
2.9 标准工作液:准确移取标准储备液1.00μL,至10mL容量瓶中,加乙腈(分析纯)稀释至刻度。
此溶液密封后避光4℃保存,三个月有效。
2.10 标准系列溶液:准确移取标准工作液适量,至10mL容量瓶中,加乙腈(分析纯)稀释至刻度(含黄曲霉毒素B1、G1的浓度为0.00μg/L、0.5000μg/L、1.000μg/L、2.000μg/L、5.000μg/L、10.00μg/L、25.00μg/L、50.00μg/L、100.0μg/L;黄曲霉毒素B2、G2的浓度为0.00μg/L、0.1250μg/L、0.2500μg/L、0.5000μg/L、1.250μg/L、2.500μg/L、6.250μg/L、12.50μg/L、25.00μg/L的系列标准溶液),注意避光。
总黄曲霉毒素免疫亲和柱

总黄曲霉毒素免疫亲和柱总黄曲霉毒素(Aflatoxin B1,AFB1)是一种由黄曲霉菌(Aspergillus flavus)和黄曲霉素菌(Aspergillus parasiticus)产生的一种强烈致癌的化合物。
该化合物在人类和动物体内会引起多种癌症,如肝癌、食管癌、胃癌等。
因此,检测和去除环境和食品中的总黄曲霉毒素对于保障人类健康至关重要。
为了检测和去除总黄曲霉毒素,研究人员开发了多种方法,其中之一就是使用总黄曲霉毒素免疫亲和柱。
这种免疫亲和柱是通过利用特异性抗体对总黄曲霉毒素进行捕捉,从而实现检测和去除的目的。
总黄曲霉毒素免疫亲和柱的制备过程通常包括以下步骤:首先,需要获得针对总黄曲霉毒素的特异性抗体。
这可以通过免疫小鼠(如小鼠、兔子等)或体外合成的方法获得。
然后,将抗体与固相材料(如琼脂糖、硅胶等)结合,形成免疫亲和柱。
接下来,将待测样品加入免疫亲和柱中,允许总黄曲霉毒素与抗体结合。
最后,用适当的缓冲液洗脱并收集样品,得到含有总黄曲霉毒素的纯净溶液。
总黄曲霉毒素免疫亲和柱的检测原理是基于特异性抗体与总黄曲霉毒素的亲和作用。
一旦待测样品中存在总黄曲霉毒素,它们会与免疫亲和柱中的抗体结合。
通过洗脱的步骤,可以将结合的总黄曲霉毒素从样品中分离出来,从而完成检测过程。
除了检测相关,总黄曲霉毒素免疫亲和柱还可以用于去除总黄曲霉毒素。
已经结合总黄曲霉毒素的免疫亲和柱可以用于净化食品和饲料,去除其中的毒素。
这是因为抗体与毒素之间的结合力较强,可以有效地捕捉和去除总黄曲霉毒素。
总的来说,总黄曲霉毒素免疫亲和柱是一种有效的工具,可以用于检测和去除环境和食品中的总黄曲霉毒素。
通过结合特异性抗体和固相材料,免疫亲和柱可以捕捉和去除总黄曲霉毒素。
然而,需要注意的是,免疫亲和柱的制备过程较为繁琐且耗时,因此需要进行全面的实验准备和操作。
对于总黄曲霉毒素的免疫亲和柱的研究和应用仍在不断发展中。
随着技术的不断进步,相信将有更多的改进和创新,提高总黄曲霉毒素的检测和去除效果,进一步保障人类的健康安全。
食品中黄曲霉毒素的测定

食品中黄曲霉毒素的测定
食品中黄曲霉毒素的测定方法主要有以下几种:
1. 同位素稀释液相色谱-串联质谱法(ID-LC-MS/MS法):该方法是目前测定食品中黄曲霉毒素的主要方法之一,具有灵敏度高、特异性强、稳定性好等优点。
该方法使用同位素稀释液对样品进行稀释,然后通过液相色谱-串联质谱法进行分离和检测。
2. 高效液相色谱-柱前衍生法(HPLC-FLD法):该方法是一种传统的测定方法,具有操作简便、成本低等优点。
该方法使用高效液相色谱进行分离,然后通过柱前衍生法进行检测。
3. 气相色谱-质谱法(GC-MS法):该方法也是一种常用的测定方法,具有灵敏度高、准确性高等优点。
该方法使用气相色谱进行分离,然后通过质谱法进行检测。
4. 酶联免疫吸附试验(ELISA)法:该方法是一种快速、简便、经济的测定方法,具有灵敏度高、特异性强、操作简单等优点。
该方法使用特异性抗体进行检测。
以上是常见的几种食品中黄曲霉毒素的测定方法,具体选择哪种方法需要根据实际情况进行考虑。
黄曲霉毒素检测法

黄曲霉毒素(《中国药典2015版第四部》通则2351) 第一法本法系用高效液相色谱法(通则0512)测定药材、饮片及制剂中的黄曲霉毒素(黄曲霉毒素B 1、黄曲霉毒素B 2、黄曲霉毒素G 1、黄曲霉毒素G 2总量计),除另有规定外,按下列方法测定。
仪器与设备:反相色谱柱、高效液相色谱仪、进样针、容量瓶、电子天平、离心机、移液枪、微孔滤膜(0.45µm)、二号筛、均质瓶。
试剂:十八烷基硅烷键合硅胶、甲醇、乙腈、水、碘、黄曲霉毒素混合对照品(黄曲霉毒素B 1、黄曲霉毒素B 2、黄曲霉毒素G 1、黄曲霉毒素G 2)溶液、氯化钠。
色谱条件与系统适用性试验:以十八烷基硅烷键合硅胶为填充剂;以甲醇-乙腈-水(40:18:42)为流动相;采用柱后衍生法检测,①碘衍生法:衍生溶液为0.05%的碘溶液(取碘0.5g ,加入甲醇100ml 使溶解,用水稀释至1000ml 制成),衍生化泵流速每分钟0.3ml ,衍生化温度70℃:②光化学衍生法:光化学衍生器(254nm);以荧光检测器检测,激发波长λex=360nm(或365nm),发射波长λex=450nm 。
两个相邻色谱峰的分离度应大于1.5。
混合对照品溶液的制备精密量取黄曲霉毒素混合对照品溶液(黄曲霉毒素B 1、黄曲霉毒素B 2、黄曲霉毒素G 1、黄曲霉毒素G 2标示浓度分别为1.0µg/m l 、0.3µg/m l 、1.0µg/m l 、0.3µg/m l )0.5ml ,置10ml 量瓶中,用甲醇稀释至刻度,作为贮备溶液。
精密量取贮备溶液lml ,置25ml 量瓶中,用甲醇稀释至刻度,即得。
供试品溶液的制备:取供试品粉末约5g(过二号筛),精密称定,置于均质瓶中,加人氯化钠3g ,精密加入70%甲醇溶液75ml ,高速搅拌1分钟(搅拌速度大于11000转/分钟),离心5分钟(离心速度2500转/分钟>,精密量取上清液15ml ,置50ml 量瓶中,用水稀释至刻度,摇匀,用微孔滤膜(0.45µm)滤过,量取续滤液20.0ml ,通过免疫亲合柱,流速每分钟3ml ,用水20ml 洗脱,洗脱液弃去,使空气进入柱子,将水挤出柱子,再用适量甲醇洗脱,收集洗脱液,置2ml 量瓶中,并用甲醇稀释至刻度,摇匀,即得。
黄曲霉毒素检测方法介绍

黄曲霉毒素检测方法介绍黄曲霉毒素(AFT)是一类化学结构类似的化合物,均为二氢呋喃香豆素的衍生物。
黄曲霉毒素是主要由黄曲霉(aspergillus flavus) 寄生曲霉(a.parasiticus)产生的次生代谢产物,在湿热地区食品和饲料中出现黄曲霉毒素的机率最高。
B1是最危险的致癌物,经常在玉米,花生,棉花种子,一些干果中常能检测到。
它们在紫外线照射下能产生荧光,根据荧光颜色不同,将其分为B族和G族两大类及其衍生物。
AFT目前已发现20余种。
AFT主要污染粮油食品、动植物食品等;如花生、玉米,大米、小麦、豆类、坚果类、肉类、乳及乳制品、水产品等均有黄曲霉毒素污染。
其中以花生和玉米污染最严重。
家庭自制发酵食品也能检出黄曲霉毒素,尤其是高温高湿地区的粮油及制品种捡出率更高。
主要的几种检验检疫方法:1,薄层层析法薄层层析(Thin-Layer Chromatography,TLC)是在黄曲霉毒素研究方面应用最广的分离技术.自1990年,它被列为AOAC(Association of Official Agricultural Chemists)标准方法,该方法同时具有定性和定量分析黄曲霉毒素的功能.2,液相色谱法液相色谱(LiquidChromatography,LC)与薄层层析在许多方面具有相似性,二者互相补充.通常用TLC进行前期的条件设定,选择适宜的分离条件后,再用LC进行黄曲霉毒素的定量测定.3,免疫化学分析方法利用具有高度专一性的单克隆抗体或多克隆抗体设计的黄曲霉毒素的免疫分析方法,也是最常用的黄曲霉毒素检测方法.这类方法通常包括放射免疫分析方法(Radioimmunoassay,RIA),酶联免疫法(Enzyme-linked of Immunosorbent Assay,ELISA)和免疫层析法(Immunoaflinity Column Assay,ICA).它们均可以对黄曲霉毒素进行定量测定.(1) 免疫亲和柱-荧光分光光度法和免疫亲和术-HPLC法免疫亲和柱法和酶联免疫吸附法虽然都可达到速简便效果,但酶联免疫吸附法仅能检测单一毒素(如黄曲霉毒素B1)含量,而且易出现假阳性结果,难以控制.免疫亲和柱法(包括荧光光度法和HPLC法)却能达到既定量准确又快速简便的要求.免疫亲和柱的使用可以避免传统TLC和HPLC的缺点,同时免疫亲和柱与TLC和HPLC法结合可以大大提高工作效率,提高灵敏度和准确度.黄曲霉毒素免疫亲和柱-荧光光度计法是以单克隆免疫亲和柱为分离手段,用荧光计,紫外灯作为检测工具的快速分析方法.它克服了TLC和HPLC法在操作过程中使用剧毒的真菌毒素作为标定标准物和在样品预处理过程中使用多种有毒,异味的有机溶剂,毒害操作人员和污染环境的缺点.同时黄曲霉毒素免疫亲和柱-荧光光度计法分析速度快,一个样品只需10-15min,比传统方法快几个小时甚至几天时间;仪器设备轻便容易携带,自动化程度高,操作简单,直接读出测试结果,可以在小型实验或现场使用.可以进行黄曲霉毒素总量(B1B2G1G2)的测定,检测限可达到1ug/kg,达到黄曲霉毒素标准限量值以下测定范围为1-300ug/kg.黄曲霉毒素免疫亲和柱-高效液相色谱法比传统的HPLC法更加安全,可靠,灵敏度和准确度高.它采用单克隆抗体免疫技术,可以特效性地将黄曲霉毒素或其他真菌毒素分离出来,分离效率和回收率高.分析原理试样中的黄曲霉毒素用一定比例的甲醇/水提取液经过过滤,稀释后,用免疫亲和柱净化,以甲醇将亲和柱上的黄曲霉毒素淋洗下来,在淋洗液中加入溴溶液衍生,以提高测定灵敏度,然后用荧光分光光度计进行定量.也可以将甲醇-黄曲霉毒素淋洗液的一部分注入HPLC中,对黄曲霉毒素B1,B2,G1,B2分别进行定量分析.免疫亲和柱是用大剂量的黄曲霉毒素单克隆抗体固化在水不溶性的载体上,然后装柱而成.该方法的测定范围0-300ug/kg.(2) 酶联免疫吸附法:1996年,Nakane建立了辣根过氧化物酶标记抗体的测定技术.由于该方法简便,敏感,特异,可作为多种抗原或抗体的测定,20世纪70年代后期,该方法引入真菌毒素的检测中,下面介绍的是竞争性酶联免疫吸附间接法检测黄曲霉毒素B1.原理:将已知抗原吸附在固态载体表面,洗除末吸附抗原,加入一定量抗体与待测样品(含有抗原)提取液的混合液,竞争培养后,在固相载体表面形成抗原抗体复合物.洗除多余抗体成分,然后加入酶标记的抗球蛋白的第二抗体结合物,与吸附在固体表面的抗原抗体结合物相结合,再加入酶底物.在酶的催化作用下,底物发生降解反应,产生有色物质,通过酶标检测仪测出酶底物的降解量,从而推知被测样品中的抗原量.(3) 微柱筛选法可以用来半定量测定各种食品中黄曲霉毒素B1,B2,G1,G2的总量.原理:样品提取液中的黄曲霉毒素被微柱管风硅镁型吸附层吸附后,在波长365nm紫外光灯下显示蓝紫色荧光环,其荧光强度与黄曲霉毒素在一定的光密度范围内成正比例关系.若硅镁型吸附剂层未出现蓝紫色荧光,则样品为阴性(方法灵敏度为5-10ug/kg).由于在微柱上不能分离黄曲霉毒素B1,B2,G1,G2,所以测得结果为总的黄曲霉毒素含量.(4) 一步式黄曲霉毒素检测金标试纸法一步式黄曲霉毒素检测金标试纸法是利用单克隆抗体而设计的固相免疫分析法.由此产生的一步式黄曲霉毒素快速检测试纸可在5-10分钟完成对样品中黄曲霉毒素的定性测定.借助黄曲霉毒素标准样品,这种方法能估算黄曲霉毒素的含量,非常适用于现场测试和进行大量样品的初选.一步式黄曲霉毒素检测金标试纸法是利用单克隆抗体而设计的固相免疫分析法.由此产生的一步式黄曲霉毒素快速检测试纸可在5-10分钟完成对样品中黄曲霉毒素的定性测定.借助黄曲霉毒素标准样品,这种方法能估算黄曲霉毒素的含量,非常适用于现场测试和进行大量样品的初选.检测方法分析薄膜层析法和液相色谱法是目前国内绝大多数检测机构都在使用的方法,由于其检测周期长,程序复杂,所需试剂繁多等缺点已远远不能满足现代检测要求.随着现代科学技术的不断发展,特别是免疫学,生物化学,分子生物学的不断发展,人们已创建了不少快速,简便,特异,敏感,低耗且适用的黄曲霉毒素检测方法.而且以金标试纸为代表的这些方法已经被先进国家所广泛使用,引进和消化这些先进的方法是我们检测领域的当务之急.免疫亲和柱法优点很多,但由于检测费用过高,而无法普及.而一步式黄曲霉毒素检测金标试纸法似乎更适用于我国,值得推广.。
黄曲霉毒素分析方法——

黄曲霉毒素分析方法——-免疫亲和净化柱/UVE法一、免疫亲和净化柱/UVE法简介:利用德国LCTech品牌AflaCLEAN 净化柱可以将黄曲霉毒素B1、B2、G1、G2专一分离出来,然后用HPLC/FLD分别测定黄曲霉毒素 B1、B2、G1、G2。
二、免疫亲和净化柱/UVE法特点:专用AflaCLEAN 净化柱使得样品制备与提取简单快速,成本低灵敏—HPLC可至30ppt—200ppt(黄曲霉毒素B1)。
简便实用,衍生化没有衍生试剂消耗(通常柱后衍生均需要使用衍生试剂,分析成本高,操作麻烦,仪器故障率较高)回收率高三、免疫亲和净化柱/UVE法操作步骤简介:1、提取样品:研磨、称重50g样品;用甲醇/水(80/20 V/V)混合物将样品高速混匀 1 分钟。
2、过滤:将提取的样品滤膜过滤,然后再过0.4 μm滤膜。
3、吸附、淋洗:将滤液2 ml加到 8ml PBS 缓冲液(pH 7.2)后,通过AflaCLEAN 净化柱,流速不大于1 mL/min;用10ml水清洗亲合柱;用甲醇1ml 两次将黄曲霉毒素从亲合柱上淋洗下来,并收集于HPLC进样小瓶中。
4、测定:HPLC直接进样,在经过柱分离后,被UVE衍生化,被荧光检测器记录各种黄曲霉毒素的浓度。
四、UVE™和 HPLC参数UVE™波长:254 nmHPLC-柱: 150 x 4.6 mm; C-18洗提液: 水 / 乙腈 / 甲醇 (60 / 15 / 30 // v / v / v)流量:1.0 mL/min柱温: 30 °C进样体积: 20 – 100 μLλ-激发波长: 365 nmλ-发射波长: 440 nm五、主机配置德国LCTech公司 UVE™主机,配有1ml反应池,9v 紫外灯254nlUVE™主机黄曲霉素免疫亲和AflaCLEAN净化柱黄曲霉素 ELISA试剂盒以下为德国LCTech公司黄曲霉素相关产品订购信息:以下为德国LCTech公司黄曲霉素相关产品订购信息:。
高效液相色谱柱后衍生法测定农田沟渠水中草甘膦残留

高效液相色谱柱后衍生法测定农田沟渠水中草甘膦残留王聪;刘颖超;庞民好;董金皋【摘要】为了准确评价草甘膦在农田沟渠水中使用后其对生态环境的安全性,建立了高效液相色谱(HPLC)-柱后衍生法对农田沟渠水中草甘膦残留量的检测方法.将田间沟渠水样中草甘膦经次氯酸钠和邻苯二甲醛、巯基乙醇衍生化后,采用荧光检测器检测.衍生剂1(5%)次氯酸钠添加量100 μL/L;衍生剂2硼酸钾和OPA添加量分别是130 g/L和100 mg/950mL.草甘膦在0.05~2 mg/L范围内线性良好,相关系数为0.999 9.在农田沟渠水中,草甘膦3个添加水平(0.05、0.5、1 mg/L)的平均回收率(n-5)为98.2%~104.4%,5次测量的相对标准偏差为2.1%~3.6%,方法检出限为0.05 mg/L.该方法灵敏、简便、快速,适合于农田沟渠水中草甘膦残留量的检测.%In order to accurately evaluate the bio-environmental safety of glyphosate, a HPLC-post column derivation method was developed to determine glyphosate in the water of farmland ditch. Glyphosate in the water of farmland ditch was derivatized with the sodium hypochlorite, o-phthalic aldehyde and mercaptoetha-nol, which were detected with fluorescence detector. The 5% sodium hypochlorite volume of derivative 1 was 100 μL/L; potassium borate and OPA volumes of derivative 2 were 130 g/L and 100 mg/950 mL, respectively. The linearities of glyphosate were at the concentration range of 0.05 to 2. 0 mg/L, with a correlation coefficient of 0. 999 9. The mean spiked recoveries of glyphosate at 3 spiked levels ranged from 98. 2% to 104. 4%. The relative standard deviations (RSD, n = 5)were 2.1% -3. 6%. The limit of detection was 0. 05 mg/L. This method issensitive, simple, rapid and suitable for determining glyphosate in the water of farmland ditch.【期刊名称】《植物保护》【年(卷),期】2012(038)005【总页数】4页(P96-99)【关键词】高效液相色谱;柱后衍生;农田沟渠水;草甘膦【作者】王聪;刘颖超;庞民好;董金皋【作者单位】河北农业大学植物保护学院,保定 071000;河北农业大学植物保护学院,保定 071000;河北农业大学植物保护学院,保定 071000;河北农业大学真菌毒素与植物分子病理学实验室,保定071000【正文语种】中文【中图分类】TQ450.263草甘膦(glyphosate,分子式为C3H8NO5P,化学结构见图1)属灭生性输导型茎叶处理剂,具有广谱、高效、低毒、低残留的特点。
利用电化学方法检测食品中的有害物质

利用电化学方法检测食品中的有害物质食品安全一直是人们关注的焦点之一,食品中存在的有害物质对人体健康产生严重的威胁。
为了保障食品安全,科学家们不断探索各种检测方法,其中电化学方法作为一种快速、灵敏和可靠的检测手段,受到了广泛的关注。
电化学方法是利用电化学技术来检测物质的性质和浓度。
该方法基于物质在电场作用下的电化学行为,通过测量电流、电压和电荷等参数,可以得到有关物质的信息。
相比传统的分析方法,电化学方法具有快速、灵敏、低成本和易操作等优点,因此在食品安全领域具有广泛的应用前景。
电化学方法可以检测的有害物质种类繁多,如重金属、农药残留、食品添加剂等。
以重金属为例,目前广泛使用的电化学方法包括阳极溶出伏安法、恒定电流伏安法和电感耦合等离子体质谱法。
这些方法在实际应用中已被证明具有高灵敏度、高选择性和快速响应的特点,能够准确监测食品中重金属的含量。
除了重金属,农药残留也是食品安全的一大隐患。
传统的检测方法包括气相色谱-负化学离子化质谱法和高效液相色谱-串联质谱法等,但这些方法需要复杂的样品前处理过程和昂贵的仪器设备。
而采用电化学方法可以大幅度降低检测成本,同时也能够实现实时监测和快速结果反馈。
目前,电化学方法在农药残留检测中的应用主要有电化学免疫传感器、电化学发光传感器和电化学生物传感器等。
这些方法通过将生物元件与电化学技术结合,可以实现对农药残留的高灵敏度检测。
食品添加剂是指为了保持食品质量和改善食品口感而在食品中添加的化学物质。
尽管食品添加剂在一定程度上提高了食品的品质和安全性,但过量或者使用不当会对人体健康带来危害。
因此,食品中添加剂的监测也变得非常重要。
电化学方法在食品添加剂的检测中具有一定的优势。
例如,利用导电性聚合物修饰电极可以增强添加剂的信号响应,从而提高检测精度。
同时,还可以通过基于纳米材料的电化学传感器来实现对食品添加剂的高灵敏度检测。
需要注意的是,电化学方法虽然具有诸多优点,但也存在一些局限性。
利用电化学方法检测食品中的重金属污染物

利用电化学方法检测食品中的重金属污染物电化学方法在食品中重金属污染物检测中的应用概述:食品中的重金属污染物对人类健康构成潜在威胁。
因此,为了保障公众健康,食品中重金属污染物的检测成为重要任务。
电化学方法作为一种快速、灵敏且可靠的检测技术,被广泛应用于食品中重金属污染物的分析。
介绍:利用电化学方法进行食品中重金属污染物检测是一种基于电化学过程的定量分析技术。
其核心原理是通过在电化学电极表面引入重金属离子,然后测量电流、电压或电荷变化来推断重金属污染物的含量。
常用电化学方法:1. 电化学沉积/溶解法:这种方法是通过在电极上沉积或溶解重金属离子,并测量电极上的电流或电荷变化,计算样品中重金属污染物的浓度。
例如,常用的方法包括阳极溶出伏安法和阳极沉积伏安法。
2. 方波伏安法:这种方法是在电极上施加方波电位,通过测量电流峰值与重金属离子浓度之间的关系来计算样品中的重金属污染物含量。
该方法具有高灵敏度和广泛的适用性。
3. 循环伏安法:该方法通过在电极上施加周期性变化的电位,测量电流与电位之间的关系,从而得出重金属污染物的含量。
该方法可以提供更多有关电极过程的信息。
4. 安培法:这种方法通过测量电极上的电流变化,推断重金属污染物的含量。
安培法通常用于生物传感器中,结合生物材料与电化学传感器,具有高选择性和灵敏度。
优势:电化学方法在食品中重金属污染物检测中具有以下优势:1. 灵敏度高:电化学方法对重金属污染物具有较高的检测灵敏度,可以检测到极低浓度的污染物。
2. 实时检测:电化学方法可以实时监测重金属污染物的含量,提供即时结果,从而帮助及早采取控制措施。
3. 简化样品前处理:相比其他分析方法,电化学方法对于样品制备的要求较低,可以减少样品前处理的复杂性。
4. 便携性:电化学仪器可以小型化,便于携带和现场使用,使得食品中重金属污染物的检测更加便捷。
应用领域:电化学方法已经广泛应用于食品中重金属污染物的检测。
以下是一些常见的应用领域:1. 水产品检测:电化学方法可以用于检测鱼类、贝类等水产品中重金属污染物的含量,帮助保障水产品的安全。
多功能净化柱和免疫亲和柱工作原理-黄曲霉毒素检测
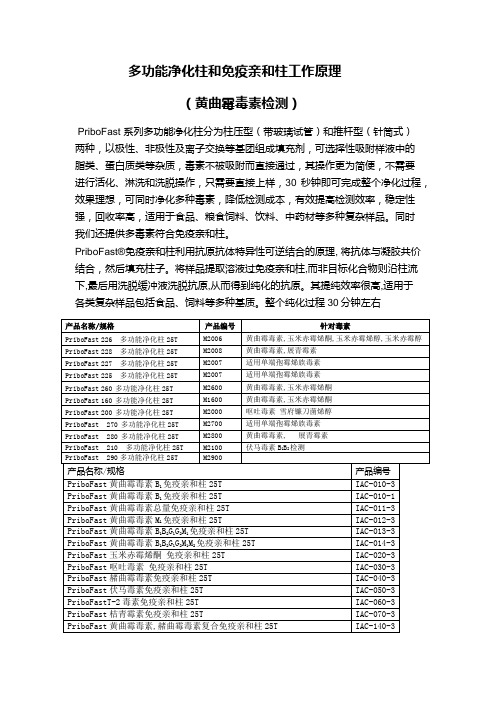
多功能净化柱和免疫亲和柱工作原理
(黄曲霉毒素检测)
PriboFast 系列多功能净化柱分为柱压型(带玻璃试管)和推杆型(针筒式)
两种,以极性、非极性及离子交换等基团组成填充剂,可选择性吸附样液中的
脂类、蛋白质类等杂质,毒素不被吸附而直接通过,其操作更为简便,不需要
进行活化、淋洗和洗脱操作,只需要直接上样,30秒钟即可完成整个净化过程,效果理想,可同时净化多种毒素,降低检测成本,有效提高检测效率,稳定性强,回收率高,适用于食品、粮食饲料、饮料、中药材等多种复杂样品。
同时
我们还提供多毒素符合免疫亲和柱。
PriboFast®免疫亲和柱利用抗原抗体特异性可逆结合的原理, 将抗体与凝胶共价结合,然后填充柱子。
将样品提取溶液过免疫亲和柱,而非目标化合物则沿柱流下,最后用洗脱缓冲液洗脱抗原,从而得到纯化的抗原。
其提纯效率很高,适用于
各类复杂样品包括食品、饲料等多种基质。
整个纯化过程30分钟左右。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
图 1. 四种黄曲霉毒素的线性方程及相关系数
G1, FLD1 A Area = 38.9685647*Amt -0.0275005
Area Rel. Res%(1): 11.809 400
350
G1
300
250 5
200
150
100
50 12 3 4 0
0
5
B1, FLD1 A Area = 41.3441001*Amt -0.3309725
Area Rel. Res%(1): 13.291
400
350
B1
300
250 5
200
150
100
50 12 3 4 0
0
5
6
R2 : 0.99999 Amount [ng/µl] 6
R2 : 0.99998 Amount [ng/µl]
由于农作物和食品中的黄曲霉毒素的含量都比较低且样品基质非 常复杂,免疫亲和柱净化结合柱前(后)衍生、HPLC-FLD 检 测的方法越来越多地应用于各种样品的分析。本文综合考虑色谱 峰柱后扩散、分析速度、分离度及灵敏度,建立了免疫亲和柱净 化-柱后电化学 (Br2) 衍生快速测定黄曲霉毒素的 HPLC-FLD 方 法成功并用于玉米和花生酱中的黄曲霉毒素的分析。
实验部分
仪器及装置
Agilent 1260 Infinity 液相色谱系统,包括溶剂架,四元泵(内置脱 气机),标准自动进样器,柱温箱,荧光检测器。拜发公司 KOBRA 电化学衍生装置,包括电化学衍生池、可变控制电源、0.5 mm 内 径 PEEK 管(至少 34 cm)等。
HPLC 方法
色谱柱:
Zorbax Eclipse Plus C18,4.6 x 150 mm x 5 µm
1.2
1.1
1
0.9
0.8
0.7
min
0
2
4
6
8
10
min
图 2. 6 针 10 µg/L 黄曲霉毒素混标连续进样色谱图(左)和 0.1 µg/L 混标色谱图(右)
样品分析 按样品前处理方法分别测定玉米及花生酱中的黄曲霉毒素。样品 色谱图如图 3 所示。
FLD1 A, Ex=362, Em=455 (AFLATOXINS\AFLATOXINS-20110715 2011-07-15 21-11-30\1107150000020.D)
柱温:
40 °C
流动相 A:
1L 水,加入 238 mg 溴化钾和 700 µL 4M 硝酸
流动相 B:
甲醇
等度:
A:B = 50 : 50,12 min
流速:
1.0 mL/min
检测:
荧光, Ex: 362 nm, Em: 455 nm,gain = 15
进样量:
20 µL
电化学衍生池电流: 100 µA
反应管:
0.5 mm i.d.*34 cm PEEK 管
(从衍生池出口到荧光检测器入口)
样品前处理方法 称取 25 g 待测样品于高速匀质器中,加入 2g 氯化钠和 125 mL 甲 醇/水 (60/40, V/V),高速搅拌匀质 1 min 后,加入 125 mL 去离 子水稀释提取液。手动混合均匀后,立即取 40-50 mL 该提取液过 Whatman No.4 滤纸,取续滤液 10 mL(相当于 1g 样品)上样于 预先活化好的 AFLAPREP® 免疫亲和柱(活化程序参考亲和柱说明 书)[3],以 2-3 mL/min 流速流过免疫亲和柱,再用 10 mL 去离子 水冲洗免疫亲和柱并抽至近干。精密移取 1 mL 甲醇于免疫亲和 柱,以手动方式,用 2 mL 注射器将甲醇缓慢推过免疫亲和柱(必 要时,可用甲醇反冲免疫亲和柱以保证黄曲霉毒素的完全洗脱), 完全收集洗脱液,并用 1 mL 去离子水稀释洗脱液,混匀后过 0.22 µm 滤膜,待测。
免疫亲和柱净化 — 柱后电化学衍生 — HPLC 法测定玉米及花生酱中的 4 种黄曲霉毒素 B1、 B2、G1 和 G2
应用
作者
杨新磊 安蓉 液相色谱产品工程师 生命科学与化学分析事业部 安捷抡科技 上海,中国
摘要
本文采用免疫亲和柱净化结合柱后电化学衍生-HPLC-荧光方法检测了玉米及花生酱中的 4 种黄曲霉毒素 B1、B2、G1 和 G2。样品提取后,先经免疫亲和柱净化、浓缩,再进入 HPLC 系统进行分离、定量。四种黄曲霉毒素在 0.1~10 µg/L 内线性相关系数 R2 > 0.99998,检出限(按 S/N = 3 计算)为 0.004 ~ 0.007 µg/L(相当于 0.008 ~ 0.014 µg/kg 样品检出限)。以 10 µg/L 黄曲霉毒素标准溶液为考察对象,连续 6 针进样,得出四种黄曲 霉毒素的保留时间相对标准偏差 (RSD) < 0.1%,峰面积 RSD < 0.3%。实验证明,该方法 可有效、准确地用于玉米及花生酱等样品中黄曲霉毒素的测定。
3
G2 G1
B2 B1
4.1522 - G2 4.965 - G1
6.122 - B2 7.481 - B1
FLD1 A, Ex=362, Em=455 (AFLATOXINS\AFLATOXINS-20110715 2011-07-15 21-11-30\1107150000014.D) FLD1 A, Ex=362, Em=455 (AFLATOXINS\AFLATOXINS-20110715 2011-07-15 21-11-30\1107150000015.D) FLD1 A, Ex=362, Em=455 (AFLATOXINS\AFLATOXINS-20110715 2011-07-15 21-11-30\1107150000016.D) FLD1 A, Ex=362, Em=455 (AFLATOXINS\AFLATOXINS-20110715 2011-07-15 21-11-30\1107150000017.D) FLD1 A, Ex=362, Em=455 (AFLATOXINS\AFLATOXINS-20110715 2011-07-15 21-11-30\1107150000018.D) FLD1 A, Ex=362, Em=455 (AFLATOXINS\AFLATOXINS-20110715 2011-07-15 21-11-30\1107150000019.D)
2
表 1. 本文黄曲霉毒素检出限和常见标准方法检出限比较
方法名称 本文方法 SN 0277-93
黄曲霉毒素种类 B1、B2、G1、G2 B1、B2、G1、G2
GB/T 5009.22-2003
B1
GB/T 18979-2003 GB/T 5009.23-2006 GB/T 23212-2008 GB 5009.24-2010 *:进样量为 100 µL
1. Commission Regulation (EC) No 1881/2006 of 19 December 2006 Setting Maximum Levels for Certain Contaminants in Foodstuffs. Official Journal of the European Union 2006, 49, L364, 5-24.
B1、B2、G1、G2 B1、B2、G1、G2 B1、B2、G1、G2、M1、M2 B1、M1
所用方法简介 柱后电化学衍生 (Br2)-HPLC-FLD HPLC-FLD 薄层色谱法(第一法) ELISA(第二法) 柱后衍生 (I2)-HPLC-FLD 柱前衍生 (TFA)-HPLC-FLD(第三法) 柱后衍生 (PBPB)-HPLC-FLD 薄层色谱法
引言
黄曲霉毒素是黄曲霉和寄生曲霉的代谢产物,广泛存在于自然界中。最常见的黄曲霉毒 素有 B1、B2、G1、G2 等,其中 B1 毒性最强,G1 次之,B2、G2 较弱。由于黄曲霉毒 素的强毒性和强致癌性,许多国家和组织机构均规定了食品中的黄曲霉毒素的限量值。 其中,欧盟规定了坚果、玉米、果脯等农作物中黄曲霉毒素 B1 的含量不得超过 2.0~8.0 µg/kg,B1、B2、G1 和 G2 的总量不得高于 4.0 ~15.0 µg/kg[1]。美国 FDA 分别规定了 食物和动物饲料中的 4 种黄曲霉毒素的总量不得超过 20 和 300 µg/kg[2]。因此,建立准 确、有效的黄曲霉毒素的测定方法非常重要。
3. Application of Immunoaffinity Columns for Sample Clean-up Prior to the HPLC Analysis for Aflatoxins. Instruction of AFLAPREP® Immunoaffinity Columns provided by R-BIOPHARM RHÔNE LTD. .
方法线性范围、检出限和精密度 分别配制 0.1、0.25、0.5、1.0、5.0、10.0 µg/L 四种黄曲霉毒素 B1、B2、G1、G2 的混合标准溶液(稀释剂为 MeOH/H2O = 50/50),按上述 HPLC 方法分析,以峰面积对浓度作图,得出四种 黄曲霉毒素的线性拟合曲线相关系数 R2>0.99998,线性拟合方程 见图 1。按信噪比 S/N = 3 计算,得出 B1、B2、G1 和 G2 的检出 限分别为 0.007、0.004、0.006 和 0.005 µg/L,连续 6 次进 10 µg/L 标准混合溶液考察方法精密度,得出四种黄曲霉毒素峰面积 RSD<0.3%,保留时间 RSD<0.1%。6 针 10 µg/L 标准混合溶液叠 加色谱图和 0.1 µg/L 混标色谱图如图 2 所示。表 1 比较了本文方 法和常见标准方法检出限,通过比较可以发现本文方法可完全满 足现行国内外标准的要求。
