高三化学元素周期表复习PPT课件
合集下载
高中化学元素周期表ppt课件

30
2.10e-与18e-微粒 把握住书写的规律技巧是关键。
原子
分子
阴离子 阳离子
10e- Ne
HF、H2O、 NH3、CH4
F-、
O2-、
N3-、
OH-、
NH
2
Na+、 Mg2+、 Al3+、 H3O+、 NH
4
18e-
Ar
HCl、H2S、 PH3、SiH4、 F2、H2O2、 N2H4、C2H6、 CH3OH、CH3F
5
基础回归 元素的性质与原子结构的关系
1.元素的性质决定于电子层数 和 最外层电子
,
主数要决定于
最外层电。子数
2.同一主族的元素,从上到下,原子核外电子层数依
次 增多,原子半径逐渐 增,大失电子能力逐
渐 增强,得电子能力逐渐
,减金弱属性逐渐
,非金增属强性逐渐 。
减弱
特别提醒 同主族元素性质不一定相似,如第ⅠA族
HF、H2O、NH3、CH4等。 ④任何元素都有零价,但不一定都有负价或正价。如
F无正价,Na、Mg、Al等无负价。
9
2.元素、核素、同位素
10
3.元素的相对原子质量 (1)目前已发现的110多种元素中,大多数都有 同位素。 (2)一种天然存在的元素的各种核素分占的比例 不一定相同,但所占的百分比组成不变。 (3)元素的相对原子质量是按各种天然同位素原 子所占的一定百分比算出来的平均值。元素周期表 和相对原子质量表中的数值就是元素的相对原子质 量,而非核素(或原子)的相对原子质量。
材料;②在周期表中的
F、Cl、附S、近P等探 索 研 制 农 药 的 材 料 ;
③在 过渡元素中寻找催化剂和耐高温、耐腐蚀的合
2.10e-与18e-微粒 把握住书写的规律技巧是关键。
原子
分子
阴离子 阳离子
10e- Ne
HF、H2O、 NH3、CH4
F-、
O2-、
N3-、
OH-、
NH
2
Na+、 Mg2+、 Al3+、 H3O+、 NH
4
18e-
Ar
HCl、H2S、 PH3、SiH4、 F2、H2O2、 N2H4、C2H6、 CH3OH、CH3F
5
基础回归 元素的性质与原子结构的关系
1.元素的性质决定于电子层数 和 最外层电子
,
主数要决定于
最外层电。子数
2.同一主族的元素,从上到下,原子核外电子层数依
次 增多,原子半径逐渐 增,大失电子能力逐
渐 增强,得电子能力逐渐
,减金弱属性逐渐
,非金增属强性逐渐 。
减弱
特别提醒 同主族元素性质不一定相似,如第ⅠA族
HF、H2O、NH3、CH4等。 ④任何元素都有零价,但不一定都有负价或正价。如
F无正价,Na、Mg、Al等无负价。
9
2.元素、核素、同位素
10
3.元素的相对原子质量 (1)目前已发现的110多种元素中,大多数都有 同位素。 (2)一种天然存在的元素的各种核素分占的比例 不一定相同,但所占的百分比组成不变。 (3)元素的相对原子质量是按各种天然同位素原 子所占的一定百分比算出来的平均值。元素周期表 和相对原子质量表中的数值就是元素的相对原子质 量,而非核素(或原子)的相对原子质量。
材料;②在周期表中的
F、Cl、附S、近P等探 索 研 制 农 药 的 材 料 ;
③在 过渡元素中寻找催化剂和耐高温、耐腐蚀的合
高三化学总复习之 元素周期律PPT课件
5
6
7
8
9
1 0
L K
8 2
3
11
1 2
III
B
IV B
VB
VI B
VII B
VIII
IB
II 1 B3
1 4
1 5
1 6
1 7
1 8
M L k
18 8 2
最4 外
1 9
2 0
2 1
2 2
2 3
24
25
26
2 7
2 8
2 9
3 0
3 1
3 2
3 3
3 4
3 5
3 6
层5 电
3
71
3
82
3 9
4 0
4 1
增 强
Rb Sr In Sn Sb Te I
酸 性 逐 渐 增 强
Cs Ba Tl Pb Bi Po At
碱性逐渐增强
第20页/共31页
3.气态氢化物的热稳定性
热稳定性增强
热 稳 定 性 减 弱
B CNO F
热
Si P S Cl
稳
定
As Se Br
性
Te I
增 强
At
热稳定性减弱
第21页/共31页
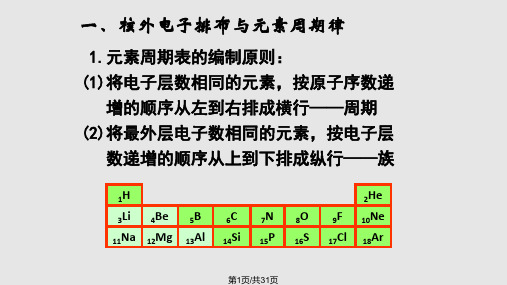
一、核外电子排布与元素周期律
1.元素周期表的编制原则: (1)将电子层数相同的元素,按原子序数递
增的顺序从左到右排成横行——周期 (2)将最外层电子数相同的元素,按电子层
数递增的顺序从上到下排成纵行——族
1H
2He
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
优秀课件——元素周期律(共45张PPT)

化学反应中不稳定结构总是通过各种方式(得失电子、
共用电子对)趋向达到稳定结构
(2)核外电子排布与元素性质的关系
质子数、电子层数 决定 元素的原子半径由________________
最外层电子数 决定 元素的化学性质主要由________________
最外层电子数 决定 元素的化合价主要由_________________ 金属元素的原子最外层电子数一般少于4,易失电子
N +5
-3
O
F
Ne 0
最低价
元素符号 最高价 Na +1 Mg +2 Al +3
-2
-1
Si +4
-4
P +5
-3
S +6
-2
Cl +7
-1
Ar 0
最低价
最高正价= 最外层电子数(F、O除外) 负价 = 最外层电子数-8
随着原子序数的递增
引起了
课堂总结
核外电子排布呈周期性变化 最外层电子数 1→8
• 【回顾】
• 1、碱金属元素的性质递变,其本质原因? • 2、卤素性质递变,其本质原因?
•【思考与交流】 元素的性质随着原子序数的递增而呈怎 样变化呢?
从今天开始,我们就通过来学习认清这些问题
一. 原子核外电子的排布
1. 电子层-表示运动着的电子离核远近及能量高低
含多个电子的原子中, 电子是分层排布的。能量较 低的电子运动在离核较近的 区域,能量较高的电子运动 在离核较远的区域。
深入探讨
原子半径受哪些因素制约?为什么随原子序数 的递增,原子半径出现从大到小的周期性变化?
①电子层数:电子层数越多,原子半径越大 最主要因素 影响原 子半径 大小的 因素 ②核电荷数: 核电荷数增多,使原子半径有减小的趋向
共用电子对)趋向达到稳定结构
(2)核外电子排布与元素性质的关系
质子数、电子层数 决定 元素的原子半径由________________
最外层电子数 决定 元素的化学性质主要由________________
最外层电子数 决定 元素的化合价主要由_________________ 金属元素的原子最外层电子数一般少于4,易失电子
N +5
-3
O
F
Ne 0
最低价
元素符号 最高价 Na +1 Mg +2 Al +3
-2
-1
Si +4
-4
P +5
-3
S +6
-2
Cl +7
-1
Ar 0
最低价
最高正价= 最外层电子数(F、O除外) 负价 = 最外层电子数-8
随着原子序数的递增
引起了
课堂总结
核外电子排布呈周期性变化 最外层电子数 1→8
• 【回顾】
• 1、碱金属元素的性质递变,其本质原因? • 2、卤素性质递变,其本质原因?
•【思考与交流】 元素的性质随着原子序数的递增而呈怎 样变化呢?
从今天开始,我们就通过来学习认清这些问题
一. 原子核外电子的排布
1. 电子层-表示运动着的电子离核远近及能量高低
含多个电子的原子中, 电子是分层排布的。能量较 低的电子运动在离核较近的 区域,能量较高的电子运动 在离核较远的区域。
深入探讨
原子半径受哪些因素制约?为什么随原子序数 的递增,原子半径出现从大到小的周期性变化?
①电子层数:电子层数越多,原子半径越大 最主要因素 影响原 子半径 大小的 因素 ②核电荷数: 核电荷数增多,使原子半径有减小的趋向
【公开课】高三化学一轮复习 元素周期表、元素周期律(课件)(共17张PPT)优秀课件PPT

子。下列说法正确的是( A)
A.原子半径:Z>X
B.离子半径:W3+>Y2-
C.非金属性:X>Y
D.最高价氧化物对应水化物的碱性:Z<W
微粒半径大小如何比较?
(1)层多,径大。(2)层同,序大,径小。
(1)H、H-、H+ (2) Fe、Fe2+、Fe3+
元素代号
L
M
Q
R
T
原子半径/nm 0.154 0.118 0.099
反思? (1)元素周期表有什么用途。
(2)如何推断未知元素在周期表 中的位置。
小结:
2He 2
元素在周期中的位置推测方法
10Ne 8
(1)记住元素周期表的结构。 18Ar 8
(2)记住稀有气体的元素符号。 36Kr 18
(3)记住每一周期含有元素的数。 54Xe 18
(2,8,8,18,18,32,32, 86Rn 32
“嫦娥一号”担负的四大科学目标之一是 探测下列14种元素的含量和分布情况:K、 Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、 Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其中
属于主族元素的有( ) D
A.4种
B.5种
C.6种
D.7种
活动二:
1、以第三周期为例,同桌之间相互说一说同 一周期的递变规律。
功地把自己推销给别人之前,你必须百分之百的把自己推销给自己。即使爬到最高的山上,一次也只能脚踏实地地迈一步。
考点:元素周期表 、元
素周期律
1、通过对元素周期表的再现,能加深 对元素周期表的结构的进一认识和 应用。
2、通过对递变规律的重复,能对做题 有更大提升。
A.原子半径:Z>X
B.离子半径:W3+>Y2-
C.非金属性:X>Y
D.最高价氧化物对应水化物的碱性:Z<W
微粒半径大小如何比较?
(1)层多,径大。(2)层同,序大,径小。
(1)H、H-、H+ (2) Fe、Fe2+、Fe3+
元素代号
L
M
Q
R
T
原子半径/nm 0.154 0.118 0.099
反思? (1)元素周期表有什么用途。
(2)如何推断未知元素在周期表 中的位置。
小结:
2He 2
元素在周期中的位置推测方法
10Ne 8
(1)记住元素周期表的结构。 18Ar 8
(2)记住稀有气体的元素符号。 36Kr 18
(3)记住每一周期含有元素的数。 54Xe 18
(2,8,8,18,18,32,32, 86Rn 32
“嫦娥一号”担负的四大科学目标之一是 探测下列14种元素的含量和分布情况:K、 Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、 Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其中
属于主族元素的有( ) D
A.4种
B.5种
C.6种
D.7种
活动二:
1、以第三周期为例,同桌之间相互说一说同 一周期的递变规律。
功地把自己推销给别人之前,你必须百分之百的把自己推销给自己。即使爬到最高的山上,一次也只能脚踏实地地迈一步。
考点:元素周期表 、元
素周期律
1、通过对元素周期表的再现,能加深 对元素周期表的结构的进一认识和 应用。
2、通过对递变规律的重复,能对做题 有更大提升。
元素周期表ppt课件

元素周期表揭示了元素在生物地球化学循环中的作用,有助于理解 生态系统的物质循环和能量流动。
05
元素周期表的未来发展
新的元素发现与合成
合成新元素
随着科学技术的不断进步,科学家们 可能会合成更多超重元素,进一步丰 富元素周期表。
探索新元素特性
新元素的发现将有助于深入了解元素 的性质和行为,为科学研究和技术创 新提供更多可能性。
元素周期表的完善与修正
修正元素性质
随着新元素的合成和性质研究,元素周期表中的元素性质可能会得到修正和完 善。
调整周期表结构
根据新发现和研究成果,元素周期表的排列和分类可能会进行相应的调整和优 化。
元素周期表在未来的应用前景
科学研究
元素周期表在化学、物理、材料科学等领域的研究中发挥着重要作用,未来仍将 是科学家们的重要工具。
技术创新
元素周期表中的元素是许多技术和产品的关键组成部分,随着新元素的发现和应 用,将有助于推动技术创新和产业发展。
THANKS
感谢观看
材料分类与鉴别
元素周期表为材料分类和鉴别提 供了依据,有助于对不同材料进
行科学分类和鉴别。
在生命科学领域的应用
生物分子结构研究
元素周期表在解析生物分子结构中发挥了重要作用,例如蛋白质 和核酸的结构研究。
药物设计与研发
通过元素周期表,可以预测药物分子的性质和行为,有助于新药的 研发和优化。
生物地球化学循环
通过元素周期表,科学家可以了解材料的物理和 化学性质,从而在材料科学和工程领域进行有效 的应用。
促进化学和其他学科的发展
元素周期表为化学学科提供了基础框架,同时也 为其他学科提供了重要的参考和借鉴。
02
元素周期表中的元素
05
元素周期表的未来发展
新的元素发现与合成
合成新元素
随着科学技术的不断进步,科学家们 可能会合成更多超重元素,进一步丰 富元素周期表。
探索新元素特性
新元素的发现将有助于深入了解元素 的性质和行为,为科学研究和技术创 新提供更多可能性。
元素周期表的完善与修正
修正元素性质
随着新元素的合成和性质研究,元素周期表中的元素性质可能会得到修正和完 善。
调整周期表结构
根据新发现和研究成果,元素周期表的排列和分类可能会进行相应的调整和优 化。
元素周期表在未来的应用前景
科学研究
元素周期表在化学、物理、材料科学等领域的研究中发挥着重要作用,未来仍将 是科学家们的重要工具。
技术创新
元素周期表中的元素是许多技术和产品的关键组成部分,随着新元素的发现和应 用,将有助于推动技术创新和产业发展。
THANKS
感谢观看
材料分类与鉴别
元素周期表为材料分类和鉴别提 供了依据,有助于对不同材料进
行科学分类和鉴别。
在生命科学领域的应用
生物分子结构研究
元素周期表在解析生物分子结构中发挥了重要作用,例如蛋白质 和核酸的结构研究。
药物设计与研发
通过元素周期表,可以预测药物分子的性质和行为,有助于新药的 研发和优化。
生物地球化学循环
通过元素周期表,科学家可以了解材料的物理和 化学性质,从而在材料科学和工程领域进行有效 的应用。
促进化学和其他学科的发展
元素周期表为化学学科提供了基础框架,同时也 为其他学科提供了重要的参考和借鉴。
02
元素周期表中的元素
高三化学总复习—— 元素周期律和元素周期表-课件(共47张PPT)

阳离子氧化性逐渐 ___减__弱_____ 阴离子还原性逐渐 __增__强______
性质
项目 气态氢化 物稳定性 最高价氧 化物对应 的水化物 的酸碱性
同周期(左→右) 逐渐___增__强_____
碱性逐渐___减__弱_____ 酸性逐渐___增__强_____
同族(上→下) 逐渐___减__弱_____
7.根据“元素的相对位置”推断元素
(2019·辽宁大连模拟)A、B、C均为短周期元素,它们在周期表中的位置如图
所示。已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别为
( )C A.Be、Na、Al
B.B、Mg、Si
C.O、P、Cl
D.C、Al、P
解析 设A的原子序数为x,则B的原子序数为x+8-1,C的原子序数为x+8+ 1,(x+8-1)+(x+8+1)=4x,解得x=8,所以A为O元素,B为P元素,C为Cl元 素,故选C。
非金属性 比较
本质
判断 方法
原子越易得电子,非金属性越强(与原子得电子数目无关) ①元素在周期表中的位置:右边或上方元素的非金属性强 ②与H2越容易化合,气态氢化物越稳定,非金属性越强
③单质氧化性越强或阴离子还原性越弱,非金属性越强 ④最高价氧化物对应水化物的酸性越强,非金属性越强 ⑤不同非金属单质与同种金属反应越易进行其非金属性越 强
(6)氧化性:Fe3+________>__Cu2+_____>_____Fe2+。
2.根据元素周期律比较下列微粒半径大小,用“>”或“<”填空: (1)Na______>____Mg______>____Cl (2)Li_______<___Na_______<___K (3)Na+_______>___Mg2+______>____Al3+ (4)F-_______<___Cl-______<____Br- (5)Cl-________>__O2-______>____Na+_____>_____Mg2+ (6)Fe2+_______>___Fe3+
性质
项目 气态氢化 物稳定性 最高价氧 化物对应 的水化物 的酸碱性
同周期(左→右) 逐渐___增__强_____
碱性逐渐___减__弱_____ 酸性逐渐___增__强_____
同族(上→下) 逐渐___减__弱_____
7.根据“元素的相对位置”推断元素
(2019·辽宁大连模拟)A、B、C均为短周期元素,它们在周期表中的位置如图
所示。已知B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C分别为
( )C A.Be、Na、Al
B.B、Mg、Si
C.O、P、Cl
D.C、Al、P
解析 设A的原子序数为x,则B的原子序数为x+8-1,C的原子序数为x+8+ 1,(x+8-1)+(x+8+1)=4x,解得x=8,所以A为O元素,B为P元素,C为Cl元 素,故选C。
非金属性 比较
本质
判断 方法
原子越易得电子,非金属性越强(与原子得电子数目无关) ①元素在周期表中的位置:右边或上方元素的非金属性强 ②与H2越容易化合,气态氢化物越稳定,非金属性越强
③单质氧化性越强或阴离子还原性越弱,非金属性越强 ④最高价氧化物对应水化物的酸性越强,非金属性越强 ⑤不同非金属单质与同种金属反应越易进行其非金属性越 强
(6)氧化性:Fe3+________>__Cu2+_____>_____Fe2+。
2.根据元素周期律比较下列微粒半径大小,用“>”或“<”填空: (1)Na______>____Mg______>____Cl (2)Li_______<___Na_______<___K (3)Na+_______>___Mg2+______>____Al3+ (4)F-_______<___Cl-______<____Br- (5)Cl-________>__O2-______>____Na+_____>_____Mg2+ (6)Fe2+_______>___Fe3+
元素周期表(优秀版)PPT课件

53 2,8,18,18,
五 ⅦA
88 72,2 22,8,18,32,18,4
六 Ⅳ9 A
练习 A、B、C是周期表中相邻的
三种元素,其中A、B是同周期,B、C是同
主族。此三种元素原子最外层电子数之和
为17,质子数之和为31,则A、B、C分别
为什三么种元元素素?原子最外层电子平均数为
你应该选择保送读大学的。麦克深情地对妻子说:你是我做过的最好选择,只是我忘记了。
你很容易找到。他是我们三年级二班的一个男生,晨会、做操、放学排路队时总是站在第一排,教室里最脏的抽屉一定是他的。对了,他的书包通常不是放在课桌抽屉里,而是扔在地 上。几乎每节课我都要提醒他或是帮他捡起,但下节课再来看,他的书包又咧着大嘴躺在了地上,书本散落一地,他的双脚,正无情地踩在一个练习本上……每每此时,我都无语凝噎, 不忍直视那么,他的抽屉里不放书包放什么?课外书、牛奶盒、瓜皮果壳、小玩具、蚂蚁、毛毛虫、小树枝、黑乎乎的樟树籽、金灿灿的棕榈树籽……总之,五花八门,应有尽有。老 师刚收缴了一批,立马他又塞进另一批……其更新换代的速度堪比火箭发射,让人叹为观止……因为小Z的不讲卫生,每到周一换座位时,轮到坐他座位的同学总是叫苦连天、自认倒霉, 皱着眉头、捂着口鼻一遍一遍地擦,先用抹布蘸着水擦,再用纸巾擦,直到完全闻不到异味才勉勉强强坐下。尽管如此,小Z同学却有很多的好朋友。每次分组活动,大家都抢着要他。 为什么?第一,他是个小书迷,知识渊博;第二,他表达能力强,说话幽默风趣有条理;第三,他为人大方,乐于分享。从小Z的优点来看,你是不是认为他应该是个学霸?这……怎么 说呢,目前算不上,但未来极有可能……看看作文课上他即兴画的思维导图吧,有条理,有创意,让小伙伴们佩服得五体投地,怎么看都不像是一个熊孩子,一个“学渣”的作品。可 是,我每天给孩子们听写十个词语,他每天的正确率只有百分之六十左右,很多字不会写。他是一个不折不扣的“君子”,光读光看不动手写,哪怕就是新学的几个词语,他也不愿意 写一写抄一抄。无论课上课下,凡是要动笔写时,他不是钻到桌子底下东找找西摸摸,就是在书包里左翻翻右抖抖,总之就是老半天下不了笔。别人已经写完了拿给老师批改,他可能 才开始写第一题………那磨磨蹭蹭的样子,活活要把老师气死。他妈妈认为他从小握笔姿势错误怎么也纠正不了,导致写字速度很慢,所以不愿意写字。我却不这么认为,我觉得没这 么简单,一定另有原因,只不过我现在还没弄明白而已。上周四上午第三、四节课,语文单元测试。两节课的考试时间过去,试卷一张张收了上来,最后一个交卷的是小我快速扫了一 下卷面。哦买噶第一页的基础题几乎一片空白!作文也没写完,只写了三四行!这样子,批改出来总分顶多也就二三十分!怎么会这样!再差也不会如此啊!考试时不务正业偷玩蚂蚁 去了?还是故意不做?身为语文老师兼班主任的我气得跳脚,一阵胸闷。怎么办?把他叫到办公室狠批一顿?或者请他家长来学校?此时,脑海里突然闪出一幕幕画面:他在班级读书 分享会上侃侃而谈,他在课堂上回答问题时妙语如珠,他把自己的零食和玩具大方地给同学们分享,他羞涩地笑着把他饼干递到我手中……虽然在完成作业方面他确实做得不好,尽管 在上课时经常偷看课外书,但不可否认的是,他绝对是个好学上进的好孩子!试卷答成这样,也许另有原因吧?不不不,不能那么简单粗暴!我应该先了解一下真实的原因。要知道, “刑讯逼供”最容易“屈打成招”……午餐后的自习时间。我笑眯眯地对小Z说:“小Z,我们的教室好脏啊,你愿不愿意为大家服务一下,打扫一下教室?“愿意!”他二话没说,跑 着去拿扫把。不要做作业,估计他心里乐开了花。他一手拿扫把,一把持簸箕,认真地扫着。看到谁的脚下有纸屑,他就轻声提醒他抬起脚来,再把纸扫出来,态度友好,而且不影响 他人。扫地的动作也很是娴熟、麻利不一会儿功夫,他就把教室打扫得干干净净,我当众狠狠地表扬了他一番,然后把他叫到我身边,拿了把椅子让他坐下他顺从地坐下了,刚才还因 为受了表扬而神采飞扬,此时却目光黯淡,低着头不敢看我,像是在担心暴风雨的来临。我摊开他上午考的那张试卷,和颜悦色地柔声问道:“这么多题没做,我想了半天也想不出原 因,你能告诉我为什么么?换句话说,我很想知道你是怎么答题的,因为这真的不是你的真实水平。”“我一拿到试卷就想着要挑分值多的题目做,就先挑了二十多分的阅读题。可是
高考化学复习精选PPT课件元素周期表

化学2
复 习
• 什么是元素周期律? 元素的性质随着元素原子序数的递增而呈 周期性变化的规律叫元素周期律。 主要包括: 1. 核外电子排布呈周期性变化 2. 原子半径呈周期性变化 3. 元素主要化合价呈周期性变化 4. 元素金属性、非金属性呈周期性变化
编 ⑴体现元素周期律 表 ⑵电子层数相同:按核电荷数的递增从左到右排在同一横行 原 则 ⑶最外层电子数相同:按电子层数的递增从上到下排在同一纵行
47
48
49
50
51
52
53
54
5 55 5
87
5 56 6
88
57 57 71
89103
72
73
7
76 6
7
77
78
79
80
81
82
83
84
85
86
104
105
108
109
110
111
112
不完全 周期
二、元素周期表的结构(族)
2.族(纵行) 共18列
七主七副零八族
1) 主族:由短周期元素和长周期元素共同构成的族。
位置
周期数
反映
决定
结构
电子层数
最外层电子数
主族序数 原子序数
= = =
质子数
请你回答
已知某主族元素的原子结构示意图如下, 判断其位于第几周期,第几族?
练习:
1、第三周期第IVA族的元素原子序数是:14 2、Na元素的原子序数为11,相邻的同族元素 的原子序数是: 3、19 3、短周期元素中, 族序数=周期序数的元素有:H,Be,Al 族序数=周期序数2倍的元素有:C,S 周期序数=族序数2倍的有:Li
复 习
• 什么是元素周期律? 元素的性质随着元素原子序数的递增而呈 周期性变化的规律叫元素周期律。 主要包括: 1. 核外电子排布呈周期性变化 2. 原子半径呈周期性变化 3. 元素主要化合价呈周期性变化 4. 元素金属性、非金属性呈周期性变化
编 ⑴体现元素周期律 表 ⑵电子层数相同:按核电荷数的递增从左到右排在同一横行 原 则 ⑶最外层电子数相同:按电子层数的递增从上到下排在同一纵行
47
48
49
50
51
52
53
54
5 55 5
87
5 56 6
88
57 57 71
89103
72
73
7
76 6
7
77
78
79
80
81
82
83
84
85
86
104
105
108
109
110
111
112
不完全 周期
二、元素周期表的结构(族)
2.族(纵行) 共18列
七主七副零八族
1) 主族:由短周期元素和长周期元素共同构成的族。
位置
周期数
反映
决定
结构
电子层数
最外层电子数
主族序数 原子序数
= = =
质子数
请你回答
已知某主族元素的原子结构示意图如下, 判断其位于第几周期,第几族?
练习:
1、第三周期第IVA族的元素原子序数是:14 2、Na元素的原子序数为11,相邻的同族元素 的原子序数是: 3、19 3、短周期元素中, 族序数=周期序数的元素有:H,Be,Al 族序数=周期序数2倍的元素有:C,S 周期序数=族序数2倍的有:Li
《元素周期表》课件ppt课件

观察,可得 A是氮元素
B是 氧元素
C是
二、元素的性质与原子结构
1.碱金属元素
元素 元素 名称 符号
核电 荷数
最外层电子 电子
数
层数
原子结构
相同点
递变性
锂
碱
金 属
钠
元
素钾
铷
Li
3
Na
11
K
19
Rb
37
1
2
最
1
3
1
外 层 都 有
核电 原 电子 子 荷层 半 数数 径
1
4
个
逐逐 逐
电
渐渐 渐
子
增增 增
1
原子 序数
6
13 34 53 88
周期 2 3 4 5 7
族 IVA IIIA VIA VIIA IIA
课 堂 练
4.下列各表为周期表的一部分(表中为 原子序数),其中正确的是(D )
习 (A)
(B)
234
2
11
10 11
19
(C) 6
18 19
(D) 67
11 12 13
14
24
31 32
课 堂 5、元素X的原子获得3个电子或元素Y的原 练 子失去2个电子后,它们的电子层结构与 习 氖原子的电子层结构相同。X、Y两种元
H、Be 、 Al
。
族序数等于周期序数2倍的元素
有: C S
。
周期序数=族序数2倍的有: Li、Ca
。
课 堂 7. A、B、C是周期表中相邻的三种元素, 练 其中A、B是同周期,B、C是同主族。此三 习 种元素原子最外层电子数之和为17,质子数
元素周期表ppt课件

通过元素周期表,可以了 解不同元素之间的组合规 律,指导新型材料的合成 。
分析材料组成
利用元素周期表,可以对 材料进行定性和定量分析 ,确定其组成元素及其比 例。
在能源科学研究中的应用
能源转换与储存
元素周期表中的元素可以用于能 源转换和储存,如利用过渡金属 元素制备催化剂,提高能源利用
效率。
能源材料研究
元素周期表的结构与特点
结构
元素周期表主要包括多个周期和多个族,每个周期和每个族都有特定的元素组 成和性质特征。
特点
元素周期表具有周期性和重复性,元素的性质随着原子序数的增加呈现出规律 性的变化。
02
元素周期表中的元素分类
金属元素
定义
金属元素是指在周期表中的具有金属特性的元素 。
特点
金属元素通常具有较高的原子序数和相对较大的 原子质量,具有导电和导热性。
稀有气体元素的化学反应性能变化规律
• 稀有气体元素:稀有气体元素位于元素周期表零族,其化学反 应性能非常不活泼,几乎不与任何其他元素发生化学反应。
05
元素周期表在科学研究中的应用
在材料科学研究中的应用
预测材料性质
元素周期表可以用于预测 材料的物理、化学性质, 如硬度、熔点、电导率等 。
指导材料合成
化合物结构研究
通过元素周期表,可以研究化合物的结构,预测 化合物的性质,为合成和设计新的化合物提供理 论支持。
化学史教育
元素周期表的发展历程也是化学史的重要内容, 有助于学生了解化学学科的发展历程。
在研究生化学教学中的应用
科研实践应用
在研究生阶段,元素周期表是科研实践的重要工具,通过元素周期 表可以研究新型材料、新药物等。
同一周期内,从左到右,电负性逐渐 增大
分析材料组成
利用元素周期表,可以对 材料进行定性和定量分析 ,确定其组成元素及其比 例。
在能源科学研究中的应用
能源转换与储存
元素周期表中的元素可以用于能 源转换和储存,如利用过渡金属 元素制备催化剂,提高能源利用
效率。
能源材料研究
元素周期表的结构与特点
结构
元素周期表主要包括多个周期和多个族,每个周期和每个族都有特定的元素组 成和性质特征。
特点
元素周期表具有周期性和重复性,元素的性质随着原子序数的增加呈现出规律 性的变化。
02
元素周期表中的元素分类
金属元素
定义
金属元素是指在周期表中的具有金属特性的元素 。
特点
金属元素通常具有较高的原子序数和相对较大的 原子质量,具有导电和导热性。
稀有气体元素的化学反应性能变化规律
• 稀有气体元素:稀有气体元素位于元素周期表零族,其化学反 应性能非常不活泼,几乎不与任何其他元素发生化学反应。
05
元素周期表在科学研究中的应用
在材料科学研究中的应用
预测材料性质
元素周期表可以用于预测 材料的物理、化学性质, 如硬度、熔点、电导率等 。
指导材料合成
化合物结构研究
通过元素周期表,可以研究化合物的结构,预测 化合物的性质,为合成和设计新的化合物提供理 论支持。
化学史教育
元素周期表的发展历程也是化学史的重要内容, 有助于学生了解化学学科的发展历程。
在研究生化学教学中的应用
科研实践应用
在研究生阶段,元素周期表是科研实践的重要工具,通过元素周期 表可以研究新型材料、新药物等。
同一周期内,从左到右,电负性逐渐 增大
元素周期表复习课PPT

位置与元素的性质
➢ 原子(离子)半径: 影响因素 电子层数(主) 质子数 (次)
质子数
逐电
逐渐增多
小
渐子
增层
多数
大
练习
➢X和Y两元素的阳离子具有相同的电子 层结构,X元素的阳离子半径比Y元素 的阳离子半径大。Z和Y两元素原子的 电子层数相同,Z元素的原子半径小于 Y元素的原子半径。X、Y、Z三种元素 原子序数的关系是__________
A. ⅢB族 B. ⅢA族 C. ⅠB族 D.ⅣA族
短周期元素
位置与结构的关系
➢主族序数 = 最外层电子数 ➢ 周期数 = 电子层数
VI A 族 第三周期
练习
➢ 今有A、B两种原子,已知A原子的核外电子总数 是B原子核外电子总数的1/2倍,B原子的L层电子 数为A原子L层电子数的2倍,A和B分别是______
C H218O、H2O互为同素异形体 D 12C、14C物理性质不同,化 质学 几性 乎相同
➢
已知某粒子
A Z
R
n
,则元素R的原子序数是
A.Z B.A-Z C.Z-n D.Z+n
元素周期表结构
练习中探求新知
同主族相邻周期的元素的原子序数可能相 差__2__、__8__、__1_8_或__3_2_。 甲、乙是周期表中同主族的相邻元素,若 甲的原子序数为x,则乙的原子序数不可能 是( B )
A.B(OH)3 C.H2BO4
B.H2BO3 D.H3BO4
元素的性质
➢金属性:失电子能力 ➢非金属性 :得电子能力
核对最外层电 子的吸引力
金属性 增强
非金属 性增强
(非)金属性与化学性质关系
金属性
➢金属单质的还原 性 (与水或酸置 换氢气)
