AR-A014418抑制剂生物数据说明书M2405
卡非佐米药物说明书

卡非佐米药物说明书目录1、基本信息>2、研发状态>3、全球同靶点竞争格局>4、中国注册申报>5、临床试验信息>6、全球上市批准>7、医药专利信息>8、市场信息>导出日期:2022-02-16药物名称carfilzomib中文名称卡非佐米研发代码ONO-7057、PR-171其余名称carfilzomib (intravenous/Captisol-enabled, cancer), Onyx/Ligand、PR 171、ONO 7057、ONO-7057、Kyprolis、PR-171、carfilzomib、PR171、ONO7057、epoxomicin derivative (anticancer), Proteolix、proteasome inhibitors (hematological malignancies), Proteolix创新类型创新药全球最高研发状态已上市(首次上市:多发性骨髓瘤-美国-2012)工艺技术Biological therapeutic(生物药)Formulation powder(粉末制剂)Freeze drying(冻干制剂)Infusion(输注)Intravenous formulation(静脉注射剂)Oral formulation(口服制剂)Peptide(肽)剂型注射剂给药途径注射、内服特殊审批Accelerated Approval(加速批准)Fast Track(快速通道)Orphan Drug(孤儿药)专利号WO-2005105827EphMRA分类号原研企业Yale University(耶鲁大学)是否国内原研企业否参与研发的企业Amgen Inc(安进)BeiGene Co Ltd(百济神州有限公司)Dr Reddy's Laboratories Ltd(瑞迪博士实验室)Ono Pharmaceutical Co Ltd(小野制药)靶点Proteasome inhibitor(PSM)全称:Proteasome inhibitor(PSM)简称:PSM中文:蛋白酶体抑制剂别名:详情:Ubiquitin inhibitor(UB)全称:Ubiquitin inhibitor(UB)简称:UB中文:泛素化抑制剂别名:详情:适应症Acute lymphoblastic leukemia(急性淋巴细胞白血病)Multiple myeloma(多发性骨髓瘤)Neuroendocrine tumor(神经内分泌肿瘤)治疗领域Hematologic(血液系统)Cancer(肿瘤)ATC分类L01XX45(抗肿瘤药和免疫机能调节药>抗肿瘤药>其它抗肿瘤药物>其它抗肿瘤药>卡非佐米)分子式C40H57N5O7分子量719.91化学名称L-Phenylalaninamide,(α S)-α -[(4-morpholinylacetyl)amino]benzenebutanoyl-L-leucyl-N-[(1S)-3- methyl-1-[[(2R)-2-methyloxiranyl]carbonyl ]butyl]-CAS登记号868540-17-4化学结构研发状态上市时间轴日期国家/地区适应症2012-07-20美国多发性骨髓瘤2015-11-19欧盟多发性骨髓瘤2016-07-04日本多发性骨髓瘤2021-07-09中国多发性骨髓瘤适应症地区最高研发阶段多发性骨髓瘤中国已上市实体瘤全球临床二期巨球蛋白血症全球临床二期套细胞淋巴瘤全球临床二期小细胞肺癌全球临床二期肾细胞癌全球临床二期激素抵抗性前列腺癌全球临床二期神经内分泌肿瘤全球临床二期血液肿瘤全球临床一期慢性淋巴细胞白血病全球临床一期外周T细胞淋巴瘤全球临床一期皮肤T淋巴细胞瘤全球临床一期急性淋巴细胞白血病全球临床一期癌症全球药物发现非霍奇金淋巴瘤全球药物发现适应症国家/地区研发公司研发现状研发进度中国BeiGene Co Ltd(百济神州有限公司)已上市(2021-07-09)药物发现临床前临床一期临床二期临床三期申请上市(2020-01-02)已上市(2021-07-09)摩洛哥Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)沙特阿拉伯Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)新西兰Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期(2013-10-01)申请上市已上市(2019-12-10)Onyx Pharmaceuticals Inc(安进)临床三期(2012-07-03)药物发现临床前临床一期临床二期临床三期(2012-07-03)————智利Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)秘鲁Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)白俄罗斯Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)阿尔及利亚Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)菲律宾Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)最高研发状态积极研发详情厄瓜多尔Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)马来西亚Amgen Inc(安进)已上市(2019-12-10)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-12-10)波兰Amgen Inc(安进)已上市(2019-02-18)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-02-18)荷兰Amgen Inc(安进)已上市(2019-01-07)药物发现临床前临床一期临床二期临床三期申请上市已上市(2019-01-07)丹麦Amgen Inc(安进)已上市(2018-12-03)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-12-03)芬兰Amgen Inc(安进)已上市(2018-11-21)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-11-21)爱尔兰Amgen Inc(安进)已上市(2018-11-05)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-11-05)挪威Amgen Inc(安进)已上市(2018-10-29)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-10-29)捷克共和国Amgen Inc(安进)已上市(2018-10-23)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-10-23)德国Amgen Inc(安进)已上市(2018-09-01)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-09-01)比利时Amgen Inc(安进)已上市(2018-08-13)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-08-13)奥地利Amgen Inc(安进)已上市(2018-03-01)药物发现临床前临床一期临床二期临床三期申请上市已上市(2018-03-01)埃及Amgen Inc(安进)已上市(2017-10-23)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-10-23)新加坡Amgen Inc(安进)已上市(2017-10-23)药物发现临床前临床一期临床二期临床三期(2013-10-01)申请上市已上市(2017-10-23)Onyx Pharmaceuticals Inc(安进)临床三期(2013-03-31)药物发现临床前临床一期临床二期临床三期(2013-03-31)————约旦Amgen Inc(安进)已上市(2017-10-23)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-10-23)希腊Amgen Inc(安进)已上市(2017-10-02)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-10-02)巴林Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)中国香港Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)澳大利亚Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)黎巴嫩Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)卡塔尔Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)中国澳门Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)土耳其Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)多发性骨髓瘤印度Dr Reddy's Laboratories Ltd(瑞迪博士实验室)已上市(2017-08-30)药物发现(2015-08-06)临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)阿拉伯联合酋长国Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)阿曼Amgen Inc(安进)已上市(2017-08-30)药物发现临床前临床一期临床二期临床三期申请上市已上市(2017-08-30)中国台湾Amgen Inc(安进)已上市(2017-04-13)药物发现临床前临床一期临床二期临床三期(2013-10-01)申请上市已上市(2017-04-13)Onyx Pharmaceuticals Inc(安进)临床三期(2013-03-31)药物发现临床前临床一期临床二期临床三期(2013-03-31)————日本Ono PharmaceuticalCo Ltd(小野制药)已上市(2016-07-04)药物发现临床前临床一期临床二期(2011-08-02)临床三期(2014-05-13)申请上市(2015-08-26)已上市(2016-07-04)巴西Amgen Inc(安进)已上市(2016-06-10)药物发现临床前临床一期临床二期临床三期(2013-10-01)申请上市已上市(2016-06-10)Onyx Pharmaceuticals Inc(安进)临床三期(2012-07-03)药物发现临床前临床一期临床二期临床三期(2012-07-03)————俄罗斯Amgen Inc(安进)已上市(2016-06-03)药物发现临床前临床一期临床二期临床三期申请上市已上市(2016-06-03)瑞士Amgen Inc(安进)已上市(2016-06-03)药物发现临床前临床一期临床二期临床三期申请上市已上市(2016-06-03)英国Amgen Inc(安进)已上市(2016-02-12)药物发现(2014-12-11)临床前临床一期临床二期临床三期申请上市已上市(2016-02-12)加拿大Amgen Inc(安进)已上市(2016-01-21)药物发现临床前临床一期临床二期临床三期申请上市已上市(2016-01-21)Onyx Pharmaceuticals Inc(安进)临床三期(2010-07-21)药物发现临床前临床一期临床二期临床三期(2010-07-21)————韩国Amgen Inc(安进)已上市(2015-11-24)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-11-24)Onyx Pharmaceuticals Inc(安进)临床三期(2012-07-03)药物发现临床前临床一期临床二期临床三期(2012-07-03)————欧盟Amgen Inc(安进)已上市(2015-11-19)药物发现临床前临床一期临床二期临床三期申请上市(2015-01-27)已上市(2015-11-19)哥伦比亚Amgen Inc(安进)已上市(2015-11-19)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-11-19)科威特Amgen Inc(安进)已上市(2015-09-18)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-09-18)泰国Amgen Inc(安进)已上市(2015-07-24)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-07-24)Onyx Pharmaceuticals Inc(安进)临床三期(2012-07-03)药物发现临床前临床一期临床二期临床三期(2012-07-03)————阿根廷Amgen Inc(安进)已上市(2015-01-27)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-01-27)以色列Amgen Inc(安进)已上市(2015-01-27)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-01-27)Onyx Pharmaceuticals Inc(安进)临床三期(2010-07-21)药物发现临床前临床一期临床二期临床三期(2010-07-21)————Amgen Inc(安进)已上市(2015-01-27)药物发现临床前临床一期临床二期临床三期申请上市已上市(2015-01-27)Onyx Pharmaceutic als Inc(安进)临床三期(2013-03-31)药物发现临床前临床一期临床二期临床三期(2013-03-31)————美国Amgen Inc(安进)已上市(2013-10-01)药物发现临床前临床一期临床二期临床三期申请上市已上市(2013-10-01)Onyx Pharmaceuticals Inc(安进)已上市(2012-07-20)药物发现临床前临床一期临床二期临床三期(2010-07-21)申请上市(2011-01-31)已上市(2012-07-20)东欧洲Onyx Pharmaceuticals Inc(安进)临床三期(2013-03-31)药物发现临床前临床一期临床二期临床三期(2013-03-31)————欧洲Onyx Pharmaceuticals Inc(安进)临床三期(2010-07-21)药物发现临床前临床一期临床二期临床三期(2010-07-21)————北美Onyx Pharmaceuticals Inc(安进)临床二期(2009-11-17)药物发现临床前临床一期临床二期(2009-11-17)——————Proteolix Inc(安进)临床二期(2007-08-16)药物发现临床前临床一期临床二期(2007-08-16)——————神经内分泌肿瘤美国Amgen Inc(安进)临床二期(2015-06-04)药物发现临床前临床一期临床二期(2015-06-04)——————激素抵抗性前列腺癌美国Ono PharmaceuticalCo Ltd(小野制药)药物发现(2014-01-20)药物发现(2014-01-20)————————————肾细胞癌美国Onyx Pharmaceuticals Inc(安进)临床二期(2013-10-24)药物发现临床前临床一期临床二期(2013-10-24)——————巨球蛋白血症美国Onyx Pharmaceuticals Inc(安进)临床二期(2011-11-10)药物发现临床前临床一期临床二期(2011-11-10)——————小细胞肺癌美国Onyx Pharmaceuticals Inc(安进)临床二期(2013-09-30)药物发现临床前临床一期临床二期(2013-09-30)——————实体瘤美国Onyx Pharmaceuticals Inc(安进)临床二期(2009-11-17)药物发现临床前临床一期临床二期(2009-11-17)——————Proteolix Inc(安进)临床二期(2007-09-24)药物发现临床前临床一期临床二期(2007-09-24)——————套细胞淋巴瘤美国Onyx Pharmaceuticals Inc(安进)药物发现(2011-12-12)药物发现(2011-12-12)————————————急性淋巴细胞白血病澳大利亚Amgen Inc(安进)临床一期(2014-12-03)药物发现临床前临床一期(2014-12-03)————————美国Amgen Inc(安进)临床一期(2014-12-03)药物发现临床前临床一期(2014-12-03)————————以色列Amgen Inc(安进)临床一期(2014-12-03)药物发现临床前临床一期(2014-12-03)————————欧洲Amgen Inc(安进)临床一期(2014-12-03)药物发现临床前临床一期(2014-12-03)————————加拿大Amgen Inc(安进)临床一期(2014-12-03)药物发现临床前临床一期(2014-12-03)————————外周T细胞淋巴瘤美国Onyx Pharmaceuticals Inc(安进)临床一期(2011-06-28)药物发现临床前临床一期(2011-06-28)————————慢性淋巴细胞白血病美国Onyx Pharmaceuticals Inc(安进)临床一期(2010-10-26)药物发现临床前临床一期(2010-10-26)————————皮肤T淋巴细胞瘤美国Onyx Pharmaceuticals Inc(安进)临床一期(2013-01-30)药物发现临床前临床一期(2013-01-30)————————Onyx Pharmaceuticals Inc(安进)临床一期(2009-11-17)药物发现临床前临床一期(2009-11-17)————————Proteolix Inc (安进)临床一期(2005-12-12)药物发现临床前临床一期(2005-12-12)————————癌症日本Ono PharmaceuticalCo Ltd(小野制药)药物发现(2010-09-08)药物发现(2010-09-08)————————————适应症国家/地区研发公司研发现状研发进度多发性骨髓瘤中国Amgen Inc(安进)申请上市(2019-12-02)药物发现临床前临床一期临床二期临床三期(2014-07-08)申请上市(2019-12-02)——激素抵抗性前列腺癌美国Amgen Inc(安进)临床二期(2014-06-05)药物发现临床前临床一期临床二期(2014-06-05)——————小细胞肺癌美国Amgen Inc(安进)临床二期(2013-10-01)药物发现临床前临床一期临床二期(2013-10-01)——————巨球蛋白血症美国Amgen Inc(安进)临床二期(2013-10-01)药物发现临床前临床一期临床二期(2013-10-01)——————实体瘤美国Amgen Inc(安进)临床二期(2013-10-01)药物发现临床前临床一期临床二期(2013-10-01)——————肾细胞癌美国Amgen Inc(安进)临床二期(2013-10-01)药物发现临床前临床一期临床二期(2013-10-01)——————套细胞淋巴瘤美国Amgen Inc(安进)临床二期(2013-04-30)药物发现临床前临床一期临床二期(2013-04-30)——————慢性淋巴细胞白血病美国Amgen Inc(安进)临床一期(2013-10-01)药物发现临床前临床一期(2013-10-01)————————皮肤T淋巴细胞瘤美国Amgen Inc(安进)临床一期(2013-10-01)药物发现临床前临床一期(2013-10-01)————————外周T细胞淋巴瘤美国Amgen Inc(安进)临床一期(2013-10-01)药物发现临床前临床一期(2013-10-01)————————非霍奇金淋巴瘤美国Amgen Inc(安进)药物发现(2013-11-11)药物发现(2013-11-11)————————————血液肿瘤美国Yale University(耶鲁大学)药物发现(2003-03-31)药物发现(2003-03-31)————————————非积极研发详情全球同靶点竞争格局(数据来源:药融云全球药物研发数据库)靶点药物发现临床前临床临床一期临床二期临床三期提交上市申请已上市PSM 1110036103UB5211药品名称药品名称靶点全球最高研发阶段carfilzomib 耶鲁大学PSM 、UB已上市bortezomib 武田26S proteasome complex 、PSM 已上市ixazomib citrate 武田PSM 已上市marizomib 加州大学圣迭戈分校PSM 临床三期CX13-608宁波圣健生物医药科技有限公司PSM临床二期zetomipzomib 安进Proteasome beta-8 subunit 、PSM 临床二期AP-101, AL-S Pharma Neurimmune Holding AG PSM 、CUZNSOD 临床二期VLX-1570Vivolux AB PSM 、UCHL5、USP14临床二期disulfiram + copper gluconate 犹他大学PSM临床二期inobrodibCellCentric LtdAR 、CREBBP 、Ep300、UB临床二期受理号药品名称生产企业承办日期JYHB2101557注射用卡非佐米Onyx Pharmaceuticals, Inc.、Amgen Technology (Ireland) Unlimited Company (ADL)2021-11-25中国注册申报 (数据来源:药融云中国药品审评数据库)企业分析受理号药品名称生产企业承办日期CYHS2101694注射用卡非佐米江苏豪森药业股份有限公司2021-09-07CYHS2101693注射用卡非佐米江苏豪森药业股份有限公司2021-09-07CYHS2101695注射用卡非佐米江苏豪森药业股份有限公司2021-09-07CYHL2100010注射用卡非佐米扬子江药业集团有限公司2021-01-27CYHL2100009注射用卡非佐米扬子江药业集团有限公司2021-01-27JXHB2000044注射用卡非佐米百济神州(北京)生物科技有限公司2020-11-02CYHS2000355注射用卡非佐米江苏豪森药业股份有限公司2020-06-03CYHS2000354注射用卡非佐米江苏豪森药业股份有限公司2020-06-03JYHB2000692注射用卡非佐米百济神州(北京)生物科技有限公司2020-06-02受理号药品名称生产企业承办日期CYHS2200094注射用硼替佐米江苏诚康药业有限公司2022-01-17JYHZ2100744注射用硼替佐米Janssen-Cilag International N.V.、BSP Pharmaceuticals S.p.A.、西安杨森制药有限公司2021-12-23JYHZ2100743注射用硼替佐米Janssen-Cilag International N.V.、BSP Pharmaceuticals S.p.A.、西安杨森制药有限公司2021-12-23JYHB2101557注射用卡非佐米Onyx Pharmaceuticals, Inc.、Amgen Technology (Ireland) Unlimited Company (ADL)2021-11-25CYHS2102042注射用硼替佐米仁合熙德隆药业有限公司2021-11-17JYHB2101417注射用硼替佐米Janssen-Cilag International N.V.、西安杨森制药有限公司、BSP Pharmaceuticals S.p.A 、Janssen pharmaceutica N.V.2021-09-16JYHB2101416注射用硼替佐米Janssen-Cilag International N.V.、西安杨森制药有限公司、BSP Pharmaceuticals S.p.A 、Janssen pharmaceutica N.V.2021-09-16CYHS2101694注射用卡非佐米江苏豪森药业股份有限公司2021-09-07CYHS2101693注射用卡非佐米江苏豪森药业股份有限公司2021-09-07CYHS2101695注射用卡非佐米江苏豪森药业股份有限公司2021-09-07同靶点药品分析临床试验信息 (数据来源:药融云全球临床试验数据库、药融云中国临床试验数据库)全球临床试验-试验阶段分析试验登记号药品名称试验阶段登记日期NCT0230 3821carfilzomibVariable regimens including 6-mercaptopurine, carfilzomib , cyclophosphamide, cytarabine , daunorubicin, dexamethasone, hydrocortisone , methotrexate , mitoxantrone , pegaspargase , vincristine1期临床2014-12-01NCT0199 1301carfilzomibciclosporin, Novartis plus methotrexate1期临床2013-11-25NCT0130 2392carfilzomib3期临床2011-02-24 carfilzomib (Arm I)NCT0194 9545carfilzomib (Arm II)carfilzomib (Arm III)carfilzomib (Arm IV)1期临床2013-09-24 carfilzomibNCT0400 4338carfilzomib——2019-07-02 EchocardiogramNCT0482 7563EndoPAT deviceblood Testscarfilzomib——2021-04-01 home blood pressure cuffNCT0326 9552carfilzomibcarfilzomib plus rituximab2期临床2017-08-31NCT0249 1359carfilzomib2期临床2015-07-08NCT0244 2648carfilzomibplasmapheresis1期临床2015-05-13NCT0231 8784carfilzomib2期临床2014-12-17INCB052793gemcitabinenab-paclitaxeldexamethasoneNCT0226 5510Carfilzomibbortezomiblenalidomide1期临床2014-10-16 azacitidinepomalidomideINCB050465INCB039110NCT0225 7476carfilzomibdexamethasone1期临床2014-10-06NCT0217 8579bortezomibcarfilzomib——2014-07-01NCT0204 2950carfilzomib2期临床2014-01-23NCT0202 0941carfilzomibcarfilzomib plus dexamethasone2期临床2013-12-25适应症4期临床3期临床2期临床1期临床0期临床临床阶段不明合计多发性骨髓瘤2918659561101221780急性淋巴细胞白血病2136150153040486神经内分泌肿瘤6161145929295登记号试验题目药品名称适应症试验状态试验分期申办单位主要临床机构首次公示日期CTR2 0212410注射用卡非佐米在复发性或难治性多发性骨髓瘤患者中随机、开放、两序列、四周期交叉生物等效性及延长用药疗效分析预试验注射用卡非佐米骨髓瘤进行中BE 试验扬子江药业集团有限公司首都医科大学附属北京朝阳医院2021-11-26CTR2 0190717一项在复发性多发性骨髓瘤患者中比较卡非佐米联合地塞米松与硼替佐米联合地塞米松的随机、开放标签的3期研究注射用卡非佐米多发性骨髓瘤进行中III 期Amgen Europe B.V.、Amgen Technology (Ireland) Unlimited Com pany (ADL)、安进生物技术咨询(上海)有限公司中国医学科学院血液病医院(中国医学科学院血液学研究所)2019-11-28CTR2 0160857一项卡非佐米联合地塞米松用于中国复发难治性多发性骨髓瘤受试者的开放标签的单臂3期研究注射用卡非佐米复发难治性多发性骨髓瘤进行中III 期Onyx Pharmaceuticals, Inc.、DS M Pharmaceuticals, Inc.(DPI)、杭州泰格医药科技股份有限公司首都医科大学附属北京朝阳医院2016-12-07CTR2 0140135一项对比CMP 疗法与VMP 疗法用于初诊的不符合移植条件的多发性骨髓瘤患者的随机、开放、Ⅲ期临床研究注射用卡非佐米初诊的不符合移植条件的多发性骨髓瘤进行中III 期Onyx Pharmaceuticals, Inc.、DS M Pharmaceuticals,Inc.(DPI)、杭州泰格医药科技股份有限公司中国医学科学院血液学研究所血液病医院2014-05-19药品名称公司名称申请号国家/地区批准日期CARFILZOMIB BRECKENRIDGE ANDA 209330美国2021-06-11CARFILZOMIBBRECKENRIDGEANDA 209330美国2021-06-11中国临床试验-试验分期分析全球上市批准 (数据来源:药融云全球上市药品筛选系统数据库)药品名称公司名称申请号国家/地区批准日期CARFILZOMIB EUGIA PHARMA ANDA 210823美国2020-03-31 CARFILZOMIB APOTEX ANDA 211185美国2020-03-20 CARFILZOMIB APOTEX ANDA 209425美国2020-03-16 CARFILZOMIB DR REDDYS ANDA 209422美国2019-09-09 CARFILZOMIB QILU PHARM CO LTD ANDA 209528美国2019-01-18KYPROLIS ONYX THERAP NDA 202714美国2012-07-20KYPROLIS ONYX THERAP NDA 202714美国2012-07-20KYPROLIS ONYX THERAP NDA 202714美国2012-07-20专利公开号专利题目专利权人专利类型专利首次公开日期WO2021257941A1Methods of measuring carfilzomib Amgen Inc诊断、分析和测定2021-12-23WO20212 31814A1Compositions and methods for the treatment and prevention of vascular malformationsColumbia University药物发现和筛选、基因筛查和组合、新用途2021-11-18WO2021222783A1Anti-TM4SFl antibody drug conjugates and methods of using same Angiex Inc配方2021-11-04WO20212 22524A1Methods of treating multiple myeloma with a triplet therapy of carfilzomib, dexamethasone, and an antibody that specifically recognizes cd38.Janssen Biotech Inc、OnyxPharmaceuticals Inc联合用药2021-11-04WO2021209947A1Stable ready to dilute formulations of carfilzomib Kashiv BioSciences LLC配方2021-10-21WO2021142359A1Stable cyclodextrin free carfilzomib formulation Amgen Inc配方2021-07-15WO2021142360A1Stable cyclodextrin free carfilzomib formulation Amgen Inc给药装置、配方2021-07-15WO20211 13754A1Use of isatuximab for the treatment of relapsed and/or refractory multiple myelomaSanofi SA、Sanofi-AventisUS LLC配方、新用途2021-06-10医药专利信息(数据来源:药融云全球医药专利数据库、药融云中国医药专利数据库)全球医药专利-专利类型分析全球医药专利-专利公开所属地分析专利公开号专利题目专利权人专利类型专利首次公开日期WO20211 10121A1HDAC6 selective inhibitor and combination therapy thereof CStone Pharmaceuticals 联合用药、配方、新用途2021-06-10WO20211 01842A1Alkylated cyclodextrin compositions and processes for preparing and using the s ameCyDex Pharmaceuticals In c配方2021-05-27公开号标题当前第一申请(专利权)人公开日专利类型CN111646958B 一种卡非佐米的制备方法常州恒邦药业有限公司——授权发明CN111646958A 一种卡非佐米的制备方法常州恒邦药业有限公司——发明申请CN111153964A 一种卡非佐米晶型及其制备方法及其用途安礼特(上海)医药科技有限公司——发明申请CN110882221A 一种注射用卡非佐米冻干制剂的生产工艺健进制药有限公司——发明申请CN110639002A 卡非佐米在制备用于治疗骨肉瘤药物中的应用西安交通大学——发明申请CN110613835A 卡非佐米在制备治疗缺血性脑损伤药物中的应用浙江大学——发明申请CN110759967A 一种卡非佐米的制备方法雅本化学股份有限公司——发明申请HK40004216A 一種用於純化卡非佐米中間體的方法FRESENIUS KABI ONCOLOGY LTD.——发明申请HK1262091A 聚乙二醇化卡非佐米化合物AMGEN INC.——发明申请CN109406685A一种分离卡非佐米和其异构体的高效液相色谱方法南京盖斯夫医药科技有限公司——发明申请中国医药专利-专利类型分析市场信息单位:万元企业该条件暂无相关数据单位:万企业该条件暂无相关数据。
碧云天生物技术产品说明书:Blasticidin S HCl (灭瘟素S)

碧云天生物技术/Beyotime Biotechnology 订货热线:400-168-3301或800-8283301 订货e-mail :****************** 技术咨询:***************** 网址:碧云天网站 微信公众号Blasticidin S HCl (灭瘟素S)产品编号 产品名称包装 ST018-1ml Blasticidin S HCl (灭瘟素S) 10mg/ml ×1ml ST018-5ml Blasticidin S HCl (灭瘟素S) 10mg/ml ×5mlST018-10mg Blasticidin S HCl (灭瘟素S) 10mg ST018-50mgBlasticidin S HCl (灭瘟素S)50mg产品简介:Blasticidin S 是来源于灰色链霉菌(Streptomyces griseochromogenes )的一种核苷类抗生素,中文名为灭瘟素S 、杀稻瘟菌素S 或稻瘟散,一般为盐酸盐。
Blasticidin S 常用于筛选携带bsr /BSD /bls 基因(常标记为bsr r /bsd r /Blast r )质粒的哺乳动物稳定转染细胞株,具有快速而强效的作用模式,很低的抗生素浓度便能使未携带抗性基因的细胞迅速死亡。
本产品10mg/ml 包装配制在HEPES (pH7.4)缓冲溶液中,浓度为10mg/ml ,经0.22μm 滤膜过滤除菌,可以直接用于细胞培养。
本产品10mg 和50mg 包装为粉末装。
Blasticidin S 通过干扰核糖体结合肽段而特异性抑制原核细胞或真核细胞的蛋白合成。
目前已经有3种灭瘟素耐受基因,一种是分离自链霉菌(Streptoverticillum sp.)的乙酰基转移酶基因bls ;另外两种是脱氨酶基因,分别是从蜡状芽孢杆菌(Bacillus cereus)中分离的bsr 和从土霉菌(Aspergillus terreus )中分离的BSD 基因。
Anti-PD-1 clone NAT105 DIA-PD1说明书

A
B
C
D
A: LyБайду номын сангаасph node. Note the strong labeling of the follicular T cells within the light zone of the germinal center. B: Angioimmunoblastic T-cell lymphoma. The neoplastic cells are selectively labeled. C: Primary cutaneous CD4-positive small/medium T-cell lymphoma. Insert shows labeled cells at a higher magnification. D: Lymphocyte predominant Hodgkin lymphoma. The non-neoplastic T-cells expressing PD-1 form rosettes around the
Data Sheet Version: 2 Page: 2 of 3
Figures Immunostaining of formalin-fixed paraffin-embedded tissue sections for PD-1, clone NAT105, dilution 1:100
(pictures courtesy of Prof. Dr. med. Harald Stein, Pathodiagnostik Berlin, Berlin, Germany)
neoplastic LP cells.
Western blot analysis Immunoblot of human YT cell line extracts using anti-PD-1 mouse monoclonal antibody clone NAT105 (DIA-PD1).
碧云天生物技术产品说明书.pdf_1694034760.8424914

碧云天生物技术/Beyotime Biotechnology订货热线:400-168-3301或800-8283301订货e-mail:******************技术咨询:*****************网址:碧云天网站微信公众号mVSMC-SV40 (小鼠永生化主动脉平滑肌细胞)产品编号产品名称包装C7419 mVSMC-SV40 (小鼠永生化主动脉平滑肌细胞) 1支/瓶产品简介:Organism Tissue Morphology Culture Properties Mus musculus (Mouse) Aorta/smooth muscle Fibroblast Adherent本细胞株详细信息如下:General InformationCell Line Name mVSMC-SV40 (Mouse Immortalized Aortic Smooth Muscle Cells)Synonyms -Organism Mus musculus (Mouse)Tissue Aorta/smooth muscleCell Type -Morphology FibroblastDisease -Strain -Biosafety Level* -Age at Sampling -Gender -Genetics -Ethnicity -Applications -Category -* Biosafety classification is based on U.S. Public Health Service Guidelines, it is the responsibility of the customer to ensure that their facilities comply with biosafety regulations for their own country.CharacteristicsKaryotype -Virus Susceptibility -Derivation -Clinical Data -Antigen Expression -Receptor Expression -Oncogene -Genes Expressed -Gene expressiondatabases -Metastasis -Tumorigenic -Effects -Comments This cell line was SV40 immortalized. If needed, blasticidin (1-2µg/ml, should be tested before adding) should be added directly to the cells in culture to maintain the immortalization.Culture Method Doubling Time -Methods for Passages Wash by PBS once then 0.05% trypsin-EDTA solution and incubate at room temperature (or at 37ºC), observe cells under an inverted microscope until cell layer is dispersed (usually within 1 to 5 minutes)2 / 5 C7419 mVSMC-SV40 (小鼠永生化主动脉平滑肌细胞)400-1683301/800-8283301 碧云天/BeyotimeMedium DMEM/F-12 (1:1)+10% FBSSpecial Remarks - Medium Renewal - Subcultivation Ratio - Growth Condition 95% air+ 5% CO 2, 37ºC Freeze medium DMEM (high glucose)+20% FBS+10% DMSO ,也可以订购碧云天的细胞冻存液(C0210)。
雷帕霉素说明书
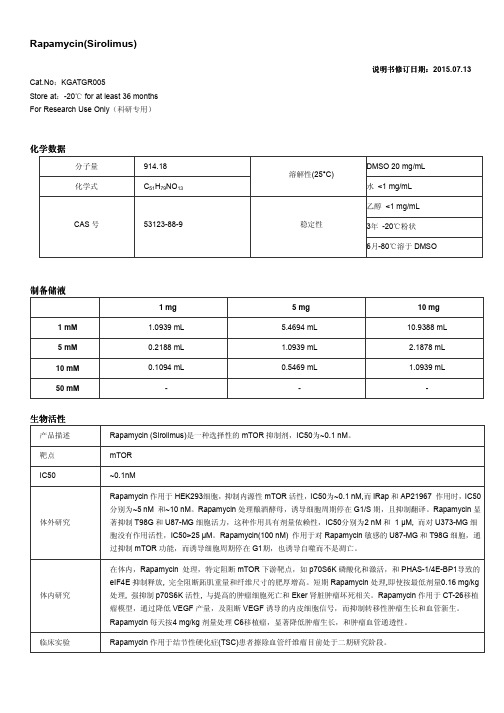
Rapamycin(Sirolimus)说明书修订日期说明书修订日期::2015.07.13Cat.No :KGATGR005Store at :-20 for at least 36 months ℃ For Research Use Only (科研专用)化学数据分子量 914.18DMSO 20 mg/mL化学式C 51H 79NO 13溶解性(25°C)水 <1 mg/mL 乙醇 <1 mg/mL3年 -20℃粉状 CAS 号53123-88-9稳定性6月-80℃溶于DMSO制备储液1 mg 5 mg 10 mg 1 mM 1.0939 mL 5.4694 mL 10.9388 mL 5 mM 0.2188 mL 1.0939 mL 2.1878 mL 10 mM 0.1094 mL0.5469 mL1.0939 mL50 mM---生物活性产品描述 Rapamycin (Sirolimus)是一种选择性的mTOR 抑制剂,IC50为~0.1 nM 。
靶点 mTOR IC50~0.1nM体外研究Rapamycin 作用于HEK293细胞,抑制内源性mTOR 活性,IC50为~0.1 nM,而iRap 和AP21967 作用时,IC50分别为~5 nM 和~10 nM 。
Rapamycin 处理酿酒酵母,诱导细胞周期停在G1/S 期,且抑制翻译。
Rapamycin 显著抑制T98G 和U87-MG 细胞活力,这种作用具有剂量依赖性,IC50分别为2 nM 和 1 µM, 而对U373-MG 细胞没有作用活性,IC50>25 µM 。
Rapamycin(100 nM) 作用于对Rapamycin 敏感的U87-MG 和T98G 细胞,通过抑制mTOR 功能,而诱导细胞周期停在G1期,也诱导自噬而不是凋亡。
体内研究在体内,Rapamycin 处理,特定阻断mTOR 下游靶点,如p70S6K 磷酸化和激活,和PHAS-1/4E-BP1导致的eIF4E 抑制释放, 完全阻断跖肌重量和纤维尺寸的肥厚增高。
AR-A014418_GSK3β抑制剂_487021-52-3_Apexbio

产品描述:
AR-A014418 是一种选择性的 GSK-3 抑制剂。 糖原合酶激酶-3(GSK3)是一种丝氨酸/苏氨酸激酶,与病理情况,如糖尿病和阿尔茨海默 病(AD)相关。 体外实验:ARA014418 以 ATP 竞争性的方式起作用,不能显著抑制 cdk2、cdk5 或 26 种其它 激酶,表明其对 GSK3 的高特异性。在稳定表达人四重复 tau 蛋白的细胞中,ARA014418 抑
产品说明书
化学性质
产品名: AR-A014418 修订日期: 6/30/2016
产品名: Cas No.: 分子量: 分子式: 别名:
化学名: SMILES: 溶解性: 储存条件: 一般建议:
运输条件:
AR-A014418
487021-52-3
308.31
C12H12N4O4S
AR-AO 14418;AR 0133418;AR 014418;GSK 3β inhibitor
参考文献: [1] Bhat R, Xue Y, Berg S, Hellberg S, Orm? M, Nilsson Y, Rades?ter AC, Jerning E, Markgren PO, Borgeg?rd T, Nyl?f M, Giménez-Cassina A, Hernández F, Lucas JJ, Díaz-Nido J, Avila J. Structural insights and biological effects of glycogen synthase kinase 3-specific inhibitor AR-A014418. J Biol Chem. 2003;278(46):45937-45. [2] Gould TD, Einat H, Bhat R, Manji HK. AR-A014418, a selective GSK-3 inhibitor, produces antidepressant-like effects in the forced swim test. Int J Neuropsychopharmacol. 2004;7(4):387-90.
Foregene RT EasyTM I 说明书

RT Easy TM IMaster Premix for first-strand cDNA synthesisCat.No.RT-01011/01012Fast and highly sensitive reverse transcription system for generating first-strand cDNA using pg-level RNAFor research use only Store at-20℃目录产品介绍 (3)产品特点 (3)试剂盒应用 (3)产品质量控制 (4)试剂盒内容 (4)运输及储存条件 (4)试剂盒组分信息 (5)注意事项 (5)RT Mix耐受性 (6)●酒精耐受性分析 (6)●胍盐耐受性分析 (6)操作前准备事项 (7)逆转录引物用量 (7)RNA模板用量 (7)实验材料和设备 (7)自备试剂 (8)安全性 (8)操作指南 (9)操作示意图 (10)问题分析指南 (11)本公司的2×RT Easy TM Mix合成第一链cDNA的温度高达50℃,有利于复杂二级结构RNA模板进行逆转录反应。
实验室纯化获得的RNA常有酒精及胍盐残留,对大多数逆转录酶有很强的抑制性,导致逆转录效果不理想或逆转录效率低。
福际2×RT Easy TM Mix对酒精和胍盐显示出极高的耐受性,对RNA样品中酒精的最高耐受为45%,胍盐的最高耐受为750mM。
即使不纯的RNA也可用福际2×RT Mix进行逆转录反应。
独特的反应体系,使得RT反应更加简便、快捷、高效,25min即可完成第一链cDNA的合成。
此产品可与Foregene公司的荧光定量产品Real Time PCR Easy TM配合使用,能获得高质量的实验结果。
产品特点◆高效的逆转录体系,只需25min即可完成第一链cDNA的合成。
◆高灵敏的逆转录体系,pg级别的模板也可以得到高质量的cDNA。
TB Green

Code No. RR420A 研究用TB Green®Premix Ex Taq™(Tli RNaseH Plus)说明书v202203Da目录内容页码●制品说明 1 ●试剂盒原理 1 ●制品内容 2 ●试剂盒外必备主要试剂和仪器 2 ●保存 2 ●使用注意 3 ●操作方法 3 ●实验条件的选择9 ●附录10 ●关联产品12● 制品说明本制品是采用TB Green 嵌合荧光法进行Real Time PCR 的专用试剂。
制品中含有Real Time PCR 反应的最适浓度TB Green ,是一种2X 浓度的Premix Type 试剂,进行实验时,PCR 反应液的配制十分方便简单。
制品中使用了抗Taq 抗体的Hot Start 法用DNA 聚合酶TaKaRa Ex Taq ® HS ,与Real Time PCR 用适合Buffer 组合,可以有效抑制非特异性的PCR 扩增,大大提高PCR 的扩增效率,可以进行高灵敏度的Real Time PCR 扩增反应。
另外,本制品中添加了Tli RNaseH(耐热性RNaseH),以cDNA 作为模板进行PCR 反应时,可以很好抑制由于cDNA 中残存mRNA 对PCR 反应造成的阻害作用。
本制品适合于快速Real Time PCR 扩增反应,可以在宽广的定量区域内得到良好的标准曲线,对靶基因进行准确定量、检测,重复性好,可信度高。
特长:1. 适用于Real Time PCR 反应,可以快速、准确地对目的基因进行检测、定量。
2. 在2X 浓度的Premix 中,预先混有TB Green ,PCR 反应液配制时,只需加入模板、引物、灭菌水便可进行Real Time PCR 反应,操作简单方便。
3. DNA 聚合酶使用了TaKaRa Ex Taq HS ,可以进行Hot Start 法PCR 反应,再与Takara 特别开发的Buffer 系统相结合,具有高扩增效率,高扩增灵敏度之特点。
碧云天生物技术产品说明书

碧云天生物技术/Beyotime Biotechnology订货热线:400-168-3301或800-8283301订货e-mail:******************技术咨询:*****************网址:碧云天网站微信公众号NF-κB p65 Rabbit Polyclonal Antibody产品编号产品名称包装AF0246 NF-κB p65 Rabbit Polyclonal Antibody50μl产品简介:来源用途交叉反应性分子量Rabbit WB, FC, IHC H, M, R65KDa WB, Western blot; IP, Immunoprecipitation; IF, Immunofluorescence; IHC, Immunohistochemistry; ICC,Immunocytochemistry;FC, Flow Cytometry; ELISA, Enzyme-linked Immuno sorbent Assay; Ch IP, C hromatin I mmunoprecipitation Assay.H, Human;M, M ouse; R,R at; C, Chicken; Cw, C ow; D g, D og; Gp, Guinea pig; Hm, Hamster; Hr, Horse; Mk, Monkey; P g, Pig;Rb,R abbit; S, Sheep; Z, Zebrafish; All, all species expected.配套提供了Western一抗稀释液,可以用于Western检测或其它适当用途时的一抗稀释。
建议抗体使用时的稀释比例如下(实际使用时需根据抗原水平的高低作适当调整):WB IP IF IHC ICC FC ELISA ChIP 1:1000-1:2000 - - 1:100-1:200 - 1:50-1:100 - -抗体详细信息如下:About this AntibodyName NF-κB p65 Rabbit Polyclonal AntibodyCategory Polyclonal antibody(pAb); Primary antibodyIsotype IgGPurification Peptide affinity purifiedAbout the ImmunogenImmunogen This antibody is produced by immunizing rabbits with a synthetic peptide (KLH-coupled) corresponding to N-terminal NF-kB p65.Gene ID5970SwissProt Q04206Synonyms NFKB3; Nuclear factor NF-kappa-B p65 subunit; RELA; TF65; Transcription factor p65; p65 Category Immunology and InflammationBackground NF-kappa-B is a pleiotropic transcription factor present in almost all cell types and is the endpoint of a series of signal transduction events that are initiated by a vast array of stimuli related to many biological processes such as inflammation, immunity, differentiation, cell growth, tumorigenesis and apoptosis. NF-kappa-B is a homo- or heterodimeric complex formed by the Rel-like domain-containing proteins RELA/p65, RELB, NFKB1/p105, NFKB1/p50, REL and NFKB2/p52 and the heterodimeric p65-p50 complex appears to be most abundant one. In unstimulated cells, NF-κB is sequestered in the cytoplasm by IκB inhibitory proteins. NF-κB-activating agents can induce the phosphorylation of IκB proteins, targeting them for rapid degradation through the ubiquitin-proteasome pathway and releasing NF-κB to enter the nucleus where it regulates gene expression .包装清单:产品编号产品名称包装AF0246 NF-κB p65 Rabbit Polyclonal Antibody50μlAZ050Western一抗稀释液50ml-说明书1份保存条件:NF-κB p65 Rabbit Polyclonal Antibody -20ºC保存,Western一抗稀释液-20ºC或4ºC保存,一年有效。
四正柏生物 IFN-α ELISA 试剂盒说明书

REV20190712仅供研究,不用于临床诊断。
客服热线: 400-7060-959﹡技术支持邮箱: **************公司官网: 目录简介 ................................................................................................................................................... - 3 -检测原理............................................................................................................................................ - 3 -试剂盒组分 ........................................................................................................................................ - 4 -储存条件............................................................................................................................................ - 4 -其他实验材料(不提供,但可协助购买) : ......................................................................................... - 5 -注意事项............................................................................................................................................ - 5 -样本收集处理及保存方法 .................................................................................................................. - 5 -试剂准备............................................................................................................................................ - 6 -操作步骤............................................................................................................................................ - 7 -操作流程图 ........................................................................................................................................ - 8 -操作要点提示..................................................................................................................................... - 8 -结果判断............................................................................................................................................ - 8 -结果重复性 ........................................................................................................................................ - 9 -灵敏度................................................................................................................................................ - 9 -特异性.............................................................................................................................................. - 10 -参考文献.......................................................................................................................................... - 10 -该产品由北京四正柏生物科技有限公司研制。
来氟米特片(爱若华)商品说明书

核准日期:2007年03月06日修改日期:2009年03月20日修改日期:2010年10月01日修改日期:2015年12月01日 修改日期:2020年05月07日来氟米特片说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名称:来氟米特片商品名称:爱若华英文名称:Leflunomide Tablets汉语拼音:Laifumite Pian【成份】主要成份为来氟米特。
其化学名称为α,α,α-三氟-5-甲基-异噁唑-N-酰基-对甲苯胺。
其化学结构式为:分子式:C 12H 9F 3N 2O 2分子量:270.2 【性状】本品为薄膜衣片,除去包衣后显白色。
【适应症】(1)适用于成人类风湿关节炎,有改善病情作用。
(2)狼疮性肾炎。
【规格】20mg【用法用量】(1)成人类风湿关节炎:口服。
由于来氟米特半衰期较长,建议间隔24小时给药。
为了快速达到稳态血药浓度,参照国外临床试验资料并结合Ⅰ期临床试验结果,建议开始治疗的最初三天给予负荷剂量一日50mg ,之后根据病情给予维持剂量一日10mg 或20mg 。
在使用本药治疗期间可继续使用非甾体抗炎药或低剂量皮质类固醇激素。
(2)狼疮性肾炎:口服。
根据病情选择适当剂量,推荐剂量一日一次,一次20-40mg ,病情缓解后适当减量。
可与糖皮质激素联用,或遵医嘱。
【不良反应】用于类风湿性关节炎的治疗:主要有腹泻、瘙痒、可逆性肝脏酶(ALT 和AST)升高、脱发、皮疹等。
在国外临床试验中,来氟米特治疗1339例类风湿关节炎病人中,发生率≥3%的不良事件包括:乏力、腹痛、背痛、高血压、厌食、腹泻、消化不良、胃肠炎、肝脏酶升高、恶心、口腔溃疡、呕吐、体重减轻、关节功能障碍、腱鞘炎、头晕、头痛、支气管炎、咳嗽、呼吸道感染、咽炎、脱发、瘙痒、皮疹、泌尿系统感染等。
以上不良事件均在安慰剂对照或阳性对照柳氮磺胺吡啶治疗组及MTX 治疗组中发现,其中来氟米特治疗组以腹泻、肝脏酶升高、脱发、皮疹较为明显,在应用过程中应加以注意。
CAS号1158838-45-9_Aurora A Inhibitor I_MedBio使用说明
品牌
货号
中文名称
英文名称
CAS
包装
纯度
MedBio
MED11561
TMCB
TMCB
905105-89-7
50mg
≥98%
品牌
货号
中文名称
英文名称
CAS
包装
纯度
MedBio
MED11424
Angiotensin 1/2 (1-9)
Angiotensin 1/2 (1-9)
34273-12-6
CAS
1、产品物理参数:
常用名
Aurora A抑制剂I
英文名
Aurora A Inhibitor I
CAS号
1158838-45-9
分子量
588.075
密度
1.4±0.1 g/cm3
沸点
无资料
分子式
C31H31ClFN7O2
熔点
无资料
闪点
无资料
2、技术资料:
体外研究
Aurora A抑制剂I是特别选择性的Aurora A抑制剂。Aurora A抑制剂I是一种有用的工具化合物,用于研究Aurora A激酶的细胞作用,而没有抑制Aurora B的并发症[1]。
25mg
≥98%
品牌
货号
中文名称
英文名称
CAS
包装
纯度
MedBio
MED11531
Mirin
Mirin
1198097-97-0
50mg
≥98%
品牌
货号
中文名称
英文名称
CAS
包装
纯度
MedBio
MED11474
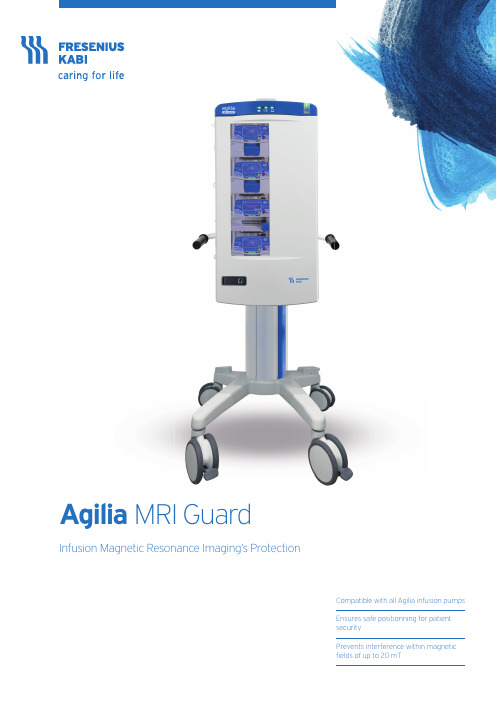
Agilia MRI Guard 病毒防护选择说明书
Agilia MRI Guard Infusion Magnetic Resonance Imaging’s ProtectionCompatible with all Agilia infusion pumpsEnsures safe positionning for patientsecurityPrevents interference within magnetic fields of up to 20 mTC C 15569-0Fresenius Kabi AG61346 Bad HomburgGermany Phone: +49 (0) 61 72 / 0123Agilia is a registered trademark by Fresenius Kabi in selected countries. Due to our policy of continuous product development as well as changes in standards, the features described are subject to change. Please contact us for the most updated information. These medical devices are regulated by health authorities. Some are CE according to European Medical Device Directive. Others are CE0123. Pictures are not contractual.Agilia MRI GuardMain power specificationsAgilia MRI Guard can be on battery or mains-operated FunctionPrimary source for Agilia power outlets and for internal electronics of Agilia MRI GuardConnectorStandard appliance inlet IEC type C14 - male - 3 poles Power supply100 V to 240 V AC - 50 / 60 HzMaximum power (with pumps)75 VAProtective fuse2 fuses, 2 A timed with high breaking capacity - T 2A H 250 V Fuseholder is externally accessible on mains power inlet connectorElectric protectionClass I with protective earth, with 3-wire power cord Cap user interface integrated battery (rechargeable)FunctionBackup battery when mains power is not available or transport of the device Characteristics7.2 V / 2.2 Ah - Lithium Ion rechargeable batteryBattery lifePreventive replacement after 3 yearsSelf protectionsOver-current, over-discharge, over-voltage and over-temperature Charging timeAt least 15 hours with integrated automatic charger when the device is plugged to the mainsBattery-pack of magnet indicatorFunctionBattery to operate the Magnet Indicator independently from the powersupply of the Agilia MRI Guard rackAccessBattery is fixed with two screws. It can be easily replaced with a screwdriverCharacteristics4.5 V / 18 Ah - Primary Alkaline (ZN/MnO2) battery, non rechargeable Battery life 1 year minimum by normal operation (Replacement by annual quality control of Agilia MRI Guard)Self-protectionsOver-current, over-dischargeCompliances with standardsCE0123Complies with the 93/42/EEC Medical directive Safety of electromedical equipmentsComplies with IEC 60601-1:2005 - Amendment A1:2012IP22 protection against dust and splashing liquidDefibrillation-proof type B applied partClass I with protective earthAgilia power outlets are wired on internal functional earth to reduceresidual current that may disturb ECG or EEG devices EMC (electromagnetic compatibility)Complies with IEC 60601-1-2:2014MR conditional Magnetic field max. 20 mT (200 Gauss)Use in MR environment MRI-scanner To be used both with 1.5 Tesla and 3.0 Tesla MRI Scanners Magnetic field To be used in magnetic fields up to 20 mT Magnet Indicator Continuously measures the intensity of the magnetic field emitting a color coded visual LED and audible signal Use of Agilia pumps With 1 up to 4 Agilia pumps Compatible with: Injectomat Agilia, Injectomat MC Agilia, Injectomat TIVAAgilia, Volumat Agilia, Volumat MC Agilia, Agilia SP, Agilia SP MC, Agilia SP MC WIFI, Agilia SP TIVA, Agilia SP TIVA WIFI, Agilia VP, Agilia VP MC, Agilia VP MC WIFI Main technical characteristics DimensionsH/W/D: 151 cm (59.44 in) x 62 cm (24.41 in) x 62 cm (24.41 in)Height including IV Pole: 194 cm (76,38 in)Weight Approximately 47 kg Safety features Electromagnetic field protection Faraday cage Magnetic field measurement Magnet indicator External window Electromagnetic shield PositioningMounted on 4 rolling wheels with break Signaling Magnet indicatorNormal operation Magnetic field < 20 mT Color: green Caution! Magnetic field: 20 – 40 mT Color: yellow The device must be moved back to return to the green zone Warning! Magnetic field > 40 mT Color: red The device must not be used in this zone. Move the unit away immediately!Cap user interface indicators Power status LED Displays mains connection status Color: green Battery status LED Displays battery status and alarm Color: green /yellow /red System status LED Displays internal software status Color: green /yellow /red Alarm centralisation LED Function Displays Agilia Infusion pumps alarms and pre alarms RED High priority alarm YELLOW Medium or low priority alarm。
