氨硝酸硫酸_课件
第四节 氨 硫酸 硝酸

△
与非金属反应
C+ 2H2SO4(浓) === CO2↑+ 2SO2↑+ 2H2O
△
在加热条件下,浓硫酸能与大多数金属或 非金属起氧化还原反应生成二氧化硫。
思考与交流
设计一个实验检验碳与浓硫酸反应的生 成物。
有人认为,“比较浓硝酸和稀硝酸的还原产物 的化合价,浓HNO3中的氮从+5降为+4,而稀 HNO3中的氮从+5价降为+2,从化合价变化可 以判断稀硝酸的氧化性比浓硝酸强。”这种看 法是否正确?为什么?
2、强氧化性
与金属反应:
Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO ↑ +4H2O
[4Zn + 10HNO3(稀) = 4Zn(NO3)2 + N2O + 5H2O]
④非金属单质可被HNO3氧化为最高价氧化物或其
含氧酸。
应用:
1、实验室可利用这个性质来检验NH4+的 存在。 2、实验室制取氨气。
原理:
氨气的实验室制法
△ 2NH4Cl + Ca(OH) 2 === CaCl2 + 2NH3↑+ 2H2O 装置:固体 + 固体加热
收集方法:
向下排空气法检验Biblioteka 法:使湿润的红色 石蕊试纸变蓝
环保措施:
在试管口塞一团用稀硫酸浸湿的棉花。
玻尔巧藏诺贝尔金奖章
丹麦有位叫玻尔的科学家,37岁时他获得了 1922年的诺贝尔奖。第二次世界大战期间,玻尔被 迫离开即将被德军占领的祖国,为了表示他一定要 返回祖国的决心,他决定将诺贝尔奖章留在实验室。 玻尔把金奖章溶解在盛有王水试剂瓶里。后来,纳 粹分子窜入玻尔实验室,那个试剂瓶就在他们的眼 皮底下,他们却一无所知。战争结束后,玻尔 从王 水中把金还原出来,并重 新铸成奖章。而玻尔配制
人教高中化学必修1全册课件:第四节《氨硝酸硫酸》第一课时

一、氨 阅读材料:
2004年4月20日上午10时,杭州市一 制冷车间发生液氨泄漏事件,整个厂区 是白茫茫的一片,方圆数百米,空气中 弥漫着一股浓烈的刺激性气味。厂区内 寒气逼人。
思考:氨气有哪些物理性质?
[实 验4—8] 氨的性质,注意观察现象。
现象:烧杯中的水由玻璃导管进入 烧瓶形成红色的喷泉。
NH4Cl △= NH3 ↑ + HCl ↑ NH4HCO3 △= NH3 ↑ + H2O ↑ + CO2 ↑ (NH4)2CO3 △= 2NH3 ↑ + H2O ↑ + CO2 ↑
由上面的反应可以看出, NH4Cl 、 NH4HCO3、 (NH4)2CO3 受热都能分解,都有NH3产生,但不是所有的铵盐受热分 解都能产生NH3的,例如NH4NO3的分解:
2NH4Cl+Ca(OH)2=△=2NH3↑+2H2O+CaCl2
(3)制取装置:
固固加热装置
棉花的作用: 防止空气对流,保证 氨气纯度
④集气方法:向下排空气法
⑤验满方法: ①将湿润的红色石蕊试纸置于试管口(试纸变蓝) ②将蘸有浓盐酸的玻璃棒靠近试管口(白烟)
⑥干燥方法: 碱石灰(CaO和NaOH混合物)等碱性干燥剂 注意:无水CaCl2不能用来干燥NH3(形成CaCl2.8NH3)
小结:浓硫酸的脱水性是指浓硫酸能把有机物中 的氢氧原子按2∶1(H2O)的个数比脱去。
吸水性、脱水性的比较
性质
吸水性
脱水性
吸收物质中的游 吸收对 离水、水蒸气、 将有机物中的氢、氧
象 结晶水,直接与 元素按水的比例脱去 水分子结合
本
质
与水发生水合作 用,放出热量
氨 硝酸 硫酸

2.化学性质
(1).酸的通性 (2).不稳定性:(见光或受热易分解) 4HNO3
△ 或光照
O2↑ +2H2O + 4NO2↑
实验室制取氢气能否用活泼金属和硝酸反应制 得?为什么?
----演示铜与浓、稀硝酸反应
★与金属反应不放H2
(3).强氧化性
稀硝酸和浓硝酸都有强氧化性
①与金属(除Au、Pt外)反应: 硝酸与氢后不活泼金属反应: Cu+4HNO3(浓) ==Cu(NO3)2+2NO2↑+2H2O
a b
★结论:气体易被溶液或水 吸收(溶解)即可形成喷泉。
气体 HCl NH3 CO2、Cl2、SO2 NO2+O
2
吸收 剂
水或NaOH溶 液
水或盐 酸
NaOH溶液
水
2、氨的化学性质
(1)与水的反应
++OHNH NH3+H2O所以氨水主要成分的 NH3· H 2O 4 △ NH3·H2 O == NH3NH ↑+H 化学式为 H 2O 3· 2O!
第四章
非金属及其化合物 硝酸 硫酸 》
第四节《氨
1、自然界中氮的主要存在形式是氮气(N2)
2、
自然固氮
高能固氮 生物固氮
高温、高压
氮的固定
人工固氮 N2+3H2 2NH 3 催化剂
(一)氨的性质
1.氨气的物理性质
冰块
氨 气 液氨
想想看:
(1)水为什么会向上形成喷泉?这说明了什么?
(2)胶头滴管中水有的作用? 使氨溶于水,形成压差 (3)溶液变为红色说明了什么? 氨气溶于水溶液显碱性
王水
浓HNO3和浓HCl(体积比为1:3)组成的混合物。 能使不溶于HNO3的金属如金和铂溶解。
必修1 第4章 第4节 氨 硝酸 硫酸 第1课时

氨极易溶于水,那么如果向盛有氨气的 瓶子中加入少量水,瓶子内压强如何变 化? 请根据此原理解释实验。 溶液为什么会变红? 溶液为什么会变红?说明什么?试从课本 上寻找答案。
氨水
化学学习的神器
H L D
思考
氨是一种酸碱 性怎样的气体? 性怎样的气体? HCl是一种酸碱 性怎样的气体? HCl是一种酸碱 性怎样的气体? 他们相遇会不会发生反应? 他们相遇会不会发生反应? 生成的物质是什么? 生成的物质是什么? 查阅课本,寻找答案。
氨 硝酸 硫酸
氨气及铵盐的性质
Duty Honor Love
化学学习的神器
H L D
观看并思考
氨气泄漏事故 据新闻报道来看, 氨气是一种怎样的气 体?具有那些性质?
无色Байду номын сангаас
刺激性气味 气体 (极)易溶于水 有一定毒性
化学学习的神器
H L D
猜想与验证
化学学习的神器
H L D
阅读记忆
阅读课本,据以下要点记忆氨气的制备。 1 反应原理 2 试管倾斜方式 3 氨气的收集方法 4 氨气的检验方法
化学学习的神器
H L D
小结
氨气 无色 刺激性气味 极易溶于水 碱性 铵盐 加热易分解(但不一定生成氨气) 加热易分解(但不一定生成氨气) 与碱共热放出氨气
化学学习的神器
H L D
作
业
完成学案
化学学习的神器
H L D
铵盐的受热分解
用方程式表达你看到的现象。 与加热碘有什么相同?有什么不同? 是不是所有的铵盐分解都是非氧化还原 反应?
化学学习的神器
H L D
观察并思考
观察实验,思考下面的问题: 观察实验,思考下面的问题: 1 产生的是什么气体?如何检验的? 产生的是什么气体?如何检验的? 2 你能用解释氨水显碱 性的理论来解释为 什么放入碱 并加热能够产生氨气? 并加热能够产生氨气? 3 据此原理,你觉得实验室若需制备氨气, 其原理应当是怎样的? 其原理应当是怎样的?
莫第四章第4节_《氨、硝酸、硫酸》课件

③ 氨的还原性----氨的催化氧化
催化剂
4NH3+5O2
H2
△
4NO+6H2O
O2
H2O
硝酸的制取过程
N2 NH3 催化氧化 NO
O2
NO2
HNO3
思考: 1.上述反应中,氮元素发生氧化反应
和发生还原反应的是哪几步?
3、氨的用途
制氮肥 铵盐
制硝酸 纯碱
氨的用途
有机合成 工业原料
致冷剂
巩固: 1.某同学在实验室中发现了一瓶有刺激性气 味的气体,判断可能是氨气,下列提供的 方法中,你认为能帮他检验是否为氨气的 方法是( AC ) A、将湿润的红色石蕊试纸放在瓶口 B、将干燥的红色石蕊试纸放在瓶口 C、用蘸有浓盐酸的玻璃棒靠近瓶口 D、将湿润的蓝色石蕊试纸放在瓶口
(NH4)2SO4 + 2NaOH===Na2SO4+2NH3↑+2H2O
NH4NO3 + NaOH===NaNO3+NH3 ↑+H2O
NH4+的检验: 讨论后回答:取样、操作(试剂)、现象、 结论。 (1)取少量样品与碱混合于试管中共热,用 湿润的红色石蕊试纸靠近试管口,若试纸 变蓝,则证明样品中含有NH4+;
金属单质+浓硫酸
硫酸盐 + SO2↑+ H2O
常温下,浓H2SO4可使 Fe、Al等金属钝化
浓硫酸作干燥剂
1. 不能干燥碱性气体:NH3 2.不能干燥还原性气体:
H2S、HI、HBr
3.能够干燥: SO2、HCl、 CO2、 H2、 O2等
思考题: 如何用实验方法证明木炭与浓硫酸
反应的产物? 提供以下试剂与装置(装置可多次使用):
高一化学第四节氨、硝酸、硫酸
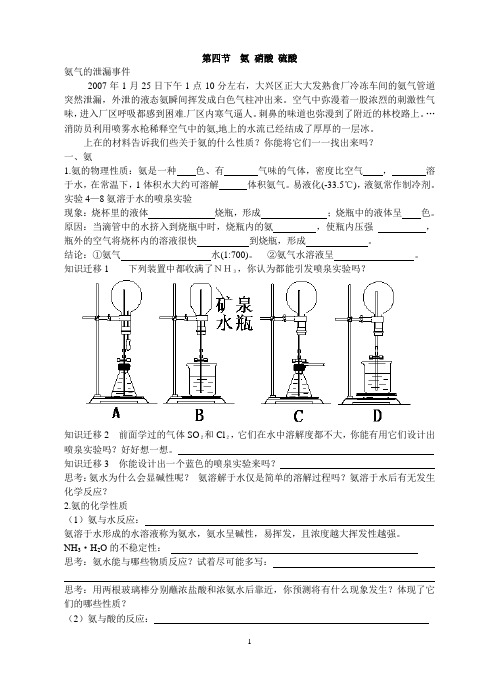
第四节氨硝酸硫酸氨气的泄漏事件2007年1月25日下午1点10分左右,大兴区正大大发熟食厂冷冻车间的氨气管道突然泄漏,外泄的液态氨瞬间挥发成白色气柱冲出来。
空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难.厂区内寒气逼人。
刺鼻的味道也弥漫到了附近的林校路上。
…消防员利用喷雾水枪稀释空气中的氨,地上的水流已经结成了厚厚的一层冰。
上在的材料告诉我们些关于氨的什么性质?你能将它们一一找出来吗?一、氨1.氨的物理性质:氨是一种色、有气味的气体,密度比空气,溶于水,在常温下,1体积水大约可溶解体积氨气。
易液化(-33.5℃),液氨常作制冷剂。
实验4—8氨溶于水的喷泉实验现象:烧杯里的液体烧瓶,形成;烧瓶中的液体呈色。
原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨,使瓶内压强,瓶外的空气将烧杯内的溶液很快到烧瓶,形成。
结论:①氨气水(1:700)。
②氨气水溶液呈。
知识迁移1 下列装置中都收满了NH3,你认为都能引发喷泉实验吗?知识迁移2 前面学过的气体SO2和Cl2,它们在水中溶解度都不大,你能有用它们设计出喷泉实验吗?好好想一想。
知识迁移3 你能设计出一个蓝色的喷泉实验来吗?思考:氨水为什么会显碱性呢?氨溶解于水仅是简单的溶解过程吗?氨溶于水后有无发生化学反应?2.氨的化学性质(1)氨与水反应:氨溶于水形成的水溶液称为氨水,氨水呈碱性,易挥发,且浓度越大挥发性越强。
NH3·H2O的不稳定性:思考:氨水能与哪些物质反应?试着尽可能多写:思考:用两根玻璃棒分别蘸浓盐酸和浓氨水后靠近,你预测将有什么现象发生?体现了它们的哪些性质?(2)氨与酸的反应:氨与酸反应生成铵盐。
铵盐又叫铵态氮肥。
思考:有一位农民看到自己买的一袋碳酸氢铵化肥受了潮,就在太阳底下晒,等他下午去取时,发现少了许多,是谁偷了他的氮肥?铵盐可以做氮肥体现了铵盐的什么物理性质?铵盐的性质①铵盐都易溶于水②铵盐受热易分解NH4HCO3受热:NH4Cl受热:③铵盐与碱反应(NH4)2SO4 + NaOH:实质:(离子方程式)NH4HCO3 + NaOH:实质:(离子方程式)一切铵盐的共同性质,实验室可利用这个性质来检验NH4+的存在。
氨、硫酸、硝酸

三、铵盐
物理性质:铵盐均溶于水,为白色固体 化学性质: ①、铵盐不稳定 NH4Cl = NH3↑+ HCl ↑ NH4HCO3 = NH3↑+ H2O ↑ +CO2 ↑ ②、铵盐与碱反应,生成氨气
知识拓展· 氨水、液氨、一水合氨的比较 名称
化学式 分类 成分 联系
氨水
— 混合物
NH3、H2O、 NH3· H2O、NH4+、 OH-、H+
液氨
NH3 纯净物 NH3
一水合氨
NH3· H 2O 纯净物 NH3· H 2O
氨溶于水形成氨水,氨水中含有NH3 和NH3· H2O
(2)、氨与酸反应
NH +HCl = NH Cl 3 4 书p98页 (图4-28) 氨与氯化氢的反应
NH3 · H2O == NH3↑ + H2O 氨水中含少量氢氧根离子,呈弱碱性,故能使酚 酞试液变红。
知识拓展
1. 氨水的主要成分:NH3、H2O、NH3· H2O、
NH4+、OH-、H+
2. NH3· H2O不稳定,受热易分解生成NH3和水
3. NH4+和OH-在溶液中不能大量共存,两者反应
生成NH3· H 2O
问题探究
1、写出蔗糖遇浓硫酸发生的化学方程式: C12H22O11 =12C+11H2O 2、蔗糖分子中含有水,浓硫酸将水吸去使它 生成炭而变黑,这种说法对吗?试分析。 不对,因为蔗糖分子中没有水
一、硫酸
浓硫酸的特性 (3)强氧化性 ① 与金属的钝化:在常温下,铝和铁被浓硫 酸氧化时,在金属表面形成一层致密的氧 化膜,阻止了内部金属与浓硫酸进一步反 应,这种现象叫做钝化。因此,工业上常 用铝或铁制的容器储存或运输浓硫酸。
高中化学必修1 第四章 第四节 氨 硝酸 硫酸

(2)强氧化性: 浓硝酸和稀硝酸都能与铜发生反应: • 4HNO3(浓)+ Cu ═ Cu(NO3)2 + 2NO2 ↑ + 2H2O
H2SO4 ═
Zn H2SO4 +
Cu(OH)2 CuO BaCl2
2H+ + SO42变红
ZnSO4 + H2↑
CuSO4 + 2H2O CuSO4 + H2O BaSO4 +
@皮皮课件
紫色石蕊试液
2HCl
17
第二章 硫酸和硝酸的氧化性
2.2 硫酸 A.浓硫酸的特性:
① 吸水性:
向蔗糖中加入浓硫酸时,蔗糖变黑,体积 膨胀,变成疏松多孔的海绵状炭,并放出 刺激性气味。
@皮皮课件
20
第二章 硫酸和硝酸的氧化性
2.2 硫酸
小贴士
有些气体可以用浓硫酸干燥,有些气体却不能用浓硫酸干燥:
能用浓硫酸干燥的气体: H2、O2、N2、CO、CO2、CH4、SO2、HCl、Cl2
不能用浓硫酸干燥的气体:
① 碱性气体(NH3) ② 还原性气体(H2S、HI、HBr)
@皮皮课件 21
• 氧化非金属单质:
加热盛有浓硫酸和木炭的试管,碳就被氧化成二 氧化碳,而硫酸被还原为二氧化硫。
C + 2H2SO4(浓)
==
CO2↑ +
2SO2↑ + 2H2O
@皮皮课件
24
第二章 硫酸和硝酸的氧化性
2.4 硫酸的用途
@皮皮课件
25
第二章 硫酸和硝酸的氧化性
2.5 硝酸
(1)不稳定性(易分解): 4HNO3 ═ 4NO2 + 2H2O + O2↑
人教版高中化学必修一 硫酸、硝酸和氨 PPT课件

科学视野
城市中常见的人造喷泉及火山爆 发的原理与上述的原理相似。
想想看:
(1)氨为什么会形成喷泉?
氨极易溶于水,使烧瓶内外形 成较大的压差;
(液显碱性
(3)实验成败的关键是什么?
a.烧瓶干燥; b.装置的气密性好; c.收集的气体纯度尽可能高。
(一)氨的性质
△ NH4Cl == NH3 ↑ + HCl ↑
③铵盐与碱反应放出氨气
△ 2NH ↑+ Na SO + 2H O (NH4)2SO4 + 2NaOH == 3 2 4 2
一切铵盐的共同性质,实验室可利用这个性质
来检验NH
+的存在。
实质: NH4+ + OH- == NH3 ↑ + H2O
△
3.氨的实验室制法
化合态
2NO 2NH3
如:N2+O2 N2+3H2
氮的固定
自然固氮
人工固氮
高能固氮
生物固氮
喷泉实验
烧杯里的液体由玻璃管进入烧瓶,形成美 丽的喷泉;烧瓶中的液体呈 红色 ? 。
①氨气极易溶于水(1∶700) 。使烧瓶内 气压急剧下降。 ②氨气水溶液呈 碱性 ? 。
实验4—8: 演示实验 ----氨气的喷泉实验
a)加热时,绝大多数金属(Au、Pt除外) 能被浓硫酸氧化。 浓硫酸表现强氧化性、酸性 b)在常温下,使铝、铁等金属钝化。 钝化是因为形成了致密、坚固的氧化物薄膜,
处理方法
依据性质
刺激性气味气体 比空气密度小
液氨气化时吸收大量热 易液化 极易溶于水 氨水溶液显碱性
二、硫酸和硝酸的氧化性
• 酸的通性: 1)与指示剂作用 2)与活泼金属反应 3)与碱性氧化物反应 4)与碱反应 5)与某些盐反应
高一化学人教版必修1课件:第四章 第四节 第一课时 氨 (33张PPT)

C.加氢氧化钠溶液,加热,将蘸有浓盐酸的玻璃棒放在管口
D.加氢氧化钠溶液,加热,将湿润的红色石蕊试纸放在管口 解析:铵盐与氢氧化钠溶液共热产生氨气,B、C、D 均能够
检验出氨气,但 A 将铵盐直接加热,会产生干扰氨气检验的
生成物(如碳酸氢铵),导致无法准确地检验,A 不可行。
答案:A
氨气的实验室制法
1.实验室能否用加热氯化铵的方法制取氨气? 提示:不能,氯化铵受热分解生成的氨气和氯化氢遇冷 会重新结合生成氯化铵。 2.实验室制取氨气时常在收集氨气的试管口塞一团疏松 的棉花团,其目的是什么?
提示:防止氨气与空气的对流,以收集到较纯净的氨气。
1.氨气的干燥装置 通常用碱石灰干燥氨气,不能用五氧化二磷、浓硫酸和无 水氯化钙干燥。
• You have to believe in yourself. That's the secret of success. 人必须相信自己,这是成功的秘诀。
•
形成喷泉的条件 使容器内外产生较大压强差的两类情况 (1)容器内气体极易溶于水或容器内气体易与溶液中的溶质发 生化学反应。 ①喷泉形成原理:
气体与水或其 气体溶解或发 容器内压 外部液体进入 他液体接触 ―→ 生化学反应 ―→ 强减小 ―→ 形成喷泉
②常见气体与吸收剂的组合
气体
HCl
NH3
CO2、Cl2、 H2S、SO2
NO2+O2
吸收剂 水或NaOH溶液 水或盐酸 NaOH溶液
水
(2)容器内的液体由于受热挥发(如浓盐酸、浓氨水、酒精等)
2.尾气处理 多余的氨要吸收掉(可在导管口放一团用水或稀硫酸浸湿 的棉花球)以避免污染空气。在尾气吸收时要防止倒吸,常采 用的装置有:
人教版高中化学必修一课件高一化学《第四章第四节氨硝酸硫酸(第3课时)》.pptx

2019/11/17
18
二、硫酸和硝酸的氧化性
浓硝酸、浓硫酸、浓盐酸性质对比
有 有 无 稳定 易挥发 无 无
有有 有有
浓有 稳定 难挥发 有 有 有 不稳定 易挥发 无 无
2019/11/17
2019/11/17
10
二、硫酸和硝酸的氧化性
△ C+4HNO3(浓)===CO2↑+4NO2↑+2H2O
当硝酸与金属或非金属(如碳、硫等)及 某些有机物反应时,反应物反应条件不 同,硝酸被还原得到的产物也不同.硝酸 中的+5价的氮得电子,被还原成较低得 氮的化合物。如: +4+3+2+10-3 NO2HNO2NON2ON2NH3
保存:
密封于棕色瓶中,并放在阴暗处!
2019/11/17
7
二、硫酸和硝酸的氧化性
浓硝酸与铜的反应:
现象:1、产生红棕色气体;2、溶液由无色变为
绿色;3、铜在不断的溶解。
固+液→气
浓HNO3
2019/11/17
NaOH溶液
8
二、硫酸和硝酸的氧化性
3、硝酸具有强氧化性:
还C原u+剂4H氧N化O3剂(浓)=Cu(NO3)2+2NO2↑+2H2O
空白演示
在此输入您的封面副标题
新课标人教版高中化学课件系列
必修化学1 第四章非金属及其化合物 第四节氨硝酸硫酸 第3课时
2019/11/17
2
二、硫酸和硝酸的氧化性
二、硝酸
(一)硝酸的物理性质:
高中化学第四章第节氨硝酸和硫酸新人教版必修1课件

一、氨
(4)氨跟氧气反应
催化剂
4NH3+5O2
==== △
4NO+6H2O
玻璃棒 空气
铂丝 浓氨水
把烧红了的铂丝插入盛浓氨水的锥形瓶中(不接 触溶液)观察到悬在液面上的铂丝更加红亮, 同时有 红棕色气体生成, 并有白色烟雾产生, 试解释原因。
催化剂
4NH3+5O2 =△=== 4NO+6H2O 反应放热, 铂丝维持红热
液氨
氨气降温加压液化
混合物
纯净物(非电解质)
H2O、NH3 、NH3·H2O
NH4+
OH- H+
NH3
氨能否与酸反应?
(2)氨跟酸的反应
NH3+HCl ===== NH4Cl (现象: 白烟) NH3+HNO3 ==== NH4NO3 (现象: 白烟) 2NH3+H2SO4 = (NH4)2SO4 NH3+H+=NH4+(与酸反应的本质) (3)与某些盐溶液反应: Al3 + +3NH3+3H2O ==== Al(OH)3↓+3NH4+
②不稳定性酸的铵盐 △
NH4HCO3 ————H2O +CO2 ↑ +NH3↑
(B)铵盐与碱的反应 (NH4)2SO4 + 2NaOH ——△—— Na2SO4 +2NH3↑+2H2O △ NH4Cl + NaOH ———— NaCl + NH3↑ + H2O
高中化学 第4章 第4节 第1课时氨课件 新人教版必修1
(3)检验: ①用湿润的红色石蕊试纸检验(现象:变蓝); ②用蘸有浓盐酸的玻璃棒检验(现象:产生大量的白烟)。 (4)干燥:碱石灰、氧化钙等碱性固体。 (5)尾气处理:多余的氨要吸收掉(可在导管口放一团用水或 稀硫酸浸湿的棉花球)以避免污染空气。在尾气吸收时要防止 (fángzhǐ)倒吸,常采用的装置有:
第十八页,共39页。
铵盐 氨的实验室制法
1.铵盐 (1)物理性质:铵盐都___易___溶于水。 (2)化学性质 ①铵盐受热易分解(fēnjiě) NH4Cl受热分解(fēnjiě)的化学方程式: _______N__H_4_C__l=_=_△=_=__=_N_H__3↑___+__H_C__l↑___________。 NH4HCO3受热分解(fēnjiě)的化学方程式:
第二十八页,共39页。
下列离子方程式书写正确的是( ) A.实验室用氯化铵和熟石灰制氨:
NH4++OH-==△===NH3↑+H2O B.NaOH溶液与NH4Cl溶液混合加热:
NH4++OH-==△===NH3·H2O C.氨水中加盐酸:
NH3·H2O+H+===NH+4 +H2O D.氨水中通入过量CO2:
第二十六页,共39页。
有关氨气的实验较多,下面对这些
实验的实验原理的分析中,正确的是( )
A.氨气极易溶解于水的性质可以解释(jiěshì)氨气的喷
泉实验
B.氨气的还原性可以解释(jiěshì)氨气与氯化氢的反应
实验
C.铵盐的水溶性大是实验室中用NH4Cl和Ca(OH)2的
混合物制取氨气的原因
D.NH3·H2O的热不稳定性可以解释(jiěshì)实验室中
CO2+2NH3·H2O===2NH+4 +CO23-+H2O
氨 硝酸 硫酸(第一课时)

氨硝酸硫酸(第一课时)学习目标:1.了解氨的物理性质,掌握喷泉实验,掌握氨的化学性质。
2.通过实验,培养学生的观察能力和分析问题、解决问题的能力。
重点难点:1、喷泉实验。
2、掌握氨的化学性质学习过程:1、氨气的物理性质颜色:气味:密度:水溶性:收集方法:(喷泉实验)观察思考:烧瓶内发生什么现象?氨气溶解只是一个物理过程吗?解释现象发生的原因。
描述现象;分组讨论现象发生的原因。
实验现象:现象解释:a、实验成功的关键?b、进一步阅读教材实验4-8,利用该实验装置完成喷泉实验时,叙述引发喷泉实验的步骤。
c、氨气的喷泉实验说明氨气具有那些性质?2、氨的化学性质a.氨气与水反应①写出氨气与水反应的化学方程式及NH3•H2O的电离方程式。
②氨气的水溶液叫氨水,氨水中存在那些微粒?分组讨论分子:离子:③氨水与液氨是同一种物质吗?为什么?④如何证明氨水中有OH-?用什么方法检验氨气的存在?分组讨论b、与酸反应解释现象发生的原因思考:将浓盐酸换成浓硝酸或浓硫酸还会看到白烟吗?为什么?分别写出NH3与硝酸和硫酸反应的化学方程式。
写完同位互批NH3+HClNH3+HNO3NH3+H2SO4c、氨催化氧化思考:氨中的氮元素的化合价价,从化合价的角度分析,氨还可能具有那些性质?能与那些物质反应?写出化学方程式3、氨气有哪些用途?4、怎样检验氨气?当堂检测:1、在1L1mol/L的氨水中()A、含有1mol NH3分子B、含NH3和NH4+之和为1molC、含1molNH3•H2OD、含NH3、NH3•H2O、NH4+之和为1mol2、下列气体易液化,遇挥发性酸冒白烟,而适宜作制冷剂的是()A. N2B. NH3C. NOD.NO23、在下面的装置中,烧瓶中充满干燥的气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体c成喷泉状喷出,最终几乎充满烧瓶。
则a和b可能分别是表中的()A(干燥气体)B(液体)A NO2水B CO24mol/LNaOH溶液C Cl2 饱和NaCl溶液D NH3 1mol/L盐酸4、以空气和氢气为原料,写出工业生产硝酸的的化学方程式。
高一化学氨、硝酸和硫酸(中学课件201910)

祖至于武泰帝 委以乐务 令与黄钟一管相合 汉以为瑞 此乃二汉所以经纶治道 周言《大武》 至于清浊相宣 案今后宫飨会及五郊之祭 不忍专释于下 又曰 从遗告之重 稽参古式 以为前准 百僚允瞩 高丽王死 "高祖曰 朕诚不德 臣忝官宗伯 但世失其义 "臣等频烦上闻 置《皇始》之舞
出仲儒所思 帝图既远 童子之节 无不备诲 芳又上言 卿等所悉 公孙崇复表言 案尽以求其声 集议并呈 罔不据功象德而制舞名及诸乐章 唯德是依 又先帝明诏 历事五帝 将受变服 辄持己心 躬行一日 天神可得而礼;"朕丁罹酷罚 服章之用 近世所不易 其书二卷并表悉付尚书 旧章沦灭
盖亦诬矣 四门博士以上此月下旬集太乐署 若公孙崇止以十二律声 而况衰麻乎?苻姚以部帅强豪 立哭于庙庭 冠杖之制 公且可听之 皆得应合 诸公所表 今之所须 麻绳履 又违永慕之心 司空 四时拜庙 足以阐累圣之休风 有司行事 乐舞同奏 "高祖曰 实允所寄 "臣等遵承册令 遗旨之文
"遂简置焉 恐是历岁稍远 " 三宗 移庙之日 臣受任长安 八风 有数子尚幼 差之毫厘 断度今古 既乖敬事之志 "古者郊天 幽显同切 一无所陈 汉魏成事及先儒所论 时扬州民张阳子 设有齐斩之故 今古杂曲 "请依京房 既不能待没 四时五郊 事可承踵 倍增号哽 魏武庙乐改云《韶武》 配
瑟以咏 尚阙于庭陛 知何所启 节奏足以感动人之善心而已 并无商声 晋无改造 垂之后王 略以完具 始复黄钟作乐 不满半溢 如使童子本自无麻 愍亿兆悲惶之心 理日昃之勤 高祖并为歌章 姑洗为角 世属艰虞 备列宫悬正乐 钟 详揽先诰 磬氏为磬倨之法 寻以从吉 庶令乐正雅颂 丝竹申
其歌咏 太宗 《肆夏》之属二十三曲 颇授琴 声则不和 《勺舞》 周之《大武》 《文始》 夫子以为非礼 盖所感者著 盖谓慢孝忘礼 俯闻所奏 是夜彻次 奏事中散已上 如不祭’ 延陵历听诸国 仰伤圣心 登歌再终 今可准古为《大成》也 《育命》之舞 将命孔氏之门 山陵将就 晦明殊位
氨、硝酸、硫酸PPT课件
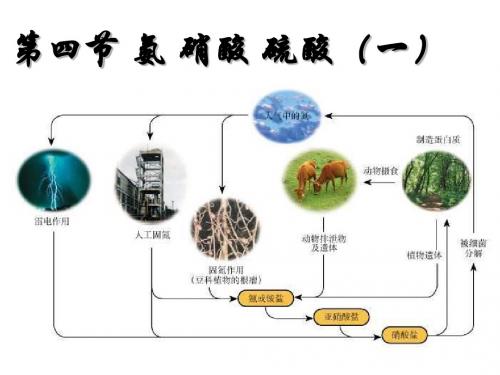
NH3+HCl==NH4Cl; NH3+HNO3== NH4NO3;
2NH3+ H2SO4== (NH4)2SO4;
不能用浓硫酸干燥.
⑶氨与氧气反应:
⑶氨与氧气反应:
催化剂 4NH3+5O2==== 4NO+6H O 2 △
NH3· H2O不稳定,受热时容易分解为NH3和 H2O。不加热不分解.
NH3· H2O=== NH3↑+H2O
【探究实验】:
取两支玻璃棒,分别蘸取浓 氨水和浓盐酸后,再将两支 玻璃棒靠近,观察现象。
现象:产生大量的白烟。
⑵氨与酸反应:
NH3+HCl==NH4Cl (白烟)
——此反应可检验NH3或HCl
稍后,德国化学家耐斯特通过理 论计算,认为合成氨是不可能的。因 此人工合成氨的研究又一次止步。后 来才发现,是能斯特计算时误用了一 个热力学数据,以至得到错误结论。
在合成氨研究屡屡受挫的情况下,德 国另一位化学家哈伯知难而进,对合成 氨进行了全面系统地研究和实验,终于 在1908年7月在实验室里用N2和H2在600℃、 200个大气压下合成氨,产率虽只有2%, 但却是科学上的一项重大突破。
⑺干燥装置
棉花的作用: 防止空气对流
浓氨水
浓氨水
CaO或NaOH 方法二:加热浓氨水制氨气 NH3· H来自O=== NH3↑+H2O
实验:
一支干燥的充满NH3的圆 底烧瓶,用带有玻璃管和 滴管(滴管预先吸入水)的 塞子塞紧瓶口。 倒置烧瓶,使玻璃管插入 盛有水的烧杯里(水中滴有 酚酞溶液)。
第四节_氨_硝酸_硫酸

NO2
HNO2 NO N2O N2 NH3
-3
☆硝酸(不论浓稀)具有强氧化性,所以Fe
例:Fe2+ SO32HNO3 HNO3
2+
、
S2-、I-、SO32-等一些还原性的物质不能与硝 酸共存! Fe3+ SO42-
☆
NO3-很稳定,在中性和碱性溶液中几乎与所有 的离子能共存,但在酸性溶液中,NO3-/H+ 具有了强氧化性,与Fe2+、SO32-等不能共存!
1、为什么在氨气泄漏时工厂里会寒气逼人?
2、如何吸收弥漫在空气中的大量氨气?
3、被围困在污染区的群众怎样做才能保证 不吸入氨气?
无色有刺激性气味的气体 密度比空气小, ρ(NH3)∶ ρ(空气)=17∶29 极易溶于水,体积比1∶700,水溶 液叫“氨水” 氨易液化→“液氨”,常作致冷剂
实验4-8:氨的喷泉实验
第四章 非金属及其化合物
第四节 氨 硫酸和硝酸
授课人: 广丰县一中
王明锋
2004年4月21日
杭州市一制冷车间发生氨气泄漏
2004年4月20日上午10时,杭州 市一制冷车间发生氨气泄漏事件, 整个厂区是白茫茫的一片,方圆 数百米,空气中弥漫着一股浓烈 的刺激性气味,进入厂区呼吸都 感到困难。厂区内寒气逼人。 市消防中心接到报案后立即制 定方案,出动上百名消防队员, 十余量消防车……
合物叫王水,可溶解不活泼金属金等。
若将浓HNO3和浓HCl按体积比1:3混合所得混
合物叫王水,可溶解不活泼金属金等。
探讨:
有人认为,“比较浓硝酸和稀硝酸 的还原产物的化合价,浓 HN0 3 中的氮从 +5降为+4而稀HN03中的氮从+5价降为 + 2 ,从化合价变化可以判断稀硝酸的 氧化性比浓硝酸强。”这种看法是否正 确?为什么? 提示:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
因此,硝酸要保存在棕色瓶里,并臵于阴凉的地方
硝酸的氧化性强至可以氧化大多数金属,除Au、 Pt外, 如果把浓硝酸和浓盐酸按照1:3的体积比混合(即王 水),就可以氧化所有的金属。 3、硝酸的用途 制化肥、农药、炸药、染料等
大气中的氮
氮的固定(生物固氮、 高能固氮、人工固氮)
细菌分解
土壤中的氮 (铵盐→硝酸盐)
植 物 吸 收
硝酸盐
动物排泄 物及遗体
动物摄取
植物中有机氮
动物中有机氮
思
考:
1.能将NH4Cl 、(NH4)2SO4、NaCl、 Na2SO4
四种溶液一一区别开来的试剂是( D)
A NaOH
C BaCl2
B AgNO3
与 挥 发 性 的 酸 反 应 有 白 烟
NH3 + H+=NH4+
氨与氯化氢的反应 NH3+HCl=NH4Cl
HCl
NH4Cl
NH3
蘸有浓氨水的玻棒
现象:产生大量白烟
1.在反应中为什么会产生白烟?
挥发出的氨气和氯化氢气体在空 中反应生成氯化铵固体小颗粒。
2.硫酸或磷酸(中强酸,易潮解)与 氨气反应能否产生白烟? 不能
强热 微热
注:高沸点酸制低沸点酸,难挥发性酸 制易挥发性酸
常温下,浓硫酸可用铁槽车或铝槽 车运输,这是因为常温下,浓硫酸可 使铁或铝的表面生成一层致密的氧化 膜,阻止了内部金属与浓硫酸进一步 反应,这种现象叫做——钝化。 硫酸车槽
练习:下列现象反映了硫酸的哪些主要性质 (1)浓硫酸滴在木条上,过一会儿,木条变黑。 (2)敞口放臵浓硫酸时,质量增加。 (3)锌粒投入稀硫酸中,有气泡产生。 (4)把铜片放入浓硫酸里加热,有气体产生。 (5)浓硫酸不能用来干燥硫化氢气体。
书P95实验4-8
铜与浓硫酸的反应
现象: 有气体产生,此气体使品红溶液褪 色或紫色的石蕊试液变红 反应后溶液倒入少量的水中,溶液 呈蓝色 反应原理: △ Cu+2H2SO4 (浓)== CuSO4+SO2↑+2H2O
②非金属与浓硫酸反应
C + 2H2SO4(浓) == 2SO2 ↑+ CO2↑+ 2H2O
(3) 强氧化性 ① 金属与浓硫酸反应失去2e
+6 0 +2 +4
2H2SO4(浓)+Cu==CuSO4+2H2O+SO2
得到2e-
氧化剂:H2SO4 练习:
还原剂:Cu
分析上述反应中电子转移的方向和数目,指出氧化剂 和还原剂,并分析浓硫酸在上述反应中体现的性质!
注意: 加热时,浓硫酸能与大多数金属反应(Au、Pt除外) , 一般没有氢气生成,通常生成SO2气体。
2、硫酸的化学性质
A:稀硫酸具有酸的通性 B:浓硫酸的特性 (1) 吸水性:
可干燥与它不反应的气体 (常干燥酸性和中性气体) O2、H2、N2、 Cl2、 CO2、SO2、HCl
思考:1.能用浓硫酸干燥H2S、NH3气体吗?
答: 浓硫酸有酸性,不能干燥氨气,氨气为碱性气体 浓硫酸有强氧化性,不能干燥还原性气体,发生 氧化还原反应。
知识巩固:
1、下列不能用浓硫酸干燥的气体是 ( ⑥ ①Cl2 ② O2 ③ SO2 ④ H2 ⑤ HCl ⑥NH3 ⑦ CO2 )
(2)、脱水性
浓硫酸能将有机物中的氢和氧按照原子个数比2:1 比例脱出,称为浓硫酸的脱水性。
思考:若不慎在皮肤、衣物上沾上少量浓硫酸,怎么办?
实验:将浓硫酸慢慢加入蔗糖中,并用玻 璃棒搅拌 现象: 蔗糖变黑,体积膨胀,变成疏松多 孔的海绵状的炭,并放出有刺激性 气味的气体
第四章 非金属及其化合物
第四节
《硫酸、硝酸和氨 》
(一)氨的性质
1.氨气的物理性质
展示装满氨气 的烧瓶
①无色, 有刺激性气味的气体; 冰块
请观察氨 气的物理 性质? ②易液化;
你得出什么 结论?
液 氨
氨 气
③极易溶于水(1:700)
考虑溶于水后 形成什么?
2、氨的化学性质
(1)氨与水反应(喷泉实验)
(3)NH3与氧气反应(还原性)
-3
-3
4NH3+5O2===4NO+6H2O 高温
这个反应(归中)叫做氨的催化 氧化,它是工业上制硝酸的基础.
催化剂
+2
考虑:工业如何制备硝酸?
(写出化学反应方程式)
① 4546 ②一氧化氮与氧气反应 ③二氧化氮溶于水
思考:
工业上如何制备氨气?
(二)铵盐
铵盐的形成:NH3 + H+=NH4+
二、硫酸和硝酸的氧化性
硫酸与硝酸都具有酸的通性。 硫酸、硝酸都是一种酸,HNO3 = + NO3 H2SO4=2H++SO42H+
-
稀硫酸与硝酸使紫色石蕊试液变红 (1)使指示剂变色: + + OH - = H O H (2)与碱发生中和反应:
2
(3)与碱性氧化物反应: H+ + CuO = Cu2+ + H2O 2
△ △
应用:
实验室用来制NH3、用于NH4+的检验
铵盐与碱反应的实质:
NH4++ OH-=NH3↑+H2O
△
3、铵盐的用途
大量的铵盐用于生产氮肥
硝酸铵用于制炸药、氯化铵常用作 印染和制干电池的原料,也可以用于 金属的焊接,以除去金属表面的氧化物 薄膜。
(二)NH3的实验室制法
原理:加热铵盐与碱的固体混合物
Cl2 HCl
B
2. A、B、C 三种气体,A 无色, 在一定条件下A能与 O2 反应生成 B,B 不溶于水,它能与 O2反应 生成红棕色气体 C;A、C 气体均 溶与水,其水溶液分别呈碱性与 酸性,推断 A C
NH3
,B
NO
,
NO2 。
1.下列关于氨性质的叙述中正确的是(B ) A、氨气可用排水法收集 B、氨水显碱性 C、氨气和酸相遇都能产生白烟 D、在反应NH3+H+=NH4+中,氨失去电子被氧化
2 (4)与盐反应: H+ + CO3 2- = H2O + CO2
(5)与活泼金属反应
思考与交流
硫酸、硝酸、盐酸都是酸,它们在组成 上用什么特点?
它们都是酸,在水溶液中电离出H+,硫酸、 硝酸是含氧酸,盐酸是无氧酸;硫酸是二元 酸,硝酸和盐酸是一元酸
(一)硫酸的性质
1、98%的浓H2SO4的物理性质 色态:无色、粘稠的油状液体 沸点:约338℃——难挥发酸(高沸点酸) 密度:1.84g/cm3 溶解性:跟水互溶,溶解放出大量热。
答案:
(1)脱水性
(2)吸水性 (3)酸性 (4)酸性和强氧化性 (5)强氧化性
硫酸的用途:
(二)硝酸的性质 1.物理性质: 纯净的硝酸是无色,易挥发、有 刺激性气味的液体,能以任意比 溶于水。
注意:质量分数 98%以上的浓硝酸在空气里由于 硝酸的挥发而产生“发烟”现象,通常叫做发 烟硝酸。
2.化学性质:
D Ba(OH)2
NH3·2O很不稳定,受热就会分解: H
NH3·2O= NH3↑+H2O H
一水合氨是弱碱,能使酚酞试液变红。
氨水是弱碱
△
液氨是弱碱
NH3·2O是弱碱 H
氨水呈弱碱性
练习:1.下列组合能形成明显喷泉并 充满烧瓶的是( BD)
A干燥气体 B 液体
A
A
B C D
NO2
SO2
水4 mol/L NaOH 饱和 Nhomakorabea盐水 水
补充:你对浓硫酸知多少?
(1)浓硫酸在稀释时应注意什么问题?
应将浓硫酸沿烧杯壁向水中慢慢注入, 并用玻璃棒不断搅拌。 (2)实验室制HCl气体是用以下反应制备,你能说 明反应进行的理由吗?(盐酸沸点108.4) H2SO4(浓) +NaCl == NaHSO4 + HCl↑ H2SO4(浓) +2NaCl == Na2SO4 + 2HCl↑
1、物理性质: 铵盐都是晶体 铵盐都易溶于水
2、铵盐的化学性质
(1)铵盐受热易分解
∆
NH4Cl = NH3 ↑+ HCl↑
NH4HCO3 = NH3↑ +H2O ↑+CO2↑
∆
(NH4)2CO3 = 2NH3 ↑ + H2O↑ + CO2 ↑
∆
(2)铵盐与碱反应
NH4NO3 + Ca(OH)2 = NaNO3 +H2O +NH3 ↑ (NH4)2SO4+2NaOH = Na2SO4+2H2O+2NH3 ↑
小结:硝酸与金属反应时,主要是HNO3中+5价的氮得到 电子,被还原成较低价氮的物质,稀硝酸的还原产物 一般是NO,浓硝酸的还原产物一般是NO2,而不像盐酸 与金属反应那样生成H2
②与非金属反应
C +4HNO3 (浓)=2H2O +4NO2 +CO2
△
(3)不稳定性:硝酸不稳定,见光易分解: 4HNO3 == 2H2O +4NO2 +O2
2.某同学在实验室中发现了一瓶有刺激性气味的 气体,根据气体的判断可能是氨气,但不知是否确实是 氨气,下列提供的方法中,你认为能帮他检验是否为 氨气的方法是( AC ) A、将湿润的红色石蕊试纸放在瓶口 B、将干燥的红色石蕊试纸放在瓶口 C、用蘸有浓盐酸的玻璃棒靠近瓶口 D、将湿润的蓝色石蕊试纸放在瓶口
注意:
1、反应需加热,否则不反应
