化学原料药生产企业情况表
化学制药财务分析报告(3篇)

第1篇一、报告概述本报告旨在对某化学制药公司的财务状况进行深入分析,通过对公司财务报表的解读,评估其盈利能力、偿债能力、运营能力和成长能力,为公司未来的经营决策提供参考。
报告分析的时间范围为2020年至2022年,涉及的主要财务报表包括资产负债表、利润表和现金流量表。
以下是对该化学制药公司财务状况的分析。
二、公司概况某化学制药公司成立于2005年,主要从事化学药品的研发、生产和销售。
公司产品涵盖心血管、神经系统、抗感染、肿瘤等多个领域,是国内领先的化学制药企业之一。
近年来,公司业务发展迅速,市场份额逐年提升。
三、盈利能力分析1. 毛利率分析(1)毛利率总体趋势从2020年至2022年,公司毛利率呈逐年上升趋势。
2020年毛利率为36.8%,2021年上升至40.5%,2022年进一步上升至42.3%。
这表明公司在产品定价和成本控制方面取得了一定的成效。
(2)毛利率波动分析从各年度毛利率波动情况来看,2020年至2022年毛利率波动幅度较小,波动幅度分别为3.7%、3.8%。
这表明公司盈利能力较为稳定。
2. 净利率分析(1)净利率总体趋势与毛利率趋势相似,公司净利率也呈逐年上升趋势。
2020年净利率为15.2%,2021年上升至18.6%,2022年进一步上升至20.9%。
这表明公司在提升毛利率的同时,有效地控制了费用支出。
(2)净利率波动分析从各年度净利率波动情况来看,2020年至2022年净利率波动幅度较小,波动幅度分别为3.4%、2%。
这表明公司盈利能力稳定,抗风险能力强。
四、偿债能力分析1. 流动比率分析(1)流动比率总体趋势从2020年至2022年,公司流动比率呈逐年上升趋势。
2020年流动比率为1.8,2021年上升至2.0,2022年进一步上升至2.2。
这表明公司短期偿债能力较强。
(2)流动比率波动分析从各年度流动比率波动情况来看,2020年至2022年流动比率波动幅度较小,波动幅度分别为0.2、0.2。
2015版化学药品原料药制造行业发展研究报告

2015版化学药品原料药制造行业发展研究报告目录1. 2009-2014年化学药品原料药制造行业分析 (1)1.1.化学药品原料药制造行业定义 (1)1.2.2009-2014年化学药品原料药制造行业产值占GDP比重 (1)1.3.2009-2014年化学药品原料药制造行业企业规模分析 (2)2. 2009-2014年化学药品原料药制造行业资产、负债分析 (4)2.1.2009-2014年化学药品原料药制造行业资产分析 (4)2.1.1. 2009-2014年化学药品原料药制造行业流动资产分析 (5)2.2.2009-2014年化学药品原料药制造行业负债分析 (6)3. 2009-2014年化学药品原料药制造行业利润分析 (8)3.1.2009-2014年化学药品原料药制造行业利润总额分析 (8)3.2.2009-2014年化学药品原料药制造行业主营业务利润分析 (9)4. 2009-2014年化学药品原料药制造行业成本分析 (11)4.1.2014年化学药品原料药制造行业总成本构成情况 (11)4.2.2009-2014年化学药品原料药制造行业成本费用分项分析 (12)4.2.1. 2009-2014年化学药品原料药制造行业产品销售成本分析 (12)4.2.2. 2009-2014年化学药品原料药制造行业产品销售成本率分析 (13)4.2.3. 2009-2014年化学药品原料药制造行业产品销售费用分析 (14)4.2.4. 2009-2014年化学药品原料药制造行业产品销售费用率分析 (16)4.2.5. 2009-2014年化学药品原料药制造行业管理费用分析 (17)4.2.6. 2009-2014年化学药品原料药制造行业管理费用率分析 (18)4.2.7. 2009-2014年化学药品原料药制造行业财务费用分析 (19)4.2.8. 2009-2014年化学药品原料药制造行业财务费用率分析 (20)4.2.9. 2009-2014年化学药品原料药制造行业产品销售税金及附加分析.. 215. 2009-2014年化学药品原料药制造行业盈利能力分析 (23)5.1.2014年化学药品原料药制造行业经营业务能力分析 (23)5.2.2009-2014年化学药品原料药制造行业成本费用利润率分析 (24)5.3.2009-2014年化学药品原料药制造行业销售利润率分析 (25)5.4.2009-2014年化学药品原料药制造行业毛利率分析 (26)5.5.2009-2014年化学药品原料药制造行业资本保值增值率分析 (28)6. 2009-2014年化学药品原料药制造行业偿债能力分析 (30)6.1.2009-2014年化学药品原料药制造行业资产负债率分析 (30)6.2.2009-2014年化学药品原料药制造行业产权比率分析 (31)7. 2009-2014年化学药品原料药制造行业发展能力分析 (33)7.1.2009-2014年化学药品原料药制造行业销售收入增长率分析 (33)7.2.2009-2014年化学药品原料药制造行业销售利润增长率分析 (34)7.3.2009-2014年化学药品原料药制造行业总资产增长率分析 (35)7.2.2009-2014年化学药品原料药制造行业利润总额增长率分析 (36)8. 2009-2014年化学药品原料药制造行业资产质量状况分析 (38)8.1.2009-2014年化学药品原料药制造行业应收账款周转率分析 (38)8.2.2009-2014年化学药品原料药制造行业流动资产周转率分析 (39)8.3.2009-2014年化学药品原料药制造行业总资产周转率分析 (40)8.4.2009-2014年化学药品原料药制造行业产成品资金占用率分析 (41)图表目录图表1:2009-2014年化学药品原料药制造行业产值占GDP比重 (1)图表2:2009-2014年化学药品原料药制造行业企业规模 (2)图表3:2009-2014年化学药品原料药制造行业企业规模对比图 (2)图表4:2009-2014年化学药品原料药制造行业企业资产增减情况表 (4)图表5:2009-2014年化学药品原料药制造行业企业资产增减变化图 (4)图表6:2009-2014年化学药品原料药制造行业企业流动资产平均余额增减情况表 (5)图表7:2009-2014年化学药品原料药制造行业企业流动资产平均余额增减变化图 (6)图表8:2009-2014年化学药品原料药制造行业企业负债增减情况表 (6)图表9:2009-2014年化学药品原料药制造行业企业负债增减变化图 (7)图表10:2009-2014年化学药品原料药制造行业企业利润总额增减情况表 (8)图表11:2009-2014年化学药品原料药制造行业企业利润总额增减变化图 (8)图表12:2009-2014年化学药品原料药制造行业企业主营业务利润增减情况表 (9)图表13:2009-2014年化学药品原料药制造行业企业主营业务利润增减变化图 (10)图表14:2014年化学药品原料药制造行业企业总成本构成图 (11)图表15:2014年化学药品原料药制造行业企业总成本变化情况表 (11)图表16:2009-2014年化学药品原料药制造行业企业产品销售成本增减情况表 (12)图表17:2009-2014年化学药品原料药制造行业企业产品销售成本增减变化图 (13)图表18:2009-2014年化学药品原料药制造行业产品销售成本率分析 . 13图表19:2009-2014年化学药品原料药制造行业产品销售成本率对比图 (14)图表20:2009-2014年化学药品原料药制造行业企业产品销售费用增减情况表 (15)图表21:2009-2014年化学药品原料药制造行业企业产品销售费用增减变化图 (15)图表22:2009-2014年化学药品原料药制造行业产品销售费用率分析 . 16图表23:2009-2014年化学药品原料药制造行业产品销售费用率对比图 (16)图表24:2009-2014年化学药品原料药制造行业企业管理费用增减情况表 (17)图表25:2009-2014年化学药品原料药制造行业企业管理费用增减变化图 (18)图表26:2009-2014年化学药品原料药制造行业管理费用率分析 (18)图表27:2009-2014年化学药品原料药制造行业管理费用率对比图 (19)图表28:2009-2014年化学药品原料药制造行业企业财务费用增减情况表 (19)图表29:2009-2014年化学药品原料药制造行业企业财务费用增减变化图 (20)图表30:2009-2014年化学药品原料药制造行业财务费用率分析 (20)图表31:2009-2014年化学药品原料药制造行业财务费用率对比图 (21)图表32:2009-2014年化学药品原料药制造行业企业产品销售税金及附加增减情况表 (22)图表33:2009-2014年化学药品原料药制造行业企业产品销售税金及附加增减变化图 (22)图表34:2009-2014年化学药品原料药制造行业企业产品销售收入与产品销售成本增减情况表 (23)图表35:2009-2014年化学药品原料药制造行业企业产品销售收入与产品销售成本增减变化图 (24)图表36:2009-2014年化学药品原料药制造行业成本费用利润率分析 . 24图表37:2009-2014年化学药品原料药制造行业成本费用利润率对比图 (25)图表38:2009-2014年化学药品原料药制造行业销售利润率分析 (25)图表39:2009-2014年化学药品原料药制造行业销售利润率对比图 (26)图表40:2009-2014年化学药品原料药制造行业毛利率分析 (27)图表41:2009-2014年化学药品原料药制造行业行业毛利率对比图 (27)图表42:2009-2014年化学药品原料药制造行业资本保值增值率分析 . 28图表43:2009-2014年化学药品原料药制造行业资本保值增值率对比图 (28)图表44:2009-2014年化学药品原料药制造行业资产负债率分析 (30)图表45:2009-2014年化学药品原料药制造行业资产负债率对比图 (30)图表46:2009-2014年化学药品原料药制造行业产权比率分析 (31)。
原料药、药用辅料和药包材登记表

注册地址:邮编:
通讯地址:邮编:
登记负责人:职位:
联系人:职位:
电话:传真:
电子信箱:手机:
法定代表人(签名):
(加盖公章处) 年 月 日
10.委托研究机构
序号
研究项目
研究机构名称
研究负责人
联系电话
申请人及委托研究机构(进口原料药)
7.境外制药厂商: 中文名称: 英文名称: 法定代表人: 注册地址: 国家或地区: 登记负责人: 电话: 电子信箱: 法定代表人(签名):8.进口原料药生产厂
版
○生物制品规程:
版
○局颁标准:第
册
标准号:
○其他:
相关情况
6.专利情况: □有中国专利 □化合物专利 □工艺专利 □处方专利 □其他专利 专利号:专利权人:
专利授权/公开日期:
□有外国专利 专利号:专利权人: 专利授权/公开日期: 专利权属声明:我们声明:本登记对他人专利不构成侵权
申请人及委托研究机构(国产原料药) :
登记号: 需填写由 “原辅包登记平台 ”生成的登记号。
1.本登记属于: 系指如果属于登记国产原料药填写 “国产原料药 登记 ”,如果属于登记进口原料药填写 “进口原料药登记 ”,如果属于登 记港澳台原料药填写 “港澳台原料药登记 ”。本项为必填写项目。
2.品种通用名称: 应当使用正式颁布的国家药品标准或者国家药 典委员会《中国药品通用名称》或其增补本收载的药品通用名称。本 项为必填项目。
中文名称:
英文名称:
社会信用代码/组织机构代码: 法定代表人: 注册地址: 生产地址: 通讯地址:
登记负责人: 联系人: 电话: 电子信箱: 法定代表人(签名):
原料药行业分析

现在跌至小企业 的盈亏平衡点
抗生素原料药用途: 从需求看,我国青霉素工业盐有四大主要流向: 一是作为制剂用原料药,包括注射青霉素G钾盐、G钠盐和普鲁卡因青霉素; 二是转化为6-APA 成为合成阿莫西林和氨苄西林的中间体; 三是转化为7-ADCA 或者GCLE 成为合成头孢拉啶、头孢氨苄等头孢类抗生素的中间体; 四是出口。其中作为制剂用的比重正逐渐下降,而转化为6-APA 的7-ADCA 的比重逐年上升,特别是阿莫 西林是促使青霉素工业盐增长的主要动力。2007 年用于生产6-APA 的青霉素工业盐约25000 吨,占50% 以上。
需求8500吨
维生素B1
东北制药,华北制药
产能12200吨+未来新建4800吨 需求7000吨 产能10000吨
维生素B2
广济药业
维生素B5
鑫富药业
需求1.7万吨 产能1.9万吨
鉴于维生素原料药产能严重过剩的情况,主要维生素可能会受到原材料涨价因素上涨,但是预计涨 幅不会太大。 维生素:从内销价看,VE、VA小幅回调,其他保持平稳;从11月份出口价(环比)看,VA升2%、 VE降5%、VC降1%、VB1降9%、VB2升2%、VB5升2%。从出口额看,各品种同比、环比均有所 上升;从累计出口额看,VE、VB2同比增长相对比较明显。未来走势预测:VE/VA:市场比较疲 软,春节过后存在补库存需求,10年全年均价较09年有所下降(见表2),预计11年价格在100-150 元/Kg波动,从长远来看,VE/VA经过05-07年的调整期,08-10H1年的利润丰厚期,逐步进入理性 竞争的寡头垄断阶段,价格出现大幅大落的可能性变小;出口方面VE形势良好,累计出口额同比增 长明显;VC:供严重大于求,中国商务部、海关总署公告2011年VC继续实行出口许可证管理(但 未涉及实施出口配额,市场预期1季度会出台出口配额政策),短期内产业难调整走出低谷,出口 方面价跌量升;VB1、VB2、VB5和VH未来价格将保持稳定。VD3价格大幅上扬后因需求稳定而快 速回调,未来上涨和下跌的空间都有限。(国信证券预计)
多功能化学合成原料药车间设计

多功能化学合成原料药车间设计随着医药行业的发展和技术的进步,化学合成原料药在药物研发中发挥着不可替代的作用。
而多功能化学合成原料药车间作为原料药生产的重要环节,其设计和建设关系着生产效率和药品质量。
本文将从环境设计、设备选型和工艺流程等多方面介绍多功能化学合成原料药车间的设计要点。
一、环境设计1. 车间布局多功能化学合成原料药车间需要根据生产工艺流程和生产设备的安排进行合理布局。
通常情况下,应根据化学合成的不同步骤,将车间划分为原料加工区、反应区、精馏区、结晶区、干燥区以及包装区等不同的功能区域。
合理的布局可以减少物料和人员的交叉污染,提高生产效率。
2. 空气洁净度化学合成原料药车间的空气洁净度对药品质量有着直接影响。
在车间设计时需要考虑安装空气净化系统,控制车间内的颗粒物和微生物的浓度。
根据不同的生产要求,车间的空气洁净度可以分为不同等级,需要根据具体情况进行设计。
3. 防爆设计由于化学合成过程中可能会涉及到易燃易爆的物质,因此车间设计需要考虑防爆设计。
在布置设备和管线时,需要考虑到火灾和爆炸的风险,采取相应的防护措施,确保车间的安全生产。
二、设备选型1. 反应釜反应釜是化学合成原料药车间中的核心设备之一,对反应釜的选型需要考虑到反应物质的性质、反应条件、生产规模等因素。
反应釜的设计应考虑到搅拌、传热和传质等功能,确保反应过程的均匀性和效率。
2. 蒸馏设备在化学合成过程中,可能需要进行蒸馏、提取等工艺操作,因此车间需要配备相应的蒸馏设备。
对于蒸馏设备的选型需要考虑到产品的纯度要求、能耗和操作方便等方面。
3. 干燥设备化学合成原料药的干燥是非常重要的制程步骤,对于固体产品的干燥设备需要考虑到干燥效果、能耗和产品质量等因素。
常见的干燥设备有气流干燥机、真空干燥机等,需要根据生产需求进行选型。
4. 控制系统化学合成原料药车间的控制系统需要考虑到生产工艺的复杂性和安全性,应采用先进的自动化控制系统,对生产过程进行实时监控和调节,确保生产的稳定性和安全性。
原料药、药用辅料和药包材登记表

附件1原料药、药用辅料和药包材登记表原料药登记—填表说明申请人保证:本项内容是各登记机构对于本项登记符合法律、法规和规章的郑重保证,各登记机构应当一致同意。
其他特别申明事项:需要另行申明的事项。
登记号:需填写由“原辅包登记平台”生成的登记号。
1.本登记属于:系指如果属于登记国产原料药填写“国产原料药登记”,如果属于登记进口原料药填写“进口原料药登记”,如果属于登记港澳台原料药填写“港澳台原料药登记”。
本项为必填写项目。
2.品种通用名称:应当使用正式颁布的国家药品标准或者国家药典委员会《中国药品通用名称》或其增补本收载的药品通用名称。
本项为必填项目。
3.英文名称:英文名填写INN英文名。
本项为必填项目。
4.包装:系指直接接触原料药的包装材料或容器,如有多个包装材质要分别填写,中间用句号分开,例如“玻璃瓶。
塑料瓶”。
包装规格是指基本包装单元的规格,原料药的基本包装单元,是原料药生产企业生产供上市的原料药最小包装,如:每瓶×毫升,对于按含量或浓度标示其规格的液体、半固体或颗粒,其装量按包装规格填写。
配用注射器、输液器或者专用溶媒的,也应在此处填写。
每一份登记表可填写多个包装规格,不同包装规格中间用句号分开,书写方式为“药品规格:包装材质:包装规格”,例如:“0.25g:玻璃瓶:每瓶30片”,多个规格的按上述顺序依次填写。
本项为必填项目。
5.质量标准:指本项原料药登记所提交药品标准的来源或执行依据。
来源于中华人民共和国药典的,需写明药典版次;属局颁或部颁标准的,需写明何种及第几册,散页标准应写明药品标准编号;来源于进口药品注册标准的,写明该进口注册标准的编号或注册证号;来源于国外药典的,需注明药典名称及版次;其他是指非以上来源的,应该写明具体来源,如自行研究,国产药品注册标准等情况。
本项为必填项目。
6.专利情况:所登记原料药的专利情况应当经过检索后确定,发现本品已在中国获得保护的有关专利或国外专利信息均应填写。
浙江九洲药业股份有限公司年产200吨奥卡西平、250吨酮洛芬、20吨盐酸度洛西汀、10吨N0701、25吨氟内酯、5吨

序号
单位名称
位置
主要产品
备注
1
椒江区块
一厂区
(外沙厂区)
外沙工业区
酮洛芬、BOC等
13个产品
2
一洲厂区
(三厂区)
岩头工业区
现有产品为格列奇特和卡马西平环合物;在建项目有苯扎贝特等4个产品
原浙江一洲化工有限公司,为九洲药业全资公司,于2008年底经合并成为九洲药业下属生产厂区(无独立法人);
甲醛
0
0.03
0.03
THF
0.1
0.1
1.52
1.62
氯仿
0.01
0.01
0.01
苯
7.12
7.12
7.12
2-甲基四氢呋喃
1.92
1.92
1.92
甲酸乙酯
0.28
0.28
0.28
正庚烷
0.36
0.36
0.36
叔丁醇
0
0.88
0.88
甲基叔丁基醚
0
6.04
6.04
甲基异丁酮
0
1.23
1.23
丙烷*
(二厂区)
浙江省化学原料药基地北区
卡马西平、文拉发辛、JBT-6、TPV-5
在建
2.2
浙江九洲药业股份有限公司川南厂区位于浙江省化学原料药基地北区(临海区块),厂区征地面积为414.5亩,浙江九洲药业股份有限公司川南厂区现有项目为“年产650吨卡马西平、100吨文拉法辛、50吨JBT-6及50吨TPV-5投资项目”,该项目于2006年经台州市环保局以台环建[2006]74号批复,目前各生产车间、污水处理站、罐区土建工作已基本完成,已进入安装设备阶段,由于本项目尚未建成,本章节内容参考台州市环境科学涉及研究院编制《浙江九洲药业股份有限公司年产650吨卡马西平、100吨文拉法辛、50吨JBT-6及TPV-5投资项目》相关环评结论。
化学药品生产工艺及质量标准通用格式和撰写指南(征求意见稿)
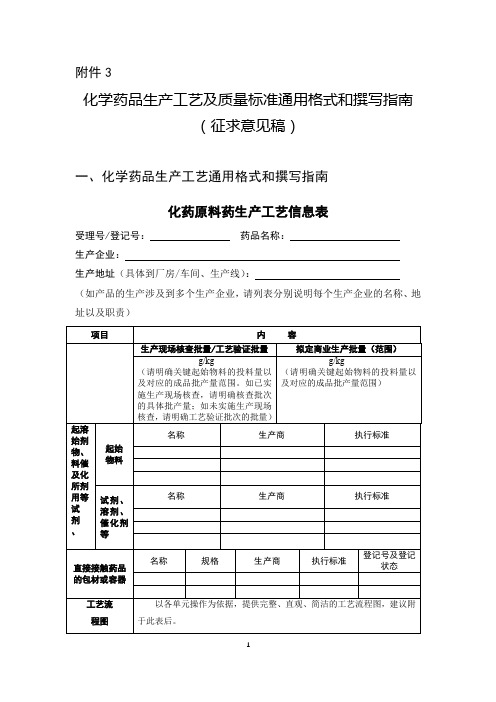
附件3化学药品生产工艺及质量标准通用格式和撰写指南(征求意见稿)一、化学药品生产工艺通用格式和撰写指南化药原料药生产工艺信息表受理号/登记号:药品名称:生产企业:生产地址(具体到厂房/车间、生产线):(如产品的生产涉及到多个生产企业,请列表分别说明每个生产企业的名称、地址以及职责)1)列表明确关键工艺步骤及工艺参数的信息,作为生产工艺信息表附件。
2)关键起始物料的来源、制备工艺、质量标准和分析方法作为生产工艺信息表附件。
请按中国药典格式规范整理关键起始物料的质量标准。
涉及有关物质检查项的,应附杂质信息,包括结构式、分子式、分子量、化学名称。
3)关键中间体的质量标准和分析方法作为生产工艺信息表附件。
4)原料药的放行标准作为生产工艺信息表附件。
请列表对比放行标准与注册标准的异同,对比内容应包括项目、方法(编号)及限度,突出显示不一致之处。
对于不同于注册标准的项目(包括分析方法及增订项目),请按中国药典格式提供规范的文字描述;无需赘述与注册标准一致的项目,简单说明即可。
5)如包材执行的内控标准与国家标准不同,请列表对比内控标准与国家标准的异同,不一致的项目,请按国家标准格式提供规范的文字描述。
6)变更记录:(如适用)请列表汇总首次获批(自本文件发布实施之日)后与工艺相关的各种变更,明确变更日期、受理号(登记号)/备案号、变更内容等信息。
7)请注意字体、格式与模板保持一致。
化药制剂生产工艺信息表受理号:药品名称:药品上市许可持有人:生产企业:生产地址(具体到厂房/车间、生产线):(如产品的生产涉及到多个生产企业,请列表分别说明每个生产企业的名称、地址以及职责)1)列表明确关键工艺步骤及工艺参数的信息,作为生产工艺信息表附件。
2)原辅料的内控标准和分析方法作为生产工艺信息表附件。
对于原料药的内控标准,请按中国药典格式规范整理。
如原料药关联申报或已有文号,请明确本文件中的内控标准与原料药注册标准的异同,如有差异,请明确说明。
2019年药品经营企业基本情况信息表【模板】

附表1 2019年药品经营企业基本情况信息表(药品批发企业、药品零售连锁企业、单体药店填报)填报人:联系电话:填报日期:端配送 D.未申报经营模式。
2、【企业性质】请填入A.国有或国有控股企业 B.股份制企业 C.民营企业D.港澳台投资企业E.合资企业F.外商独资企业。
3、无内容的单元格填写“无”。
附表2 2019年药品经营情况表(药品批发、零售连锁企业填报)*注:1、此表可依据需要增加行数,无内容的单元格填写“无”确认;2、销售至商业、零售、医疗的占比项仅由批发企业填写。
3、直营店和加盟店占比仅由零售连锁总部企业填写,加盟店占比非连锁企业不填。
附表3 2019年药品经营品种情况表(药品批发、零售连锁企业填报)*注:无内容的单元格填写“无”确认附表4药品零售连锁企业门店和医保情况信息表企业名称:填报人:联系电话:填报日期:附表5 企业仓储及信息化管理情况表(药品批发、零售连锁企业填报)企业名称:填报人:联系电话:填报日期:附表6 XX市互联网药品交易基本情况调查表(从事药品网络销售企业填报)企业名称:填报人:联系电话:填报日期:*注:请提供以下附表:1、业务发展计划;2、客户服务流程及规范;3、与第三方药品交易平台合作合同;4、第三方质量保证协议。
附表7企业创新发展情况表(所有药品经营企业填报)企业名称:填报人:联系电话:填报日期:附表8企业面临问题调查表(所有药品经营企业填报、连锁门店由总部收集统一填报)企业名称:填报人:联系电话:填报日期:附表9对XX市药品监管部门建议调查表(所有药品经营企业填报、连锁门店由总部收集统一填报)企业名称:填报人:联系电话:填报日期:。
总局2017年第146号公告附件1(1.原料药、药用辅料和药包材登记表)

附件1原料药、药用辅料和药包材登记表—1——2——3——4——5——6——7——8——9——10—原料药登记—填表说明申请人保证:本项内容是各登记机构对于本项登记符合法律、法规和规章的郑重保证,各登记机构应当一致同意。
其他特别申明事项:需要另行申明的事项。
登记号:需填写由“原辅包登记平台”生成的登记号。
1.本登记属于:系指如果属于登记国产原料药填写“国产原料药登记”,如果属于登记进口原料药填写“进口原料药登记”,如果属于登记港澳台原料药填写“港澳台原料药登记”。
本项为必填写项目。
2.品种通用名称:应当使用正式颁布的国家药品标准或者国家药典委员会《中国药品通用名称》或其增补本收载的药品通用名称。
本项为必填项目。
3.英文名称:英文名填写INN英文名。
本项为必填项目。
4.包装:系指直接接触原料药的包装材料或容器,如有多个包装材质要分别填写,中间用句号分开,例如“玻璃瓶。
塑料瓶”。
包装规格是指基本包装单元的规格,原料药的基本包装单元,是原料药生产企业生产供上市的原料药最小包装,如:每瓶×毫升,对于按含量或浓度标示其规格的液体、半固体或颗粒,其装量按包装规格填写。
配用注射器、输液器或者专用溶媒的,也应在此处填写。
每一份登记表可填写多个包装规格,不同包装规格中间用句号分开,书写方式为“药品规格:包装材质:包装规格”,例如:“0.25g:玻璃瓶:每瓶30片”,多个规格的按上述顺序依次—11—填写。
本项为必填项目。
5.质量标准:指本项原料药登记所提交药品标准的来源或执行依据。
来源于中华人民共和国药典的,需写明药典版次;属局颁或部颁标准的,需写明何种及第几册,散页标准应写明药品标准编号;来源于进口药品注册标准的,写明该进口注册标准的编号或注册证号;来源于国外药典的,需注明药典名称及版次;其他是指非以上来源的,应该写明具体来源,如自行研究,国产药品注册标准等情况。
本项为必填项目。
6.专利情况:所登记原料药的专利情况应当经过检索后确定,发现本品已在中国获得保护的有关专利或国外专利信息均应填写。
化学原料药招标文件

一、招标公告1. 招标项目名称:化学原料药采购招标2. 招标项目编号:XX-2021-00X3. 招标人:XX医药有限公司4. 招标代理机构:XX招标代理有限公司5. 招标内容:化学原料药采购6. 招标方式:公开招标7. 招标地点:XX医药有限公司会议室8. 报名时间:自公告发布之日起至2021年X月X日17:00止9. 报名地点:XX医药有限公司招标办公室10. 开标时间:2021年X月X日9:0011. 开标地点:XX医药有限公司会议室二、项目背景随着我国医药产业的快速发展,化学原料药作为药品生产的基础原料,其质量直接影响着药品的安全性、有效性。
为提高我司药品生产质量,确保药品供应稳定,现对我司所需化学原料药进行公开招标。
三、招标范围及要求1. 招标范围:本次招标的化学原料药品种包括但不限于以下几种:(1)抗生素类:青霉素类、头孢类、大环内酯类等;(2)抗病毒类:抗病毒药物原料;(3)抗肿瘤类:抗肿瘤药物原料;(4)心脑血管类:心脑血管药物原料;(5)神经系统类:神经系统药物原料;(6)其他:其他常用化学原料药。
2. 招标要求:(1)投标人须具备有效的《药品生产许可证》和《药品经营许可证》;(2)投标人须具备良好的商业信誉和健全的财务制度;(3)投标人须具备与招标药品生产相关的质量管理体系,并通过GMP认证;(4)投标人须具备稳定的原料药生产供应能力,能够满足我司的生产需求;(5)投标人须提供所投标药品的生产工艺、质量标准、检验报告等相关资料;(6)投标人须承诺在合同执行期间,确保所供应药品的质量符合我国相关法规和标准。
四、招标文件及投标文件要求1. 招标文件:(1)招标公告;(2)招标文件;(3)投标须知;(4)投标报名表;(5)合同范本。
2. 投标文件:(1)投标报名表;(2)营业执照副本复印件;(3)药品生产许可证、药品经营许可证复印件;(4)GMP认证证书复印件;(5)所投标药品的生产工艺、质量标准、检验报告等相关资料;(6)投标报价表;(7)投标保证金缴纳凭证;(8)其他相关证明文件。
医药工业生产及用能特点

医药工业生产及用能特点1.化学原料药1)行业概况化学原料药是指药物活性成分(API),是加工化学药品制剂所需的原料。
我国是原料药生产大国,有生产企业数千家,产品种类和数量众多,在国家药品监督管理局注册的产品按照通用名计有1600 个左右,加上大量的医药中间体,产品数量更多。
原料药生产的特点是产品品种多,生产过程复杂,使用的原辅料种类多、数量大。
按照生产工艺类型划分,原料药可分为生物发酵类、化学合成类和提取类产品。
2)生产设备及重点耗能环节原料药生产过程主要包括发酵、合成、提取、分离纯化、精制、干燥、包装等单元操作,采用的工艺设备有发酵罐、反应釜、结晶罐、冻干机等。
工艺辅助系统主要包括工艺用水制备、制冷、溶剂回收等,采用的设备有精馏塔、纯化水机组、纯蒸汽发生器等。
公用工程系统主要包括供水、供气(汽)、供电、供热、空气净化、环保治理等,采用的设备有锅炉、冷水机组、空调系统、空压机组、真空机组等。
原料药企业生产中主要使用的一次能源有煤、天然气、水等,二次能源有电力、蒸汽、燃油、煤气、沼气等。
煤、天然气和燃油主要是产生蒸汽或电力,部分用于危废、废气的焚烧处理。
蒸汽主要用于加热、灭菌、消毒等,电力主要用于拖动、加热、制冷、照明等。
水主要用于工艺用水和清洗用水。
2.化学药品制剂1)行业概况化学药品制剂是指由化学原料药、辅料等制备而成的直接作用于人体的用于疾病诊断治疗的产品。
截至2022 年,化学药品制剂生产企业数量达4千余家,化学药品制剂批件有9 万余件,化学药品制剂的品种达5千多个(按照通用名)。
化学药品主要剂型有固体制剂、注射剂、吸入制剂和透皮制剂等。
2)生产设备及重点耗能环节化学药品制剂中产量和用量最大的两类剂型为口服固体制剂和注射剂。
口服固体制剂生产过程主要包括粉碎、过筛、称重、混合、造粒、干燥、压片、胶囊灌装、包装等单元操作,采用的工艺设备有混合机、流化床、制粒机、压片机、胶囊灌装机、灯检机、包衣设备、包装线等。
化学原料药生产工艺规程模板

化学原料药生产工艺规程一、产品概述1.产品名称(包括英文名及汉语拼音名)、化学结构、理化性质。
2.产品代码: 企业内部编制的唯一识别号符号3.质量标准、临床用途和包装规格要求及贮藏。
-----质量标准:写明质量标准的编号及依据,如:××药典××版或写“企业现行标准”等。
-----包装规格及储存:指成品的包装规格、包装层次、密闭、防潮、防热、避光等方面的储存要求。
二、原料、包装材料质量标准及规格1.2.-----包括包装材料的名称、材质和尺寸。
三、化学反应过程及工艺流程图1.化学反应式-----化学反应式要平衡。
-----写出主、副反应式及辅助反应式。
-----在反应式下标出名称,注明分子量(保留小数点后两位有效数字)。
2. 工艺流程图-----用方框图表示,要求表明物料走向,并标出关键工艺参数。
四、工艺过程分工序写出以下内容。
1.物料配比及投料量2.-----写出工艺过程。
-----写出涉及到的主要工艺条件和工艺参数的控制点及控制范围(工艺参数的描述应有过渡且连续)。
-----写出中间产品及成品的返工方法,并写明该返工方法的适用范围。
3.收率计算-----写出收率及理论量的计算公式。
-----写出收率和批产量范围(保留小数点后两位有效数字)。
4.操作要点及注意事项5.关键参数-----关键原料-----关键设备五、中间产品、半成品的质量标准列表叙述所有中间产品、半成品现行最新版的质量标准。
六、技术安全与防火1.原料性能及保存使用注意事项(可附页)-----原料性状、理化特性(比重、熔点、沸点、闪点、自燃点、爆炸极限及空气中允许浓度等)。
-----毒理与毒性。
-----贮存及使用安全注意事项。
2.安全生产与防火防爆事项-----写明车间(岗位)的防爆等级,对电器、设备、传动装置的相应要求以及人员进入车间(岗位)注意事项。
七、综合利用与三废处理1. 副产品的回收利用2.八、操作工时与生产周期1. 操作工时分工序列表叙述。
化学原料药供应商审计内容

化学原料药供应商审计内容一、供应商审计概念:审计是一项有计划性、用文件形式记录,用来判定生产行为是否严格遵循已经建立的标准以及其遵守规范的程度的活动。
二、供应商审计内容1、资质的符合性●药用物料-原料药:药品生产许可证/药品经营许可证,产品注册证/经营范围,GMP证书/GSP证书,原料药生产批件-中国药典辅料:生产许可证,生产批件●药包材-已有国家标准的:《药包材注册证》-未有国家标准的:国家食品包装标准●进口药品-质量评估的符合性-物料质量的符合性质量评估的符合性2、供应商系统评估-厂房、设施、设备的条件-质量保证体系(文件/质量标准/检验仪器)-人员及培训-产品质量-供货能力-企业信誉-协作态度3、物料质量与标准的符合性·供应商供货标准与验收要求标准·实物与标准的符合性-小样检验-试机-工艺试验-批量检验-批量工艺验证三、供应商动态管理(一)物料部、QA建立与供应商的信息联系1、在所供物料出现任何质量问题时及时向供应商信息反馈,便于协同查处理和制定防范措施。
2、在供应商生产条件、质量标准以及其它注册证照发生变更时,能及时获得信息,达到更新供应资料或采取其它相应措施。
3、供应商供货产品年度质量回顾:由QA在每年的1月份对供应商上一年的供货质量进行统计,内容包括:产品名称、供货批次、数量、交货时间准确度、检验合格率、质量差错情况、售后服务等。
4、召开年度供应商交流会:质量评估,培训等。
(二)供应商的变更管理1、供应商因多种原因已失去所供应物料的生产经营资格;2、供应商停止所供应物料的生产或停止供货;3、经留样考察,所提供的物料不能满足我公司产品的稳定性要求或其佗要求;4、所生产的物料连续出现质量问题并经现场评审不合格的供应商;5、供应商的变更程序:供应商的变更程序执行(变更处理程序),由要求变更的部门提出。
四、基本内容介绍A、检查的文件· 1. 药品主文件·主文件:设施·主文件:产品·审核信函·修正案· 2. 工艺流程图· 3. 开发报告/验证报告B、审查的数据和过程· 4. 组织和人员· 5. 设施· 6. 批记录审核· 7. 设备校准/确认· 8. 工艺改变控制· 9. 稳定性数据· 10. 辅助系统C、失败的调查· 11. 投诉· 12. 返工批· 13. 拒绝批· 14. 退货/收回五、具体内容1. 药品主文件–申报日期–是否有对主文件答复的函件?答复日期:说明:–是否有针对答复函件的修正案?日期:说明:–是否有对主文件的补充/更新文件?日期:说明:–是否有关于在药品主文件,规格,接受标准或生产工艺方式改变后通知公司的程序?核对前两年的年度审计报告.生产工艺是否有显著改变?2. 工艺流程图–是否有详细的工艺流程图:·图纸标明:–操作单元?–所用的设备?–加料步骤?–工艺的关键步骤?–关键参数?–监控点?·图纸是否经QA部门批准?·图纸是否能正确反映生产工艺?3. 开发报告/验证报告–是否能提供认可的原料药生产工艺开发报告?–是否能提供认可的原料药生产工艺验证方案?–是否能提供生产工艺验证报告:·是否包括下列数据:–中间品-来源及规格标准;–工艺步骤和限度;–返工,母液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学原料药生产企业情况表
序号
企业名称
品种
地址
1
新疆制药厂
葡萄糖酸锌
乌鲁木齐市头屯河区工业园沙坪西街21号
2
新疆制药厂
甘草锌
乌鲁木齐市头屯河区工业园沙坪西街21号
3
新疆制药厂
罗布麻浸膏
乌鲁木齐市头屯河区工业园沙坪西街21号
4
新疆制药厂
四环素
乌鲁木齐市头屯河区工业园沙坪西街21号
5
新疆制药厂
土霉素
新疆金鹿药业科技有限责任公司
罗布麻浸膏
新疆库尔勒市经济技术开发区
29
新疆生化药业有限公司
羔羊胃提取物
乌鲁木齐市头屯河区工业园沙坪西街61号
30
新疆新姿源生物制药有限责任公司
结合雌激素
新疆218国道252公里处
31
吐鲁番天山莲麻黄素制品有限责任公司
盐酸麻黄碱
托克逊县北大街胜利路7苍
32
吐鲁番天山莲麻黄素制品有限责任公司
乌鲁木齐市头屯河区工业园沙坪西街21号
6
新疆制药厂
盐酸麻黄碱
乌鲁木齐市头屯河区工业园沙坪西街21号
7
新疆制药厂
盐酸伪麻黄碱
乌鲁木齐市头屯河区工业园沙坪西街21号
8
新疆天山制药工业有限公司
甘草次酸
新疆乌鲁木齐市鲤鱼山南路228号
9
新疆天山制药工业有限公司
甘草酸A
新疆乌鲁木齐市鲤鱼山南路228号
10
新疆天山制药工业有限公司
甘草酸单钾M
新疆乌鲁木齐市鲤鱼山南路228号
11
新疆天山制药工业有限公司
甘草酸单钾A
新疆乌鲁木齐市鲤鱼山南路228号
12
新疆天山制药工业有限公司
甘草酸单铵盐A
新疆乌鲁木齐市鲤鱼山南路228号
13
新疆天山制药工业有限公司
甘草酸单铵盐S
新疆乌鲁木齐市鲤鱼山南路228号
14
新疆天山制药工业有限公司
甘草酸二钾
19
新疆天山制药工业有限公司
甘草甜味素R-21
新疆乌鲁木齐市鲤鱼山南路228号
20
新疆天山制药工业有限公司
去甜酸甘草粉
新疆乌鲁木齐市鲤鱼山南路228号
21
新疆哈密戈泉药业有限责任公司
格列吡嗪
新疆哈密市益寿路1号
22
新疆哈密戈泉药业有限责任公司
盐酸麻黄碱
新疆哈密市益寿路1号
23
新疆哈密戈泉药业有限责任公司
盐酸伪麻黄碱
托克逊县北大街胜利路7苍
33
尉犁县金兴甘草制品有限公司
甘草提取物粉
新疆尉犁县西尼尔工业区
34
尉犁县金兴甘草制品有限公司
罗布麻浸膏
新疆尉犁县西尼尔工业区
35
新疆金硕植物添加剂有限责任公司
甘草提取物粉
新疆和硕县清水河北路
36
新疆康平药业有限责任公司
盐酸麻黄碱
新疆温宿县乌喀公路977公里处
37
盐酸伪麻黄碱
新疆哈密市益寿路1号
24
新疆哈密戈泉药业有限责任公司
硫酸钡(Ⅰ型)
新疆哈密市益寿路1号
25
新疆和硕麻黄素制品有限责任公司
盐酸麻黄碱
新疆和硕县清水河北路
26
新疆和硕麻黄素
新疆金鹿药业科技有限责任公司
甘草酸单钾M
新疆库尔勒市经济技术开发区
28
新疆康平药业有限责任公司
盐酸伪麻黄碱
新疆温宿县乌喀公路977公里处
38
新疆库车麻黄素制品有限责任公司
盐酸伪麻黄碱
阿克苏地区库车县库车镇草原路10号
39
新疆库车麻黄素制品有限责任公司
盐酸麻黄碱
阿克苏地区库车县库车镇草原路10号
40
新疆温泉麻黄素制品有限责任公司
盐酸麻黄碱
新疆温泉县哈日布呼镇
41
新疆温泉麻黄素制品有限责任公司
盐酸伪麻黄碱
新疆温泉县哈日布呼镇
42
新疆锂盐厂
碳酸锂
乌鲁木齐仓房沟路54号
新疆乌鲁木齐市鲤鱼山南路228号
15
新疆天山制药工业有限公司
甘草酸二钠
新疆乌鲁木齐市鲤鱼山南路228号
16
新疆天山制药工业有限公司
甘草酸三钠
新疆乌鲁木齐市鲤鱼山南路228号
17
新疆天山制药工业有限公司
甘草提取物粉
新疆乌鲁木齐市鲤鱼山南路228号
18
新疆天山制药工业有限公司
甘草甜味素R-19
新疆乌鲁木齐市鲤鱼山南路228号
