普化大纲
《普通化学》考试大纲

《普通化学》考试大纲本《普通化学》考试大纲适用于重庆邮电大学生物医学工程专业的硕士研究生入学考试。
普通化学是一门化学基础课,对化学作一整体的阐述和研讨,是许多工科专业的基础理论课程。
主要介绍化学的基本概念和方法,主要内容有:气体、液体和固体,化学热力学,化学动力学,电化学,物质结构,有机化合物和配位化合物。
要求考生了解各种基本概念,理解、掌握各种基本理论和应用,并具有综合运用所学知识分析问题和解决问题的能力。
一、考试内容(一)气体、液体和固体. 气体的状态方程. 气体的液化. 饱和蒸气压. 水的相图. 溶液的饱和蒸气压. 液体的表面张力(二)化学热力学基础. 热力学第一定律. 热力学第二定律. 自由能. 化学平衡. 电离平衡和沉淀溶解平衡(三)化学动力学基础. 反应速率和反应动力学方程. 具有简单级数的反应的动力学方程. 典型复杂反应的动力学. 反应级数和反应速率测定的实验方法. 速率常数. 反应的碰撞理论. 气固相吸附平衡. 色谱分析法(四) 电化学. 电极电势的产生. 原电池的电池反应. 原电池的电动势. 电极和电极电势. 电动势与电极电势在化学上的应用(五) 物质结构. 分子结构测定——晶体衍射. 核外电子排布规律. 共价键理论. 分子间作用力. 原子光谱和分子光谱(六) 有机化合物. 有机化合物的分类. 有机物分子结构的基本规律. 有机化合物的反应规律. 有机化合物的手性. 杂环化合物(七) 配位化学基础. 配位化合物的组成. 配位几何和配位键. 配体交换和配位平衡. 配合物的异构现象. 配合物及配位化学的应用二、考试要求(一)气体、液体和固体了解低压气体的几个低压定律,掌握理想气体状态方程式,混合理想气体的分压定律和分体积定律,范德华方程和实际气体的等温线。
理解气体的液化和饱和蒸气压,掌握水的相图,溶液的饱和蒸气压和液体的表面张力。
(二)化学热力学基础了解一些常用术语:系统、环境、状态、状态函数、过程与途径、热与功、可逆过程、热力学能。
普通化学课程大纲

《普通化学》课程教学大纲一、课程名称:普通化学 General Chemistry二、课程编码:三、学时与学分:48/3(含实验12学时)四、先修课程:无五、课程性质:必修六、课程教学目标及要求1.帮助学生获得必要的化学基础知识,了解学科发展前沿;2.引导学生了解有关化学与水处理之间的相互联系,提高学生对于自身专业价值的认识;3.培养学生正确的环境观和资源观,增强社会责任感,促进全面素质的提高。
七、适用学科专业给水与排水工程八、基本教学内容与学时安排绪论(1学时)【内容】(1)化学的定义与研究对象(2)化学的地位(3)化学的发展史(4)化学与给水排水的关系(5)课程教学目的与教学内容(6)课程要求与考核【基本要求】(1)了解化学的定义和地位(2)认识化学学科的地位(3)理解化学与给水排水的关系【重点与难点】重点:化学对给水与排水工程专业的重要性;难点:化学与给水排水工程的关系。
第一章热化学与能源(6学时)【内容】(1)关于反应热的几个基本概念(2)反应热的测量【(1)(2)用一大节2课时来完成】(3)热力学第一定律(4)化学反应的反应热与焓【(3)(4)用一大节2课时来完成】(5)反应标准摩尔焓变的计算【(5)用一大节2课时来完成】【基本要求】(1)掌握与化学反应热有关的基本概念(2)掌握反应热测量的方法(3)理解热力学第一定律及其应用方法(4)掌握化学反应标准摩尔焓变的计算方法【重点与难点】重点:与反应热有关的基本概念、热力学第一定律、化学反应的标准摩尔焓变;难点:反应热的测量、热力学第一定律的应用;化学反应标准摩尔焓变的计算。
第二章化学反应的基本原理与大气污染(6学时)【内容】(1)影响化学反应的因素(2)化学反应的判断(3)反应的摩尔吉布斯函数变的计算及应用(4)反应限度的判据与化学平衡(5)平衡常数和多重平衡规则(6)化学平衡的有关计算(7)化学平衡的移动及温度对平衡常数的影响(8)浓度的影响和反应级数(9)温度的影响和阿仑尼乌斯公式(10)反应的活化能和催化剂【基本要求】(1)掌握化学反应的影响因素及化学反应的判据(2)掌握化学反应的摩尔吉布斯函数变的计算方法(3)理解反应限度的判据与化学平衡、平衡常数及多重平衡规则(4)掌握化学平衡的有关计算(5)理解化学平衡的移动、温度、浓度和催化剂对平衡常数的影响【重点与难点】重点:化学反应的判据、反应的摩尔吉布斯函数变、反应的判据、化学平衡、平衡常数及其计算、影响化学平衡的因素;难点:化学反应的摩尔吉布斯函数变的计算、化学平衡的有关计算。
普化复习提纲

总复习基本要求:1 •认真的看一遍书和笔记。
认真整理和理解所有学过的基本概念、公式、定理和理论。
对重点要求的内容,必须掌握。
2. 作业应认真检查,做过的习题要明白错在何处。
3. 辅导教材上的练习要多做。
4. 看实验书和实验报告。
考试结束后课代表将实验报告收齐交回实验室。
5. 抓紧答疑。
考前答疑时间:元月6、7、8日全天。
地点:D座303和304。
6. 带计算器,重要公式、R值、近似能级顺序、屏蔽常数要记。
第一章化学热力学基础一、本章的基本概念和理论:1. 体系与环境状态函数的特征:①唯一;②辽与途径;③循环过程为dZ=O2. 体积功的计算:W体积=-P夕外V(恒外压)Q(+吸),W;+体系得到能量)3. 热力学第一定律一能量守衡:(1)封闭::U = Q + W 公式⑴恒容:厶U = Q V恒压:Q p= H (注意,只存在数值上的关系)(2)物质的标准摩尔生成焓.-■: f H m(标准下各最稳定单质的5 H m为零)⑶标准摩尔反应热-SH m由盖斯定律可得.^H m八v「f H m(产物)—a v「f H m(反应物)公式⑵⑷热力学的标准态压力p—100kPa对气态物质各气态物质的分压均为100kPa即;对液态物质在ph下,各液态物质的浓度均为1mol kg-1;对纯液体和固态物质(5)反应进度的概念及意义 4 •热力学第二定律 ------- (1)熵与混乱度(S m 单位J mol -1 K -1)(2) 反应熵变的求取:.\r s rn = Ms m (产物)―、V i S m (反应物)公式⑶(3) 吉布斯函数及其关系式二 r G m (T )=二 r H m — T - r s m公式(4*)(注意能量单位统一) .-■:r G m = 、 V r ■■: f G m (产物)一、(反应物)公式(5)(4) 在标准状态下可用 .》G m 作为反应是否可能自发的判据自发:.—G m < 0 ;平衡:cam = 0 ;不自发:^G m > 0 (5) 反应转变方向的温度:-r G m (T )=0, T 转向==rH m / - r S m 5•化学反应的限度一化学平衡(1) 反应商和标准平衡常数若化学反应为 aA(g) + bB(g) ==== gG(g) + dD(g)则反应商的表达式: (当各物质均为平衡分压时)Q eq = K T根据定义可知,正逆反应的标准平衡常数之间的关系应为K 正二1-K _1(2) 任意状态时反应方向的确定「G m (T) = SG m (T) RTl nQ公式(6) 任意状态时反应方向的确定(方法一)自发: 4G m < 0 ; 平衡:厶r G m = 0 ; 不自发:4G m > 0 当任意状态下达到平衡时应有=Q 二0所以 ^G m = - RTlnK=公式⑺ AQr G m K RTln 公式(8) 在ph 下的纯物质 n BV B化学反应的方向K任意状态时反应方向的确定(方法二):判断Q 与K 71的大小关系即可知反应的 自发方向。
09058_普通化学教学网教学大纲

制定改进计划
针对存在的问题,制定具体的改进计 划和措施,明确改进目标和时间表。
持续改进
建立定期评估和改进机制,不断跟踪 教学效果和学生满意度情况,及时发 现问题并采取相应措施进行改进,实 现教学的持续改进和提高。
22
06
课程特色与创新点
Chapter
2024/1/27
23
突出实践应用能力培养
实验设计
根据作业的难度、完成质量、提交时 间等因素进行评分。
2024/1/27
12
期末考试形式及内容
考试形式
采用闭卷考试形式,考试 时间为2小时。
2024/1/27
考试内容
涵盖课程的主要知识点, 包括化学反应原理、物质 结构、化学热力学、化学 动力学、电化学等方面。
Байду номын сангаас
题型分布
选择题、填空题、简答题 、计算题等,其中计算题 占比较大。
13
总评成绩计算方法
平时成绩占比
平时成绩占总评成绩的 30%,其中课堂表现占 10%,作业完成情况占 10%,实验报告占10% 。
2024/1/27
期末考试成绩占比
期末考试成绩占总评成 绩的70%。
总评成绩计算方式
总评成绩=平时成绩 ×30%+期末考试成绩 ×70%。
14
04
教学资源建设与利用
Chapter
通过设计综合性、创新性实验,培养学生独立思考和解决问题的 能力。
案例分析
引入工业、环保、医学等领域的实际案例,让学生了解化学知识 的应用。
实践活动
组织学生参与课外科研、社会实践等活动,提高学生的实践能力 和综合素质。
2024/1/27
24
《普通化学》课程教学大纲全文

可编辑修改精选全文完整版《普通化学》课程教学大纲英文名称:General Chemistry课程编码:总学时:32 实验学时:6 学分:2适用对象:水利类、生态类、土建类、机械及材料类等理工科专业本科生开课单位:理学院大纲主撰人:大纲审核人:制定时间:2014年9月使用教材与参考书:《普通化学》(第六版),浙江大学普通化学教研组编,高等教育出版,2011《大学化学》韩选利,张思敬,张凤云编,高等教育出版社,2005《普通化学实验》,李聚源主编,化学工业出版社,2007一、课程性质、目的和任务《普通化学》是理工科本科生必修的基础课程之一,课程内容主要包括物质结构理论基础、化学热力学、化学反应的基本规律与工程实际密切有关的重要元素和化合物、新技术、新材料等基本知识。
通过该门课程的学习,使学生了解近代化学的基本理论,具备化学基本实验技能,培养学生正确的学习和研究方法,为以后的学习和工作提供必要的化学基础,同时树立辩证唯物主义世界观。
二、教学内容及要求第1章化学的发展授课学时: 1基本要求:1-1 大学化学课程简介1-2 化学分支学科的形成与发展1-3 现代化学的发展1-4 课程学习方法及与专业关系重点:课程学习方法及与专业关系难点:课程学习方法及与专业关系第2章物质结构基础授课学时:2基本要求:2-1 了解原子核外电子运动的特征(量子化、波粒二象性、统计性);2-1 了解波函数、四个量子数和电子云的基本概念;2-3 了解s、p、d 波函数和电子云的角度分布示意图;2-4 掌握周期系元素的原子核外电子分布的一般规律及其与周期表的关系;2-5 理解元素按s、p、d (或d、ds)、f分区的情况,原子、离子、分子、金属晶体;2-6了解原子结构,分子结构和晶体结构等。
重点:四个量子数;原子和离子的电子分布式;核外电子分布与周期系的关系;杂化轨道理论与分子空间构型的关系;分子间力和氢键对物质性质的影响;原子、离子、分子、金属晶体的特征;晶体结构与物质性质的关系;配合物的组成及命名。
普通化学大纲

《普通化学》课程教学大纲课程代号:061002课程名称:普通化学英文名:general chemistry课程类别:公共基础课学时学分:48/2.5先修课程:无授课对象:过程与自动化控制专业开课单位:材料与化学工程学院教材:《普通化学》(第六版),浙江大学普通化学教研组编,徐端钧等修订,高等教育出版社2011.6。
参考书目:[1] 《普通化学原理》(第三版)华彤文等主编;北京大学出版社2005.7[2]《近代化学导论》(上、下册),申泮文主编,高等教育出版社2002.6。
[3]《无机化学》(第三版)(上、下册)武汉大学、吉林大学等校编,曹锡章等修订,高等教育出版社1994.4。
[4]《结构化学基础》(第三版)周公度,段连运编著,北京大学出版社2002.7。
[5]《物理化学》(第五版)(上、下册)傅献彩等编,高等教育出版社2005.7。
[6] 《生物化学》古练权主编,高等教育出版社2000.7。
一、本课程的目的和任务:《普通化学》是土木工程、城建土木、勘查技术、安全技术等专业本科生的一门必修的公共基础课程。
是一门现代化学导论课程,其目的是要给学生以高素质的化学通才教育。
通过化学反应基本规律和物质结构理论的基本学习,使学生了解当代化学学科的概貌,能用当代化学的理论、观点、方法审视公众关注的环境污染、能源危机、新兴材料、生命科学、健康与营养等公众关注的热点话题,了解化学对人类社会的作用和贡献。
并对本专业有所裨益。
二、课程的基本要求和内容1、基本要求通过本课程的学习,使学生获得物质结构的基础理论、化学反应的基本原理、化学元素的基本知识和实验的基本技能;培养学生具有分析处理一般化学问题的初步能力,独立进行普通化学实验和自学一般化学书刊,以获取新知识,解决实际问题的能力。
本课程的教学应该运用辩证唯物主义观点和科学方法,阐明化学的基本原理和元素及化合物性质的变化规律,以促进学生辩证唯物主义世界观的形成。
教学中应当注意结合我国化学、化工发展的成就和新世界建设的实际,并适当反映现代化学的发展,以激发学生的学习热情。
普通化学教学大纲

普通化学教学大纲(总学分:4 总上课时数:64 实验学时数:32)东南大学化学化工学院一、课程的性质与目的《普通化学(含实验)》是非化学、化工类各专业的一门自然科学基础课,对于培养具有综合性素质、创新意识、全面发展的人才,是不可缺少的。
由于《普通化学》是一般工科学生大学阶段唯一的化学课,因此本课程介绍学生所应具备的化学最基本的基础理论、基本知识,以及与化学密切相关的社会热点、科技发展、学科渗透交叉等方面的知识,使学生具有较高化学素质和知识水平,建立化学的思维方式,增加用化学方法解决实际问题的综合能力。
二、课程教学基本要求1.化学基本理论部分。
包括化学热力学基础,电化学基础,化学平衡理论和近代物质结构理论基础。
这一部分要求建立正确的概念,学会进行有关的近似计算,依据基本概念、一般规律和计算结果对化学反应的方向、限度,物质的物理、化学性质进行粗略分析、判断。
2.化学基本知识部分。
包括金属材料,无机非金属材料,有机高分子化合物与高分子材料,工业用油,化学与环境,化学与能源,化学与生命,化学与生活等在科学技术和社会文明中的重大而又贴近生活的相对独立的课题。
三、实验要求工程化学实验是在已学过的基本化学原理、化学知识和实验方法的基础上进行综合训练,使学生有更多的独立实验的机会,以提高学生综合运用所学知识解决实际问题的能力。
四、能力培养的要求1. 分析能力的培养:主要对实验现象观察和理论分析能力的培养。
2. 计算能力的培养:要求学生通过本课程的学习,具备对反应方向、反应平衡等化学反应基本原理进行计算以及确定计算步骤的能力和对计算结果的正确性进行判断或校核的能力。
3. 自学能力的培养:通过本课程的教学,要培养和提高学生对所学知识进行整理、概括、消化吸收的能力,以及围绕课堂教学内容,阅读参考书籍和资料,自我扩充知识领域的能力。
4. 表达能力的培养:主要是通过作业与写小论文,清晰、整洁地表达自己解决问题的思路和步骤的能力。
《普通化学》内容简介及教学大纲.doc

《普通化学》内容简介及教学大纲一、课程性质与教学目的《普通化学》是药学院、海洋学院、环境与材料学院、土木学院等几个相关专业的第一门化学基础课,同时也是药学院、海洋学院、环境与材料学院相关专业的基础化学必修课。
它是培养上述各专业技术人才的整体结构及能力结构的重要组成部分,同时也是后续化学课程的基础.通过本课程的学习,并与《普通化学实验》课相配合,使学生能对化学热力学、化学动力学和物质结构等化学原理有一个基本认识,为深入学习其它化学课程打下良好基础。
二、基本要求要求学生具备高中化学的基本知识,和初步的数理基础。
三、教学内容绪论(1学时)1、化学变化的特征2、化学的分支学科3、化学实验的重要性4、回顾史实,瞻望前沿第一章化学热力学(4学时)1、热力学常用术语:体系和环境,状态和状态函数,过程和途径,功,热量,内能。
2、热力学第一定律:恰变,反应热和热化学方程式,盖斯定律,几种热效应生成焰,溶解焙,水合焙)3、化学反应的方向:最低能量和最大混乱度概念,自由能概念,爛,热力学第二定律, 温度对自由能变化的影响,热力学原理的应用第二章化学反应速率(4学时)1、化学反应速度的表示方法:平均速度和瞬时速度2、化学反应机理简介:基元反应和复杂反应3、有效碰撞理论和活化能4、浓度对化学反应速度的影响一质量作用定律和反应级数5、温度对化学反应速度的影响一阿仑尼乌斯公式6、催化剂对化学反应速度的影响第三章化学平衡(5学时)1、化学反应的可逆性与化学平衡;分压定律2、平衡常数与平衡常数的物理意义3、平衡常数与标准自由能变化的关系4、有关化学平衡的计算5、化学平衡的移动:浓度、压力、温度和催化剂对化学平衡的影响,吕查德里原理。
第四章酸碱平衡(3学时)1、强电解质溶液,活度及活度系数2、弱酸、弱碱的电离平衡,电离常数3、同离子效应;缓冲溶液;盐效应4、水的电离及离子积常数;溶液的pH值;酸碱指示剂5、盐类的水解;水解常数;盐溶液的pH值6、酸碱质子理论第五章沉淀溶解平衡(3学时)1、溶度积概念,溶度积与溶解度的关系2、沉淀的生成、溶解、转化3、分步沉淀第六章氧化还原反应(7学时)1、氧化还原反应的基本撅念;氧化数;氧化还原反应方程式的配平(氧化数法,离子电子法)2、原电池;电极电势3、标准电极电势:利用标准电极电势判断氧化剂、还原剂的强弱及氧化还原方向;根据标准状态的电池电动势求平衡常数;标准电极电势与金属活动顺序的关系;标准电极电势与电离能的关系4、影响电极电势的因素;能斯特方程,离子浓度对电极电势、氧化还原反应方向的影响,介质酸碱度对氧化还原反应的影响,pH值电势图第七章原子结构与元素周期律(8学时)1、氢光谱;玻尔理论的氢原予模型2、微观离子的运动特点3^核外电子运动状态的描述;波函数和原子轨道,电子云,径向分布,角度分布,四个量子数4、多电子原子基态的电子层结构:屏蔽效应,钻穿效应,近似能级图5、核外电子的排布原理和电子排布6、原子结构与元素周期性的关系;原子的电子层结构与周期、族、区的关系7、电离能,电子亲和能,电负性第八章分子结构(7学时)1、离子键理论:离子键的形成,离子的特征,离子型化合物2、共价键理论:共价键的本性、特征,价健参数和物理性质3、分子轨道理论:理论要点,原子轨道线性组合的一些规则,M0法处理同核双原予分子和异核双原子分子的实例4、杂化轨道理论:理论要点,s p、s p \ s p "和不等性s p 3及s p " d、s p 3 d,杂化,杂化类型与分子空间类型的关系5、价层电子对互斥理论:理论要点,用该理论判断共价分子结构的一些规则6、配位键、金属键的概念7、分子间作用力和氢键第九章配位化合物(4学时)1、配合物的定义、特征、分类和命名2、配合物的组成3、配合物的化学键理论:价健理论四、参考书目1、《普通化学原理》,华彤文等编,北京大学出版社,19942、《无机化学》,武汉大学、吉林大学等校编,高等教育出版社,19943、《无机化学》,大连理工大学,高等教育出版社,20034、《基础无机化学》,尹敬执、申泮文著,人民教育出版杜,19805、《大学普通化学》,傅鹰,人民教育出版杜,19806、《CHEMISTRY—The Central Science)) (Sixth Edition) , BROWN, LEMAY, BURSTEN;1994 by Prentice Hall, Inc.五、学时分配(共48学时) 章次012345678910学时1646638101038。
831普通化学大纲

《普通化学》考试大纲第一部分考试说明一、考试性质普通化学是环境科学与工程硕士研究生入学考试的专业基础课。
考试对象为参加环境科学与工程专业2020年全国硕士研究生入学考试的准考考生。
二、考试形式与试卷结构(一)答卷方式:闭卷,笔试。
(二)答题时间:180分钟。
(三)考试题型及比例:判断题:30%;简答题:20%;计算题:50%。
(四)参考书目普通化学(第二版),马家举主编,化学工业出版社;2012.05。
第二部分考试要点第一章原子结构与分子结构波函数与原子轨道,电子云,量子数,电子原子结构和周期系,多电子原子轨道的能级,核外电子分布,基态原子中电子的分布,元素周期表和元素性质的周期性变化,化学键的类型和价键理论,杂化轨道理论与分子的空间构型,配位共价键与配位化合物,分子间的相互作用。
第二章物质的聚集状态物质的聚集状态,相,理想气体,道尔顿分压定律,液体的蒸气压和沸点,晶体与非晶体,离子键与离子晶体,原子晶体,分子晶体,金属键与金属晶体。
第三章化学热力学初步热力学第一定律的基本概念,能量守恒定律、等容热效应和等压热效应的基本概念,焓的基本概念,热化学方程式,反应热的计算,自发过程的特点,焓变与自发过程,吉布斯函变与化学反应的方向,化学反应的限度——化学平衡,化学平衡与平衡常数,化学平衡的移动。
第四章水溶液与离子平衡稀溶液的依数性(溶液的蒸气压下降、溶液的凝固点下降和沸点上升、溶液的渗透压),酸碱质子理论,酸碱水溶液中pH的计算,多相离子平衡,溶度积规则及应用,配离子的稳定性,配离子平衡浓度的计算,含有配离子平衡的多重平衡。
第五章氧化还原反应与电化学原电池及其组成,原电池的半反应式与氧化还原反应方程式的配平,电池的表示方法——原电池符号,电极电势与电池电动势,电极电势的确定和标准电极电势,浓度对电极电势的影响——能斯特方程,电池电动势与吉布斯函数变的关系,电解池与原电池的异同,化学电源,腐蚀电池第六章化学反应速率化学反应速率及其表示方法,反应速率理论,化学反应速率方程,反应速率常数,反应级数。
普化
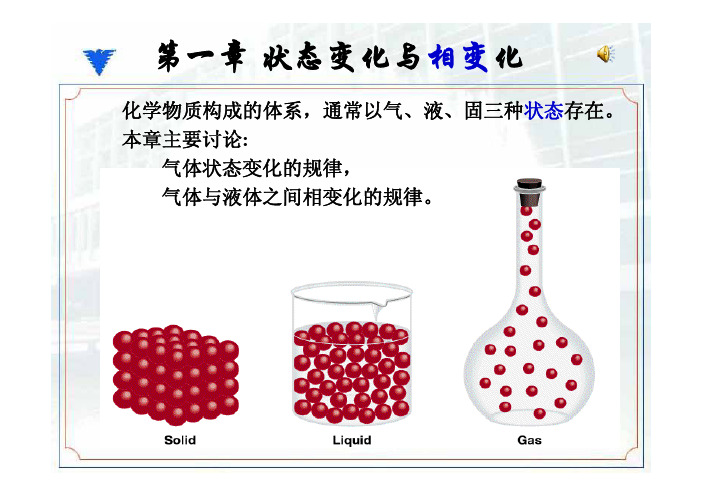
CO2气体恒温下的液化过程
CO2等温线 等
临界温度, 临界压力, 临界压力 临界体积。 ——临界参数 液体和气体本质 的区别 不是分 的区别,不是分 子距离的远近。
2)不同温度下压缩CO2气体,p、V 变化 如右图。 3)对右图的理解: 3)对右图的理解 a)同一水平线段两端的B和C点,分别 代表气相和液相的状态;B点和C点 纵坐标和横坐标分别表示CO2气体和 液体的压力和摩尔体积。 b) 处于平衡状态的气体和液体,压力 相等,温度相等,但是摩尔体积不 相同;所以属于气、液两个不同相。 ) 温度升高,B、C两点靠近,气相与 c) 液相的差别缩小。 d)当温度为31.2℃时,B点和C点合并 为同一个点C 为同 个点C,这时气体与液体的差 这时气体与液体的差 别消失,气体就是液体,液体就是 气体;压缩过程没有发生相变。 e)31 1℃以上的的CO2气体,在恒温压 e)31.1℃以上的的 气体 在恒温压 缩过程中也不会发生液化。
Boyle’s law: pV=const (n,T一定 定)
V const V p p T ,n p p T ,n
V T V p ,n T
Gay-Lussac’s law: V=const*T (n、p一定) Avogadro’s law: V=const*n (T、p一定)
本章核心概念是饱和蒸气压。
1)液体、固体都有蒸气压,本章以液体为例讨论; 2)蒸气压与液体的温度、液体的压力有关; 3)溶质的存在对溶液的饱和蒸气压有影响; 4)表面张力对液体的蒸气压也有影响。 )表面张力对液体的蒸气压也有影响
1.1 气体的状态
1.状态和状态方程
1) 气体的状态: 可由 压强p(压力) 温度T 体积V 等物理量来描述。 等物理量来描述 一组p、V、T的数值,确定气体的一个状态,对应于右 上图中的一个点。
普通化学内容简介及教学大纲

《普通化学》内容简介及教学大纲一、课程性质与教学目的《普通化学》是药学院、海洋学院、环境与材料学院、土木学院等几个相关专业的第一门化学基础课,同时也是药学院、海洋学院、环境与材料学院相关专业的基础化学必修课。
它是培养上述各专业技术人才的整体结构及能力结构的重要组成部分,同时也是后续化学课程的基础.通过本课程的学习,并与《普通化学实验》课相配合,使学生能对化学热力学、化学动力学和物质结构等化学原理有一个基本认识,为深入学习其它化学课程打下良好基础。
二、基本要求要求学生具备高中化学的基本知识,和初步的数理基础。
三、教学内容绪论 (1学时)1、化学变化的特征2、化学的分支学科3、化学实验的重要性4、回顾史实,瞻望前沿第一章化学热力学 ( 4学时)1、热力学常用术语:体系和环境,状态和状态函数,过程和途径,功,热量,内能。
2、热力学第一定律:焓变,反应热和热化学方程式,盖斯定律,几种热效应生成焓,溶解焓,水合焓)3、化学反应的方向:最低能量和最大混乱度概念,自由能概念,熵,热力学第二定律,温度对自由能变化的影响,热力学原理的应用第二章化学反应速率 (4学时)1、化学反应速度的表示方法:平均速度和瞬时速度2、化学反应机理简介:基元反应和复杂反应3、有效碰撞理论和活化能4、浓度对化学反应速度的影响——质量作用定律和反应级数5、温度对化学反应速度的影响——阿仑尼乌斯公式6、催化剂对化学反应速度的影响第三章化学平衡 (5学时)1、化学反应的可逆性与化学平衡;分压定律2、平衡常数与平衡常数的物理意义3、平衡常数与标准自由能变化的关系4、有关化学平衡的计算5、化学平衡的移动:浓度、压力、温度和催化剂对化学平衡的影响,吕查德里原理。
第四章酸碱平衡 (3学时)1、强电解质溶液,活度及活度系数2、弱酸、弱碱的电离平衡,电离常数3、同离子效应;缓冲溶液;盐效应4、水的电离及离子积常数;溶液的pH值;酸碱指示剂5、盐类的水解;水解常数;盐溶液的pH值6、酸碱质子理论第五章沉淀溶解平衡 (3学时)1、溶度积概念,溶度积与溶解度的关系2、沉淀的生成、溶解、转化3、分步沉淀第六章氧化还原反应 (7学时)1、氧化还原反应的基本撅念;氧化数;氧化还原反应方程式的配平(氧化数法,离子电子法)2、原电池;电极电势3、标准电极电势:利用标准电极电势判断氧化剂、还原剂的强弱及氧化还原方向;根据标准状态的电池电动势求平衡常数;标准电极电势与金属活动顺序的关系;标准电极电势与电离能的关系4、影响电极电势的因素;能斯特方程,离子浓度对电极电势、氧化还原反应方向的影响,介质酸碱度对氧化还原反应的影响,pH值电势图第七章原子结构与元素周期律(8学时)1、氢光谱;玻尔理论的氢原予模型2、微观离子的运动特点3、核外电子运动状态的描述;波函数和原子轨道,电子云,径向分布,角度分布,四个量子数4、多电子原子基态的电子层结构:屏蔽效应,钻穿效应,近似能级图5、核外电子的排布原理和电子排布6、原子结构与元素周期性的关系;原子的电子层结构与周期、族、区的关系7、电离能,电子亲和能,电负性第八章分子结构(7学时)1、离子键理论:离子键的形成,离子的特征,离子型化合物2、共价键理论:共价键的本性、特征,价健参数和物理性质3、分子轨道理论:理论要点,原子轨道线性组合的一些规则,M0法处理同核双原予分子和异核双原子分子的实例4、杂化轨道理论:理论要点,sp、sp2、sp3和不等性sp3及sp3d、sp3d2杂化,杂化类型与分子空间类型的关系5、价层电子对互斥理论:理论要点,用该理论判断共价分子结构的一些规则6、配位键、金属键的概念7、分子间作用力和氢键第九章配位化合物 (4学时)1、配合物的定义、特征、分类和命名2、配合物的组成3、配合物的化学键理论:价健理论四、参考书目1、《普通化学原理》,华彤文等编,北京大学出版社,19942、《无机化学》,武汉大学、吉林大学等校编,高等教育出版社,19943、《无机化学》,大连理工大学,高等教育出版社,20034、《基础无机化学》,尹敬执、申泮文著,人民教育出版杜,19805、《大学普通化学》,傅鹰,人民教育出版杜,19806、《 CHEMISTRY—The Central Science》(Sixth Edition),BROWN,LEMAY,BURSTEN;1994 by Prentice Hall,Inc.五、学时分配章次0 1 2 3 4 5 6 7 8 9 10学时 1 6 4 6 6 3 8 10 10 3 8。
2022年普通高等学校招生全国统一考试大纲 化学

化学科考试为选拔具有学习潜能和创新精神的考生,根据普通高等学校对新生思想道德素质和科学文化素质的要求,以能力测试为主导,将在测试考生必备知识、关键能力和思维方法的基础上,全面检测考生的化学科学素质。
化学科命题注重测量自主学习的能力,重视理论联系实际,关注与化学有关的科学技术、社会经济和生态环境的协调发展,促进学生在知识和技能、过程和方法、情感态度和价值观等方面的全面提升,促进学生德智体美劳全面发展。
1. 接受、吸收、整合化学信息的能力(1)对中学化学基础知识能正确复述、再现、辨认,并能融会贯通。
(2)通过对自然界、生产和生活中的化学现象的观察,以及实验现象、实物、模型的观察,对图形、图表的阅读,获取有关的感性知识和印象,并进行初步加工、吸收、有序存储。
(3)从提供的新信息中,准确地提取实质性内容,并与已有知识整合,重组为新知识块。
2. 分析和解决化学问题的能力(1)将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题。
(2)将分析和解决问题的过程及成果,能正确地运用化学术语及文字、图表、模型、图形等进行表达,并做出合理解释。
3. 化学实验与探索的能力(1)掌握化学实验的基本方法和技能,并初步实践化学实验的普通过程。
(2)在解决化学问题的过程中,运用化学原理和科学方法,能设计合理方案,初步实践科学探索。
高考化学命题对知识内容的要求分为了解、理解(掌握)、综合应用三个层次,高层次的要求包含低层次的要求。
其含义分别为:了解:对所学化学知识有初步认识,能够正确复述、再现、辨认或者直接使用。
理解(掌握):领略所学化学知识的含义及其合用条件,能够正确判断、解释和说明有关化学现象和问题。
能“知其然”,还能“知其所以然”。
综合应用:在理解所学各部份化学知识之间的本质区别与内在联系的基础上,运用所掌握的知识进行必要的分析、类推或者计算,解释、论证一些具体的化学问题。
根据普通高等学校对新生科学素质的要求,按照既保证与全国普通高校招生统一考试的要求基本一致,又有利于实验省(自治区、直辖市)实施普通高中化学课程标准的原则,参照《普通高中化学课程标准(实验)》,将高考化学科考试范围分为必考内容和选考内容。
《普通化学》课程教学大纲

《普通化学》课程教学大纲《普通化学》课程教学大纲一、课程说明(一)课程名称、所属专业、课程性质、学分;普通化学、材料物理、必修、3学分(二)课程简介、目标与任务;课程简介:普通化学课程主要讲授化学原理,包括气体和液体的基本定律,热化学和化学反应方向,化学平衡(包括水溶液中的离子平衡、氧化还原反应等)及其在容量分析中的应用,化学反应速率,原子的电子结构,分子结构和理论,晶体结构配位化学以及常见元素及化合物的基本性质和有机化学、高分子化学、仪器分析等基础知识内容。
此课程也是高等学校材料、化学、化工、药学、轻工、纺织、环境、冶金地质等有关专业的第一门化学基础课,因此它是培养上述各类专业技术人才的整体知识结构及能力结构的重要组成部分,同时也为后继材料、化学及其它课程打下基础。
目标与任务:《普通化学》是一般工科学生大学阶段唯一的化学必修课,因此本课程介绍学生所应具备的化学最基本的基础理论、基本知识、以及与化学密切相关的社会热点、科技前沿发展、学科渗透交叉等方面的知识,使学生具有较高的化学素质和知识水平,建立化学的思维方式,增加用化学方法解决实际问题,尤其是材料领域研究问题的综合能力。
(三)先修课程要求,与先修课与后续相关课程之间的逻辑关系和内容衔接;先修课:高中化学;高中物理;高中数学后续相关课程:材料科学基础;陶瓷材料;功能材料;物理化学;固体化学(四)教材与主要参考书。
教材:大连理工大学无机化学教研室编:《无机化学》,高等教育出版社,2006参考书:1、张淑民著:《无机化学》,兰州大学出版社,19952、华彤文主编:《普通化学原理》,北京大学出版社,20133、浙江大学普通化学教研组编:《普通化学》,高等教育出版社,2011二、课程内容与安排第一章绪论第一节介绍化学的定义;第二节化学变化的特征;第三节化学的疆域;第四节学习要点,学习方法及课程安排(一)教学方法与学时分配课堂讲授;共1学时。
第二章气体第一节理想气体状态方程;第二节理想气体状态方程的应用;第三节混合气体的分压定律和分体积定律;第四节气体分子动理论的基本要点;第五节真实气体(一)教学方法与学时分配课堂讲授;共2学时。
普通高中化学考试大纲

普通高中化学考试大纲一、考试目的与要求普通高中化学考试旨在考查学生对化学基础知识的掌握程度,以及运用这些知识分析问题和解决问题的能力。
考试要求学生能够理解化学概念、原理,掌握化学实验技能,并通过化学知识解决实际问题。
二、考试内容与范围1. 化学基本概念- 物质的组成、性质和变化- 原子、分子和离子- 化学键和分子间力- 化学计量和化学方程式2. 物质的分类与性质- 元素周期表和元素周期律- 金属和非金属元素的性质- 酸碱盐的性质和反应3. 化学反应原理- 反应速率和化学平衡- 氧化还原反应- 有机化学基础4. 化学实验技能- 基本实验操作和仪器使用- 实验数据处理和分析- 常见化学实验5. 化学与生活、环境- 化学在日常生活中的应用- 环境污染与化学治理- 化学与健康三、考试形式与题型1. 选择题:包括单项选择题和多项选择题,考查学生对化学基础知识的掌握程度。
2. 填空题:考查学生对化学概念、原理的理解和应用能力。
3. 简答题:考查学生对化学知识的综合运用能力。
4. 实验题:考查学生对化学实验操作和实验结果分析的能力。
5. 计算题:考查学生运用化学计量进行计算和分析问题的能力。
6. 论述题:考查学生对化学知识的深入理解和综合运用能力。
四、考试时间与分值考试时间一般为120分钟,总分为100分。
具体分值分布如下:- 选择题:30分- 填空题:10分- 简答题:20分- 实验题:20分- 计算题:10分- 论述题:10分五、考试备考建议1. 系统复习化学基础知识,确保对概念、原理有深刻理解。
2. 注重化学实验操作的练习,提高实验技能。
3. 多做练习题,尤其是历年真题,熟悉考试题型和答题技巧。
4. 加强化学与生活、环境的联系,提高运用化学知识解决实际问题的能力。
5. 注重时间管理,合理分配答题时间,确保所有题目都能得到充分解答。
六、考试注意事项1. 仔细阅读题目要求,避免因误解题目而失分。
2. 答题前先规划好时间,确保有足够的时间完成所有题目。
普化必讲内容

普通化学必讲内容1. 气体和溶液(1)分散体系概述(2)溶液;溶解;溶解度;相似相溶原理;浓度的表示(3)稀溶液的依数性;蒸气压下降;拉乌尔定律;沸点升高;凝固点降低;渗透压(4)胶体分散体系溶胶与凝胶;布朗运动;丁铎尔效应;电泳与电渗;胶体的表面特性;胶团结构;溶胶的稳定与聚沉2. 化学热力学基础(1)理想气体状态方程;分压定律(2)系统与环境;相与界面;体系的性质(3)状态与状态函数;过程与途径;标准态(4)化学反应的质量守恒;化学反应计量方程式;化学计量数(5)热力学第一定律;功与热;热力学能与热力学能变;焓与焓变;盖斯定律;化学反应热的计算(6)热力学第二定律;自发过程与自发方向;混乱度与熵及熵变;熵增原理;吉布斯自由能与吉布斯自由能变;吉布斯-亥姆霍兹公式;反应商(7)热力学第三定律;标准熵(8)反应方向的判据(9)化学平衡;标准平衡常数;多重平衡;化学反应等温方程;标准摩尔反应焓计算; 标准摩尔反应熵计算;标准摩尔反应吉布斯自由能计算;影响化学平衡的因素;平衡移动原理3化学平衡原理标准平衡常数;多重平衡系统;化学平衡的移动4. 化学反应速率(1)化学反应进度;化学反应速率;基元反应(2)浓度对反应速率的影响:反应速率方程;反应速率常数(3)反应级数;反应机理(4)温度对反应速率的影响:阿仑尼乌斯公式;活化能(5)基元反应速率理论简介: 碰撞理论;过渡态理论(6)催化剂对反应速率的影响:催化剂;催化作用;催化反应历程;生物催化剂(7)链反应与光反应简介5. 物质结构基础原子结构微观粒子的运动特征:量子化;波粒二象性;统计规律;德布罗依关系式原子结构:波函数与原子轨道;电子云与概率密度;四个量子数;原子轨道的角度分布与径向分布图形;电子云的角度分布与空间分布图形、界面图;核外电子排布原则;原子轨道的近似能级图;原子核外电子排布;价电子构型;核外电子排布的周期性与元素周期表;元素性质的周期性(原子半径,电离能,电子亲和能,电负性,金属性与非金属性)6 化学键与分子结构离子键;共价键(价键理论,杂化轨道理论);金属键;氢键;分子的极性;偶极矩;分子间力;离子的极化7 酸碱反应水的离子积常数;一元弱酸与弱碱的电离平衡;多元弱酸弱碱的电离平衡;两性物质体系的电离平衡;酸碱质子理论;盐的水解;同离子效应;盐效应;缓冲溶液8 沉淀-溶解反应离子积;溶度积常数;溶度积规则;分步沉淀;沉淀的溶解与转化9. 氧化还原反应(1)原电池原电池的构造;电极反应;电池反应;电池符号;电极电位与电极电势;电动势(2)标准电极电势指示电极;参比电极;标准氢电极;甘汞电极;标准电极电势(3)能斯特方程式实际情况下的电极电势;能斯特关系式;能斯特公式的应用(4)电化学热力学原电池电动势与吉布斯自由能变的关系;原电池标准电动势与标准平衡常数的关系(5)电极电势的应用计算电动势;判断原电池的正负极;氧化还原能力的强弱;氧化还原反应的方向;氧化还原反应进行的程度(6)电解电解池;分解电压与析出电位;超电压与超电位;电极的极化(浓差极化,电化学极化);极化曲线;电极放电规律与电解产物10配位化合物(1)配合物基本概念配位化合物的定义、构成(中心离子或中心原子,配体,配位原子,配位键,配位数)与命名(2)配位化合物的结构理论杂化轨道理论和空间构型;内轨型域外轨型配合物;配合物的磁性(3)螯合物(4)配位离解平衡;配合物的稳定常数;配合物的离解常数(不稳定常数);逐级稳定常数;逐级离解常数;累积平衡。
普通化学原理927大纲

普通化学原理927大纲I.化学基本概念和原理A.原子结构:原子的组成、元素周期表、原子核、电子结构等。
B.化学键和分子结构:离子键、共价键、金属键、分子和晶体结构。
C.化学反应和化学方程式:化学反应类型、平衡常数、速率方程。
D.化学计量和化学方程式的应用:摩尔计算、化学反应的平衡计算、热力学计算。
II.气体和气体定律A.理想气体定律:理想气体状态方程、熵增定律、气体混合物的性质。
B.真实气体和气体的行为:气体的偏离行为、气体的挤压和液化、气体溶解性。
III.溶液和溶解度A.溶液的基本概念:溶质、溶剂、溶解度、饱和溶液等。
B.溶液的浓度计算:摩尔浓度、质量浓度、体积浓度等。
C.溶液的化学反应:溶解度平衡、酸碱中和反应、配位化合物的形成。
IV.化学平衡与反应动力学A. 化学平衡:化学平衡的条件、平衡常数、Le Châtelier原理。
B.化学反应速率:反应速率的定义、速率方程、反应速率与浓度的关系。
C.化学平衡和反应速率的应用:平衡常数的计算、反应机理的分析。
V.酸碱和酸碱平衡A. 酸碱的理论:Arrhenius理论、Brønsted-Lowry理论、Lewis理论。
B.强酸弱酸和强碱弱碱:强酸弱碱的定义、酸碱中和反应的计算。
C.酸碱平衡的计算:pH和pOH的计算、酸碱平衡的常数。
VI.化学热力学A.热化学方程式:内能、焓、热化学反应方程式。
B.热力学定律:热力学第一定律、热力学第二定律、熵的改变。
C.热力学计算:焓变和反应热计算、自由能和化学平衡计算。
VII.化学反应动力学A.反应动力学的基本概念:反应速率、活化能、反应机理。
B.反应速率方程式:速率常数、反应级别、反应速率和温度的关系。
C.反应动力学的应用:反应速率的控制、催化剂的作用。
VIII.化学电化学A.化学电池:电势、电解质溶液、电极和电子转移。
B. 电动势和电解质溶液的浓度: Nernst方程,标准电位,电化学细胞的应用。
普通化学教学大纲

普通化学教学大纲引言:普通化学作为一门基础学科,是理科及工科专业中必修的一门课程。
它着重培养学生对基本化学概念和原理的理解,以及涉及到的实验技巧和安全知识。
本文档旨在为普通化学教学制定一份大纲,以指导教师和学生在教学过程中的具体安排和学习目标。
课程目标:1. 掌握基本化学概念和原理。
包括原子结构和元素周期表、化学键和分子结构、化学方程式和化学反应、氧化还原反应等。
2. 培养实验技巧和实验安全意识。
学生应具备基本的实验操作能力,并能正确运用实验仪器和设备。
同时,学生应了解实验中的安全事项和风险预防措施。
3. 培养化学思维和问题解决能力。
通过解决化学问题和实际应用案例,培养学生的逻辑思维和科学推理能力。
4. 开发学生对科学的兴趣和创新意识。
通过有趣的化学实验和案例研究,激发学生对科学研究的兴趣和动力。
课程大纲:1. 原子结构和元素周期表1.1 原子和分子的基本概念1.2 元素周期表的组成和分类1.3 原子结构和元素周期表的相互关系2. 化学键和分子结构2.1 化学键的种类和强度2.2 分子结构的影响因素2.3 分子间相互作用的原理3. 化学方程式和化学反应3.1 化学方程式的基本要素3.2 反应类型的分类和特点3.3 化学反应速率和平衡的研究4. 酸碱中和反应和氧化还原反应4.1 酸碱中和反应的基本原理4.2 氧化还原反应的基本概念4.3 化学强度和电化学概念的讲解5. 化学实验和实验技巧5.1 实验仪器和设备的使用和操作5.2 常见实验方法和技巧的实践5.3 实验数据的处理和分析教学方法:1. 授课结合实例。
在讲授基本概念和原理时,结合实际案例和应用来进行讲解,以增加学生的兴趣和理解深度。
2. 实验教学。
在教学过程中加强实验教学的环节,让学生亲自动手进行化学实验,培养实验技巧和安全意识。
3. 问题解决和讨论。
鼓励学生在学习过程中提问和发表自己的观点,培养学生的思考能力和团队合作精神。
评估方式:1. 课堂测验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二节 沉淀的生成
第三节 分步沉淀
第四节 沉淀的转化
第五节 沉淀的溶解
教学要求:
1. 掌握沉淀–溶解平衡和溶度积基本概念;
2. 弄清难溶电解质溶解度、溶度积和离子积的关系并能进行有关的近似计算;
适用专业:食品、生物、动医、动科,资环等专业。
所需先修课:
课程负责人:刘霞
二、 课程内容简介(中英文对照)
(包括课程性质、任务、主要内容、重点及深度等,字数约300-500字)
普通化学为食品科学与工程类及生物类等各专业本科生的必修基础课程。主要介绍如下几个方面的知识:1). 学习化学基本原理及其在学生所学专业领域中的应用;2). 了解现代化学的实验基础;3). 熟悉用化学术语描述相关化学反应。
第二章 化学键分子结构(6学时)
第一节 离子键理论
第二节 共价键理论
第三节 轨道杂化理论
第四节 分子间力和氢键
第五节 晶体结构
教学要求:
1. 理解离子键理论的要点、离子键的特点,理解离子的特征(离子半径、离子电荷及离子的电子构型)对离子化合物性质的影响;
2. 配合物命名(根据化学式命名;根据名称写出化学式);
3. 理解配合物稳定常数的概念,能进行有关计算;
4. 理解配体酸效应、中心原子水解效应、沉淀反应、氧化还原反应等影响配位平衡移动的因素,并能进行有关计算。
第九章 氧化还原反应(8学时)
华彤文、陈景祖、严洪杰、王颖霞、卞江、李彦 著,《普通化学原理(第三版)》,北京大学出版社,2005。
执笔人:刘霞 鲁润华
审定人:杜凤沛
2012年 3月12日制定(修订)
Topics studied in this course mainly include, solution and colloid, atomic structure, chemical bonding and molecular structure(valence bond theory, molecular orbital theory, etc.), basic thermodynamics, chemical dynamics, principles of chemical equilibrium, equilibriums on acid-base, precipitation-dissolution, oxidation-reduction, and coordination, etc., and as well as elemental chemistry.
2. 了解波函数与原子轨道、几率密度与电子云、原子轨道和电子云角度分布图等基本概念;
3. 掌握四个量子数的物理意义、相互关系及合理组合;
掌握单电子原子、多电子原子的轨道能级和核外电子排布规律,熟练写出第四周期以内元素原子的核外电子排布式;
5. 掌握原子结构与周期系的关系,了解元素基本性质的变化规律。
2. 掌握共价键理论现代价键理论要点和σ键、π健的特征;
3. 掌握杂化轨道理论基本要点,杂化类型、特征;等性、不等性杂化概念及应用,了解杂化轨道与分子空间构型的关系,能正确判断简单分子的空间构型;
4. 理解分子间力类型、特点、产生原因;
5. 掌握氢键形成条件、特征、应用及其对物质重要性质的影响;
2. 理解热力学第一定律的内涵;
3. 掌握化学反应定容热、定压热概念及其与反应的摩尔热力学能(变)、摩尔焓(变)的关系;
4. 理解并能熟练运用热化学定律,掌握化学反应热的基本计算方法;
5. 理解自发过程的趋势,了解熵与混乱度的概念;
第三章 溶液和胶体(4学时)
第一节 分散系及其分类
第二节 溶液
第三节 胶体溶液
教学要求:
1. 了解分散体系的分类;
2. 掌握溶液浓度的定义及其相互换算;
3. 掌握稀溶液的依数性及其计算;
4. 理解稀释作用、了解盐效应对酸碱平衡移动的影响;
5. 了解酸碱缓冲溶液的性质,理解酸碱缓冲溶液作用原理;
6. 掌握缓冲溶液pH的计算;
7. 掌握缓冲溶液的配制方法。
第七章 沉淀反应及沉淀-溶解平衡(6学时)
2. 掌握有关原电池的概念;电极电势概念,了解其物理意义;
3. 理解原电池电动势与反应摩尔吉布斯自由能的关系,掌握判断氧化还原反应自发方向的方法;
4. 掌握能斯特方程及其应用;
5. 掌握氧化还原反应标准平衡常数与反应的标准摩尔吉布斯自由能的关系;
4. 掌握胶体的特性及胶团结构式的书写。
第四章 化学反应速率(4学时)
第一节 化学反应速率及其表示法
第二节 化学反应速率理论简介
第三节 影响化学反应速率的因素
教学要求:
1. 掌握化学反应速率的表示方法及基元反应、复杂反应等基本概念;
普通化学课程教学大纲
(General chemistry )
一、 课程基本情况
课程编号:10110300
课程总学时:56,其中:讲课:56,实验:0,上机:0,实习:0,课外:0。
课程学分:3.5
课程分类:(填必修或选修) 必修
开课学期:(填秋或春或夏) 秋、1上
开课单位:理学院应化系无机及分析化学教研室
第八章 配位化合物(4学时)
第一节 配合物的基本概念
第二节 配合物的化学键理论
第三节 配位平衡
第四节 螯合物
第五节 ቤተ መጻሕፍቲ ባይዱ配合物的应用
教学要求:
1. 了解配合物、配合物内界、外界、中心原子、配体、配体原子及螯合物等概念;
第一节 基本概念
第二节 氧化还原反应方程式的配平
第三节 原电池和电极电势
第四节 电动势与吉布斯自由能变
第五节 影响电极电势的因素
第六节 电极电势图及应用
教学要求:
1. 掌握氧化还原反应式的配平方法;
第二节 酸碱平衡
第三节 酸碱平衡的移动
第四节 缓冲溶液及其性质
教学要求:
1. 掌握质子酸碱、共轭酸碱、两性物质、酸碱反应、酸碱离解常数等概念;
2. 熟练运用近似方法计算酸碱水溶液的酸度和其它有关离子浓度;
3. 理解同离子效应、介质酸度对酸碱平衡移动的影响,熟练掌握有关近似计算;
三、各部分教学纲要
第一章 原子结构和元素周期系(8学时)
第一节 核外电子的运动特性
第二节 核外电子运动状态的描述
第三节 原子核外电子的排布和元素周期律
第四节 原子结构与元素周期性
教学要求:
1. 了解微观粒子的运动特征:能量量子化、波粒二象性、测不准关系;
6. 掌握标准电极电势图及其应用。
四、使用教材的名称、主编人、出版社、出版时间及版次及主要参考书名称。
教材:
揭念芹 主编《基础化学》(第二版),科学出版社,2008年。
主要参考书:
1. 赵士铎 主编,《普通化学》(第三版),中国农业大学出版社,2007年。
2. 黄秀锦 主编,《无机及分析化学》,科学出版社,2005。
2. 了解浓度对反应速率的影响;理解质量作用定律;
3. 了解反应速率理论,了解活化能;理解反应速率常数、反应级数等概念;了解速率方程;
4. 了解温度对反应速率的影响;掌握阿仑尼乌斯公式的简单应用;
5. 了解催化剂对反应速率的影响;
这门课程包含的主要内容有:溶液和胶体;原子结构;化学键与分子结构;化学平衡原理;化学热力学基础;水溶液中的四大平衡:酸—碱平衡、沉淀—溶解平衡、氧化—还原平衡、配位平衡。
General chemistry is a kind of course designed to provide following knowledges for non-chemistry studying students: 1). Learn the general principles of chemistry and their applications in current events related to the majors of the students; 2). Understand the experimental basis for modern chemistry; 3). Become familiar with the language of chemistry and with the representation of chemical reactions.
6. 掌握反应速率的碰撞理论要点。
第五章 化学热力学基础知识(10学时)
第一节 热力学第一定律
第二节 热化学
第三节 化学反应的自发性
第四节 化学平衡
教学要求:
1. 了解化学热力学基本概念,了解热力学能、焓、熵、自由能等状态函数的物理意义;
3. 掌握溶度积原理;
4. 掌握沉淀生成与溶解的条件、分步沉淀与转化的原理,并进行相关计算;
5. 掌握介质酸度对沉淀—溶解平衡的影响;
6. 理解氧化还原反应、配位反应对沉淀–溶解平衡的影响;
7. 理解同离子效应和盐效应对沉淀–溶解平衡的影响。
6. 掌握吉布斯自由能的有关计算,能用吉布斯自由能判据判断化学反应的自发方向;
7. 熟练运用吉布斯-亥姆霍兹方程进行有关计算;
8. 掌握浓度、压力、温度对化学平衡移动的影响。
第六章 酸碱反应及酸碱平衡(6学时)
第一节 质子酸碱理论
