南京大学-热力学与统计物理第4章
热力学与统计物理第四章

(4.9)
式(4.9)表明,整个系统达到平衡时,两相的温度、压力和化学势 必须相等, 这就是复相系统的平衡条件。 如果平衡条件未被满足,复相系统将发生变化。变化朝着熵增加 的方向进行。如果热平衡条件未能满足,变化将朝着
的方向进行。
1 1 U 0 T T
例如,当T T 时,变化朝着U 0 的方向进行。 即能量将从高温的相传递到低温的相去。
1 p p 1 U V n T T T T T T
当整个系统达到平衡时,总熵有极大值
(4.7)
S 0
考虑到式(4.7)中的 U 要求
设T,p和T dT, p dp 是两相平衡曲线上邻近两点, 在这两点
上两相的化学势相等:
T , p T , p
T dT, p dp T dT, p dp
两式相减得
d d
(4.11)
式(4.11)表示,当沿着平衡曲线由(T,P)变到(T+dT,p+dp) 时,两相化学势的变化相等。
第四章 相平衡
第四章
相平衡
本章将讨论多组元复相系统
相的定义:系统中物理性质相同的部分,称为一个相。 如果系统是由多相组成的,则该系统称为复相系。在复相 系中可能发生相转变过程。这个过程简称为相变。 当系统参量在某个值附近作微变动时,系统的某些物理性 质发生显著的跃变的现象,称该系统经历了相变。 在相变过程中,物质可以由一相变到另一相,因此一个相 的质量或摩尔数是可变的,这时系统为开系。
两相边界线为相平衡曲线。 如图中1和2两相的平衡曲线称为 气化曲线AC。在气化线上气液两 相可以共存。
南京大学物理化学(第五版)04章_多组分系统热力学
(
Gm p
)T
Vm
对多组分系统,把 Gm 换为 B ,则摩尔体积变为偏
摩尔体积 VB 。
化学势与温度的关系
(
B
T
)
p
,nB
,
nc
[ T
G ( ) ] T , p,nc p,nB ,nc nB
[ nB
G ( T ) p,nB ,nc ]T , p,nc
(S) [ nB ]T , p,nc
nk 0
dnk
k
n1Z1 n2 Z2 nk Zk nBZB B=1
偏摩尔量的加和公式
k
Z= nB ZB
B=1
这就是偏摩尔量的加和公式,说明系统的总 的容量性质等于各组分偏摩尔量的加和。
例如:系统只有两个组分,其物质的量和偏 摩尔体积分别为 n1,V1 和 n2 ,V2 ,则系统的总体积为:
(1)热力学能
设系统中有 1, 2,3, , k 个组分
所含的量分别为 n1, n2, , nk
U U (S,V , n1, n2, , nk )
化学势的定义
U U (S,V , n1, n2, , nk )
其全微分为
dU
U ( S )V ,nB dS
(
U V
)
S
,nB
dV
k U B1 ( nB )S ,V ,nc(cB) dnB
如果转移是在平衡条件下进行,则
dG 0 又
dnB dnB
所以 (B B )dnB 0
化学势在相平衡中的应用
(B B )dnB 0
因为 dnB 0 所以
B B
组分B在α,β两相中,达平衡的条件是该
热力学与统计物理复习资料

i
i
根据以上两式,
SdT −Vdp + ∑ nidµi = 0
i
这称为吉布斯关系,表明 k + 2 个强度量 T, p, μi (i = 1, 2, …, k)中只有 k + 1 个是独立的。
∂V ∂p
T
由
∂V ∂T
∂T ∂p
p
∂p
V
∂V
T
=
−1 ,可得α
= κT β p
1 / 35
热力学•统计物理(第五版)
汪志诚编 朱泽斌&尹韩整理
1.3 pV = nRT p11
范德瓦耳斯气体:
p
+
an2 V2
(V
−
nb)
= nRT
1.4 顺磁性固体 p13
居里定律:
数。
2.12 将热力学方程通过代换 p → −µ0 H ,V → m 可得磁介质的热力学方程。p68 m = MV 为介质的总磁矩;H:磁场强度
2.13 绝热去磁致冷(推导)p69
由完整微分条件可得
∂S ∂H
T
=
µ0
∂m ∂T
H
(1)
在磁场不变时,磁介质的热容 CH 为
CH
=
T
∂S ∂T
1.7 焓 p23
CV
=
∂U ∂T
V
; Cp
=
∂H ∂T
p
Cp − CV = nR
γ = Cp CV
; CV
=
nR γ −1
; Cp = γ CV
H= U + pV ; ∆H =∆U + p∆V
1.8 焦耳定律 p23:气体的内能只是温度的函数,与体积无关。 U = i nRT ,i:自由度 2
热力学与统计物理课件 统计物理部分 第四章 系综理论

为子相空间。
其中N个点对应相空间的关系可以这样考虑:相空间与相空间。
在某些条件下,发,用整个系统的广义坐标和广义动量所张开的空间来描述系统的状态,这个相空间称为μΓΓμΓμΓ处理粒子间有强相互作用这类问题,不能用分子(相空间,而要用系统(两者都表示一个运动状态,后者是前者的集合。
))相空间。
直接从整个系统状态出相空间的一个点;ΓNr 2Γ空间:以描述系统状态的广义坐标和广义动量为轴构成系统在某一时刻的运动状态,可用称为系统运动状态的代表点。
的笛卡尔坐标空间。
(此空间有个维数)空间中的一点表示,空间。
系统任意时刻的运动状态可以用维的空间就是上述提到的个广义坐标Nr f =二、两种统计平均(1)时间平均(2)系综平均比如在经典力学的范畴内,一个由N个粒子组成的,有相互作用的经典系统的自由度数目,r f f q q L 1f P P L 1f q q L 1f P P L 1f 2ΓΓΓ这样一个经典系统在任意时刻的运动状态可以由该时刻的,以及与之共轭的广义动量来描述。
以,构成的一点来描述,这即是运动状态的代表点。
当系统的运动状态随时间改变时,其代表点就在随时间变化从而划出一条轨道,这个轨道称为系统的相轨道。
为一个粒子的自由度,空间的空间中根据外部条件的不同可以将系综分为三类:(1)微正则系综:孤立系统N、E、V不变(2)正则系综:N、V、T不变,设想与大热源接触μ不变,设想与热源、粒子源接触。
(3)巨正则系综:V、T、之间的一个窄范围内,系统不可能有处在这个能量范围之外的微观状态。
在一宏观条件:孤立系统:N 、E 、V 保持不变(对连续问题,E 在一个能壳范围内)一、微正则分布:ρE E E Δ+E E E Δ+孤立系统的能量具有确定值,更精确地说能量在和和的微观状态数是大量的,而且每一个可能的微观状态出现的概率都相等,这称为等概率原理,即等几原理。
等概率原理:对于平衡态的孤立系统(属于同一能量和相同粒子数),系统的一切微观态出现的概率是相等的。
热力学与统计物理答案第四章

第四章 多元系的复相平衡和化学平衡4.1 若将U 看作独立变量1,,,,k T V n n 的函数,试证明:(a );iii U UU n V n V∂∂=+∂∂∑ (b ).i i i U U u u n V∂∂=+∂∂ 解:(a )多元系的内能()1,,,,k U U T V n n =是变量1,,,k V n n 的一次齐函数. 根据欧勒定理(式(4.1.4)),有,,,ji i i T V n U UU n V n V ⎛⎫∂∂=+ ⎪∂∂⎝⎭∑ (1) 式中偏导数的下标i n 指全部k 个组元,j n 指除i 组元外的其他全部组元.(b )式(4.1.7)已给出v ,i i iV n =∑,i i iU n u =∑ (2)其中,,,,v ,j ji ii i T p n T p n V U u n n ⎛⎫⎛⎫∂∂==⎪ ⎪∂∂⎝⎭⎝⎭偏摩尔体积和偏摩尔内能. 将式(2)代入式(1),有,,,v i ji i i i i i i i T n i T V n U U n u n n V n ⎛⎫∂∂⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭∑∑∑ (3) 上式对i n 的任意取值都成立,故有,,,v .i ji i T n i T V n U U u V n ⎛⎫∂∂⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭ (4)4.2 证明()1,,,,i k T p n n μ是1,,k n n 的零次齐函数0.i i i i n n μ⎛⎫∂= ⎪∂⎝⎭∑ 解:根据式(4.1.9),化学势i μ是i 组元的偏摩尔吉布斯函数,,.ji i T p nG n μ⎛⎫∂=⎪∂⎝⎭ (1) G 是广延量,是1,,k n n 的一次齐函数,即()()11,,,,,,,,.k k G T p n n G T p n n λλλ= (2)将上式对λ求导,有()()()()()()111,,,,,,,,,,,,k k i i i ik ii G T p n n G T p n n n n n G T p n n n λλλλλλλλλλλ∂=∂∂∂=∂∂∂=∂∑∑左方()1,,,,,i i k in T p n n μλλ=∑ (3)()()11,,,,,,,,k k G T p n n G T p n n λλ∂=⎡⎤⎣⎦∂=右边()1,,,,.i i k in T p n n μ=∑ (4) 令式(3)与式(4)相等,比较可知()()11,,,,,,,,.i k i k T p n n T p n n μλλμ= (5)上式说明i μ是1,,k n n 的零次齐函数. 根据欧勒定理(式(4.1.4)),有0.i j j i n n μ⎛⎫∂= ⎪∂⎝⎭∑ (6)4.3 二元理想溶液具有下列形式的化学势:()()111222,ln ,,ln ,g T p RT x g T p RT x μμ=+=+其中(),i g T p 为纯i 组元的化学势,i x 是溶液中i 组元的摩尔分数. 当物质的量分别为12,n n 的两种纯液体在等温等压下合成理想溶液时,试证明混合前后(a )吉布斯函数的变化为()1122ln ln .G RT n x n x ∆=+(b )体积不变,即0.V ∆=(c )熵变()1122ln ln .S R n x n x ∆=-+ (d )焓变0,H ∆= 因而没有混合热. (e )内能变化为多少?解:(a )吉布斯函数是广延量,具有相加性. 混合前两纯液体的吉布斯函数为()()()01122,,,.G T p n g T p n g T p =+ (1)根据式(4.1.8),混合后理想溶液的吉布斯函数为()()()()()112211112222,,,,In ,In .G T p n T p n T p n g T p n RT x n g T p n RT x μμ=+=+++ (2)混合前后吉布斯函数的变化为()()0,,G G T p G T p ∆=-()1122ln ln ,RT n x n x =+ (3)其中12121212,n n x x n n n n ==++分别是溶液中组元1,2的摩尔分数. (b )根据式(4.1.10),混合前后体积的变化为12,,0.T n n V G p ⎛⎫∂∆=∆= ⎪∂⎝⎭ (4)(c )根据式(4.1.10),混合前后熵的变化为12,,p n n S G T ∂⎛⎫∆=-∆ ⎪∂⎝⎭()1122ln ln .R n x n x =-+ (5)注意1x 和2x 都小于1,故0,S ∆> 混合后熵增加了.(d )根据焓的定义,H G TS =+ 将式(3)和式(5)代入,知混合前后焓的变化为0.H G T S ∆=∆+∆= (6)混合是在恒温恒压下进行的.在等压过程中系统吸收的热量等于焓的增加值,式(6)表明混合过程没有混合热.(e )内能.U H pV =- 将式(6)和式(4)代入,知混合前后内能的变化为0.U H p V ∆=∆-∆= (7)4.4 理想溶液中各组元的化学势为(),ln .i i i g T p RT x μ=+(a )假设溶质是非挥发性的. 试证明,当溶液与溶剂的蒸气达到平衡时,相平衡条件为()11ln 1,g g RT x '=+-其中1g '是蒸气的摩尔吉布斯函数,1g 是纯溶剂的摩尔吉布斯函数,x 是溶质在溶液中的摩尔分数.(b )求证:在一定温度下,溶剂的饱和蒸气压随溶质浓度的变化率为.1Tp p x x ∂⎛⎫=- ⎪∂-⎝⎭ (c )将上式积分,得()01,x p p x =-其中0p 是该温度下纯溶剂的饱和蒸气压,x p 是溶质浓度为x 时的饱和蒸气压. 上式表明,溶剂饱和蒸气压的降低与溶质的摩尔分数成正比. 该公式称为拉乌定律.解:(a )溶液只含一种溶质. 以x 表示溶质在液相的摩尔分数,则溶剂在液相的摩尔分数为1.x - 根据式(4.6.17),溶剂在液相的化学势1μ为()()()11,,,ln 1.T p x g T p RT x μ=+- (1)在溶质是非挥发性的情形下,气相只含溶剂的蒸气,其化学势为 ()()11,,.T p g T p μ''= (2) 平衡时溶剂在气液两相的化学势应相等,即()()11,,,.T p x T p μμ'= (3)将式(1)和式(2)代入,得()()()11,ln 1,,g T p RT x g T p '+-= (4) 式中已根据热学平衡和力学平衡条件令两相具有相同的温度T 和压强p . 式(4)表明,在,,T p x 三个变量中只有两个独立变量,这是符合吉布斯相律的.(b )令T 保持不变,对式(4)求微分,得11.1T T g g RTdp dx dp p x p '⎛⎫⎛⎫∂∂-= ⎪ ⎪∂-∂⎝⎭⎝⎭ (5) 根据式(3.2.1),m Tg V p ⎛⎫∂=⎪∂⎝⎭,所以式(5)可以表示为(),1m m RTV V dp dx x'-=-- (6) 其中m V '和m V 分别是溶剂气相和液相的摩尔体积. 由于m m V V '>>,略去m V ,并假设溶剂蒸气是理想气体,,m pV RT '=可得().11T m p RT p x xx V ∂⎛⎫=-=- ⎪∂-'⎝⎭- (7) (c )将上式改写为.1dp dxp x=-- (8) 在固定温度下对上式积分,可得()01,x p p x =- (9)式中0p 是该温度下纯溶剂的饱和蒸气压,x p 是溶质浓度为x 时溶剂的饱和蒸气压. 式(9)表明,溶剂饱和蒸气压的降低与溶质浓度成正比.4.5 承4.4题:(a )试证明,在一定压强下溶剂沸点随溶质浓度的变化率为()2,1p T RT x L x ∂⎛⎫= ⎪∂-⎝⎭ 其中L 为纯溶剂的汽化热.(b )假设 1.x << 试证明,溶液沸点升高与溶质在溶液中的浓度成正比,即2.RT T x L∆=解:(a )习题4.4式(4)给出溶液与溶剂蒸气达到平衡的平衡条件()()()11,ln 1,,g T p RT x g T p '+-= (1)式中1g 和1g '是纯溶剂液相和气相的摩尔吉布斯函数,x 是溶质在溶液中的摩尔分数,令压强保持不变,对式(1)求微分,有()11ln 1.1ppg g RT dT R x dT dx dT T x T ⎛⎫'∂∂⎛⎫+--= ⎪ ⎪ ⎪∂-∂⎝⎭⎝⎭ (2) 根据(3.2.1),有,m pg S T ∂⎛⎫=- ⎪∂⎝⎭ 所以式(2)可以改写为()ln 1.1m m RTdx S S R x dT x⎡⎤'=-+-⎣⎦- (3)利用式(1)更可将上式表为()111m mg TS g TS RT dx dT x T ⎡⎤''+-+⎢⎥=-⎢⎥⎣⎦,m mH H dT T'-= (4)其中m m H g TS =+是摩尔焓. 由式(4)可得2211,11p m mT RT RT x x x L H H ∂⎛⎫=⋅=⋅ ⎪∂--'⎝⎭- (5) 式中m m L H H '=-是纯溶剂的汽化热.(b )将式(5)改写为()21.1d x dT R T L x--=- (6)在固定压强下对上式积分,可得()011ln 1,Rx T T L-=- (7) 式中T 是溶质浓度为x 时溶液的沸点,0T 是纯溶剂的沸点. 在稀溶液1x <<的情形下,有()()0200ln 1,11,x x T T T T T T T T-≈---∆-=≈ 式(7)可近似为2.RT T x L∆= (8)上式意味着,在固定压强下溶液的沸点高于纯溶剂的沸点,二者之差与溶质在溶液中的浓度成正比.4.6 如图所示,开口玻璃管底端有半透膜将管中的糖的水溶液与容器内的水隔开. 半透膜只让水透过,不让糖透过. 实验发现,糖水溶液的液面比容器内的水现上升一个高度h ,表明在同样温度下糖水溶液的压强p 与水的压 强0p 之差为0.p p gh ρ-=这一压强差称为渗透压. 从理想溶液化学势的表达式可知,如果糖的水溶液与纯水具有相同的压强和温度,糖水溶液的化学势将低于纯水的化学势. 因此水将从容器流入玻璃管,直到糖水的压强增为p ,两相的化学势相等而达到平衡. 平衡时有()()()110,ln 1,,g T p RT x g T p +-=其中1g 是纯水的摩尔吉布斯函数,x 是糖水中糖的摩尔分数,221211n nx n n n =≈<<+(12,n n 分别是糖水中水和糖的物质的量). 试据证明20,n RTp p V-=V 是糖水溶液的体积.解:这是一个膜平衡问题. 管中的糖水和容器内的水形成两相. 平衡时两相的温度必须相等. 由于水可以通过半透膜,水在两相中的化学势也必须相等. 半透膜可以承受两边的压强差,两相的压强不必相等. 以p 表示管内糖水的压强,0p 表示容器内纯水的压强. 根据式(4.6.17),管内糖水中水的化学势为()()()11,,ln 1.T p g T p RT x μ=+- (1)容器内纯水的化学势为()10,.g T p 相平衡条件要求()()()110,ln 1,.g T p RT x g T p +-= (2) 由于p 和0p 相差很小,可令()()()11100,,Tg g T p g T p p p p ⎛⎫∂-=- ⎪∂⎝⎭()10,m V p p =- (3) 其中用了(3.2.1)式,11m Tg V p ⎛⎫∂= ⎪∂⎝⎭是纯水的摩尔体积. 代入式(2),得()01In 1.mRTp p x V -=-- (4) 在1x <<的情形下,可以作近似()ln 1,x x -≈-且糖水溶液的体积11m V n V ≈,因此式(4)可近似为220111.m m n n RTRT RT p p x V V n V-=== (5)4.7实验测得碳燃烧为二氧化碳和一氧化碳燃烧为二氧化碳的燃烧热Q H =-∆,其数值分别如下:522CO C O 0, 3.951810J;H --=∆=-⨯ 5221CO CO O 0, 2.828810J.2H --=∆=-⨯试根据赫斯定律计算碳燃烧为一氧化碳的燃烧热.解:本题给出了两个实验数据,在291K 和1n p 下,有522CO C O 0, 3.951810J;H --=∆=-⨯ (1)5221CO CO O 0, 2.828810J.2H --=∆=-⨯ (2)式(1)的含义是,1mol 的C 与1mol 的2O 燃烧为1mol 的2CO ,放出燃烧热53.951810J.Q =⨯ 由于等压过程中系统吸收的热量等于焓的增量,所以燃烧热为11.Q H =-∆ 式(2)的含义是,1mol 的CO 与1mol 2的2O 燃烧为1mol 的2CO ,放出燃烧热52222.828810J,.Q Q H =⨯=-∆焓是态函数,在初态和终态给定后,焓的变化H ∆就有确定值,与中间经历的过程无关. 将式(1)减去式(2),得5221CO CO O 0,1.123010J.2H --=∆=-⨯ (3)式中312.H H H ∆=∆-∆ 式(3)意味着,1mol 的C 与1mol 2的2O 燃烧为1mol 的CO 将放出燃烧热51.123010J.C ⨯燃烧为CO 的燃烧热是不能直接测量的. 上面的计算表明,它可由C 燃烧为CO 2和CO 燃烧为CO 2的燃烧热计算出来. 这是应用赫斯定律的一个例子.4.8 绝热容器中有隔板隔开,两边分别装有物质的量为1n 和的理想气体,温度同为T ,压强分别为1p 和2p . 今将隔板抽去,(a )试求气体混合后的压强.(b )如果两种气体是不同的,计算混合后的熵增加值. (c )如果两种气体是相同的,计算混合后的熵增加值. 解:(a )容器是绝热的,过程中气体与外界不发生热量交换. 抽去隔板后气体体积没有变化,与外界也就没有功的交换. 由热力学第一定律知,过程前后气体的内能没有变化. 理想气体的内能只是温度的函数,故气体的温度也不变,仍为T.初态时两边气体分别满足111222,.pV n RT p V n RT == (1)式(1)确定两边气体初态的体积1V 和2V . 终态气体的压强p 由物态方程确定:()()1212,p V V n n RT +=+即1212.n n p RT V V +=+ (2) 上述结果与两气体是否为同类气体无关.(b )如果两气体是不同的. 根据式(1.15.8),混合前两气体的熵分别为111,11110,222,22220ln ln ln ln .p m m p m m S n C T n R p n S S n C T n R p n S =-+=-+ (3)由熵的相加性知混合前气体的总熵为12.S S S =+ (4)根据式(4.6.11),混合后气体的熵为111,111012ln lnp m m n S n C T n R p n S n n '=-+++222,222012ln ln.p m m n n C T n R p n S n n -++ (5) 两式相减得抽去隔板后熵的变化()b S ∆为()1212121122ln ln b n n p p S n R n R n n p n n p ⎛⎫⎛⎫∆=-⋅-⋅ ⎪ ⎪++⎝⎭⎝⎭12121212lnln ,V V V Vn R n R V V ++=+ (6) 第二步利用了式(1)和式(2). 式(6)与式(1.17.4)相当. 这表明,如果两气体是不同的,抽去隔板后两理想气体分别由体积1V 和2V 扩散到12.V V + 式(6)是扩散过程的熵增加值.(c )如果两气体是全同的,根据式(1.15.4)和(1.15.5),初态两气体的熵分别为111,1101222,2202ln ln,ln ln.V m m V m m V S n C T n R n S n V S n C T n R n S n =++=++ (7)气体初态的总熵为12.S S S =+ (8)在两气体是全同的情形下,抽去隔板气体的“混合”不构成扩散过程. 根据熵的广延性,抽去隔板后气体的熵仍应根据式(1.15.4)和(1.15.5)计算,即()()()1212,1212012ln ln.V m m V V S n n C T n n R n n S n n +'=++++++ (9) 两式相减得抽去隔板后气体的熵变()c S ∆为()()121212121212lnln ln .c V V V VS n n R n R n R n n n n +∆=+--+ (10) 值得注意,将式(6)减去式(10),得()()12121212lnln .b c n n S S n R n R n n n n ∆-∆=--++ (11) 式(11)正好是式(4.6.15)给出的混合熵.4.9 试证明,在3NH 分解为2N 和2H 的反应22313N H NH 022+-= 中,平衡常量可表为22,41p K p εε=- 其中ε是分解度. 如果将反应方程写作223N 3H 2NH 0,+-=平衡常量为何?解: 已知化学反应0i i iv A =∑ (1)的平衡常量p K 为.i iv v v p i i i i iiK p p x v v ⎛⎫=== ⎪⎝⎭∑∏∏ (2)对于3NH 分解为2N 和2H 的反应22313N H NH 0,22+-= (3)有 12313,,1,1,22v v v v ===-= 故平衡常量为1322123.p x xK p x ⋅=(4) 假设原有物质的量为0n 的3NH ,达到平衡后分解度为ε,则平衡混合物中有012n ε的203N ,2n ε的()20H ,1n ε-的3NH ,混合物物质的量为()01n ε+,因此()()12331,,.21211εεεx x x εεε-===+++ (5) 代入式(4),即得.p K p = (6)如果将方程写作223N 3H 2NH 0,+-= (7)与式(1)比较,知1231,3,2, 2.v v v v ===-=则根据式(2),平衡常量为321223.p x x K p x = (8)将式(5)代入式(8),将有()422227.161p εK p ε=- (9) 比较式(4)与式(8),式(6)与式(9)可知,化学反应方程的不同表达不影响平衡后反应度或各组元摩尔分数的确定.4.10 物质的量为01n v 的气体A 1和物质的量为02n v 的气体A 2的混合物在温度T 和压强p 下体积为0V ,当发生化学变化334411220,v A v A v A v A +--=并在同样的温度和压强下达到平衡时,其体积为.e V 证明反应度ε为01203412.e V V v v εV v v v v -+=⋅+-- 解:根据式(4.6.3),初始状态下混合理想气体的物态方程为()0012.pV n v v RT =+ (1)以ε表示发生化学变化达到平衡后的反应度,则达到平衡后各组元物质的量依次为()()010203041,1,,.n v εn v εn v εn v ε--总的物质的量为()0123412+++--,n v v εv v v v ⎡⎤⎣⎦其物态方程为()0123412.e pV n v v v v v v RT ε=+++--⎡⎤⎣⎦ (2)两式联立,有01203412.e V V v v V v v v v ε-+=⋅+-- (3) 因此,测量混合气体反应前后的体积即可测得气体反应的反应度.4.11 试根据热力学第三定律证明,在0T →时,表面张力系数与温度无关,即0.d dTσ→ 解: 根据式(1.14.7),如果在可逆过程中外界对系统所做的功为 đ,W Ydy =则系统的热力学基本方程为.dU TdS Ydy =+ (1)相应地,自由能F U TS =-的全微分为.dF SdT Ydy =-+ (2)由式(2)可得麦氏关系.y TY S T y ⎛⎫∂∂⎛⎫=- ⎪ ⎪∂∂⎝⎭⎝⎭ (3) 根据热力学第三定律,当温度趋于绝对零度时,物质的熵趋于一个与状态参量无关的绝对常量,即0lim 0.T TS y →⎛⎫∂= ⎪∂⎝⎭ 由式(3)知0lim 0.T yY T →∂⎛⎫= ⎪∂⎝⎭ (4) 对于表面系统,有đ,W dA σ=即,Y A y σ~~,所以0lim 0.T AdT σ→∂⎛⎫= ⎪⎝⎭ (5) 考虑到σ只是温度T 的函数,与面积A 无关(见§2.5),上式可表为0lim0.T dTσ→∂= (6)4.12 设在压强p 下,物质的熔点为0T ,相变潜热为L ,固相的定压热容量为p C ,液相的定压热容量为p C '. 试求液相的绝对熵的表达式.解: 式(4.8.12)给出,以,T p 为状态参量,简单系统的绝对熵的表达式为()()0,,.Tp C T p S T p dT T=⎰(1)积分中压强p 保持恒定. 一般来说,式(1)适用于固态物质,这是因为液态或气态一般只存在于较高的温度范围. 为求得液态的绝对熵,可以将式(1)给出的固态物质的绝对熵加上转变为液态后熵的增加值.如果在所考虑的压强下,物质的熔点为0T ,相变潜热为L ,固相和液相的定压热容量分别为p C 和p C ',则液相的绝对熵为()()()000,,,.T T p p C T p C T p L S T p dT dT TT T=++⎰⎰ (2)4.13 锡可以形成白锡(正方晶系)和灰锡(立方晶系)两种不同的结晶状态。
统计热力学课件第四章

T
S
T V
等熵线与等温线斜率之比
p V S
2011-4-25
T p V T S
T 0 两线重合
lim 1
T 0
27
3、绝对零度不能达到原理(1912年)
不可能使一个物体的温度冷却到绝对温度的零度。
4、热力学第三定律
选择多元体系的状态参量:T、p、nk(mk),热力学函 数体积、内能和熵分别为:
2011-4-25
3
若状态参量T、p不变,而各组元的物质量增加λ倍, 则相应的热力学函数体积、内能和熵也增加λ倍:
热力学函数体积、内能和熵都是各组员物质量的一次齐函数。 注意:
2011-4-25
4
• 偏摩尔变数
物理意义: 在保持温 度、压强及其他 组元摩尔数不变 的情况下,每增 加1mol第i组元物 偏摩尔体积 偏摩尔内能 偏摩尔熵 质量系统体积、 内能、熵的增 量。
S V 0 lim lim T 0 T T 0 p p T
1 V V T p
lim p 0
T 0
1 p p T V
lim 0
T 0
26
2011-4-25
2011-4-25 22
等温等压下虚变动所引起的系统的吉布斯函数变化为:
G=0 等温等压下,平衡态的吉布斯函数最小,即: 由此可得:
=0
i i
——单相化学反应的平衡条件
如果平衡未能满足,则反应必向使吉布斯函数减小方 向继进行:
2011-4-25
23
ni
2011-4-25
24
§4.8
热力学与统计物理答案(汪志诚)

第一章 热力学的基本规律习题1.1 试求理想气体的体胀系数α,压强系数β和等温压缩系数T κ。
解:由得:nRT PV = V nRTP P nRT V ==; 所以, T P nR V T V V P 11)(1==∂∂=αT PV RnT P P V /1)(1==∂∂=βP PnRT V P V V T T /111)(12=--=∂∂-=κ习题1.2 试证明任何一种具有两个独立参量的物质p T ,,其物态方程可由实验测得的体胀系数α及等温压缩系数T κ,根据下述积分求得:⎰-=)(ln dp dT V T κα如果1Tα=1T p κ= ,试求物态方程。
解: 因为0),,(=p V T f ,所以,我们可写成),(p T V V =,由此, dp p V dT T V dV T p )()(∂∂+∂∂=, 因为T T p pVV T V V )(1,)(1∂∂-=∂∂=κα 所以, dp dT VdVdp V dT V dV T T κακα-=-=,所以, ⎰-=dp dT V T καln ,当p T T /1,/1==κα.CT pV pdpT dT V =-=⎰:,ln 得到 习题 1.3测得一块铜块的体胀系数和等温压缩系数分别为1510*85.4--=K α和1710*8.7--=n T p κ,T κα,可近似看作常量,今使铜块加热至10°C 。
问(1压强要增加多少n p 才能使铜块体积不变?(2若压强增加100n p ,铜块的体积改多少 解:分别设为V xp n ∆;,由定义得:74410*8.7*10010*85.4;10*858.4----=∆=V x T κ所以,410*07.4,622-=∆=V p x n习题 1.4描述金属丝的几何参量是长度L ,力学参量是张力η,物态方程是0),,(=T L f η实验通常在n p 1下进行,其体积变化可忽略。
线胀系数定义为ηα)(1TL L ∂∂=等杨氏摸量定义为T L A L Y )(∂∂=η其中A 是金属丝的截面积,一般说来,α和Y 是T 的函数,对η仅有微弱的依赖关系,如果温度变化范不大,可看作常数。
热力学统计物理第4章_详解

3
一 μ空间(相空间) :粒子位置和动量构成的空间 经典力学: 确定一个粒子的运动状态用 r 和 p。
d = dq1 dq2 … dqr · dp1 dp2 …dpr
5
二
经典描述方法例子
px
x
L
1 自由粒子
不受外力作用的粒子(如理想气体 O 分子、金属自由电子等),其能量 p2 2m ① 1D自由粒子: 限制在长L范围内 (线状材料等); 互相正交的 x、px 轴构成2D的μ空间。 相轨道“——”等能面是一条直线.
1
统计物理: 关于热现象的微观理论。
研究对象: 大量微观粒子组成的宏观物质系统。 (微观粒子:如分子、原子、自由电子、光子等) 统计物理认为: 宏观性质是大量微观粒子运动的集体表现。 宏观物理量是相应微观物理量的统计平均值。 经典统计: 粒子满足经典力学规律 (运动状态的经典描述) 量子统计: 粒子满足量子力学规律 (运动状态的量子描述)
px p sin cos , p y p sin sin , pz p cos .
V dp x dp y dpz 3 h
z
p
则动量空间的体积元:
V p sin d pd dp p 2 sin dp d d
在体积V 内,动量大小在 p 到 p + dp, 动量方向在 到 + d, φ 到 φ + dφ内,自由粒子可能的状态数为:
px
dp x
热力学统计物理第四章课件

多元系的 复相平衡和化学反应
Ch4.1多元系的热力学基本方程
一、多元系统的热力学函数(单相)
1、状态描述 单元单相系(封闭系):T、P 单元单相系(开放系):T、P、n K元单相系: T、P、n1、……、nk k元ψ相系: ψ相: Tψ、P ψ 、n1 ψ 、……、nk 平衡时:平衡条件 2、热力学函数 1)欧勒定理
V
i
V ni n i T ,P ,n j U ni n i T ,P ,n j S ni n i T ,P ,n j
S , si n i T , P ,n j
等温过程有 G H TS
S 有界 , T 0
G H
H G T 0 T 0
G H T
T 0
S
利用洛必达法则
lim
(S )
T0
如果假设
lim S T
T0
0
T 0
H 和 G 相等且 具有相同的偏导数
Ch4.4单相化学平衡的条件与性质
四、化学反应平衡条件
吉布斯判据 G = -A n 0, A = - i i 分析 演化方向: A > 0 n >0, 正向反应 平衡条件:A = - i i = 0
Ch4.4单相化学平衡的条件与性质
五、自发化学反应的结果
四、相律的应用
Ch2多元复相平衡条件与性质
二元系相图(k=2,f=3-φ )
平衡变量:p,t,x 三维空间被一些曲面分成为若干区域,每个区域代表一个相;空 间中的一点代表二元系的一个平衡态;曲面代表两相平衡共存状 态;两曲面的交线代表三相平衡共存状态;两曲线的交点(也是 三个曲面的交点)代表四相平衡共存状态,称为四相点。 平面相图 P-T 相图 T-x 相图 p-x 相图
热力学统计物理简明教程

热力学统计物理简明教程第一章:热力学基本概念1.1 热力学系统:定义热力学系统为与外界相互作用的物质集合,可以是一个孤立系统、封闭系统或开放系统。
1.2 热平衡:当一个系统与外界无能量交换时,系统达到热平衡。
系统内各部分的温度、压力等宏观性质保持恒定。
1.3 状态函数:热力学基本量,与系统的当前状态有关而与历史路径无关,如内能、熵、压力、温度等。
第二章:热力学定律2.1 第一定律:能量守恒原理,能量既不能被创造也不能被毁灭,只能转化形式或在系统间传递。
2.2 第二定律:熵的增加原理,自然界中熵总是趋向增加的方向进行变化,热量只能自高温物体流向低温物体。
2.3 第三定律:绝对零度不可达到,任何物体都无法降至绝对零度(零开尔文)。
3.1 宏观态与微观态:一个宏观系统对应于多个微观系统可能的状态,微观态是描述微观粒子的位置和动量等的状态。
3.2 统计平均:宏观量可以通过对大量微观状态进行统计平均来获得。
3.3 热力学极限:当系统粒子数足够大时,微观态的统计平均值可以近似为宏观量。
第四章:分布函数与统计热力学4.1 统计系综:包括正则系综、巨正则系综和平均系综等,用于描述与热平衡态相关的情况。
4.2 分布函数:用于描述系统处于不同状态的概率分布,如能级分布函数、玻尔兹曼分布等。
4.3 统计热力学量:基于分布函数和统计平均,可以推导出各种统计热力学量的表达式,如配分函数、自由能、熵等。
第五章:应用与实例5.1 理想气体模型:通过应用统计物理理论,可以推导出理想气体的各种性质,如压力、内能和熵等。
5.2 凝聚态物质:应用统计物理理论可以解释凝聚态物质的相变,如固体到液体的熔化和液体到气体的汽化等。
5.3 热力学函数的应用:通过计算热力学函数,可以推导出一些与实际系统相关的性质,如化学反应平衡条件和热电材料的热电效应等。
以上是热力学统计物理简明教程的大致内容,希望能够帮助你对热力学统计物理有初步的了解。
热力学第四章

第三十七页,编辑于星期二:十一点 五十五分。
第三十八页,编辑于星期二:十一点 五十五分。
第三十九页,编辑于星期二:十一点 五十五分。
第四十页,编辑于星期二:十一点 五十五分。
第四十一页,编辑于星期二:十一点 五十五分。
第四十二页,编辑于星期二:十一点 五十五分。
第四十三页,编辑于星期二:十一点 五十五分。
第一页,编辑于星期二:十一点 五十五分。
第二页,编辑于星期二:十一点 五十五分。
第三页,编辑于星期二:十一点 五十五分。
第四页,编辑于星期二:十一点 五十五分。
第五页,编辑于星期二:十一点 五十五分。
第六页,编辑于星期二:十一点 五十五分。
第七页,编辑于星期二:十一点 五十五分。
第八页,编辑于星期二:十一点 五十五分。
第九页,编辑于星期二:十一点 五十五分。
第十页,编辑于星期二:十一点 五十五分。
第十一页,编辑于星期二:十一点 五十五分。
第十二页,编辑于星期二:十一点 五十五分。
第十三页,编辑于星期二:十一点 五十五分。
第十四页,编辑于星期二:十一点 五十五分。
第十五页,编辑于星期二:十一点 五十五分。
第三十页,编辑于星期二:十一点 五十五分。
第三十一页,编辑于星期二:十一点 五十五分。
第三十二页,编辑于星期二:十一点 五十五分。
第三十三页,编辑于星期二:十一点 五十五分。
第三十四页,编辑于星期二:十一点 五十五分。
第三十五页,编辑于星期二:十一点 五十五分。
第三十六页,编辑于星期二:十一点 五十五分。
第二十三页,编辑于星期二:十一点 五十五分。
第二十四页,编辑于星期二:十一点 五十五分。
第二十五页,编辑于星期二:十一点 五十五分。
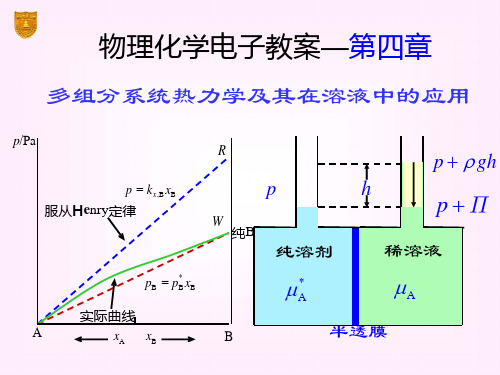
南京大学物理化学 第四章 多组分均相系统热力学及其在溶液中的应用

大能力(可逆时系统对外所做功最大) ② 当W’=0时,:反应永远向着化学势降低的方向进行,可用来判断
反应进行的情况(=0可逆,<0不可逆) 该判据也可推广到多组分多相系统:和 2. 判据的应用 (1) 相变
广义的相变是物质由一个相迁往另一个相的过程,是一个物质流动的 过程。
第15次课
3. 理想溶液的化学势
化学势是物质迁移的推动力,不论物质是否混合,只要气液两相平 衡,则气液两相的化学势相等。 混合前:纯组分 混合后:溶液组分
是纯液体A在温度为T、压力为溶液上方总压时的化学势。
4. 理想溶液的热力学性质 (1) 蒸气压与液相组成的关系
,故 (2) 蒸气压与气相组成的关系
等温等压条件下,非挥发性溶质形成的溶液中,溶剂的蒸气压等于 纯溶剂的蒸汽压乘以溶液中溶剂的摩尔分数(或:溶剂蒸气压的降低值 与纯溶剂的蒸气压之比等于溶质的摩尔分数) 说明:公式只适用于溶液中只有A、B两个组分的系统(),而则具有 普适性。
2. 亨利定律(Henry) 一定温度、压力下,稀溶液中某挥发性物质的平衡分压与该溶质的
① ∵∴压力p升高,化学势μB也随之增加 ② 若已知,则可求出 说明:实际上,在与吉布斯自由能有关的关系式中,如果把G换成μ, 并将公式中其它广度量换成相应的偏摩尔量,则公式仍然成立。 例:
第14次课
(四)化学势判据
1. 判据推导 组成可变的封闭系统,发生广义化学变化时(可逆取等号) 将上述四式与⑤-⑧式对比,得到
可称为定浓物理量
2 偏摩尔量的集合公式(加和定理) 等温等压条件下,
在任一系统中,将各组分的物质的量增加一倍,其各组分浓度仍不 变,广度量Z则相应增加一倍。 注:在所有偏摩尔量中,只有偏摩尔体积可测,可由求出溶液的总体 积。
热力学统计物理 第四章 课件

由前面G=Σniμi,求微分有
i
dG ni di i dni
i
将此式与G的全微分式相比较,得
SdT Vdp ni di 0
此式称为吉布斯关系。它指出,在k+2个强度量变量T,p,
i
μ1,…,μk中,只有k+1个是独立的。
多元复相系
对于多元复相系,每一个相各有其热力学函数和热力 学基本方程。例如,α相的基本方程为
G i ni , G i ni
i i
总吉布斯函数的变化为
δG =δGα+δGβ
将前面两式代入此式,得
G i i ni
平衡态的吉布斯函数最小,必有δG =0。由于虚变动中各 δniα任意,故有 μiα = μiβ (i =1,…,k) 此式即多元系的相变平衡条件。它指出整个系统达到平衡
一般而言对于单相化学反应各组元物质的量的改变dn必满足dn表示i组元的偏摩尔焓则在等温等压条件下发生化学反应以后系统焓的改变为我们知道在等压过程中焓的增加等于系统在过程中从外界吸收的热表示等压条件下发生化学反应时系统从外界吸收的热量有称为化学反应的定压反应热
第四章 多元系的复相平衡和化学平衡 热力学第三定律
n i i 0
由此可知,如果Σνiμi<0,反应将正向进行(δn>0 );如果
i
Σνiμi>0,反应将逆向进行(δn<0 )。
如果给定初态下各组元的物质的量n10,…,nk0,终态 各组元物质的量将为 ni = ni0 +νiΔn (i =1,…,k)
只要定出参量Δn ,就可以确定各组元物质的量。
由欧勒定理可知
V S U V ni , S ni , U ni n n n i i i i T , p ,n j i T , p ,n j i T , p ,n j
热力学与统计物理学第四章 统计热力学

第四章 统计热力学
动机和目的 一、热力学概率 二、相体积、态密度 三、微观态的量子描写
小结和习题课
7
•思路:统计力学对概率处理的一个独特方式是事先 将相空间分割成许多个小相格,计算等能面附近单 位能隙的相格数(微观态数),若相格数越大,则粒 子处于这个能级的概率就越大。
•基本概念:
(1) μ空间:一个粒子的广义坐标和广义动量所构成
•统计热力学的任务是用粒子分布来研究宏观系统的平衡态 行为,也就是用概率观点来刻画系统的有序和无序程度, 提供物质原子的微观理论与宏观热力学之间的联系。这种 连续的关键是熵。
•本章的核心知识点是热力学概率和态密度,为后续内容作 准备。
2
第四章 统计热力学
动机和目的 一、热力学概率 二、相体积、态密度 三、微观态的量子描写
对于孤立系统而言,所有可能的微观态以等概率出现。一般 来说,很多微观态对应于一个宏观态,热力学概率大意味着这 个宏观态出现的概率就大。——等概率原理是统计力学中的唯 一假设。
4
以同时投四个硬币为例,来说明热力学概率与通常意义下 的概率的关系。
5
通常的概率等于一种宏观态的微观态数 k 与所有
宏观态所具有的微观态数之和Ω的比:
H
N i1
2pmi2 V(qi)
9
能量等于 E的等能面所围的相体(E积 )定义为
(E) dq1dqrdp1dpr HE
能量层E EE之间的相体积用以式 下计 公算: (EE)(E) d(E) E dE
2. 态密度
对粒子的动量和坐标的测量有一定的精度限制,在一个相格 内,粒子坐标和动量无法区分,认为是一个粒子的同一个状 态。现规定大小为 h r 的相体积元代表一个粒子的一个微观 态,则态密度定义为
热力学与统计物理学第四章 统计热力学

10
【书102页例4-3】
一维线性谐振子的哈密 顿量H p2 1 m 2q2 ,求能量为 E的等能面所围
2m 2 的相体积和态密度。
解:将等能线 H E写成标准的椭圆方程的 形式:
p2 a2
q2 b2
1,
a 2mE 2 ,
b
2E
m 2
则相体积就是椭圆的面 积
H
N i1
2pmi2 V(qi)
9
能量等于 E的等能面所围的相体(E积 )定义为
(E) dq1dqrdp1dpr HE
能量层E EE之间的相体积用以式 下计 公算: (EE)(E) d(E) E dE
2. 态密度
对粒子的动量和坐标的测量有一定的精度限制,在一个相格 内,粒子坐标和动量无法区分,认为是一个粒子的同一个状 态。现规定大小为 h r 的相体积元代表一个粒子的一个微观 态,则态密度定义为
对于孤立系统而言,所有可能的微观态以等概率出现。一般 来说,很多微观态对应于一个宏观态,热力学概率大意味着这 个宏观态出现的概率就大。——等概率原理是统计力学中的唯 一假设。
4
以同时投四个硬币为例,来说明热力学概率与通常意义下 的概率的关系。
5
通常的概率等于一种宏观态的微观态数 k 与所有
宏观态所具有的微观态数之和Ω的比:
的空间;
(2)相点: μ空间中的一个点代表粒子的一个可能的 运动状态;
(3)等能面:把μ空间具有相同能量的粒子状态连接 起来所构成的曲面;
8
(4) 相体积:等能面在相空间所围成的一块体积; (5) 相格:用 hr q1 qr p1 pr的体积元把μ空间等分,
每个体元能容纳许多代表点,且各点q和p 相等; (6) 态密度:某一能量E处单位能量间隔中的状态数。 • 相体积和态密度的计算 1. 相体积 2. 一个有r个自由度的粒子的哈密顿量写作
热力学与统计物理第四章知识总结

§6.1粒子运动状态的经典描述一、μ空间1、μ空间的建立在经典力学中,我们经常利用物体的坐标和动量描述物体的力学运动状态。
当然这种方法也可以用于描述遵守经典力学规律的近独立粒子。
如果粒子的自由度为r,则粒子在任一时刻的力学运动状态由粒子的r个坐标q,q,…,q和相应的r个广义动量P,P,…,P在该时刻的数值确定。
粒子的能量ε是广义坐标和广义动量的函数,即ε=ε(q,q,…,q; P,P,…,P)当存在外场时,ε还是描述外场参量的函数。
为了形象地描述粒子的力学运动状态,我们用q,q,…,q;P,P,…,P共2r个变量为直角坐标,构成一个2r维空间,称为粒子的相空间或者μ空间。
粒子在某一时刻的力学运动状态 (q,q,…,q; P,P,…,P)可以用μ空间中的一个点表示,称为粒子运动状态的代表点。
当粒子的运动状态随时间改变时,代表点相应地在μ空间中移动,描绘出一种轨迹,称为相轨迹。
由N个粒子组成的系统在某一时刻的一个特定的微观状态,在μ空间中用N个代表点表示。
随着时间的变化,系统运动状态的变化由N个代表点在μ空间中的N条运动轨迹,即N条线代表。
2、性质i) μ空间是人为想象出来的超越空间,是个相空间。
引进它的目的在于使运动状态的描述几何化、形象化,以便于进行统计。
μ空间中的一个代表点是一个粒子的微观运动状态而不是一个粒子。
ii) 在经典力学范围,在无相互作用的独立粒子系统中,任何粒子总可找到和它相应的μ空间来形象地描述它的运动状态,但不是所有的粒子的运动状态可以在同一μ空间中描述。
如一个自由度数为3的粒子,它需在一个6维的μ空间中描述;一个自由度数为5的粒子,它的μ空间是10维的,即需在10维的μ空间中描述它的运动状态。
二、自由粒子所谓自由粒子,指的是不受外力作用可以自由运动的粒子。
在通常情况下,我们还经常把可以忽略外力作用的粒子看作自由粒子。
例如,当不存在力场时,理想气体的分子或金属中的自由电子都可以被看作自由粒子。
热力学与统计物理第四章知识总结

§6.1粒子运动状态的经典描述一、μ空间1、μ空间的建立在经典力学中,我们经常利用物体的坐标和动量描述物体的力学运动状态。
当然这种方法也可以用于描述遵守经典力学规律的近独立粒子。
如果粒子的自由度为r,则粒子在任一时刻的力学运动状态由粒子的r个坐标q,q,…,q和相应的r个广义动量P,P,…,P在该时刻的数值确定。
粒子的能量ε是广义坐标和广义动量的函数,即ε=ε(q,q,…,q; P,P,…,P)当存在外场时,ε还是描述外场参量的函数。
为了形象地描述粒子的力学运动状态,我们用q,q,…,q;P,P,…,P共2r个变量为直角坐标,构成一个2r维空间,称为粒子的相空间或者μ空间。
粒子在某一时刻的力学运动状态 (q,q,…,q; P,P,…,P)可以用μ空间中的一个点表示,称为粒子运动状态的代表点。
当粒子的运动状态随时间改变时,代表点相应地在μ空间中移动,描绘出一种轨迹,称为相轨迹。
由N个粒子组成的系统在某一时刻的一个特定的微观状态,在μ空间中用N个代表点表示。
随着时间的变化,系统运动状态的变化由N个代表点在μ空间中的N条运动轨迹,即N条线代表。
2、性质i) μ空间是人为想象出来的超越空间,是个相空间。
引进它的目的在于使运动状态的描述几何化、形象化,以便于进行统计。
μ空间中的一个代表点是一个粒子的微观运动状态而不是一个粒子。
ii) 在经典力学范围,在无相互作用的独立粒子系统中,任何粒子总可找到和它相应的μ空间来形象地描述它的运动状态,但不是所有的粒子的运动状态可以在同一μ空间中描述。
如一个自由度数为3的粒子,它需在一个6维的μ空间中描述;一个自由度数为5的粒子,它的μ空间是10维的,即需在10维的μ空间中描述它的运动状态。
二、自由粒子所谓自由粒子,指的是不受外力作用可以自由运动的粒子。
在通常情况下,我们还经常把可以忽略外力作用的粒子看作自由粒子。
例如,当不存在力场时,理想气体的分子或金属中的自由电子都可以被看作自由粒子。
热力学统计-笔记

第六章
近独立粒子的最概然分布
1、线性谐振子:质量为 m 的粒子在弹性力 F Ax 作用下,将沿着 x 轴在原点 附近作简谐振动; 此粒子的能量=动能和势能之和,
p2 A 2 p2 1 x m 2 x 2 , 2m 2 2m 2
转子: 质量为 m 的质点 A 被具有一定长度的轻杆系于原点 O 时所作的运动;
第二章
均匀物质的热力学性质
U U dU dS dV , S V V S
1、物态方程、内能和熵:
U Q W ,
dU TdS pdV ,
热力学函数焓:
H U pV ,
自由能函数:
dH TdS Vdp ,
H H dH dp , dS S p p S
l
l ! al !l al !
经典极限条件,或非简并条件: 如果在波色和费米系统中的任一能级上,粒子数远小于该能级的量子态数,即:
l
B.E
al
1
l
l al 1! l al 1l al 2 l l a M .B , al !l 1! al ! al ! N! l l l l l 1 l al 1 l ! l a M .B F .D , al ! al ! N! l al ! l al ! l l
第三章
单元系的相变
充分必要条件: S 0
1、熵判据:系统稳定平衡;熵达到最大值,处于稳定状态; 自由能判据:在等温等容条件下,系统的自由能永不增加; 充分必要条件: F 0 吉布斯判据:在等温等压条件下,系统的吉布斯函数永不增加; 充分必要条件: G 0
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
改变的只有f个, 即: f (k 1) (k 2)( 1)
前者为强度数,后者为平衡方程数
f k 2 (吉布斯相律)
f为多元复相系的自由度数,是多元复相系可以独立改变的强度量的数目。
说明:
在以上的证明中,我们假设每一个相都有k个组元,如果某 一相的组元少了一个,系统的强度量变量将减少一个,但相变平 衡条件必然也少一个,总的自由度数仍然是式 f k 2 给出的f。 不过这时的k的意义改变了,它不是每一个相的组元数而是复相 系中总的组元数。
S S(T , P, n1 , , nk ) S(T , P, n1 , , nk )
即:体积、内能和熵都是各组元摩尔数的一次齐函数
如果函数 f (x1,L , xk ) 满足以下关系: f (x1 , , xk ) m f (x1 , , xk )
这个函数称为 x1,L , xk 的m次齐函数。
na nb
当反应正向进行达最大限度(即 : n n)a 时, 1;
当反应逆向进行达最大限度(即: n n)b 时, 0
一个例子:
1 2
mol的H
2
S;3 4
mol
的H
2O
2mol 的H2;1mol的SO2;把这4种气体引入容器
T 300 C;1P0条件下: 化学反应方程:
H2S 2H2O - 3H2 - SO2 0 平衡条件:
vi
V ni
T ,P,nj
ui
U ni
T ,P,n j
si
S ni
T ,P,nj
则:
V ni vi
i
U niui
i
S ni si
i
显然,任何广延量都是各组元摩尔数的一次齐函数。
所以,对于吉布斯函数:G
i
ni
G ni
T
,P,n j
i
ni i i
i
G ni
T ,P,nj
H2S 2 H2O H2 SO2=0
各个组元物质的量:
nH2S
1 n 2
nH 2O
3 2n 4
nH 2 2 3n
nSO2 1 n
如果已知各个组元的化 学势,则根据平衡条件 :
nb
3 8
,
na
2 可以得到 n 3
假设n 1 3
4
4
如果将温度降到某一个温度,根据: i i 0
dF SdT PdV dn
dG SdT VdP dn
dJ SdT PdV nd
(b)、齐次函数的欧拉定理
考虑一个均匀系统,并且整个系统是单相系或者是复相系的一个相。 假设含有k个组元 引进化学参量n1......n. k 表示各个组元物质的量
选 T , P, n1,L , nk 为状态参量,系统的三个基本热力学函数体 积、内能和熵分别为:
G ni
为n1
,.....n. k的零次齐函数
所以
i
F (T , P,tn1 ,....,tnk )
t k nj 1
j1
i F (T , P, x1 , x2 ,...xk )
k
并且 xi 1 i 1
吉布斯相律
设多元复相系有个 相,k组,无化学反应,T , P , n1 ,L , nk
即: G G
定义: G U TS PV
(二)、多元系的复相平衡条件
1.多元系的相变平衡条件
系统条件:
(1)设有 , 相都含有k个组元,各组元间无化学反应;
(2)满足热力学平衡条件和力学平衡条件,即:压强、温度不变。
设有虚变动,摩尔数在两相中发生变化:ni ,ni (i 1,2, , k)
dU T dS P dV i dni i
相的焓: H U PV 自由能: F U T S
吉布斯: G U T S PV
(2)根据体积、内能、熵和摩尔数的广延性质,整个复相系的
体积、内能、熵和i组元的摩尔数为:
V V U U S S ni ni
各组元总摩尔数不变:ni ni 0 (i 1,2, , k)
吉布斯函数的变化: G
i
ni
i
G
i
ni
i
总吉布斯函数的变化: G (i i ) ni i
平衡时吉布斯函数最小,有 G 0 ,在虚变动中,各 ni 的
变化是任意的,有
i
i
(i 1,2, , k)
(多元系的相变平衡条件)
(3)整个复相系不存在总的焓,当各相的压强相同时,总的焓
才有意义,等于各相的焓之和。 H H
定义: H U PV
(4)整个复相系不存在总的自由能,当各相的温度相同时,总 的自由能才有意义,等于各相的自由能之和
即: F F 定义: F U TS
(5)整个复相系不存在总的自由能,当各相的温度相同时,总 的自由能才有意义,等于各相的自由能之和
i 也称为 i 组元的化学势,它代表在保持温度、压气和其它组 元的摩尔数不变时,增加1摩尔的i组元物质时系统吉布斯函数
的增量, i 为强度量。
(c).多元系的热力学基本方程 先考虑吉布斯函数 G G(T, P, n1,L , nk ) 的全微分得:
dG
G T
P , ni
dT
G P
T ,ni
应用举例:
1、k 1, 1(单元单相系)
f 2 PVT系统
2.单元双相系,k 1, 2
f 1
T给定 P确定,或P=P T
3.单元三相系,k 1, 3
对 求导后令 1 得:
mm1 f
i
f xi xi
f
即: i xi xi mf
(欧勒定理)
体积、内能和熵都是各组元摩尔数的一次函数,由欧勒定理得:
V
i
ni
V ni
T ,P,nj
U
i
ni
U ni
T ,P,n j
n j 指除i组元外其他全部组元,定义:
S
iHale Waihona Puke niS niT ,P,nj
i Ai 0
i
AAii 为组元分子式, i 为组元的系数
(b)当发生化学反应时,各组元摩尔数的改变必与各组元在 反应中的系数成正比。
例: dnH2 : dnO2 : dnH2O 2 : 1: 2 dnH2 2dn , dnO2 dn , dnH2O 2dn
所以: dni i dn (n 1,2, , k) dn>0反应正向进行, dn<0 反应逆向进行
i
不满足平衡条件,反应就要进行,反应进行的方向必须使吉布
斯函数减小,即: dn i i 0
i
如果 i i 0 (n 0,) 反应将正向进行 i
如果 i i 0 (n 0) ,反应将反向进行 i
给定初态下各组元的摩尔数 n10 ,L , nk0 ,终态各组元的摩尔数为: ni ni0 i n
多元系的相变平衡条件指出整个系统达到平衡时,两相
各组元的化学势都必须分别相等。上述条件不满足系统发生
相变,相变朝着使 (i i ) ni 0 的方向进行,
如 i i,变化朝着 ni 0 的方向进行,
即:i组元物质将i 由i 该组元化学势高的相转变到化学势低的相去。
自然界有些物质可以造成半透膜,两相用固定 的半透膜隔开,只让i组员通过不让其他组元 通过,当平衡时两相的温度必然相等,i组元 在两相中的化学势也必须相等。即
i
计算出:n 0.8 na
则当正方向达到n
2 3
时,H
2
将耗尽。
因此n只能够
等于
2 3
;
反应度=1
(四) 吉布斯相律
相律是关于多元复相平衡的一个普遍性结 论,是吉布斯证明的一个定理。
多元复相系中,i组元在相中的化学势i是系统T , P
及各组元在 相中浓度xi的函数
xi
ni
k
( 1, 2......)
V V (T , P, n1 , , nk )
U U (T , P, n1 , , nk )
S S(T , P, n1 , , nk )
全为广延量,T、P不变,n增大 倍,有:
V V (T , P, n1 , , nk ) V (T , P, n1 , , nk )
U U (T , P, n1, , nk ) U (T , P, n1 , , nk )
i i
半透膜可以承受两边的压强差,所以平衡时压 强不相等。
(三) 化学平衡条件
(1)一般化学反应式的热力学描述
(a)讨论多元系中各组元可以发生化学反应时系统达到平衡时 所要满足的条件,称为化学平衡条件。
2H 2 O2 2H 2O 热力学中:2H 2O 2H 2 O2 0
3H 2 SO2 H 2 S 2H 2O 热力学中:H 2 S 2H 2O 3H 2 SO2 0 (正号的物质为生成物,带负号的为反应物)
dU TdS PdV i dni 多元系的热力学基本方程
i
焓: dH TdS VdP i dni i
dF SdT PdV i dni
i
i
U ni
S ,V ,n j
H ni
S,P,nj
F ni
T ,V ,n j
对于 G nii 求微分得: dG ni di i dni
式中 n可由 ii 0 在化学平衡下推导求出 i
用 na 表示任何 ni 均非负值时 n 的最大值,所以 na 相应
于反应正向进行的最大限度,用 nb 表示任何 ni 均非负值时 n
的最小值(代数值最小),所以 nb 相应于反应逆向进行的最大 限度,而 nb n na ,定义反应度: n nb
系统达到热动平衡是由强度量决定的,热力学系统能独立 改变的强度变量的个数称为系统的自由度。
