溶解性表
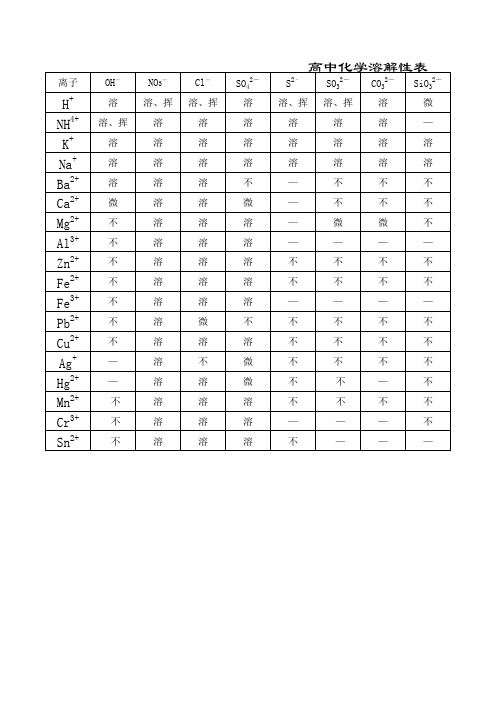
高中化学溶解性表(仅供参考)
Cl- 溶、挥
溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 微 溶 不 溶 溶 溶 溶
SO42- 溶 溶 溶 溶 不 微 溶 溶 溶 溶 溶 不 溶 微 微 溶 溶 溶
高中化学溶解性表
S2ˉ
SO32-
CO32-
SiO32-
溶、挥 溶、挥 溶
微
溶
溶
溶
—
溶
溶
溶
溶
溶
溶
溶
溶
—
不
不
不
—
不
不
不
—
微
微
不
—
—
—
—
不
不
不
不
离子
H+ NH4+ K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Zn2+ Fe2+ Fe3+ Pb2+ Cu2+ Ag+ Hg2+ Mn2+ Cr3+ Sn2+
OH- 溶 溶、挥 溶 溶 溶 微 不 不 不 不 不 不 不 — — 不 不 不
NO3- 溶、挥
溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶 溶
不
不
不
不
—
—
—
—
不
不
不
不
不
不
不
不
不
不
不
不
不
不
—
不
不
不
不
不
—
—
—
不
不
—
—
—
性表
PO43- 溶
F-
溶解性表

1. ^ 2MS + 2H2O = M(OH)2 + M(SH)22. ^ Strontium sulfide, 3. ^ 2MnO4−(aq) + 3Mn2+(aq) + 2H2O ↔ 5MnO2(S) + 4H+高锰酸盐 (法文)4. ^ 因为氟的电负性太高以至于它总是会把铜氧化至+2氧化态,参考Greenwood, Norman N.; Earn5. ^ Greenwood, Norman N.; Earnshaw, Alan., Chemistry of the Elements. 2nd, Oxford: But6. ^ 在少量硫酸存在的条件下得到红色的氢化铜沉淀7. ^The crystal structure of copper hydride J. A. Goedkoop and A. F. Andresen Acta Cry8. ^ 一般以碱式碳酸铜存在9. ^ Biedermann, George; Sillén, Lars Gunnar. Studies on the Hydrolysis of Metal Ions.10. ^ AgOH 常温分解为 Ag2O。
11. ^ 高锰酸银受热或遇水分解,参考Greenwood, N. N.; Earnshaw, A. Chemistry of the Eleme12. ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd Edition. Oxford:Butt13. ^ Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements, 2nd Ed., Oxford14. ^ 三氟化镓与无机酸反应生成剧毒的氢氟酸,参考Anthony John Downs, (1993), Chemistry o15. ^ 无机化学丛书.第二卷.4.11.2氢氧化物.P646.张青莲 主编16. ^ "The Exciting Chemistry of Tetraazidomethane", Klaus Banert, Young-Hyuk Joo, Tobi17. ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd Edition. Oxford:Buttwood, Norman N.; Earnshaw, Alan., Chemistry of the Elements. 2nd, Oxford: Butterworth-Heinemann. 199 nts. 2nd, Oxford: Butterworth-Heinemann. 1997: 1183–1185, ISBN 0080379419. F. Andresen Acta Cryst. (1955). 8, 118-119 doi:10.1107/S0365110X55000480lysis of Metal Ions. Part 30. A Critical Survey of the Solubility Equilibria of Ag2O. Acta Chemica S hemistry of the Elements 2nd Edition. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.d Edition. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4. , p. 1184.ents, 2nd Ed., Oxford: Butterworth-Heinemann. ISBN 0-7506-3365-4., (1993), Chemistry of Aluminium, Gallium, Indium, and Thallium, Springer, ISBN 978-0-7514-0103-5Young-Hyuk Joo, Tobias Ruffer, Bernhard Walfort, and Heinrich Lang, Angew. Chem. Int. Ed. 2007, 46 d Edition. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.orth-Heinemann. 1997: 1183–1185, ISBN 0080379419g2O. Acta Chemica Scandinavica. 1960, 14: 717. doi:10.3891/acta.chem.scand.14-0717. -7506-3365-4.978-0-7514-0103-5Int. Ed. 2007, 46, 1168–1171. doi:10.1002/anie.200603960。
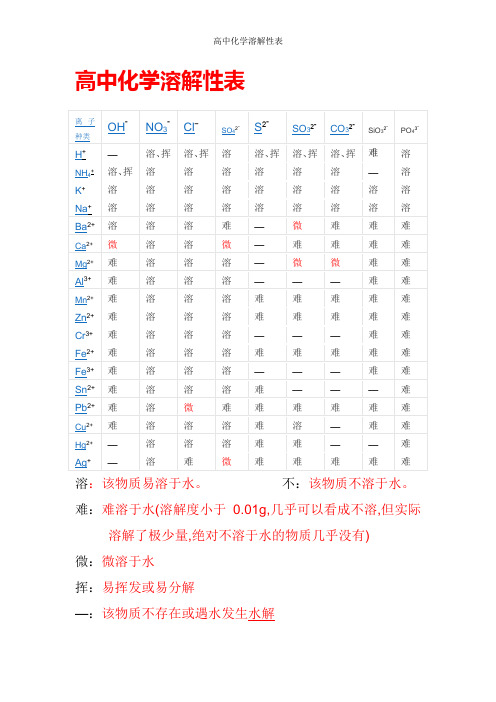
高中化学溶解性表
高中化学溶解性表
溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)
微:微溶于水
挥:易挥发或易分解
—:该物质不存在或遇水发生水解
红褐色:Fe(OH)3
沉淀鉴别
沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;
Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);
BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);
不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)
溶解性口诀:
钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)
盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)
硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)
其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)
碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)
另有几种微溶物,可单独记住(见上表)。
高中化学溶解性表

高中化学溶解性表溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)微:微溶于水挥:易挥发或易分解—:该物质不存在或遇水发生水解常见沉淀:白色:BaSO4、BaCO3、CaCO3、AgCl、Mg(OH)2、Fe(OH)2、Al(OH)3、ZnCO3、MnCO3、Zn(OH)2。
蓝色:Cu(OH)2、CuCO3浅黄色:AgBr、Ag2CO3红褐色:Fe(OH)3沉淀鉴别Cu(OH)2蓝色沉淀;Fe(OH)3红褐色沉淀;AgBr淡黄色沉淀;AgI,Ag3PO4黄色沉淀;AgCl白色沉淀;CuO黑色沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)溶解性口诀:钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住(见上表)。
化学溶解性表

化学溶解性表物质的溶解性溶解性溶解度(20℃)易溶大于等于10g可溶大于等于1g小于10g微溶大于等于0.01g小于1g难溶(不溶)小于0.01g在许多化学反应里,作为一个整体参加反应,好像一个原子一样,这样的原子集团叫做原子团。
原子团又叫做根或基团,如氢氧根OH- 、硝酸根NO3- 、碳酸根CO32-、硫酸根SO42-、氯酸根ClO3-、磷酸根PO43-、碳酸氢根HCO3-、铵根NH4+、碳酸根CO32-等。
值得注意的是:原子团不能独立存在,只是化合物的一个组成部分。
在溶液中原子团作为一个整体参加反应。
各种原子团都有自己的特性反应,如CO32 -遇酸变成CO2,SO 42-遇Ba2+产生不溶于稀硝酸的白色沉淀,OH-使酚酞试液变成红色等。
利用特性反应可以检验根的存在。
g (气体)、l (液体)、s (固体)、aq (溶液)化学活动性金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,Cs>Rb>K>Ca>Na>Li>Mg>Al>Ti>Zn>Fe>Sn>Pb>Ni>(H)>Cu>Hg>Ag>O s>Ru>Ir>Rh>Pt>Pd>Au 非金属活动性,一般是指卤素与类卤素的活动性。
一般的,周期大的卤素可以把周期小的卤素从它们的卤化物中置换出来F>SCN>Cl(O)>Br>CN>OCN>I>S>N>P>C>Si>H物质溶解性表及沉淀颜色1.Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解溶液呈黄色铁器除锈2.Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解3.CuO+H2SO4=CuSO4+H2O 黑色固体溶解溶液呈蓝色4.ZnO+H2SO4=ZnSO4+H2O 白色固体溶解5.MgO+H2SO4=MgSO4+H2O 白色固体溶解6.2NaOH+H2SO4=Na2SO4+2H2O7.Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解8.Ca(OH)2+H2SO4=CaSO4+2H2O9.Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解10.2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解11.2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解溶液呈黄色12.Ba(OH)2+ H2SO4=BaSO4+2H2O 生成白色沉淀不溶解于稀硝酸检验SO42的原理13..BaCl2+ H2SO4=BaSO4+2HCl 生成白色沉淀不溶解于稀硝酸检验SO42的原理14.Ba(NO3)2+H2SO4=BaSO4+2HNO3 生成白色沉淀不溶解于稀硝酸检验SO42的原理15.Na2O+2HNO3=2NaNO3+H2O 白色固体溶解16.CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解溶液呈蓝色17.ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解18.MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解19.CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解20.NaOH+HNO3=NaNO3+ H2O21.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解22.Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解23.Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解24.Ca(OH)2+2HNO3=Ca(NO3)2+2H2O25.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解溶液呈黄色26.3NaOH + H3PO4=3H2O + Na3PO427.3NH3+H3PO4=(NH4)3PO428.2NaOH+CO2=Na2CO3+ H2O 吸收COO2H2中的CO229.2NaOH+SO2=Na2SO3+ H2O2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)30.FeCl3+3NaOH=Fe(OH)3+3NaCl 溶液黄色褪去有红褐色沉淀生成1.碳与氧气(不足)的反应2C+O2==== 2CO 碳与氧气(充足)的反应C+O2==== CO22.一氧化碳与氧气的反应2CO+O2==== 2CO23.二氧化碳与碳的反应CO2+C==== 2CO4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3 +2H2O10.碳酸氢钠加热的反应2Na HCO3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应N2+O2==== 2NO15.一氧化氮与氧气的反应2NO+O2==== 2NO216.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应N2+3H2========= 2NH318.氨气与水的反应NH3+H2O==== NH3•H2O19.氨气与盐酸的反应NH3+HCl==== NH4Cl20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应NH3+H+==== NH4+22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应N H4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO237.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO338.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO339.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO==== 2NaNO2+ H2O40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N241.二氧化氮生成四氧化二氮的反应2NO2==== N2O442.硫与铜的反应S+2Cu==== Cu2S43.硫与铁的反应S+Fe==== FeS44.硫与钠的反应S+2Na==== Na2S45.硫与铝的反应3S+2Al==== Al2S346.硫与汞的反应S+Hg==== HgS47.硫与氧气的反应S+O2==== SO248.硫与氢气的反应S+H2==== H2S49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O50.硫与浓硫酸的反应 S+2H2SO4(浓)==== 3SO2+2H2O51.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑52.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+H2O二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO353.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O54.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca(HSO3)255.二氧化硫与水的反应SO2+H2O==== H2SO356.二氧化硫与硫化氢的反应SO2+2H2S==== 3S↓+2H2O57.二氧化硫与氧气的反应2SO2+O2====== 2SO358.二氧化硫与过氧化钠的反应SO2+Na2O2==== Na2SO459.二氧化硫与氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl60.三氧化硫与水的反应SO3+H2O==== H2SO461.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO462.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO463.浓硫酸与铜的反应 2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2O64.浓硫酸与碳的反应 2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O寿65.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O366.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO2↑+H2O67.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O68.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS69.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+O2==== 2S+2H2O硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O70.硫化氢与氯气的反应H2S+Cl2==== 2H Cl+S↓71.硫化氢与浓硫酸的反应 H2S+H2SO4(浓)==== S↓+SO2↑+2H2O72.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑73.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+Cl2↑74.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑75.海水制镁(1) CaCO3==== CaO+CO2 (2) CaO+H2O==== Ca(OH)2(3) Mg2++2OH2-==== Mg(OH)2↓ (4) Mg(OH)2+2HCl==== MgCl2+2H2O(5) MgCl2==== Mg+Cl2↑76.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO(与氮气的反应) 3Mg+N2==== Mg3N2(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C77.镁与氯气的反应Mg+Cl2==== MgCl278.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑79.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑80.镁与氢离子的反应Mg+2H+==== Mg2++H2↑81.二氮化三镁与水的反应Mg3N2+6H2O==== 3Mg(OH)2↓+2NH3↑82.镁与溴水的反应(颜色退去) Mg+Br2==== MgBr2(产生气泡) Mg+2HBr==== MgBr2+H2↑83.溴与水的反应Br2+H2O==== HBr+HBrO84.溴与氢氧化钠的反应Br2+2NaOH==== NaBr+NaBrO+H2O85.溴与氢气的反应Br2+H2==== 2HBr86.溴与铁的反应3Br2+2Fe==== 2FeBr387.碘与铁的反应I2+Fe==== FeI288.溴与碘化钾的反应Br2+2KI==== 2KBr+I289.氯气与溴化钾的反应2KBr+Cl2==== 2KCl+Br290.硅与氧气的反应Si+O2==== SiO291.硅与氯气的反应Si+2Cl2==== SiCl492.硅与氢气的反应Si+2H2===== SiH493.二氧化硅与氟的反应Si+2F2==== SiF494.硅与碳的反应Si+C==== SiC95.硅与氢氧化钠溶液的反应Si+2NaOH+H2O==== Na2SiO3+2H2↑96.硅与氢氟酸的反应Si+4HF==== SiF4+2H2↑97.单质硅的制备(1.制备)SiO2+2C==== Si+2CO(2.提纯)Si+2Cl2==== SiCl4(3.提纯)SiCl4+2H2==== Si+4HCl98.二氧化硅与氢氧化钠的反应SiO2+2NaOH==== Na2SiO3+H2O99.二氧化硅与氧化钠的反应SiO2+Na2O==== Na2SiO3100.二氧化硅与碳酸钠的反应SiO2+Na2CO3==== Na2SiO3+ CO2↑101.二氧化硅与氧化钙的反应SiO2+CaO==== CaSiO3102.二氧化硅与碳酸钙的反应SiO2+CaCO3==== CaSiO3+CO2↑103.二氧化硅与氢氟酸的反应SiO2+4HF==== SiF4+2H2O104.硅酸的制备Na2SiO3+ CO2+H2O==== H2SiO3↓+ Na2CO3105.硅酸加热分解H2SiO3==== SiO2+H2O106.铝与氧气的反应4Al+3O2==== 2Al2O3107.铝与氯气的反应2Al+3Cl2==== 2AlCl3108.铝与盐酸的反应2Al+6HCl==== 2AlCl3+3H2↑109.铝与氢氧化钠的反应2Al+2NaOH+6H2O==== 2Na[Al(OH)4]+3H2↑110.铝与水的反应2Al+6H2O==== 2Al(OH)3+3H2↑111.铝与三氧化二铁的反应(铝热反应)2Al+Fe2O3==== 2Fe+Al2O3112.铝与二氧化锰的反应(铝热反应)4Al+3MnO2==== 3Mn+2AlO3113.氧化铝与盐酸的反应Al2O3+6HCl==== 2AlCl3+3H2O114.氧化铝与氢氧化钠的反应Al2O3+2NaOH+3H2O==== 2Na[Al(OH)4]115.电解氧化铝2Al2O3==== 4Al+3O2↑116.硫酸与与一水合氨的反应Al2(SO4)3+6NH3•H2O==== 2Al(OH)3↓+3(NH4)2S O4117.氯化铝与一水合氨的反应AlCl3+3NH3•H2O==== Al(OH)3↓+3NH4Cl118.氯化铝与氢氧化钠(少量)的反应AlCl3+3NaOH==== Al(OH)3↓+3NaCl 119.氢氧化铝与氢氧化钠的反应Al(OH)3+NaOH==== Na[Al(OH)4]120.氯化铝与氢氧化钠(过量)的反应AlCl3+4NaOH==== Na[Al(OH)4]+3NaCl 121.四羟基合氯酸钠与盐酸(少量)的反应Na[Al(OH)4]+HCl==== Al(OH)3↓+Na Cl+H2O122.氢氧化铝与盐酸的反应Al(OH)3+3HCl==== AlCl3+3H2O123.四羟基合氯酸钠与盐酸(过量)的反应Na[Al(OH)4]+4HCl==== AlCl3+NaCl+4H2O124.四羟基合氯酸钠与氯化铝的反应3Na[Al(OH)4]+AlCl3==== 4Al(OH)3↓+3N aCl125.向四羟基合氯酸钠中通入过量二氧化碳Na[Al(OH)4]+CO2==== Al(OH)3↓+NaHCO3126.铜在潮湿空气中被腐蚀2Cu+O2+H2O+CO2==== Cu2(OH)2CO3 127.铜与氧气的反应2Cu+O2==== 2CuO 128.铜与氯气的反应Cu+Cl2==== CuCl2129.铜氧化在高温下转化4CuO==== 2Cu2O+O 2↑ 130.硫酸铜与水的反应CuSO4+5H2O==== CuSO4•5H2O1.与碱反应产生气体 (1)(2)铵盐:O H NH NH 234+↑−→−+碱2.与酸反应产生气体(1)(2)()()()2332222332H H H CO HCO CO S HS H S SO HSO SO +++------⎧−−→↑⎪⎪−−→↑⎨⎪−−→↑⎪⎩化合物3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H +=S ↓+SO 2↑+H 2O 4.与水反应产生气体 (1)单质⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎨⎧⎪⎪⎩⎪⎪⎨⎧⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑↑−−−→−⎪⎩⎪⎨⎧↑↑−−→−↑−−−→−↑−−→−2222222222342342342NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓⎪⎩⎪⎨⎧↑+=+↑+=+22222422222O HF O H F H NaOH O H Na ⎪⎧↑+=+2222422O NaOH O H O Na(2)化合物5.强烈双水解6.既能酸反应,又能与碱反应(1)单质:Al (2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
最全的溶解性表

NH4+ 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 水 - 水
HCl HCl HCl HCl HCl HCl HCl HCl HCl HCl 水 水 HCl HCl 不溶 HCl 水 水 水 水 水 水 水 水 HCl HCl
磷酸盐, PO4
-
硅酸盐, SiO3
- HCl 水 HCl HCl HCl HCl HCl - HCl 水 HCl 浓HCl - - 不溶 水 - 水 水解, HCl 水解, HCl 水 - - HCl HCl
磷酸盐, PO4
-
硅酸盐, SiO3
2-
酒石酸, C4H4O62硫酸盐, SO42CrO42硫化物S2氰化物, CNFe(CN)64Fe(CN)6 S2O32CNS
3-
碘化物, I溴化物, Br氯化物, ClCH3COONO2
-
硝酸盐, NO3O2OH-
Zn2+ 碳酸盐, CO32草酸盐, C2O4 氟化物, F亚硫酸盐, SO32AsO33AsO4 BO2
332-
Ba2+ HCl HCl 略溶 HCl HCl HCl HCl HCl HCl HCl 不溶 HCl 水 略溶, HCl 水 水 HCl 水 水 水 水 水 水 水 HCl HCl
Hg2+ HCl HCl 水 HCl HCl HCl HCl - - HCl 略溶 HCl 王水 水 - 不溶 - 水 HCl 水 水 水 水 水 HCl -
Bi3+ HCl HCl HCl - HCl HCl HCl HCl HCl HCl 略溶 HCl HNO3 - - - - - HCl 水解, HCl 水解, HCl 水 - 略溶, HNO3 HNO3 HCl
高中化学溶解性表

高中化学溶解性表溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)微:微溶于水挥:易挥发或易分解—:该物质不存在或遇水发生水解常见沉淀:白色:BaSO4、BaCO3、CaCO3、AgCl、Mg(OH)2、Fe(OH)2、Al(OH)3、ZnCO3、MnCO3、Zn(OH)2。
蓝色:Cu(OH)2、CuCO3浅黄色:AgBr、Ag2CO3红褐色:Fe(OH)3沉淀鉴别Cu(OH)2蓝色沉淀;Fe(OH)3红褐色沉淀;AgBr淡黄色沉淀;AgI?,Ag3PO4黄色沉淀;?AgCl?白色沉淀?;CuO?黑色沉淀;Cu2O 红色沉淀;Fe2O3?红棕色沉淀;FeO 黑色沉淀FeS2?黄色沉淀;PbS 黑色沉淀;FeCO3?灰色沉淀;Ag2CO3?白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3?暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)溶解性口诀:钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住(见上表)。
化学溶解性表

化学溶解性表物质的溶解性溶解性溶解度(20℃)易溶大于等于10g可溶大于等于1g小于10g微溶大于等于0.01g小于1g难溶(不溶)小于0.01g在许多化学反应里,作为一个整体参加反应,好像一个原子一样,这样的原子集团叫做原子团。
原子团又叫做根或基团,如氢氧根OH-、硝酸根NO3-、碳酸根CO32-、硫酸根SO42-、氯酸根ClO3-、磷酸根PO43-、碳酸氢根HCO3-、铵根NH4+、碳酸根CO32-等。
值得注意的是:原子团不能独立存在,只是化合物的一个组成部分。
在溶液中原子团作为一个整体参加反应。
各种原子团都有自己的特性反应,如CO32 -遇酸变成CO2,SO42-遇Ba2+产生不溶于稀硝酸的白色沉淀,OH-使酚酞试液变成红色等。
利用特性反应可以检验根的存在。
g (气体)、l (液体)、s (固体)、aq (溶液)化学活动性金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,Cs>Rb>K>Ca>Na>Li>Mg>Al>Ti>Zn>Fe>Sn>Pb>Ni>(H)>Cu>Hg>Ag>Os>Ru>Ir>Rh>Pt>Pd>Au 非金属活动性,一般是指卤素与类卤素的活动性。
一般的,周期大的卤素可以把周期小的卤素从它们的卤化物中置换出来F>SCN>Cl(O)>Br>CN>OCN>I>S>N>P>C>Si>H物质溶解性表及沉淀颜色1.Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解溶液呈黄色铁器除锈2.Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解3.CuO+H2SO4=CuSO4+H2O 黑色固体溶解溶液呈蓝色4.ZnO+H2SO4=ZnSO4+H2O 白色固体溶解5.MgO+H2SO4=MgSO4+H2O 白色固体溶解6.2NaOH+H2SO4=Na2SO4+2H2O7.Cu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解8.Ca(OH)2+H2SO4=CaSO4+2H2O9.Mg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解10.2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解11.2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解溶液呈黄色12.Ba(OH)2+ H2SO4=BaSO4+2H2O 生成白色沉淀不溶解于稀硝酸检验SO42的原理13..BaCl2+ H2SO4=BaSO4+2HCl 生成白色沉淀不溶解于稀硝酸检验SO42的原理14.Ba(NO3)2+H2SO4=BaSO4+2HNO3 生成白色沉淀不溶解于稀硝酸检验SO42的原理15.Na2O+2HNO3=2NaNO3+H2O 白色固体溶解16.CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解溶液呈蓝色17.ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解18.MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解19.CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解20.NaOH+HNO3=NaNO3+ H2O21.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解22.Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解23.Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解24.Ca(OH)2+2HNO3=Ca(NO3)2+2H2O25.Fe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解溶液呈黄色26.3NaOH + H3PO4=3H2O + Na3PO427.3NH3+H3PO4=(NH4)3PO428.2NaOH+CO2=Na2CO3+ H2O 吸收COO2H2中的CO229.2NaOH+SO2=Na2SO3+ H2O2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)30.FeCl3+3NaOH=Fe(OH)3+3NaCl 溶液黄色褪去有红褐色沉淀生成1.碳与氧气(不足)的反应2C+O2==== 2CO 碳与氧气(充足)的反应C+O2==== CO22.一氧化碳与氧气的反应2CO+O2==== 2CO23.二氧化碳与碳的反应CO2+C==== 2CO4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3+2H2O10.碳酸氢钠加热的反应2NaHC O3==== Na2CO3+ H2O+CO2↑11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑12.碳酸钙加热的反应CaCO3==== CaO+CO2↑13.二氧化碳(过量)通入氢氧化钙溶液中的反应Ca(OH)2+2CO2==== Ca(HCO3)2二氧化碳(少量)通入氢氧化钙溶液中的反应Ca(OH)2+CO2==== CaCO3↓+H2O14.氮气与氧气的反应N2+O2==== 2NO15.一氧化氮与氧气的反应2NO+O2==== 2NO216.二氧化氮与水的反应3NO2+ H2O==== 2HNO3+ NO17.氮气与氢气的反应N2+3H2========= 2NH318.氨气与水的反应NH3+H2O==== NH3•H2O19.氨气与盐酸的反应NH3+HCl==== NH4Cl20.氨气与硫酸的反应2NH3+H2SO4==== (NH4)2SO421.氨气与强酸的离子的反应NH3+H+==== NH4+22.氨的催化氧化的反应4NH3+5O2====== 4NO+6H2O23.碳酸氢铵加热的反应NH4HCO3==== NH3↑+CO2↑+H2O24.氯化铵加热的反应NH4Cl==== NH3↑+HCl↑25.碳酸铵加热的反应(NH4)2CO3==== 2NH3↑+CO2↑+H2O26.氯化铵与氢氧化钙的反应2NH4Cl+ Ca(OH)2==== CaCl2+2NH3↑+2H2O27.氯化铵与氢氧化钠的反应NH4Cl+ NaOH==== NaCl+NH3↑+H2O28.碳酸氢铵与氢氧化钠的反应NH4HCO3+2NaOH==== Na2CO3+NH3↑+2H2O29.碳酸氢铵与氢氧化钙的反应NH4HCO3+Ca(OH)2==== CaCO3↓+NH3↑+2H2O30.硝酸的分解的反应4HNO3========= 4NO2↑+O2↑+2H2O31.铜与浓硝酸的反应Cu+4HNO3(浓)==== Cu(NO3)2+2NO2↑+2H2O32.铜与稀硝酸的反应3Cu+8HNO3(稀)==== 3Cu(NO3)2+2NO↑+4H2O33.铁与浓硝酸的反应Fe+6HNO3(浓)==== Fe(NO3)3+3NO2↑+3H2O34.铁与稀硝酸的反应Fe+4HNO3(稀)==== Fe(NO3)3+NO↑+2H2O35.碳与浓硝酸的反应C+4HNO3(浓)==== CO2↑+4NO2↑+2H2O36.一氧化氮与一氧化碳的反应2NO+2CO====== N2+2CO237.一氧化氮与氧气和水的反应4NO+3O2+2H2O==== 4HNO338.二氧化氮与氧气和水的反应4NO2+O2+2H2O==== 4HNO339.氢氧化钠吸收二氧化氮和一氧化氮的反应2NaOH+NO2+NO==== 2NaNO2+ H2O40.氨气(过量)与氯气的反应8NH3+3Cl2==== 6NH4Cl+N2氨气(少量)与氯气的反应2NH3+3Cl2==== 6HCl+N241.二氧化氮生成四氧化二氮的反应2NO2==== N2O442.硫与铜的反应S+2Cu==== Cu2S43.硫与铁的反应S+Fe==== FeS44.硫与钠的反应S+2Na==== Na2S45.硫与铝的反应3S+2Al==== Al2S346.硫与汞的反应S+Hg==== HgS47.硫与氧气的反应S+O2==== SO248.硫与氢气的反应S+H2==== H2S49.硫与氢氧化钠的反应3S+6NaOH==== 2Na2S+Na2SO3+3H2O50.硫与浓硫酸的反应 S+2H2SO4(浓)==== 3SO2+2H2O51.黑火药点燃S+2KNO3+3C==== K2S+3CO2↑+N2↑52.二氧化硫(少量)与氢氧化钠的反应SO2+2NaOH==== Na2SO3+H2O二氧化硫(过量)与氢氧化钠的反应SO2+NaOH==== NaHSO353.二氧化硫与氢氧化钙的反应SO2+Ca(OH)2==== CaSO3↓+H2O54.二氧化硫与亚硫酸钙溶液的反应SO2+CaSO3+H2O ==== Ca(HSO3)255.二氧化硫与水的反应SO2+H2O==== H2SO356.二氧化硫与硫化氢的反应SO2+2H2S==== 3S↓+2H2O57.二氧化硫与氧气的反应2SO2+O2====== 2SO358.二氧化硫与过氧化钠的反应SO2+Na2O2==== Na2SO459.二氧化硫与氯水的反应SO2+ Cl2+2H2O==== H2SO4+2HCl60.三氧化硫与水的反应SO3+H2O==== H2SO461.亚硫酸与氧气的反应2H2SO3+O2==== 2H2SO462.亚硫酸钠与氧气的反应2Na2SO3+O2==== 2Na2SO463.浓硫酸与铜的反应 2H2SO4(浓)+Cu==== CuSO4+SO2↑+2H2O64.浓硫酸与碳的反应 2H2SO4(浓)+C==== CO2↑+2SO2↑+2H2O寿65.工业制备硫酸(初步) 4FeS2+11O2==== 8SO2+2Fe2O366.实验室制备硫酸(初步) Na2SO3+H2SO4(浓)==== Na2SO4+SO2↑+H2O67.硫化氢(少量)与氢氧化钠的反应H2S+2NaOH==== Na2S+2H2O硫化氢(过量)与氢氧化钠的反应H2S+NaOH==== NaHS+H2O68.硫化氢(少量)与氨气的反应H2S+2NH3==== (NH4)2S硫化氢(过量)与氨气的反应H2S+NH3==== NH4HS69.硫化氢与氧气(不足)的反应2H2S+O2==== 2S↓+2H2O 2H2S+O2==== 2S+2H2O硫化氢与氧气(充足)的反应2H2S+3O2==== 2SO2+2H2O70.硫化氢与氯气的反应H2S+Cl2==== 2H Cl+S↓71.硫化氢与浓硫酸的反应 H2S+H2SO4(浓)==== S↓+SO2↑+2H2O72.硫化氢的制备FeS+H2SO4==== FeSO4+H2S↑73.电解饱和食盐水(氯碱工业) 2NaCl+2H2O==== 2NaOH+H2↑+Cl2↑74.电解熔融状态氯化钠(制单质钠) 2NaCl==== 2Na+Cl2↑75.海水制镁(1) CaCO3==== CaO+CO2 (2) CaO+H2O==== Ca(OH)2 (3) Mg2++2OH2-==== Mg(OH)2↓ (4) Mg(OH)2+2HCl==== MgCl2+2H2O (5) MgCl2==== Mg+Cl2↑76.镁在空气中燃烧(与氧气的反应) 2Mg+O2==== 2MgO(与氮气的反应) 3Mg+N2==== Mg3N2(与二氧化碳的反应) 2Mg+CO2==== 2MgO+C77.镁与氯气的反应Mg+Cl2==== MgCl278.镁与水的反应Mg+2H2O==== Mg(OH)2+H2↑79.镁与盐酸的反应Mg+2HCl==== MgCl2+H2↑80.镁与氢离子的反应Mg+2H+==== Mg2++H2↑81.二氮化三镁与水的反应Mg3N2+6H2O==== 3Mg(OH)2↓+2NH3↑82.镁与溴水的反应(颜色退去) Mg+Br2==== MgBr2(产生气泡) Mg+2HBr==== MgBr2+H2↑83.溴与水的反应Br2+H2O==== HBr+HBrO84.溴与氢氧化钠的反应Br2+2NaOH==== NaBr+NaBrO+H2O85.溴与氢气的反应Br2+H2==== 2HBr86.溴与铁的反应3Br2+2Fe==== 2FeBr387.碘与铁的反应I2+Fe==== FeI288.溴与碘化钾的反应Br2+2KI==== 2KBr+I289.氯气与溴化钾的反应2KBr+Cl2==== 2KCl+Br290.硅与氧气的反应Si+O2==== SiO291.硅与氯气的反应Si+2Cl2==== SiCl492.硅与氢气的反应Si+2H2===== SiH493.二氧化硅与氟的反应Si+2F2==== SiF494.硅与碳的反应Si+C==== SiC95.硅与氢氧化钠溶液的反应Si+2NaOH+H2O==== Na2SiO3+2H2↑96.硅与氢氟酸的反应Si+4HF==== SiF4+2H2↑97.单质硅的制备(1.制备)SiO2+2C==== Si+2CO(2.提纯)Si+2Cl2==== SiCl4(3.提纯)SiCl4+2H2==== Si+4HCl98.二氧化硅与氢氧化钠的反应SiO2+2NaOH==== Na2SiO3+H2O99.二氧化硅与氧化钠的反应SiO2+Na2O==== Na2SiO3100.二氧化硅与碳酸钠的反应SiO2+Na2CO3==== Na2SiO3+ CO2↑101.二氧化硅与氧化钙的反应SiO2+CaO==== CaSiO3102.二氧化硅与碳酸钙的反应SiO2+CaCO3==== CaSiO3+CO2↑ 103.二氧化硅与氢氟酸的反应SiO2+4HF==== SiF4+2H2O 104.硅酸的制备Na2SiO3+ CO2+H2O==== H2SiO3↓+ Na2CO3 105.硅酸加热分解H2SiO3==== SiO2+H2O 106.铝与氧气的反应4Al+3O2==== 2Al2O3 107.铝与氯气的反应2Al+3Cl2==== 2AlCl3 108.铝与盐酸的反应2Al+6HCl==== 2AlCl3+3H2↑109.铝与氢氧化钠的反应2Al+2NaOH+6H2O==== 2Na[Al(OH)4]+3H2↑ 110.铝与水的反应2Al+6H2O==== 2Al(OH)3+3H2↑111.铝与三氧化二铁的反应(铝热反应)2Al+Fe2O3==== 2Fe+Al2O3 112.铝与二氧化锰的反应(铝热反应)4Al+3MnO2==== 3Mn+2AlO3 113.氧化铝与盐酸的反应Al2O3+6HCl==== 2AlCl3+3H2O114.氧化铝与氢氧化钠的反应Al2O3+2NaOH+3H2O==== 2Na[Al(OH)4] 115.电解氧化铝2Al2O3==== 4Al+3O2↑116.硫酸与与一水合氨的反应Al2(SO4)3+6NH3•H2O==== 2Al(OH)3↓+3(NH4)2SO4 117.氯化铝与一水合氨的反应AlCl3+3NH3•H2O==== Al(OH)3↓+3NH4Cl 118.氯化铝与氢氧化钠(少量)的反应AlCl3+3NaOH==== Al(OH)3↓+3NaCl 119.氢氧化铝与氢氧化钠的反应Al(OH)3+NaOH==== Na[Al(OH)4]120.氯化铝与氢氧化钠(过量)的反应AlCl3+4NaOH==== Na[Al(OH)4]+3NaCl121.四羟基合氯酸钠与盐酸(少量)的反应Na[Al(OH)4]+HCl==== Al(OH)3↓+NaCl+H2O 122.氢氧化铝与盐酸的反应Al(OH)3+3HCl==== AlCl3+3H2O123.四羟基合氯酸钠与盐酸(过量)的反应Na[Al(OH)4]+4HCl==== AlCl3+NaCl+4H2O 124.四羟基合氯酸钠与氯化铝的反应3Na[Al(OH)4]+AlCl3==== 4Al(OH)3↓+3NaCl 125.向四羟基合氯酸钠中通入过量二氧化碳Na[Al(OH)4]+CO2==== Al(OH)3↓+NaHCO3 126.铜在潮湿空气中被腐蚀2Cu+O2+H2O+CO2==== Cu2(OH)2CO3 127.铜与氧气的反应2Cu+O2==== 2CuO 128.铜与氯气的反应Cu+Cl2==== CuCl2 129.铜氧化在高温下转化4CuO==== 2Cu2O+O 2↑ 130.硫酸铜与水的反应CuSO4+5H2O==== CuSO4•5H2O1.与碱反应产生气体(1)(2)铵盐:O H NH NH 234+↑−→−+碱⎪⎪⎩⎪⎪⎨⎧↑+=++↑+=++↑−−→−-232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质2.与酸反应产生气体(1) (2)()()()2332222332H H H CO HCO CO S HS H S SO HSO SO +++------⎧−−→↑⎪⎪−−→↑⎨⎪−−→↑⎪⎩化合物3.Na 2S 2O 3与酸反应既产生沉淀又产生气体: S 2O 32-+2H +=S ↓+SO 2↑+H 2O4.与水反应产生气体 (1)单质(2)化合物5.强烈双水解6.既能酸反应,又能与碱反应(1)单质:Al (2)化合物:Al 2O 3、Al(OH)3、弱酸弱碱盐、弱酸的酸式盐、氨基酸。
化学溶解性表

化学溶解性表物质的溶解性溶解性溶解度(20℃)易溶大于等于10g可溶大于等于1g小于10g微溶大于等于0.01g小于1g难溶(不溶)小于0.01g在许多化学反应里,作为一个整体参加反应,好像一个原子一样,这样的原子集团叫做原子团。
原子团又叫做根或基团,如氢氧根OH- 、硝酸根NO3- 、碳酸根CO32-、硫酸根SO42-、氯酸根ClO3-、磷酸根PO43-、碳酸氢根HCO3-、铵根NH4+、碳酸根CO32-等。
值得注意的是:原子团不能独立存在,只是化合物的一个组成部分。
在溶液中原子团作为一个整体参加反应。
各种原子团都有自己的特性反应,如CO32 -遇酸变成CO2,SO 42-遇Ba2+产生不溶于稀硝酸的白色沉淀,OH-使酚酞试液变成红色等。
利用特性反应可以检验根的存在。
g (气体)、l (液体)、s (固体)、aq (溶液)化学活动性金属的活动性是反映金属在水溶液里形成水合离子倾向的大小,也就是反映金属在水溶液里起氧化反应的难易,Cs>Rb>K>Ca>Na>Li>Mg>Al>Ti>Zn>Fe>Sn>Pb>Ni>(H)>Cu>Hg>Ag>Os>Ru>Ir>Rh>Pt>Pd>Au 非金属活动性,一般是指卤素与类卤素的活动性。
一般的,周期大的卤素可以把周期小的卤素从它们的卤化物中置换出来F>SCN>Cl(O)>Br>CN>OCN>I>S>N>P>C>Si>H无机部分:纯碱、苏打、天然碱、口碱:Na2CO3小苏打:NaHCO3大苏打:Na2S2O3石膏(生石膏):CaSO4.2H2O 熟石膏:2CaSO4·.H2O 莹石:CaF2重晶石:BaSO4(无毒)碳铵:NH4HCO3 石灰石、大理石:CaCO3生石灰:CaO 食盐:NaCl 熟石灰、消石灰:Ca(OH)2芒硝:Na2SO4·7H2O (缓泻剂) 烧碱、火碱、苛性钠:NaOH 绿矾:FaSO4·7H2O 干冰:CO2明矾:KAl (SO4)2·12H2O 漂白粉:Ca (ClO)2、CaCl2(混和物)泻盐:MgSO4·7H2O 胆矾、蓝矾:CuSO4·5H2O 双氧水:H2O2皓矾:ZnSO4·7H2O 硅石、石英:SiO2刚玉:Al2O3 水玻璃、泡花碱、矿物胶:Na2SiO3铁红、铁矿:Fe2O3磁铁矿:Fe3O4黄铁矿、硫铁矿:FeS2铜绿、孔雀石:Cu2(OH)2CO3菱铁矿:FeCO3赤铜矿:Cu2O 波尔多液:Ca (OH)2和CuSO4石硫合剂:Ca (OH)2和S 玻璃的主要成分:Na2SiO3、CaSiO3、SiO2过磷酸钙(主要成分):Ca (H2PO4)2和CaSO4重过磷酸钙(主要成分):Ca (H2PO4)2天然气、沼气、坑气(主要成分):CH4水煤气:CO和H2硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2溶于水后呈淡绿色光化学烟雾:NO2在光照下产生的一种有毒气体王水:浓HNO3与浓HCl按体积比1:3混合而成。
高中化学溶解性表
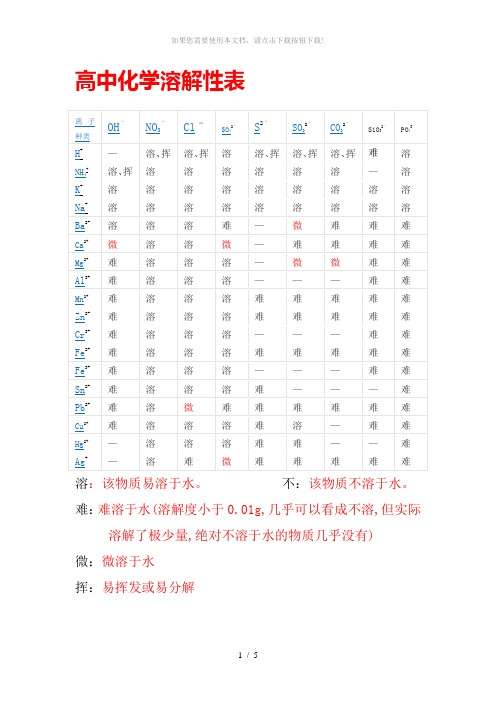
高中化学溶解性表溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有)微:微溶于水挥:易挥发或易分解沉淀鉴别色沉淀;Cu2O 红色沉淀;Fe2O3红棕色沉淀;FeO 黑色沉淀FeS2黄色沉淀;PbS 黑色沉淀;FeCO3灰色沉淀;Ag2CO3白色沉淀(制作过程中Ag2CO3易分解成褐色Ag2O,混合物常常为黄色);Cu2(OH)2CO3暗绿色沉淀;BaCO3白色沉淀(且有CO2生成);CaCO3白色沉淀(且有CO2生成);BaSO4白色沉淀;不溶的碳酸盐白色沉淀(且有CO2生成);不溶的碱、金属氧化物白色沉淀(且有CO2生成);Fe(OH)2为白色絮状沉淀(在空气中很快变成灰绿色,再变成Fe(OH)3红褐色沉淀)溶解性口诀:钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)硫酸盐除钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物);只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)碱类中,钾、钠、铵、钡溶。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住(见上表)。
8、这个世界并不是掌握在那些嘲笑者的手中,而恰恰掌握在能够经受得住嘲笑与批忍不断往前走的人手中。
9、障碍与失败,是通往成功最稳靠的踏脚石,肯研究、利用它们,便能从失败中培养出成功。
10、在真实的生命里,每桩伟业都由信心开始,并由信心跨出第一步。
(注:可编辑下载,若有不当之处,请指正,谢谢!)。
物质的溶解性表
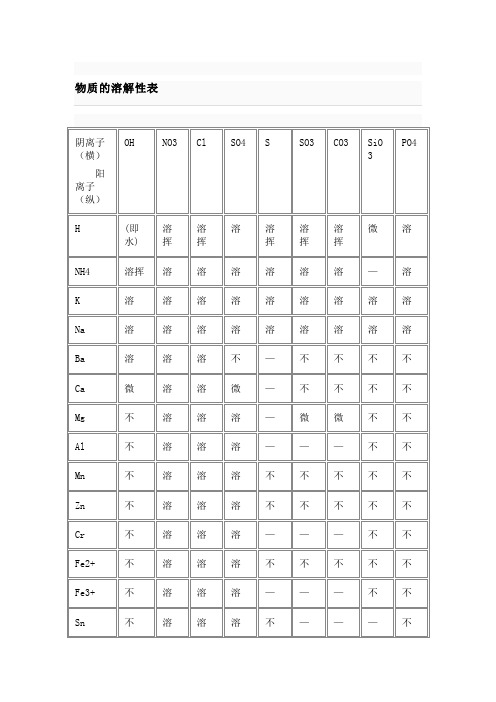
物质的溶解性表白色:BaSO4 BaCO3 CaCO3 AgCl Ag2CO3 Mg(OH)2 Fe(OH)2 Al(OH)3 黄色:AgI蓝色:Cu(OH)2浅黄色:AgBr AgNO2红褐色:Fe(OH)3编辑本段溶解性口诀溶解性口诀一钾钠铵盐溶水快,①硫酸盐除去钡铅钙。
②氯化物不溶氯化银,硝酸盐溶液都透明。
③口诀中未有皆下沉。
④注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶;③硝酸盐都溶于水;④口诀中没有涉及的盐类都不溶于水;溶解性口诀二钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。
说明,以上四句歌谣概括了8类相加在水中溶解与不溶的情况。
溶解性口诀三钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶溶解性口诀四钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)另有几种微溶物,可单独记住。
溶解性口诀五钾钠铵盐硝酸盐完全溶解不困难氯化亚汞氯化银硫酸钡和硫酸铅生成沉淀记心间氢硫酸盐和碱类碳酸磷酸硝酸盐可溶只有钾钠铵溶解性口诀六(适合初中化学课本后面的附录)钾钠铵盐硝酸盐①氢氧根多钡离子②硫酸盐除钡钙银③碳酸溶氢钾钠铵④生成沉淀氯化银⑤解释①钾盐、钠盐、铵盐、硝酸盐都溶于水②除了以上四种,氢氧根和钡离子结合时也溶于水③硫酸根除了和钡离子、钙离子、银离子结合时不溶于水,其他都溶④碳酸根除了和氢离子、钾离子、钠离子和铵离子结合时溶于水,其他都不溶⑤氯离子只有和银离子结合时不溶于水初中常用溶解性口诀(溶解性口诀七)铵钾钠钡氢氧溶①碳酸只溶铵钾钠②所有硝酸都能溶③盐酸只有银不溶④硫酸只有钡不溶⑤解释①氢氧化铵,氢氧化钾,氢氧化钠,氢氧化钡都溶于水,其余带氢氧根的都不溶于水。
常见物质的化学式(溶解性)表
氢氧根
硝酸根
氯离子
硫酸根
碳酸根
磷酸根
硫离子
氢离子
铵根离子
钾离子
钠离子
钡离子
钙离子
镁离子
铝离子
锌离子
亚铁离子
铁离子
铜离子
银离子
物质的化学式(溶解性)表
氢氧根
硝酸根
氯离子
硫酸根
碳酸根
磷酸根
硫离子
氢离子
铵根离子
钾离子
钠离子
钡离子
钙离子
镁离子
铝离子
锌离子
亚铁离子
铁离子
铜离子
银离子
物质的化学式(溶解性)表
氢氧根
硝酸根
氯离子
硫酸根
碳酸根
磷酸根
硫离子
氢离子
铵根离子
钾离子
钠离子
钡离子
钙离子
镁离子
铝离子
锌离子
亚铁离子
铁离子
铜离子
银离子
物质的化学式(溶解性)表
氢氧根
硝根
硫离子
氢离子
铵根离子
钾离子
钠离子
钡离子
钙离子
镁离子
铝离子
锌离子
亚铁离子
铁离子
铜离子
银离子
有关溶解性表

有关溶解性表:
1、酸:常见酸
2、碱:是溶碱(),是微溶碱(),
其余都不溶。
其中是蓝色固体的是,是红褐色固体的是,其中是白色固体的是。
3、盐:
(1)全溶(是,)
(2)盐酸盐:只有不溶(),其余全溶。
(3)硫酸盐:只有不溶(),微溶(),其余全溶。
(4)碳酸盐:只溶(),微溶(),
4、蓝色固体,红色固体,白色固体,
既不溶于水,也不溶于酸的固体:,溶于酸产生气体的固体,溶于不产生气体的固体
5、溶液颜色:呈黄色的是:
呈蓝色的是:
呈浅绿色的是:
6、离子共存问题:两种离子结合能生成就不能共存
不能与氢氧根离子共存的是:
不能与硫酸根离子共存的是:
不能与氯离子共存的是:
不能与碳酸根离子共存的是:。
高中化学溶解性表
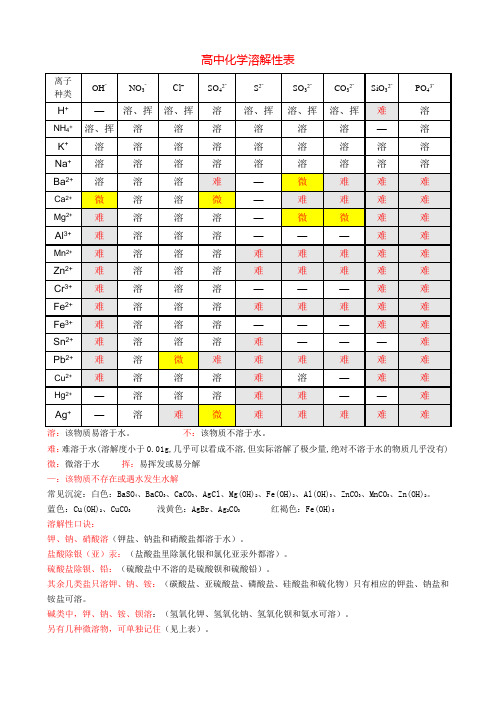
高中化学溶解性表
溶:该物质易溶于水。
不:该物质不溶于水。
难:难溶于水(溶解度小于0.01g,几乎可以看成不溶,但实际溶解了极少量,绝对不溶于水的物质几乎没有) 微:微溶于水挥:易挥发或易分解
—:该物质不存在或遇水发生水解
常见沉淀:白色:BaSO4、BaCO3、CaCO3、AgCl、Mg(OH)2、Fe(OH)2、Al(OH)3、ZnCO3、MnCO3、Zn(OH)2。
蓝色:Cu(OH)2、CuCO3浅黄色:AgBr、Ag2CO3红褐色:Fe(OH)3
溶解性口诀:
钾、钠、硝酸溶(钾盐、钠盐和硝酸盐都溶于水)。
盐酸除银(亚)汞:(盐酸盐里除氯化银和氯化亚汞外都溶)。
硫酸盐除钡、铅:(硫酸盐中不溶的是硫酸钡和硫酸铅)。
其余几类盐只溶钾、钠、铵:(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只有相应的钾盐、钠盐和铵盐可溶。
碱类中,钾、钠、铵、钡溶:(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)。
另有几种微溶物,可单独记住(见上表)。
物质溶解性表

HNO3
HNO3
HCl
HCl
水
HCl
-
-
HCl
-
HCl
水
-
略溶,
HCl
HCl
HCl
水
-
HCl
略溶
水
水
水
水
水
硫化物S2-
HNO3
王水
HNO3
王水
HNO3
HNO3
HNO3
HNO3
浓HCl
浓HCl
浓HCl
水解,
HCl
HCl
HCl
HCl
HNO3
HNO3
HCl
水解,
HCl
水
水
水
水
水
水
水
氰化物CN-
不溶
-
HNO3
水
-
HCl
HCl
-
-
-
-
HCl
-
不溶
HCl
HNO3
HNO3
HCl
-
略溶,
HCl
水
水
水
水
水
水
六氰合铁(Ⅱ)酸盐
/亚铁氰化物Fe(CN)64
不溶
-
不溶
-
-
不溶
不溶
-
-
-
不溶
-
不溶
不溶
HCl
不溶
不溶
不溶
-
水
水
水
水
水
水
水
六氰合铁(Ⅲ)酸盐
/铁氰化物Fe(CN)63-
不溶
-
不溶
不溶
-
不溶
不溶
-
溶解性表

碳酸盐, CO32草酸盐, C2O42-
氟化物, F-
亚硫酸盐, SO32AsO33AsO43-
磷酸盐, PO43BO2-
硅酸盐, SiO32酒石酸, C4H4O62-
硫酸盐, SO42CrO42-
硫化物S2-
氰化物, CNFe(CN)64Fe(CN)63S2O32CNS-
碘化物, I-
溴化物, Br-
HCl
水 -
HCl
不溶 不溶 不溶 水 水
水
水
水 水 -
水
Mn2+ HCl HCl
HCl
HCl HCl HCl HCl HCl HCl 略溶, HCl 水 略溶, HCl HCl
HCl
HCl 不溶 水 水
水
水
水 水 水
水
-
-
-
-
水
水
水
水
水
HCl
HCl
HCl
HCl, 略溶
HCl
HCl
HCl
HCl
HCl
H+ NH4+
K+ Na+ Ba2+ Ca2+ Mg2+ Al3+ Mn2+ Zn2+ Cr3+ Fe2+ Fe3+ Sn2+ Pb2+ Bi3+ Cu2+ Hg22+ Hg2+ Ag+
部分酸、碱和盐的溶解性表(20℃)
OH-
NO3-
Cl-
SO42-
溶、挥 溶、挥 溶
I-
S2-
SO32-
溶 溶、挥 溶、挥
略溶
水
水
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 . 氯化钠 碳酸钠 碳酸氢钠 碳酸钙 的化学式如何书写? NaCl Na2CO3 NaHCO3 CaCO3
2.碳酸盐的检验方法? 取少量样品加入适量稀盐酸,有气体生成,将其通
入澄清石灰水中,如果澄清石灰水变浑浊,则该物质为 碳酸盐。
1.阳离子和阴离子能够组成一种物质 如 Na+和Cl-可以构成NaCl Ca2+和CO3-可以构成CaCO3
----
NO3-
HNO3 NH4NO3
KNO3 NaNO3 Ba(NO3)2 Ca(NO3)2
Mg(NO3)2 Al(NO3)3 Mn(NO3)2 Zn(NO3)2 Fe(NO3)2 Fe(NO3)3 Cu(NO3)2 AgNO3
Cl-
HCl NH4Cl
KCl NaCl BaCl2 CaCl2 MgCl2 AlCl3 MnCl2 ZnCl2 FeCl2 FeCl3 CuCl2 AgCl
2.盐的分类: 可以根据金属离子(或者铵根离子)进行分类,可分为: 钾盐,钠盐,钙盐等
也可以根据酸根离子进行分类,可分为碳酸盐,硝酸盐, 硫酸盐,盐酸盐(即包含氯离子的)
请思考下列物质是哪类盐?
• 碳酸钠
既是碳酸盐,也是钠盐
• 硫酸钙
既是硫酸盐,也是钙盐
• 氯化钠
Байду номын сангаас
既是盐酸盐,也是钠盐
阴离子
阳离子
SO42-
H2SO4 (NH4)2SO4
K2SO4 Na2SO4 BaSO4 CaSO4
MgSO4 Al2(SO4)3 MnSO4
ZnSO4 FeSO4 Fe2(SO4)3 CuSO4 Ag2SO4
CO32-
H2CO3 (NH4)CO3
K2CO3 Na2CO3 BaCO3 CaCO3
MgCO3 ----
OHH2O
Al(OH)3
NO3-
ClBaCl2
SO42-
CO32-
阴离子
阳离子
H+ NH4+
K+ Na+ Ba2+ Ca2+
Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+
OH-
H2O NH3·H2O
KOH NaOH Ba(OH)2 Ca(OH)2 Mg(OH)2 Al(OH)3 Mn(OH)2 Zn(OH)2 Fe(OH)2 Fe(OH)3 Cu(OH)2
MnCO3 ZnCO3 FeCO3
---CuCO3 Ag2CO3
酸类都可溶
溶碱有五位:钾钠铵钙钡
盐类:钾钠硝铵溶 盐酸盐不溶氯化银 硫酸盐不溶硫酸钡 碳酸盐只溶钾钠铵
其中氯化银和硫酸钡也不溶于酸
看例题:判断下列物质是否溶于水
• 氯化钠 • 碳酸钙 • 硫酸钡 • 氯化银 • 硝酸钙
H+ NH4+
K+ Na+ Ba2+ Ca2+
Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+
部分酸、碱、盐的溶解性表
OH-
NO3-
Cl-
SO42-
CO32-
阴离子
阳离子
H+ NH4+
K+ Na+ Ba2+ Ca2+
Mg2+ Al3+ Mn2+ Zn2+ Fe2+ Fe3+ Cu2+ Ag+
