—碳酸钠的制备与定量分析PPT课件
无机化工工艺学——纯碱

❖ 析出碳酸氢钠
❖
Na+ + HCO3- = NaHCO3 (s)
❖ 反应到一定时间后,氨基甲酸铵的水解是控制步骤,所以
塔中要保持足够的溶液量使反应时间充分。
27
4.2.2 氨碱法的工业生产
碳酸化度R的定义
游离 已结合
R
溶 液 中 全 部CO2浓 度 总氨浓度
CCO2 2C NH3 C NH3,T
5
4.1 概述
四、生产方法
❖草木灰 ❖ 氨碱法生产纯碱 ❖ 联碱碱法生产纯碱(侯氏法) ❖ 路布兰法 湿法芒硝制碱法 干法芒硝制碱法 ❖ 天然碱加工提纯制纯碱
6
4. 2 碱法制纯碱
4.2.1 氨碱法的生产过程
(1)CO2气和石灰乳的制备。煅烧石灰石制得 石灰和二氧化碳,石灰消化而得石灰乳。
(2)盐水的制备、精制及氨化,制得氨盐水。 (3)氨盐水的碳酸化制重碱。来自石灰石煅烧 及重碱煅烧的CO2,经压缩、冷却送至碳化塔。 (4)重碱的过滤及洗涤(即碳化所得晶浆的液 固分离)。 (5)重碱煅烧制得纯碱成品及CO2。 (6)母液中氨的蒸馏回收。
❖ 总组成在 AC 线上,
只 析 出NaHCO3 时 ,
又必须在其饱和面
上 。 所 以 在 RS 线
碳酸钠的制备及其总碱度的测定40 优质课件

(2) 灼烧制备Na2CO3: 将上面的产品放到蒸发皿中,放至石棉网上加热,同
时用玻璃棒不停翻搅,使固体受热均匀并防止结块。开 始加热用温火,几分钟后改用强火,灼烧大约半小时, 即可得到干燥的白色细粉状Na2CO3产品。冷却到室温后 在台称上称其质量,记录产品的质量,并计算产率。
2. 总碱度的的测定
碳酸钠的制备及其总碱度的测定
实验目的
1. 学会通过复分解反应制备碳酸钠 2. 掌握恒温条件控制及高温灼烧的基本操作 3. 掌握混合碱测定原理及测定结果的计算,
学会用双指示剂滴定法,正确判断两个滴定 终点
实验原理 1. 碳酸钠的制备
首先采用碳酸氢铵与氯化钠作用制取碳酸 氢钠,再经过高温灼烧,转化为碳酸钠。
同样方法平行测定 3次,要求消耗HCl的总体积的极 差不大于0.05ml。
Na2CO3 + NaHCO3 加入酚酞
HCl
V1
NaHCO3 + NaHCO3 V2 酚酞褪色, 加入甲基橙 HCl
H2CO3
甲基橙变色
百分含量的计算:
(Na2CO3) = c(HCl) 2V1M(Na2CO3) /(2ms1000) 100% (NaHCO3) = c(HCl) (V2-2V1) M(NaHCO3) /(在30~35℃之间 2. 减压过滤的操作步骤要准确无误 3. 滴定时终点颜色的判断
思考题
1. 在滴定过程中,用标准HCl溶液滴定到达第二个终 点时,为什么要将溶液加热沸腾?不然会对实验数据带 来什么影响? 2. 影响产品产量高低的主要因有哪些?影响产品纯度, 即碳酸钠、碳酸氢钠及其它杂质含量的主要因素有哪些?
(1) 样品的配制: 准确称取Na2CO3产品0.5000g, 配制于100ml容量瓶
《碳酸钠和碳酸氢钠》课件

热稳定性
加热时,碳酸氢钠会分 解为碳酸钠、水和二氧
化碳。
与酸的反应
与酸反应放出二氧化碳 气体。
与碱的反应
碳酸氢钠与碱反应,生 成碳酸盐和氢氧化钠。
03
碳酸钠和碳酸氢钠的用途
碳酸钠的用途
玻璃工业
碳酸钠可用于制造平板玻璃、 瓶罐玻璃、光学玻璃等,提高
玻璃制品的硬度和耐用性。
肥皂工业
碳酸钠是生产肥皂的主要原料 之一,能够去除油脂和污垢, 保持皮肤清洁。
化学工业
碳酸钠可用于生产染料、油漆 、油墨等化学品,以及作为催 化剂和溶剂等。
食品工业
碳酸钠可作为膨松剂、面团调 节剂等,提高食品的口感和品
质。
碳酸氢钠的用途
食品添加剂
碳酸氢钠可作为发酵粉、饼干、面包等食品 的膨松剂,增加食品的体积和口感。
清洁剂
碳酸氢钠可用作清洁剂,去除污垢和异味, 保持物品的清洁和卫生。
以碳酸钙、纯碱或氯化钠为原料,与 酸反应制得碳酸氢钠。
气相法
以氯化钠、氨气和二氧化碳为原料, 在高温、加压条件下反应制得碳酸氢 钠。
固相法
将纯碱和氯化钠的混合物加热至高温 ,再与二氧化碳反应制得碳酸氢钠。
碳化法
以石灰石、煤灰或重质碱灰为原料, 与碳酸气反应制得碳酸氢钠。
05
碳酸钠和碳酸氢钠的鉴别方 法
药品
碳酸氢钠可用于治疗胃酸过多、消化不良等 病症,缓解胃痛和不适感。
化工原料
碳酸氢钠可用于生产其他化学品,如醇钠、 丙酮等,以及作为催化剂和溶剂等。
04
碳酸钠和碳酸氢钠的制备方 法
碳酸钠的制备方法
侯氏制碱法
利用氨气、二氧化碳、水和氯化钠为原料,在加压、低温 条件下先制得碳酸氢钠,再通过加热分解碳酸氢钠得到碳 酸钠。
化工工艺纯碱工艺PPT课件

消费预测: 2005—2010年国内消费增长率预计为6·5%; 2010—2015年预计为2·8%; 2005—2010年以纯碱出口量增加到180万t计算,进口量按30万t计,2010年 我国对纯碱的需求量将达到1 700万t。 以上分析结果显示,今后5~10年,我国纯碱生产能力还需要增加500万t/a左 右才能满足国内消费及出口的需求。因此我国纯碱工业仍有一定的发展 空间。
3NaCl+3NH3+2CO2+4H2O→Na2CO3·2H2O+3NH4C1
第29页/共243页
(2)盐水吸氨
水和盐水吸收二氧化碳是很困难的,在 没有氨存在时,CO2几乎不溶解在盐水中。 为了使反应能很好进行,必须要先将氨溶解 在盐水中,然后再进行碳酸化。盐水吸氨是 在吸氨塔中进行的。
第30页/共243页
•
CO
2
的
来源:①大部分△由煅烧石灰石 ②一部分由重碱煅烧而来。
得
到
;
【石灰石煅烧】 CaCO3 = CaO+ CO2
石灰窑中煅烧来的CaO供“氨回收”反应用:
【石灰乳制备】CaO + H2O = Ca(OH)2
第27页/共243页
一.氨碱法的主要过程 氨碱法生产纯碱是以食盐和石灰石为原料,以氨为媒介物,进行一系列化学反应和工 艺过程而制得的。 (1)氨盐水碳酸化 NaCl+NH3+CO2+H2O→NaHCO3 +NH4C1
2NaHCO3 →Na2CO3+H2O↑+CO2 ↑ 此时重碱中所含的NH4HCO3、(NH4)2CO3也一起分解:
NH4HCO3→NH3↑+H2O+CO2↑ (NH4)2CO3→2NH3↑+H2O+CO2↑ 放出的二氧化碳气因其在煅烧炉中产生,故名为炉气,冷却除去其中的NH3和部分 H2O后,经压缩机压缩,回到碳酸化塔中。
碳酸钠的制备及其总碱度的测定

操作要点 1. 碳酸钠的制备
(1) 复分解反应制中间产物 复分解反应制中间产物NaHCO3: 将盛有25ml NaCl 溶液的小烧杯放在水浴上加热, 溶液的小烧杯放在水浴上加热, 将盛有 控制温度在30 之间。 固体粉末10 控制温度在 ~ 350C之间。称取 之间 称取NH4HCO3固体粉末 g,在搅拌下分批次加入到上述溶液中。加料完毕后继 ,在搅拌下分批次加入到上述溶液中。 左右。 续搅拌并保持反应要求温度 20min左右。静置几分钟后 左右 减压过滤,得到 晶体。 减压过滤,得到NaHCO3晶体。用少量水淋洗晶体以除 去粘附的铵盐,尽量抽干母液。将布氏漏斗中洁白、 去粘附的铵盐,尽量抽干母液。将布氏漏斗中洁白、蓬 松的NaHCO3 晶体取出,在台称上称其湿重并纪录数据。 晶体取出,在台称上称其湿重并纪录数据。 松的
Na2CO3 + NaHCO3 加入酚酞 ↓ HCl ↓ HCl H2CO3 甲基橙变色 V1
酚酞褪色, V2 酚酞褪色 加入甲基橙
NaHCO3 + NaHCO3
百分含量的计算: 百分含量的计算:
ω(Na2CO3) = c(HCl) × 2V1×M(Na2CO3) /(2ms×1000) × 100% ω(NaHCO3) = c(HCl) (V2-2V1)× M(NaHCO3) /(ms×1000) × 100% ×
(2) 灼烧制备 2CO3: 灼烧制备Na 将上面的产品放到蒸发皿中,放至石棉网上加热,同 将上面的产品放到蒸发皿中,放至石棉网上加热, 时用玻璃棒不停翻搅,使固体受热均匀并防止结块。 时用玻璃棒不停翻搅,使固体受热均匀并防止结块。开 始加热用温火,几分钟后改用强火,灼烧大约半小时, 始加热用温火,几分钟后改用强火,灼烧大约半小时, 即可得到干燥的白色细粉状Na 产品。 即可得到干燥的白色细粉状 2CO3产品。冷却到室温后 在台称上称其质量,记录产品的质量,并计算产率。 在台称上称其质量,记录产品的质量,并计算产率。
工业碳酸钠的分析测定 ppt课件

(800±25)℃下灼烧恒重后称量, 利用称量所得质量即可计算SO42-的含 量。
硫酸钡重量法 仲裁法
01 02 03 04
方法提要 溶解试样并分离不溶物,在稀盐酸介质中使硫酸盐沉淀为硫酸钡,将得 到的沉淀进行分离,在800士25℃下灼烧后称量。
1
无水Na2CO3保存不当,吸收了1%的水 分,用此基准物质标定盐酸溶液的浓 度时,对其结果产生何种影响?
2 标定盐酸的两种基准物质无 水Na2CO3和硼砂,各有什么优 缺点?
2
工业碳酸钠中氯化物含量的测定
试剂和仪器
(1)硝酸(GB 626)溶液l+1。
(3)氢氧化钠(GB 629)溶液40g/L。
计算试样中na的含量即为总碱度测定各次的相对偏差应在05内数据记录与处理项目次数式样g试样溶液总体积ml滴定v式样的体积ml盐酸的浓度moll1盐酸的体积mlw碳酸钠相对偏差平均相对偏差保存不当吸收了1的水分用此基准物质标定盐酸溶液的浓度时对其结果产生何种影响
工业碳酸钠的分析测定 6个小实验
项目目的
将滴定后的废液保存起来,按GB 3051附录D规定进行处理。
实 分数x2格式(1)计算 式中 c——硝酸汞标准滴定溶液的实际浓度, mol/L; V——滴定中消耗硝酸汞标准滴定溶液的体积,ml; V0——参比溶液制备中所消耗硝酸汞标准滴定溶液的体积,ml; m——试料的质量,g;
指示剂的选择
还是用HCl标准溶液作为滴定剂,但是是用溴甲 酚绿-甲基红作为指示剂指示反应终点。 化学计量点pH为5.0以下 指示终点:pH为5.0以下为暗红色
溴甲酚绿-甲基红的配制 称取0.1 g 溴甲酚绿,溶于乙醇(95%),用乙醇
碳酸钠的性质与应用PPT课件

目 录
• 碳酸钠的性质 • 碳酸钠的应用 • 碳酸钠的生产工艺 • 碳酸钠的储存与运输 • 碳酸钠的市场分析
01
碳酸钠的性质
物理性质
01
02
03
04
白色固体,易溶于水, 溶解时放热。
相对密度为2.53,熔点 为851°C。
热稳定性较好,加热至 1000°C以上才开始分解。
03
碳酸钠的生产工艺
天然碱法
天然碱法是最早的碳酸钠生产方法,利用天然存在的碱湖或碱泉中的天然碱(碳 酸钠和碳酸氢钠的混合物)作为原料,经过溶解、澄清、蒸发、干燥等工序制得 碳酸钠。
该方法的优点是利用天然资源,生产成本较低,但原料来源受地域限制,产量不 稳定。
氨碱法
氨碱法是目前碳酸钠生产的主要方法之一,以食盐(氯化钠 )为主要原料,通过一系列化学反应制得碳酸钠。
THANK YOU
运输工具
运输工具应保持干燥、通风良好, 并避免与易燃、易爆、腐蚀性等
危险品混装。
运输温度
在运输过程中,应保持温度在 25℃以下,以防止碳酸钠受潮和
结块。
安全注意事项
01
防护措施
操作人员应穿戴防护眼镜、口罩、手套等个人防护用品,以防止碳酸钠
粉尘对皮肤和呼吸道的刺激。
02 03
急救措施
如果不慎吸入碳酸钠粉尘,应立即离开污染区,用清水漱口,保持呼吸 道通畅。如果皮肤或眼睛接触到碳酸钠,应立即用大量清水冲洗,并及 时就医。
市场前景预测
未来几年,全球碳酸钠市场规模将继续保持增长态势,尤其在新兴市场的推动下, 市场需求将进一步扩大。
中国碳酸钠市场在未来几年内将继续保持稳定增长,同时,随着环保要求的提高和 产业结构的升级,碳酸钠行业将逐步向绿色、低碳、循环方向发展。
碳酸钠、碳酸氢钠的定量计算和图像分析和侯氏制碱法课件-高一化学人教版(2019)必修第一册

列叙述正确的是
()
• A.A气体是CO2,B气体是NH3 • B.第Ⅲ步得到的晶体是Na2CO3·10H2O • C.侯氏制碱法的工艺过程中应用了物质溶解度的差异
• D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
Thank you
( C- Na+ CO23- HCO- 3
B Na+ CO23- Cl-
H C O - 3
C
Na+
C O 23-
H
C
O
-
3
Cl-
D
Na+
H
C
O
-
3
Cl-
C O 23-
课堂练习
2、向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体,再在所 得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl 的量的关系如图所示(忽略CO2的溶解和HCl的挥发): (1)在NaOH溶液中通入一定量的CO2后,溶液中溶质的组成可能是 ①_N__a_O_H__、__N_a_2C__O_3 ,②__N_a_2_C__O_3,③___N__a_2C__O_3_、__N__a_H_C__O,3 ④_N__a_H_C__O_3。
归纳总结:
1、将CO2通入至NaOH溶液中,请分析溶液中溶质的成分。
2、结合Na2CO3、NaHCO3溶液中逐滴加入HCl溶液,的单一图像,并 总结归纳图像的特点。
3.向 Na2CO3、NaHCO3:混合溶液中逐滴加入稀盐酸,生成气体的量随盐
酸加入量的变化关系如图所示。则下列离子组在对应的溶液 中,一定
(2)沉淀池中发生反应的化学方程式是_______________________________。 (3)写出上述流程中物质X的分子式________。 (4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 ________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是___。
碳酸钠的含量滴定原理

碳酸钠的含量滴定原理碳酸钠的含量滴定原理是通过滴定法来测定样品中碳酸钠的含量。
滴定法是一种常用的定量分析方法,通常使用一种称为滴定液的溶液与待测样品反应,并用另一种称为指示剂的物质来指示滴定终点的达到。
下面对碳酸钠的含量滴定原理进行详细介绍。
滴定法中重要的步骤之一是选择合适的滴定酸和指示剂。
在测定碳酸钠的含量时,一种常用的滴定酸是盐酸(HCl),而靛蓝指示剂则常常被用来指示滴定终点。
盐酸可以与碳酸钠反应生成氯化钠和二氧化碳,反应方程式如下所示:Na2CO3 + 2HCl →2NaCl + H2O + CO2根据反应方程式可以知道,每个摩尔的碳酸钠消耗2个摩尔的盐酸。
因此,可以通过滴定法来测定样品中碳酸钠的含量。
具体实验操作如下:步骤一:准备样品溶液。
将待测样品溶解在适量的去离子水中,得到已知浓度的碳酸钠溶液。
步骤二:准备滴定液。
将所需量的盐酸溶液用去离子水稀释到适当的浓度,根据滴定液和样品溶液的反应比例来计算盐酸的用量。
步骤三:滴定操作。
将碳酸钠溶液加入滴定瓶中,加入几滴靛蓝指示剂。
然后,用盐酸滴定溶液滴定样品溶液,直到出现由蓝色变为无色的变化。
这个变化表示碳酸钠与盐酸的反应已经完全进行。
步骤四:记录滴定液的用量。
滴定结束后,需要记录滴定液的用量,以用于计算样品溶液中碳酸钠的含量。
步骤五:计算碳酸钠的含量。
根据滴定液的用量和反应的计量关系,可以计算出样品溶液中碳酸钠的含量。
例如,假设滴定液的浓度为0.1 mol/L,用了20 mL 的滴定液,那么样品溶液中碳酸钠的含量可以计算为:0.1 mol/L ×20 mL ×2/1 = 4 mmol。
以上就是碳酸钠的含量滴定原理的详细说明。
通过滴定法可以准确快速地测定样品中碳酸钠的含量,对于许多实验和工业应用非常有用。
但需要注意,滴定法的精确度和准确性很大程度上取决于实验者的经验和技术操作水平,因此在进行滴定实验时需要严格遵循实验操作规范。
碳酸钠的制备与定量分析PPT课件

原料
制备原理
制取装置
产品分析
制备产品
装置连接
第4页/共13页
侯氏制碱的第一步反应原理可以用下面的方程 式表示:
NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl 1、请设计实验装置模拟工业生产实现这一过 程,获得碳酸氢钠晶体。
2、将所得碳酸氢钠焙烧后得到的碳酸钠中可能 含有什么杂质,如何检测?
资料卡:有效氯是衡量含氯消毒剂氧化能力的标 志,有效氯数值等于过量HCl和漂白粉作用生成氯 气的质量和漂白粉质量之比。
第10页/共13页
原理 原料
制备原理
制取装置
产品分析
制备产品
装置连接
参考以上流程,设计实验装置模拟二氧化硫 的催化氧化制得三氧化硫晶体。
资料卡:三氧化硫常温下是一种无色油状 液体,具有强刺激性臭味。熔点16.83℃, 沸点(101.3kPa)44.8℃。
第2页/共13页
某同学用下图中的实验装置(其它装置未画 出)实现了碳酸氢钠的制备。思考下列问题:
(3)实验时,须先通入什么气体? (4) 冷却水的作用是什么?
第3页/共13页
侯氏制碱的第一步反应原理可以用下面的方程 式表示:
NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
1、设计实验装置模拟工业生产实现这一过程, 获得碳酸氢钠晶体。
制取装置
产品分析
制备产品
装置连接
参考以上流程,设计制取漂白粉的实验装置。
资料卡:工业制漂白粉的过程中,如果温度过 高氯气和氢氧化钙容易生成氯酸钙等杂质。
第8页/共13页
氢氧化钙
氢氧化钠
第9页/共13页
碳酸钠含量测定ppt课件
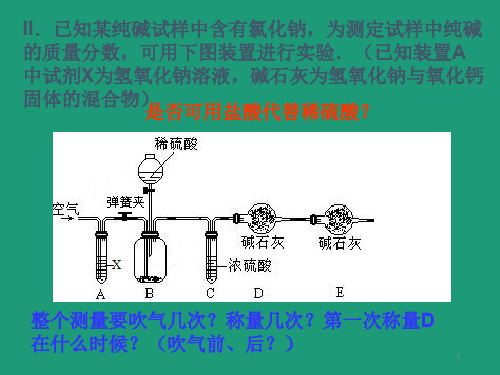
3.E装置的作用是__防__止__空__气__中__的__二__氧__化__碳__和__水__蒸__气__进__入__D_装置
4.在不考虑实验装置引起误差的基础上,若要增加实验的
精确度,可采取的措施是__多__次__实__验_________
13
_________________________________________浓__盐__酸__具__有__挥, 本发实性验,中会为影什响么气选体用体硫积酸的进行测试定验。而不用盐酸_____________
_________________________。
10
(2)有同学提出以图2代替图1中的收集装置,若不考虑所加硫 酸带来的体积影响,则所测CO2气体的体积 _偏__小__(填“偏大” 、“偏小”、“不变”),理由是CO__2能__溶__于__水_且__与__水__反__应____, 你的改进方案是 __在__水_面__上__覆__盖__一__层_植__物__油____。
(2)没有最后一个装置,对氢氧化钠质量分 数的测定结果影响是__偏__大________ (填“偏大”、“偏小”或“不变”)
8
二、样品中NaOH的含量测定 有哪些方法?
小刚认为可以通过沉淀法计算碳酸钠的质量,他称取了
该混合物样品10.0g,按下列步骤进行实验:
CaCl2 + Na2CO3→CaCO3 ↓ + 2NaCl
9
小明认为可以通过气化法计算碳酸钠的质量,他选用了 如下装置进行实验。
(1)如图1所示(铁夹夹持的仪器是理想无摩擦注射器),把
Xg的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积 。检查该装置的气密性的方法是将注射器活塞拉出一定距离
__,__一__段__时__间__后__松__开__活__塞__,__活__塞_ 能回到原位则不漏气
碳酸钠基准物质

碳酸钠基准物质1. 引言碳酸钠(Na2CO3)是一种无机化合物,常见的化学品之一。
它是碱性的固体,在工业生产中有着广泛的应用。
为了确保质量控制和实验结果的准确性,需要使用基准物质来进行校准和比对。
本文将介绍碳酸钠基准物质的定义、特性、制备方法以及在实验室和工业中的应用。
2. 碳酸钠基准物质的定义碳酸钠基准物质是指具有已知纯度和化学组成,可作为标准参照物来校正和比对其他样品的化学分析方法。
它通常由国家或国际标准组织认可,并通过严格的测试程序进行验证。
3. 碳酸钠基准物质的特性3.1 物理性质•外观:白色结晶固体•密度:2.54 g/cm³•熔点:851 °C•沸点:1600 °C3.2 化学性质碳酸钠是一种强碱,可与酸反应生成盐和水。
它也是一种重要的缓冲剂,在调节溶液pH值时起到稳定作用。
4. 碳酸钠基准物质的制备方法碳酸钠基准物质的制备通常分为以下几个步骤:4.1 原料准备选择高纯度的氢氧化钠(NaOH)和二氧化碳(CO2)为原料。
这些原料通常经过多次反复提纯,以确保最终产品的纯度。
4.2 反应制备将适量的氢氧化钠溶解在水中,生成氢氧化钠溶液。
然后通过通入二氧化碳气体来反应生成碳酸钠。
4.3 结晶与干燥将反应得到的碳酸钠溶液进行结晶,得到固体碳酸钠。
随后对固体进行干燥处理,以去除残留的水分和杂质。
4.4 纯化与包装对干燥后的固体进行粉碎和再结晶,以提高其纯度。
最后将纯化后的碳酸钠基准物质按照规定的包装要求进行包装和封存。
5. 碳酸钠基准物质的应用5.1 实验室应用碳酸钠基准物质在实验室中有广泛的应用,主要用于以下方面: - 校准和比对分析仪器,如pH计、电导仪等。
- 作为标准溶液,用于定量分析和质量控制。
- 作为缓冲剂,在调节溶液pH值时使用。
5.2 工业应用碳酸钠基准物质在工业生产中也起到重要作用,具体应用包括: - 玻璃制造:碳酸钠是玻璃制造过程中的重要原料之一,可调节玻璃的成分和性质。
工业中碳酸钠含量的测定ppt正式完整版

采用双指示剂,第一步加入酚酞指示剂,逐滴 加入标准盐酸溶液,待溶液至近乎无色(极浅 的粉红色)时,达到第一个滴定终点,此时测 定的是中和其中的Na2CO3至NaHCO3,之后 加入甲基橙指示剂,滴定至橙色时,达到第二 个滴定终点,此时为将全部NaHCO3(原始的 NaHCO3与Na2CO3转化来的NaHCO3)滴定 至H2CO3。
2、电位滴定法方法原理:
死停终点法,设定两个终点,连续滴定。酚酞 的变色点时的pH值为8.2~10.0,故将滴定氢 氧化钠时终点的pH值设为8.4。溴甲酚绿-甲基 混合指示剂变色点时的pH值为5.1,故将滴 定氢氧化钠和碳酸钠总和时终点的pH值设为 5.1。
3、试剂
电位滴定法
1、化学滴定法的方法: 2克左右,置于250毫升的锥形瓶中,加水50毫升使其溶解,必要时可稍加热促进溶解,冷却后加入1-2滴溴甲酚绿-甲基红,用0. 氯化钡溶液100g/L C= -------------C= -------------2g已于270~300℃灼烧至质量恒重的基准无水Na2CO33份,分别倒入250ml锥形瓶中。 然后将锥形瓶放在电热套上加热至沸1~2min,如果锥形瓶内溶液的颜色由橙色变回为黄色,则需再次补滴HCl至橙色,同时在刚才记 录的数据上补上再加入的HCl数; 盐酸标准滴定溶液:c=1mol/L,配制和标定按GB/T601进行 移液管、盐酸、碳酸钠、溴甲酚绿-甲基红。
时测定的是中和其中的Na2CO3至NaHCO3,之后加入甲基橙指示剂,滴定至橙色时,达到第二个滴定终点,此时为将全部NaHCO3 (原始的NaHCO3与Na2CO3转化来的NaHCO3)滴定至H2CO3。
磁力搅拌机
双指示剂法 1、测定原理:
N H 3+ C O 2+ H 2O + N aC l N aH C O 3 + N H 4C l 2 N aH C O 3 灼 烧 N a2 C O 3 C O 2 + H 2 O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原料
制备原理
制取装置
装置连接
-
4
某同学用下图中的实验装置(其它装置未画 出)实现了碳酸氢钠的制备。思考下列问题:
(12) 指连出接下a、面b装的置分与别a是、什b、么c装连置接?以c后导形管成是的否整需 要套连装接置其的它明装显置缺?陷。
-
5
某同学用下图中的实验装置(其它装置未画 出)实现了碳酸氢钠的制备。思考下列问题:
(3)实验时,须先通入什么气体? (4) 冷却水的作用是什么?
-
6
侯氏制碱的第一步反应原理可以用下面的方程 式表示:
NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
1、设计实验装置模拟工业生产实现这一过程, 获得碳酸氢钠晶体。
-
11
氢氧化钙
氢氧化钠
-
12
原理
原料
制备原理
制取装置
产品分析
制备产品
装置连接
若通过实验测得漂白粉中Ca(ClO)2的质量分 数为35.75%,则该漂白粉的有效氯=35. 50 %
资料卡:有效氯是衡量含氯消毒剂氧化能力的标 志,有效氯数值等于过量HCl和漂白粉作用生成氯 气的质量和漂白粉质量之比。
-
1
侯氏制碱的第一步反应原理可以用下面的方程 式表示:
NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
1、设计实验装置模拟工业生产实现这一过程, 获得碳酸氢钠晶体。
原料
制备原理
制取装置
-
2
装置一
装置二
装置三
装置四
-
3
侯氏制碱的第一步反应原理可以用下面的方程 式表示:
NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
①沉淀法 ②气体法 ③滴定法 ④ ……
-
8
某同学用下图中的装置进行碳酸钠纯度的测 定实验,分析该装置中有哪些不当之处。
-
9
实验模拟化工生产的基本思路:
原理
原料
制备原理
制取装置
产品分析
制备产品
装置连接
-
10
原理
原料
制备原理
制取装置
产品分析
Hale Waihona Puke 制备产品装置连接参考以上流程,设计制取漂白粉的实验装置。
资料卡:工业制漂白粉的过程中,如果温度过 高氯气和氢氧化钙容易生成氯酸钙等杂质。
原料
制备原理
制取装置
产品分析
制备产品
装置连接
-
7
侯氏制碱的第一步反应原理可以用下面的方程 式表示:
NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl 1、请设计实验装置模拟工业生产实现这一过 程,获得碳酸氢钠晶体。
2、将所得碳酸氢钠焙烧后得到的碳酸钠中可能 含有什么杂质,如何检测?
3、请设计实验方案测定上述纯碱的纯度。
-
13
原理
原料
制备原理
制取装置
产品分析
制备产品
装置连接
参考以上流程,设计实验装置模拟二氧化硫 的催化氧化制得三氧化硫晶体。
资料卡:三氧化硫常温下是一种无色油状 液体,具有强刺激性臭味。熔点16.83℃, 沸点(101.3kPa)44.8℃。
-
14
-
15
