第五章同位素地球化学优秀课件
合集下载
中国地质大学-2012春地球化学课件-第5章1

①α衰变:原子核自发地放射出α粒子而发生的
衰变。
ZAM1
M A-4
Z-2 2
例 如:
226 88
Ra
222 86
Rn
24He
②β衰变: 原子核自发地放射出β粒子和中微
子而发生的放射性衰变. 分为β+和-两种类型.
A.β+衰变:原子核自发放射出β+粒子。β+粒
子又称正电子,是质量与电子相等而带正电荷
University Press. ➢ Robin Gill, Chemical Fundamentals of Geology,1996, Chapman &
Hall. ➢ Mason, B., Moore, C.B. Principles of Geochemistry. (4th ed.). 1982,
➢ 郑永飞主编. 1999. 化学地球动力学,北京:科学出版社郑永 飞, 陈江峰(编著). 2000. 稳定同位素地球化学. 北京:科学 出版社.
➢ 于津生,李耀菘(主编), 1997. 中国同位素地球化学研究.北京: 科学出版社.
➢ 陈文寄,彭贵 (主编). 1991, 年轻地质体系的年代测定. 北京: 地震出版社.
应用:地球热源、地质时钟、矿物岩石形成 温度测定、成岩成矿地球化学机理推断、地 壳演化历史示踪以及地质作用指示剂;
同位素地质年代学的定义
地质年代学 (geochronology): 研究岩层形成的 年代顺序及测定其年龄值的学科。地质年代学包 括相对地质年代学和同位素地质年代学两大分支。 相对地质年代学的研究对象:地层、岩石、古生 物和古地磁。 同位素地质年代学(Isotopic geochronology), 又称绝对地质年代学。它是研究同位素地质记时 方法并用以研究各种地质体的形成时间和演化历 史的一门地质科学。
地球化学课件5

元素在地壳中的分布
阐述元素在地壳中的丰度、分布特征及其与地质构造、岩石类型 等因素的关系。
元素在地球各圈层中的迁移
分析元素在大气圈、水圈、生物圈和岩石圈之间的迁移途径和影响 因素。
元素迁移的地球化学过程
探讨元素迁移的主要地球化学过程,如溶解、沉淀、吸附、解吸、 氧化、还原等。
Hale Waihona Puke 元素存在形式及转化机制利用放射性同位素衰变规 律测定地质体年龄。
稳定同位素年代学
利用稳定同位素分馏原理 研究古气候、古环境等。
应用实例
测定岩石、矿物、化石等 地质体年龄,研究地球历 史与演化;分析古气候、 古环境变化,揭示地球环
境演变规律。
同位素示踪技术在环境科学中应用
大气环境示踪
利用同位素技术研究大气污染物的来源、 迁移转化和归宿。
运用色谱法、质谱法等有机分析技术,研 究样品中有机质的组成、结构和地球化学 行为。
数据处理与解释方法
第一季度
第二季度
第三季度
第四季度
数据整理与统计
对实验数据进行整理、 分类和统计,计算元素 的平均值、标准差、变 异系数等统计参数,了 解元素的空间分布和变 化特征。
数据可视化
利用GIS技术、地球化 学图件编制等方法,将 实验数据以图形、图像 等形式展现出来,直观 地反映元素的空间分布 规律和地球化学异常。
实验室分析测试技术
样品前处理
元素含量测定
对采集的样品进行破碎、研磨、过筛等前 处理,以满足不同测试方法的要求。
采用原子吸收光谱法、原子荧光光谱法、 电感耦合等离子体发射光谱法等方法,准 确测定样品中元素的含量。
同位素分析
有机地球化学分析
利用质谱法、中子活化法等手段,测定样 品中同位素的组成和比值,为地球化学示 踪和年代学研究提供重要依据。
第五章4同位素地球化学基础
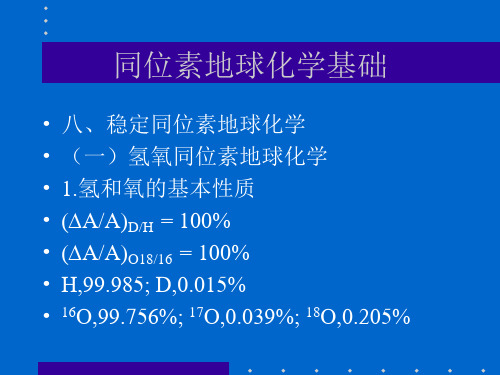
同位素地球化学基础
• • • • • • • 八、稳定同位素地球化学 (一)氢氧同位素地球化学 1.氢和氧的基本性质 (A/A)D/H = 100% (A/A)O18/16 = 100% H,99.985; D,0.015% 16O,99.756%; 17O,0.039%; 18O,0.205%
同位素地球化学基础
(2)岩浆岩 (3)沉积岩:最高的18O和变化范围 (4)变质岩:
同位素地球化学基础
4.研究意义 (1)矿物和矿床的成因 根据矿物及其中的流体包裹体研究
同位素地球化学基础
(2)花岗岩成因 • S型花岗岩:18O %o = 10-12.5 • (Sediment type) • I型花岗岩:18O %o = 7.5-9.5 • (Igneous type) (3)古环境(纬度)的确定
同位素地球化学基础
• • • • • • 2.自然界中氢和氧的分馏作用 (1)蒸发-凝聚分馏 H216Ol + H218OV <=> H218Ol + H216OV 25oC下 a(18O) = (18O/16O) l / (18O/16O)V =1.0029
同位素地球化学基础
• H216Ol + D216OV <=> D216Ol + H216OV • a( D) = (D/H)l /(D/H)V = 1.071 • D 与 18O之间有如下关系: • D = 8 18O + 10
同位素地球化学基础
4.研究意义 (1)矿床物质来源(沉积岩,岩浆岩?) (2)硫同位素地碳同位素地球化学 • 自然界中的碳同位素 • 12C = 98.89% • 13C = 1.11% 1. 碳同位素的分馏反应:
• • • • • • • 八、稳定同位素地球化学 (一)氢氧同位素地球化学 1.氢和氧的基本性质 (A/A)D/H = 100% (A/A)O18/16 = 100% H,99.985; D,0.015% 16O,99.756%; 17O,0.039%; 18O,0.205%
同位素地球化学基础
(2)岩浆岩 (3)沉积岩:最高的18O和变化范围 (4)变质岩:
同位素地球化学基础
4.研究意义 (1)矿物和矿床的成因 根据矿物及其中的流体包裹体研究
同位素地球化学基础
(2)花岗岩成因 • S型花岗岩:18O %o = 10-12.5 • (Sediment type) • I型花岗岩:18O %o = 7.5-9.5 • (Igneous type) (3)古环境(纬度)的确定
同位素地球化学基础
• • • • • • 2.自然界中氢和氧的分馏作用 (1)蒸发-凝聚分馏 H216Ol + H218OV <=> H218Ol + H216OV 25oC下 a(18O) = (18O/16O) l / (18O/16O)V =1.0029
同位素地球化学基础
• H216Ol + D216OV <=> D216Ol + H216OV • a( D) = (D/H)l /(D/H)V = 1.071 • D 与 18O之间有如下关系: • D = 8 18O + 10
同位素地球化学基础
4.研究意义 (1)矿床物质来源(沉积岩,岩浆岩?) (2)硫同位素地碳同位素地球化学 • 自然界中的碳同位素 • 12C = 98.89% • 13C = 1.11% 1. 碳同位素的分馏反应:
第五章同位素地球化学-1-1详解

同位素地球化学在解决地学领域问题的独到之处:
1)计时作用:每一对放射性同位素都是一只时钟, 自地球形成以来它们时时刻刻地,不受干扰地走动着,这 样可以测定各种地质体的年龄,尤其是对隐生宙的前寒武 纪地层及复杂地质体。 2)示踪作用:同位素成分的变化受到作用环境和作 用本身的影响,为此,可利用同位素成分的变异来指示地 质体形成的环境条件、机制,并能示踪物质来源。 3)测温作用:由于某些矿物同位素成分变化与其形 成的温度有关,为此可用来设计各种矿物对的同位素温度 计,来测定成岩成矿温度。 另外亦可用来进行资源勘查、环境监测、地质灾害防 治等。
达到同位素交换平衡时共存相同位素相对丰度比值为一
常数,称分馏系数α。例如:
1/3CaC O3+H2 O≒1/3CaC O3+H2 O
16 18 18 16
(25℃,α=1.0310)
又如:大气圈与水圈之间发生氧同位素交换反应
2H 2 18O16O2 2H 2 16O18O2
(0℃:α=1.074, 25℃:α=1.006)
112,114,115,116,117,118,119,120,122,124Sn
只有一种同位素的元素:Be、F、Na、Al、P等27种。
其余大多数由2-5种同位素组成。
(二) 同位素分类
放射性同位素:
其核能自发地衰变为其它核的同位素,称放射性同位素; 原子序数大于83,质量数>209 稳定同位素: 原子存在的时间大于1017年; 原子序数<83,质量数A<209的同位素大部分是稳定的
稳定同位素又分重稳定同位素和轻稳定同位素。
轻稳定同位素: 原子序数Z<20(原子量小),同一种元素的各同位素 间的相对质量差异较大ΔA/A≥10% ;
1)计时作用:每一对放射性同位素都是一只时钟, 自地球形成以来它们时时刻刻地,不受干扰地走动着,这 样可以测定各种地质体的年龄,尤其是对隐生宙的前寒武 纪地层及复杂地质体。 2)示踪作用:同位素成分的变化受到作用环境和作 用本身的影响,为此,可利用同位素成分的变异来指示地 质体形成的环境条件、机制,并能示踪物质来源。 3)测温作用:由于某些矿物同位素成分变化与其形 成的温度有关,为此可用来设计各种矿物对的同位素温度 计,来测定成岩成矿温度。 另外亦可用来进行资源勘查、环境监测、地质灾害防 治等。
达到同位素交换平衡时共存相同位素相对丰度比值为一
常数,称分馏系数α。例如:
1/3CaC O3+H2 O≒1/3CaC O3+H2 O
16 18 18 16
(25℃,α=1.0310)
又如:大气圈与水圈之间发生氧同位素交换反应
2H 2 18O16O2 2H 2 16O18O2
(0℃:α=1.074, 25℃:α=1.006)
112,114,115,116,117,118,119,120,122,124Sn
只有一种同位素的元素:Be、F、Na、Al、P等27种。
其余大多数由2-5种同位素组成。
(二) 同位素分类
放射性同位素:
其核能自发地衰变为其它核的同位素,称放射性同位素; 原子序数大于83,质量数>209 稳定同位素: 原子存在的时间大于1017年; 原子序数<83,质量数A<209的同位素大部分是稳定的
稳定同位素又分重稳定同位素和轻稳定同位素。
轻稳定同位素: 原子序数Z<20(原子量小),同一种元素的各同位素 间的相对质量差异较大ΔA/A≥10% ;
第五章2同位素地球化学基础

根据 地壳中平均(87Sr/ 86Sr)o =0.712 地幔中平均(87Sr/ 86Sr)o =0.699 由下式可得模式年龄:
t = 1/ ln {[(87Sr/ 86Sr) - (87Sr/ 86Sr)o]/ (87Rb/ 86Sr)+1}
同位素地球化学基础
• 普通铅法的样品要求: • 无U和Th的矿物,如方铅矿、黄铁矿等
同位素地球化学基础
• 4.U-Pb谐和曲线法
• •
=e1t -1 207Pb*/235U =e2t -1
206Pb*/238U
同位素地球化学基础
5.铅同位素的演化 原始铅:地球形成时的初始铅 放射铅:地球形成后放射性母体产物
同位素地球化学基础
2. U-Th-Pb法年龄测定 根据基本公式:D* = N(et - 1)
(206Pb/204Pb) =(206Pb/204Pb)o + (238U/ 204Pb)(et - 1) (207Pb/204Pb) =(207Pb/204Pb)o + (235U/ 204Pb)(et - 1) (208Pb/204Pb) =(208Pb/204Pb)o + (232Th/ 204Pb)(et - 1)
• 地球铅同位素的相对丰度变化是体系中 放射性母体衰变的结果。 • 铅矿物形成后,铅同位素与放射性母体 分离。
同位素地球化学基础
• T=45.5亿年 t 0亿年 • 时间 1————————1——————1 • 事件 1————————1——————1 • 地球形成 矿物形成 测定
同位素地球化学基础
同位素地球化学基础
二、铷-锶法年龄测定和锶同位素地球化学 1.Rb-Sr衰变体系 (1)Rb和Sr的同位素 Rb: 85Rb (72.15%) 87Rb (27.85%)
5-同位素地球化学

A Z
M e
A Z 1
M
40 19
K e Ar
40 18
④重核裂变:重同位素自发地分裂为2-3片原子量大致 相同的碎片,各以高速度向不同方向飞散(裂变径迹 的定年原理)。
河南理工大学-机械与动力学院
14 14
放射同位素地球化学
1902年Rutherford(卢瑟福)通过实验发现放射性同位素
稳定同位素不自发地衰变形成其它同位或由于衰变 期长,其同位素丰度变化可忽略不计,对于稳定同位素 丰度的变异或分镏除了示踪地质过程外,还可指示地质 过程中的物理化学条件等。
河南理工大学-机械与动力学院
5 5
同位素的基本知识
同 位 素
稳定同位素
原生放射性同位素: 238U等 人造放射性同位素:137Cs 等 宇宙成因放射性同位素:14C等
河南理工大学-机械与动力学院 25 25
放射同位素地球化学
河南理工大学-机械与动力学院
26 26
放射同位素地球化学
如何选择同位素定年的方法
(1)应当选用适当的放射性同位素体系的半衰期,这样 才能积累起显著数量的子核,同时保留有未衰变的 母核。 (2)测定对象处于封闭体系中,母体和子体核素只因衰 变反应而改变,不存在它们的丢失和从外部体系的 带入。目前在地球科学研究中对新生代前的事件广 泛应用的年代学方法有U-Th-Pb法,Rb-Sr法,SmNd法,K-Ar法等,第四纪研究的年代学方法主要为 14C法。
放射性衰变过程中及最终形成的稳定同位素称为放射 成因同位素,或子体同位素。
河南理工大学-机械与动力学院 10 10
放射同位素地球化学
放射性同 位素
放射性成 因同位素
87Sr
M e
A Z 1
M
40 19
K e Ar
40 18
④重核裂变:重同位素自发地分裂为2-3片原子量大致 相同的碎片,各以高速度向不同方向飞散(裂变径迹 的定年原理)。
河南理工大学-机械与动力学院
14 14
放射同位素地球化学
1902年Rutherford(卢瑟福)通过实验发现放射性同位素
稳定同位素不自发地衰变形成其它同位或由于衰变 期长,其同位素丰度变化可忽略不计,对于稳定同位素 丰度的变异或分镏除了示踪地质过程外,还可指示地质 过程中的物理化学条件等。
河南理工大学-机械与动力学院
5 5
同位素的基本知识
同 位 素
稳定同位素
原生放射性同位素: 238U等 人造放射性同位素:137Cs 等 宇宙成因放射性同位素:14C等
河南理工大学-机械与动力学院 25 25
放射同位素地球化学
河南理工大学-机械与动力学院
26 26
放射同位素地球化学
如何选择同位素定年的方法
(1)应当选用适当的放射性同位素体系的半衰期,这样 才能积累起显著数量的子核,同时保留有未衰变的 母核。 (2)测定对象处于封闭体系中,母体和子体核素只因衰 变反应而改变,不存在它们的丢失和从外部体系的 带入。目前在地球科学研究中对新生代前的事件广 泛应用的年代学方法有U-Th-Pb法,Rb-Sr法,SmNd法,K-Ar法等,第四纪研究的年代学方法主要为 14C法。
放射性衰变过程中及最终形成的稳定同位素称为放射 成因同位素,或子体同位素。
河南理工大学-机械与动力学院 10 10
放射同位素地球化学
放射性同 位素
放射性成 因同位素
87Sr
同位素地球化学PPT课件

32
1)轻稳定同位素
A. 原子量小,同一元素的各同位素间
的相对质量差异较大(ΔA/A≧5%);
B. 轻同位素组成变化的主要原因是同
位素分馏作用造成的,其反应是可逆的。
2019/7/3
第五章 同位素地球化学Ⅰ
33
2)重稳定同位素
A. 原子量大,同一元素的各同位素间的相
对质量差异小(ΔA/A=0.7~1.2%),环境 的物理和化学条件的变化通常不导致重稳 定同位素组成的改变;
526262621放射性同位素衰变定律及同位素地质年代学原理622kar法及40ar39ar法年龄测定623rbsr法年龄测定624smnd法年龄测定625upb法年龄测定53621621同位素地质年代学的基本原理前提及分类541放射性原子释放出粒子和能量的现象即所谓的放2放射性衰变元素的原子核自发地发出粒子和释放能量而变成另一种原子核的过程
2019/7/3
第五章 同位素地球化学Ⅰ
11
5. 同位素地球化学发展现状
同位素地球化学发展迅速,已渗透到地 球科学的各个研究领域,如:大地构造 学、岩石学、矿床学、海洋学、环境科 学、空间科学等。
主要表现在以下方面:
♣ 实验测试技术不断完善和提高; ♣ 多元同位素体系的综合研究; ♣ 研究领域不断扩大; ♣ 各种新方法的出现 。
28
② 类型
1)放射性同位素(unstable or radioactive isotope)
其原子核是不稳定的,它们能自发地放出粒子并衰变成 另一种同位素。
2)稳定同位素(stable isotope)
原子核是稳定的,或者其原子核的变化不能被觉察。 元素周期表中,原子序数相同,原子质量不同,化学性
几种年代学方法介绍——同位素地球化学课件PPT

• 近年来迅速发展起来的多接收器双耦合等离子体质 谱仪(MC-ICP-MS)综合了等离子体的高电离温度和 磁式多接收器质量分析器的优势,使得一些高电离 能元素的高精度同位素分析成为现实。
Lu-Hf同位素测年
测试仪器
• 在Re-Os 年代学研究的早期,二次离子质谱、共 振离子质谱、加速器质谱、电感耦合等离子体质谱 (ICP-MS)都曾用于Re-Os 同位素的测定研究
• 近些年来,随着质谱技术及分析方法的发展,负离 子热表面电离质谱(NTIMS)已逐渐成为Re-Os年 代学研究尤其是Os 同位素比值测定的主要工具
几种年代学方法介绍
Re-Os法,Sm-Nd法, Lu - Hf法
Re-Os法
铼与锇
• Re,分散元素,不形成独立矿物,与Mo地 球化学相似性
• 地幔部分熔融时,中等不相容元素Re趋于进 入岩浆,而相容元素Os则趋于保留在地幔中。 因此,富集不相容元素的流体对地幔岩石的 交代作用通常难以对地幔岩石中Os的同位 素组成造成明显的影响。居于此原因,该体 系已被广泛地用于研究大陆岩石圈地幔的形 成和演化
天然同位素
• Re有两种天然同位素
– 185 -37.398%, – 187 -62.602%
• Os有七种天然同位素
– 184-0.02%, – 186-1.6%, – 187-1.6%, – 188-13.3%, – 189-16.1%, – 190-26.4%, – 192-41%
年龄公式
Re-Os法定年问题讨论
• 有些金属矿床辉钼矿的Re-Os 年龄高于其赋矿围 岩,原因不清;
• 黄铁矿等多数硫化物含Re-Os 量明显偏低,并含 有普通Os ,对样品化学制备过程中低本底的要求 很高,一般实验室难以达到,普通Os 也难以准确 扣除;
Lu-Hf同位素测年
测试仪器
• 在Re-Os 年代学研究的早期,二次离子质谱、共 振离子质谱、加速器质谱、电感耦合等离子体质谱 (ICP-MS)都曾用于Re-Os 同位素的测定研究
• 近些年来,随着质谱技术及分析方法的发展,负离 子热表面电离质谱(NTIMS)已逐渐成为Re-Os年 代学研究尤其是Os 同位素比值测定的主要工具
几种年代学方法介绍
Re-Os法,Sm-Nd法, Lu - Hf法
Re-Os法
铼与锇
• Re,分散元素,不形成独立矿物,与Mo地 球化学相似性
• 地幔部分熔融时,中等不相容元素Re趋于进 入岩浆,而相容元素Os则趋于保留在地幔中。 因此,富集不相容元素的流体对地幔岩石的 交代作用通常难以对地幔岩石中Os的同位 素组成造成明显的影响。居于此原因,该体 系已被广泛地用于研究大陆岩石圈地幔的形 成和演化
天然同位素
• Re有两种天然同位素
– 185 -37.398%, – 187 -62.602%
• Os有七种天然同位素
– 184-0.02%, – 186-1.6%, – 187-1.6%, – 188-13.3%, – 189-16.1%, – 190-26.4%, – 192-41%
年龄公式
Re-Os法定年问题讨论
• 有些金属矿床辉钼矿的Re-Os 年龄高于其赋矿围 岩,原因不清;
• 黄铁矿等多数硫化物含Re-Os 量明显偏低,并含 有普通Os ,对样品化学制备过程中低本底的要求 很高,一般实验室难以达到,普通Os 也难以准确 扣除;
同位素水文地球化学优秀课件

① 大气层的休止层渗漏效应: 大气层上部(休止层)的氚通过气团交换向对
流层迁移(渗漏),这种交换主要是在中纬度高压 带休止层不连续区域内,其交换强度随季节而异, 每年的晚冬和春季期内达到最大值;
② 氚自身的衰变和与贫氚的海洋表面水分子 交换,导致大气氚浓度的降低;
③ 大气层人工核试验导致大气氚浓度的急剧
3. 放射性衰变定律:
(1) 放射性母体同位素的衰变公式: 放射性母体的衰变速率(dN/dt)与现有母体
数目(N)成正比。写成: 写成:dN/dt∞N dN/dt=-λN ∫dN/ N=-λ∫dt ㏑N=-λt+K 当t=0时,K=㏑N0 ㏑N-㏑N0=-λt N= N0e-λt 或N0= N eλt 意义:放射性母体同位素随着时间的增长呈
1. 氚法:
(1) 氚的起源:大气层上部—宇宙射线的 快中子(超过400万电子伏特)与稳定的14N 的核反应:
14N+n→3H(T)+12C
3H(T)与大气中的氧原子化合成HTO,以大气 降水或水汽的形式参与水循环。
(2) 地下水氚的定年:
①在一定条件下,地下水流中任意一点 的 滞留氚时(间T)(t)含有量关与,氚其的关输系式入为量:(T0)和水的
④ 水圈和部分含碳酸盐的沉积物的14C主要来 自大气CO2的溶解和同位素交换作用,构成了大气 圈、生物圈、水圈以及岩石圈中部分碳酸盐的天然 14C的循环。
⑤ 各水体中的含14C的物质从交换储存库转入 非交换储存库后,就赋予了定年的意义:即14C经β -衰减成稳定的14N:
146C→147N+β-+γ+Q
(2)放射性衰变:放射性元素在产生放 射性辐射和放出能量时,原子核也发生了变 化,一种元素的原子转变为另一种元素的原 子,这一过程成为放射性衰变。
流层迁移(渗漏),这种交换主要是在中纬度高压 带休止层不连续区域内,其交换强度随季节而异, 每年的晚冬和春季期内达到最大值;
② 氚自身的衰变和与贫氚的海洋表面水分子 交换,导致大气氚浓度的降低;
③ 大气层人工核试验导致大气氚浓度的急剧
3. 放射性衰变定律:
(1) 放射性母体同位素的衰变公式: 放射性母体的衰变速率(dN/dt)与现有母体
数目(N)成正比。写成: 写成:dN/dt∞N dN/dt=-λN ∫dN/ N=-λ∫dt ㏑N=-λt+K 当t=0时,K=㏑N0 ㏑N-㏑N0=-λt N= N0e-λt 或N0= N eλt 意义:放射性母体同位素随着时间的增长呈
1. 氚法:
(1) 氚的起源:大气层上部—宇宙射线的 快中子(超过400万电子伏特)与稳定的14N 的核反应:
14N+n→3H(T)+12C
3H(T)与大气中的氧原子化合成HTO,以大气 降水或水汽的形式参与水循环。
(2) 地下水氚的定年:
①在一定条件下,地下水流中任意一点 的 滞留氚时(间T)(t)含有量关与,氚其的关输系式入为量:(T0)和水的
④ 水圈和部分含碳酸盐的沉积物的14C主要来 自大气CO2的溶解和同位素交换作用,构成了大气 圈、生物圈、水圈以及岩石圈中部分碳酸盐的天然 14C的循环。
⑤ 各水体中的含14C的物质从交换储存库转入 非交换储存库后,就赋予了定年的意义:即14C经β -衰减成稳定的14N:
146C→147N+β-+γ+Q
(2)放射性衰变:放射性元素在产生放 射性辐射和放出能量时,原子核也发生了变 化,一种元素的原子转变为另一种元素的原 子,这一过程成为放射性衰变。
最新5第五章1同位素地球化学基础

同位素地球化学基础
• 电子捕获
原子自发地从K或L层电子轨道吸取一个电 子形成中子,通式为:
AZM
+
e
-
=>
A Z
-1M
,例如:
4019K + e - => 4018Ar
13857La + e - => 13856Ba
同位素地球化学基础
• 衰变
重核通过放出质点(He核),通式为:
AZM
=>
A-4 Z
同位素地球化学基础
H, O, C, S 同位素国际标准
同位素比值 缩写符号 标准样品
2D/1H
SMOW 标准平均大洋水
18O/16O
SMOW 标准平均大洋水
18O/16O 13C/12C
PDB PDB
美国南卡罗林纳州白垩系 皮狄组的美洲似箭石
34S/32S
CD
美国亚历桑那州卡扬迪阿
布洛铁陨石中的陨硫铁
• 温度:温度越高,分馏作用越小。 • 平衡程度:
同位素地球化学基础
各同位素的质量差
同位素 2D-1H 13C-12C A/A 100% 8.3%
18O-16 34S-32S O 12.5% 6.25%
同位素 87Sr-86Sr 144Nd-143Nd
A/A 1.2% 0.7%
同位素地球化学基础
同位素地球化学基础
• 质谱仪测定 见下图
同位素地球化学基础
思考题: • 自然界中放射性同位素组成变异的原因? • 自然界中非放射性同位素组成变异的原
因?
5第五章1同位素地球化学 基础
同位素地球化学基础
• 地质体的年龄 • 板块构造 • 地球的年龄 • 太阳系各天体的年龄 • 物质来源 • 地球、地壳和地幔演化
Rb-Sr——同位素地球化学课件PPT

• 利用等时线既可求出年龄,又可以得到锶初始值
• 数据点拟合程度的好坏,也是检验所有样品是否一 直保持封闭的一个尺度
0.710 0.708
t>0
87Sr/86Sr
0.706
t=0
0.0
0.5
1.0
1.5
2.0
2.5
3.0
87Rb/86Sr
同源岩浆岩石Rb-Sr同位素演化和等时线图
等时线 的拟合
• 最常用的是双误差最小二乘回归法进行拟合。
• 实际观测也表明,矿物中的Rb—Sr衰变图确 实受到影响 。
基本假设
• 假设在区域变质或接触变质过程中, 87Sr的变 化仅仅是由于放射性同位素87Rb的衰变导致的, 而矿物中铷和锶的浓度基本上保持不变
• 如果在热变质过程中,矿物发生了同位素均匀 化,一般手标本大小的全岩样品都保持着封闭 体系,则可以计算矿物等时年龄(内等时线), 代表变质年龄,而全岩年龄代表成岩年龄
未受变质的沉积岩的年龄测定
• 沉积岩中的含铷矿物,既可以是自生的,也 可以是它地生成的和碎屑的
• 自生的有海绿石、钾盐、光卤石等 • 海绿石较好,可以反映沉积年龄 • 蒸发岩矿物不够稳定,所测年龄不可靠
小结
• 铷和锶是分散元素,它们在火成岩、沉积岩和 变质岩中的浓度从小于几ppm到大于几百ppm。
挑选单矿物时,除了含钾矿物以外,通常还 会挑选一种富钙贫钾矿物,如磷灰石、榍石 等。它投点基本落在纵轴上。
变质岩的年龄测定
变质岩的年龄测定
• 变质作用可以是热变质,也可以有流体的参 与,结果使岩石的总体化学组成和微量元素 成分都可能发生变化。
• 可以预料,变质作用对岩石中存在的天然放 射性元素的母体和子体的关系将产生深刻影 响。
• 数据点拟合程度的好坏,也是检验所有样品是否一 直保持封闭的一个尺度
0.710 0.708
t>0
87Sr/86Sr
0.706
t=0
0.0
0.5
1.0
1.5
2.0
2.5
3.0
87Rb/86Sr
同源岩浆岩石Rb-Sr同位素演化和等时线图
等时线 的拟合
• 最常用的是双误差最小二乘回归法进行拟合。
• 实际观测也表明,矿物中的Rb—Sr衰变图确 实受到影响 。
基本假设
• 假设在区域变质或接触变质过程中, 87Sr的变 化仅仅是由于放射性同位素87Rb的衰变导致的, 而矿物中铷和锶的浓度基本上保持不变
• 如果在热变质过程中,矿物发生了同位素均匀 化,一般手标本大小的全岩样品都保持着封闭 体系,则可以计算矿物等时年龄(内等时线), 代表变质年龄,而全岩年龄代表成岩年龄
未受变质的沉积岩的年龄测定
• 沉积岩中的含铷矿物,既可以是自生的,也 可以是它地生成的和碎屑的
• 自生的有海绿石、钾盐、光卤石等 • 海绿石较好,可以反映沉积年龄 • 蒸发岩矿物不够稳定,所测年龄不可靠
小结
• 铷和锶是分散元素,它们在火成岩、沉积岩和 变质岩中的浓度从小于几ppm到大于几百ppm。
挑选单矿物时,除了含钾矿物以外,通常还 会挑选一种富钙贫钾矿物,如磷灰石、榍石 等。它投点基本落在纵轴上。
变质岩的年龄测定
变质岩的年龄测定
• 变质作用可以是热变质,也可以有流体的参 与,结果使岩石的总体化学组成和微量元素 成分都可能发生变化。
• 可以预料,变质作用对岩石中存在的天然放 射性元素的母体和子体的关系将产生深刻影 响。
同位素地球化学5(2024版)

水~岩交换反应中氢同位素成分变化不大。
3、矿物晶格的化学键对氧同位素的选择
最富: Si—O—Si 键矿物18O;
其次: Si—O—Al ,Si—O—Mg, Si—O—Fe;
最贫: 含(OH) 的矿物 18O .
4、生物同位素分馏
➢植物光合作用的结果使18O在植物体中
富集,放出O2富含16O:
❖2H216O+C18O2 → 2(HC18OH)n+16O2 ➢光合作用的实质是水的去氢作用,植物将水
斑岩铜钼矿床钾化带蚀变以岩浆水作用为 主导,而围岩中青盘岩化蚀变当地围岩中 的大气降水起到了重要的作用;
斑岩矿床成矿蚀变流体是多源的。
作业
δD/‰
○老湾矿床
0
◆凉亭矿床
△黄竹园矿点
①演化大气降水②
演化岩浆水
-40
大气降水线
200℃
0.001
海水
(W/R比值) 250℃
① 0.01
300℃
①
350
➢大洋及赤道地区出现重水(δ18O、δD趋向
更大正值)。
➢这就是“氢氧同位素的纬度效应”
蒸 发
-
凝
聚
δD=8 δ 18O +10
分
馏
2、水-岩同位素平衡
➢ 1/2Si16O2+H218O→1/2Si18O2+H216O
(25℃,α=1.0492) 其结果是岩石中富集了18O,水中富集了16O。 由于大部分岩石中氢的含量很低,因此,在
➢ H234S+32SO42-→ H232S+34SO42- (α=1.075)
➢分馏系数与温度呈反相关
②生物动力分馏
➢生物成因硫化物的δ 34S (‰)一般
3、矿物晶格的化学键对氧同位素的选择
最富: Si—O—Si 键矿物18O;
其次: Si—O—Al ,Si—O—Mg, Si—O—Fe;
最贫: 含(OH) 的矿物 18O .
4、生物同位素分馏
➢植物光合作用的结果使18O在植物体中
富集,放出O2富含16O:
❖2H216O+C18O2 → 2(HC18OH)n+16O2 ➢光合作用的实质是水的去氢作用,植物将水
斑岩铜钼矿床钾化带蚀变以岩浆水作用为 主导,而围岩中青盘岩化蚀变当地围岩中 的大气降水起到了重要的作用;
斑岩矿床成矿蚀变流体是多源的。
作业
δD/‰
○老湾矿床
0
◆凉亭矿床
△黄竹园矿点
①演化大气降水②
演化岩浆水
-40
大气降水线
200℃
0.001
海水
(W/R比值) 250℃
① 0.01
300℃
①
350
➢大洋及赤道地区出现重水(δ18O、δD趋向
更大正值)。
➢这就是“氢氧同位素的纬度效应”
蒸 发
-
凝
聚
δD=8 δ 18O +10
分
馏
2、水-岩同位素平衡
➢ 1/2Si16O2+H218O→1/2Si18O2+H216O
(25℃,α=1.0492) 其结果是岩石中富集了18O,水中富集了16O。 由于大部分岩石中氢的含量很低,因此,在
➢ H234S+32SO42-→ H232S+34SO42- (α=1.075)
➢分馏系数与温度呈反相关
②生物动力分馏
➢生物成因硫化物的δ 34S (‰)一般
同位素地球化学第五章 同位素地球化学

放射性衰变
自然界中部分核素在能量上处于不稳定状 态,自发地从某一核素衰变成为另一核素, 并伴随各种粒子形式的能量释放的过程称为 放射性衰变。
发生放射性衰变的同位素称放射性同位素, 或母体同位素(radioactive parent nucleus )。
放射性衰变过程中及最终形成的稳定同位 素称为放射成因同位素或子体同位素 (radiogenic daughter nuclei) 。
放射性同位素丰度的变异记载着地质作用 的时间,同时它们又是地质过程有效的示踪剂, 而对于稳定同位素丰度的变异或分镏除了示踪 地质过程外,还可指示地质过程中的物理化学 条件等。
同位素地球化学在研究地球或宇宙体的成 因与演化,主要包括地质时钟、地球热源、壳 幔相互作用及壳幔演化、成岩成矿作用、构造 作用及古气候和古环境记录等方面提供了重要 有价值的信息,为地球科学从定性到定量的发 展作出了重要贡献。
t1/2=0.693/
•母体(N)和子体同位素(D)存在如下关系: N0=N+D
D N
D N (et 1)
Evolution of daughter isotopes
No/ So
*
Daughter D/S
Concentration ratios
Parent N/S
0 0
t 1/2
2 3 time
变质砾岩中花岗岩质砾石中的锆石年龄,其地 质含义是花岗岩的形成年龄,应该早于砾岩的地 层年龄。
谐和线年龄,上交点年龄为 2573±52Ma。 表面加权年龄,2580Ma。 谐和线年龄和表面加权年龄结果很相近,结果 是可信的。 综合来说:花岗岩的形成时代为2573±52Ma是 可信的。砾岩的地层年龄应晚于2573Ma。根据目 前的年龄结果,不支持砾岩比郭家窑组老的认识。
第五章 同位素地球化学-有机化学
So, one atom 12C = 12.000000 amu
1 atomic mass unit (amu) = 1/12 the mass of 12C
And, one mole of 12C = 12.000000 g, one mole = 6.022 e23 atoms
元素的原子量计算
Chen J H & Wasserburg GJ (1981) . The isotopic composition of uranium and lead in Allende inclusions and meteoritic phosphates. Earth Planet. Sci. Lett., 52, 1-15.
元素原子量的计算方法:
W M i Abi
i 1
n
M i : i同位素的质量 Abi : i同位素的丰度
例:氧的原子量计算: WO=M18OAb18O + M17OAb17O + M16OAb16O =17.9991600.205%+ 16.999132 0.038%+15.994915 99.757% =15.99941
-1907 – Boltwood calculates age of ~500Ma from U/Pb ratios in U minerals. 根据含U矿物中的U/Pb比值, Boltwood(美)计算其形成 年龄为~500Ma。
-1912 – Bohr introduces new model hydrogen atom, Planck‘s constant. Bohr(丹麦)引入了新的理想H原子模型和Planck常数(描述 量子的大小)。 -1913 – Holmes uses range of evidence (& U/Pb ratios) to argue for 1.3Ga age of Earth. 根据一系列证据和U/Pb比值,Holmes(英) 提出地球的年龄为13亿年。
1 atomic mass unit (amu) = 1/12 the mass of 12C
And, one mole of 12C = 12.000000 g, one mole = 6.022 e23 atoms
元素的原子量计算
Chen J H & Wasserburg GJ (1981) . The isotopic composition of uranium and lead in Allende inclusions and meteoritic phosphates. Earth Planet. Sci. Lett., 52, 1-15.
元素原子量的计算方法:
W M i Abi
i 1
n
M i : i同位素的质量 Abi : i同位素的丰度
例:氧的原子量计算: WO=M18OAb18O + M17OAb17O + M16OAb16O =17.9991600.205%+ 16.999132 0.038%+15.994915 99.757% =15.99941
-1907 – Boltwood calculates age of ~500Ma from U/Pb ratios in U minerals. 根据含U矿物中的U/Pb比值, Boltwood(美)计算其形成 年龄为~500Ma。
-1912 – Bohr introduces new model hydrogen atom, Planck‘s constant. Bohr(丹麦)引入了新的理想H原子模型和Planck常数(描述 量子的大小)。 -1913 – Holmes uses range of evidence (& U/Pb ratios) to argue for 1.3Ga age of Earth. 根据一系列证据和U/Pb比值,Holmes(英) 提出地球的年龄为13亿年。
13第五章同位素地球化学3

t
注意:
• Nd模式年龄计算取决于壳幔演化模式; • 计算前提假设:各种地壳过程中Sm-Nd 同位素体系保持封闭。
壳源岩石Nd同位素模式年龄(TDM)
7.Nd-Sr同位素地球化学示踪
用到的参数: εNd(0)—代表现今的样品对球粒陨石偏差 εNd(t)—代表t时样品与球粒陨石偏差 εNd(t)>0,表明物质来自亏损地幔; εNd(t)<0表示来自地壳或富集型地幔; εNd(t)=0表明物质来自球粒陨石型未分异地幔。 εSr(0) εSr(t)
•叠代法可求得或查表获得t
4 使用条件和适用矿物
• ①条件:与其它同位素体系相同。 • ②适用矿物: • U和Th矿物或含U和Th的矿物,如沥青 铀矿,晶质铀矿,钍矿,锆石,榍石和 磷灰石等。这些矿物富含U、Th,对其 及其子体保存较好,同时分布普遍。
• 初始铅和铅丢失问题 • Pb丢失导致四个年龄方程式所得的年龄,一般是 t207/206> t207 >t206 >t208。 • 为了减少初始铅选择带来的误差,以及铅丢失带来的 误差,采用U-Pb谐和线法来避免这些误差。
εNd(t) 的示踪意义:
εNd(t) > 0, 物质来自亏损地幔; εNd(t) < 0, 物质来自于地壳; εNd(t) ≈0, 物质来自于未分异的原始地幔。
在Nd同位素示踪应用中,常结合Sr同位素的研究,构筑εNd(t)-(87Sr/86Sr)t图解。
物 质 来 源 为 壳 幔 混 合
Nd 同位素地球化学示踪主要基于Nd同位素初始比值(143Nd/144Nd)0,该 比值通过等时线法获得,对于一个已知年龄的样品,通过实测该样品的 143Nd/144Nd和147Sm/144Nd比值,就能计算该样品的 (143Nd/144Nd) 比值,公式 0 如下: (143Nd/144Nd)0=143Nd/144Nd -147Sm/144Nd(eλt-1) 由于在整个地质时期,143Nd/144Nd比值变化较小,所以一般用εNd表示, 其定义如下: εNd(0)=[( 143Nd/144Nd) S/(143Nd/144Nd )CHUR-1]×104 式中εNd(0)代表样品现今的(143Nd/144Nd)S比值相对于CHUR现今的 (143Nd/144Nd )CHUR比值的偏差值。 εNd(t)=[( 143Nd/144Nd)S(t)/(143Nd/144Nd )CHUR(t)-1]×104 式中代表样品时间为t时的(143Nd/144Nd)S(t)比值相对于CHUR在时间为t时 的(143Nd/144Nd)CHUR(t)比值的偏差值。其中: (143Nd/144Nd)S(t)=(143Nd/144Nd)S-(147Sm/144Nd)S(eλt-1) (143Nd/144Nd)CHUR(t)=(143Nd/144Nd)CHUR-(147Sm/144Nd)CHUR(eλt-1)
相关主题
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
α=(18O/16O)CO32-/(18O/16O)H2O 当α>1,反应向右进行;当α<1,反应向左进行;α=1, 无同位素分馏。
例如样品中34S/32S相对于标准样品的富集程度,
即以 δ34S‰ 来表示: δ34S‰=[((34S/32S)样/(34S/32S)标)-1] ×1000
习惯上把微量(较小相对丰度)同位素放在R的分子上, 这样可以从样品的δ值,直接看出它含微量同位素比标准样 品是富集了,还是贫化了。
δ>0表示34S比标准样品是富集了; δ<0表示34S比标准样品是贫化了。
稳定同位素: 原子存在的时间大于1017年; 原子序数<83,质量数A<209的同位素大部分是稳定的 稳定同位素又分重稳定同位素和轻稳定同位素。
轻稳定同位素: 原子序数Z<20(原子量小),同一种元素的各同位素 间的相对质量差异较大ΔA/A≥10% ; 同位素成分变化的主要原因是同位素分馏,其反应是可 逆的。
➢ 具有相同质子数的核素构成元素。一种元素的核数可以
有不同数量的中子,称为同位素。它们在元素周期表上占 据同一位置。
➢ 任何一个核素都可以用质量数A=P(质子数)+N(中子
数)这三个参数来表示。
2、核素的性质
(1)核素具有电荷 (2)核素具有质量 (3)核素具有丰度 (绝对丰度/相对丰度) (4)核素具有能量 (5)核素具有放射性
2、同位素丰度的表示方法
1)同位素丰度的表示方法
R值——重同位素和轻同位素之比 如大气中的16O/18O比值: R=16O/18O=99.763/0.1995=500.065, 或 R=18O /16O=2.0×10-3。
δ值——若取某一给定样品的R值为标准,则地质样品中R值 与标准的绝对变差以δ表示: δ(‰)= (R样-R标) /R标×1000‰= (R样/R标-1)×1000‰ .
(0℃:α=1.074, 25℃:α=1.006)
④生物化学反应:动植物及微生物在生存过程中经常与介质 交换物质、并通过生物化学过程引起同位素分馏。
例如:植物通过光合作用,使12C更多地富集在有机体中, 因此生物成因地质体如煤、油、气等具有高的12C/13C值。 生物化学分馏是同位素分异作用中重要的控制反应。
于重同位素分子,因此,在共存平衡相之间产生微小的分馏
,反应产物,特别是活动相中更富集轻同位素。
例如:C+16O2→C16O2
平衡常数K1
C+16O18O→C16O18O
平衡常数K2
K1/K2=1.17
③平衡分馏(同位素交换反应):在化学反应中反应物和生成
物之间由于物态、相态、价态以及化学键性质的变化,使轻重
➢ 112,114,115,116,117,118,119,120,122,124Sn ➢ 只有一种同位素的元素:Be、F、Na、Al、P等27种。 ➢ 其余大多数由2-5种同位素组成。
(二) 同位素分类
放射性同位素: 其核能自发地衰变为其它核的同位素,称放射性同位素; 原子序数大于83,质量数>209
概念:在地质作用中由于质量差所引起的轻同位素(Z<20) 相对丰度的变异,称为同位素分馏作用。 引起分馏效应的原因:
① 物理分馏:也称质量分馏, 同位素之间因质量差异而引 起的与质量有关的性质的不同,(如密度、比重、熔点、沸 点等微小的差别),在蒸发、凝聚、升华、扩散等自然物理 过程中,使得轻、重同位素分异。
水和重水的物理性质
分 子
H216O
分子 量
18.015
密度 20℃g/cm
3
0.9979
最大密度 时温度℃
3.98
熔点
℃
0.00
沸点℃ 100.00
蒸气压
100℃,Pa
101325
D216O 20.028 1.1051
11.24
3.813 101.42 96.208
H218O
-
1.1106 4.30
0.28 100.14
-
蒸发作用强烈的死海(约旦、巴勒斯坦国之间)咸水中 D218O含量最高。单向多次反复的物理过程,同位素分馏效 应最明显。
② 动力分馏:其实质是质量不同的同位素分子具有不同的
分子振动频率和化学健强度,因轻同位素形成的键比重同位
素更易破裂,这样在化学反应中轻同位素分子的反应速率高
同位素分别富集在不同分子中而发生分异叫做平衡分馏,也称
同位素交换反应。
达到同位素交换平衡时共存相同位素相对丰度比值为一
常数,称分馏系数α。例如:
16
1/3CaC O
+H
18O≒1/3CaC18O
+H
16
O
(25℃,α=1.0310)
32
32
又如:大气圈与水圈之间发生氧同位素交换反应
2 H 2 1O 8 1O 6 2 2 H 2 1O 6 1O 8 2
重稳定同位素: 原子序数Z>20,ΔA/A<10% (0.7-1.2%) ; 同位素成分变化的主要原因是放射性核素衰变,这种变 化是不可逆的。 87Rb 87Sr14S7 m 14N 3 d 238U→206Pb、235U→207Pb、232Th→208Pb,
(三) 同位素成分变化
1、稳定同位素分馏
第五章同位素地球化学
Байду номын сангаас
第五章 同位素地球化学
本章内容 自然界引起同位素成分变化的原因 同位素年代学 稳定同位素地球化学
一、自然界引起同位素成分变化的原因
核素的性质 同位素分类 同位素成分变化
(一)核素的性质
1.什么叫核素?
➢ 由不同数量的质子和中子按一定结构组成各种元素的原
子核称为核素,核素的质子数和中子数之和等于核素的质 量数(如16O)。
2)同位素标准样品
世界标准样品的条件: ①在世界范围内居于该同位素成分变化的中间位置,可以
做为零点; ②标准样品的同位素成分要均一; ③标准样品要有足够的数量; ④标准样品易于进行化学处理和同位素测定。
元素
标准样
H、O
标准平均大洋水
C 美国南卡罗莱纳州,皮迪组的美洲箭石(已耗尽)
C
索洛霍芬石灰岩
S 美国亚利桑那州坎宁迪亚布洛铁陨石中的陨硫铁
缩写
SMOW PDB NBS— 20 CD
3)分馏系数
对于同位素分馏系数,设有同位素平衡分馏反应:
aA1+bB2≒aA2+bB1
式中:A、B为含有相同元素的两种分子;a、b为系数;1
为轻同位素,2为重同位素。则同位素分馏系数α的定义
公式为:
α=RA/RB=(A2/A1)/(B2/B1)
如:
C16O32-+3H218O≒C18O32-+3H216O
