中元临床评价资料
临床评价资料

临床评价资料
产品名称:
1.医疗器械预期用途
2.预期与其组合使用的器械的情况
3.产品预期使用环境
(包括该产品预期使用的地点如医院、家庭等,以及可能会影响其安全性和有效性。
)……(宋体小四号)
4.产品适用人群
(包括目标患者人群的信息,患者选择标准的信息,以及使用过程中需要监测的参数、考虑的因素。
)……(宋体小四号)
5.产品禁忌症
(如适用,应明确说明该器械禁止使用的疾病或情况。
)……(宋体小四号)
6. 已上市同类产品临床使用情况的比对说明
……(宋体小四号)
7. 同类产品不良事件情况说明
……(宋体小四号)。
中药注射剂专项点评表Microsoft Word 文档
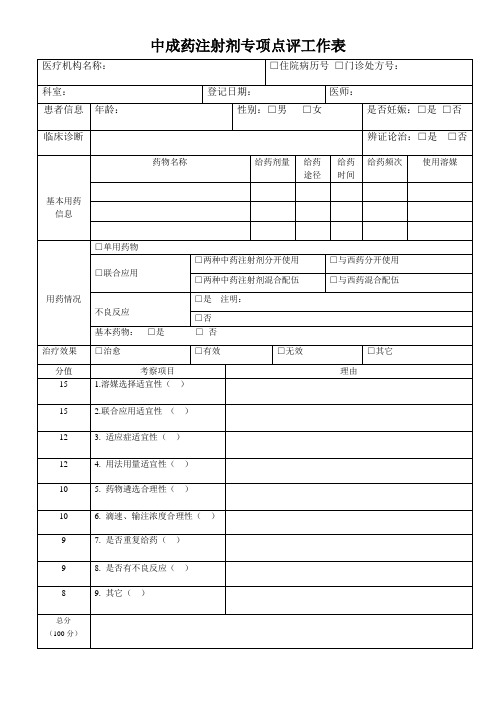
不良反应
□是注明:
□否
基本药物:□是□否
治疗效果
□治愈
□有效
□无效
□其它
分值
考察项目
理由
15
1.溶媒选择适宜性()
15
2.联合应用适宜性()
12
3.适应症适宜性()
12
4.用法用量适宜性()
10
5.药物遴选合理性()
10
6.滴速、输注浓度合理性()
9
7.是否重复给药()
9
8.是否有不良反应()
中成药注射剂专项点评工作表
医疗机名称:
□住院病历号□门诊处方号:
科室:
登记日期:
医师:
患者信息
年龄:
性别:□男□女
是否妊娠:□是□否
临床诊断
辨证论治:□是□否
基本用药信息
药物名称
给药剂量
给药途径
给药时间
给药频次
使用溶媒
用药情况
□单用药物
□联合应用
□两种中药注射剂分开使用
□与西药分开使用
□两种中药注射剂混合配伍
8
9.其它()
总分
(100分)
6、临床评价资料

临床评价资料
第六部分
一次性使用医用口罩(非无菌型)
临床评价资料
湖南佑华医疗用品有限公司
临床评价资料
一、产品概述
一次性使用医用口罩由口罩体、鼻梁夹、口罩带组成;口罩体为三层结构,内、外层为医用纺粘无纺布,中间层为聚丙烯熔喷布制成;鼻梁夹由可弯折的聚丙烯材料制成;口罩带由松紧带制成。
本品为《免于临床试验医疗器械目录》(2019年第91号通告,以下简称《目录》)中第668号产品“一次性使用医用口罩”。
因此,申报产品拟按免临床路径进行临床评价。
二、申报产品与《目录》产品的对比
我们将申报产品与上述目录内产品进行了对比,结果请见表1:
表1 申报产品与《目录》产品的对比表:
三、申报产品与境内已上市同类产品对比情况
我们详细研究了亿信医疗器械股份有限公司等企业的一次性使用医用口罩产品,并将我公司申报产品与亿信医疗器械股份有限公司的同类产品进行了对比,其情况如下表2所示:表2. 申报产品与目录内国内已上市产品对比表
由表2的对比可知,申报产品与亿信医疗器械股份有限公司的同类产品在结构、材料、性能、使用方法方面一致。
四、结论
通过与《目录》产品的描述、适用范围的对比,并与国内已上市同类产品在结构、材料、性能、使用方法等方面的综合对比,申报产品与《目录》所述的产品为实质等同产品,预期在临床使用时将具有同等的安全性和有效性,可免于进行临床试验。
五、同类产品不良事件情况说明
该产品临床使用过程中无不良事件产生。
中药临床疗效评价

综合化:综合考虑多种因素,如药物疗效、安全性、经济性等,进行全面评价
中药临床疗效评价的规范与标准
中药临床疗效评价的规范
评价目的:确保中药临床疗效的客观、准确、科学
评价方法:采用随机、双盲、安慰剂对照等方法,确保评价结果的可靠性和有效性
评价指标:包括临床疗效、安全性、经济性等方面,全面评估中药的临床应用价值
睡眠改善:睡眠质量提高,入睡时间缩短
精神振奋:精神饱满,情绪稳定,注意力集中
生化指标
肾功能:反映肾脏的健康状况
电解质:反映体内电解质平衡状况
血常规:反映血液系统的健康状况
血糖:反映糖尿病患者的血糖控制情况
血脂:反映心血管疾病的风险因素
肝功能:反映肝脏的健康状况
影像学指标
影像学检查:X光、CT、MRI等
队列研究:选择一定数量的患者,观察他们在接受中药治疗前后的疗效变化。
病例报告:收集个别患者的治疗效果,进行分析和总结。
系统评价和Meta分析:对多个临床试验的结果进行综合分析,得出更可靠的结论。
中药临床疗效评价指标
症状改善指标
食欲增加:食欲增强,消化吸收能力提高
疼痛缓解:疼痛程度减轻,持续时间缩短
影像学评价:根据影像学检查结果,评估药物疗效
影像学指标:肿瘤大小、淋巴结转移、骨转移等
患者生活质量指标
生理功能:包括疼痛、呼吸困难、疲劳等
心理功能:包括焦虑、抑郁、睡眠质量等
社会功能:包括工作、学习、社交等
健康行为:包括饮食、运动、戒烟等
生存质量:包括生命质量、幸福感、满意度等
中药临床疗效评价的实践
评价方法:采用随机、双盲、对照试验等方法
中药临床疗效评价的伦理问题
保护受试者权益:确保受试者自愿参与,充分了解试验目的和风险
医疗器械临床评价

临床评价资料
产品名称:吸唾管
1.医疗器械预期用途
用于牙科治疗时吸取患者口腔内的血水、唾液及其他异物
(包括产品所提供的功能,并可描述其适用的医疗阶段,目标用户及其操作该产品应具备的技能/知识/培训)……(宋体小四号)
2.预期与其组合使用的器械的情况
……(宋体小四号)
、
3.产品预期使用环境
(包括该产品预期使用的地点如医院、家庭等,以及可能会影响其安全性和有效性。
)……(宋体小四号)
4.产品适用人群
(包括目标患者人群的信息,患者选择标准的信息,以及使用过程中需要监测的参数、考虑的因素。
)……(宋体小四号)
5.产品禁忌症
(如适用,应明确说明该器械禁止使用的疾病或情况。
)……(宋体小四号)
6. 已上市同类产品临床使用情况的比对说明
……(宋体小四号)
7. 同类产品不良事件情况说明
……(宋体小四号)。
性能验证报告-CREA

文件编号:肌酐〔CREA〕试剂盒性能分析报告时间: 2016.08.09-08.14仪器:AU5821操陈崇汇总报告:目录:一、实验材料 (3)二、实验方案 (4)2.1 正确度 (4)2.2 批内精密度... (4)2.3 批间精密度 (5)2.4 线性评价 (5)2.5 灵敏度评价 (5)2.6特异性评价 (5)2.7参考范围验证 (5)三、实验数据 (6)3.1 正确度〔附表1〕 (6)3.2 批内精密度〔附表2〕... (6)3.3 批间精密度〔附表3〕 (7)3.4 线性评价〔附表4/附图1〕....................................... . (8)3.5 灵敏度评价〔附表5〕 (9)3.6特异性评价〔附表6〕 (10)3.7参考范围验证〔附表7〕 (11)四、结论 (13)五、附录A 〔朗道校准液溯源性说明以及企业标准〕附录B 〔CREA临床意义〕附录C 〔中元CREA试剂盒、朗道校准液、朗道质控液说明书〕附录D 〔中元CREA试剂盒SOP文件〕附录E 〔中元CREA试剂盒AU5821配套参数表〕附录F 〔中元CREA试剂盒与校准液注册证〕附录G 〔实验原始数据〕实验材料:生化试剂盒:重庆中元生物技术肌酐〔CREA〕试剂盒批号:Z160501有效期:2017.05.01 校准液〔定值液〕:重庆中元生物技术朗道CREA校准品批号:CAL2351-800UE有效期:2017.02.01 质控液:重庆中元生物技术朗道CREA质控品批号:HN1532-791UE;HN1530-1117UN有效期:2017.02.01 测定仪器:AU5821全自动生化分析仪批内精密度样本:临床高值标本3份混合尿液,低值标本3份混合尿液批间精密度样本:临床随机标本3份混合分装冻存线性物质:临床高值标本1份特异性物质:日本希森美康干扰物质一套,批号:160201 效期:2017.02.01参考区间验证样本:挑选体检标本20例分析灵敏度:朗道复合校准品1盒,批号:800UE 有效期:2017.02.01实验方案:2.1 正确度按实验室常规操作程序,进行CREA项目两点定标,然后按照常规样本尿液检测程序测定朗道复合质控品,使用前充分混匀,质控品重复测定3次,计算3次重复测定的均值。
袁灿兴-“卒中单元”中药注射剂应用评价

长沙 北京
200 中国
150
每年因卒中死亡的人数(万)
135
上海
150
165
100
印度
76.1
50
77
俄罗斯
51
0 3个国家每年卒中死亡人数
Bin Jiang, et al.Stroke. 2006;37:63-68。
卒中-危害严重的全球性问题
• 我国为脑卒中高发国家 –年发病率为185-219/10万人 –每年有200万人新发脑卒中 –存活的脑卒中700万人 –2/3致死或致残 • 脑血管病是我国人口总死亡第二位原因 –每年死于脑血管病150万人 • 每年脑卒中治疗费用约120亿元人民币
“卒中单元”中药注射剂应用评价
上海中医药大学附属龙华医院 袁灿兴
卒中对人类的危害早已引起国际社会的 高度重视。 多年来,国际范围内对脑卒中治疗的研 究投入巨资;新药不断开发,新的治疗 手段不断涌现,对于临床医疗研究的投 入也在不断扩大。
临床对脑卒中的医疗现状确实有了很大 的改观,但是发病率、致残率和疾病的 死亡率仍然高居不下。
结果 检索相关文献5087篇,纳入合格研究236项 ,涉及益气法、益气养阴法、活血法、清热 法、活血化痰法、活血清热法、益气活血法 、清热养阴活血法等治法28种,包括汤剂、 丸剂、散剂、注射剂等方药74种,统计分析 总有效率和不良事件发生率的相对危险度及 率差、神经功能缺损和日常生活活动能力评 分的加权均数差、需治疗病人数,并计算99 %可信区间。
苦揲子注射液 一项纳入20个研究、共计2146例患者的系统 评价显示,苦揲子注射液治疗急性脑梗死, 在第14天时可提高患者神经功能缺损的总有 效率(RR=1.17;95%CI:1.11,1.23),具有 提高患者日常生活能力的趋势(WMD=13.96 ,95%CI:2.14,25.78);神经功能缺损评 分疗效差值变化虽有统计学意义[标准化均数 差(SMD)为0.18;95%CI:-0.13,0.49],但 临床意义不明显;尚不能确定苦揲子注射液 是否存在面色潮红、心慌等不良反应。
--中--医病证诊断疗效标准.doc

中医病证诊断疗效标准中医病证诊断疗效标准ZY /T001.1-94一、中医内科病证诊断疗效标准主题内容与适用范围本标准规定了中医内科57 个病证的病证名、诊断依据、证候分类、疗效评定。
本标准适用于中医临床医疗质量评定,中医科研、教学亦可参照使用。
感冒的诊断依据、证候分类、疗效评定感冒病系外感风邪,客于肺卫,以鼻塞、流涕、咳嗽、恶寒、发热、头身疼痛为主要临床表现。
2.1 诊断依据2.1.1 鼻塞流涕,喷嚏,咽痒或痛,咳嗽。
2.1.2 恶寒发热,无汗或少汗,头痛,肢体酸楚。
2.1.3 四时皆有,以冬春季节为多见。
2.1.4 血白细胞总数正常或偏低,中性粒细胞减少,淋巴细胞相对增多。
2.2 证候分类2.2.1 风寒束表:恶寒、发热、无汗、头痛身疼,鼻寒流清涕,喷嚏。
舌苔薄白,脉浮紧或浮缓。
2.2.2 风热犯表:发热、恶风、头胀痛,鼻塞流黄涕,咽痛咽红,咳嗽。
舌边尖红,苔白或微黄,脉浮数。
2.2.3 暑湿袭表:见于夏季,头昏胀重,鼻塞流涕,恶寒发热,或热势不扬,无汗或少汗,胸闷泛恶。
舌苔黄腻,脉濡数。
临床尚有体虚感冒,以及挟湿、挟滞等兼证。
2.3 疗效评定2.3.1 治愈:症状消失。
2.3.2 好转:发热消退,临床症状减轻。
2.3.3 未愈:临床症状无改善或加重。
咳嗽的诊断依据、证候分类、疗效评定咳嗽是因邪客肺系,肺失宣肃,肺气不清所致,以咳嗽、咯痰为主要症状的病症。
多见于急、慢性支气管炎。
3.1 诊断依据1. 1 咳逆有声,或伴咽痒咳痰。
1. 2 外感咳嗽,起病急,可伴有寒热等表证。
1. 3 内伤咳嗽,每因外感反复发作,病程较长,可咳而伴喘。
3.1.4 急性期查血白细胞总数和中性粒细胞增高。
3.1.5 两肺听诊可闻及呼吸音增粗,或伴散在干湿性罗音。
3.1.6 肺部 X 线摄片检查,正常或肺纹理增粗。
3.2 证候分类3.2.1 风寒袭肺:咳嗽声重,咯痰稀薄色白,恶寒,或有发热,无汗。
舌苔薄白,脉浮紧。
3.2.2 风热犯肺:咳嗽气粗,咯痰粘白或黄,咽痛或咳声嘶哑,或有发热,微恶风寒,口微渴。
中药临床疗效评价

患者因素对中药疗效的影响
患者年龄、性别、体质等差异
不同年龄、性别、体质的患者对药物的吸收、代谢、排泄等生理过 程存在差异,影响中药疗效的发挥。
患者病情严重程度及病程
病情轻重、病程长短等因素会影响中药疗效的显现速度和程度。
患者心理状态
患者的心理状态对中药疗效也有一定影响,如情绪稳定、信心充足 的患者往往能获得更好的疗效。
中药临床疗效评价
汇报人:XX 2024-01-30
目 录
• 疗效评价标准与方法 • 中药治疗常见病症疗效评价 • 中药不良反应监测与评估 • 中药疗效影响因素分析 • 提高中药临床疗效的策略与措施 • 总结与展望
01 疗效评价标准与 方法
疗效评价标准
临床症状改善
观察患者临床症状的改善程度,如疼痛、发热、 咳嗽等症状的缓解情况。
开发新型中药制剂
根据临床需求,开发具有高效、速效、长效等特点的新型中药制剂,提高中药治疗的便 捷性和患者依从性。
提高中医临床诊疗水平
加强中医临床人才培养
01
加大对中医临床人才的培养力度,提高中医临床医师
的诊疗水平和综合素质。
推广中医临床诊疗规范
02 制定和推广中医临床诊疗规范,规范中医临床医师的
诊疗行为,提高中医治疗的准确性和有效性。
促进中药现代化
科学的疗效评价有助于推动中药 的现代化进程,提高中药在国际 市场的竞争力。
当前中药临床疗效评价存在的问题与挑战
评价标准不统一
目前中药疗效评价标准尚未统一,不同研究之间的可 比性较差。
疗效评价指标单一
很多研究仅关注临床症状的改善,缺乏对生活质量、 生存期等长期指标的评估。
研究方法不规范
部分研究在设计、实施和数据分析等方面存在不规范 之处,影响了结果的可靠性。
完整版)实体瘤疗效评价标准RECIST1

完整版)实体瘤疗效评价标准RECIST1.1版中文实体瘤疗效评价标准RECIST(1.1版)背景肿瘤治疗的临床评价中,评价肿瘤负荷的改变是一个重要特征。
肿瘤缩小和疾病进展时间是癌症临床试验的重要端点。
肿瘤缩小作为II期试验端点被多年研究的证据所支持。
这些研究提示对于多种实体肿瘤来说,促使部分病人肿瘤缩小的药物以后都有可能被证实可提高病人的总体生存期或在随机Ⅲ期试验中有进入事件评价的其他机会。
客观反应比其他生物标记更可靠。
在Ⅱ和Ⅲ期药物试验中,进展期疾病中的临床试验正越来越利用疾病进展的时间(无进展生存)作为得出有治疗效果结论的端点,而这些也是建立在肿瘤大小的基础上。
然而,这些肿瘤端点、客观反应和疾病进展时间,只有建立在以肿瘤负荷解剖学基础上的广泛接受和容易使用的标准准则上才有价值。
1981年世界卫生组织(WHO)首次出版了肿瘤反应标准,主要用于肿瘤反应是主要终点的试验中。
然而,在该标准出版后的十几年中,使用该标准的协作组和制药公司通常对其进行修改以适应新的技术或在原始文献中提出了不清楚的地方,这就导致了试验结果解释的混乱。
各种反应标准的应用导致同一种治疗方法的治疗效果大相径庭。
对这些问题的反应是国际工作组于19世纪中期形成,并对反应标准进行了标准化和简化。
新的标准,也称为RECIST(实体肿瘤的反应评价标准)于2000年出版。
最初的RECIST关键特征包括病变最小大小的确定、对随访病变数目的建议、一维而不是二维的使用、肿瘤负荷的总体评价。
这些标准后来被学术团体、协作组和制药工业广泛采用,而该标准的最初端点就是客观反应或疾病进展。
另外,当局接受RECIST作为这些评价的合适的标准。
为什么要更新RECIST?自从2000年出版RECIST后,许多研究者在前瞻性研究中证实将以二维测量为基础的标准(甚至是三维测量)替换为一维测量的有效性。
但也有例外(如间皮瘤),一维测量标准似乎在实体肿瘤Ⅱ期试验中更好。
医学文献检索中的元分析与综述分析技术

元分析采用定量方法,通过严格的统计技术对多个独立研究的结果进行合并和分析;综 述分析则采用定性和定量相结合的方法,包括文献筛选、内容提取、质量评价等步骤。
结果和结论的比较
结果
元分析的结果通常是一个量化的效应值或结论,具有更高的精确度和可信度;综述分析的结果则是对该领域研究 的全面概述,包括研究主题、方法、结果和结论等方面。
背景
随着医学研究的不断发展,大量研究成果涌现,如何有效地 筛选、整合和利用这些研究成果成为医学领域面临的重要问 题。元分析和综述分析技术作为解决这一问题的有效手段, 逐渐受到广泛关注和应用。
医学文献检索的重要性
提高研究效率
通过对已有文献的检索和分析,研究 者可以快速了解相关领域的研究现状 和进展,避免重复研究,提高研究效 率。
综述分析通过对已有文献的搜集、整理、归纳和比较,旨在揭示该领域的 研究现状、发展趋势和存在的问题。
综述分析可以为后续研究提供理论支持和参考依据,有助于推动学术进步 和实践发展。
综述分析在医学文献检索中的应用
01
在医学领域,综述分析被广泛应用于各类疾病的诊断、治疗、 预防等方面。
02
通过综述分析,医学研究者可以了解某一疾病的研究历史、现
结论
元分析能够提供更精确的效应估计和更可靠的结论,但受限于纳入研究的质量和数量;综述分析则能够提供更全 面的研究概述和更深入的讨论,但受限于作者的主观判断和经验。
适用性和局限性的比较
适用性
元分析适用于对同一问题或多个相关问题进行的多个独立研究的结果进行整合和分析,尤其适用于临 床医学、心理学、教育学等领域;综述分析则适用于对某一领域的研究进行全面的梳理和评价,尤其 适用于新兴领域或跨学科领域。
综述分析通过对相关研究的系统评价,可以 全面了解某一领域的研究现状、研究热点和 研究趋势。
某院224例中成药安全评价分析

例数 27 29 86 22 22 19 19
224
所占比例(%)
主要临床表现
12.05 呼吸困难、气促
12.95 恶心、呕吐、 肝功能异常
38.39 皮疹,瘙痒
9.82 头晕、头痛
9.82 胸闷、潮红
8.48 寒颤、发冷、高热
8.48 过敏样反应
100.00
(38.39%),见表 4。 3 讨论
3.1 ADR 与个体情况的关系 本 次 调 查 发 现,女 性 ADR 发 生 率(58.04%)高 于 男 性 (41.96%),由 于 女 性 的 特 殊 生 理 结 构 会 影 响 药 物 的 敏 感 性 和 不良反应的耐受性 [8-9]。ADR 发生的最小年龄< 3 岁,最大年 龄> 79 岁,发生 ADR 的患者中≥ 60 岁的 108 例,占总人数的 48.21%,< 18 岁的患者共 11 例,占 4.91%,从表 1 中可以看出 青少年的 ADR 发生率最低,随着年龄的增长 ADR 发生率逐渐 增加。有研究表明 [10],老年患者由于身体机能随年龄增长而减 退,且有多种基础疾病,多数患者合并用药种类多,因此 ADR 发 生率高。因此,临床上要密切关注老年患者的用药情况,加强对 中成药致 ADR 的监测,及时采取相应措施并关注转归情况,以 降低中成药 ADR 的发生率,保证患者用药安全。 3.2 ADR 与给药途径和给药剂型的关系 在本研究中,患者静脉给药和使用注射剂后 ADR 的发生率 最高(91.96%),由于静脉给药是住院患者常见的给药方式,避 免了肝脏的首关效应,使药物直接进入血液,导致给药风险高, 更易发生 ADR[11]。中成药注射剂主要成分是中药材提取物,成 分比较复杂,且有效成分大部分是大分子物质,容易引起变态反 应,比一般西药注射剂的 ADR 发生率高 [12-14],因此应该建议医 生在制定给药方案时,合理选择用药途径,遵循“能口服不肌注, 能肌注不静脉滴注”的用药原则。大多数中成药注射剂说明书 中的不良反应都只写了“暂未发现明显不良反应”,使得临床医 生觉得中成药注射剂疗效显著,不良反应少。 3.3 导致 ADR 发生的主要药品 引发 ADR 的中成药中,主要有参附注射液、疏血通注射液、 血塞通注射液、生脉注射液等。其中,参附注射液是引发 ADR 例数最多的中成药(27 例,12.05%)。导致的 ADR 主要临床表 现为皮疹、瘙痒、气促等。涉及的人群主要是≥ 60 岁的老年人, 根据笔者多年从事一线处方点评工作的经验来看,临床上老年 人使用活血剂以及补虚剂的情况比较多,而且存在不合理用药 的情况。比如疏血通注射液和血塞通注射液,本来是用来治疗
临床试验设计与评价课件(共32张PPT)

受试者分配情况及
试验完成情况指标
统计分析指标
可比性 分析指标
疗效评价指标
安全性评价指标
试验完成情况指标
依从性
人口学特征分析指标 生命体征分析指标
疾病情况(基线)分析指标
治疗前影响因素分析指标
主要疗效指标
次要疗效指标
全局评价指标
治疗中影响因素分析指标
安全性评价
不良事件发生情况 不良反应发生情况 治疗后生命体征监测
Ⅲ期
400例
健康志愿者的安全性或毒性
药代动力学
确定最大耐受剂量
增加用药时间及用药人数
确定不同患者人群的 剂量方案
观测不良反应
Ⅳ期 2000-3000例
新药临床试验管理规范(GCP)good clinical practice
目的: 过程规范、结果可靠 保障受益者权益和安全 伦理性和科学性
研究计划并至少有一次访视记录的全部受试者 ,用全分析数据集进行FAS分析。对脱落病例疗效相关部分的缺失数据, 采用末次访视向前结转(LOCF)的方法进行补充。
符合方案(Per-Protocol,PP)人群
所有符合试验方案,依从性好(实际用药量占应用药量80%~120%),试验 期间未用禁止药物,完成CRF规定填写内容且没有对试验方案有重大违反的受试者 ,构成本研究的PP数据集。
设计CRF
药监部门
伦理委员会
评估 多中心
研究者 研究基地
分类、病毒学检查
安全性评价指标:一般体检项目、血、尿、便常规、心电图、肝功能(GPT)、肾功能(BUN、CR)及不良反应,疗前正常疗后异常者,应定期
复查至随访终点。 首都医科大学附属北京儿童医院
纳入/排除 病程超过48小时者,或病程虽未超过48小时,但已接受其它抗病毒、抗炎等药物治疗;
临床评价资料

临床评价资料申报产品与目录中已获准境内注册医疗器械对比表对比项目目录中医疗器械申报产品差异性支持性资料概述基本原理(工作原理/作用机理)结构组成产品制造材料或与人体接触部分的制造材料性能要求灭菌/消毒方式适用范围使用方法……注:对比项目可根据实际情况予以增加。
申报产品与同品种医疗器械的对比项目(无源医疗器械)申报产品与同品种医疗器械的对比项目(有源医疗器械)申报产品与同品种医疗器械对比表的格式对比项目同品种医疗器械申报产品差异性支持性资料概述基本原理结构组成………………注:对比项目至少应包括附件2所列全部项目。
通过同品种医疗器械临床试验或临床使用获得的数据进行分析评价路径附5文献检索和筛选要求一、检索数据库注册申请人需根据申报产品/同品种医疗器械的具体情况(如设计特征、适用范围等)选择检索数据库,并在方案中论述选择的理由。
数据库的选择应具有全面性,可考虑的数据库类型举例如下。
1.科学数据库:如中国期刊全文数据库、美国《医学索引》(Medline)、荷兰《医学文摘》(EM)等。
2.临床试验数据库:如科克伦对照试验注册中心(CENTRAL)、临床试验注册资料库()等。
3.系统评价数据库:如科克伦(Cochrane)图书馆等。
4.专业数据库:如诊断测试索引数据库(MEDION)、骨关节登记数据库等。
二、检索途径、检索词、检索词的逻辑关系为全面、准确地检索出申报产品/同品种医疗器械的临床文献,应综合考虑检索途径的选择、检索词的选择和各检索词间逻辑关系的配置,制定科学的检索策略。
常见的检索途径包括主题词检索、关键词检索、摘要检索、全文检索等。
检索词应与选择的检索途径相适应,考虑因素如产品的通用名称、商品名称、生产企业、基本原理、结构组成、制造材料、设计特征、关键技术、适用范围等。
进行检索词逻辑组配时, 应正确地选用逻辑算符来表达检索词之间的逻辑关系,如逻辑或(OR)扩大检索范围,逻辑与(AND)缩小检索范围。
医疗研究项目中期评价报告

腰椎间盘突出症根性痛的临床研究项目中期评价报告一,计划项目执行情况1.项目主要研究工作开展情况项目名称为《腰椎间盘突出症根性痛的临床研究》。
项目承担单位:1.1项目主要开展的技术工作(1).本报告期内,本项目研究已经基本完成对腰椎间盘突出患者的病例筛选工作。
(2).本报告期内,本项目研究已经基本完成病人的分组治疗工作。
(3).本报告期内,本项目研究已经基本完成病人的疗效观察工作。
1.2项目实施具体内容(1).多次召开项目组成员协调会议,优化临床试验观察方案,并定期进行临床试验的监督管理(2).多成员分工明确,协同开展病例收集,治疗及分析工作,填写JOA评分等各种临床数据量表工作。
(3).临床三个试验组汇总已完成病例的临床数据。
(4).对已完成的资料进行分析讨论,查阅文献及临床调查研究发现:髓核突出是腰椎间盘突出症的主要病理表现,因此传统的看法认为,突出的椎间盘髓核对神经根的直接压迫是疼痛的原因,其疼痛程度取决于髓核突出的类型和大小。
但是,在临床上可见到,有些病人其神经根受压并不严重,而根性疼痛十分剧烈;另一些病人其神经受压颇重,但根性痛不重。
由此可见,椎间盘突出所致神经根性疼痛还有其他病理机制参与。
临床分析表明,腰椎间盘突出物对神经根的机械压迫与其引起的临床疼痛症状和神经根体征似乎无直接关系,而与神经根炎症有密切关系。
神经根呈急性炎症反应的病人中重度疼痛高达80%,但是,神经根炎症肯定与突出物对其反复的机械刺激有关,而无论突出物或大或小均可导致不同程度的炎症和神经根性疼痛。
另外,腰椎间盘突出,有人认为,慢性反复机械刺激可导致感觉神经的致敏,表现为延时反复放电。
间盘髓核对神经根的直接压迫是疼痛的原因,其疼痛程度取决于髓核突出的类型和大小。
但是,在临床上可见到,有些病人其神经根受压并不严重,而根性疼痛十分剧烈;另一些病人其神经受压颇重,但根性痛不重,由此可见,椎间盘突出所致神经根性疼痛还有其他病理机制参与。
7.临床评价资料(可编辑修改word版)

7.临床评价资料
本品属于列入《免于进行临床试验的第二类医疗器械目录》的产品,不需进行临床试验。
7.1申报产品相关信息与《免于进行临床试验的第二类医疗器械目录》所述内容的比对资料
7.2申报产品与《免于进行临床试验的第二类医疗器械目录》内境内已上市同品种医疗器械比对表
【用途】
本产品供医疗单位使用。
【产品结构组成】
医用棉球以医用脱脂棉为原材料制成,A 型经环氧乙烷灭菌,产品无菌,无菌有效期为3 年,B 型未经灭菌处理。
【详细说明】
本产品以医用脱脂棉为原材料制成。
【产品标准】。
临床疗效标准名称大全

文献评价点8:疗效标准来源1.比较方式:把1285篇临床文献中的记录的疗效标准来源进行统计。
2.检索范围:1997年—2006年中国中医药期刊临床文献数据库中的文献。
3.比较结果:1997年—2006年中国中医药期刊临床文献数据库中含溃疡性结肠炎主题词的临床文献1285篇,记载疗效标准来源的临床文献468篇;其中核心期刊209篇,记载疗效标准来源的临床文献87篇。
表25:全部1285篇文献疗效标准来源统计表序号(所占比例疗效标准来源所占比所占比123效标准》,太原,1993年。
5.14% 5.0345 2.02% 1.98%7 1.09% 1.07%8上制定的疗效标准》,临汾,1992年9月1.01%0.99%91011中华人民共和国卫生部,1995年。
0.62%0.61%12《中医病证诊断疗效标准》,国家中医药管理局,南京大学出版0.47%0.46%14《溃疡性结肠炎疗效标准》,中华全国中医学会肛肠分会。
0.47%0.46% 15161718编,北京,人民军医出版社,1987年。
0.39%0.38%1920210.31%0.30%23及治疗标准》,1987年0.31%0.30% 24《内科学》,第4版,陈灏珠主编,北京:人民卫生出版社,1996 378252627学技术出版社,1993,9:1030.23% 0.23%3031药政局,1993年。
0.23% 0.23% 323334社,1998.1250~1251。
0.16% 0.15% 35《溃疡性结肠炎诊断标准及疗效标准》36军医出版社,1987。
0.16% 0.15%37《实用中西医结合内科学》,第10版,陈可冀,北京,北京医科大学、中国协和医科大学联合出版社,1998 ,713。
0.16% 0.15%3839判断标准.0.16% 0.15% 4041病杂志,1998,8(3):42。
0.16% 0.15% 4243社,1993年。
0.16% 0.15%44《中医内科疾病诊疗常规》,朱文峰,长沙:湖南科学技术出版社,1999年。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
临床评价资料
1、产品预期用途和说明:该产品通常为独立使用,用于医疗机构门诊、病房、检查室等作普通隔离
2、产品预期使用坏境:该产品为医疗机构、病房、检查室使用,通常在室温条件下使用。
使用方法如下:拆开包装,取出隔离服进行穿戴。
该产品应储存于阴凉干燥处
3、产品适用人群:产品适用于医护人员。
4、产品禁忌症:对非织造布等原材料过敏者慎用。
5、已经上市同类产品临床使用情况的对比说明
医疗器械产品技术要求:
隔离服
1.产品型号/规格及其划分说明
1.1划分说明
隔离衣主要由非织造布为主要原料制造,符合标准FZ/T 64005-2011卫生用薄型非织造布的要求。
该产品型号按产品结构进行划分,定义为连身式。
规格划分主要是依据尺码划分的,分为 S、M、L 共3个规格。
1.2 产品型号/规格如下
表 1 型号规格及尺寸表单位:cm
2. 性能指标
2.1外观及拉链活动性能
产品应干燥、清洁、无尘、无霉斑、表面不允许有斑疤、裂孔、开缝等缺陷,且包装应完整。
拉链应能自如活动,且不易脱落。
2.2尺寸规格
尺寸规格应符合 1.2 表1 的要求,偏差±3cm。
2.3 断裂伸长率
产品断裂伸长率应≥15%。
2.4 断裂强力
产品断裂强力应≥15N 。
3. 检验方法
3.1外观及使用性能 采用目测及穿脱测试,结果应符合2.1 的要求。
3.2 尺寸规格 用通用量具进行测量,结果应符合 2.2 的要求。
3
.
3 断
裂伸长率
取试样,有效
宽度 50m m ±0
.5m
m (不
包括毛边
,长度应能满足隔距长度 200mm ,记录原始长度 L 0。
使用夹钳夹住一端,缓慢拉伸另一端,记录试样断裂时的长度增加量△L 。
断裂伸长率=△L/L 0×100%; 计算结果应符合 2.3 的要求。
3.4 断裂强力
取试样,有效宽度 50mm±0.5mm(不包括毛边),长度应能满足隔距长度 200mm 。
使用夹钳固定一端,使用拉力计缓慢拉伸另一端,记录试样断裂时拉力计的读数。
结果应符合 2.4 的要求。
4.术语 无
产品检验报告
产品性能自检报告。
