青篙素前体合成基因克隆与酵母穿梭表达载体的构建
合成生物学技术在人类健康领域的应用

人工基因组设计与合成论文学院化工学院专业制药工程学号姓名班级2012年04 月06 日合成生物学技术在人类健康领域的应用及前景展望【摘要】:合成生物学是一门新兴的建立在生物信息学、DNA化学合成技术、遗传学和系统生物学之上的交叉学科。
本篇论文简单总结了合成生物学的研究进展,并对合成生物学在新药物开发、疾病治疗领域的发展,以及其面临的科学技术难题进行综述,指出合成生物学在医药领域的发展潜力。
【关键词】:合成生物学;人类健康;研究进展。
1合成生物学近况合成生物学是综合了科学与工程的一个崭新的生物学研究领域。
它既是由分子生物学、基因组学、信息技术和工程学交叉融合而产生的一系列新的工具和方法,又通过按照人为需求(科研和应用目标),人工合成有生命功能的生物分子(元件、模块或器件)、系统乃至细胞,并自系统生物学采用的“自上而下”全面整合分析的研究策略之后,为生物学研究提供了一种采用“自下而上”合成策略的正向工程学方法。
它不同于对天然基因克隆改造的基因工程和对代谢途径模拟加工的代谢工程,而是在以基因组解析和生物分子化学合成为核心的现代生物技术基础上,以系统生物学思想和知识为指导,综合生物化学、生物物理和生物信息技术与知识,建立基于基因和基因组、蛋白质和蛋白质组的基本要素(模块)及其组合的工程化的资源库和技术平台,旨在设计、改造、重建或制造生物分子、生物部件、生物系统、代谢途径与发育分化过程,以及具有生命活动能力的生物部件、体系以及人造细胞和生物个体。
1. 1 国外的研究进展合成生物学作为一门新兴的学科,过去五年中在概念理论、功能应用和方法技术方面都取得了显著的进展,三方面相辅相成,极大地促进了该学科的发展和成熟。
1.1.1 以基因线路为基础的合成生物学基本概念和理论的深入研究,奠定了学科发展的坚实基础。
合成生物学的思想起源于对电子线路概念的借鉴,试图利用已知的基因功能和相互调控关系,通过构造可设计、可组装、可替换的具有全新功能的基因元件,搭建具有特定功能和逻辑关系的基因线路,用以加深对基因表达和调控的认识。
工程酵母生产青蒿素的原理

工程酵母生产青蒿素的原理
工程酵母生产青蒿素的原理主要包括以下几个步骤:
1. 提取青蒿素的基因:从青蒿植物中提取出负责合成青蒿素的基因。
青蒿素是一种有效的抗疟疾药物,其合成主要依赖于青蒿素的合成酶基因。
2. 克隆基因至工程酵母:将提取的青蒿素合成酶基因克隆到工程酵母的基因组中。
工程酵母是通过基因工程技术改造的酵母菌,具有较高的表达能力和稳定性。
3. 调控基因表达:利用基因调控技术,使工程酵母在适当的条件下高效表达青蒿素的合成酶基因。
这可以通过调控转录因子等方式实现。
4. 合成青蒿素:在适宜的发酵条件下,工程酵母通过合成酶基因表达合成青蒿素的合成酶。
这些合成酶可以将酵母菌中的代谢产物转化为青蒿素。
5. 提取和纯化青蒿素:将发酵产生的青蒿素提取出来,并进行纯化和精制,以得到纯度较高的青蒿素产品。
通过工程酵母生产青蒿素可以大量生产这一重要抗疟疾药物,提高生产效率和降低生产成本,有助于满足世界范围内对于青蒿素的需求。
生物合成青蒿酸课件

7
生物合成青蒿酸
菌株改造:
Y337 (原始菌株, PMET3-ERG9 )
导入表达CYP71AV1 和CPR1 基因的高 拷贝质粒
14
结果
添加10%的IPM,使得所有菌株的生存能力显著加强。同时,对Y285 、Y301、Y657和 Y692菌株(缺乏ALDH1和ADH1基因)而言,添加IPM会导致中间产物的析出。而对有 ALDH1和ADH1基因的菌株,添加IPM会提高青蒿酸的产量
15
化学途径
1.the reduction of the D11(13) double bond. 2. the esterification of the carboxylic acid. 3. an ‘ene-type’ reaction of the C4 –C5 double bond with singlet oxygen. 4. the allylic hydroperoxide undergoes an acid-catalysed Hock fragmentation and rearrangement to afford a ringopened ketoaldehyde enol
12
添加IMP
表达ALDH1基因的菌株以胞外晶体沉淀的形式生产青蒿 酸,沉淀在初期发酵时便能观察到,这对使得多相发酵样 品中产品的精确测量变得复杂。为了克服由青蒿酸结晶沉 淀带来的困难,我们利用萃取发酵溶解沉淀的现象,在十 四酸异丙酯(IMP)环境中培养菌体。
基因工程在中药发展中的应用

基因工程在中药发展中的应用【摘要】随着植物基因工程的快速发展,转基因技术的应用越来越广泛。
目前已获得了多种转基因中药材,在改良药用植物、提高天然药物含量、培养新型转基因药材、培养抗病抗寒植物等方面前景良好,转基因植物药物的开发研究将会得到更大发展。
概述了植物基因工程应用于中草药研究的进展情况。
【关键词】转基因植物、中草药、基因工程【正文】一、现代生物技术在中药材生产和质量控制中的应用我国现在运用的中药绝大部分为人工栽培的品种,科研和临床验证表明,一些人工栽培的中药材经多年繁衍其药性和有效成分就会发生变化,如栽培的柴胡、板蓝根、三七、何首、乌生、地黄等,因种植域不同其活性成分就相径庭,严重影响疗效稳定。
另外在长期的中药材种植中,难以解决的问题主要有品种种质老化、病毒寄生蔓延、种植费工费时、繁殖系数低下。
这些问题很难适应当前正在进行的开设生产基地发展药材生产的趋势。
利用现代生物技术利用现代生物技术,首先能解决的是中药天然资源不足及栽培周期长、效益差的缺点。
据统计,民间应用的草药几乎百分之百是野生。
目前全世界的植被正以惊人的速度在改变或遭到破坏,已有5000一 6000种植物受到威胁,而我国现有5000个品种处于濒危状态,一些物种已经绝迹。
药用资源的保护和可持续利用是目前函待解决的问题。
那么采用现代生物技术来快繁濒危药物资源也已成为当务之急。
其方法措施有:1、是植物组培快繁技术。
郭洪波等研究了铁皮石解无菌茎段在MS+ N A A0。
4 m g / L + 6一B A 5 m g / L培养基上体外培养,培养50d后,腋芽萌发率、增殖倍数最高,分别为9 3.3 3 % 1.9 7,植株生长健壮;以该培养基进行继代培养时,其增殖倍数达到3.2倍。
以茎段为材料,实现铁皮石解快速繁殖。
朱俊义等进行东北刺人参组培快繁试验,结果1 / 2B +B A1.0 m g / L +N A A0.1m g / L + IB A0.2m g / IJ+Ve5 0m g / I、+ K T0.1 m g / IJ 对愈伤组织的诱导效果最好,2 /3M S + 6一 B A1.0 m g / L + N A A0.5m g / L + vc1 0 0m g / IJ是愈伤继代最合适的培养基。
酵母双杂交步骤

酵母双杂交步骤酵母双杂交是一种常用的实验方法,用于研究基因之间的相互作用以及确定基因功能。
这种方法可以帮助科学家更好地理解生物学系统的复杂性,并为疾病的研究提供重要线索。
下面将介绍酵母双杂交的步骤及其意义。
进行酵母双杂交实验需要准备两个重要的构建:酵母表达载体和融合蛋白质的基因。
酵母表达载体通常包含启动子、选择标记基因和复制起点等元件,可以在酵母细胞中稳定表达外源基因。
而融合蛋白质的基因则是由研究人员设计合成,其中包含感兴趣的基因片段与激活结构域的融合。
将融合蛋白质的基因克隆到酵母表达载体中,构建成表达载体。
然后将这些表达载体分别转化到两株不同的酵母菌株中,形成两个亲本菌株。
接着,将这两个亲本菌株进行交配,使它们在同一酵母细胞内共存。
接下来,通过培养这个双杂交菌株,观察融合蛋白质是否发生相互作用。
如果两个融合蛋白质相互结合,可能会激活报告基因的表达,从而产生可检测的信号。
通过检测这些信号,可以初步判断这两个蛋白质之间是否存在相互作用。
为了验证这种相互作用的真实性,通常需要进行一系列的对照实验和进一步的验证。
例如,可以利用突变体蛋白质来确认相互作用位点,也可以通过共沉淀实验证明这种相互作用在细胞内是否真实发生。
酵母双杂交实验是一种简单而有效的方法,可以帮助科学家快速筛选出潜在的蛋白质相互作用,并为后续的深入研究提供基础。
通过这种方法,研究人员可以更好地理解生物学系统的复杂性,揭示基因之间的相互关系,为疾病的研究和治疗提供新的思路。
总的来说,酵母双杂交是一种重要的实验方法,对于生物学研究具有重要意义。
通过这种方法,科学家们可以揭示基因之间的相互作用,探索生物学系统的奥秘,为人类健康和疾病治疗提供新的思路和方法。
希望未来能有更多的科研工作者投入到这一领域,共同推动生命科学的发展和进步。
青蒿素公开课ppt课件

开展临床试验和药理研究,验证青蒿 素及其衍生物在治疗其他疾病方面的 疗效和安全性。
针对青蒿素的作用机制和构效关系, 设计并合成新的衍生物或类似物,发 现具有更好药理活性的新药。
THANK YOU
效果并降低毒副作用。
05
青蒿素的未来展望
青蒿素在全球范围内的应用前景
青蒿素是治疗疟疾的重要药物, 随着全球抗击疟疾的深入,青蒿
素的需求量将会继续增加。
随着全球疟疾发病率的下降,青 蒿素的应用将逐渐转向预防性用 药,如预防性疫苗的研发和应用
。
青蒿素在全球范围内的普及和推 广,将有助于降低疟疾的发病率
青蒿素公开课ppt课件
目录
• 青蒿素简介 • 青蒿素的抗疟疾作用 • 青蒿素的提取与合成 • 青蒿素的研究进展 • 青蒿素的未来展望
01
青蒿素简介
青蒿素的发现
青蒿素是由中国科学家在20世纪 70年代从黄花蒿中提取的一种抗
疟疾药物。
青蒿素的发现是经过多次试验和 筛选的结果,科学家们在研究中 发现黄花蒿具有抗疟疾活性,进
,改善全球公共卫生状况。
提高青蒿素产量的研究展望
通过基因工程和代谢工程等手 段,提高青蒿素的产量和纯度 ,降低生产成本。
探索新的培养方式和发酵工艺 ,提高青蒿素的发酵效率和产 物浓度。
开发新的提取和纯化技术,提 高青蒿素的纯度和收率,降低 杂质含量。
青蒿素在其他疾病治疗中的应用前景
青蒿素具有抗肿瘤、抗炎、免疫调节 等作用,有望在治疗其他疾病方面发 挥重要作用。
一步分离出了青蒿素。
青蒿素的发现为全球抗击疟疾做 出了巨大贡献,拯救了数百万人
的生命。
青蒿素的化学结构
青蒿素是由一种名为倍半萜的化合物组成的,其化学结构较为复杂。
青蒿素-合成生物学_青蒿素在合成生物学中的研究进展

优化措施: 增加基因的拷贝数、启动子修饰、密码子优化、基因替换、增加辅酶数量、优 化或平衡多基因控制的代谢途径
1.Wu W, Yuan M, Zhang Q, et al. Chemotype-dependent metabolic response to methyl jasmonate elicitation in Artemisia annua [J]. Planta Med, 2011, 77: 1048−1053.
3.3提高底物利用效率
提高青蒿素生物合成特异途径中的途径酶效率, 主要通过 两种方式:提高单个基因效率和优化平衡整条途径来实现 这个目的。 对于单个基因效率的 提高, : 主要采取增加基因拷 贝数、密码子优化、 强启动子调控和融合 基因等方式。
对于代谢途径的平衡优化: 主要采用一种基于全局的数学 算法和生物信息分析, 如代谢 流控制分析。相对于单个基因 效率的提高, 整条代途径的平 衡优化显得更为困难和复杂, 对最终产物产量的影响也是最 深刻和直接的。
青蒿素在合成生物学中的研究进展
CONTENTS
简介:青蒿素与合成生物学
青蒿素的生物合成主要包括四大步骤 提高工程菌中目的产物产量的措施 工业化研究进展 研究展望 参考文献
Part1 : 简介:青蒿素与合成生物学
青蒿素(artemisinin)是中国科学家于 20 世纪 70年代从传统中草药青蒿或称 黄花蒿中分离提纯的抗疟有效单体, 其化学本质是含“过氧桥”结构(1,2,4-三噁 烷环)的倍半萜内酯。
3.1通过“开源”方式增加前体供应
青蒿素是 一种Βιβλιοθήκη 半 萜, 其生物 合成包括 两部分。
上游部分 (top pathway) 主 要指倍半萜共同前体 法尼基 焦磷酸(FPP) 的形成。通过 MEP 和MVA 两条途径形成的 FPP 池可以为下游各种半萜以 及甾提供前体物质。
一种酵母表达载体的构建及表达鉴定

一种酵母表达载体的构建及表达鉴定王海涛;李雪萍;郭红云;王涛;闵建平;郭欢;朱公建;苏海翔【摘要】目的:通过基因工程技术构建霍乱毒素B亚基(CTB)与人Aβ42的融合基因,并进行表达鉴定.方法:将融合基因克隆到酵母表达载体pYES2中,并将鉴定正确的重组载体通过乙酸锂转化法转入野生型酵母菌株INVSc1.筛选阳性转化株,并将其诱导表达,通过Western blot检测融合蛋白CTB-Aβ42.结果:成功构建了CTB-Aβ42融合基因的酵母表达载体,并且可以有效表达融合蛋白.结论:本研究为进一步研制有效的抗阿尔茨海默症药物提供了一种新思路,具有一定的理论和应用价值.【期刊名称】《甘肃医药》【年(卷),期】2017(036)012【总页数】4页(P993-996)【关键词】乱毒素B亚基;β淀粉样蛋白;融合蛋白;酵母表达【作者】王海涛;李雪萍;郭红云;王涛;闵建平;郭欢;朱公建;苏海翔【作者单位】甘肃省医学科学研究院,甘肃兰州730050;甘肃省医学科学研究院,甘肃兰州730050;甘肃省医学科学研究院,甘肃兰州730050;甘肃省医学科学研究院,甘肃兰州730050;甘肃省医学科学研究院,甘肃兰州730050;甘肃省医学科学研究院,甘肃兰州730050;甘肃省医学科学研究院,甘肃兰州730050;甘肃省医学科学研究院,甘肃兰州730050【正文语种】中文【中图分类】Q78阿尔茨海默症(alzheimer’s disease,AD)又称老年痴呆症,是老年人中一种最为常见的中枢神经系统退行性疾病[1]。
老年痴呆症的症状在临床上主要表现为中枢神经系统全面衰退,认知功能、记忆逐渐丧失,造成生活自理能力的障碍和精神行为的异常,最终导致死亡[2]。
AD最显著的神经病理组织学特征是老年斑的形成、神经元纤维缠结和神经细胞的大量死亡,AD晚期还伴有乙酰胆碱水平的降低。
其中老年斑主要是由41~43个氨基酸片段的β淀粉样蛋白(β-amyloidpeptide,Aβ)沉积而成的,而Aβ是β淀粉样前体蛋白经由β和γ分泌酶分解产生的,具有高度的成纤维性和神经毒性[3]。
青蒿素生物合成

青蒿素生物合成10生物技术(2)班曾庆辉201024112211青蒿素是我国科研人员从传统中医药黄花蒿中提取出来并自主研发的一种抗疟疾特效药[1]。
20世纪70年代,我国科技工作者从黄花蒿中分离提纯出一种抗疟活性单体——青蒿素,以后又确定了它的分子结构和构型。
1986年我国自主研发的蒿甲醚油针剂、青蒿琥酯钠盐的水针剂以及青蒿素栓剂等抗疟疾药作为一类新药在我国批准生产。
1995年蒿甲醚率先被收入国际药典,这是我国首次得到国际认可的自主研发新药。
目前,青蒿素系列抗疟药已有5种新药(青蒿素、青蒿琥酯、蒿甲醚、双氢青蒿素、复方蒿甲醚)共9种剂型上市并在世界各国销售,每年挽救了数百万重症疟疾患者的生命。
除了独特的抗疟作用外,青蒿素系列药物还具有抗血吸虫、肺吸虫、红斑狼疮、皮炎以及免疫调节,抗流感等多种疗效[2]。
但是,目前国际抗疟药市场上青蒿素类药物只占有很少的份额,其原因主要在于青蒿素原料缺乏。
由此,有研究者另辟蹊径,设想通过生物合成青蒿素。
时至今日,青蒿素的生物合成已经取得一定进展,介绍如下:早在20世纪80年代,中国科学院上海有机化学研究所汪猷院士领导的研究小组就利用放射性同位素标记的2-14C-青蒿酸与青蒿匀浆(无细胞系统)保温法证明,青蒿酸和青蒿 B 是青蒿素的共同前体[3]。
青蒿素生物合成途径仅见于青蒿,但其“上游”途径为真核生物所共有,可望通过“下游”途径重建,在真核微生物(如酵母)中全合成青蒿素。
过去10年来,青蒿素合成基因被国内外研究团队陆续克隆并导入酿酒酵母细胞,已成功合成青蒿酸及双氢青蒿酸等青蒿素前体。
由于酵母缺乏适宜的细胞环境,尚不能将青蒿素前体转变成青蒿素。
因此,青蒿依然是青蒿素的唯一来源,凸显出继续开展青蒿种质遗传改良的必要性。
同时,青蒿素生物合成的限速步骤尤其是终端反应机制已基本得到阐明,有助于开展青蒿素形成与积累的环境模拟及仿生,从而为彻底缓解青蒿素的供求矛盾创造先机[4]。
青蒿二烯功能模块与酵母底盘的适配性

青蒿二烯功能模块与酵母底盘的适配性贾云婧;赵鹃;丁明珠;元英进【摘要】设计构建人工酿酒酵母细胞合成青蒿二烯的关键是使外源功能模块与底盘细胞适配,本文通过对外源功能模块中的载体、蛋白表达和启动子进行优化,以提高功能模块与底盘细胞的适配性.使用着丝粒载体和附加型载体构建了2种青蒿二烯功能模块,在过表达甲羟戊酸(MEV)途径中关键基因(截短的3-羟基-3..甲基戊二酰辅酶A还原酶基因tHMGR及法尼基焦磷酸合酶基因ERG20)的2种酵母底盘中进行适配,得到适配性较好的人工合成细胞,其产量为11.2 mg/L;将青蒿二烯合酶基因(ADS)与ERG20进行融合构建融合蛋白功能模块,在选定底盘中适配性进一步提高,青蒿二烯的产量提升至17.5 mg/L;采用不同强度的启动子(TDH3p,TEF1p和PGK1p)对融合蛋白功能模块进行调控,最终得到功能模块与底盘间适配关系更好的人工合成细胞,其产量提升到71.8 mg/L.【期刊名称】《高等学校化学学报》【年(卷),期】2013(034)012【总页数】7页(P2765-2771)【关键词】青蒿二烯;酵母底盘;融合蛋白;功能模块;适配【作者】贾云婧;赵鹃;丁明珠;元英进【作者单位】系统生物工程教育部重点实验室,天津大学化工学院制药工程系,天津300072;系统生物工程教育部重点实验室,天津大学化工学院制药工程系,天津300072;系统生物工程教育部重点实验室,天津大学化工学院制药工程系,天津300072;系统生物工程教育部重点实验室,天津大学化工学院制药工程系,天津300072【正文语种】中文【中图分类】O629;Q599近年来,利用合成生物学技术在微生物中异源生产植物源萜类物质及其它天然化合物的研究备受关注[1],这种方法克服了植物提取及化学全合成的环境不友好、产率低和过程复杂等不足. 在萜类物质的异源生产中,研究者通过对前体物质积累、外源基因转录及表达水平等影响因素进行优化以提升产量[2 ~8]. 在此过程中,外源功能模块与底盘细胞的适配性直接决定了人工合成细胞中代谢流的通畅程度和前体物质的供给水平,对目标物质的产量有重要影响.目前,在酿酒酵母中进行萜类物质异源生产的研究大多集中在对酿酒酵母内的甲羟戊酸(MEV)途径进行改造上,如过表达MEV 途径中截短的3-羟基-3-甲基戊二酰辅酶A 还原酶基因(tHMGR)、法尼基焦磷酸合酶基因(ERG20)和转录因子(upc2-1)[7 ~15]以提高法尼基焦磷酸(FPP)的积累;敲除或者抑制角鲨烯合酶基因(ERG9)的表达以抑制竞争路径鲨烯的合成[7 ~10]等. 作为抗疟疾药物青蒿素的关键前体,青蒿二烯的微生物异源合成受到广泛关注. Keasling 等[6 ~8]通过改造酿酒酵母底盘细胞、提高青蒿二烯功能模块的表达水平及优化发酵条件等一系列措施,获得了青蒿二烯产量超过40 g/L 的酵母人工细胞. 孔建强等[11,16]通过改造酿酒酵母底盘细胞及对青蒿二烯合酶基因(ADS)进行突变等方法,获得了最高产量为123.2 mg/L 的酿酒酵母工程菌.尽管青蒿二烯的异源合成已经达到了较高水平,但提高外源模块与底盘细胞的适配性仍可为进一步提高产量提供可能. 在底盘细胞选择方面,不同遗传背景的酵母底盘细胞在萜类物质的异源合成中的表现有较大差异[17],因此选择合适的底盘细胞对外源模块的表达有重要意义. 在外源模块的优化方面,外源模块的表达水平与载体类型、蛋白表达方式和水平及启动子强度等密切相关. 首先,表达载体在底盘细胞中的稳定性及拷贝数直接关系到外源功能模块中蛋白质的表达水平[18],不同载体所构建的功能模块与底盘的适配性对目标物质的产量有很大影响. 其次,在选定的底盘细胞中,外源模块可能无法很快适应内源的复杂环境,导致代谢流不通畅、目标物质的合成受到限制. 这种情况可能是由中间产物的扩散、降解或者流入其它竞争途径等原因所致[19,20]. 为解决此问题,利用蛋白的邻近效应将代谢流更多地引入目标途径的方法备受关注[9,14,21 ~23],其中最简单易行的手段就是蛋白融合技术将催化两个相邻反应的酶通过连接肽连接在一起形成一个蛋白团,缩短两个酶的空间距离. 目前,在酵母中利用融合蛋白提升萜类物质产量的研究已取得一定进展. Albertsen 等[9]利用融合蛋白FPPS-PTS 将薄荷醇在酿酒酵母中的产量提高了2 倍;Ohto 等[21]研究表明,表达融合蛋白BTS1-ERG20 的酿酒酵母菌株中香叶基香叶醇产量比单独表达蛋白BTS1 和ERG20 的酿酒酵母菌株提高了8倍. 可见,蛋白融合技术能使外源模块与内源模块之间建立更直接的联系,有利于外源模块与底盘细胞的适配. 最后,由于不同强度启动子的使用对目标物质的产生同样有重要影响[4,5,24],可以通过更换外源功能模块中的启动子进一步提高外源模块与底盘细胞的适配性.构建的生产青蒿二烯的酵母人工合成细胞中的目标代谢途径及人工合成细胞优化过程如图1 所示. 选用2 株酿酒酵母菌株W303-1A 及YSG50 进行改造得到2 种底盘细胞W00 及Y00,研究了着丝粒载体(YCp)及附加型载体(YEp)所表达的外源功能模块与2 个底盘的适配性. 选用适配性更好的底盘和表达载体,验证了融合蛋白(ADS-ERG20 和ERG20-ADS)功能模块的表达效果,通过融合蛋白功能模块中不同强度启动子的更换,获得了青蒿二烯产量达到71.8 mg/L 的酿酒酵母人工合成细胞.Fig.1 Biosynthesis of amorphadiene in engineered S.cerevisiae(A)Engineered pathway to produce amorphadiene in S. cerevisiae;(B)the fitness of heterologous modules and chassis.1 实验部分1.1 试剂与仪器Fast Pfu 酶和鲑鱼精DNA(Transgene 公司);T4 DNA 连接酶和各类限制性内切酶(Fermentas 公司);PEG4000 和各类氨基酸粉末(鼎国昌盛公司);去氨基酵母氮源(Sigma 公司);酵母浸粉和蛋白胨(奥博星生物试剂公司);朱栾倍半萜标准品(TCI 公司);正十二烷(天津市文达稀贵试剂化工厂);DNA 凝胶回收试剂盒、质粒小提试剂盒、酵母基因组提取试剂盒和酵母质粒小提试剂盒(天根公司).ALD1244 型PCR 仪(Bio-Rad 公司);HPX-9162 MBE 型电热恒温培养箱(上海博迅实业有限公司医疗设备厂);HNY-2102C 型恒温振荡器(天津市欧诺仪器仪表有限公司);75-6 型紫外-可见分光光度计(天津喀纳斯光学分析仪器有限公司);CAB051 型GC-TOF/MS(Waters 公司).1.2 质粒、菌种和培养基宿主菌E.coli DH5α {endA1,hsdR17,gyrA96,thi-1,relA1,supE44,recA1,△lacU169(80lac,△ZM15)}和酿酒酵母菌株W303-1A(MATa {leu2-3,112 trp1-1,can1-100,ura3-1,ade2-1,his3-11,15})为本实验室保存;酿酒酵母菌株YSG50(MATα{le u2-3,112 trp1-1,can1-100,ura3-1,ade2-1,his3-11,15})由伊利诺伊大学香槟分校赵惠民教授馈赠;酵母表达载体pRS403,pRS304,pRS316 和pRS425 购自ATCC 公司.LB 培养基(10 g/L 胰蛋白胨+5 g/L 酵母提取物+10 g/L NaCl+固体培养基添加1.5%琼脂粉)用于大肠杆菌的培养;YPD 培养基(10 g/L 酵母提取物+20 g/L 胰蛋白胨+20 g/L 葡萄糖+固体培养基添加2%琼脂粉)用于酵母的培养;SC drop-out 培养基(6.7 g/L 无氨基酵母氮源+2 g/L drop-out 混合物+20 g/L 葡萄糖+固体培养基添加2%琼脂粉)用于酵母转化子筛选和培养.1.3 酵母表达载体的构建以W303-1A 基因组为模版扩增基因tHMGR,ERG20 TDH3p 和CYC1t. 分别用ApaI/EcoRI,EcoRI/PstI 和PstI/BamHI 对TDH3p,tHMGR 和CYC1t 进行酶切,先后连入质粒pRS304,得到酵母表达载体pRS304 ∶∶TDH3p-tHMGR-CYC1t. 同样,分别用XbaI/BamHI,BamHI/EcoRI 和EcoRI/ApaI 对TDH3p,ERG20 和CYC1t 进行酶切,先后连入质粒pRS403,得到酵母表达载体pRS403 ∶∶TDH3p-ERG20-CYC1t.以W303-1A 基因组为模板扩增TDH1p 和PGK1t,亚克隆ADS 基因,使用重叠延伸PCR(OE-PCR)[25]的方法构建表达盒TDH1p-ADS-PGK1t,用XhoI/SacI 进行酶切,将表达盒分别连入质粒pRS316 和pRS425,得到酵母表达载体pRS316 ∶∶TDH1p-ADS-PGK1t 和pRS425 ∶∶TDH1p-ADS-PGK1t. 以W303-1A基因组为模板扩增TDH1p,TDH3p,TEF1p,PGK1p,PGK1t 和ERG20,亚克隆ADS 基因,使用酵母体内自组装的方法[26]构建酵母表达载体pRS425 ∶∶TDH1p-ADS-ERG20-PGK1t,pRS425 ∶∶TDH1p-ERG20-ADS-PGK1t,pRS425 ∶∶TDH3p-ERG20-ADS-PGK1t,pRS425 ∶∶TEF1p-ERG20-ADS-PGK1t 和pRS425 ∶∶PGK1p-ERG20-ADS-PGK1t.1.4 青蒿二烯人工合成细胞的构建使用及构建的酵母菌株见表1.Table 1 Yeast strains used in this workNo. Name Description Parent strains SyBE_0013151 W303-1A MATa leu2-3,112 trp1-1 can1-100 ura3-1 ade2-1his3-11,15 SyBE_0013152 YSG50 MATα ade2-1 ade3△22 ura3-1 his3-11,15 trp1-1 leu2-3,112 can1-100 Engineered yeast chassis SyBE_001354W00 tHMGR and ERG20 genes integrated into W303-1A SyBE_001378 Y00 tHMGR and ERG20 genes integrated into YSG50 Artificial cells harboring free enzyme functional modules SyBE_001355 W01 W00 harboringpRS316 ∶∶TDH1p-ADS-PGK1t SyBE_001356 W02 W00 harboringpRS425 ∶∶TDH1p-ADS-PGK1t SyBE_001379 Y01 Y00 harboringpRS316 ∶∶TDH1p-ADS-PGK1t SyBE_001380 Y02 Y00 harboringpRS425 ∶∶TDH1p-ADS-PGK1t Artificial cells harboring fusion enzyme func tional modules SyBE_001357 W03 W00 harboring pRS425 ∶∶TDH1p-ADS-ERG20-PGK1t SyBE_001358 W04 W00 harboring pRS425 ∶∶TDH1p-ERG20-ADS-PGK1t SyBE_001360 W05 W00 harboring pRS425 ∶∶TDH3p-ERG20-ADS-PGK1t SyBE_001362 W06 W00 harboring pRS425 ∶∶TEF1p-ERG20-ADS-PGK1t SyBE_001364 W07 W00 harboring pRS425 ∶∶PGK1p-ERG20-ADS-PGK1t所有酿酒酵母人工细胞的转化均采用醋酸锂转染法[27]. 酵母底盘细胞W00 和Y00 分别通过向W303-1A 和YSG50 中先后转化质粒pRS304 ∶∶TDH3p-tHMGR-CYC1t 和pRS403 ∶∶TDH3p-ERG20-CYC1t得到. 将pRS316 ∶∶TDH1p-ADS-PGK1t 和pRS425 ∶∶TDH1p-ADS-PGK1t 分别导入W00 中,得到人工细胞W01 和W02. 同样将pRS316 ∶∶TDH1p-ADS-PGK1t 和pRS425 ∶∶TDH1p-ADS-PGK1t 分别导入Y00 中,得到人工细胞Y01 和Y02. 将质粒pRS425 ∶∶TDH1p-ADS-ERG20-PGK1t,pRS425 ∶∶TDH1p-ERG20-ADSPGK1t,pRS425 ∶∶TDH3p-ERG20-ADS-PGK1t,pRS425 ∶∶TEF1p-ERG20-ADS-PGK1t 和pRS425 ∶∶PGK1p-ERG20-ADS-PGK1t 分别转化W00,得到人工细胞W03 ~W07. 所有人工细胞均使用SCdrop-out 固体培养基进行筛选,于30 ℃倒置培养2 ~4 d,直到长出重组克隆. 挑取3 ~5 个单克隆接种到SC drop-out液体培养基中,于30 ℃,200 r/min转速培养至饱和. 再以12000 r/min 转速离心1 min,弃去上清液,收集菌体,提取基因组/质粒,通过PCR 检测目的基因的存在,确定阳性克隆.1.5 青蒿二烯人工合成细胞的发酵将筛选正确的阳性克隆接种到5 mL 相应的SC drop-out 液体培养基中,于30 ℃培养24 h,然后转接到50 mL 新鲜的SC drop-out 液体培养基中,初始OD600 为0.05,于30 ℃,200 r/min 转速培养. 培养10 h 后加入2.5 mL 正十二烷覆盖,继续培养72 h. 将发酵液以4000 r/min 转速离心10 min,吸取10 μL 正十二烷层进行GC-TOF/MS 检测.1.6 发酵产物的检测发酵产物参考文献[28]方法采用GC-TOF/MS 进行检测. 色谱条件:DB-5MS 毛细管色谱柱(30 m×0.25 μm×0.25 mm);升温程序:初始温度100 ℃,保持2 min,以5 ℃/min 升至200 ℃,以25 ℃/min 升至250 ℃,保持10 min;进样口温度260 ℃,分流进样(分流比20 ∶1),1 μL;恒压模式91 kPa;色谱-质谱接口温度280 ℃. 质谱条件:EI+电离源;电子能量70 eV;离子源温度250 ℃;溶剂延迟时间5 min;质量扫描方式:全离子扫描;定性离子:m/z 204(青蒿二烯分子)和189([MCH3]+)[8]. 定量方法:使用相同的色谱条件对青蒿二烯的同分异构体朱栾倍半萜[11]的标准溶液(10 ~200 mg/L)进行分析,根据峰面积绘制标准曲线,对青蒿二烯进行定量.2 结果与讨论2.1 酿酒酵母底盘的构建向酿酒酵母菌株W303-1A 和YSG50 中转化质粒pRS304 ∶∶TDH3p-tHMGR-CYC1t 和pRS403 ∶∶TDH3p-ERG20-CYC1t. 提取基因组,通过PCR 检测是否整合tHMGR 及ERG20 基因表达盒,构建的酿酒酵母底盘命名为W00 和Y00. 对酵母底盘的内源MEV 途径进行tHMGR 和ERG20 的过表达,以便为青蒿二烯的合成提供更多的前体FPP. 在酵母中合成萜类物质的研究[6 ~13]表明,提高FPP 的积累对于获得目标产物具有重要意义. HMGR 是酵母MEV 途径中一个关键限速酶并在麦角固醇含量高时受到反馈抑制[29],而过表达截短的HMGR 基因tHMGR 可解除途径中的反馈抑制[30],实现代谢路径的畅通,促进FPP 的积累;过表达ERG20 则能直接促进FPP 的合成,为青蒿二烯的合成提供更多前体. 2.2 酿酒酵母底盘与外源功能模块的适配2.2.1 不同载体所构建功能模块与酵母底盘的适配性向酿酒酵母底盘W00 和Y00 中分别转化质粒pRS316 ∶∶TDH1p-ADS-PGK1t 和pRS425 ∶∶TDH1p-ADS-PGK1t,提取质粒,通过PCR 反应检测,构建的酿酒酵母人工细胞命名为W01,W02,Y01 和Y02(见表1).从合成青蒿二烯的人工细胞中各挑取3 个单克隆进行发酵,对发酵产物进行GC-TOF/MS 检测.从总离子流图[图2(A)]中提取青蒿二烯的质谱特征峰m/z 189 和204,发现在保留时间为12.97 min时同时检测到了这2 种特征峰,表明该组分是青蒿二烯[图2(B)].Fig.2 Production of amorphadiene by artificial cell W02(A)GC-TOF/MS analysis of dodecane phase;(B)mass spectrum of amorphadiene.This strain was cultivated in SC drop-out medium with 2%glucose at 30 ℃,200 r/min for 72 h.Fig.3 Amorphadiene production by artificial cells W01,W02,Y01 and Y02 expressing free enzyme ADSThe strainswere cultivated in SC drop-out medium with 2% glucose at 30 ℃,200 r/min for 72 h. The dodecanephasewas analyzed by GC-TOF/MS to determine the amorphadiene concentration. The error bars represented standard deviation(n=3).根据朱栾倍半萜标准曲线,对酵母人工细胞中的青蒿二烯进行了定量分析. 结果如图3 所示,使用着丝粒载体pRS316 构建的功能模块在底盘Y00 中产量仅为1.8 mg/L,在底盘W00 中产量为3.4 mg/L;而使用附加载体pRS425 构建的功能模块在底盘Y00 中产量为3 mg/L,在底盘W00 中达到11.2 mg/L.可见,青蒿二烯的产量与功能模块的载体类型和底盘细胞有密切关系. 无论使用哪种载体,以W00 作为底盘的人工细胞(W01/W02)产量均高于以Y00 作为底盘的人工细胞(Y01/Y02)产量. 这表明,酵母菌的遗传背景对目标产物的合成有一定影响[17]. 本研究中所使用的酵母底盘W00 更适于合成青蒿二烯. 此外,在2 种底盘细胞中,包含着丝粒载体的人工细胞产量均低于包含附加型载体的人工细胞产量,可见在ADS 的表达中,由附加型载体构建的外源功能模块与酵母底盘的适配性更好. 着丝粒的拷贝数在培养过程中稳定为1[31];而附加型载体pRS425 的拷贝数约为5 ~30[32],但是可能会由于培养环境的压力及菌株内部代谢不通畅等多种因素而有不同程度的降低[5]. 本研究中包含附加型载体的人工细胞产量虽然比着丝粒型高,但产量差异并未达到拷贝数比例之大,可见其拷贝数多的优势并未全部体现. 这可能是由于代谢不通畅,或底盘细胞受到来自代谢物的毒害、压力等,导致附加型载体的人工细胞中ADS 并未表达到最高水平或者培养过程中质粒拷贝数下降. 可见,附加型载体与底盘细胞之间的适配尚未达到最佳. 综上,选择适配性较好的W00 及pRS425 作为底盘细胞及表达载体以进行进一步的优化.2.2.2 通过融合表达优化外源模块提高适配性向酿酒酵母底盘W00 中分别转化质粒pRS425 ∶∶TDH1p-ADS-ERG20-PGK1t 和pRS425 ∶∶TDH1p-ERG20-ADS-PGK1t,经PCR 验证得到人工细胞W03 和W04(见表1). 经GC-TOF/MS检测,结果见图4.Fig.4 Protein fusion improved amorphadiene productionThe strains were cultivated in SC drop-out medium with 2% glucose at 30 ℃,200 r/min for 72 h. The dodecane phase was analyzed by GC-TOF/MS to determine the amorphadiene concentration. The error bars represented standard deviation(n=3).与单独表达ADS 的人工细胞W02 相比,使用相同启动子TDH1p 调控的融合蛋白(ADS-ERG20和ERG20-ADS)功能模块构建的人工细胞W03 和W04 中青蒿二烯产量分别达到15.8 和17.5 mg/L,是W02 产量的1.4 倍和1.5 倍. 可见,融合蛋白功能模块的应用提高了青蒿二烯的产量. 迄今,利用融合蛋白提高目标物质产量在萜类物质合成中也有较多应用. Zhou 等[23]将BTS1 与ERG20 融合后,将FPP 更多地引入了GGPP 合成路径,进而提升了目标产物次丹参二烯的产量. 本研究中融合蛋白ADS-ERG20 和ERG20-ADS 提升青蒿二烯产量的原因可能在于融合蛋白中ERG20 和ADS 活性位点的邻近效应:通过调节相邻反应催化酶ERG20 和ADS 的空间位置,可以缩短FPP 的运输时间,提高ADS 周围FPP 的浓度,从而加速FPP 向青蒿二烯的转化,减少扩散、降解及流入其它竞争途径(如鲨烯合成途径等)的FPP. 此外,研究[9,21,23]表明,两种蛋白的前后顺序可能会导致催化效力的不同. 显著性分析结果表明,本研究中两种融合方式的效果差异不显著(P=0.25>0.05). 这可能是因为对于ERG20 和ADS 两种酶而言,融合前后并不会对其空间上活性中心位点的距离造成太大影响. 因此,随机选用融合蛋白ERG20-ADS 进行后续研究.Fig.5 Promoter engineering improved amorphadiene productionThe strains were cultivated in SC drop-out medium with 2% glucose at 30 ℃,200 r/min for 72 h. The dodecane phase was analyzed by GC-TOF/MS to determine the amorphadiene concentration. The error bars representedstandard deviation(n=3).2.2.3 通过启动子替换优化融合蛋白功能模块提高适配性向酿酒酵母底盘W00 中分别转化质粒pRS425 ∶∶TDH3p-ERG20-ADS-PGK1t,pRS425 ∶∶TEF1p-ERG20-ADS-PGK1t 和pRS425 ∶∶PGK1p-ERG20-ADS-PGK1t,经PCR 验证得到人工细胞W05 ~W07(见表1). 发酵结果(图5)表明,通过更换不同强度的启动子,青蒿二烯产量得到了进一步提高. 其中,由PGK1p 调控的功能模块所构建的人工细胞W07中青蒿二烯产量达到了71.8 mg/L,是由TDH1p 调控的功能模块所构建的人工细胞W04 产量的4.1倍. 可见,外源模块中启动子的调控对于青蒿二烯的合成同样具有重要作用. 在Partow 等[4]的研究中,启动子TEF1p,TDH3p 和PGK1p 在发酵培养基中葡萄糖尚未耗尽时的调控强度大体相同,而葡萄糖耗尽时TEF1p 的调控强度最大. Fang 等[5]研究发现,TEF1p 的强度略高于PGK1p. 在Sun 等[24]的研究中,启动子强度为TEF1p >TDH3p(GPDp)>PGK1p,PGK1p 仅为中强启动子. 本研究中,启动子PGK1p 所调控的功能模块与底盘细胞W00 的适配性最佳,青蒿二烯产量最高. 可见,在不同培养条件及不同表达体系中,并非选用调控强度越大的启动子效果就越好,这与由不同启动子组成的外源功能模块与底盘细胞的适配程度、目标产物的差异等相关. 合适的启动子的选择对外源功能模块的功能发挥至关重要,有利于功能模块与底盘细胞的适配,进而提升目标物质的产量. 本研究中,强度最大的启动子TEF1p 并不及比它弱的启动子PGK1p所调控的功能模块在底盘细胞中的产量,后者与底盘细胞适配性更佳,更利于青蒿二烯的合成. 因此,在以后的研究中,应在参考前人研究成果的基础上,针对具体的表达体系进行多种启动子调控的功能模块与底盘细胞适配关系的尝试,以期达到外源功能模块与底盘细胞的更优适配.综上,通过对外源功能模块中载体、蛋白表达和启动子的优化,提高了功能模块与底盘细胞的适配性. 最终,在启动子PGK1p 调控下的融合蛋白(ERG20-ADS)功能模块与a 型酵母底盘W00 适配性最佳,得到了最高产量为71.8 mg/L 的酿酒酵母人工细胞. 外源模块与底盘细胞的适配性是青蒿二烯及其它萜类物质在酵母底盘中产量的重要因素,其适配性也与多种因素相关,单一或孤立的调控不一定能实现最终产量的提高,需要对多种因素进行优化,彼此适配,才能达到代谢流通畅、进一步提升产量的目的. 在今后的研究中,需要深层次地挖掘造成各种差异的机理以及各因素间的关系网络,从而实现更加理性、高效的实验设计.参考文献【相关文献】[1] Liu D.,Du J.,Zhao G. R.,Yuan Y. J.,CIESC Journal,2011,62(9),2391—2397(刘夺,杜瑾,赵广荣,元英进. 化工学报,2011,62(9),2391—2397)[2] Martin V. J.,Pitera D. J.,Withers S. T.,Newman J. D.,Keasling J. D.,Nat. Biotechnol.,2003,21(7),796—802[3] Babiskin A. H.,Smolke C. D.,Mol. Syst. Biol.,2011,7,471[4] Partow S.,Siewers V.,Bjorn S.,Nielsen J.,Maury J.,Yeast,2010,27(11),955—964[5] Fang F.,Salmon K.,Shen M. W.,Aeling K. A.,Ito E.,Irwin B.,Tran U. P.,Hatfield G. W.,Da S. N.,Sandmeyer S.,Yeast,2011,28(2),123—136[6] Westfall P. J.,Pitera D. J.,Lenihan J. R.,Eng D.,Woolard F. X.,Regentin R.,Horning T.,Tsuruta H.,Melis D. J.,Owens A.,Fickes S.,Diola D.,Benjamin K. R.,Keasling J. D.,Leavell M. D.,McPhee D. J.,Renninger N. S.,Newman J. D.,Paddon C. J.,Proc. Natl. Acad. Sci.,2012,109(3),E111—E118[7] Ro D. K.,Paradise E. M.,Ouellet M.,Fisher K. J.,Newman K. L.,Ndungu J. M.,Ho K. A.,Eachus R. A.,Ham T. S.,Kirby J.,Chang M. C.,Withers S. T.,Shiba Y.,Sarpong R.,Keasling J. D.,Nature,2006,440(7086),940—943[8] Paradise E. M.,Kirby J.,Chan R.,Keasling J. D.,Biotechnol. Bioeng.,2008,100(2),371—378[9] Albertsen L.,Chen Y.,Bach L. S.,Rattleff S.,Maury J.,Brix S.,Nielsen J.,Mortensen U. H.,Appl. Environ. Microbiol.,2011,77(3),1033—1040[10] Asadollahi M. A.,Maury J.,Schalk M.,Clark A.,Nielsen J.,Biotechnol. Bioeng.,2010,106(1),86—96[11] Kong J. Q.,Cheng K. D.,Wang L. N.,Zheng X. D.,Dai J. G.,Zhu P.,Wang W.,Acta Pharm. Sin.,2007,42(12),1314—1319(孔建强,程克棣,王丽娜,郑晓东,戴均贵,朱平,王伟. 药学学报,2007,42(12),1314—1319)[12] Engels B.,Dahm P.,Jennewein S.,Metab. Eng.,2008,10(3/4),201—206 [13] Rico J.,Pardo E.,Orejas M.,Appl. Environ. Microbiol.,2010,76(19),6449—6454[14] Tokuhiro K.,Muramatsu M.,Ohto C.,Kawaguchi T.,Obata S.,Muramoto N.,Hirai M.,Takahashi H.,Kondo A.,Sakuradani E.,Shimizu S.,Appl. Environ. Microbiol.,2009,75(17),5536—5543[15] Verwaal R.,Wang J.,Meijnen J. P.,Visser H.,Sandmann G.,van den Berg J. A.,van Ooyen A. J.,Appl. Environ. Microbiol.,2007,73(13),4342—4350[16] Kong J. Q.,Wang W.,Wang L. N.,Zheng X. D.,Cheng K. D.,Zhu P.,J. Appl. Microbiol.,2009,106(3),941—951[17] Jackson B. E.,Hart-Wells E. A.,Matsuda S. P.,Org. Lett.,2003,5(10),1629—1632[18] Keasling J. D.,Metab. Eng.,2012,14(3),189—195[19] Conrado R. J.,Varner J. D.,Delisa M. P.,Curr. Opin. Biotechnol.,2008,19(5),492—499[20] Jrgensen K.,Rasmussen A.V.,Morant M.,Nielsen A.H.,Bjarnholt N.,Zagrobelny M.,Bak S.,Mller B.L.,Curr. Opin. Plant Biol.,2005,8(3),280—291[21] Ohto C.,Muramatsu M.,Obata S.,Sakuradani E.,Shimizu S.,Appl. Microbiol. Biotechnol.,2010,87(4),1327—1334[22] Dai Z.,Liu Y.,Huang L.,Zhang X.,Biotechnol. Bioeng.,2012,109(11),2845—2853[23] Zhou Y. J.,Gao W.,Rong Q.,Jin G.,Chu H.,Liu W.,Yang W.,Zhu Z.,Li G.,Zhu G.,Huang L.,Zhao Z. K.,J. Am.Chem. Soc.,2012,134(6),3234—3241[24] Sun J.,Shao Z.,Zhao H.,Nair N.,Wen F.,Xu J. H.,Zhao H.,Biotechnol. Bioeng.,2012,109(8),2082—2092[25] Ho S. N.,Hunt H. D.,Horton R. M.,Pullen J. K.,Pease L. R.,Gene,1989,77(1),51—59[26] Shao Z.,Zhao H.,Zhao H.,Nucleic Acids Res.,2009,37(2),e16[27] Gietz R. D.,Woods R. A.,Methods Enzymol.,2002,350,87—96[28] Lindahl A. L.,Olsson M. E.,Mercke P.,Tollbom O.,Schelin J.,Brodelius M.,Brodelius P. E.,Biotechnol. Lett.,2006,28(8),571—580[29] Dimster-Denk D.,Thorsness M. K.,Rine J.,Mol. Biol. Cell.,1994,5(6),655—665[30] Donald K. A.,Hampton R. Y.,Fritz I. B.,Appl. Environ. Microbiol.,1997,63(9),3341—3344[31] Parent S. A.,Fenimore C. M.,Bostian K. A.,Yeast,1985,1(2),83—138 [32] Mumberg D.,Muller R.,Funk M.,Nucleic Acids Res.,1994,22(25),5767—5768。
青蒿素的生物合成与代谢途径

青蒿素的生物合成与代谢途径青蒿素作为一种重要的抗疟药物,经过几十年的不断研究和应用已经取得了许多突破性的成果。
然而,许多人对于青蒿素的生物合成和代谢途径并不熟悉。
下面就让我们来一起探究一下青蒿素的生物合成和代谢过程。
一、青蒿素的生物合成青蒿素是一种大环内酯类化合物,由多种化学物质经过多步酶催化转化而来。
在青蒿素的合成中,最重要的当属艾滋病疗法药物的前体物质艾洛菲莫的生物合成。
艾洛菲莫最初是由邻苯二甲酸和丙二酸合成,经过一系列酶的催化反应后转化为青蒿酸。
青蒿酸在自身广泛存在的CYP家族酶的帮助下,转化为青蒿素,并被细胞返回到青蒿素的细胞数中储存起来。
在体内,青蒿素的生物合成受到许多因素的影响,如光照、日夜节律以及病原体的侵袭等。
二、青蒿素的代谢途径青蒿素代谢途径主要包括肝脏代谢和肠道代谢两个过程。
青蒿素在进入人体后,会在肝脏中被CYP450酶家族代谢。
这些酶通过氧化、还原和水解等反应将青蒿素代谢成更易于排泄的代谢产物。
另外,肠道微生物群中的某些细菌也可以通过羟化和磺酸化等反应来代谢青蒿素。
这些代谢产物通过肝脏和肾脏进入血液循环并排出体外。
值得注意的是,在青蒿素的代谢过程中,还涉及到一些代谢酶的物种差异。
例如,在人体中,青蒿素主要被CYP450酶家族代谢,而在老鼠和犬中,则主要依赖于UDP-葡糖醛酸转移酶代谢。
这些差异可能与物种的代谢酶谱有关,需要进一步研究。
三、青蒿素的作用机制青蒿素最初用于治疗疟疾,后经发现还具有许多其他的生物活性。
青蒿素的作用机制主要涉及到靶向线粒体、膜和蛋白质等多个生物过程。
青蒿素可以通过与铁离子结合并进入细胞内,与线粒体蛋白质作用从而杀死寄生生物。
同时,青蒿素还可以通过改变细胞膜的物理和化学性质,影响细胞的功能状态。
此外,青蒿素还可以阻断DNA复制、RNA转录以及蛋白质合成等生物过程,从而发挥药物的效果。
总之,青蒿素的生物合成和代谢途径是一项非常复杂的研究课题。
通过深入的研究,我们可以更好地了解青蒿素的化学特性和药理学作用,从而更加有效地应用这种药物来治疗疟疾和其他疾病。
青蒿素类化合物的合成及其生物活性研究

青蒿素类化合物的合成及其生物活性研究青蒿素,是一种来自植物青蒿中的天然产物,具有治疗疟疾的功效。
在20世纪70年代,中国科学家屠呦呦首次从中提取出青蒿素,为疟疾的治疗开辟了新的途径。
随着近年来药物研究的深入,青蒿素及其衍生物也引起了越来越多的关注,成为治疗多种疾病的前沿研究领域之一。
本文主要介绍青蒿素类化合物的合成及其生物活性研究。
青蒿素类化合物的合成研究青蒿素的药效作用是由其含有的内酯环、大环和过渡金属等多种结构单元共同作用所致。
由于青蒿素的天然来源极为有限,因此合成青蒿素类化合物成为了研究的焦点之一。
近年来,科学家们在合成青蒿素及其衍生物方面取得了重大进展。
1.1 外消旋青蒿素的不对称合成研究外消旋青蒿素是一种含有两个手性中心的化合物,如何实现其对映异构体的选择合成是一个难点。
研究表明,通过使用手性催化剂或手性辅助剂等手段,可以实现对青蒿素对映异构体的选择合成。
例如,有学者使用氨基醇作为手性辅助剂,在对应的氧化反应中合成了具有高对映选择性的青蒿素衍生物。
1.2 单端基的青蒿素类化合物的合成研究单端基的青蒿素衍生物通常指在中环上引入一个含有反式-亲核芳香取代反应活性的单端基基团。
其主要药理作用也是通过识别阴性药物靶标来发挥作用。
近年来,研究显示,使用磺酰胺基团或其他亲核基团可以有效引入单端基,实现对青蒿素类化合物的不对称合成。
青蒿素类化合物的生物活性研究青蒿素及其衍生物不仅具有治疗疟疾的功效,还可以用于治疗多种疾病,如艾滋病、癌症、系统性红斑狼疮等。
下面我们将介绍青蒿素类化合物在不同领域中的生物活性研究进展。
2.1 抗癌作用青蒿素类化合物在抗癌领域中的应用研究非常广泛。
研究表明,青蒿素类化合物具有广谱的抗肿瘤效应,可以抑制多种癌细胞的生长和增殖。
此外,青蒿素类化合物还可通过诱导癌细胞凋亡、调节基因表达和代谢等多种方式发挥作用。
2.2 免疫抗病毒作用青蒿素及其衍生物在治疗艾滋病等病毒感染方面也具有较好的疗效。
酵母文库构建原理

酵母文库构建原理
酵母文库构建原理是指利用酵母作为表达载体构建基因文库的方法。
酵母文库是由数百万个基因克隆所组成的DNA资源库,可以用来研究基因功能、蛋白质相互作用等生物学问题。
酵母文库的构建过程包括以下几个步骤:
1. 酵母基因组DNA的提取和片段化:从酵母细胞中提取总DNA 并用限制酶酶切,获得大小为数千到数万碱基对的DNA片段。
2. DNA片段的连接到载体上:将上述DNA片段与载体(如质粒或噬菌体)上的兼容酶切位点配对后用DNA连接酶连接,形成重组DNA分子。
3. 重组DNA分子的转化到酵母细胞中:将上述重组DNA分子转化到酵母细胞中,使其在细胞内复制并表达。
4. 筛选目标基因:通过筛选、鉴定,找到目标基因的克隆,进而研究其功能和调节机制。
总之,酵母文库构建原理充分利用了酵母细胞在基因工程中的独特优势,为研究基因功能、蛋白质相互作用等提供了有效的手段。
- 1 -。
青蒿素的合成生物学研究进展

青蒿素的合成生物学研究进展一、本文概述青蒿素,源自菊科植物青蒿(Artemisia annua L.),是一种具有显著抗疟活性的天然产物,自20世纪70年代被发现以来,已成为全球抗击疟疾的重要武器。
然而,青蒿素的天然来源有限,化学合成成本高昂,且存在环境污染等问题,这使得青蒿素的可持续供应面临挑战。
近年来,随着合成生物学的发展,利用合成生物学方法生产青蒿素成为研究热点。
本文将对青蒿素的合成生物学研究进展进行全面概述,探讨如何利用合成生物学技术提高青蒿素的产量、优化生产过程,以及面临的挑战和未来的发展方向。
本文首先回顾了青蒿素的研究历程和其在全球抗击疟疾中的作用,指出合成生物学在青蒿素生产中的潜在价值和重要性。
随后,综述了目前青蒿素合成生物学研究的主要成果,包括青蒿素生物合成途径的解析、关键酶的发现与改造、以及基于代谢工程的青蒿素高产菌株的构建等。
在此基础上,讨论了合成生物学方法在青蒿素生产中的优势与挑战,如提高青蒿素产量的同时保持其生物活性、优化生产过程的可持续性、以及降低生产成本等。
展望了青蒿素合成生物学研究的未来发展方向,包括利用新兴技术如CRISPR-Cas9基因编辑系统、合成基因组学等进一步提高青蒿素产量和质量,以及推动青蒿素合成生物学技术的产业化应用。
二、青蒿素生物合成途径解析青蒿素是一种具有高效抗疟活性的天然产物,其独特的化学结构和强大的生物活性使其成为全球公共卫生领域关注的焦点。
为了深入理解青蒿素的生物合成机制并进一步提高其产量,科学家们对青蒿素的生物合成途径进行了详尽的解析。
青蒿素的生物合成起始于异戊烯基焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP),这两个分子在甲羟戊酸途径(MVA途径)或2-C-甲基-D-赤藓糖醇4-磷酸途径(MEP途径)中生成。
随后,通过一系列酶促反应,包括预青蒿酸合成酶、青蒿酸合成酶和青蒿素合成酶等,逐步转化为青蒿素的前体物质青蒿酸。
青蒿酸经过青蒿素合成酶的催化,形成青蒿素。
高中生物高考热点微练29 PCR技术的应用

热点微练29 PCR 技术的应用(时间:15分钟)1.(2021·江西南昌四校联考)2019年6月17日,新华社报道了屠呦呦及其团队经过多年攻坚,在“抗疟机理研究”“抗药性成因”“调整治疗手段”等方面取得新突破。
之后屠呦呦团队提出应对“青蒿素抗药性”难题的切实可行的治疗方案。
某课题组为得到青蒿素产量高的新品系,让青蒿素合成过程的某一关键酶基因fps 在野生青蒿中过量表达,其过程如图:⎭⎬⎫提取青蒿素总RNA ――→酶1cDNA ――→PCR 含fps 基因的DNA 片段――→酶2 质粒a ――→酶2――→混合酶3重组质粒――→农杆菌青蒿回答下列问题:(1)图中酶1是 ,酶2是 。
利用PCR 技术扩增目的基因时,使反应体系中的模板DNA 解链为单链的条件是加热至90~95 ℃,目的是破坏DNA 分子中的 键。
在构建重组Ti 质粒的过程中,需将目的基因插入Ti 质粒的 。
(2)检验目的基因是否整合到青蒿基因组,可以将放射性同位素标记的 制成基因探针,与青蒿基因组DNA 杂交。
理论上,与野生青蒿相比,该探针与转基因青蒿DNA 形成的杂交带的量 (填“较多”或“较少”)。
(3)据图分析,农杆菌的作用是 。
为准确判断该课题组的研究目的是否达到,必须检测转基因青蒿植株中的 。
答案 (1)逆转录酶 限制酶 氢 T -DNA (2)fps 基因 较多 (3)感染植物,将目的基因转移到受体细胞中 青蒿素产量解析 (1)据图示可知,酶1促进逆转录的过程,故为逆转录酶,酶2用于切割目的基因和质粒,故为限制性内切核酸酶(限制酶)。
利用PCR 技术扩增目的基因时,使反应体系中的模板DNA 解链为单链的条件是加热至90~95 ℃,目的是破坏DNA 分子中的氢键。
构建重组Ti 质粒的过程中,需将目的基因插入Ti 质粒的T -DNA 。
(2)检验目的基因是否整合到青蒿基因组,可用DNA 分子杂交法,即将fps 基因制成基因探针,与青蒿基因组DNA 杂交。
合成生物学及青蒿素合成
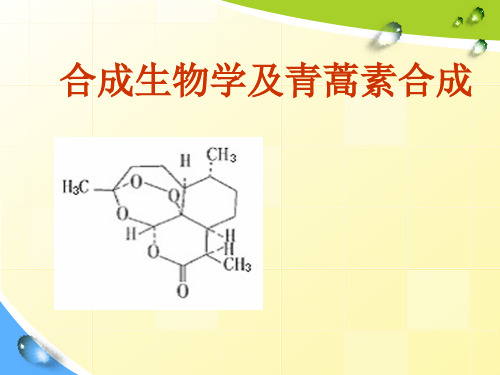
•通过植物青蒿的amorphadiene 合成酶( ADS)密码 子优化、共表达SOE4 操纵子( 编码DXS、IPPHp 、 IspA) 以及引入异源的酵母菌甲羟戊酸途径等途径, 提高了amorphadiene 的产量。对于酵母菌, 主要 工作包括改造FPP 合成途径,引入植物青蒿的 amorphadiene 合成酶( ADS)基因, 克隆青蒿类植 物转化amorphadiene 为青蒿酸的细胞色素P450 氧化还原酶等。
16
美国科学家合成青蒿素的前体物质青蒿酸美国加利福尼亚大学伯克利分校化学工程学的教授jaykeasling及其同事最近成功地用转基因酵母合成了青蒿素的前体物质青蒿酸有望大幅增加青蒿素产量有关论文发表在自然杂microbialproductionartemisininusingsyntheticbiology?通过植物青蒿的amorphadiene合成酶ads密码子优化共表达soe4操纵子编码dxsipphpispa以及引入异源的酵母菌甲羟戊酸途径等途径提高了amorphadiene的产量
• 不过现在,将会有一些新成员加入到这个 生物大家族。在过去这些年里,科学家一 直在尝试从零开始制造全新的生命形式— —用化学物质造出合成DNA(脱氧核糖 核酸),由DNA合成基因,再由基因形 成基因组,最终在实验室造出全新生物体 的分子系统,而这种生物体在自然界从未 出现过。
由基因工程到合成生物学
Tools
Registries Synthesis
Measurement
➢标准化 ➢底盘机架
合成生物学的学科基础与应用范围
生物
生物 质 能 计算机
生物传 感器
应用
生物材料
精细 化学品
环境修复
食品 原料
青蒿素的生物合成

青蒿素的生物合成
周衍庆 2011304110081
主要内容
1 2 3 4
青蒿素的介绍 青蒿素的生物合成 关键酶 调控和展望
青蒿素Artemisinin
定义:从中药黄花蒿中提取的一种抗疟有效成分,
具有抗白血病和免疫调节功能。
分子式:C15H22O5 分子量:282.33
3)组和生物合成:组合生物合成是指将不同生物体来源的基
Company Logo
生物合成途径
青蒿素的生物合成途径 属于植物类异戊二烯代 谢途径。植物类异戊二 烯的生物合成至少存在 2条途径,即甲羟戊酸酸 途径(MVA) 和丙酮酸/ 磷酸甘油醛途径(DXP) 青蒿素等倍半萜类的生 物合成途径属于MVA途 径,该途径在细胞质中 进行。
Company Logo
展望和挑战
展望: 青蒿素的生物合成研究是增加青蒿素供给的重要手段。近 年来,随着分子生物学技术的迅速发展和对青蒿素生物合 成途径认识的不断深入。青蒿素生物合成途径的重要关键 酶紫穗槐-4,11-二烯合酶的基因已被几个实验室克隆,已 进行了功能分析,并在烟草中得到表达。另外,青蒿中的 鲨烯合酶基因和紫穗槐-4,11-二烯合酶以外的几种倍半萜 合酶基因已经被克隆。使得通过基因工程方法获得青蒿素 高产株系成为该研究领域新的热点。 挑战: 青蒿酸向青蒿素转化的机制;优化植物基因在微生物体内 表达。
ADS
法尼基焦磷酸(FPP)
紫穗槐-4,11-二烯 (amorpha-4,11-diene)
Company Logo
HMGR
3-羟基-3-甲基戊二酰CoA还原酶(HMGR)
HNGR催化HMG-CoA形成甲羟戊酸(MVA),由于MVA形成是不可 逆的,因此HMGR被认为是动物植物的类异戊二烯代谢途径的一个限 速酶。 以后的进一步研究表明,HMGR相关存在着一类基因 家族,在这个基因家族中,不同同源基因的表达,可 能控制着细胞质中甲羟戊酸代谢途径中“碳流”的向 , HMGR2亚家族的成员表达与倍半萜类物质的合成密切 相关 。作为甲羟戊酸代谢途径的早期酶类,它决定“碳流” 的流向,而各支路中最终产物的合成却受到各支路中其它
