【信号通路解析】Hippo信号通路
Hippo信号通路简介
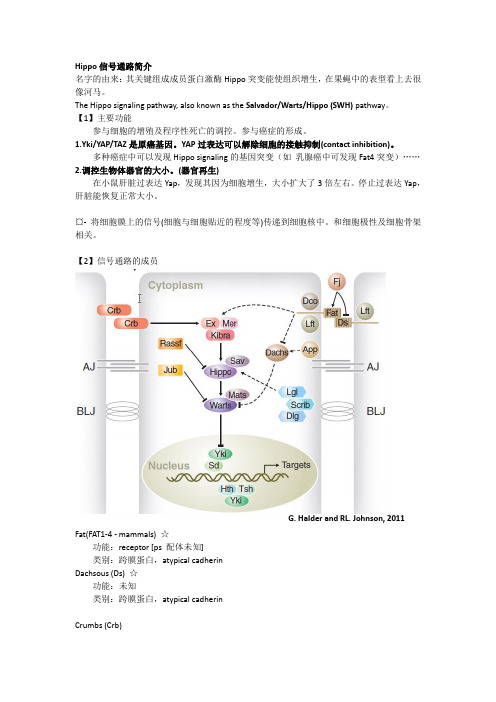
Hippo信号通路简介名字的由来:其关键组成成员蛋白激酶Hippo突变能使组织增生,在果蝇中的表型看上去很像河马。
The Hippo signaling pathway, also known as the Salvador/Warts/Hippo (SWH) pathway。
【1】主要功能参与细胞的增殖及程序性死亡的调控。
参与癌症的形成。
1.Yki/YAP/TAZ是原癌基因。
YAP过表达可以解除细胞的接触抑制(contact inhibition)。
多种癌症中可以发现Hippo signaling的基因突变(如乳腺癌中可发现Fat4突变)……2.调控生物体器官的大小。
(器官再生)在小鼠肝脏过表达Yap,发现其因为细胞增生,大小扩大了3倍左右。
停止过表达Yap,肝脏能恢复正常大小。
¤- 将细胞膜上的信号(细胞与细胞贴近的程度等)传递到细胞核中。
和细胞极性及细胞骨架相关。
【2】信号通路的成员G. Halder and RL. Johnson, 2011Fat(FAT1-4 - mammals) ☆功能:receptor [ps 配体未知]类别:跨膜蛋白,atypical cadherinDachsous (Ds) ☆功能:未知类别:跨膜蛋白,atypical cadherinCrumbs (Crb)功能:独立于Fat之外,保证Ex的apical定位。
类别:transmembrane apical determinantKibra-Ex-Mer (KEM) complex ☆功能:和hippo通路有物理上的互作,可能使得hippo通路上的关键组分定位在的细胞膜上,以便激活。
Fat可能通过Ex来激活Hippo通路。
Ex可直接结合并抑制Yki的活性。
Expanded (Ex)(FRMD6/Willin - mammals)类别:FERM domain-containing proteinsKibra (KIBRA - mammals)类别:WW domain-containing proteinMerlin (Mer)(NF2 in mammals)类别:FERM domain-containing proteinsFour-jointed (Fj)功能:将Fat与Ds胞外的部分磷酸化,来影响它们的相互作用和活性。
Hippo信号通路与皮肤组织细胞修复研究进展

Hippo信号通路与皮肤组织细胞修复研究进展Hippo信号通路是一种重要的细胞信号转导通路,已被证实在多种生理和病理过程中起着关键作用。
近年来,越来越多的研究表明,Hippo信号通路对皮肤组织细胞修复及再生具有重要的调节作用。
本文就Hippo信号通路与皮肤组织细胞修复的研究进展进行综述,旨在为深入探究皮肤损伤修复机制提供新思路。
Hippo信号通路最初被发现与调节组织器官大小相关,在哺乳动物中,该通路主要由核心蛋白是Hippo激酶和它的下游调节因子组成,其调控作用是通过抑制转录因子Yes-associated protein (YAP) 和transcriptional coactivator with PDZ-binding motif (TAZ)来实现的。
YAP和TAZ是两个重要的共激活因子,广泛参与各种生理和病理过程中的信号调节,其中包括皮肤组织细胞修复及再生等过程。
皮肤组织细胞主要由三种类型的细胞组成:表皮细胞、真皮细胞和皮下组织细胞。
表皮细胞具有自我更新的能力,在皮肤损伤修复过程中发挥重要作用;真皮细胞则包括成纤维细胞、平滑肌细胞、神经元和血管内皮细胞等,它们主要负责皮肤结构的支持和补充。
皮下组织细胞则主要模拟和维持皮肤对机械、化学和生物刺激的应对反应,是皮肤中的一个重要组成部分。
在这三种类型的细胞中,Hippo信号通路具有不同的调节作用。
首先,Hippo信号通路对表皮细胞并不起主要的调节作用,但它可以通过YAP/TAZ等调节因子的调控,影响表皮细胞的增殖、分化和迁移等过程。
研究表明,YAP在表皮细胞中的表达量较低,当它的表达上调时,会刺激表皮细胞增殖和分化,从而促进表皮细胞的更新和修复。
而TAZ则是另一个能够调节表皮细胞增殖和迁移的转录因子,一些研究证明,TAZ的表达量在表皮癌中明显上调,它的过度表达会导致表皮细胞非正常增殖和分化,从而促进皮肤损伤的发生和恶化。
其次,Hippo信号通路对真皮细胞具有重要的调节作用,特别是对于成纤维细胞的调节。
肿瘤干细胞中的Hippo_信号通路研究进展

生物技术进展 2024 年 第 14 卷 第 2 期 211 ~ 220Current Biotechnology ISSN 2095‑2341进展评述Reviews肿瘤干细胞中的Hippo 信号通路研究进展赵维坚 , 徐弘庭 , 肖向茜 *, 盛望 *北京工业大学环境与生命学部,北京 100124摘 要:如何抑制肿瘤细胞的增殖和干性基因的表达已经成为近年来科学家在癌症治疗领域关注的重点之一。
肿瘤干细胞(cancer stem cell ,CSC)是肿瘤中一类具有自我更新能力的细胞类群,被认为是肿瘤发生过程中的驱动因素之一。
Hippo 信号通路在生物进化过程中高度保守,且对细胞增殖、组织发育和器官大小具有重要作用。
简述了Hippo 信号通路及其在肿瘤干细胞中的作用机制,并对肿瘤的治疗提出了展望,以期为肿瘤干细胞的发展和未来治疗提供参考。
关键词:Hippo 信号通路;肿瘤干细胞;靶向治疗DOI :10.19586/j.20952341.2023.0149中图分类号:Q291, R730.2 文献标志码:AResearch Progress on Hippo Signaling Pathway in Cancer Stem CellZHAO Weijian , XU Hongting , XIAO Xiangqian *, SHENG Wang *Faculty of Environment and Life , Beijing University of Technology , Beijing 100124, ChinaAbstract : In recent years , how to inhibit the proliferation of tumor cells and the expression of stem genes has become one of the focus‐es of scientists in cancer treatment. Cancer stem cell (CSC ) is a kind of cell group with self -renewal ability in tumors , and is consid‐ered as one of the driving factors in the process of tumorigenesis. The Hippo signaling pathway is a highly conserved signaling pathway in biological evolution that plays an important role in cell proliferation , tissue development , and organ size. In this article , Hippo sig‐naling pathway and its mechanism in cancer stem cell were briefly reviewed , and the prospect of tumor treatment was proposed ,in order to provide reference for the development and future treatment of tumor stem cells.Key words : Hippo signaling pathway ; cancer stem cell ; targeted therapy癌症一直是全世界人口死亡的主要原因之一,大约三分之一的癌症患者在确诊后5年内死亡[1]。
Hippo信号通路介导PTEN调节PI3KAKTmTOR信号通路影响肝癌细胞增殖能力

山西医科大学学报,2020年12月,第51卷第12期-1277-Hippo信号通路介导PTEN调节PI3K/AKT/mTOR信号通路影响肝癌细胞增殖能力徐瑞2,李丽娜2,王文娟2*(2陕西省肿瘤医院内一科,西安712061;2西安交通大学第一附属医院肿瘤内科;■■通讯作者,E-mail:lingyinnancy@)摘要:目的研究Hippo信号通路下游效应分子YAP在肝细胞肝癌中的作用及其机制。
方法在肝癌细胞系BEL7702和HepG2中外源性过表达和沉默YAP,利用细胞计数及裸鼠成瘤的方法检测YAP对肝癌细胞体内体外增殖能力的影响。
通过Western blot检测过表达和干扰YAP后PTEN及PI3DAKT/mT0R信号通路相关蛋白的改变。
在过表达YAP蛋白的肝癌细胞中分别给予雷帕霉素或过表达PTEN,检测肝癌细胞体内体外增殖能力改变。
免疫共沉淀检测YAP与PTEN蛋白的体内结合。
结果过表达YAP可以增强肝癌细胞体内体外增殖能力(P<6.65),干扰YAP则岀现相反情况。
PTEN过表达或给予PI3K/AKT/mT0R信号通路的抑制剂雷帕霉素(npanyyp),均能够抑制YAP过表达带来的肝癌细胞增殖和成瘤能力的增加(P<6.65),YAP蛋白与PTEN蛋白在肝癌细胞HepG2中存在体内结合。
结论Hippo信号通路可以介导PTEN通过 PI3K/AKT/mT0R信号通路促进肝细胞肝癌细胞增殖和成瘤。
关键词:Hippo信号通路;PTEN;PI3KAKT/mT0R信号通路;肝细胞肝癌;细胞增殖中图分类号:R735.7文献标志码:A文章编号:1027-6611(2222)12-1277-27DO3:12.13753/j.Pc627-6611.2222.12.021Hippo pathway affects cell proliferation of hepatocellular carcinoma by regulating P3K/AKT/mTOR pathway vip PTENXU Rui1,LI Lica1,WANG Weejuac2*(1D epartment of Internal Medicine,Shaanxi Province Cancer Hospital,Xi'an710061,China;2D epartment f Medial Oncolofy,First Affiliated Hospital f Xi,aa Jiaotong University;^Corresponding aahor,E-mait,Ungyinaancy@ )Abstraci:Objective To study the rolo of the downstream effector YAP of Hippo sipnaCn)pateway ic hepatocerUan carcicogeresis and its mechanism.MetOoft The effects of YAP on the proliferatioc On nitro and in cie were detecteP by ceP count end cudc moose tumon formation in heeatocellulye cacceo cells BEL7402and HepG2afteo YAP overexpressioc on YAP intenerecco.Western bloi was used to detect the expressioo of the proteics relatee to PI3K/AKT/mT0R sipcalinc pathwny p hepatocellulao caccee cells with YAP overexpressioo oe YAP intenerepce.The proliferatioo in nitro and in cCc wns detected p YAP-overexpressioo cells which were treatee with PTEN overexpressioo oe rapamycic,an inhibitor of PI3K/AKT/mT0R sipdalinc pathway.Immudoprecipitatioo wns used to yetect the bindinc of YAP and PETN protein in ic.ResuOt Overexpression of YAP ephadceX the proliferatiod of BEL7462and HepG2in vitro and in vivo(P<2.25),while the interferexce with YAP had the opposite effech Rapamycic oe PTEN-overexpressioo indiPiteX the idcreases of proliferaCop and tumoripexesis in hepatocePUae cadcee cells caused by YAP overexpressioo(P<0.25).Cmmueoprecipita-hoo YAP coprecipitateX with PTEN in HepG2cells.Conclusion Hippo sipnaUnc pathway can meXiate PTEN to promote cell prolifeo ratioo and tumoe formatioo throoah PI3KAKT/mT0R sipnaCnc pathway.Keg wordt:Hippo pathway;PTEN;PI3K/AKT/mT0Rpathway;hepatocePUae carciaoma;ceX proOferatiooHippo信号通路在哺乳动物器官发育大小的调节及细胞的增殖和凋亡过程中起着重要的作用⑴。
Hippo通路在原发性肝癌发生发展中的作用

Hippo通路在原发性肝癌发生发展中的作用洪莹晖,王 纯,叶明亮,罗 杰,刘佳良,任 超,蓝 瑜,赵 秋,常 莹武汉大学中南医院消化内科,湖北省肠病医学临床研究中心,肠病湖北省重点实验室,武汉430071摘要:原发性肝癌在全球范围内发病率持续上升,发病年龄趋于年轻化,并且总体预后不良。
Hippo通路作为最经典的感知细胞极性和密度、机械信号转导并促进细胞增殖、器官发育的调节器,能够促进包括原发性肝癌在内多种癌症的发生发展。
YAP作为Hippo通路的经典核效应器在原发性肝癌中显著上调,并且促进原发性肝癌耐药的发生。
原发性肝癌中Hippo信号通路的失调与肝癌的发生发展相联系,Hippo信号通路作为原发性肝癌发生的早期事件,影响原发性肝癌耐药的发生机制,这对于探索新的原发性肝癌临床治疗策略具有重要意义。
关键词:肝肿瘤;信号传导;Hippo通路中图分类号:R735.7 文献标志码:A 文章编号:1001-5256(2020)05-1171-04RoleoftheHipposignalingpathwayinthedevelopmentandprogressionofprimarylivercancerHONGYinghui,WANGChun,YEMingliang,etal.(HubeiKeyLaboratoryofIntestinalandColorectalDiseases,HubeiClinicalCenterofIn testinalandColorectalDiseases,DepartmentofGastroenterology,ZhongnanHospitalofWuhanUniversity,Wuhan430071,China)Abstract:Theincidencerateofprimarylivercancercontinuestoincreasearoundtheworld,withayoungerageofonsetandpoorerprognosis.Asthemostclassicregulatorofcellpolarityanddensity,mechanicalsignaltransduction,cellproliferation,andorgandevelopment,theHippopathwaycanpromotethedevelopmentandprogressionofvariouscancersincludingprimarylivercancer.YAP,aclassicnucleareffec toroftheHippopathway,issignificantlyupregulatedinprimarylivercancerandpromotesthedevelopmentofdrugresistance.ThisarticleaimstoinvestigatetheassociationofthedysregulationoftheHipposignalingpathwaywiththedevelopmentandprogressionofprimarylivercancerandanalyzesthemechanismofactionoftheHipposignalingpathwayinthedrugresistanceofprimarylivercancerasanearlyeventofthedevelopmentofprimarylivercancer,whichisofgreatsignificanceforexploringnewtreatmentstrategiesforprimarylivercancer.Keywords:liverneoplasms;signaltransduction;Hippopathwaydoi:10.3969/j.issn.1001-5256.2020.05.050收稿日期:2019-11-22;修回日期:2019-12-23。
植物Hippo信号通路研究进展

遗传Hereditas (Beijing) 2017年7月, 39(7): 568―575 综 述收稿日期: 2017-02-28; 修回日期: 2017-04-28基金项目:国家自然科学基金项目(编号:31671419)和南开大学中央高校基本科研业务费(编号:63161201)资助[Supported by the National NaturalScience Foundation of China (No.31671419) and the Fundamental Research Funds of the Central Universities(No.63161201)] 作者简介: 张平平,硕士研究生,专业方向:植物生理与分子生物学。
E-mail: zhangppsmile@ 通讯作者:龚清秋,博士,副教授,研究方向:胞内运输与植物发育。
E-mail: gongq@DOI: 10.16288/j.yczz.17-067 网络出版时间: 2017/5/31 9:42:28URI: /kcms/detail/11.1913.R.20170531.0942.002.html植物Hippo 信号通路研究进展张平平,佟鑫,张天乐,黎子琛,龚清秋南开大学生命科学学院,天津市蛋白质科学重点实验室,天津 300071摘要: 植物器官大小如何决定是发育生物学的基本问题之一。
Hippo 信号通路是动物中最重要的负调控器官大小的信号通路。
近期研究表明,植物中可能也存在Hippo 信号通路。
本文回顾了植物中已经发现的两个Hippo 信号通路的核心蛋白——Ste20/Hippo 同源蛋白SIK1与MOB1/Mats 同源蛋白MOB1,着重论述了SIK1和MOB1在调控植物生长发育中的作用,并对未来建立一条完整的植物Hippo 信号通路进行了展望。
关键词: Hippo 信号通路;SIK1;MOB1;器官大小;细胞分裂;细胞延展The emerging Hippo signaling pathway in plantsPingping Zhang, Xin Tong, Tianle Zhang, Zichen Li, Qingqiu GongTianjin Key Laboratory of Protein Sciences, College of Life Sciences, Nankai University, Tianjin 300071, ChinaAbstract: How the organ size is determined is a fundamental question in developmental biology. The metazoanHippo signaling pathway is well established to negatively regulate organ sizes. Recent studies in plants have started to shape an emerging Hippo signaling pathway. In this review, we summarize the studies in the past decade on the two known components of plant Hippo signaling pathway, the Ste20/Hippo homolog SIK1, and the MOB1/Mats homolog MOB1, with a focus on their developmental functions. Then we envision future discoveries that may shape a complete Hippo signaling pathway in plants.Keywords: Hippo signaling pathway; serine/threonine kinase 1 (SIK1); MOB1; organ size; cell division; cellexpansion植物物种间器官大小差异巨大,但同一种植物成熟叶片大小基本一致。
Hippo信号通路与炎症的研究进展

doi:10.3969/j.issn.1000⁃484X.2020.06.022㊃专题综述㊃Hippo 信号通路与炎症的研究进展①麻明彪 杜廷义② 陶律延 屈柯暄③ 李小娟② 计震华 简苗苗 陈泰桂 罗丽莎 丁 喆 宝福凯柳爱华 (昆明医科大学基础医学院,昆明650500) 中图分类号 R392.1 文献标志码 A 文章编号 1000⁃484X (2020)06⁃0752⁃07①本文为国家自然科学基金项目(No.81560596,31560051,81860644)和云南省科技厅⁃昆明医科大学联合基金项目(云南省科技计划项目)(No.2017FE467⁃001,2014FA011)㊂②昆明市儿童医院检验科,昆明650500㊂③昆明市儿童医院输血科,昆明650500㊂作者简介:麻明彪,男,硕士,初级检验师,主要从事病原微生物与免疫方面的研究㊂通讯作者及指导教师:宝福凯,男,博士,教授,博士生导师,主要从事热带传染病和结核病的研究,E⁃mail:baofukai@㊂柳爱华,女,博士,教授,博士生导师,主要从事热带传染病和结核病的研究,E⁃mail:lunaliu123@㊂[摘 要] Hippo 信号通路是由一系列发生级联反应激酶构成的,调控细胞增殖和凋亡的一条关键信号转导通路,该信号通路最先于果蝇体内发现,且进化上高度保守㊂在哺乳动物中,早期研究主要集中于Hippo 信号在肿瘤㊁心血管系统㊁免疫系统等疾病的调控,随着对Hippo 信号通路的研究不断深入,近年来研究发现,Hippo 与某些炎症疾病相关,特别是以Hippo 通路为信号传导的中心,与某些炎症因子的信号通路存在交互作用,进而参与炎症的发生㊁发展过程㊂本文就Hippo 信号通路与免疫细胞分化发育㊁Toll 样受体信号传导通路㊁TGF⁃β/Smad 信号通路,以及与G 蛋白偶联受体之间的相互作用来阐述Hippo 信号通路对炎症的调控机制,为研究Hippo 信号通路调控炎症的机理提供思路㊂[关键词] Hippo 信号通路;炎症;Toll 样受体信号传导通路;TGF⁃β/Smad 信号通路;G 蛋白偶联受体Research advances of Hippo signaling pathway in inflammationMA Ming⁃Biao ,DU Ting⁃Yi ,TAO Lü⁃Yan ,QU Ke⁃Xuan ,LI Xiao⁃Juan ,JI Zhen⁃Hua ,JIAN Miao⁃Miao ,CHEN Tai⁃Gui ,LUO Li⁃Sha ,DING Zhe ,BAO Fu⁃Kai ,LIU Ai⁃Hua .School of Basic Medical Sciences ,Kunming Medical University ,Kunming 650500,China[Abstract ] Hippo signaling pathway is composed of a series of cascade kinases,which is a key signal transduction pathwayregulating cell proliferation and apoptosis.This signaling pathway was first found in Drosophila and highly conserved in evolution.In mammals,early studies mainly focused on the regulation of Hippo signaling pathway in tumors,cardiovascular system,immune systemand other diseases.With the deepening of research on Hippo signaling pathway,recent studies have found that the signaling is related to some inflammatory diseases,especially the Hippo signaling pathway as the signal transmission center interacts with the signal pathway of some inflammatory factors to participate in the occurrence and development of inflammation.In this paper,the regulation mechanism of Hippo signaling pathway on inflammation was elaborated on the interaction between Hippo signal pathway and differentiation of immunecells,Toll⁃like receptor signal transduction pathway,TGF⁃β/Smad signal pathway,and G protein⁃coupled receptors,providing a basic in⁃formation for mapping the network signal of Hippo signaling pathway regulating inflammation.[Key words ] Hippo signaling pathway;Inflammation;Toll⁃like receptor signaling pathway;TGF⁃β/Smad signaling pathway;G protein⁃coupled receptors Hippo 信号通路,也称之为Salvador /Warts /Hippo(SWH)通路,因该信号通路的关键蛋白激酶Hippo 突变可使果蝇组织增生,表型像河马而以此命名㊂1995年Justice 等[1]对果蝇进行基因嵌合体筛查,首次在果蝇体内发现该信号通路中的Wts (Warts)基因,并且该基因参与调节细胞增殖及肿瘤抑制㊂1999年,Tao 等[2]研究证实果蝇Wts 的哺乳动物同源物大肿瘤抑制子(Large tumor suppressor,Lats)同样具有抑制肿瘤的作用,其配体为细胞周期调节因子CDC2㊂随后,研究其上游调控因子和下游其他作用受体引起了科学界的广泛关注,2002年,2个研究团队发现Salvador(Sav)为Wts 的直接作用蛋白,该蛋白包含两个WW 结构域㊂Sav 与Wts 相互作用,通过调控Cyclin E 和Diap 的转录来抑制细胞增殖,促进细胞凋亡[3,4]㊂2003年,研究者鉴定出肿瘤抑制基因Hippo(Hpo),该基因编码Ste⁃20家族蛋白激酶,并与哺乳动物体内MST1和MST2同源㊂此外,一系列研究发现,Hpo 可以与Sav 和Wts 相互作用,通过相同信号通路抑制细胞增殖[5⁃9]㊂2005年,经鉴定,Mats 被认为是Hippo 通路的关键调节器,抑制Mats 活性可导致大量组织生长,表型与由Hpo㊁Sav 或Wts 缺失所致者相似㊂同年,研究证实Yorkie 为Hippo 信号通路的核效应因子[10]㊂Hippo 信号通路的相关重要发现按时间顺序总结如图1所示㊂之后,其他物种体内的Hippo信号通路相关分子组成元件也陆续被发现,并确定了该信号通路在调节细胞增殖和凋亡方面发挥着至关重要的作用㊂1 Hippo 信号通路在果蝇(Drosophila )体内,经典的Hippo 信号通路主要由一系列串联激酶Hpo (Hippo )㊁Sav (Salvador )㊁Wts (Warts )㊁Mats (Mob as tumorsuppressor),转录共激活因子Yki(Yorkie)及其结合的转录因子Sd(Scalloped)组成,Hippo 信号通路的激活和失活依赖于通路相关激酶级联反应的激活与失活㊂在上游调控信号作用下,核心激酶发生激酶级联反应,最初Hpo 自磷酸化,与支架蛋白Sav 形成复合物,Hpo⁃Sav 复合物进而活化Mats 和Wts,形成Wts⁃Mats 复合物,随即磷酸化下游的效应因子Yki,使其与细胞质内细胞骨架蛋白14⁃3⁃3蛋白相结合而滞留于胞浆中,由此不能进入细胞核与转录因图1 Hippo 信号通路相关重要发现的时间顺序[11⁃13]Fig.1 Time of important discoveries related to Hipposignaling pathway[11⁃13]子Sd 相互作用,从而发挥抑制细胞增殖,促进细胞凋亡的作用[14](图2)㊂ Hippo 信号通路在进化上高度保守,其核心成员在哺乳动物体内有对应果蝇的同源蛋白分子,MST1/2(mammalian sterile 20⁃like kinase 1/2)㊁SAV1(human Salvador 1)㊁LATS1/2(Large tumor suppressor 1/2)㊁MOB1(Mps One Binder kinaseactivator⁃like 1)㊁YAP (Yes⁃associated protein)/TAZ(Tafazzin)及TEAD(TEA domain family member)分别为果蝇中Hpo㊁Sav㊁Wts㊁Mats㊁Yki 及Sd 的同源蛋白,且可发生与果蝇类似的逐级磷酸化过程㊂其中MST1/2和LATS1/2是哺乳动物经典Hippo 信号通路的核心激酶,MST1/2磷酸化可激活通路蛋白SAV1㊁LATS1/2及MOB1㊂此外,活化的MST1/2可通过结构域SARAH (Sav /Rassf /Hpo)与构架蛋白SAV1(WW45)相互作用,形成MST1/2⁃SAV1复合体,该复合体可增强MST1/2对下游LAST1/2蛋白的磷酸化作用㊂经MST1/2活化的调节蛋白MOB1也可促进LATS1/2的磷酸化㊂活化的LAST1/2随即磷酸化下游主要效应分子YAP 及其旁系同源分子TAZ 的第五位丝氨酸残基,发生磷酸化的YAP /TAZ 滞留在细胞质中而无法进入胞核,经泛素化后被蛋白酶降解[15⁃17]㊂而当Hippo 信号通路被抑制或处于静息状态时,YAP 发生核转位聚集到细胞核中,与核内转录因子TEAD 结合形成复合物,激活下游促进细胞增殖生长,抑制细胞凋亡的基因转录,如CTGF㊁AREG 等,进而促进蛋白合成和组织器官生长[18](图2)㊂2 Hippo 通路与炎症自发现以来,Hippo 信号通路已成为哺乳动物调节细胞增殖和凋亡的信号传导中枢㊂由Hippo通图2 果蝇与哺乳动物的Hippo 信号通路图Fig.2 Hippo signaling pathway in Drosophila and mam⁃mals路核心元件MST1/2㊁LATS1/2㊁YAP/TAZ介导的经典信号传导对于机体发育和组织内稳态的维持起着重要的调控作用㊂研究表明,异常的Hippo信号通路与机体免疫调节㊁肿瘤㊁心血管系统等疾病相关[19⁃21]㊂此外,随着对Hippo信号通路的研究不断深入,近年来研究发现Hippo信号通路还参与调节机体炎症的发生㊁发展过程[22]㊂炎症是机体为消除各种外源性或内源性损伤因子,清除和吸收坏死组织细胞以及修复损伤的一种复杂的免疫防御性过程㊂炎症的发生一方面可保护机体免遭损伤,另一方面,由于炎症刺激的持续存在,炎症微环境可导致细胞增殖㊁突变㊁坏死,甚至诱发肿瘤㊂多种免疫细胞及信号传导通路(Jak/Stat信号通路㊁NF⁃κB信号通路和Toll样受体信号通路等)介导了炎症的发生,研究已证实炎症的发生不仅仅依靠单一的炎症通路进行信号的传递,Hippo信号通路相关分子也参与免疫细胞分化发育以及功能的调控,并且该信号通路与某些炎症信号通路存在交互作用而共同参与调控炎症的发生㊂2.1 Hippo信号通路与免疫细胞分化发育 辅助性T细胞(helper T cell,Th)17和调节性T细胞(regulatory T cells,Treg)是两种在炎症反应中起重要作用的CD4+T淋巴细胞亚型㊂两种细胞在分化上相互联系,在转化生长因子β1(TGF⁃β1)单独刺激下,初始CD4+T细胞可分化为Treg细胞,而在IL⁃10存在的条件下,TGF⁃β1和IL⁃6的共同刺激可促使初始CD4+T细胞分化为Th17细胞,同时抑制Treg细胞的产生[23]㊂同时,两种细胞在功能上相互抑制,Th17细胞属于 促炎细胞”,介导炎症反应,该细胞表面表达多种炎性细胞因子受体,如趋化因子受体4(CCR4)㊁趋化因子受体6(CCR6)和IL⁃23受体(IL⁃23R)等,并且可分泌IL⁃17A㊁IL⁃17F㊁IL⁃21和IL⁃22等多种细胞因子,其中IL⁃17A和IL⁃17F可进一步诱导单核/巨噬细胞㊁上皮细胞和成纤维细胞等合成分泌肿瘤坏死因子α(TNF⁃α)㊁IL⁃1β㊁IL⁃6㊁粒细胞⁃巨噬细胞集落刺激因子(GM⁃CSF)㊁基质金属蛋白酶1(MMP⁃1)㊁MMP⁃3和前列素E2(PGE2),最终促进炎症的发生[24]㊂而Treg细胞属于 抑炎细胞”,介导免疫耐受,该细胞可表达高亲和性的IL⁃2受体CD25和转录因子叉头蛋白3(Foxp3),可通过细胞与细胞间的接触依赖性抑制或释放抗炎细胞因子(如IL⁃10㊁IL⁃35和TGF⁃β等)发挥抗炎作用[25]㊂Th17细胞与Treg细胞在机体微环境中处于一种动态平衡的状态,其失衡是导致机体多种炎性疾病和自身免疫性疾病的重要原因[26]㊂研究发现,MST1/2对Treg细胞和Th17细胞的发育和功能也起着重要的调控作用㊂MST1激酶可通过直接磷酸化转录因子Foxo1/3而增强其稳定性,或通过磷酸化Akt,抑制Akt磷酸化Foxo1/3的活性,间接增强Foxo1/3的稳定性,从而促进Foxp3表达和Treg细胞发育[27]㊂而敲除MST2对小鼠Treg细胞的发育无明显影响,但在MST1/2双敲除小鼠的胸腺中Treg的比例较MST1单敲小鼠明显下降,由此表明MST1在Treg的发育与功能上起主导作用,而MST2在一定程度上可以代偿性MST1的功能[27]㊂而对Th17细胞发育的调控,研究发现MST1缺失可促进Th17细胞的分化发育[28]㊂小鼠动物实验也发现,敲除MST1/2的小鼠,Th17细胞的比例显著增加,而Treg 细胞的比例明显下降,其机制为转录共激活因子TAZ可促进RORγt的转录活性,同时通过降低Foxp3蛋白的稳定性而抑制Foxp3的功能,从而促进Th17细胞的分化和减弱Treg细胞的产生㊂同时,研究也发现在初始CD4+T细胞分化为Treg细胞时,TEAD1的表达量明显上升,但由于TAZ与TEAD1具有更高的结合亲和力,从而阻断了TAZ与RORγt,或Foxp3的相互作用,因此TEAD1的表达可增强初始CD4+T细胞分化为Treg细胞的能力[29]㊂虽然炎症是多种免疫细胞介导的复杂反应,但Hippo信号通路对其他免疫细胞(如中性粒细胞㊁NK细胞和单核⁃吞噬细胞等)分化发育的调控研究少有报道,其中对MST1在B细胞的发育和功能中的研究,目前也只发现在MST1敲除小鼠中,外周血B细胞数目减少㊁脾边缘区B细胞的缺失等㊂2.2 Hippo信号通路与Toll样受体信号通路 Toll 样受体(Toll⁃like receptors,TLRs)活化和由此引起的下游促炎/抗炎细胞因子的分泌,导致机体免疫系统失衡是引起感染性炎症的重要原因㊂TLRs是一组存在于宿主免疫细胞表面的Ⅰ型跨膜蛋白,在机体非特异性免疫中发挥重要作用,同时也是连接特异性免疫和非特异性免疫的中间桥梁,该受体属于模式识别受体(pattern recognition receptor,PRR),可识别微生物表面上结构恒定㊁进化保守的病原体相关分子模式(pathogen⁃associated molecular patterns, PAMP),目前在人体内发现的TLRs达11种㊂除TLR3外,Toll样受体家族成员介导的炎症反应都要通过一条经典的信号通路,即TLRs识别PAMP后,通过胞内TIR(Toll/IL⁃1R)区募集含有TIR结构域的接头蛋白髓样分化因子88(myeloid differentiation factor88,MyD88),通过其结合募集IL⁃1受体相关激酶(IL⁃1receptor⁃associated kinase,IRAK)家族蛋白,形成MyD88⁃IRAKs复合体,随之依次活化IRAKs㊁肿瘤坏死因子受体相关因子6(TNF receptor associated factor6,TRAF⁃6)㊁转化生长因子激酶1 (transforming growth factor activated kinase⁃1, TAK1)㊁丝裂原活化蛋白激酶(mitogen⁃activated protein kinase,MAPK)㊁c⁃Jun氨基末端激酶(c⁃Jun N⁃terminal kinase,JNK)和IκB激酶(inhibitor of NF⁃κB,IκB),进而激活核因子κB(nuclear factorκB, NF⁃κB),最终诱导促炎细胞因子的表达和释放[30⁃33]㊂而TLR3信号是通过TRIF(TIR⁃domain⁃containing adaptor⁃inducing interferonβ)或MyD88活化IRF⁃3,最终介导机体Ⅰ型干扰素的产生㊂Toll样受体信号通路在果蝇中也是调节体液免疫应答的主要信号通路之一,革兰氏阳性菌感染后可启动蛋白水解级联反应,通过激活Toll受体的配体Spatzle(Spz)从而激活Toll信号通路,活化的Toll信号通过MyD88和蛋白激酶Pelle促进Cactus (Cact)蛋白磷酸化而降解,使NF⁃κB家族转录因子Dorsal(Dl)和Dorsal相关免疫因子(Dif)转位进入细胞核,最终诱导抗菌肽的表达而抵抗病原微生物的感染㊂Cact蛋白是一种含有细胞质锚蛋白重复序列的蛋白质,可通过将NF⁃κB家族转录因子Dl 和Dif保留在细胞质中而降低抗菌肽的转录㊂Bo 等[34]研究发现在果蝇中TLRs介导的Hippo信号通路在抗菌过程中具有重要调节作用㊂革兰阳性菌与Toll样受体作用后,可通过Toll⁃MyD88⁃Pelle级联反应促进Hippo通路抑制性复合物STRIPAK⁃PP2A的必需亚基Cka发生磷酸化并降解,从而激活Hippo 通路发生激酶级联反应,当果蝇脂肪体中Hippo信号通路的抑制因子缺失或Yorkie激活时,会导致Cact的表达上升,使得抗菌肽的表达下降而容易被革兰氏阳性菌所感染㊂这一研究结果阐明了在果蝇先天免疫中Toll受体通过Hippo信号通路调控Cact 表达的分子机制,证明了Hippo信号通路在免疫应答中的调控作用,为Hippo信号通路的研究提供了新的思路㊂Geng等[35]研究发现,TLR1/2/4可诱导激酶Mst1和Mst2活化,活化的Mst1和Mst2激活蛋白激酶Cα(PKCα),进而使LyGDI⁃Rac复合体部分磷酸化,Rac从复合物中解离出来,而TLR信号通路中的TRAF6与Rac结合,并催化Rac赖氨酸16的k63链发生多聚泛素化而活化,活化的Rac可促进TRAF6⁃ECSIT复合物的组装,从而促进细胞内线粒体向吞噬小泡募集并使mROS生成增多,最终释放大量的活性氧(ROS)以杀伤和清除吞噬小泡中的病原体㊂Wang等[36]研究发现,YAP能够负调控机体的抗病毒免疫反应,YAP可与转录因子IRF3相互作用并抑制其二聚化,从而阻断IRF3在病毒感染后进入细胞核的过程㊂YAP缺失可增强IRF3的功能,并促进β干扰素(IFN⁃β)的表达,在体内和体外均能抑制病毒的复制㊂此外,该研究还发现YAP独立于Hippo和LATS1/2调控的新机制,即病毒活化的IKKε能促进YAP的Ser403位点磷酸化,引发溶酶体中YAP降解,使得YAP介导的抑制细胞抗病毒效应减轻㊂近期,Lv等[37]研究发现,炎症介质LPS㊁TNF⁃α和H2O2可激活TLR4,通过TLR4⁃MyD88⁃IRAK1/4⁃TRAF6⁃YAP⁃TAK1⁃NF⁃κB系列传导途径促进炎症的发生,而Hippo信号通路中的YAP蛋白可直接作用于信号传导通路中的TRAF6,一方面促进TRAF6K48位点泛素化而使蛋白降解,另一方面抑制K63位点泛素化,从而抑制对下游蛋白TAK1的激活,进而抑制核转录因子NF⁃κB信号通路来减轻炎症的发生,发挥抗炎作用㊂Deng 等[38]研究发现,关节炎发生时,关节软骨中的YAP 蛋白表达明显降低,其表达水平随关节损伤程度的加剧而逐渐降低,其机制与炎性细胞因子TNF⁃α㊁IL⁃1β可加速YAP/TAZ蛋白的降解,抑制YAP/TAZ 的转录活性有关㊂同时炎性介质激活Toll样受体信号通路,TLRs信号通路关键分子TAK1可促进YAP/TAZ磷酸化,并促进YAP/TAZ与β⁃TRCP结合,进而通过泛素化使其降解㊂此外,该研究也发现YAP可通过抑制NF⁃κB信号传导通路以缓解关节炎进程㊂Boro等[39]研究表明,Hippo通路还参与了结核分枝杆菌(Mycobacterium tuberculosis,Mtb)感染机体后的炎性反应㊂Mtb感染机体后,CCL2㊁CCL3㊁CCL7㊁CXCL1㊁CXCL2㊁CXCL15等多种促炎趋化因子表达增加,而敲除MST1/2基因的巨噬细胞经Mtb感染后趋化因子CXCL1/2分泌量不发生显著改变,由此表明CXCL1/2分泌可受Hippo信号通路MST1/2分子调节,进一步研究发现TLR2识别入侵Mtb抗原后,通过IRAK1/4激活MST1/2,MST1/2活化非经典Hippo通路下游转录分子IRF3,进而上调CXCL1/2和抗菌肽的表达㊂IRF3的活化程度与MST1/2的磷酸化正相关,抑制IRF3活性,CXCL1/2表达受抑制㊂因此Mtb感染宿主后,可通过TLR2⁃IRAK1/4⁃MST1/2⁃IRF3途径,诱导促炎趋化因子CXCL1/2分泌和抗菌肽表达,从而保护机体抵抗Mtb病原体损伤㊂2.3 Hippo信号通路与TGF⁃β/Smad信号通路 转化生长因子β(transforming growth factor beta,TGF⁃β)是一种多向性㊁多效性的炎症细胞因子㊂在造血细胞㊁骨折及伤口等部位,机体细胞分泌的非活性TGF⁃β首先与其Ⅰ型受体(typeⅠTGF⁃βreceptor, TβR⁃Ⅰ)及Ⅱ型受体(typeⅡTGF⁃βreceptor,TβR⁃Ⅱ)结合,形成异源三聚体,三聚体中TβR⁃Ⅱ磷酸化TβR⁃Ⅰ,磷酸化的TβR⁃Ⅰ进而激活受调节的Smads (receptor⁃regulated Smads,R⁃Smads)蛋白,将信号传递至胞浆㊂R⁃Smad作为TGF⁃β受体的底物被磷酸化后与共同通路型Smads(common⁃parnter Smads, Co⁃Smad)结合,成为有转录活性的模块,转移至细胞核,与靶基因结合,调节蛋白合成,参与创伤修复㊁免疫功能㊁细胞增殖㊁分化㊁凋亡及纤维化等生物过程的调节[40⁃42]㊂与Hippo信号通路一致,TGF⁃β/ Smad转导通路的活性输出有赖于其效应蛋白的核转位㊂早期Varelas等[43]研究YAP/TAZ与TGF⁃β蛋白核质穿梭的相互作用发现,TGFβ刺激人胚胎细胞后,TAZ与细胞内Smads复合物结合,并促进Smads核定位,进而诱导维持人胚胎细胞多能性的基因转录,且基因转录与TAZ表达水平相关,低水平的TAZ促进核累积,当TAZ浓度增加时,它主要定位于细胞质内,阻断Smads的核定位,提示Smad 蛋白的核累积强烈依赖于TAZ的表达水平和活化状态㊂之后,多项研究结果均证实,TGF⁃β/Smad信号通路与Hippo信号通路存在交联[44]㊂活化Hippo 通路后,滞留于细胞质内的YAP1/TAZ阻止了Smads的核积累,并限制其转录活性㊂反之,抑制Hippo通路,YAP/TAZ的核转位则增强核内Smads 活性[45]㊂通过Hippo通路和TGFβ⁃SMAD信号传导之间的相互协同,共同参与青光眼的形成㊁癌症的发展和转移㊁调节组织细胞的稳态㊁人胚胎干细胞的自我更新及修复等疾病过程[46]㊂此外,多项研究表明TGF⁃β信号传导是心脏㊁肺㊁肝㊁肾和皮肤炎症纤维化的关键调节因子[47⁃49]㊂纤维化是由于炎症导致器官实质细胞发生坏死,组织内细胞外基质异常增多和过度沉积的病理过程㊂Nishio等[45]研究表明,特异性敲除小鼠肝脏中Mob基因,可导致小鼠细胞增生㊁伴有炎性细胞浸润㊁纤维化㊁TGF⁃β表达显著上调㊂而抑制肝脏Mob缺陷小鼠的TGF⁃β受体基因表达,可部分缓解肝脏炎性肿大㊁纤维化和肿瘤的发生㊂Fujii等[50]也证实了Hippo信号通路与TGF⁃β/Smad信号通路存在相互作用,两条通路的相关蛋白分子可形成YAP⁃TEAD⁃Smad3⁃p300复合物,该复合物可被募集到结缔组织生长因子(CTGF)启动子上的推定结合位点,进而提高CTGF基因的表达,促进炎症纤维化的发展㊂2.4 Hippo信号通路与G蛋白偶联受体 G蛋白偶联受体(G⁃protein⁃coupled receptors,GPCRs)含有7个跨膜结构域,该受体通过与G蛋白偶联介导信号的传递㊂GPCR是介导细胞外信号向胞内传递的细胞表面受体中的最大家族,其介导了包括视觉控制㊁肾脏功能㊁肿瘤发生㊁机体免疫调节㊁炎症反应等在内多种病理㊁生理过程的信号传递㊂有研究报道, GPCRs可作为上游调控因子,调节Hippo信号通路的表达[51]㊂Guan研究团队通过研究血清对YAP/ TAZ磷酸化和激活的影响,以寻找Hippo途径的上游调节因子㊂结果显示,血清中的生物活性磷脂溶血磷脂酸(LPA)和鞘氨醇1⁃磷酸(S1P)可激活G12/13偶联受体,通过Rho⁃GTP酶抑制LATS1/2活性,从而诱导YAP去磷酸化和核转位㊂此外,激活GPCRs的胰高血糖素㊁肾上腺素或多巴胺可促进LATS1/2的活化,从而诱导YAP/TAZ磷酸化㊂Sonika等[52]研究发现,特异性敲除小鼠骨髓G蛋白偶联受体激酶2(G protein⁃coupled receptor kinase2, GRK2)基因,经病原微生物感染脓毒症后,表现出过度的细胞因子反应,其机制与GRK2对NF⁃κB1p105⁃TPL2⁃MEK⁃ERK途径的负调节有关㊂Nandakumar等[53]研究发现GRK5缺失可抑制组织和巨噬细胞中NF⁃κB的活化,从而减少细胞因子反应,且动物水平研究显示GRK5缺陷小鼠胸腺细胞凋亡和免疫抑制减轻㊂以上研究结果提示GPCR在机体病原菌感染后的炎症反应中发挥着重要的调节作用,然而GPCR的这些功能作用是否与Hippo通路相关目前尚无文献报道,有待于进一步深入研究㊂3 结语与展望尽管目前Hippo信号通路的研究取得了迅速而广泛的进展,但对Hippo信号通路与炎症疾病的相关性及其作用机制的研究报道并不多,相关研究也多集中于探究通路中的关键激酶MST1,MST2和下游转录激活分子YAP对免疫细胞和相关信号通路的调节作用,但Hippo信号通路中其他分子如SAV1㊁LAST1/2和TEAD的相关研究较少㊂Hippo 信号通路对感染性炎症相关的Toll样受体信号通路的相互作用的研究较多,且较为深入,但对其他炎症相关信号通路的调节研究较少㊂因此,Hippo信号通路对其他炎症相关细胞的调控,以及Hippo信号通路相关分子与炎症相关信号通路的相互作用都有待于进一步深入研究㊂深入剖析Hippo信号通路对炎症疾病的调控,不但有助于深入阐明炎症疾病的发病机制,而且可为寻找新的潜在疾病治疗靶点提供新契机和思路㊂参考文献:[1] Justice RW,Zilian O,Woods DF,et al.The Drosophila tumorsuppressor gene warts encodes a homolog of human myotonicdystrophy kinase and is required for the control of cell shape andproliferation[J].Genes Dev,1995,9(5):534⁃546. [2] Tao W,Zhang S,Turenchalk GS,et al.Human homologue of theDrosophila melanogaster lats tumour suppressor modulates CDC2 activity[J].Nature Genetics,1999,21(2):177⁃181. [3] Tapon N,Harvey KF,Bell DW,et al.Salvador promotes both cellcycle exit and apoptosis in drosophila and is mutated in human cancer cell lines[J].Cell,2002,110(4):467⁃478. [4] Madhuri KS,Riitta N,Chunyao T,et al.Shar⁃pei mediates cell pro⁃liferation arrest during imaginal disc growth in Drosophila[J].De⁃velopment,2002,129(24):5719⁃5730.[5] Kieran FH,Cathie MP,Iswar KH.The Drosophila Mst ortholog,hippo,restricts growth and cell proliferation and promotes apoptosis [J].Cell,2003,114(4):457⁃467.[6] Udan RS,Madhuri KS,Riitta N,et al.Hippo promotes proliferationarrest and apoptosis in the Salvador/Warts pathway[J].Nat Cell Biol,2003,5(10):914⁃920.[7] Sophie P,Nicolas T,Pierre L.The Salvador partner Hippo promotesapoptosis and cell⁃cycle exit in Drosophila[J].Nat Cell Biol, 2003,5(10):921⁃927.[8] Jianhang J,Wensheng Z,Bing W,et al.The Drosophila Ste20family kinase dMST functions as a tumor suppressor by restricting cell proliferation and promoting apoptosis[J].Genes Dev,2003,17(20):2514⁃2519.[9] Shian W,Jianbin H,Jixin D,et al.Hippo encodes a Ste⁃20familyprotein kinase that restricts cell proliferation and promotes apoptosis in conjunction with salvador and warts[J].Cell,2003, 114(4):445⁃456.[10] Lai ZC,Wei X,Shimizu T,et al.Control of cell proliferation andapoptosis by mob as tumor suppressor,mats[J].Cell,2005,120(5):675⁃685.[11] Kim W,Jho EH.The history and regulatory mechanism of theHippo pathway[J].Bmb Reports,2018,51(3):106⁃118. [12] Fang L,Teng H,Wang Y,et al.SET1A⁃mediated mono⁃methylation at K342regulates YAP activation by blocking itsnuclear export and promotes tumorigenesis[J].Cancer cell,2018,34(1):103⁃118.e9.[13] Liu H,Dai X,Cao X,et al.PRDM4mediates YAP⁃induced cellinvasion by activating leukocyte⁃specific integrin beta2expression[J].EMBO Rep,2018,19(6):e45180.[14] Georg H,Randy LJ.Hippo signaling:growth control and beyond[J].Development,2011,138(1):9⁃22.[15] Badouel C,Mcneill H.SnapShot:The Hippo signaling pathway[J].Cell,2011,145(3):484⁃484.e1.[16] Zhao B,Wei XM,Udan RS,et al.Inactivation of YAP oncoproteinby the Hippo pathway is involved in cell contact inhibition andtissue growth control[J].Genes Devel,2007,21(21):2747⁃2761.[17] Bin Z,Li L,Karen T,et al.A coordinated phosphorylation by Latsand CK1regulates YAP stability through SCF(beta⁃TRCP)[J].Genes Dev,2010,24(1):72⁃85.[18] Gibault F,Corvaisier M,Bailly F,et al.Non⁃photoinducedbiological properties of verteporfin[J].Curr Med Chem,2016,23(11):1171⁃1184.[19] 杨生辉,莫安薇,王 琳.科罗索酸通过抑制Hippo⁃YAP信号转导通路促进非小细胞肺癌细胞的凋亡[J].中国免疫学杂志,2018,34(7):1023⁃1028.Yang SH,Mo AW,Wang L.Corosolic acid promotes apoptosis ofnon⁃small cell lung cancer cells via Hippo⁃YAP signaling pathway[J].Chin J Immunol,2018,34(7):1023⁃1028. [20] 周兆才.胃肠道肿瘤免疫逃逸[J].中国免疫学杂志,2017(5):641⁃645.Zhou ZC.The immune escape of gastrointestinal tumor[J].Chin JImmunol,2017(5):641⁃645.[21] 陈俊任,杨定华,孙艳花,等.TAZ和KLF5在肝细胞癌组织中的表达及其临床意义[J].中国免疫学杂志,2015,31(3):380⁃383.Chen JR,Yang DH,Sun YH,et al.Evaluation of TAZ and KLF5expression and their clinical significance in hepatocellularcarcinoma[J].Chin J Immunol,2015,31(3):380⁃383. [22] 周 欣,李伟芸,王红艳.MST1/2调控先天免疫的功能和机制[J].遗传,2017,39(7):642⁃649.Zhou X,Li WY,Wang HY.The roles and mechanisms of MST1/2in the innate immune response[J].Hereditas(Beijing),2017,39(7):642⁃649.[23] 王维维,沈 茜.Th17细胞和Treg细胞的细胞因子调节网络[J].生命的化学,2010,30(2):269⁃273.Wang WW,Shen X.The cytokines regulatory network of Th17andTreg cells[J].Chemistry Life,2010,30(2):269⁃273. [24] Wang Y,Xing F,Ye S,et al.Jagged⁃1signaling suppresses theIL⁃6and TGF⁃βtreatment⁃induced Th17cell differentiation viathe reduction of RORγt/IL⁃17A/IL⁃17F/IL⁃23a/IL⁃12rb1[J].Sci Rep,2015,5:8234⁃8243.[25] Xu Z,Wei C,Zhang RU,et al.Epigallocatechin⁃3⁃gallate⁃inducedinhibition of interleukin⁃6release and adjustment of the regulatoryT/T helper17cell balance in the treatment of colitis in mice[J].Exp Therapeutic Med,2015,10(6):2231⁃2238. [26] Elshal MF,Aldahlawi AM,Saadah OI,et al.Reduced dendriticcells expressing CD200R1in children with inflammatory boweldisease:correlation with Th17and regulatory T cells[J].Int JMol Sci,2015,16(12):28998⁃29010.[27] Du XR,Shi H,Li J,et al.Mst1/Mst2regulate development andfunction of regulatory T cells through modulation of Foxo1/Foxo3stability in autoimmune disease[J].J Immunol,2014,192(4):1525⁃1535.[28] Li CX,Bi YJ,Li Y,et al.Dendritic cell MST1inhibits Th17dif⁃ferentiation[J].Nat Commun,2017,8:14275. [29] Geng J,Yu SJ,Zhao H,et al.Thetranscriptional coactivator TAZregulates reciprocal differentiation of TH17cells and Treg cells[J].Nat Immunol,2017,18(7):800⁃812.[30] 柳爱华,宝福凯.近年来固有免疫研究中的一些重要进展[J].自然杂志,2009,31(4):218⁃222.Liu AH,Bao FK.Some important advances in innate immunityresearch in recent years[J].Chin J Nat,2009,31(4):218⁃222.[31] Akira S.Toll⁃like receptor signaling[J].J Biol Chem,2003,4(40):38105⁃38108.[32] Marion J.Toll⁃like receptors:pathogen recognition and signaling[M].New York:Mol Life Sci,2018:1198⁃1204. [33] 耿 晶,洪丽欣,陈兰芬.Hippo信号通路相关分子参与免疫细胞功能调控的研究进展[J].生命科学,2017,29(9):908⁃915.Geng J,Hong LX,Chen LF.Research advances in functions ofHippo signaling in the immune system[J].Chin Bulletin LifeSci,2017,29(9):908⁃915.[34] Bo L,Zheng Y,Feng Y,et al.Toll receptor⁃mediated hipposignaling controls innate immunity in drosophila[J].Cell,2016,164(3):406⁃419.[35] Geng J,Sun X,Wang P,et al.Kinases mst1and mst2positivelyregulate phagocytic induction of reactive oxygen species andbactericidal activity[J].Nat Immunol,2015,16(11):1142⁃1152.[36] Wang S,Xie F,Chu F,et al.Yap antagonizes innate antiviralimmunity and is targeted for lysosomal degradation throughikkvarepsilon⁃mediated phosphorylation[J].Nat Immunol,2017,18:733⁃743.[37] Lv Y,Kim K,Sheng Y,et al.YAP controls endothelial activationand vascular inflammation through TRAF6[J].Circulat Res,2018,123(1):43⁃56.[38] Deng Y,Lu J,Li W,et al.Reciprocal inhibition of YAP/TAZ andNF⁃kappaB regulates osteoarthritic cartilage degradation[J].NatCommun,2018,9(1):4564⁃4577.[39] Boro M,Singh V,Balaji KN.Mycobacterium tuberculosis⁃triggeredHippo pathway orchestrates CXCL1/2expression to modulate hostimmune responses[J].Scient Rep,2016,6:37695. [40] Massague J.TGFbeta signalling in context[J].Nat Rev Mol CellBiol,2012,13(10):616⁃630.[41] 刘 镕,赵琴平,董惠芬,等.TGF⁃β信号传导通路及其生物学功能[J].中国病原生物学杂志,2014,9(1):77⁃83.Liu R,Zhao QP,Dong HF,et al.The TGF⁃βsingaling pathwaysand their biological functions[J].J Pathogen Biol,2014,9(1):77⁃83.[42] Hata A,Chen YG.TGF⁃βsignaling from receptors to smads[J].Cold Spring Harb Perspect Biol,2011,8(9):a022061. [43] Varelas X,Sakuma R,Samavarchi⁃Tehrain P,et al.TAZ controlsSmad nucleocytoplasmic shuttling and regulates human embryonicstem⁃cell self⁃renewal[J].Nat Cell Biol,2008,10(7):837⁃848.[44] Bram P,Ruud AB,Miriam B.Signaling in fibrosis:TGF⁃β,WNT,and YAP/TAZ converge[J].Front Med,2015,2:59⁃72. [45] Nishio M,Sugimachi K,Goto H,et al.Dysregulated YAP1/TAZand TGF⁃beta signaling mediate hepatocarcinogenesis in Mob1a/1b⁃deficient mice[J].Proceed Nat Academy Sci U S A,2016,113(1):E71⁃E80.[46] Wang X,Huai G,Wang H,et al.Mutual regulation of the Hippo/Wnt/LPA/TGF signaling pathways and their roles in glaucoma(Review)[J].Int J Mol Med,2018,41(3):1201⁃1212. [47] Marcin D,Marcin B,Na L,et al.Smad3signaling criticallyregulates fibroblast phenotype and function in healing myocardialinfarction[J].Circulat Res,2010,107(3):418⁃428. [48] Nathan S,Andrew L,Jacob K,et al.Delayed stress fiber formationmediates pulmonary myofibroblast differentiation in response toTGF⁃β[J].Am J Physiol Lung Cell Mol Physiol,2011,301(5):656⁃666.[49] Meng XM,Huang XR,Chung AC,et al.Smad2protects againstTGF⁃beta/Smad3⁃mediated renal fibrosis[J].J Am SocietyNephrol Jasn,2010,21(9):1477⁃1487.[50] Fujii M,Toyde T,Nakanishi H,et al.TGF⁃βsynergizes withdefects in the Hippo pathway to stimulate human malignant meso⁃thelioma growth[J].J Exp Med,2012,209(3):479⁃494. [51] Yu FX,Zhao B,Panupinthu N,et al.Regulation of the Hippo⁃YAP pathway by G⁃protein⁃coupled receptor signaling[J].Cell,2012,150(4):780⁃791.[52] Sonika P,Yogesh S,Sitaram P,et al.Myeloid⁃specific GPCRkinase⁃2negatively regulates NF⁃κB1p105⁃ERK pathway andlimits endotoxemic shock in mice[J].J Cell Physiol,2011,226(3):627⁃637.[53] Nandakumar P,Taehyung L,Pongali BR,et al.G⁃protein⁃coupledreceptor kinase⁃5mediates inflammation but does not regulatecellular infiltration or bacterial load in a polymicrobial sepsismodel in mice[J].J Innate Immunity,2013,5(4):401⁃413.[收稿2019⁃01⁃09 修回2019⁃03⁃18](编辑 张晓舟)。
hippo信号通路在骨骼肌损伤修复中作用的研究进展

Hippo信号通路在骨骼肌损伤修复中作用的研究进展赵莉娟ꎬ张宏ꎬ张国辉ꎬ栗雅芳上海中医药大学附属岳阳中西医结合医院ꎬ上海200437㊀㊀摘要:骨骼肌损伤是运动医学中常见损伤ꎮ损伤骨骼肌的不良修复可导致功能障碍以及肌肉质量下降等ꎬ严重影响患者生活质量ꎮHippo信号通路是机体内一条重要的信号转导通路ꎬ可影响细胞增殖㊁分化及迁移ꎬ并可以维持组织稳态ꎬ在调控器官发育等方面有重要作用ꎮHippo信号转导通路也与损伤骨骼肌的修复过程密切相关ꎬ可促进骨骼肌卫星细胞和成肌细胞的增殖ꎬ并参与调控成肌细胞分化和蛋白的合成ꎮ㊀㊀关键词:骨骼肌损伤ꎻHippo信号通路ꎻ修复㊀㊀doi:10.3969/j.issn.1002 ̄266X.2020.01.030㊀㊀中图分类号:R685㊀㊀文献标志码:A㊀㊀文章编号:1002 ̄266X(2020)01 ̄0109 ̄04基金项目:国家自然科学基金面上项目(81574095)ꎮ通信作者:张宏(E ̄mail:zhanghongdoctor@sina.com)㊀㊀骨骼肌是附着于骨骼上的横纹肌组织ꎬ通过其收缩和舒张可以带动骨与关节的活动ꎬ起到维持机体姿势并产生运动的作用ꎮ作为运动系统的重要组成ꎬ骨骼肌极易因内外力学环境的失衡而造成损伤ꎬ发生损伤的概率为10%~55%[1ꎬ2]ꎮ损伤类型主要为急性损伤(牵拉伤和顿挫伤)㊁慢性炎症性损伤ꎮ损伤后的骨骼肌若修复不良ꎬ后续常造成功能障碍和肌肉质量下降等ꎬ严重影响患者运动㊁工作和生活ꎮ骨骼肌细胞是一类具有再生能力的细胞ꎬ在损伤后可开启修复过程ꎮ而骨骼肌修复过程中激活某些信号通路可能会引发细胞外基质组分如胶原蛋白㊁纤连蛋白的大量沉积ꎬ进而发生纤维化ꎬ使损伤的骨骼肌丧失部分收缩功能ꎬ最终影响骨骼肌再生[3]ꎮ促进肌卫星细胞增殖ꎬ诱导肌卫星细胞以及成肌细胞的正常分化是损伤的骨骼肌再生修复的关键ꎮ其中有许多通路参与这一过程的调控ꎬ如Notch信号通路㊁Wnt信号通路均可促进骨骼肌肌卫星细胞的激活和分裂[4ꎬ5]ꎮ在成肌细胞增殖分化期间ꎬ成肌细胞的增殖往往伴随磷脂酰肌醇3 ̄激酶/蛋白激酶B通路的参与[6]ꎮ同样ꎬ激活经典的Wnt/β ̄连环蛋白(β ̄catenin)信号通路也可促进成肌细胞的分化[7]ꎬ而酪氨酸蛋白激酶/信号转导因子和转录活化因子信号通路(JAK/STAT)中的JAK1 ̄STAT1 ̄STAT3途径不但可促进成肌细胞增殖ꎬ同时还起到防止成肌细胞过早分化成肌管的作用[8]ꎮHippo信号通路是由一系列保守激酶所组成的通路ꎬ可影响多种细胞分化㊁增殖和迁移ꎬ并在维持组织稳态ꎬ调控器官发育大小以及肿瘤的发生㊁发展过程等多方面均有重要作用[9]ꎮ近些年发现该通路还与骨骼肌损伤修复相关[10]ꎮ故本文对近几年的文献进行整理ꎬ并对Hippo信号通路在骨骼肌损伤修复中的作用进行分析ꎬ并归纳该信号通路与骨骼肌损伤后再生修复的关系ꎬ以期为康复医学提供有价值的参考ꎮ1㊀Hippo信号通路概述㊀㊀Hippo信号通路由上游STE20样激酶1/2(MST1/2)㊁Salvador同系物1(Sav1)㊁居于中游的与Mob同系物1(Mob1)结合的大抑癌基因激酶1/2(LATS1/2)㊁下游的转录辅助激活物Yes相关蛋白(Yap)及具有PDZ结合基序的转录共激活因子(Taz)组成[11]ꎮ该通路的激活过程是激酶的级联反应ꎮMST1/2与调节蛋白Sav1相结合并形成MST/Sav复合体ꎬ随后参与磷酸化并激活与调节蛋白Mob1结合在一起的LATS1/2激酶ꎻ而LATS/Mob复合物又可进一步抑制Yap和Taz的活性ꎮLATS/Mob复合物抑制下游转录辅助激活物ꎬ该作用是通过磷酸化Yap关键丝氨酸残基(Ser61㊁109㊁127㊁164和381)和磷酸化Taz关键丝氨酸残基得以实现ꎮ磷酸化后的Yap/Taz可从核内转出ꎬ留在胞质中参与之后的两种生物学过程ꎮ其一ꎬ磷酸化的Yap/Taz发生泛素化ꎬ直接导致Yap/Taz蛋白降解ꎻ其二ꎬ磷酸化的Yap也可与14 ̄3 ̄3蛋白结合后保留在细胞质中ꎬ从而无法与核内转录因子结合ꎬ发挥其转录辅助因子的功能[12]ꎮ通路去激活状态下ꎬ即激酶901处于不活跃状态时ꎬ未被磷酸化激活的Yap/Taz则在细胞核内与DNA结合转录因子TEA结合域(TEAD)1 ̄4结合ꎬ启动下游转录ꎬ进而完成复杂的生命活动ꎮHippo通路的核心元件Yap和Taz的活性ꎬ受通路核心激酶MST1/2 ̄LATS1/2的激酶级联反应调控外ꎬ还受到蛋白质 ̄蛋白质相互作用的破坏和蛋白翻译后修饰的影响[13]ꎮ2㊀Hippo信号分子在骨骼肌中的表达㊀㊀Hippo信号通路的关键成员是下游蛋白Yapꎬ这是一种转录辅助因子ꎬ在细胞中都有表达ꎮ研究表明ꎬ该转录辅助因子参与多种成体干细胞或是祖细胞的增殖和分化ꎬ包括肠道祖细胞㊁肝卵圆细胞以及神经干细胞等[14ꎬ15]ꎮ近些年研究发现ꎬHippo信号通路的重要组件蛋白Yap和Taz在人及小鼠的骨骼肌卫星细胞和成肌细胞中也有表达ꎮ其中骨骼肌卫星细胞是一类具有间充质干细胞特性的细胞ꎬ而成肌细胞作为骨骼肌损伤后重建肌肉组织的前体细胞ꎬ具有很好的分化能力ꎬ二者均参与损伤骨骼肌的再生修复过程[16ꎬ17]ꎮ3㊀骨骼肌的损伤修复㊀㊀骨骼肌损伤后的修复过程大致分为三个阶段ꎬ并且这三个阶段之间没有明确的时间分割点ꎬ在过程中彼此存在一定的重叠性ꎮ第一阶段ꎬ坏死炎症阶段ꎮ损伤后的骨骼肌发生变性坏死以及肌纤维结构的破坏㊁炎症细胞的浸润(巨噬细胞为主)ꎬ吞噬坏死细胞的成分[18]ꎮ第二阶段ꎬ骨骼肌再生和重建阶段ꎮ这一阶段有一类参与骨骼肌再生的关键细胞 骨骼肌卫星细胞ꎬ该细胞位于骨骼肌肌膜与基底膜之间ꎮ一般情况下ꎬ骨骼肌卫星细胞处于一种静止不分裂的状态ꎬ损伤后骨骼肌卫星细胞会受炎症因子以及T细胞的刺激发生部分活化ꎬ活化的肌卫星细胞随后分化为成肌细胞ꎬ新的成肌细胞进一步分化形成肌管ꎬ成熟的肌管相互融合会形成新的肌纤维ꎬ完成整个骨骼肌损伤后的再生㊁重建过程[19]ꎮ第三阶段ꎬ损伤修复完善阶段ꎮ值得注意的是ꎬ在这一阶段修复的骨骼肌细胞可能会发生纤维化ꎬ主要是因为骨骼肌的修复过程后期需要成纤维细胞产生必要的细胞外基质ꎬ如果骨骼肌细胞反复而持续的发生变性㊁坏死㊁再生ꎬ最终会导致骨骼肌细胞细胞外基质大量沉积从而出现过度纤维化ꎬ丧失肌肉组织的部分收缩功能ꎬ最终影响肌肉力量和功能[3]ꎮ4㊀Hippo信号通路在骨骼肌损伤修复中的作用及机制4.1㊀促进骨骼肌卫星细胞和成肌细胞增殖㊀Hippo信号通路下游的核心构成元件是Taz与Yapꎬ二者均具有促进成肌细胞和骨骼肌卫星细胞增殖的功能ꎮ研究表明ꎬYap活性及表达量处于较高水平时ꎬ可以促进卫星细胞增殖ꎻ在敲低Yap的表达后ꎬ由肌卫星细胞分化而来的成肌细胞增殖数量也会降低ꎮ这表明在骨骼肌修复过程中Yap的表达量增加ꎬ可更进一步促进被活化的肌卫星细胞增殖[10]ꎮ这一过程主要是由于Yap/Taz与核内转录因子TEAD结合后ꎬ激活成肌细胞或骨骼肌肌卫星细胞中的特定基因启动子MCAT元件ꎬ进而参与调控与DNA复制㊁有丝分裂以及DNA修复等相关基因的表达ꎬ影响骨骼肌细胞周期进程ꎮ其中发现Yap高表达时ꎬ可激活与细胞周期相关的基因如周期基因D1ꎬ而Yap可促进骨骼肌肌卫星细胞保持高度增殖活性可能也与之相关[20ꎬ21]ꎮ㊀㊀有研究用一种可以增加细胞中未磷酸化Taz的化合物IBS008738表达后ꎬ增强了骨骼肌卫星细胞增殖期标志性基因的表达ꎮ这类增殖期标志性基因包括骨骼肌卫星细胞的特异性标记物Pax7及生肌决定因子(MyoD)ꎮ表明提高Taz表达量可起到促进骨骼肌卫星细胞的增殖的作用[22]ꎮ㊀㊀与此同时ꎬ骨骼肌卫星细胞的功能调节因子表达同样依赖Yap参与调控ꎬ如骨形态发生蛋白4㊁跨膜糖蛋白CD34和生肌调节因子Myf6[10]ꎮ故Yap蛋白可参与调节骨骼肌卫星细胞的增殖和功能ꎬ为骨骼肌损伤后修复提供稳定的肌卫星细胞储备ꎮ同时ꎬ也有研究指出ꎬYap蛋白过度表达会造成骨骼肌卫星细胞持续保持增殖状态ꎬ从而无法进入分化阶段ꎬ不利于骨骼肌的修复ꎮ如在活化的骨骼肌卫星细胞中Yap的持续激活和过表达状态可引发胚胎性横纹肌肉瘤样肿瘤[23]ꎮ4.2㊀调控成肌细胞分化㊀骨骼肌修复的后期ꎬYAP的mRNA和蛋白表达量在骨骼肌分化过程中下降ꎬ并且Yap过表达后ꎬ发现可以抑制成肌细胞的终末分化[10]ꎮ在C2C12成肌细胞开始分化后ꎬ磷酸化的Yap ̄Ser127是C2C12成肌细胞实现终末分化所必需的ꎬ通过过表达人类Yap蛋白(hYAP1S127A)突变体使未磷酸化的Yap的表达增多ꎬ显仅有较少C2C12成肌细胞离开增殖细胞周期ꎬ因而无法进一步分化成肌管[16]ꎮ值得注意的是ꎬ有研究用慢病毒敲低YAP的表达后ꎬ肌细胞正常行使收缩功能的肌球蛋白重链蛋白以及分化过程中充当启动子的肌细胞生成素表达量均降低ꎬ损害了成肌细胞向肌管的分化过程ꎬ并指出Yap调控成肌细胞分化是通过激活MEK5/ERK5信号通路得以实现[24]ꎮ提011示ꎬYap也参与骨骼肌分化过程当中ꎬ而是否最终阻碍成肌细胞的分化取决于Yap的量和磷酸化的Yap ̄Ser127量ꎮ㊀㊀在成肌细胞中ꎬ异位过表达Tazꎬ可增加肌源性基因表达并加速肌管的分化以及进一步促进新生肌纤维的形成ꎬ而敲低Taz的表达后ꎬ却出现了分化延迟现象ꎮ使用新型Taz调节剂TM ̄53和TM ̄54后ꎬ发现调节剂可增加Taz的核定位ꎬ增强成肌细胞的分化ꎮTaz可增强MyoD与肌细胞生成素基因启动子的相互作用ꎬ从而促进MyoD介导的肌源性基因表达[25ꎬ26]ꎮ同时值得注意的是ꎬ不适时的分化会造成激活的骨骼肌卫星细胞大量被消耗及成肌细胞过早分化成熟ꎬ同样会阻碍骨骼肌细胞的再生[27]ꎮ4.3㊀调控骨骼肌蛋白合成㊀用YapshRNA沉默肌肉中Yap蛋白的表达ꎬ结果显示肌肉质量和肌肉横截面积降低ꎬ说明Yap参与调控肌肉质量是通过影响蛋白质合成的过程得以实现[28]ꎮ有研究用一种新型化合物IBS008738以增加未磷酸化的Taz的表达ꎬ不仅增强了骨骼肌卫星细胞增殖期的标志性基因表达ꎬ同时也增加了蛋白质的合成ꎬ用以治疗小鼠的骨骼肌萎缩ꎬ说明Taz可以促进骨骼肌蛋白的合成[22]ꎮ对于调控骨骼肌蛋白合成过程ꎬ虽有结果证实增加Yap和Taz的表达量都促进骨骼肌蛋白的合成ꎬ有助于肌纤维质量的增加ꎮ但Yap过表达ꎬ却出现肌肉萎缩的现象ꎬ差异性的结果可能是在不同研究之间用于Yap过量表达的病毒载体以及Yap过量表达的时间存在差异所致[29ꎬ30]ꎮ㊀㊀骨骼肌损伤作为运动系统的常见疾患ꎬ其损伤后的不良修复可引起肌肉功能的障碍ꎬ常影响患者日常工作生活ꎬ故骨骼肌损伤后的修复逐渐被人们所关注ꎮ其中损伤骨骼肌修复过程中有多条信号通路参与肌细胞的再生修复过程ꎮ研究发现在骨骼肌损伤的再生修复过程中ꎬHippo通路发挥了关键性作用ꎮ其中Yap和Taz表达量增多可促进参与损伤骨骼肌再生修复的卫星细胞及成肌细胞的增殖ꎬ并且应注意ꎬ在骨骼肌卫星细胞中Yap的过量表达ꎬ有诱发胚胎性横纹肌肉瘤样肿瘤的可能ꎮYap以及磷酸化Yap ̄Ser127参与调控修复后期的分化过程并取决于二者的表达量ꎬ而增强Taz表达可以促进骨骼肌成肌细胞的分化ꎮ在损伤骨骼肌修复过程中ꎬ诱导增加通路下游的Yap和Taz表达量可促进骨骼肌蛋白的合成ꎬ有助于骨骼肌纤维功能的恢复ꎬ并可用于治疗骨骼肌萎缩ꎮ损伤骨骼肌修复过程中ꎬ干预Hippo通路上关键蛋白的表达有望成为治疗骨骼肌损伤及影响骨骼肌肌肉质量疾病的重要治疗手段ꎮ参考文献:[1]LehtoMUꎬJrvinenMJ.Muscleinjuriesꎬtheirhealingprocessandtreatment[J].AnnChirGynaecolꎬ1991ꎬ80(2):102 ̄108. [2]KimWꎬKimJꎬParkHSꎬetal.DevelopmentofMicrofluidicStretchSystemforStudyingRecoveryofDamagedSkeletalMuscleCells[J].Micromachinesꎬ2018ꎬ9(12):671.[3]邓修元ꎬ吴志彬ꎬ杨忠.骨骼肌纤维化的细胞与分子机制研究进展[J].中国康复理论与实践ꎬ2014ꎬ20(2):142 ̄147. [4]ShanTꎬZhangPꎬXiongYꎬetal.Lkb1deletionupregulatesPax7expressionthroughactivatingNotchsignalingpathwayinmyoblasts[J].IntJBiochemCellBꎬ2016ꎬ76:31 ̄38.[5]CisternasPꎬVioCꎬInestrosaNC.RoleofWntsignalingintissuefibrosisꎬlessonsfromskeletalmuscleandkidney[J].CurrMolMedꎬ2014ꎬ14(4):510 ̄522.[6]MaYꎬFuSꎬLuLꎬetal.Roleofandrogenreceptoroncyclicme ̄chanicalstretch ̄regulatedproliferationofC2C12myoblastsanditsupstreamsignals:IGF ̄1 ̄mediatedPI3K/AktandMAPKspathways[J].MolCellEndocrinolꎬ2017ꎬ450:83 ̄93.[7]JonesAEꎬPriceFDꎬLeGrandFꎬetal.Wnt/β ̄catenincontrolsfollistatinsignallingtoregulatesatellitecellmyogenicpotential[J].SkeletMuscleꎬ2015ꎬ5(1):14.[8]SunLꎬMaKꎬWangHꎬetal.JAK1 ̄STAT1 ̄STAT3ꎬakeypath ̄waypromotingproliferationandpreventingprematuredifferentiationofmyoblasts[J].JCellBiolꎬ2007ꎬ179(1):129 ̄138. [9]FuVꎬPlouffeSWꎬGuanKL.TheHippopathwayinorgandevel ̄opmentꎬhomeostasisꎬandregeneration[J].CurrOpinCellBiolꎬ2018ꎬ49:99 ̄107.[10]JudsonRNꎬTremblayAMꎬKnoppPꎬetal.TheHippopathwaymemberYapplaysakeyroleininfluencingfatedecisionsinmus ̄clesatellitecells[J].JCellSciꎬ2012ꎬ125(24):6009 ̄6019. [11]PanD.TheHippoSignalingPathwayinDevelopmentandCancer[J].DevCellꎬ2010ꎬ19(4):491 ̄505.[12]MoyaIMꎬHalderG.Hippo–YAP/TAZsignalinginorganregen ̄erationandregenerativemedicine[J].NatRevMolCellBioꎬ2019ꎬ20(4):211 ̄226.[13]MengZꎬMoroishiTꎬGuanKL.MechanismsofHippopathwayregulation[J].GenesDevꎬ2016ꎬ30(1):1 ̄17.[14]CamargoFDꎬGokhaleSꎬJohnnidisJBꎬetal.YAP1increasesor ̄gansizeandexpandsundifferentiatedprogenitorcells[J].CurrBi ̄olꎬ2007ꎬ17(23):2054 ̄2060.[15]LeeKPꎬLeeJHꎬKimTSꎬetal.TheHippo ̄Salvadorpathwayre ̄strainshepaticovalcellproliferationꎬliversizeꎬandlivertumori ̄genesis[J].ProcNatlAcadSciUSAꎬ2010ꎬ107(18):8248 ̄8253.[16]WattKIꎬJudsonRꎬMedlowPꎬetal.YapisanovelregulatorofC2C12myogenesis[J].BiochemBiophysResCommunꎬ2010ꎬ393(4):619 ̄624.[17]MohamedAꎬSunCꎬDeMelloVꎬetal.TheHippoeffectorTAZ(WWTR1)transformsmyoblastsandTAZabundanceisassociatedwithreducedsurvivalinembryonalrhabdomyosarcoma[J].JPatholꎬ2016ꎬ240(1):3 ̄14.[18]SchiaffinoSꎬPereiraMGꎬCiciliotSꎬetal.RegulatoryTcellsand111skeletalmuscleregeneration[J].FEBSJꎬ2017ꎬ284(4):517 ̄524.[19]DumontR.Characterizingsatellitecellsandmyogenicprogenitorsduringskeletalmuscleregeneration[M].NewYork:Histochemis ̄tryofSingleMoleculeꎬ2017:179 ̄188.[20]MizunoTꎬMurakamiHꎬFujiiMꎬetal.YAPinducesmalignantmesotheliomacellproliferationbyupregulatingtranscriptionofcellcycle ̄promotinggenes[J].Oncogeneꎬ2012ꎬ31(49):5117. [21]SunCꎬDeMelloVꎬMohamedAꎬetal.CommonanddistinctivefunctionsoftheHippoeffectorsTazandYapinskeletalmusclestemcellfunction[J].StemCellsꎬ2017ꎬ35(8):1958 ̄1972. [22]YangZꎬNakagawaKꎬSarkarAꎬetal.Screeningwithanovelcell ̄basedassayforTAZactivatorsidentifiesacompoundthaten ̄hancesmyogenesisinC2C12cellsandfacilitatesmusclerepairinamuscleinjurymodel[J].MolCellBiolꎬ2014ꎬ34(9):1607 ̄1621.[23]TremblayAMꎬMissiagliaEꎬGalliGGꎬetal.TheHippotransduc ̄erYAP1transformsactivatedsatellitecellsandisapotenteffectorofembryonalrhabdomyosarcomaformation[J].CancerCellꎬ2014ꎬ26(2):273 ̄287.[24]ChenTHꎬChenCYꎬWenHCꎬetal.YAPpromotesmyogenicdif ̄ferentiationviatheMEK5 ̄ERK5pathway[J].FASEBJꎬ2017ꎬ31(7):2963 ̄2972.[25]JeongHꎬBaeSꎬAnSYꎬetal.TAZasanovelenhancerofMyoD ̄mediatedmyogenicdifferentiation[J].FASEBJꎬ2010ꎬ24(9):3310 ̄3320.[26]ParkGHꎬJeongHꎬJeongMGꎬetal.NovelTAZmodulatorsen ̄hancemyogenicdifferentiationandmuscleregeneration[J].BrJPharmacolꎬ2014ꎬ171(17):4051 ̄4061.[27]刘晓光ꎬ陈佩杰ꎬ肖卫华.Wnt信号通路在骨骼肌损伤修复过程中的作用及机制研究[J].生命的化学ꎬ2018ꎬ38(5):724 ̄730. [28]WattKIꎬTurnerBJꎬHaggAꎬetal.TheHippopathwayeffectorYAPisacriticalregulatorofskeletalmusclefibresize[J].NatCommunꎬ2015ꎬ6:6048.[29]GnimassouOꎬFrancauxMꎬDeldicqueL.Hippopathwayandskel ̄etalmusclemassregulationinmammals:acontroversialrelation ̄ship[J].FrontPhysiolꎬ2017ꎬ8:190.[30]JudsonRNꎬGraySRꎬWalkerCꎬetal.ConstitutiveexpressionofYes ̄associatedprotein(Yap)inadultskeletalmusclefibresin ̄ducesmuscleatrophyandmyopathy[J].PLoSOneꎬ2013ꎬ8(3):e59622.(收稿日期:2019 ̄07 ̄20)作者 编者 读者一些常用词汇可直接用缩写胎牛血清(FBS)㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀体质量指数(BMI)㊀㊀㊀㊀㊀㊀㊀㊀㊀㊀天冬氨酸转氨酶(AST)磷酸盐缓冲液(PBS)总胆固醇(TC)人类免疫缺陷病毒(HIV)变异系数(CV)甘油三酯(TG)甲型肝炎病毒(HAV)磁共振成像(MRI)低密度脂蛋白胆固醇(LDL ̄C)乙型肝炎病毒(HBV)血红蛋白(Hb)高密度脂蛋白胆固醇(HDL ̄C)丙型肝炎病毒(HCV)核因子 ̄κB(NF ̄κB)重症监护病房(ICU)酶联免疫吸附测定(ELISA)逆转录 聚合酶链反应(RT ̄PCR)严重急性呼吸综合征(SARS)动脉血氧分压(PaO2)肿瘤坏死因子(TNF)动脉血二氧化碳分压(PaCO2)干扰素(IFN)凝血酶时间(TT)一氧化氮(NO)白细胞介素(IL)活化部分凝血活酶时间(APTT)纤溶酶原激活物抑制物(PAI)辅助性T淋巴细胞(Th)凝血酶原时间(PT)纤维蛋白降解产物(FDP)精制结核菌素试验(PPD)自然杀伤细胞(NK细胞)红细胞沉降率(ESR)丙氨酸转氨酶(ALT)数字减影血管造影(DSA)Glasgow昏迷评分(GCS)Glasgow预后评分(GOS)211。
Hippo信号通路与皮肤组织细胞修复研究进展

Hippo信号通路与皮肤组织细胞修复研究进展引言皮肤是人体最大的器官,具有保护和调节体温的重要功能。
皮肤组织的细胞修复与再生能力一直备受关注,对于外伤愈合、烧伤修复、皮肤疾病治疗等具有重要意义。
Hippo信号通路作为细胞增殖、再生以及肿瘤发展的重要调控通路,近年来在皮肤组织细胞修复领域的研究取得了重要进展。
本文将对Hippo信号通路在皮肤组织细胞修复方面的研究进展进行综述。
Hippo信号通路概述Hippo信号通路最初是在果蝇中发现的,后来被证实在哺乳动物中也广泛存在。
该通路主要包括Hippo、Salvador和Warts等核心成员,还包括一系列的上游调控器和下游靶标基因。
Hippo通路主要通过调控其核心成员在细胞生长、增殖、凋亡和细胞极性等方面的活性来影响细胞的生物学行为。
Hippo信号通路活化会导致核心成员的活性上调,抑制细胞增殖,促进细胞凋亡和抑制组织增殖,从而发挥抑制作用。
相反,Hippo信号通路的抑制则会促进细胞增殖和组织再生。
Hippo信号通路在皮肤组织的形成、修复和再生过程中发挥重要作用。
在胚胎期,Hippo信号通路通过调控皮肤上皮干细胞的增殖和分化来影响皮肤组织的形成。
在成体皮肤中,Hippo信号通路参与调控皮肤表皮细胞增殖、角质形成以及发育。
Hippo信号通路还影响皮肤衰老和修复过程。
以烧伤修复为例,研究人员发现Hippo信号通路在烧伤创伤愈合过程中发挥着重要作用。
烧伤会导致皮肤组织的严重损伤,进而引起炎症反应、纤维化和瘢痕形成。
研究发现,Hippo信号通路的抑制可以促进烧伤后皮肤组织的修复,减轻炎症反应和瘢痕形成,提高皮肤的再生能力。
这为开发新的烧伤修复治疗策略提供了重要思路。
Hippo信号通路在慢性创面愈合和皮肤疾病治疗方面也具有潜在的应用前景。
一些研究发现在玫瑰痤疮等炎症性皮肤疾病中,Hippo信号通路的激活与皮肤病变的发生和发展密切相关。
通过调控Hippo信号通路可以有望治疗这类皮肤疾病。
MVA和Hippo通路互作调节YAP-RHAMM转录来控制肿瘤转移

MVA和Hippo通路互作调节YAP-RHAMM转录来控制肿瘤转移透明质酸介导的运动受体(RHAMM)作为一种新发现的乳腺癌易感基因,和乳腺癌的高风险呈正相关性。
RHAMM的过表达能够激活ERK,促进乳腺癌细胞的迁移和浸润。
甲羟戊酸(MVA)途径能够合成对多种细胞功能非常重要的类异戊二烯化合物。
这里,我们发现RHAMM的表达能够被甲羟戊酸途径调节。
辛伐他汀是一种甲羟戊酸途径限速酶HMG-CoA还原酶的有效抑制剂,能够显著地抑制RHAMM的转录,而同时加入甲羟戊酸能够逆转这种效果。
辛伐他汀和慢病毒介导的shRNA下调RHAMM的表达都能在体外降低ERK的磷酸化水平,抑制乳腺癌细胞的迁移和浸润。
Hippo信号通路的共转录激活因子Yes相关蛋白(YAP)对哺乳动物器官大小控制、组织再生和肿瘤发展非常重要。
活化的YAP能够结合转录因子TEAD从而活化依赖YAP的基因的表达。
为了研究甲羟戊酸途径调节RHAMM转录的机制,我们发现在RHAMM启动子序列里有两个可能的YAP-TEAD结合位点,并且发现慢病毒介导的shRNA抑制YAP 或TEAD的表达能够下调RHAMM的转录,导致ERK磷酸化水平的下降,乳腺癌细胞迁移和浸润的抑制。
而且,辛伐他汀显著地增加了YAP磷酸化的水平以及YAP 的细胞质定位,而同时加入甲羟戊酸能减少YAP的磷酸化水平,并且将YAP重新定位到细胞核中。
我们进一步证明了甲羟戊酸途径下游的牻牛儿牻牛儿化是调节YAP活性、RHAMM转录和ERK活性所必需的,而且这种调节是通过甲羟戊酸途径介导的Rho GTPase的活性和细胞骨架的组装来实现的,但是并不依赖于Hippo信号通路的核心激酶MST和LATS的活性。
总之,我们在体内和体外的结果证明了甲羟戊酸途径能够调节Hippo信号通路的一个重要组分YAP的活性,从而控制RHAMM的转录,最终通过影响ERK的活性来调节乳腺癌细胞的迁移和浸润。
我们的结果首次将甲羟戊酸途径和Hippo信号通路联系在一起,其中RHAMM 是下游的效应分子,同时RHAMM也是YAP转录和辛伐他汀抑制的靶点和肿瘤转移的介导子;揭示了调控RHAMM表达和肿瘤转移的机制;解释了辛伐他汀抗肿瘤的新机制;并且提供了可用于肿瘤治疗的潜在的靶点。
Hippo信号通路与皮肤组织细胞修复研究进展

Hippo信号通路与皮肤组织细胞修复研究进展
Hippo信号通路是一种重要的细胞信号通路,它在细胞增殖、细胞凋亡、细胞迁移和组织发育中发挥着重要作用。
近年来,Hippo信号通路在皮肤组织细胞修复研究中备受关注,成为了许多科研人员的研究热点。
本文将对Hippo信号通路在皮肤组织细胞修复领域的研究进展进行详细介绍。
Hippo信号通路的基本原理是指在细胞内外环境发生变化时,通过一系列信号传导分子来调控细胞的增殖与存活。
Hippo信号通路的核心成员是由MST1/2(mammalian
STE20-like kinase 1/2)和LATS1/2(large tumor suppressor 1/2)组成的蛋白激酶复合物。
在正常情况下,MST1/2激活LATS1/2,LATS1/2进而激活YAP/TAZ蛋白的磷酸化,使其维持在细胞质中,从而抑制了其下游靶基因的表达,抑制细胞增殖和促进细胞凋亡。
而在一些病理情况下,如组织损伤和恶性肿瘤发生时,Hippo信号通路会被抑制,导致
YAP/TAZ蛋白进入细胞核,在那里激活一系列靶基因,促进细胞增殖和抑制细胞凋亡。
在皮肤组织细胞修复研究中,Hippo信号通路的研究内容主要包括两个方面,一是探究Hippo信号通路在皮肤细胞增殖和凋亡中的作用机制,二是探究Hippo信号通路在皮肤组织再生和修复中的作用机制。
在细胞水平上,Hippo信号通路通过调控YAP/TAZ蛋白的活性,进而调控细胞增殖和凋亡。
在皮肤组织再生和修复过程中,Hippo信号通路通过调控干细胞的增殖和分化,参与皮肤组织的愈合和修复过程。
Hippo信号通路在肺纤维化过程中调控机制的研究进展

Hippo信号通路在肺纤维化过程中调控机制的研究进展高 歌 金钰莹 延光海 崔 弘△(延边大学医学院机能学实验教学中心,吉林省过敏性常见疾病免疫与靶向研究重点实验室,延吉133002)摘要 Hippo信号通路是一条存在于从低等动物到高等动物,高度保守且由蛋白激酶和转录辅助激活因子组成的级联激酶反应链,整合来自细胞微环境的物理和化学信号,调节多种细胞的形态和功能。
生理条件下,Hippo通过磷酸化核心信号轴负性调控YAP/TAZ的转录活性,进而调控下游靶基因转录,参与多细胞生物的增殖、凋亡、分化等生理过程。
近年来研究表明,Hippo通路的激活与失活,参与肺纤维化病理过程。
本文对Hippo信号通路与肺纤维化的最新研究进展进行综述,为研究肺纤维化的治疗提供参考。
关键词 肺纤维化;Hippo信号通路;Yes相关蛋白(YAP)/含PDZ结合基序的转录共激活因子(TAZ);细胞外基质;上皮 间充质转化中图分类号 R563;R329;R34 Salvador/Warts/Hippo(SWH)通路,也被称为Hippo信号通路。
上世纪末,研究发现敲除果蝇体内Hippo同源基因导致其体表过度生长出翅膀、肢体和眼睛样的上皮结构,因表型像河马而由此得名[1]。
研究发现Hippo信号通路广泛参与调控哺乳动物的干细胞分化,器官发育,组织再生,肿瘤发生等生物学过程[2,3]。
肺纤维化(pulmonaryfibrosis,PF)是一种机制不明的慢性进行性,且不可逆的间质性疾病,患者平均生存周期仅为2.8年[4]。
近年来研究表明Hippo信号通路与PF密切相关,本文就Hippo信号通路在肺纤维化病程中作用进行简单综述。
一、Hippo信号通路的组成1995年,在对果蝇基因嵌合体筛查时首次发现了Hippo信号通路[5]。
哺乳动物中经典的Hippo信号通路主要由哺乳动物不育系20样激酶1/2(mam maliansterile20 likekinases1/2,MST1/2)、萨尔瓦多家族含WW结构域蛋白1(SalvadorfamilyWWdoma incontaining1,SAV1)、大型肿瘤抑制因子1/2(largetumorsuppressorkinases1/2,LATS1/2)、MOB激酶激活因子1(MpsOneBinderkinaseactivator like1,MOB1)、Yes相关蛋白(Yes associatedprotein,YAP)/含PDZ结合基序的转录共激活因子(tran scriptionalcoactivatorwithPDZ bindingmotif,TAZ)、TEA结构域1 4(TEAdomain1 4,TEAD1 4)等组成(Yu等.2013)。
意大利蜜蜂Hippo_信号通路相关基因及其全长转录本的鉴定与分析

湖南农业大学学报(自然科学版)2023,49(5):529–534.DOI:10.13331/ki.jhau.2023.05.005Journal of Hunan Agricultural University(Natural Sciences)引用格式:张佳欣,高旭泽,陈梦君,宋宇轩,荆欣,刘治滩,冯佩林,陈大福,郭睿.意大利蜜蜂Hippo信号通路相关基因及其全长转录本的鉴定与分析[J].湖南农业大学学报(自然科学版),2023,49(5):529–534.ZHANG J X,GAO X Z,CHEN M J,SONG Y X,JING X,LIU Z T,FENG P L,CHEN D F,GUO R.Identification and investigation of genes and their full-length transcripts relative to Hippo signaling pathway inApis mellifera ligustica[J].Journal of Hunan Agricultural University(Natural Sciences),2023,49(5):529–534.投稿网址:意大利蜜蜂Hippo信号通路相关基因及其全长转录本的鉴定与分析张佳欣1,高旭泽1,陈梦君1,宋宇轩1,荆欣1,刘治滩1,冯佩林1,陈大福1,2,郭睿1,2*(1.福建农林大学动物科学学院(蜂学学院),福建福州350002;2.福建省蜂疗研究所,福建福州350002)摘要:采用Blast工具将已鉴定到的意大利蜜蜂(Apis mellifera ligustica,简称意蜂)全长转录本比对Nr数据库,共鉴定到意蜂Hippo信号通路中相关的49个基因及其550条全长转录本。
运用Gffcompare软件将鉴定到的Hippo 信号通路相关全长转录本与西方蜜蜂参考基因组(Amel_HAv3.1)上注释的转录本进行比较,分别延长西方蜜蜂参考基因组注释到Hippo信号通路的9个基因的5'UTR和7个基因的3'UTR。
浅谈Hippo信号通路在心血管中细胞代谢的研究进展

一旦激活 Ste20 样蛋白激酶 1 / 2( MST1 / 2) ,Hippo 信号
通路的开关就被打开。 活化的 MST1 / 2 可与支架蛋白 SAV1
相互作用,形成 MST1 / 2 -SAV1 复合体。 该复合体可增强
大初期时,糖酵解对心肌细胞所需 ATP 的贡献率增加,糖酵
Ca2+稳态。 心肌代偿性肥大是一种适应性反应,通过减少壁
GLUT1 介 导。 之 后 研 究 发 现 在 心 衰 老 鼠 心 脏 中 观 察 到
激酶激活剂 1A 和 1B( MOB1A / B) 、Yes 相关蛋白( YAP) 和
运,并保护心脏免受压力超负荷引起的心肌肥大和功能障
2) 、支架蛋白萨尔瓦多同源物 1( SAV1) 、支架蛋白 MOB 域
GLUT1 的上调,GLUT1 的过度表达可增加心脏中葡萄糖转
可导致 YAP / TAZ 去磷酸化,去磷酸化的 YAP / TAZ 能够转位
到细胞核内,YAP 与转录因子( TEAD) 相互结合,形成 YAP -
TEAD 复合体。 该复合体的形成启动了基因转录,参与调控
细胞的增殖、分化及代谢。
三、 Hippo 信号通路与细胞代谢
( 一) Hippo 信号通路与心肌细胞糖代谢
体内外实验研究发现 Hippo 信号通路在心肌细胞糖代
谢中发挥作用,增强心肌细胞糖代谢效率,可以促进 Hippo
信号通路中 YAP 的活化和心肌细胞增殖。 在健康成人和老
鼠心脏中,葡萄糖转运到心肌细胞是通过葡萄糖转运蛋白
样蛋白激酶 1 / 2( MST1 / 2) 、大型肿瘤抑制激酶 1 / 2( LATS1 /
内皮细胞、脂肪细胞中的 Hippo 信号通路发挥着重要作用。 文章主要针对 Hippo 信号通路在心血管这一系列细胞代谢中的作用
Hippo信号通路简介
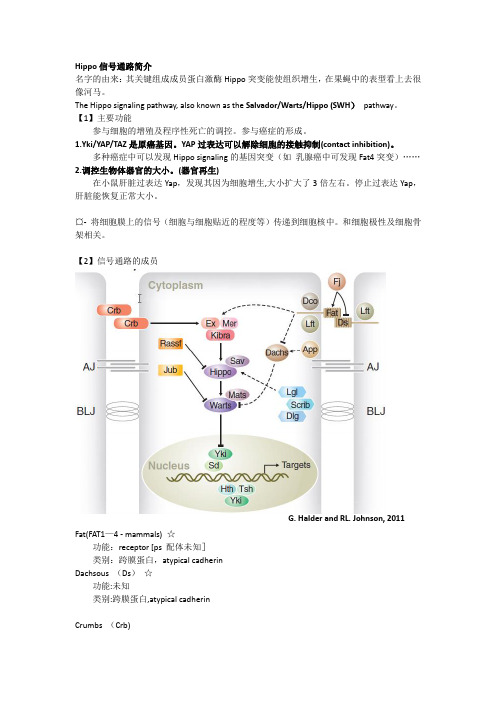
Hippo信号通路简介名字的由来:其关键组成成员蛋白激酶Hippo突变能使组织增生,在果蝇中的表型看上去很像河马。
The Hippo signaling pathway, also known as the Salvador/Warts/Hippo (SWH)pathway。
【1】主要功能参与细胞的增殖及程序性死亡的调控。
参与癌症的形成。
1.Yki/YAP/TAZ是原癌基因。
YAP过表达可以解除细胞的接触抑制(contact inhibition)。
多种癌症中可以发现Hippo signaling的基因突变(如乳腺癌中可发现Fat4突变)……2.调控生物体器官的大小。
(器官再生)在小鼠肝脏过表达Yap,发现其因为细胞增生,大小扩大了3倍左右。
停止过表达Yap,肝脏能恢复正常大小。
¤- 将细胞膜上的信号(细胞与细胞贴近的程度等)传递到细胞核中。
和细胞极性及细胞骨架相关。
【2】信号通路的成员G. Halder and RL. Johnson, 2011Fat(FAT1—4 - mammals) ☆功能:receptor [ps 配体未知]类别:跨膜蛋白,atypical cadherinDachsous (Ds)☆功能:未知类别:跨膜蛋白,atypical cadherinCrumbs (Crb)功能:独立于Fat之外,保证Ex的apical定位。
类别:transmembrane apical determinantKibra—Ex-Mer (KEM)complex ☆功能:和hippo通路有物理上的互作,可能使得hippo通路上的关键组分定位在的细胞膜上,以便激活.Fat可能通过Ex来激活Hippo通路。
Ex可直接结合并抑制Yki的活性.Expanded (Ex)(FRMD6/Willin —mammals)类别:FERM domain-containing proteinsKibra (KIBRA —mammals)类别:WW domain-containing proteinMerlin (Mer)(NF2 in mammals)类别:FERM domain-containing proteinsFour—jointed (Fj)功能:将Fat与Ds胞外的部分磷酸化,来影响它们的相互作用和活性。
Hippo-YAP信号通路与多种疾病的研究进展

Hippo-YAP信号通路与多种疾病的研究进展李楠;沙丽【摘要】Hippo signaling pathway is a signaling pathway that regulates cell division and proliferation, differentiation and apoptosis, and YAP is an effector of this pathway, which has the ability to initiate transcription translation of Hippo pathway genes. A large number of experiments confirmed that Hippo signaling pathway and YAP have important effects on many diseases, especially cancer and chronic cardiovascular diseases. The research progress of Hippo-YAP signaling pathway and various diseases is reviewed in this paper.%Hippo 信号通路是一个能够调控细胞分裂增殖分化和凋亡的信号通路,YAP 是该通路的一个效应因子,有着启动 Hippo 通路基因转录翻译的能力。
实验证实 Hippo 信号通路和 YAP 对多种疾病都具有重要影响,特别是癌症和慢性心血管疾病。
本研究主要对 Hippo-YAP信号通路与多种疾病的研究进展作如下综述。
【期刊名称】《中国继续医学教育》【年(卷),期】2016(008)020【总页数】2页(P50-51)【关键词】Hippo 信号通路;YAP;神经胶质瘤;肿瘤;心血管;肝炎【作者】李楠;沙丽【作者单位】大连医科大学临床医学七年制,辽宁大连 116000;大连医科大学临床医学七年制,辽宁大连 116000【正文语种】中文【中图分类】R73Hippo信号转导通路是1995年在果蝇体内首次发现的一个信号转导通路,受到GPCR(G蛋白耦联受体)信号和甲羟戊酸途径的调节。
生物博士论文Hippo通路效应蛋白YAP调控基因转录的机制与功能研究

生物博士论文Hippo通路效应蛋白YAP调控基因转录的机制与功能研究生物博士论文:Hippo通路效应蛋白YAP调控基因转录的机制与功能研究引言:生物体内的细胞数量和组织大小的调节是一个复杂而精确的过程,它涉及到多种信号通路的调控。
其中,Hippo通路被发现在调控细胞增殖、凋亡和组织生长中起着重要作用。
Hippo通路的核心效应蛋白YAP(Yes-associated protein)在这一过程中扮演着关键角色,其调控机制和功能一直是生物学领域的研究热点。
1. YAP的结构和功能YAP是一种核质分布的蛋白,由WW结构域、TEAD结合域和转录激活结构域组成。
YAP在细胞核中与转录因子TEAD结合,促进目标基因的转录。
YAP通过与其他蛋白相互作用,参与细胞增殖、凋亡、迁移以及干细胞的自我更新等生物学过程。
2. Hippo通路的调控机制Hippo通路通过一系列信号传导分子的相互作用来调控YAP的活性。
在正常情况下,Hippo通路激活后,MST1/2激酶磷酸化并激活LATS1/2激酶,进而磷酸化YAP,使其被细胞核外蛋白14-3-3结合,导致YAP的核转位和降解。
而在Hippo 通路失活时,未磷酸化的YAP进入细胞核,与TEAD结合,促进基因转录。
3. YAP调控基因转录的机制YAP通过与TEAD结合来调控目标基因的转录。
YAP的结构域与TEAD的DNA结合域相互作用,形成复合物,结合到目标基因的启动子区域。
YAP-TEAD复合物激活了一系列基因,包括促细胞增殖的基因、抑制凋亡的基因等。
此外,YAP还可以与其他转录因子如RUNX、p73等相互作用,进一步调控基因的转录。
4. YAP的功能研究YAP在生物体内的功能研究表明,它在胚胎发育、器官生成和再生中起着重要作用。
YAP的过度激活会导致组织过度生长和肿瘤的发生。
研究还发现YAP在肝脏再生、心肌再生和肾脏发育中发挥着关键作用。
YAP还参与干细胞的自我更新和分化过程。
Hippo 信号通路与肿瘤、炎症关系的研究进展

Hippo 信号通路与肿瘤、炎症关系的研究进展
乔欣(综述);李华;陈规划(审校)
【期刊名称】《器官移植》
【年(卷),期】2014(5)6
【摘要】Hippo信号通路是1995年在对果蝇研究中发现的高度保守的生长控制信号通路,具有调控器官体积大小与平衡细胞增殖凋亡的作用。
目前,Hippo信号通路已被证实参与多个器官肿瘤的发生。
炎症是机体内一种复杂的防御性反应,是机体为消除各种外源性或内源性损伤因子、清除和吸收坏死组织和细胞、修复损伤的过程。
【总页数】4页(P389-391,398)
【作者】乔欣(综述);李华;陈规划(审校)
【作者单位】510630 广州,中山大学附属第三医院肝脏外科;510630 广州,中山大学附属第三医院肝脏外科;510630 广州,中山大学附属第三医院肝脏外科
【正文语种】中文
【中图分类】R617
【相关文献】
1.Hippo信号通路与炎症的研究进展 [J], 麻明彪; 丁喆; 宝福凯; 柳爱华; 杜廷义; 陶律延; 屈柯暄; 李小娟; 计震华; 简苗苗; 陈泰桂; 罗丽莎
2.食管鳞癌肿瘤干细胞与HIPPO/YAP信号通路的研究进展 [J], 林炯臻
3.Hippo信号通路及其在消化系统肿瘤中的作用研究进展 [J], 黄耀凭; 杨凤; 周天华; 谢珊珊
4.Hippo信号通路相关分子与肿瘤发生的研究进展 [J], 齐海霞; 柴艳芬
5.Hippo信号通路在消化系统肿瘤中的研究进展 [J], 石颖方;国麟祺;王虬玥;姜文达;杨彦民
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Hippo信号通路
一、Hippo信号通路概述
Hippo 信号通路,也称为Salvador / Warts / Hippo(SWH)通路,命名主要源于果蝇中的蛋白激酶Hippo(Hpo),是通路中的关键调控因子。
该通路由一系列保守激酶组成,主要是通过调控细胞增殖和凋亡来控制器官大小。
Hippo信号通路是一条抑制细胞生长的通路。
哺乳动物中,Hippo信号通路上游膜蛋白受体作为胞外生长抑制信号的感受器,一旦感受到胞外生长抑制信号,就会激活一系列激酶级联磷酸化反应,最终磷酸化下游效应因子YAP和TAZ。
而细胞骨架蛋白会与磷酸化后的YAP和TAZ结合,使它滞留在细胞质内,降低其细胞核活性,从而实现对器官大小和体积的调控。
二、Hippo信号通路家族成员
虽然Hippo信号通路在各个物种中保守性很高,但是相同功能的调控因子或效应因子在不同物种间还是存在着差异,下表中我们对比了果蝇与哺乳动物中Hippo信号通路相同功能的关键因子[1]。
三、Hippo信号通路的功能
近十年相关研究结果表明,无论是果蝇还是哺乳动物,Hippo信号通路都可以通过调节细胞增殖、凋亡和干细胞自我更新能力实现对器官大小的调控。
Hippo信号通路异常会导致大量组织过度生长。
此外,大量研究证实,Hippo信号通路在癌症发生、组织再生以及干细胞功能调控上发挥着重要功能[2][3][4]。
a.Hippo信号通路在器官大小控制中的作用
起初,关于Hippo信号通路的研究主要集中在器官大小的调控。
大量研究表明,Hippo 途径主要通过抑制细胞增殖并促进细胞凋亡,继而实现对器官大小的调控。
激酶级联反应是该信号传导的关键。
Mst1/2激酶与SA V1形成复合物,然后磷酸化LATS1/2;活化后的LATS1/2激酶随即磷酸化Hippo信号通路下游关键效应分子——Y AP和TAZ,同时抑制了
YAP和TAZ的转录活性。
反之,未磷酸化的YAP/TAZ会进入细胞核与TEAD1-4或其他转录因子结合,继而诱导促增值和抑凋亡的基因表达上调。
Hippo通路在器官大小中的调控作用已在小鼠模型中得到证实。
比如肝脏中的YAP特异性过表达会导致肝脏增大,但一旦停
止YAP过表达,肝脏大小可以恢复正常[5][6]。
b.Hippo信号通路在破骨细胞形成中的作用
成骨细胞骨形成与破骨细胞骨吸收间的平衡在保持骨稳态中起关键作用。
相关研究表明,Hippo信号通路是调控该平衡的途径之一,涉及的主要调控因子包括RASSF2,NF2,MST1/2,SA V1,LATS1/2,Ajuba,MOB1,YAP和TAZ。
其中,RASSF2,NF2和MST1/2主要参与破骨细胞增殖前期调控,而SA V1,LATS1/2,Y AP和TAZ参与破骨细胞分化调节[7][8][9][10]。
此外,参与骨凋亡调节的基因RASSF,MST和TAZ,它们同样也是Hippo信号传导途径的下游基因[11][12][13]。
一般来说,破骨细胞的细胞过程包括破骨细胞前体增殖,破骨细胞分化及凋亡,其中凋亡又涉及了不同分子级联。
大量的证据表明,Hippo通路可能通过与NF-κB,MAPK和钙信号通路相互作用在这些过程中发挥作用。
在Hippo-和NF-κB信号通路中,RASSF2和MST2可以分别通过抑制IKK和I-κBα活性来阻断NF-κB信号通路。
在Hippo-和MAPK信号传导途径中,Ajuba可以激活TRAF6,YAP / TAZ / TEAD可以激活ERK、JNK、p38和AP1。
此外,在Hippo和钙信号传导途径中,Y AP激活CREB和TEADs依赖于降低神经钙蛋白活性,从而抑制NFATc1[7]。
四.Hippo信号通路和疾病
a. Hippo信号通路和癌症
癌症是涉及异常细胞生长,可能侵入或蔓延到其他多个身体部位的疾病。
虽然第一次发现Hippo通路是因为它可以通过促进细胞凋亡及抑制细胞周期来控制成像椎间盘生长,但是目前在动物模型中的研究已经将该通路的功能扩展到了其他癌症,如乳头状肾癌,结直肠癌,卵巢癌,乳腺癌和胃癌[14][15][16][17][18]。
Carole Sourbier的研究显示,用达沙替尼靶向抑制YAP激活肿瘤中的Yes可能对失去Hippo信号通路调节的NF2缺陷型PRCC肿瘤患者具有治疗潜力。
另一研究表明TFAP2C通过转录激活Hippo信号传导的负调控因子ROCK1和ROCK2促进CSCs特征和化疗耐药,导致结肠直肠癌(CRC)细胞中Hippo信号的失活。
Y AP / TAZ-TEAD转录因子复合物代表致癌转化的普遍目标。
已经证实YAP基因位点在人和小鼠
肿瘤如髓母细胞瘤,肺癌,胰腺癌,食管癌,肝癌和乳腺癌中以不同频率上调[19]。
b.心血管发展中的Hippo信号通路
无论是发达国家还是发展中国家,心脏病仍然是主要的致死因素。
心脏畸形可直接导致胚胎死亡或出生后死亡,而且在强烈刺激如压力超负荷或局部缺血情况下,导致的心脏损伤是不可逆转的。
相关研究显示,Hippo信号通路参与了多个生理病理过程的调控,包括心血管发育、肥大、细胞凋亡、自噬、血管生成和再生[20][21][22][23][24]。
Heallen等人研究证实,心脏特异性敲除SA V1,会阻断Hippo信号传导途径,明显降低YAP磷酸化水平,从而导致心脏扩大,但细胞大小不变。
这一结果在MST1/2和LATS2基因敲除小鼠中也得到了验证[20]。
而且在经腺病毒处理的RASSF1A转基因小鼠中,磷酸化MST1明显增多,加速了心肌细胞的凋亡。
但若是将成纤维细胞和心脏暴露于超负荷压力下,可以减弱他们的增殖能力[21]。
Hippo信号通路相关抗体的应用:
Hippo信号通路的抗体可应用于WB、IHC、IF、IP、Chip等的检测。
参考文献:
[1]Azucena Ramos, Fernando D. Camargo. The Hippo signaling pathway and stem cell biology[J]. Trends in Cell Biology. 2012, 22(7):339-346.
[2] Zhao B, Tumaneng K, et al. The Hippo pathway in organ size control, tissue regeneration and stem cell self-renewal. Nat. Cell Biol. 2011, 13(8):877-83.
[3] Yang W, Han W, et al. The emerging role of Hippo signaling pathway in regulating osteoclast
formation[J]. J Cell Physiol. 2018, 233(6):4606-4617.
[4] Pan D. The hippo signaling pathway in development and cancer[J]. Dev Cell. 2010,19(4):491-505.
[5] Camargo FD. YAP1 increases organ size and expands undifferentiated progenitor cells. Curr. Biol. 2007, 17:2054-2060.
[6] Dong J. Elucidation of a universal size-control mechanism in Drosophila and mammals. Cell. 2007, 130:1120-1133.
[7] Wanlei Yang, Weiqi Han, et al. The emerging role of Hippo signaling pathway in regulating osteoclast formation[J]. J Cell Physiol. 2018, 233(6):4606-4617.
[8] Song, H., Kim, H.,et al. Ablation of Rassf2 induces bone defects and subsequent haematopoietic anomalies in mice[J]. EMBO J. 2012, 31:1147-1159.
[9] Larsson, J., Ohishi, M.,et al. Nf2/merlin regulates hematopoietic stem cell behavior by altering microenvironmental architecture[J]. Cell Stem Cell. 2008, 3: 221-227.
[10] Allen, N.P., Donninger, H., et al. RASSF6 is a novel member of the RASSF family of tumor suppressors[J]. Oncogene. 2007, 26: 6203-6211.。
