资深PI最新文章解析信号通路
PI3K AKT信号通路与肿瘤的最新研究进展

PI3K AKT信号通路与肿瘤的最新研究进展PI3K/AKT信号通路与肿瘤的最新研究进展一、PI3K/AKT综述PI3K/Akt信号通路作为细胞内重要信号转导通路之一,参与很多重要的生物学过程的调控,其通过影响下游多种效应分子的活化状态,在细胞内发挥着抑制凋亡、促进增殖的关键作用,与人类多种肿瘤的发生、发展密切相关。
正因为PI3K/AKT通路在肿瘤治疗方面有着巨大潜力,其近年来也成为生物科学界的研究热点。
现就对PI3K/AKT的组成结构,机制功能,与癌症的关系及相关抑制剂做一个综述。
二、组成与结构PI3K(Phosphatidylinositol-4,5-bisphosphate 3-kinase)分为3个不同的类别:Ⅰ、Ⅱ和Ⅲ类,所属分类是基于其主要结构,调控规律和体外脂质底物的特异性。
I类PI3K是负责生产PI(3)P,PI(3,4)P2,PI(3,4,5)P3的,I类PI3K是一个监管和催化亚基组成的异二聚体分子;它们进一步根据IA和IB之间子集上的序列相似性划分。
IA类PI3K 是由P110催化亚基和p85亚基调节亚基之间的异二聚体,包括p85调节亚基的5种变体,分别是p85α,p55α,p50α,p85β和p55γ,也有P110催化亚基衍生的p110α,β,δ三个变体。
ⅠB亚类包括p110γ,它并不与p85结合,而是与1个相对分子质量为101×103的接头蛋白结合,此接头蛋白可介导G蛋白的β、γ亚基活化p110。
Ⅱ类包括3个催化亚基C2α,C2β,和C2γ,但是不像Ⅰ类和Ⅲ类,它没有调节蛋白,Ⅱ类催化PI产生PI(3)P,催化PIP产生PI(3,4)P2,但是关于他们在免疫细胞中的作用目前所知甚少。
Ⅲ类只催化PI产生PI(3)P,从结构上来说与Ⅰ类相似,因为他们有一个催化亚基(VPS34)和一个调节亚基(Vps15/ P150)的异二聚体,第Ⅲ类似乎主要是参与蛋白和囊泡运输,也有证据表面,它可以帮助免疫细胞在一些重要进程中发挥作用,尤其是吞噬作用的有效性。
PI3KAKT、RTK相关、TGF

RTK在细胞增殖、分化、迁移、凋亡等生理过程中发挥重要作用。
A
B
C
D
RTK通过激活下游信号通路,促进细胞周期进展和DNA合成,从而推动细胞增殖。
细胞增殖
细胞分化
细胞迁移
细胞凋亡
RTK信号通路参与调控细胞分化相关基因的表达,决定细胞向不同方向分化。
PI3KAKT与RTK信号通路的交叉对话
RTK通过磷酸化作用激活PI3K,进而激活AKT信号通路,参与细胞生长、增殖和存活等过程的调控。
PI3KAKT信号通路可以被RTK激活
PI3KAKT信号通路的激活可以促进RTK的表达和活性,形成正反馈调节机制,进一步放大信号效应。
PI3KAKT信号通路对RTK的反馈调节
单克隆抗体
针对RTK的特异性抗体,可以阻断RTK与其配体的结合,进而抑制RTK信号通路的激活。
多靶点抑制剂
同时抑制多个RTK的活性,具有更广泛的抗肿瘤谱和更低的耐药性。
03
02
01
THANKS
感谢您的观看。
调节细胞代谢
PI3KAKT信号通路可以调节细胞的糖酵解、脂肪酸合成和蛋白质合成等代谢过程,以满足细胞生长和增殖的需求。
02
CHAPTER
RTK相关信号通路
1Leabharlann 23RTK(Receptor Tyrosine Kinase)是一类受体酪氨酸激酶,其结构包括细胞外配体结合域、跨膜域和细胞内酪氨酸激酶域。
RTK通过调控细胞骨架重排和黏附分子的表达,影响细胞的迁移能力。
RTK信号通路在细胞凋亡过程中发挥双向调控作用,既可以促进也可以抑制细胞凋亡。
自噬过程中磷脂酰肌醇信号通路的调节研究

自噬过程中磷脂酰肌醇信号通路的调节研究自噬是细胞通过溶酶体分解和回收细胞内垃圾物质的过程。
近年来,自噬被发现对于维持细胞的稳态、减缓衰老和对抗疾病等重要作用。
磷脂酰肌醇(PI)信号通路是自噬调节中的一个重要组成部分,因此,研究PI信号通路的调节对于深入了解自噬过程具有重要意义。
自噬是一种高度保守的生物学现象,大多数生物种的细胞都能进行自噬。
在自噬过程中,先通过形成一个隔离膜,把特定的细胞器或物质包裹进去,形成一个内腔,随后这个内腔会融合到溶酶体中,并通过溶酶体内各种水解酶对内腔中的物质进行降解,最终释放出营养物质和废物。
磷脂酰肌醇(PI)信号通路包括PI3K-Akt-mTOR和PI3K-Beclin1-Atg14L/Vps34等两个分支,分别参与自噬的运行机制。
如果PI3K信号通路持续激活,细胞会抑制自噬过程;而如果PI3K信号通路被抑制,细胞将会引发自噬。
因此,调节PI信号通路的活性是自噬过程一个非常重要的调控机制。
PI3K-Akt-mTOR信号通路通过磷酸化和抑制ULK1(Autophagy-related protein 1)来抑制自噬过程。
ULK1是自噬发生的早期事件,其磷酸化会抑制其自身激酶活性。
这一机制能够通过调节IRS-1/Akt/mTOR信号通路来发挥作用。
当IRS-1/Akt/mTOR信号通路被激活的时候,细胞将会抑制自噬与ULK1的磷酸化,因此阻止自噬发生。
相反的,当细胞发生紧急情况、糖葡萄糖原储备枯竭和氧/营养不足时,细胞会被迫通过自噬来进行细胞垃圾清理和提供能量的需求。
这时,PI3K信号通路被抑制,Beclin1和Atg14L结合后的复合物会增强Vps34的活性,从而诱导自噬泡形成。
此外,PI信号通路中的另一个分支PI3K-Beclin1-Atg14L/Vps34也参与了自噬的形成。
在这个过程中,Vps34活性的明显增加,会导致自噬囊泡的形成和发展。
而Beclin1和Atg14L会通过协同作用来调节Vps34的激活。
信号通路合辑

信号通路合辑纵观现如今的科研发展趋势,⽆论哪⽅⾯的研究都脱离不了分⼦机制,其实归根结底就是搞明⽩信号通路中上下游的基因是如何调控的,受到了哪些因素的影响。
华美⽣物特别整理了各研究领域信号通路⽰意图,以便于我们获取最直接的科研思路。
AMPK signaling pathway腺苷酸激活蛋⽩激酶 (AMPK) 在细胞能量稳态调节中起到关键作⽤。
在低⾎糖、低氧、缺⾎和热休克等情况下,可激活AMPK。
AMPK可作为异源三聚体复合体出现,内含⼀个催化性α亚单位和调节性β和γ亚单位。
AMP结合到γ亚单位后,可变构激活复合体,使其苏氨酸172位点更易磷酸化的底物,在α亚单位的激活环中更易被主要的上游AMPK激酶LKB1 磷酸化。
AMPK还能被CAMKK2在苏氨酸172位点直接磷酸化,这是由代谢激素(如脂联素和瘦素)刺激后胞内钙离⼦⽔平变化引起的反应。
作为细胞能量感受器,AMPK 可对ATP低⽔平做出反应,被激活后,可对补充细胞 ATP 供应的信号转导通路做出正向调控,这些通路包括脂肪酸氧化和⾃噬。
Apoptosis细胞凋亡,为⼀种细胞程序性死亡。
相对于细胞坏死(necrosis),细胞凋亡是细胞主动实施的。
细胞凋亡⼀般由⽣理或病理性因素引起。
⽽细胞坏死则主要为缺氧造成,两者可以很容易通过观察区分开来。
Caspase家族属于半胱氨酸蛋⽩酶。
起始组Caspase包括caspase-2,-8,-9,-10,-11和-12,与促凋亡信号紧密相连,⼀旦激活,这些酶会切割并激活下游的效应组Caspase,包括Caspase-3,-6,-7。
效应 Caspase通过对细胞内蛋⽩特定的天冬氨酸残基位置处进⾏切割实现细胞的凋亡。
FasL和 TNF对Fas和 TNFR的结合能够激活caspase-8和-10。
DNA损伤诱导PIDD的表达,PIDD与RAIDD 和caspase-2结合并激活caspase-2。
受损线粒体中释放的细胞⾊素C与caspase-9的活化相关。
pikakt信号通路图谱

p i k a k t信号通路图谱 WTD standardization office【WTD 5AB- WTDK 08- WTD 2C】P I3K/A K T信号通路磷脂酰肌醇3-激酶(PI3Ks)信号参与增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节. 近年来发现, IA型PI3K和其下游分子蛋白激酶B(PKB或Akt)所组成的信号通路与人类肿瘤的发生发展密切相关. 该通路调节肿瘤细胞的增殖和存活, 其活性异常不仅能导致细胞恶性转化, 而且与肿瘤细胞的迁移、黏附、肿瘤血管生成以及细胞外基质的降解等相关, 目前以PI3K-Akt信号通路关键分子为靶点的肿瘤治疗策略正在发展中.在PI3K家族中, 研究最广泛的是能被细胞表面受体所激活的I型PI3K. 哺乳动物细胞中Ι型PI3K又分为IA和IB两个亚型, 他们分别从酪氨酸激酶连接受体和G蛋白连接受体传递信号.IA 型PI3K是由催化亚单位p110和调节亚单位p85所组成的二聚体蛋白, 具有类脂激酶和蛋白激酶的双重活性.PI3K通过两种方式激活, 一种是与具有磷酸化酪氨酸残基的生长因子受体或连接蛋白相互作用, 引起二聚体构象改变而被激活; 另一种是通过Ras和p110直接结合导致PI3K的活化. PI3K激活的结果是在质膜上产生第二信使PIP3, PIP3与细胞内含有PH结构域的信号蛋白Akt和PDK1(phosphoinositidedependentkinase-1)结合, 促使PDK1磷酸化Akt蛋白的Ser308导致Akt的活化. Akt还能通过PDK2(如整合素连接激酶ILK)对其Thr473的磷酸化而被激活.活化的Akt通过磷酸化作用激活或抑制其下游靶蛋白Bad 、Caspase9、NF-κB、GSK-3、FKHR、 p21Cip1和p27 Kip1等, 进而调节细胞的增殖、分化、凋亡以及迁移等.PI3K-Akt信号通路的活性被类脂磷酸酶PTEN(phosphatase and tensin homolog deleted on chromosome ten)和SHIP(SH2-containing inositol 5-phosphatase)负调节, 他们分别从PIP3的3′和5′去除磷酸而将其转变成PI(4,5)P2和PI(3,4)P2而降解. 迄今为止, 尚未发现下调Akt活性的特异磷酸酶, 但用磷酸酶抑制剂处理细胞后, 发现Akt的磷酸化和活性均有所增加. 最近发现Akt能被一种C末端调节蛋白(CTMP)所失活, CTMP能结合Akt并通过抑制Akt的磷酸化而阻断下游信号的传递, CTMP的过表达能够逆转v-Akt转化细胞的表型. 热休克蛋白90(HSP90)亦能结合Akt, 阻止Akt被PP2A磷酸酶的去磷酸化而失活, 因此具有保护Akt的作用.本信号转导涉及的信号分子主要包括Integrin,FAK,Paxillin,ILK,PIP3,S6,p70S6K,RTK,Gab1,Gab2,IRS-1,PI3K,PTEN,AKT,PDK1,Cytokine Receptor,Jak1,CD19,BCR,Ag,BCAP,Syk,Lyn,GPCR,TSC1,TSC2,Gβγ,GαGTP,PP2A,PHLPP,CTMP,PDCD4,4E-BP1,ATG13,mTORC1,TSC1,TSC2,PRAS40,XIAP,FoxO1,Bim,Bcl-2,Bax,MDM2,p53,Bax,Bad,14-3-3,Wee1,Myt1,p27Kip1,p21Waf1/Cip1,CyclinD1,GSK-3,GS,Bcl-2,mTORC2,LaminA,Tpl2,IKKα,eNOS,GABAAR,Huntingtin,Ataxin-1,PFKFB2,PIP5K,AS160等。
pi信号通路引起的细胞生物学效应

pi信号通路引起的细胞生物学效应细胞是生物体的基本单位,它具有自主生长、自主分裂和自主运动等特点。
细胞内存在着复杂的信号通路网络,其中pi信号通路是一种重要的调控通路。
通过pi信号通路的激活,细胞可以对外界刺激做出相应的生物学效应。
本文将从细胞信号通路的激活机制、pi信号通路的特点以及pi信号通路引起的细胞生物学效应等方面进行探讨。
了解细胞信号通路的激活机制对于理解pi信号通路的功能至关重要。
细胞内的信号通路是由一系列分子组成的,这些分子相互作用,通过化学信号传递信息。
细胞内的信号分子可以是激素、细胞因子或者是细胞外基质的成分。
当外界刺激物与细胞表面的受体结合时,会触发一系列的信号转导过程。
pi信号通路是其中的一种重要的信号通路。
pi信号通路具有自身的特点和调控机制。
pi信号通路主要通过磷酸化和去磷酸化来传递信号。
磷酸化是指通过酶的作用,在分子上加上磷酸基团,而去磷酸化则是指通过酶的作用,将分子上的磷酸基团去除。
pi信号通路的激活主要涉及到一系列的蛋白激酶和蛋白磷酸酶。
当外界刺激物与细胞表面的受体结合后,会激活下游的蛋白激酶,进而激活pi信号通路。
pi信号通路的激活可以影响细胞的生长、分化、凋亡等生物学过程。
pi信号通路的激活对细胞生物学过程有着重要的影响。
首先,pi信号通路的激活可以促进细胞的增殖和生长。
研究发现,pi信号通路的激活可以使细胞进入增殖状态,促进细胞的分裂和增加细胞数量。
其次,pi信号通路的激活可以影响细胞的分化和功能。
细胞的分化是指细胞从未分化状态发育成特定功能的细胞。
pi信号通路的激活可以调控细胞分化的过程,使细胞发育成特定功能的细胞。
最后,pi信号通路的激活还可以参与细胞的凋亡过程。
细胞凋亡是一种程序性细胞死亡的过程,它对于维持机体正常功能和发育具有重要作用。
pi信号通路的激活可以引发细胞凋亡,从而调控细胞数量和维持机体的平衡。
总结起来,pi信号通路作为一种重要的细胞信号通路,通过磷酸化和去磷酸化来传递信号。
代谢物pi与信号通路

代谢物pi与信号通路英文回答:Metabolites are small molecules that are produced as a result of cellular metabolism. They can be used as substrates for further metabolic reactions or they can be excreted from the cell. Metabolites can also act as signaling molecules, transmitting information between cells and tissues.The pi metabolite is a small molecule that is produced during the glycolysis pathway. Glycolysis is the process by which glucose is broken down to produce energy. The pi metabolite can be used as a substrate for the citric acid cycle, which is another energy-producing pathway. However, the pi metabolite can also act as a signaling molecule.The pi metabolite has been shown to regulate a number of different signaling pathways. For example, the pi metabolite can inhibit the mTOR pathway, which is a keyregulator of cell growth and proliferation. The pi metabolite can also activate the AMPK pathway, which is a key regulator of energy metabolism.The pi metabolite is a versatile molecule that can play a number of different roles in cellular metabolism and signaling. The study of the pi metabolite and its role in cellular function is an active area of research.中文回答:代谢物pi与信号通路。
脑胶质瘤PI3K信号通路的研究进展

.
3 9
综述 .
脑 胶 质 瘤 P3 IK信 号通 路 的研 究 进 展
韩 磊 ,浦 佩 玉 , 春 生 康
30 5 ) 0 0 2 ( 天津 医科 大学总 医院神 经 外科/ 津市神 经病 学研 究所 ,天津 天
重 对 该 通 路 的 相关 内容 作 简 要 介 绍
关 键 词 : 质瘤 ;信 号转 导 通 路 : 酸 磷脂 酰 肌 醇一 一 基 激 酶 胶 磷 3羟
中 图分 类 号 : 3 . R7 941 文献标识码: A 文 章 编 号 :7 6 8 9 ( 01 0 — 0 9 0 1 2 — 1 2 2 0) 1 0 3 — 5
【 B T AC A S R T】 G i a ae h m s cmm n r ay nrcailtm r.T e c r n h rp s r lm s r o te ot o o p m r it rna u os h ur t ea i a i a e t e e
u s t fc o y b c u e o n l t g g w h o l ma .T e eo e n a sa tr e a s f i f  ̄a n r t f gi i i i o o s h rf r ,mo e e e t e t ame t e d t e d v lp d r f c v r t ns n e o b e eo e . i e
行 增 殖 和 侵 袭 , 而 出现 恶 性 表 型 。 年 研 究 发 现 . 进 近
me a e p s ono io一 OH — na e s c o e y o r l e tlt e e eop ntan mai n nt r g e so o dit d by ho ph i stl3一 ki s i l s l c reatd wi} h d v l me d lg a p o r s in f gi ma . e eo e lo s Th r fr ,webre y r ve d t oe o 3 p t wa n g imasi i ri l i f e iwe he r l fPI K a l h y i lo n t sa tce. h K EY O RD S:Glo a ina ig pa wa ;Ph s o n stl3 OH — na e W im ;S g ln t h y o ph i 0 io 一 一 ki s
细胞信号通路图解介绍之PI3KAkt信号通路

细胞信号通路图解介绍之PI3KAkt信号通路丝/苏氨酸激酶Akt/PKB最初发现是作为一种原癌基因,现在已受到广泛的关注,因为其在很多的细胞活动中都起到关键性的作用,包括癌症的发展和胰岛素代谢。
Akt级联反应可以被许多机制激活,诸如受体酪氨酸激酶,整合素,B细胞和T细胞受体,细胞因子受体,G 蛋白偶联受体以及其他各种刺激,这些途径可以促使肌醇磷脂-3-激酶(PI3K )产生磷脂酰肌醇3,4,5 -三磷酸。
这些脂类物质为含有PH结构域(pleckstrin-homologydomain)的蛋白提供锚定位点,这些分子包括Akt和它的上游活化因子PDK1。
肿瘤抑制基因PTEN是一种公认的Akt的主要抑制剂,通常在人类肿瘤中会消失。
最近,越来越多的关注集中在磷酸酶(包括PHLIP)上,它能使Akt失活。
三种Akt的异构体(Akt1, Akt2,Akt3 )介导了许多PI3K 调控的下游通路。
Akt是胰岛素信号传递和葡萄糖代谢中主要的调节分子,小鼠的遗传学研究发现Akt2 在这些过程中起关键作用。
另外,现在已经发现癌症和胰岛素代谢在病理情况下会出现Akt的种系突变。
Akt作用于TSC1/TSC2复合物和mTOR信号通路来调控细胞生长;作用于CDK 的抑制分子P21和P27,并间接影响cyclinD1和p53的表达水平来调控细胞周期和细胞增殖。
Akt可以通过直接抑制促凋亡信号如促凋亡调节者Bad和Forkhead家族转录因子来促进细胞的存活。
T淋巴细胞转运到淋巴组织这个过程是由Akt下游的粘附因子的表达来控制的。
Akt还能调控神经元功能相关蛋白如GABA受体,ataxin-1 和huntingtin 分子。
最近,Akt又被发现能和Smad 分子结合调节TGF β信号传导。
最后,Akt对核纤层蛋白A抗原的磷酸化在核蛋白的结构组织中发挥作用。
这些发现使Akt/PKB成为在治疗癌症,糖尿病,中风和神经退行性疾病中的重要靶点。
PI3KAktmTOR信号通路和靶向药物

PI3KAktmTOR信号通路和靶向药物PI3K/AKT/mTOR信号通路的梳理着实不易,寄希望该贴梳理的知识帮助到患者和家属。
很多癌种都会涉及这个信号通路,很多患者都面对这个信号通路的药物问题。
经常读报告看到mTOR抑制剂的靶向药物推荐,而且很多基因突变都与该种类型的靶向药物相关,我印象中的基因有PIK3CA,PTEN、NF1等等。
当然也不是这些基因随便某个位点出现了改变就可以用mTOR抑制剂,某些变异只是良性多态性,没有影响到蛋白的结构和功能,对于肿瘤的增殖没有影响,相对应的靶向药物推荐也就没有意义。
一、PI3K信号通路的突变类型我们不从信号通路的科学去阐释,如此繁多的术语和英文字符看的我自己都头疼,我们先用尽量简单的语言去看PI3K信号通路的突变类型有哪些,该信号通路的激活经常是通过关键节点的直接突变,如PIK3CA和AKT1的激活突变或扩增,以及PTEN这个负调控基因的失活突变。
另外PI3K信号通路的激活也可能源于RAS基因,下面的图1是PI3K信号通路的组成部分、和相互之间的抑制和激活关系。
图1:PI3K/AKT信号通路。
图1突变的机制包含受体酪氨酸激酶和原癌基因(如ERBB2,KRAS)的基因扩增/突变,PIK3CA、AKT、TSC1/2、mTOR的突变。
抑癌基因如PTEN、INPP4B和LKB1的失活突变。
mTOR激酶包含两个核蛋白TORC1和TORC2,分别位于AKT基因的上游和下游。
粉红色背景框的是原癌基因,而蓝色背景框的是抑癌基因。
需要注意的是,MEK和ERK蛋白是涉及到PI3K信号通路中的。
所以有时要把两种信号通路的靶向药物联合起来开展临床试验的原因。
下面的图2是具体的某些基因的突变形式,以及它们出现的肿瘤类型。
图2:PI3K信号通路相关的基因突变二、针对mTOR的靶向药物mTOR是一个丝氨酸——苏氨酸激酶,属于PI3K相关的激酶家族,参与介导生长、营养、能量获取等来调控细胞增殖、凋亡等。
PI3KAkt信号通路与肿瘤细胞凋亡关系的研究进展

PI3KAkt信号通路与肿瘤细胞凋亡关系的研究进展一、本文概述PI3KAkt信号通路是一种重要的细胞信号转导通路,参与调控多种细胞功能,包括细胞生长、增殖、存活和代谢等。
近年来,越来越多的研究表明,PI3KAkt信号通路与肿瘤细胞凋亡之间存在密切的关系。
本文将对PI3KAkt信号通路与肿瘤细胞凋亡关系的研究进展进行综述,探讨该通路在肿瘤发生和发展中的作用,以及针对该通路进行抗肿瘤治疗的可能性和前景。
本文将介绍PI3KAkt信号通路的基本组成和调控机制,阐述该通路如何被激活以及如何通过下游效应分子发挥其生物学功能。
接着,本文将重点综述PI3KAkt信号通路在肿瘤细胞凋亡中的作用,包括抑制凋亡和促进凋亡的双重作用,以及该通路在不同类型肿瘤中的表现差异。
本文还将关注PI3KAkt信号通路与其他信号通路的交互作用,以及这些交互作用如何影响肿瘤细胞的凋亡过程。
本文将探讨针对PI3KAkt 信号通路进行抗肿瘤治疗的策略和方法,包括抑制该通路的活性、增强肿瘤细胞对凋亡信号的敏感性等,以期为未来肿瘤治疗提供新的思路和方法。
二、PI3KAkt信号通路的分子机制PI3KAkt信号通路是一种重要的细胞内信号转导通路,对于细胞生长、增殖、存活以及代谢等多个方面发挥着关键作用。
在肿瘤细胞凋亡的研究中,PI3KAkt信号通路的影响日益受到关注。
PI3KAkt信号通路的分子机制主要包括PI3K(磷脂酰肌醇3-激酶)和Akt(也被称为蛋白激酶B,PKB)的相互作用及其下游效应分子的激活。
当细胞受到外部刺激时,如生长因子、激素等,PI3K会被激活并催化磷脂酰肌醇(PI)生成磷脂酰肌醇-3,4,5-三磷酸(PIP3)。
PIP3随后与Akt的PH结构域结合,导致Akt从细胞质转位至细胞膜,并在PDK1(3-磷酸肌醇依赖性蛋白激酶1)和mTORC2(哺乳动物雷帕霉素靶蛋白复合物2)的作用下被磷酸化激活。
激活的Akt通过磷酸化多种下游底物,包括Bad、Caspase-Forkhead box O(FoxO)转录因子等,来抑制细胞凋亡并促进细胞存活和增殖。
PI3K-AKT信号通路
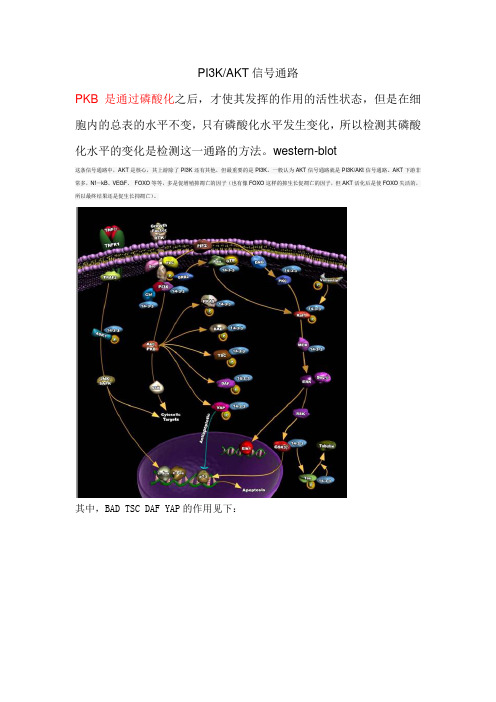
PI3K/AKT信号通路PKB是通过磷酸化之后,才使其发挥的作用的活性状态,但是在细胞内的总表的水平不变,只有磷酸化水平发生变化,所以检测其磷酸化水平的变化是检测这一通路的方法。
western-blot这条信号通路中,AKT是核心,其上游除了PI3K还有其他,但最重要的是PI3K。
一般认为AKT信号通路就是PI3K/AKt信号通路。
AKT下游非常多,Nf-kB、VEGF、FOXO等等,多是促增殖抑凋亡的因子(也有像FOXO这样的抑生长促凋亡的因子,但AKT活化后是使FOXO失活的,所以最终结果还是促生长抑凋亡)。
其中,BAD TSC DAF YAP的作用见下:BAD: The protein encoded by this gene is a member of the BCL-2 family. BCL-2 family members are known to be regulators of programmed cell death. This protein positively regulates cell apoptosis by forming heterodimers with BCL-xL and BCL-2, and reversing their death repressor activity. Proapoptotic activity of this protein is regulated through its phosphorylation. Protein kinases AKT and MAP kinase, as well as protein phosphatase calcineurin were found to be involved in the regulation of this protein. Alternative splicing of this gene results in two transcript variants which encode the same isoform. [provided by RefSeq, Jul 2008]TSC: This gene encodes a growth inhibitory protein thought to play a role in the stabilization of tuberin. Mutations in this gene have been associated with tuberous sclerosis. Alternative splicing results in multiple transcript variants. [provided by RefSeq, Jun 2009]DAF(CD55): his gene encodes a protein involved in the regulation of the complement cascade. The encoded glycoprotein is also known as the decay-accelerating factor (DAF); binding of DAF to complement proteins accelerates their decay, disrupting the cascade and preventing damage to host cells. Antigens present on the DAF glycoprotein constitute the Cromer blood group system (CROM). Two alternatively spliced transcripts encoding different proteins have been identified. The predominant transcript encodes a membrane-bound protein expressed on cells exposed to plasma component proteins but an alternatively spliced transcript produces a soluble protein present at much lower levels. Additional, alternatively spliced transcript variants have been described, but their biological validity has not been determined. [provided by RefSeq, Jul 2008]YAP: This gene encodes a downstream nuclear effector of the Hippo signaling pathway which is involved in development, growth, repair, and homeostasis. This gene is known to play a role in the development and progression of multiple cancers as a transcriptional regulator of this signaling pathway and may function as a potential target for cancer treatment. Alternative splicing results in multiple transcript variants encoding different isoforms. [provided by RefSeq, Aug 2013]。
磷脂酰肌醇信号转导通路的生物学调控

磷脂酰肌醇信号转导通路的生物学调控磷脂酰肌醇(Phosphatidylinositol,PI)是细胞膜中一种重要的脂质成分,又是许多重要信号通路的生物合成前体和催化物。
磷脂酰肌醇酰基转移酶、磷酸酰肌醇肌醇酰转移酶、肌醇酰吲哚三酮酶、蛋白酪氨酸磷酸酶等酶参与的磷脂酰肌醇信号转导通路涉及细胞分化、分裂、凋亡、细胞迁移和细胞周期等多种生命过程。
本文将详细论述磷脂酰肌醇信号转导通路的生物学调控。
一、磷脂酰肌醇信号转导通路的基础概念细胞膜是所有细胞都拥有的重要组成部分,细胞膜所固有的物理和化学性质决定了许多与生命过程有关的细胞行为,如细胞分化、分裂、凋亡、细胞迁移和细胞周期等。
磷脂酰肌醇是细胞膜中一种重要的脂质成分,被认为是许多信号分子修饰的底物。
细胞通过离子通道、转运蛋白、酵素等多种方式将外部信号转化为细胞内信号,再通过网络传导机制产生复杂的生物学效应。
磷脂酰肌醇信号转导通路是一种复杂的信号传导系统,可分为三个主要层次:前体、底物和产物。
其中,底物磷脂酰肌醇的磷酸化、去磷酸化和肌醇磷酸酶降解等均涉及到信号转导,这种信号转导反应通过一系列酶类、蛋白质、离子通道和反应性氧物质完成,最终影响细胞的特定功能。
二、磷脂酰肌醇信号转导通路的调节机制细胞内的磷脂酰肌醇代谢是一种高度动态的过程,磷脂酰肌醇信号转导通路的正常功能需要细胞内磷脂酰肌醇水平的精确调控。
因此,细胞内部存在着多种调节机制,如磷脂酰肌醇互相转化、质膜上的受体激活、小分子结合蛋白的活化等。
磷脂酰肌醇点突变是一种常见的疾病,可以导致一些神经退化和罕见继发性皮肤病。
PI的生物合成和降解受许多内源性和外源性因素的影响。
在细胞内,PI水平由细胞表面上的受体和内部的酶类以及细胞周期调控和运输调控机制等共同调节。
三、磷脂酰肌醇的几种主要代谢酶1.磷脂酰肌醇3-激酶(PI3K)家族PI3K家族成员包括六种不同亚型,分别是类A、B、C的IA和IB、IIα和IIβ。
它们具有不同的生物学活性和多种调节性的功能,因此在生理和病理过程中具有重要作用。
NOTCH1信号通路调控PI3KAKTmTOR信号通路的研究进展

doi:10.3969/j.issn.1000⁃484X.2020.21.022㊃专题综述㊃NOTCH1信号通路调控PI3K /AKT /mTOR 信号通路的研究进展①朱玉娇 马 蕾 薛海波 (滨州医学院附属医院,滨州256603) 中图分类号 R392 文献标志码 A 文章编号 1000⁃484X (2020)21⁃2667⁃05①本文受国家自然科学基金(81803145)㊁山东省重点研发计划(2016GSF201021)和山东省高等学校科技计划(J16LL01)资助㊂作者简介:朱玉娇,女,在读硕士,主要从事甲状腺疾病分子免疫学研究,E⁃mail:514799643@㊂通讯作者及指导教师:薛海波,男,博士,主任医师,教授,硕士生导师,主要从事甲状腺疾病分子免疫学研究,E⁃mail:doctor_xuehaibo@㊂[摘 要] NOTCH1信号通路可以通过多种途径调节磷脂酰肌醇⁃3激酶/蛋白激酶/雷帕霉素靶蛋白(PI3K /AKT /mTOR)信号通路,两者的交互作用在多种疾病的发生发展中扮演着至关重要的角色,亦成为近年来的研究热点㊂本文着重就NOTCH1信号通路调控PI3K /AKT /mTOR 信号通路的研究进展进行综述㊂[关键词] NOTCH1;PI3K;AKT;mTORRecent progress NOTCH1singaling pathway regulates PI3K /AKT /mTOR signaling pathwayZHU Yu⁃Jiao ,MA Lei ,XUE Hai⁃Bo .Binzhou Medical University Hospital ,Binzhou 256603,China[Abstract ] NOTCH1signaling pathway can regulate phosphatidylinositol⁃3⁃kinase /protein kinase B /rapamycin target protein(PI3K /AKT /mTOR)signaling pathway through a variety of ways.The interaction between them plays a crucial role in the occurrence and development of many diseases and it also has become a research hotspot in recent years.This review is focused on the researchprogress of the regulatory roles of NOTCH1signaling on PI3K /AKT /mTOR signaling pathway.[Key words ] NOTCH1;PI3K;AKT;mTOR NOTCH1信号通路与磷脂酰肌醇⁃3激酶/蛋白激酶/雷帕霉素靶蛋白(PI3K /AKT /mTOR)信号通路通过下游靶基因及细胞因子等多种方式实现交互作用并在多种疾病中发挥重要作用,随着相关研究的逐渐深入,这两条通路可能为多种相关疾病的治疗靶点提供有意义的理论依据㊂本文就NOTCH1信号通路对PI3K /AKT /mTOR 信号通路的调控予以简要综述㊂1 NOTCH 信号通路的组成㊁激活及效应NOTCH 信号是一种进化上高度保守的信号传导途径,它与细胞的分化㊁增殖㊁凋亡和上皮细胞间充质转化等有关[1]㊂在哺乳动物中,NOTCH 信号转导由4类异二聚体形式的NOTCH 受体(NOTCH1⁃4)㊁5类Ⅰ型跨膜蛋白的NOTCH 配体(DLL⁃1㊁3㊁4,Japped⁃1㊁2)和DNA 结合蛋白(C⁃promoter binding factor,CBF⁃1)3部分组成㊂NOTCH 的配体与受体结合后,导致NOTCH 暴露S2㊁S3的切割位点,继而被酶切形成NOTCH 受体活化形式(NOTCH intracellular domain /intracellular domain of NOTCH,NICD /ICN),NICD 与DNA 结合蛋白CBF1和核转录激活蛋白家族MAML (mastermind⁃like,MAML)结合形成CBF⁃NICD⁃MAML 三元复合物后一起启动下游靶基因的转录,如发状分裂增强子1(hairy and enhancer of split⁃1,Hes1)和MYC(其中包括C⁃MYC)[2]㊂NOTCH1突变可以引起配体非依赖性激活,导致NOTCH1信号通路的持续激活㊂这种突变通过激发配体独立激活或延长NOTCH1受体活化形式ICN1半衰期来增强信号强度㊂激活的NOTCH1信号通路通过调节多个下游靶点激活PI3K /AKT /mTOR 信号通路㊂2 PI3K /AKT /mTOR 信号转导通路及功能既往研究证实PI3K /AKT /mTOR 信号通路在糖尿病㊁肿瘤㊁哮喘及系统性红斑狼疮等疾病中发挥重要作用,而PI3K㊁AKT㊁mTOR之间激活的机制是NOTCH1信号通路调控PI3K/AKT/mTOR信号通路的基石㊂2.1 PI3K的组成㊁效应及激活 磷脂酰肌醇⁃3激酶(phosphatidylinositol⁃3⁃kinase,PI3K)属于磷脂酰肌醇家族成员,PI3Ks基础活性低,能够被RAS GTP 酶和不同的细胞表面受体等激活[3]㊂根据结构和调节作用等的不同PI3Ks可分为Ⅰ类㊁Ⅱ类㊁Ⅲ类㊂然而只有Ⅰ类参与该途径,它是由调节亚基p110㊁催化亚基p85构成的异二聚体酶㊂PI3K催化质膜表面的磷脂酰肌醇二磷酸(phosphatidylinositol⁃4,5⁃bisphosphate,PIP2)生成磷脂酰肌醇3,4,5⁃三磷酸(phosphatidylinositol⁃3,4,5⁃trisphosphate,PIP3),使下游含PH的结构域的信号蛋白(如AKT㊁mTORC2)能特异性识别结合PIP3[3⁃5]㊂2.2 AKT的组成㊁效应及激活 AKT是一种丝氨酸苏氨酸激酶,又被称为蛋白激酶B(protein kinase B,PKB),它通常存在于细胞浆内㊂在结构上AKT 是由3部分组成:N末端的PH结构域㊁中心激酶催化结构域(CAT)和C延伸端的HM结构域[6]㊂AKT 主要有T308和S473两大磷酸化位点,只有这两大位点全部被磷酸化后AKT才能被完全激活㊂在PI3K在产生PIP3后,细胞质上未活化的AKT被募集到细胞膜上,并通过其PH区域与PIP3结合,这就导致3⁃磷酸肌醇依赖性蛋白激酶1(3⁃phosphoinositide⁃dependent protein kinase⁃1,PDK1)和mTORC2分别磷酸化AKT的T308和S473,至此AKT完全激活㊂活化的AKT释放入胞内引起信号级联反应,从而激活下游的靶蛋白mTOR[5]㊂2.3 mTOR的组成㊁效应及激活 雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是丝氨酸/苏氨酸磷脂酰肌醇⁃3⁃激酶相关激酶家族(PIKK)成员,在感受营养信号㊁调节细胞生长与增殖中起着关键性的作用㊂mTOR主要由2种蛋白复合物: mTORC1㊁mTORC2构成,其中mTORC1主要由mTOR㊁Raptor㊁mLST8等构成,而mTORC2由mTOR㊁Rictor㊁mLST8等构成㊂在PI3K⁃AKT途径传递生长因子信号时,被AKT磷酸化的去泛素酶USP4(Ubiquitin specific protease4,USP4)使小GTP 酶Rheb(Ras homolog enriched in brain,Rheb)去泛素化,导致抑制性的结节性硬化性复合体(Tuberous sclerosis complex,TSC)从Rheb中脱离形成活性的Rheb⁃GTP,而Rheb⁃GTP对于mTORC1至关重要㊂Rheb一般存在于溶酶体等内膜系统,而小GTP结合蛋白Rag GTPase可以使溶酶体移位并将mTORC1带到其激活剂Rheb⁃GTP旁,接着Rheb⁃GTP刺激mTORC1激活[7,8]㊂两种复合物之间也是相互影响的,mTORC1促使Rictor磷酸化抑制mTORC2,而mTORC2可以控制AKT的磷酸化来控制mTORC1的活性[9]㊂3 NOTCH1和PI3K/AKT/mTOR的相互作用 NOTCH1信号通路与PI3K/AKT/mTOR信号通路分别在细胞的生物学活动中发挥重要作用,在异常激活时,两者均是造成各种疾病发生的高危因素,但两条通路不是相互独立进行的,NOTCH1信号通路可以通过多种途径来调节PI3K/AKT/mTOR信号通路,本文将从以下几个方面来讨论NOTCH1信号通路对PI3K信号通路的调节㊂3.1 NOTCH1调控PTEN调节PI3K信号通路 肿瘤调控抑制因子(phosphatase and tensin homolog, PTEN)即张力蛋白和辅助蛋白同源㊁第10号染色体丢失的磷酸酶基因㊂PTEN能将PIP3去磷酸化产生PIP2从而对抗PI3K的磷酸化功能,因此PTEN是PI3K/AKT/mTOR信号通路的重要负调节因子㊂NOTCH1可以通过以下4种途径调控PTEN㊂第一种:NOTCH1下游靶基因MYC是作为转录抑制因子,而Hes1作为转录激活剂,在NOTCH1信号通路激活时,ICN1使Hes1占主导地位,Hes1与PTEN的启动子结合并抑制PTEN的表达,低表达的PTEN使PI3K/AKT/mTOR信号通路过度激活,而在NOTCH1信号通路受抑制时,Hes1对PTEN 的抑制减轻,加之MYC对PTEN的激活,使PTEN 高表达,从而使PI3K/AKT/mTOR信号通路抑制[1,10]㊂第二种:NOTCH1通过调节ROS调控PTEN㊂活性氧簇(reactive oxygen species,ROS)是细胞代谢的副产物,能破坏细胞内的大分子㊂Giambra等[11]研究发现,NOTCH1可以通过一系列复杂的途径调控ROS,首先NOTCH1诱导生成runt相关转录因子3(runt⁃related transcription factor3,RUNX3),接着RUNX3抑制runt相关转录因子1(runt⁃related transcription factor1,RUNX1),然后RUNX1进而诱导PKC⁃θ[属于蛋白激酶C(protein kinase C,PKC)家族],而PKC⁃θ影响ROS的积累㊂也有研究表明NOTCH1下游靶基因Hes1可以直接降低ROS的产生[12]㊂Zhang等[13]研究证实,ROS可以导致PTEN 启动子CPG的低甲基化,这种低甲基化可使PTEN 基因表达增强,从而增强PTEN的转录与翻译㊂这个结果与以前ROS促进PTEN的氧化与失活的结果不同,但不管ROS是促进PTEN的表达还是使其失活,可以确认的是NOTCH1可以通过调控ROS调节PTEN㊂第三种:酪蛋白激酶Ⅱ(casein kinaseⅡ,CK2)是催化肽链中邻近酸性氨基酸残基的丝氨酸/苏氨酸磷酸化的一种酶㊂活化的NOTCH1使脯氨酸顺反异构酶(peptidyl⁃prolyl cis⁃trans isomerase NIMA⁃interacting1,Pin1)转录,Pin1使CK2表达上调[14]㊂在CK2的表达及活性增加时它通过介导PTEN磷酸化导致PTEN蛋白稳定性增加㊁活性降低,使PTEN对PIP3的作用减弱[15]㊂第四种:NOTCH1靶基因C⁃MYC可以调控miR17⁃92簇㊂miR⁃17⁃92簇是miRNA多顺反子的一种,在细胞的存活㊁增殖㊁分化及血管生成方面有重要的作用,NOTCH1下游靶基因C⁃MYC可以与miR⁃17⁃19b三个子簇中的miR⁃19两者协同调节共同控制PTEN的地表达[16]㊂总之NOTCH1可以通过C⁃MYC㊁ROS㊁CK2㊁mir17⁃92来调控PTEN,PTEN进而调控PI3K/AKT/ mTOR信号激活㊂3.2 NOTCH1调控IL⁃7R㊁IGF1R调节PI3K3.2.1 通过IL⁃7R IL⁃7是由骨髓㊁胸腺和其他器官中的基质细胞产生的细胞因子㊂IL⁃7受体(interleukin⁃7receptor,IL⁃7R)主要由淋巴细胞表达,它对于T细胞的发育和周围内环境的稳态起重要作用㊂IL⁃7R由α链和γC链构成㊂NOTCH1和IL⁃7R的增强子结合能并驱动其基因表达[17]㊂Jian 等[18]发现,IL⁃7/IL⁃7R可以通过调节自噬相关因子Beclin1来调节PI3K/AKT/mTOR信号通路㊂这与之前的理论略有不同:IL⁃7和IL⁃7R结合引起IL⁃7R 构象改变并使Jak1㊁Jak3活化与反磷酸化,随后IL⁃7Rα细胞质尾部的酪氨酸残基(含保守的Y449)磷酸化,这就产生了下游效应分子PI3K等信号分子的对接位点,从而激活PI3K/AKT/mTORC1信号通路㊂PI3K/AKT/mTORC1信号通路是IL⁃7R和NOTCH1两条信号通路的交互作用点[17,19]㊂3.2.2 通过IGF1R 胰岛素样生长因子1(insulin⁃like growth factor1,IGF1)及其受体胰岛素生长因子1受体(insulin⁃like growth factor1receptor,IGF1R)可以调节正常细胞的生长发育㊂在IGF1R中存在NOTCH1的反应性增强子,NOTCH1与CSL㊁MAML 形成的三元复合物直接与IGF1R的增强子结合,进而上调IGF1R的转录和翻译,使IGF1R维持在高水平表达[20]㊂也有研究证实血清微小RNA⁃223(microRNA⁃223,miR⁃223)可以降低IGF1R蛋白水平,而NOTCH1可以负性调节miR⁃223而间接提高IGF1R的蛋白水平[21]㊂因此,NOTCH1信号既可以直接促进IGF1R表达也可以间接促进IGF1R表达㊂而IGF1㊁IGF2与IGF1R(一种跨膜受体酪氨酸激酶/RTK)结合引起下游通路如PI3K/AKT/mTOR 信号通路的级联反应,继而调节细胞代谢和蛋白质的合成㊂Zorea等[22]研究证明高表达的IGF1R可以直接激活AKT/mTOR㊂3.3 NOTCH1调控AKT3.3.1 NOTCH1通过穹窿体主蛋白(major vault protein,MVP)调节AKT 穹隆复合体是一种具有中空筒状结构的核糖核蛋白颗粒,MVP是穹隆体的主要组成部分㊂Xiao等[23]研究发现,NOTCH1胞内结构域(ICD)能够与MVP启动子上的CBF⁃1结合并驱动其转录,也就是说MVP作为NOTCH1的直接靶点,而MVP可以独立激活AKT㊂3.3.2 NOTCH1转录激活DEPTOR选择性激活AKT DEPTOR作为mTOR复合物的组成部分,与mTOR有特定的交互作用㊂DEPTOR一般作为mTOR内源性抑制剂,在DEPTOR缺失后可导致mTOR过度活化㊂此外,mTORC1和mTORC2也都可以在转录和翻译后水平上负性调节DEPTOR的表达[24]㊂在以往的报道中AKT可以被PTEN㊁Hes1等多种机制激活㊂而Hu等[24]研究不仅证实NOTCH1可以直接结合并激活DEPTOR启动子,最重要的是发现了AKT激活的替代机制,即过度激活的DEPTOR可以通过减轻mTORC1到PI3K的反馈性抑制使AKT激活㊂3.3.3 NOTCH1通过PP2A使AKT去磷酸化 蛋白磷酸酶2(protein phosphatase2A,PP2A)属于丝氨酸/苏氨酸磷酸酶,它在细胞周期的每个阶段中都发挥关键作用,这主要与它的去磷酸化作用有关㊂AKT的活性由磷酸化与去磷酸化之间的平衡决定, Li等[25]研究发现,NOTCH受体的活化形式NICD 过度表达导致TRY307位点的PP2A过磷酸化,这种过磷酸化使PP2A活性减弱㊂PP2A活性的降低使其对AKT的Ser473的去磷酸化作用降低,这就使AKT的活性增加㊂此外,NOTCH1介导的PP2A过磷酸化也使PI3K(P85)的活性增加,但具体机制尚不清楚㊂3.4 NOTCH1调控mTOR3.4.1 C⁃MYC上调氨基酸转运子调控mTOR Liu 等[26]研究发现,氨基酸是激活mTORC1的关键㊂C⁃MYC可以激活SLC1A5和SLC7A6在内的多个氨基酸转运体,这种氨基酸转运子属于膜转运蛋白,能运输大量底物进入胞内,并在各种生理及病理过程中发挥关键作用㊂这两种氨基酸转运子是驱动C⁃MYC激活mTOR的关键因素,在他们表达上调后,使细胞对氨基酸的摄取增多,进而级联mTOR 激活㊂3.4.2 NOTCH1调控Rheb激活mTOR Rheb如上所述在mTOR的激活中扮演着重要的角色㊂与GTP 结合的Rheb可以与mTOR的激酶结构域相互作用激活mTORC1的活性㊂以往的研究证实Rheb可以激活NOTCH1㊂而Cho等[27]发现,NOTCH1可以与Rheb启动子上的NOTCH反应元件(Notch⁃responsive element,NREs)结合并诱导Rheb的激活㊂然而NRE2和NRE3的突变会影响Rheb启动子的活性,表明在Rheb中NRE2和NRE3对NOTCH1依赖性启动子的活性十分重要㊂被认为是NOTCH1与Rheb之间的调节器㊂NOTCH1可以通过与NRE2和NRE3结合激活Rheb启动子,而Rheb如上所述可以激活mTOR,这也就是说NOTCH1可以调节Rheb激活mTOR㊂而Okuhashi等[28]实验研究曾证实,激活的NOTCH1信号通路可以直接激活mTOR蛋白的表达和磷酸化㊂3.4.3 MYC上调TSC1/2控制mTORC1 TSC1/2作为mTORC1的上游调节分子,调节机制已如上所述㊂Hartleben等[29]研究发现,MYC既可以减少微小RNA⁃15a(microRNA⁃15a,miR⁃15a)来间接靶向调控TSC1的mRNA的表达,也可以直接激活TSC1转录㊂而TSC1属于mTORC1的抑制剂,这也就是说NOTCH1下游靶基因MYC最终使mTORC1信号减弱,这样可以保护细胞中线粒体的稳态,也可以防止毒性ROS的累积,而ROS如上所述可以影响PTEN 的表达而影响AKT的信号传导㊂NOTCH1信号通路和PI3K/AKT/mTOR信号通路在急性淋巴细胞白血病㊁胶质母细胞瘤及食管癌等肿瘤㊁哮喘及系统性红斑狼疮等自身免疫性疾病的发生和发展中发挥重要的作用,两者之间的互相影响与调节亦为当今的研究热点㊂NOTCH1信号通路不仅可以通过多种途径调控PI3K/AKT/mTOR信号通路的激活,也会受到PI3K/AKT/mTOR信号通路的反调控:有研究报道,活化的AKT可以抑制NOTCH1酪氨酸的磷酸化进而减少NOTCH1被溶酶体途径单泛素化和降解的数量,从而维持高水平的NOTCH1信号[30]㊂在上述研究的基础上,进一步在疾病模型或患者中开展深入的体内外研究,对阐明两个信号通路参与疾病的发生发展的机制及探索相关疾病新的治疗靶点提供有意义的理论依据:如γ分泌酶抑制剂㊁MYC靶基因的靶向治疗等可能会成为部分肿瘤及自身免疫性疾病治疗的新靶点㊂参考文献:[1] Tian T,Fu X,Lu J,et al.MicroRNA⁃760inhibits doxorubicinresistance in hepatocellular carcinoma through regulating Notch1/ Hes1⁃PTEN/Akt signaling pathway[J].J Biochem Mol Toxicol, 2018,32(8):e22167.[2] Leong KG,Karsan A.Recent insights into the role of Notchsignaling in tumorigenesis[J].Blood,2006,107(6):2223⁃2233.[3] Wise HM,Hermida MA,Leslie NR.Prostate cancer,PI3K,PTENand prognosis[J].Clin Sci(Lond),2017,131(3):197⁃210.[4] Li H,Marshall AJ.Phosphatidylinositol(3,4)bisphosphate⁃specific phosphatases and effector proteins:A distinct branch of PI3K signaling[J].Cell Sig,2015,27(9):1789⁃1798. [5] Manning BD,Toker A.AKT/PKB Signaling:Navigating thenetwork[J].Cell,2017,169(3):381⁃405.[6] Singh SS,Yap WN,Arfuso F,et al.Targeting the PI3K/Aktsignaling pathway in gastric carcinoma:A reality for personalized medicine?[J].World J Gastroenterol,2015,21(43): 12261⁃12273.[7] Hoxhaj G,Hughes⁃Hallett J,Timson RC,et al.The mTORC1signaling network senses changes in cellular purine nucleotide levels[J].Cell Rep,2017,21(5):1331⁃1346.[8] Deng L,Chen L,Zhao L,et al.Ubiquitination of Rheb governsgrowth factor⁃induced mTORC1activation[J].Cell Res,2019,29(2):136⁃150.[9] Samidurai A,Kukreja RC,Das A.Emerging role of mTORsignaling⁃related miRNAs in cardiovascular diseases[J].Oxid Med Cell Longev,2018,2018:6141902.[10] Gutierrez A,Look AT.NOTCH and PI3K⁃AKT pathwaysintertwined[J].Cancer Cell,2007,12(5):411⁃413. [11] Giambra V,Jenkins CR,Wang H,et al.NOTCH1promotes T cellleukemia⁃initiating activity by RUNX⁃mediated regulation of PKC⁃theta and reactive oxygen species[J].Nat Med,2012,18(11):1693⁃1698.[12] Zhou XL,Zhao Y,Fang YH,et al.Hes1is upregulated byischemic postconditioning and contributes to cardioprotection[J].Cell Biochem Funct,2014,32(8):730⁃736.[13] Zhang X,Hadley C,Jackson IL,et al.Hypo⁃CpG methylationcontrols PTEN expression and cell apoptosis in irradiated lung[J].Free Radic Res,2016,50(8):875⁃886. [14] Koorella C,Nair JR,Murray ME,et al.Novel regulation of CD80/CD86⁃induced phosphatidylinositol3⁃kinase signaling byNOTCH1protein in interleukin⁃6and indoleamine2,3⁃dioxygenase production by dendritic cells[J].J Biol Chem,2014,289(11):7747⁃7762.[15] Gowda C,Soliman M,Kapadia M,et al.Casein kinase II(CK2),Glycogen Synthase Kinase⁃3(GSK⁃3)and Ikaros mediatedregulation of leukemia[J].Adv Biol Regul,2017,65:16⁃25.[16] Benhamou D,Labi V,Getahun A,et al.The c⁃Myc/miR17⁃92/PTEN axis tunes PI3K activity to control expression ofrecombination activating genes in early B cell development[J].Front Immunol,2018,9:2715.[17] Oliveira ML,Akkapeddi P,Ribeiro D,et al.IL⁃7R⁃mediatedsignaling in T⁃cell acute lymphoblastic leukemia:An update[J].Adv Biol Regul,2019,71:88⁃96.[18] Jian M,Yunjia Z,Zhiying D,et al.Interleukin7receptor activatesPI3K/Akt/mTOR signaling pathway via downregulation of Beclin⁃1in lung cancer[J].Mol Carcinog,2019,58(3):358⁃365. [19] Ribeiro D,Melao A,Barata JT.IL⁃7R⁃mediated signaling in T⁃cellacute lymphoblastic leukemia[J].Adv Biol Regul,2013,53(2):211⁃222.[20] Medyouf H,Gusscott S,Wang H,et al.High⁃level IGF1Rexpression is required for leukemia⁃initiating cell activity in T⁃ALL and is supported by Notch signaling[J].J Exp Med,2011,208(9):1809⁃1822.[21] Gusscott S,Kuchenbauer F,Humphries RK,et al.Notch⁃mediatedrepression of miR⁃223contributes to IGF1R regulation in T⁃ALL[J].Leuk Res,2012,36(7):905⁃911.[22] Zorea J,Prasad M,Cohen L,et al.IGF1R upregulation confersresistance to isoform⁃specific inhibitors of PI3K in PIK3CA⁃drivenovarian cancer[J].Cell Death Dis,2018,9(10):944. [23] Xiao YS,Zeng D,Liang YK,et al.Major vault protein is a directtarget of Notch1signaling and contributes to chemoresistance intriple⁃negative breast cancer cells[J].Cancer Lett,2019,440⁃441:156⁃167.[24] Hu Y,Su H,Liu C,et al.DEPTOR is a direct NOTCH1targetthat promotes cell proliferation and survival in T⁃cell leukemia[J].Oncogene,2017,36(8):1038⁃1047.[25] Li L,Zhang J,Xiong N,et al.Notch⁃1signaling activates NF⁃kappaB in human breast carcinoma MDA⁃MB⁃231cells via PP2A⁃dependent AKT pathway[J].Med Oncol,2016,33(4):33. [26] Liu P,Ge M,Hu J,et al.A functional mammalian target ofrapamycin complex1signaling is indispensable for c⁃Myc⁃drivenhepatocarcinogenesis[J].Hepatology,2017,66(1):167⁃181.[27] Cho JH,Patel B,Bonala S,et al.Notch transactivates Rheb tomaintain the multipotency of TSC⁃null cells[J].Nat Commun,2017,8(1):1848.[28] Okuhashi Y,Itoh M,Nara N,et al.NOTCH knockdown affects theproliferation and mTOR signaling of leukemia cells[J].Anticancer Res,2013,33(10):4293⁃4298.[29] Hartleben G,Muller C,Kramer A,et al.Tuberous sclerosiscomplex is required for tumor maintenance in MYC⁃drivenBurkitt′s lymphoma[J].EMBO J,2018,37(21):e98589. [30] Platonova N,Manzo T,Mirandola L,et al.PI3K/AKT signalinginhibits NOTCH1lysosome⁃mediated degradation[J].GenesChromosomes Cancer,2015,54(8):516⁃526.[收稿2019⁃05⁃21 修回2019⁃06⁃29](编辑 张晓舟 刘格格)(上接第2666页)[2] 曹 鹏,何成诗.基于中医毒邪理论对新冠肺炎辨证分型的探讨[J].中药与临床,2020,11(1):1⁃2,5.Cao P,He CS.Discussion on syndrome differentiation of COVID⁃19 based on the toxin and pathogen theory of traditional Chinese medicine[J].Chin Med Clin,2020,11(1):1⁃2,5. [3] 央视新闻.病毒与免疫系统的战争,我以为看了一场宇宙大战[EB/OL].(2020⁃03⁃05)[2020⁃05⁃02].https://www./video/BV1BE411W7rX.CCTV news.The war between virus and immune system,I thoughtI saw a world war[EB/OL].(2020⁃03⁃05)[2020⁃05⁃02].https:///video/BV1BE411W7rX. [4] 米 娜,吴 瑗,赵汉宁,等.‘医学免疫学“的教学 六要素”[J].中国免疫学杂志,2018,34(12):1891⁃1894.Mi N,Wu Y,Zhao HN,et al.Six essential factors in teaching of medical immunology[J].Chin J Immunol,2018,34(12): 1891⁃1894.[5] 卫生健康委办公厅,中医药局办公室.关于印发新型冠状病毒肺炎诊疗方案(试行第7版)的通知[EB/OL].(2020⁃03⁃04)[2020⁃05⁃02]./zhengce/zhengceku/2020⁃03/04/content_5486705.htm.General Office of National Health Commission of the People′s Republic of China,Office National Administration of Traditional Chinese Medicine.Notice on printing and distributing the national diagnosis and treatment plan for COVID⁃19(trial version7th) [EB/OL].(2020⁃03⁃04)[2020⁃05⁃02]./ zhengce/zhengceku/2020⁃03/04/content_5486705.htm. [6] 卫生健康委,中国红十字会总会办公室.关于做好新冠肺炎康复者捐献恢复期血浆招募动员服务工作的通知[EB/OL].(2020⁃02⁃18)[2020⁃05⁃02]./zhengce/ zhengceku/2020⁃02/21/content_5481600.htm.National Health Commission of the People′s Republic of China, Office of the Red Cross Society of China.Notice on COVID⁃19 recovery recipients′plasma recruitment and mobilization service [EB/OL].(2020⁃02⁃18)[2020⁃05⁃02]./ zhengce/zhengceku/2020⁃02/21/content_5481600.htm. [7] 张竞文,胡 欣,金鹏飞.新型冠状病毒引起的细胞因子风暴及其药物治疗[J].中国药学杂志,2020,55(5):333⁃336.Zhang JW,Hu X,Jin PF.Cytokine storm induced by SARS⁃CoV⁃2 and the drug therapy[J].Chin Pharm J,2020,55(5):333⁃336.[8] Xu Z,Shi L,Wang Y,et al.Pathological findings of COVID⁃19associated with acute respiratory distress syndrome[J].Lancet Respir Med,2020,8(4):420⁃422.[9] 宋承翰,乔燕薇.对话首例新冠肺炎肺移植主刀医生:和普通肺移植手术完全不一样[N].南方都市报,2020⁃03⁃02.https:///mp/toutiao/BAAFRD000020200302274829.html.Song CH,Qiao YW.Dialogue with the surgeon who performed the first COVID⁃19lung transplant:It′s totally different from a normal lung transplant[N].Nanfang Metropolis Daily,2020⁃03⁃02.https:///mp/toutiao/BAAFRD000020200302274829.html.[收稿2020⁃05⁃13 修回2020⁃07⁃21](编辑 张晓舟)。
PI3K/Akt信号通路及其抑制剂的研究进展

PI3K/Akt信号通路及其抑制剂的研究进展磷脂酰肌醇3激酶(PI3K)/丝氨酸-苏氨酸激酶(Akt)信号通路在信号转导的调控中扮演着重要角色,能调节细胞增殖、凋亡、代谢、运动、血管生成等生物过程。
与其他信号通路相比,PI3K/Akt信号通路的组成部分更庞大,在肿瘤中更多见。
目前已证实多种肿瘤中存在PI3K/Akt信号通路的超活化,对肿瘤细胞的存活、生长、运动、血管生成和代谢意义重大。
因此,抑制PI3K和与通路相关的成分可能会使肿瘤生长受抑,使患者预后改善。
PI3K/Akt信号通路抑制剂包括针对单一成分的抑制剂和双重抑制剂。
目前大量的PI3K抑制剂已在临床前期研究中取得良好结果,有些已经在血液恶性肿瘤和实体肿瘤中进行了临床试验。
在此综述中,我们简单的总结了PI3K-AKt通路的研究成果,讨论了PI3K 抑制剂从临床前研究到临床研究的发展前景。
Abstract:The phosphatidylinositol 3-kinase(PI3K)/serine-threonine kinase (Akt)signaling pathway plays an important role in the regulation of signal transduction,and can regulate biological processes such as cell proliferation,apoptosis,metabolism,movement,and pared with other signaling pathways,the components of the PI3K/Akt signaling pathway are larger and more common in tumors.It has been confirmed that there are hyperactivations of PI3K/Akt signaling pathways in many types of tumors,which are important for the survival,growth,movement,angiogenesis and metabolism of tumor cells.Therefore,inhibition of PI3K and pathway-related components may inhibit tumor growth and improve patient outcomes.PI3K/Akt signaling pathway inhibitors include single-component inhibitors and dual inhibitors.A large number of PI3K inhibitors have achieved good results in preclinical studies,and some have been clinically tested in hematologic malignancies and solid tumors.In this review,we briefly summarized the research results of the PI3K-AKt pathway and discussed the prospects for the development of PI3K inhibitors from preclinical studies to clinical studies.Key words:PI3K;Akt;mTOR;PI3K/Akt signaling pathway inhibitorsPI3K/Akt信號通路是细胞内信号传导通路,对细胞凋亡、恶变、肿瘤进展、转移和放射治疗都有重要作用[1],可因突变、扩增、缺失、甲基化和翻译后的修饰,导致它在癌症患者中调节异常。
磷脂酰肌醇信号通路调节机制的研究

磷脂酰肌醇信号通路调节机制的研究磷脂酰肌醇(PI)是一种重要的信号分子,参与了细胞的多种生理活动,例如细胞增殖、生长、分化和凋亡等。
PI信号通路的调节机制一直是细胞和分子生物学研究的热点之一。
一、磷脂酰肌醇信号通路的基本概念1. PI信号通路的组成PI信号通路是由多种信号分子组成的复杂信号网络。
其中最核心的信号分子是磷脂酰肌醇,也叫做PIP2。
PI的含氧阴离子分子团儿使得它具有高度的电负性,能够与电荷相反的蛋白质结构域形成稳定的复合物,从而介导信号转导。
除了PIP2之外,PI信号通路还包括其衍生的次级信号分子,如二磷酸甘油酯(DAG)、肌醇三磷酸(IP3)和肌醇四磷酸(IP4)等。
这些信号分子能够直接调节多种酶的活性,如磷脂酰肌醇3-激酶(PI3K)、肌醇三磷酸3-激酶(PI3K)和蛋白激酶C(PKC)等。
2. PI信号通路的功能PI信号通路比较复杂,涉及到多种生理活动的调节。
通常来说,PI信号通路主要参与细胞的增殖、存活、生长、分化和细胞内物质的代谢等方面。
此外,由于PI信号通路与多种生物体内的其他信号通路交叉作用,因此在多种疾病的发生和发展过程中也扮演着重要的角色。
3. PI信号通路的调节机制PI信号通路的调节机制相当复杂,它受到多种内外界因素的影响。
其中包括生长因子、神经递质、激素、炎症因子、环境因素和基因等。
这些因素能够通过多种途径间接或直接地调节PI信号通路的不同分支。
二、PI信号通路调节机制的研究进展在过去的几十年中,生物学家们不断深入地研究PI信号通路的调节机制。
这些研究揭示了多个涉及PI信号通路调节机制的关键蛋白质,这些蛋白质能够直接或间接地影响PI信号通路的活性。
1. PI3K/Akt/mTOR信号通路PI3K/Akt/mTOR信号通路是PI信号通路中最为重要且最为典型的分支之一。
在此信号通路中,PI3K能够促进PI(4,5)P2的合成,并激活Akt的磷酸化作用,从而增强肌醇-3,4,5-三磷酸的产生,最终激活mTOR的信号通路。
信号通路

信号通路信号通路是指当细胞里要发生某种反应时,信号从细胞外到细胞内传递了一种信息,细胞要根据这种信息来做出反应的现象。
信号通路(signal pathway)的提出最早可以追溯到1972年,不过那时被称为信号转换(signal transmission)。
1980年,M. Rodbell在一篇综述中提到信号转导(signal transduction),此后这个概念就被广泛使用了。
信号通路是指能将细胞外的分子信号经细胞膜传入细胞内发挥效应的一系列酶促反应通路。
这些细胞外的分子信号(称为配体,ligand)包括激素、生长因子、细胞因子、神经递质以及其它小分子化合物等。
定义当配体特异性地结合到细胞膜或细胞内的受体(receptor)后,在细胞内的信号又是如何传递的呢?细胞内各种不同的生化反应途径都是由一系列不同的蛋白组成的,执行着不同的生理生化功能。
各个信号通路中上游蛋白对下游蛋白活性的调节(包括激活或抑制作用)主要是通过添加或去除磷酸基团,从而改变下游蛋白的立体构象完成的。
所以,构成信号通路的主要成员是蛋白激酶和磷酸酶,它们能够快速改变和恢复下游蛋白的构象。
从细胞受体接收外界信号到最后做出综合性应答,不仅是一个信号转导过程,更重要的是将外界信号进行逐步放大的过程。
受体蛋白将细胞外信号转变为细胞内信号,经信号级联放大、分散和调节,最终产生一系列综合性的细胞应答,包括下游基因表达的调节、细胞内酶活性的变化、细胞骨架构型和DNA合成的改变等。
这些变化并非都是由一种信号引起的,也可以通过几种信号的不同组合产生不同的反应。
分类一是当信号分子是胆固醇等脂质时,它们可以轻易穿过细胞膜,在细胞质内与目的受体相结合;二是当信号分子是多肽时,它们只能与细胞膜上的蛋白质等受体结合,这些受体大都是跨膜蛋白,通过构象变化,将信号从膜外domain传到膜内的domain,然后再与下一级别受体作用,通过磷酸化等修饰化激活下一级别通路。
完整的信号通路阐释

完整的信号通路阐释信号通路是指在生物学或工程学领域中,传递信号的一系列分子或电气元件之间的路径或通路。
在不同的领域,信号通路的概念可能有所不同,下面将对生物学和电子工程领域中的信号通路进行阐释。
### 生物学领域的信号通路:在细胞生物学中,信号通路是一系列的生物分子相互作用,以调控细胞的生理功能和生物学行为。
以下是一个典型的细胞信号通路的阐释:1. 信号发起:通常由外部刺激引发,例如细胞外的激素、生长因子或环境因子。
2. 受体激活:外部信号被细胞表面的受体捕获和识别,这可能是膜受体或细胞内受体。
3. 传递:受体激活后,内部的信号分子会传递信号,通常通过一系列蛋白质激酶、磷酸化等过程。
4. 放大:信号通过引发级联反应,逐渐放大,确保在细胞内产生足够的响应。
5. 传导:放大后的信号被传导至细胞内的执行器,可能是转录因子、酶或其他调节分子。
6. 细胞响应:最终,信号通路的活动导致细胞产生一定的生物学响应,如基因表达的改变、细胞运动、增殖或凋亡等。
7. 负反馈:为了维持细胞内稳态,通常信号通路还包含负反馈机制,以避免过度激活。
### 电子工程领域的信号通路:在电子工程中,信号通路是指信号从输入端经过一系列电子元件传递到输出端的路径。
以下是一个简单的电子信号通路的阐释:1. 信号源:通常是传感器或其他设备,产生需要处理的电信号。
2. 输入端:信号进入信号通路的起始点。
3. 处理元件:信号通过一系列的电阻、电容、电感、运算放大器等元件进行处理,可能会经过滤波、放大或调制等过程。
4. 传输:处理后的信号通过导线或电路板传输到下一个阶段。
5. 输出端:处理后的信号最终到达输出端,可以是用于显示、记录、控制其他设备等。
6. 反馈:反馈机制可以根据输出来调整输入,以便维持系统的稳定性和性能。
这只是两个领域中信号通路的简单阐释,实际上,不同的领域和应用场景中的信号通路可能会更加复杂和多样化。
PI3K信号通路详解
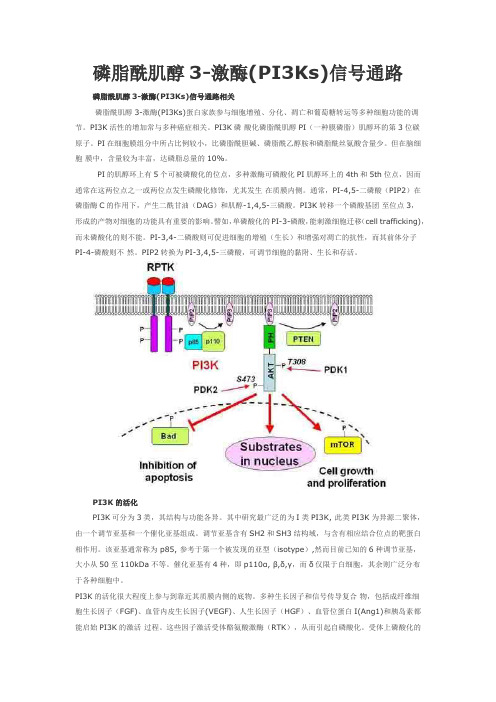
磷脂酰肌醇3-激酶(PI3Ks)信号通路磷脂酰肌醇3-激酶(PI3Ks)信号通路相关磷脂酰肌醇3-激酶(PI3Ks)蛋白家族参与细胞增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节。
PI3K活性的增加常与多种癌症相关。
PI3K磷酸化磷脂酰肌醇PI(一种膜磷脂)肌醇环的第3位碳原子。
PI在细胞膜组分中所占比例较小,比磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰丝氨酸含量少。
但在脑细胞膜中,含量较为丰富,达磷脂总量的10%。
PI的肌醇环上有5个可被磷酸化的位点,多种激酶可磷酸化PI肌醇环上的4th和5th位点,因而通常在这两位点之一或两位点发生磷酸化修饰,尤其发生在质膜内侧。
通常,PI-4,5-二磷酸(PIP2)在磷脂酶C的作用下,产生二酰甘油(DAG)和肌醇-1,4,5-三磷酸。
PI3K转移一个磷酸基团至位点3,形成的产物对细胞的功能具有重要的影响。
譬如,单磷酸化的PI-3-磷酸,能刺激细胞迁移(cell trafficking),而未磷酸化的则不能。
PI-3,4-二磷酸则可促进细胞的增殖(生长)和增强对凋亡的抗性,而其前体分子PI-4-磷酸则不然。
PIP2转换为PI-3,4,5-三磷酸,可调节细胞的黏附、生长和存活。
PI3K的活化PI3K可分为3类,其结构与功能各异。
其中研究最广泛的为I类PI3K, 此类PI3K为异源二聚体,由一个调节亚基和一个催化亚基组成。
调节亚基含有SH2和SH3结构域,与含有相应结合位点的靶蛋白相作用。
该亚基通常称为 p85, 参考于第一个被发现的亚型(isotype),然而目前已知的6种调节亚基,大小从50至110kDa不等。
催化亚基有4种,即p110α, β,δ,γ,而δ仅限于白细胞,其余则广泛分布于各种细胞中。
PI3K的活化很大程度上参与到靠近其质膜内侧的底物。
多种生长因子和信号传导复合物,包括成纤维细胞生长因子(FGF)、血管内皮生长因子(VEGF)、人生长因子(HGF)、血管位蛋白I(Ang1)和胰岛素都能启始PI3K的激活过程。
信号通路是什么鬼?今天给你们讲讲刺猬

信号通路是什么鬼?今天给你们讲讲刺猬上次给你们讲完了Notch信号通路,今天就继续给你们讲信号通路,当然,讲什么信号通路当然我说了算哈。
今天给你们讲的是刺猬:呃,不是这张,这张是十年前夏老师在4698听他们演出的时候拍的……Hedgehog信号通路最早是在果蝇上发现的,因为这个信号通路上的基因突变后,会导致果蝇背上长出毛状的刺:信号通路大概是这样的:这个是KEGG上的信号通路图,看不懂是吧?很正常,要真是这样看的话,确实不容易看懂,所以夏老师会用灵魂画风给你们讲刺猬信号通路。
看KEGG上的信号通路图,你首先可以看懂,刺猬信号通路分成两个不同的步骤,就是:1)无信号时的抑制状态,2)有信号时的激活状态。
我们先看看无信号时的抑制:我把关键的蛋白都用颜色给你们表示了一下,对应到灵魂画风上,应该能看个大概了。
那接下去是有信号是的激活:看完这样两个灵魂版的信号通路图,我再一步步拆解给你们看具体信号通路过程。
刺猬信号通路的信号分子自然就是刺猬(Hh)了,信号通路上关键的部分还有膜受体,在刺猬信号通路上关键的膜受体是Ptc(当然有的图上会写Ptch)。
当Ptc没有结合到刺猬(Hh)信号的时候,会抑制Smo蛋白入细胞膜。
一旦Ptc结合上Hh后,Smo蛋白就会不受抑制,转移到细胞膜上:接下去,就要讲到Cos2/Sufu/Gli三聚体了,这是刺猬信号通路的关键。
这样的三聚体如果没有细胞膜上Smo的结合,在三聚体上的Gli就会被PKA、CK1和GSK3β磷酸化。
而Hh信号激活的状态下Smo会结合到细胞膜上,这个时候的Smo会结合Cos2(有的地方叫Kif7),这样就Smo结合上了Cos2/Sufu/Gli三聚体:被磷酸化的Gli会被泛素化降解掉一部分,变成Gli的抑制状态——Gli-R(有的地方叫GiR),而Cos2/Sufu/Gli三聚体结合到Smo 上后,Gli会从三聚体上脱离出来,这个状态的Gli被称为Gli的激活状态——Gli-A(有的地方叫GiA):抑制状态的Gli-R会抑制下游基因转录,而激活状态的Gli-A则会激活下游靶基因的转录:刺猬信号通路的下游靶基因有好多,比如Bcl2(凋亡相关),CCND1(cyclin-D1,细胞周期相关)等等,所以刺猬信号通路也是研究比较广泛的信号通路。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
资深PI最新文章解析信号通路------------------------------------------------------------------------------------------------------------------------------------摘要:来自新加坡分子与细胞生物学研究院,癌症与发育细胞生物学部的研究人员获得了YAP-TEAD4复合物在YAP因子N端结构域相互作用,以及在TEAD4 C端结构域与YAP相互作用的晶体结构,从中研究人员认为YAP中的PXXΦP片段是与TEAD4相互作用的关键结构,这为研究Hippo信号通路提供了重要的分子机理线索。
这一研究成果公布在《Genes Development》杂志上。
生物通报道:来自新加坡分子与细胞生物学研究院,癌症与发育细胞生物学部的研究人员获得了YAP-TEAD4复合物在YAP因子N端结构域相互作用,以及在TEAD4 C端结构域与YAP相互作用的晶体结构,从中研究人员认为YAP中的PXXΦP片段是与TEAD4相互作用的关键结构,这为研究Hippo信号通路提供了重要的分子机理线索。
这一研究成果公布在《Genes Development》杂志上。
领导这一研究的是新加坡分子与细胞生物学研究院宋海卫博士,其早年毕业于河南大学化学系,之后进入中科院生物物理研究院进行分子生物学方面的学习,1998年获得利兹大学(The University of Leeds)分子生物学专业博士学位。
目前任新加坡分子与细胞生物学研究所资深研究员。
Hippo信号转导通路是几年前发现的一个信号转导通路。
研究发现Hippo信号通路是参与调控器官大小发育的关键信号通路,这一观点首先在果蝇中被发现,后来的研究发现在哺乳动物的发育过程中Hippo有相同的功能。
06年Cell发表的一篇文章证实Hippo 是一种细胞分裂和死亡的控制开关。
Hippo信号转导通路通过促进细胞调亡和限制细胞增殖调控器官大小的发育,越来越多的证据表明,Hippo信号的调控可能与人类的肿瘤发生密切相关。
在这篇文章中,研究人员获得了YAP-TEAD4复合物在YAP因子N端结构域相互作用,以及在TEAD4 C端结构域与YAP相互作用的晶体结构,从中研究人员进行了深入分析,包括了一系列的变异分析,研究人员认为YAP中的PXXΦP片段是与TEAD4相互作用的关键结构。
YAP基因在文献中首先是在果蝇实验中引起人们的注意,果蝇中的YAP基因,又称为Yorkie (Yki),作用是促进细胞分裂和细胞生存,并受其它几个基因调控,如:Hippo (Hpo), Salvador (Sav), Warts (Wts), 和Mats。
这些调控途径上游基因中任何一个发生变异或者Yki基因的过量表达将会引起果蝇眼睛或者翅膀细胞的过量生长。
这种促进细胞分裂和细胞生存的作用的偶联是唯一的——其它能促进细胞分裂的基因如Myc,却会促进细胞的死亡。
研究人员通过晶体结构发现,YAP的N端区域能折叠成两个短小的螺旋,和一个延长的,包含PXXΦP片段的环,而TEAD4的C端结构域则是一种类似免疫球蛋白的折叠结构。
研究人员认为YAP与TEAD4相互作用主要是通过这两个短小的螺旋。
之后他们进行了点突破分析,发现对于YAP相互作用至关重要的蛋白残基同样也在其转换活性中扮演了重要角色,从而研究人员认为,YAP中的PXXΦP片段是与TEAD4相互作用的关键结构。
近期另外一组中国科学家也进行了相关研究,他们发现在Hippo的下游存在一种转录激活子Yki/YAP/TAZ。
在哺乳动物细胞中,Hippo pathway kinase cascade(Hippo通路级联激酶)通过磷酸化和促进细胞质转位来抑制YAP及其同系物TAZ的功能。
TEAD家族转录因子是进化上保守的影响YAP生物功能的关键因子。
他们认为Yap是一个候选的致癌基因,而Hippo通路上的其他几个因子是肿瘤抑制因子。
如果Hippo通路功能失调将导致癌细胞丧失接触性抑制(癌细胞不受接触性抑制局限将更容易扩散,肿瘤灶将更快地扩散)。
(生物通:万纹)原文检索:Structural basis of YAP recognition by TEAD4 in the hippo pathway.Chen L, Chan SW, Zhang X, Walsh M, Lim CJ, Hong W, Song H.The Cancer and Developmental Cell Biology Division, Institute of Molecular and Cell Biology, Proteos, Singapore.The Hippo signaling pathway controls cell growth, proliferation, and apoptosis by regulating the expression of target genes that execute these processes. Acting downstream from this pathway is the YAP transcriptional coactivator, whose biological function is mediated by the conserved TEAD family transcription factors. The interaction of YAP with TEADs is critical to regulate Hippo pathway-responsive genes. Here, we describe the crystal structure of the YAP-interacting C-terminal domain of TEAD4 in complex with the TEAD-interacting N-terminal domain of YAP. The structure reveals that the N-terminal region of YAP is folded into two short helices with an extended loop containing the PXXPhiP motif in between, while the C-terminal domain of TEAD4 has an immunoglobulin-like fold. YAP interacts with TEAD4 mainly through the two short helices. Point mutations of TEAD4 indicate that the residues important for YAP interaction are required for its transforming activity. Mutagenesis reveals that the PXXPhiPmotif of YAP, although making few contacts with TEAD4, is important for TEAD4 interaction as well as for the transforming activity.作者简介:宋海卫1987年毕业于河南大学化学系,之后进入中科院生物物理研究院进行分子生物学方面的学习,1998年获得利兹大学(The University of Leeds)分子生物学专业博士学位。
发表论文Loh PG and Song H, (2010) Structural and mechanistic insights into translation termination.Curr. Opin. Struc. Biol. In press.Chen L, Chan SW, Zhang X, Walsh M, Lim CJ, Hong W and Song H. (2010). Structural basis of YAP recognition by TEAD4 in the Hippo pathway.Genes & Development In press.Cheng Z, Saito K, Pisarev AV, Wada M, Pisareva VP, Pestova TV, Gajda M, Round A, Kong C, Lim M, Nakamura Y, Svergun DI, Ito K, and Song H. (2009). Structural insights into eRF3 and stop codon recognition by eRF1.Genes & Development 23, 1106-18.Loh PG, Yang HS, Walsh MA, Wang Q, Wang X, Cheng Z, Liu D, Song H. (2009). Structural basis for translational inhibition by the tumour suppressorPdcd4.EMBO J. 28, 274-85She M, Decker CJ, Svergun DI, Round A, Chen N, Muhlrad D, Parker R, Song H. (2008). Structural basis of Dcp2 recognition and activation by Dcp1.Mol. Cell. Biol. 29, 337-349.Gao, H., Zhou, Z., Rawat, U., Huang, C., Bouakaz, L., Wang, C., Cheng, Z., Liu, Y., Zavialov, A., Gursky, R., Sanyal, S., Ehrenberg, M., Frank, J. and Song H. (2007). RF3 induces ribosomal conformational changes responsible for the dissociation of class-I release factor. Cell129, 929-941.。
