4催化反应动力学-1单底物
4催化反应动力学-3多底物课件

Alberty形式(4-62)
EA
k1[A0] k-1
E
k4 [Q]
[P] k2
F
k-3
k3[B0]
EB
稳态乒乓BiBiKing-Altman图
四、多底物酶促反应机制的鉴别
1、底物动力学作图鉴别
(1)顺序机制 双倒数方程:
顺序机制的各直线交于 纵轴左侧一点,但此法 不能区别有序顺序机制 和随机顺序机制
A
B
NADH + DHA
[B0]
1/[A0]
2、再分别以截矩对 1/[B0]作图: ~1/[B0]
KmB
其二次作图的竖轴截矩为 1/Vm,斜率为KmB/Vm,横轴 截矩为KmB
以斜率对1/[B0]作图: 亦然!!!
1/Vm
KmB/Vm
1/[B0]
1/[B0]
附2:稳态法推导多底物反应方程例
①序列机制的底物动力学的推导
一、酶促反应分类
底物数目 酶分类
单底物 单向单底物 假单底物 双底物
三底物
异构酶 裂合酶 水解酶 氧化还原酶 基团转移酶 连接酶
催化反应 略
比例(%)
5 12 26 27 24 6
大多数酶催化反应是两个或多个底物参与的反应 (以双底物反应物系统为例讨论),以转移反应为主, 占总酶促反应的50%左右;
初速度方程
所得到的速度方程的一般形式及初速度方 程和以前数学推导的结果完全相同。
2.Alberty表达式
许多双底物酶促反应在固原定一个底物浓度而改变另一个 底物浓度时服从米氏方程式; 对许多双底物酶促反应,在总酶浓度固定并远小于两个底 物浓度时,Alberty根据K-A图形法推导出其方程一般形式 为:
酶催化反应的动力学和热力学模型

酶催化反应的动力学和热力学模型酶催化反应是生命体系中关键的一环,它在细胞代谢、信号传导、免疫反应等生命活动中发挥着至关重要的作用。
酶催化反应的动力学和热力学模型则是研究这些反应本质和控制机制的关键工具。
本文将介绍酶催化反应的动力学和热力学背景,探讨几种常见的酶催化反应模型,并简述大分子反应的特点及控制机制。
一、酶催化反应的动力学和热力学背景酶催化反应是指在生物体内,酶作为催化剂促进化学反应的进行。
酶能够显著降低反应所需的能垒,从而提高反应速率。
这是因为酶与底物之间形成的酶底物复合物能够在化学反应中提供一个更加稳定的、能量较低的过渡态,从而降低反应所需的能量和活化能。
在酶催化反应中,反应速率是非常重要的一个参数。
反应速率和底物浓度、酶浓度、反应温度等因素相关,因此需要建立反应速率的动力学模型。
此外,酶催化反应的热力学特性也是研究的关键点之一,热力学模型的建立可以帮助我们理解反应的驱动力和热力学限制。
二、几种常见的酶催化反应模型1. 米高斯-明茨动力学模型米高斯-明茨动力学模型是最早提出的酶动力学模型之一。
这个模型假设底物结合酶的速率比化学反应速率快很多,因此酶底物复合物的形成是反应速率的控制步骤。
当底物浓度很低时,酶活性不会受到抑制。
但是随着底物浓度的增加,酶活性会逐渐达到饱和,反应速率也会趋于常数。
2. 酶抑制模型酶抑制模型是一种描述酶和抑制剂之间互作关系的动力学模型。
抑制剂可以直接地或者通过结合酶活性部位抑制酶的活性。
在酶活性被抑制的情况下,反应速率呈现非线性关系,其动力学方程可以写成一个双曲线形式。
3. 酶电化学模型酶电化学模型结合了动力学和电化学的理论,描述酶催化反应的电化学过程和催化剂对电极反应动力学的影响。
这种模型在电化学和生物传感领域有着广泛的应用。
三、大分子反应的特点及控制机制除了小分子酶催化反应,大分子反应也是生物体系中一种重要的反应类型。
大分子反应包括蛋白质合成和降解、DNA复制和修复等过程。
酶催化反应动力学

酶催化反应动力学一、引言酶是生物体内自然存在的一类生物催化剂,其作用是加速生物体内的化学反应。
酶的催化效率比非酶催化的反应高出成千上万倍,甚至数十百万倍。
这种高效的催化作用使得酶在生物体内的生命活动中扮演着不可或缺的角色。
酶催化反应动力学是研究酶催化反应速率以及影响反应速率的各种因素的科学。
它是生物化学反应工程、生物制药工程、生物农业工程、生物材料工程等学科的基础,也是生物医学、生物工程、生物安全等领域的热点研究课题。
二、酶催化反应动力学的基础概念1、酶催化反应速率:指单位时间内,单位体积中底物的消耗速率或产物的生成速率。
2、米氏方程:Michaelis-Menten方程是描述酶催化反应速率与底物浓度关系的经典方程,它揭示了酶的催化效率与底物浓度的关系。
3、酶的活性中心:酶分子中与底物结合并发生催化反应的部位,通常由多种氨基酸残基组成。
4、底物结合与释放:酶与底物的结合和释放是酶催化反应的重要环节,其速率受底物浓度、竞争性抑制剂、温度、pH等多种因素的影响。
三、影响酶催化反应速率的因素1、底物浓度:底物浓度是影响酶催化反应速率的主要因素之一。
在底物浓度较低时,反应速率随底物浓度的增加而线性增加;当底物浓度达到一定值时,反应速率达到最大值,此时即使再增加底物浓度,反应速率也不会再增加。
2、温度:温度对酶催化反应速率的影响较大。
在一定范围内,随着温度的升高,酶的活性增强,反应速率增大;但当温度超过一定范围后,高温会导致酶失活,反应速率反而下降。
3、pH:pH对酶催化反应速率的影响也较大。
每种酶都有其最适pH 值,在此pH值下,酶的活性最强,反应速率最大。
当pH值偏离最适范围时,酶的活性降低,反应速率下降。
4、抑制剂:抑制剂是能够降低酶催化反应速率的物质。
竞争性抑制剂通过与底物竞争结合酶的活性中心来降低反应速率;非竞争性抑制剂通过与酶活性中心外的位点结合来降低反应速率;反竞争性抑制剂通过与底物-酶复合物结合来降低反应速率。
催化反应动力学

d[P] = k2 [ES] dt
k1[S][E] [S][E] [ES] = = k−1 + k2 KM
酶催化反应的级数
令酶的原始浓度为[E] 反应达稳态后, 令酶的原始浓度为 0,反应达稳态后,一 部分变为中间化合物[ES],余下的浓度为 部分变为中间化合物 ,余下的浓度为[E]
[E] = [E]0 -[ES]
它的选择性超过了任何人造催化剂, 它的选择性超过了任何人造催化剂,例如脲酶它只 能将尿素迅速转化成氨和二氧化碳, 能将尿素迅速转化成氨和二氧化碳,而对其他反应 没有任何活性。 没有任何活性。
2.高效率 2.高效率
它比人造催化剂的效率高出10 它比人造催化剂的效率高出 9至1015 倍。例如 一个过氧化氢分解酶分子, 一个过氧化氢分解酶分子,在1秒钟内可以分解十 秒钟内可以分解十 万个过氧化氢分子。 万个过氧化氢分子。 一般在常温、常压下进行。 一般在常温、常压下进行。
1 1 作图,从斜率和截距求出K 以 r ~ [S] 作图,从斜率和截距求出 M和rm
= k [ A] k = k 0 + k c [C ]
酶催化反应
•酶催化反应历程 酶催化反应历程 •用稳态近似法处理 用稳态近似法处理 •酶催化反应的级数 酶催化反应的级数 •酶催化的反应速率曲线 酶催化的反应速率曲线 •米氏常数 米氏常数 •酶催化反应特点 酶催化反应特点
酶催化反应特点
酶催化反应与生命现象有密切关系, 酶催化反应与生命现象有密切关系,它的主 要特点有: 要特点有: 1.高选择性 高选择性
均相酸碱催化反应
设有一均相催化反应: 设有一均相催化反应: C A P C:催化剂 : • 催化反应历程可设为: 催化反应历程可设为: k1 A + C M k-1 k2 M P + C • 由稳态法: 由稳态法:
酶反应动力学

Km值的物理意义:即是Km值是 当酶反应速率达到最大反应速率 一半时的底物浓度。(摩尔/升)。 Km是酶的一个特性常数与酶的性 质有关,与酶浓度无关,只是对 一定底物、一定的pH、一定的温 度条件而言。
V
零级反应
混合级反应
一级反应
[S]
中间复合物学说:
第一步: E+S 第二步: ES→E+P
ES V∝[ES]
1913年Michaelis和Menten推导了米氏方程
Vmax [S] v K m [S]
k2 ES E S P E k 1
酶促反应的米氏方程及Km
中间产物学说 第一节单底物酶促动力学 第二节双底物酶促反应动力学 第三节 酶反应影响因素
中间产物学说 酶动力学研究始于1902年,当时,A.Brown用酵母β -呋喃 果糖糖苷酶对蔗糖进行水解。他发现当蔗糖的浓度比酶的浓度 高许多时,反应速度不再取决于蔗糖的浓度,即是说,反应速 度相对于蔗糖来说是零级反应。因此,他提出,蔗糖水解的总 反应是由两个基本反应构成,第一步是底物与酶形成一种复合 物,第二步是这种中间物生成产物并释放出酶: k1 k2 E + S ←→ ES → P + E k-1 这里,E、S、ES和P分别代表酶、底、酶-底物复合物和产物。 中间产物学说认为, 当酶催化某个反应时, 酶和底物先结合形 成一个中间复合物, 然后中间复合物再分解, 生成产物并释放 出酶。一般以产物的生成速度代表整个酶催化反应速度,而产 物的生成取决于中间物的浓度. 因此, 整个酶促反应的速度取 决于中间物的浓度.
* 可近似表示酶和底物亲合力,Km愈小,E对S的亲合
力愈大,Km愈大,E对S的亲合力愈小。
酶的反应动力学

竞争性抑制剂双倒数曲线,如下图所示:
1 =Km 1 〔 I 〕 1 (1+ ) + Ki 〔S〕 Vmax v Vmax
Vmax指该酶促反应的最大速度,[S]为底 物浓度,Km是米氏常数,VO是在某一底物浓 度时相应的反应速度。从米氏方程可知: 当底物浓度很低时 [S] << Km,则 V≌Vmax[S]/Km ,反应速度 与底物浓度呈正比; 当底物浓度很高时, [S]>> Km ,此时V≌Vmax ,反应速度达最大 速度,底物浓度再增高也不影响反应速度。
Vmax A B A B K A AB K s KB m
B m
A Ks KB A m Km B
v
K
A m
1 1 v Vmax
1 KB m A 1 B
1 V max
二. 酶浓度的影响
化学动力学基础
底物浓度对酶反应速率的影响 温度、pH及激活剂 对酶反应的影响
酶的抑制作用
目的与要求
重点掌握酶促反应动力学:米氏方程、 温度、pH、激活剂、抑制剂对酶促反应速 度的影响;掌握三种可逆抑制作用的动力 学特点。
化学动力学基础
各级反应的特征
1 一级反应
t1/2≈0.693/k 2 二级反应 t1/2=1/ka 3 零级反应
ES的形成速度: d„ES‟/ dt=k1„E‟„S‟ ES的分解速度: -d„ES‟/ dt=(k2+k3)„ES‟ 稳态平衡下, k1„E‟„S‟ =(k2+k3)„ES‟ 即:„E‟„S‟/„ES‟= (k2+k3)/ k1=Km
而„E‟=[E]t-„ES‟代入
得:
Et ES S Km ES
酶的反应动力学

双倒数作图法
(二)双底物的反应
双底物反应的动力学
1 乒乓反应动力学
v
Vm axAB
2、〔S〕 >> 〔E〕,[S]-[ES] ≈[S]
3、反应系统处于稳态平衡状态,即〔ES〕的形成速度等于〔ES〕 的分解速度:d〔ES〕/dt=-d〔ES〕/dt
ES的形成速度: d〔ES〕/ dt=k1〔E〕〔S〕
ES的分解速度: -d〔ES〕/ dt=(k2+k3)〔ES〕
稳态平衡下, k1〔E〕〔S〕 =(k2+k3)〔ES〕
(2)特点:
① 抑制剂I与底物S在化学结构上相似,能与 底物S竞争酶E分子活性中心的结合基团.
例如,丙二酸、苹果酸及草酰乙酸皆和琥珀酸 的结构相似,是琥珀酸脱氢酶的竞争性抑制剂。
②抑制程度取决于抑制剂与底物的浓度比、 〔ES〕和〔EI〕的相对稳定性;
③加大底物浓度,可使抑制作用减弱甚至消除。
(3)竞争性抑制剂的动力学方程
(一)不可逆性抑制作用
不可逆性抑制作用的抑制剂,通常以共 价键方式与酶的必需基团进行不可逆结合 而使 酶丧失活性。常见的不可逆抑制剂如下图 所 示。按其作用特点,又分专一性及非专一 性两种。
1.非专一性不可逆抑制
抑制剂与酶分子中一类或几类基团作用,不论 是必需基团与否,皆可共价结合,由于其中必需基 团也被抑制剂结合,从而导致酶的抑制失活。某些 重金 属(Pb++、Cu++、Hg++)及对氯汞苯甲酸等,能与酶分 子的巯基进行不可逆适合,许多以巯基作为必需基 团 的酶(通称巯基酶),会因此而遭受抑制,属于此种 类型。用二巯基丙醇(british anti lewisite,BAL)或二巯基丁二酸钠等含巯基的化合 物可使酶复活。
3-1-单底物酶反应动力学

Haldane 关系式
当酶反应达到 平衡时: 得到总反应的 平衡常数:
这个总反应的平衡常数和正逆反应的动力 学参数之间的关系式称为Haldane 关系式。
四、米氏公式的基本作图
1. Lineweaver-Burk Plots(双倒数作图) 由米氏公式两侧同时取倒数,得到:
以1/v vs. 1/[S] 作图为直线。 直线的斜率为Km/Vm,纵轴截距为1/Vm。 由此作图的斜率和纵轴截距即可算出Km和 Vm。进而可由Vm和酶浓度得到kcat 。
米氏常数 Km
以v = Vm/2 代入米氏公式: Vm/2 = Vm [S]/(Km+[S]) Km+[S] = 2[S],Km = [S] Km值越小,表示达到最大反应速度一半 (一半酶被底物结合)所需的底物浓度越 低,即底物在酶上亲和力越高。 但Km不是解离常数。解离常数KS=k-1/k1 只有k2<<k-1时,近似地Km=KS。
Lineweaver-Burk Plots
实验设计
由于是倒数作图,同时低底物浓度时变化 对速度影响大,高浓度时变化影响小。 底物浓度的设计应遵循低浓度小间隔,高 浓度大间隔得原则。 很低底物浓度区接近一级反应,很高底物 浓度区接近0级反应,作图的准确性都会 很低。实验误差难免,这两个区域实验误 差会造成大的结果误差,应当避开。 一般选择0.25-5倍Km范围的底物浓度。
0级反应
产物:[P] = [A0]-[At] = k0t
一级反应
产物:[P] = [A0]-[At] = [A0](1 - e-kt)
二级反应
产物公式:k2t = (1 / [A0 - B0]) ln([B0][A0 –Pt] / [A0][B0-Pt])
催化反应动力学

在化学反应中,凡加入某些物质(可以是一 种或几种)可以改变化学反应速率,而这些物
质本身在反应前后没有数量上的变化,同时也
没有化学性质的改变,则这类物质称为催化 剂,这种作用称为催化作用。有催化剂参加的 反应称为催化反应。
①化学工业的发展和国民经济上的需要都推动着对催化作用的 研究。催化作用无论在工业生产或在科学实验中都应用的非 常广泛,化学工业品的生产有80%以上离不开催化剂的使用。 ②在生命现象中存在着大量催化作用,例如植物对CO2的光合 作用、有机体内的新陈代谢、蛋白质、碳水化合物和脂肪的 分解作用、酶的作用等都是催化作用。但是由于涉及的问题 比较复杂,催化理论的发展远远落后于实际,因此探索催化 作用的规律,从而能从理论上预示如何选择催化剂就成为目 前物理化学发展中一个相当活跃的领域。
Pt表面变得粗糙等。
②催化剂量比较少(相对于反应物而言)。
③催化剂能加快反应达到平衡的速率,是由于改变了反应的历 程,降低了活化能。至于它怎样降低活化能,机理如何,对 大部分催化反应来说,了解得还很有限。
④催化剂只能加速反应达到平衡,缩短达到平衡所需的时间, 但不能改变平衡常数,不能移动平衡点。原因是△ G0 只取决 于起始态,而与中间过程无关。(△G0=-RTlnK0)。 对于已达到平衡的反应,不可能借助加入催化剂以增加产物 百分比,只提高反应速率。我们知道所谓化学平衡不是绝对 的静止,而是正向反应速率与逆向反应速率相等。对一可逆 反应来说,其平衡常数等于正向反应速率常数和逆向反应速 率常数之比,即 K=k+/k-
化剂上脱氢。同样,相同条件下,水合反应的催化剂也是脱 水反应的催化剂。甲醇是一种重要的化工原料,工业上合成 甲醇用下列反应:
CO2 3H2 ƒ CH3OH H2O
第四章-酶促反应动力学

四、酶动力学图解法
要建立一个完整的动力学方程,必须通过动力学 实验确定其动力学参数。对Michaelis-Menten方程, 就是要确定rmax(或k+2)和km值。但直接应用 Michaelis-Menten方程求取动力学参数所遇到的主 要困难在于该方程为非线性方程。为此常将该方程
加以线性化,通过作图法直接求取动力学参数。
mol/l
将已知数据代入上式中,求得
k 0.0202
当 t=3min时,可以求得
min-1 、
S 0.94105
xS=6 %
mol/l
P 6% S0 6 107
mol/l
(2)当[S0]为1×10-6mol/l时,仍可视为一 级反应, ∴t=3 min时,同样可求得 xS=6 %
Km=1.7x10-5mol/L
乳酸脱氢酶
乳酸 乙酰CoA Km=1.3x10-3 mol/L Km=1.0x10-3mol/L
丙酮酸
丙酮酸脱氢酶
丙酮酸脱羧酶
乙醛 Km可以帮助推断某一反应的方向和途径
(2)Vmax和K3(Kcat)的意义
在一定的酶浓度下,酶对特定底物的Vmax也是一个常数。 当[s]很大时, Vmax=K3『E]。Vmax与K3成线性关系,而直线 的斜率为K3。 K3 表示当酶被底物饱和时每秒钟每个酶分子转换底物的分子数,这 个常数又叫转换数(简称TN),通称催化常数(catalytic constant, kcat). Kcat值越大,表示酶的催化效率越高。
dc k (a x) 2 dt 1 x k t a (a x)
x b( a x ) ln a x a(b x)
k
情况1:A和B的初始浓度不同,则 移项积分
酶工程 第二章酶动力学 第一节酶促反应动力学

1913年前后,米彻利斯(Michaelis)和曼吞(Menten) 在前人工作的基础上,通过大量的定量研究,提出了酶促动力 学基本原理,并推导出了著名的米-曼氏方程,推导过程如下:
根据上述反应式,中间产物ES的生成速度(底物S的消失速度)
v1=k1[S][E]-k2[ES]
(2-1)
而ES的消失速度(产物P的生成速度) v2=k3 [ES],当反应达到 平衡时,即v1=v2时
第一节 酶促反应动力学
对许多酶的性质的观察和研究得知,在低的底物浓度[S]下, 反应速度(v)直接与底物浓度[S]成正比;在高底物浓度[S]下, 速度趋向于最大值(Vmax),此时反应速度与底物浓度[S]无关 (如图2-1)。
图2-1 单底物酶促反应的反应速度与底物浓度的关系
第一节 酶促反应动力学
图2-5 乒乓反应机理 实际上,多底物酶促反应动力学是非常复杂的,以上只是作以简要介绍, 有关详细内容,可查阅相关专著。
将米氏方程改写成以下形式
以 对作图,绘出曲线,横轴截距即为-值,纵轴截距则是 (图2-2)。
第一节 酶促反应动力学
图2-2 双倒数作图
第一节 酶促反应动力学
二、多底物动力学 通常情况下,酶催化反应涉及两个(少数情况下三个)底物。 现在我们考虑一个涉及两种底物和两种产物的酶促反应物反应。现在已知的生化反应 中有六成以上属于这一种反应。双底物反应的机理有下面三种 可能:
第一节 酶促反应动力学
1.有序反应机理(ordered reaction) 这种情况下,A和B分别可被说成是先导底物和后随底物,Q 是A的产物,最后被释放。A和Q竞争同游离酶E结合,但A和B则 不会(或者Q和B也不会)发生竞争(如图2-3)。依赖烟酰胺腺 嘌呤二核苷酸(NAD+或NADP+)的脱氢酶的反应就属于这种类型。
催化反应动力学

2.当[S]<<KM时 r =k2[E]0[S]/KM 对[S]呈一级
3.当[S]→∞时, r = rm=k2[E]0
d S
dt 3
rm
2
1.5
rm
2
1
KM1 2 3 4 5 S
酶催化的反应速率曲线
d S
dt 3
rm
2
1.5
rm
2
1
KM 1
2
3
4
5 S
典型的酶催化反应速率曲线
下面的数学处理可以求出 KM 和 rm
他们认为酶(E)与底物(S)先形成中间化合物
ES,中间化合物再进一步分解为产物(P),并释放
出酶(E),整个反应的速决步是第二步。
d[P] dt
k2[ES]
[ES] k1[S][E] [S][E]
k1 k2
KM
令酶的原始浓度为[E]0,反应达稳态后,一 部分变为中间化合物[ES],余下的浓度为[E]
E3 Ea
AK+B
反应途径
AB K
催化剂与催化作用
A…B
能量
Ea E1 E3 E2
E0
A…B…K
A…K
E1 E2 A+BK
E3 Ea
AK+B
反应途径
AB K
催化剂与催化作用
也有某些催化反应,活化能降低得不多,而反 应速率却改变很大。有时也发现同一反应在不同的 催化剂上反应,其活化能相差不大,而反应速率相 差很大,这种情况可由活化熵的改变来解释。
催化剂与催化作用 什么是催化剂毒物?
固体催化剂的活性中心被反应物中的杂质占 领而失去活性,这种杂质称为毒物。
毒物通常是具有孤对电子元素(如S,N,P等) 的化合物,如 H2S, HCN, PH3 等.
酶促反应动力学

不属于抑制剂。
通常抑制作用分为可逆性抑制和不可逆性抑制两类。
(一)不可逆性抑制作用(irreversible inhibition) 不可逆性抑制作用的抑制剂,通常以共价 键方式与酶的必需基团进行不可逆结合而使 酶丧失活性。常见的不可逆抑制剂如下图所 示。按其作用特点,又分专一性及非专一性 两种。
3.4 酶促反应动力学 酶促反应动力学(kinetics of enzymecatalyzed reactions)是研究酶促反应速度及其 影响因素的科学。 酶促反应的影响因素主要包括
1. 2. 3. 4. 5. 6. 底物的浓度、 酶的浓度、 pH、 温度、 抑制剂 激活剂
一、 底物浓度对反应速度的影响
木瓜蛋白酶
胆碱脂酶
动物体内多数酶的最适pH值接近中性,但也有例外,如胃
蛋白酶的最适pH约1.8,肝精氨酸酶最适pH约为9.8(见下表)。
一些酶的最适pH
五. 激活剂对酶反应速度的影响
能使酶活性提高的物质,都称为激活剂(activator),其 中大部分是离子或简单的有机化合物。如Mg++是多种激酶和 合成酶的激活剂,动物唾液中的α-淀粉酶则受Cl-的激活。
3、反应系统处于稳态平衡状态,即„ES‟的形成速度等于„ES‟ 的分解速度:d„ES‟/dt=-d„ES‟/dt
Briggs和Haldane“稳态平衡”理论
(1) (2)
稳态平衡理论:
反应进行一段时间后,系统的ES浓度,由零逐渐 增加到一定数值,在一定时间内,尽管底物浓度和 产物浓度不断变化,复合物ES的浓度也在不断的 生成和分解,但当系统中ES的生成速率和ES的分 解速率相等时,ES的浓度不变。
第四节酶促反应动力学
第四节酶促反应动力学生物体进行的新陈代谢都是在酶的催化下发生的物质代谢和能量代谢,而酶催化的反应速度是非常重要的。
在活细胞中一个合成反应必须以足够快的速度满足细胞对反应产物的需要。
而有毒的代谢产物也必须以足够快的速度进行排除,以免积累到损伤细胞的水平。
若需要的物质不能以足够快的速度提供,而有害的代谢产物不能以足够快的速度排走,势必将造成代谢紊乱。
研究酶反应速度不仅可以阐明酶反应本身的性质,了解生物体内正常的和异常的新陈代谢,而且还可以在体外寻找最有利的反应条件来最大限度地发挥酶反应的高效性。
生物体内进行的酶促反应,可用化学动力学的理论和方法进行研究,即在测定酶促反应速度的基础上,研究底物浓度、酶浓度、温度、pH值、激活剂和抑制剂等对反应速度的影响。
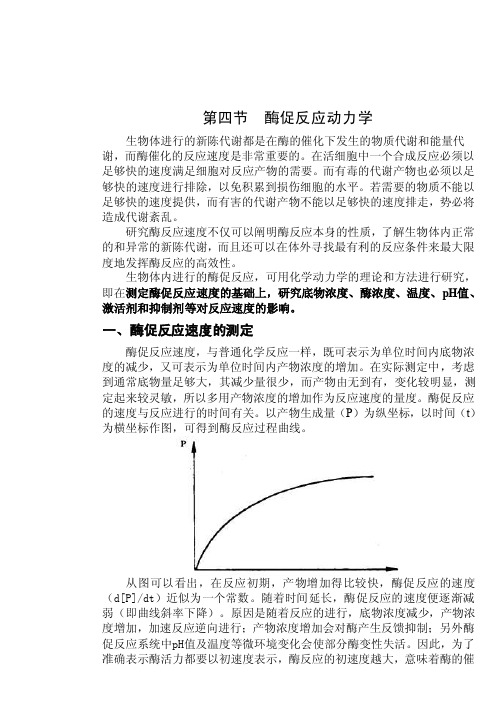
一、酶促反应速度的测定酶促反应速度,与普通化学反应一样,既可表示为单位时间内底物浓度的减少,又可表示为单位时间内产物浓度的增加。
在实际测定中,考虑到通常底物量足够大,其减少量很少,而产物由无到有,变化较明显,测定起来较灵敏,所以多用产物浓度的增加作为反应速度的量度。
酶促反应的速度与反应进行的时间有关。
以产物生成量(P)为纵坐标,以时间(t)为横坐标作图,可得到酶反应过程曲线。
从图可以看出,在反应初期,产物增加得比较快,酶促反应的速度(d[P]/dt)近似为一个常数。
随着时间延长,酶促反应的速度便逐渐减弱(即曲线斜率下降)。
原因是随着反应的进行,底物浓度减少,产物浓度增加,加速反应逆向进行;产物浓度增加会对酶产生反馈抑制;另外酶促反应系统中pH值及温度等微环境变化会使部分酶变性失活。
因此,为了准确表示酶活力都要以初速度表示,酶反应的初速度越大,意味着酶的催化活力越大。
二、底物浓度对酶促反应速度的影响1、底物浓度与酶促反应速度的关系确定底物浓度([S])与酶促反应速度(V )间关系,是酶促反应动力学的核心内容。
在酶浓度、温度、pH 不变的情况下,实验测得,酶反应速度与底物浓度的关系,从图曲线所示,底物的浓度很低时,V 与[S]呈直线关系(OA 段),这时,随着底物浓度的增加,反应速度按一定比率加快,为一级反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
热力学
热力学所能性和限度
动力学 Kinetics
动力学所关心的是由初状态( 动力学所关心的是由初状态(反应物 变終状态(产物)的过程(路径) )变終状态(产物)的过程(路径) ,即反应进行的速率和反应机制
二、米氏方程推导
1、Henri与Michaelis-Menten方程 、 与 方程
双曲线方程: 双曲线方程:
k1 E+S k-1 ES
k2 k-2
E+P
1913 ,MichaelisMenten 根据中间复合 物学说对图6-1的曲线进 物学说对图 的曲线进 行了数学处理. 行了数学处理
k1 E+S k-1 ES k2
1903 Henri
acid sucrose + H2O glucose + fructose V
enzyme sucrose + H2O V V glucose + fructose
[sucrose]
[sucrose] [enzyme]
零级反应
酶浓度固定
一级反应
初速度对初底物浓度下的曲线
如图,底物浓度改变对酶促反应速度影响较复杂; 如图,底物浓度改变对酶促反应速度影响较复杂; 饱和与部分饱和是对整体酶而言; 饱和与部分饱和是对整体酶而言; 如何解释上述现象? 如何解释上述现象?
“稳态平衡假说”及其对米式方程的发展 稳态平衡假说”
Briggs和 Briggs和Haldane 1925 [ES]的动态平衡不仅与 有关,还与ES P+E有关 有关。 [ES]的动态平衡不仅与 E+S → S有关,还与ES → P+E有关。 稳态平衡假说的贡献在于发展了快速平衡学说的第③ 稳态平衡假说的贡献在于发展了快速平衡学说的第③点。 所谓“稳态” ES的形成速度与分解速度相等 ES的浓度保持不 的形成速度与分解速度相等、 所谓“ 稳态 ”: ES 的形成速度与分解速度相等、 ES 的浓度保持不 变的反应状态
E+P
Ks为底物解离常数(底物常数) 为底物解离常数(底物常数) 为底物解离常数
假设将酶浓度固定,底物 假设将酶浓度固定 底物 浓度对反应速度的影响
其推导过程基于以下三点假设
“快速平衡学说” 快速平衡学说” 快速平衡学说 (Rapid Equilibrium)
(1)底物浓度 显著超过酶浓度 ,ES形成不会明显降低 ,[S] 底物浓度[S]显著超过酶浓度 形成不会明显降低[S], 底物浓度 显著超过酶浓度[E], 形成不会明显降低 以起始浓度计。因此, 可以认为不变 可以认为不变。 以起始浓度计。因此,[S]可以认为不变。 (2)测定的速度为反应初速度,底物消耗很少,产物P的生成极少, 测定的速度为反应初速度,底物消耗很少,产物 的生成极少 的生成极少, 测定的速度为反应初速度 的可能性不考虑。 由P+E逆转生成 ES的可能性不考虑。P+E→ ES可以忽略不记。 逆转生成 的可能性不考虑 (3)酶和底物结合物 合成速度显著快于 形成 酶和底物结合物ES合成速度显著快于 形成P+E速度,也就是 速度, 酶和底物结合物 合成速度显著快于ES形成 速度 的可逆反应在测定初速度时已达到平衡, 分解生成 说E+S ES的可逆反应在测定初速度时已达到平衡,ES分解生成 的可逆反应在测定初速度时已达到平衡 产物不足以破坏这个平衡,即 产物不足以破坏这个平衡 即: 游离的酶与底物形成ES的速度极快 快速平衡), 的速度极快( ),而 形成产物 游离的酶与底物形成 的速度极快(快速平衡),而ES形成产物 的速度极慢, 的动态平衡与ES 的速度极慢,故, [ES] 的动态平衡与 → P+E没有关系 没有关系 >>K2 ) (既 K1、K-1 >> 、
1913,Michaelis与Menton提出了酶促反应动力 1913,Michaelis与Menton提出了酶促反应动力 学基本原理, 学基本原理,表明底物与酶反应速度之间的定 量关系,中间产物学说认同; 量关系,中间产物学说认同; 1936,分光镜研究过氧化物酶第一次证实酶底 1936,分光镜研究过氧化物酶第一次证实酶底 物络合物存在,此后,X射线结晶学, ,X射线结晶学 物络合物存在,此后,X射线结晶学,电子自旋共 振ESR,NMR,荧光测定均证实. ESR,NMR,荧光测定均证实. 荧光测定均证实
酶 学
Enzymology
彭益强
国 立 华 侨 大 学 生 物 工 程 与 技 术 系
研究酶结构与功能关 及酶作用机制时需动 力学提供实验证据
酶促反应动力学
Kinetics of enzyme-catalyzed reactions 发挥酶催化的高效 率,寻找有利条件
研究酶促反应的速率以及影响 此速率的各种因素的科学。 此速率的各种因素的科学。
速率与机制
速率和所走的路径有很大的关系。 速率和所走的路径有很大的关系。当反应机 制不同时,反应速率就会不同, 制不同时,反应速率就会不同,所以动力学 也被认为是研究与反应速率相关的理论。 也被认为是研究与反应速率相关的理论。
换言之,想了解反应的机制, 换言之,想了解反应的机制,就必须由 反应速率的研究下手。 反应速率的研究下手。例如想要了解酶 作用的机制,就必須由酶动力学着手. 作用的机制,就必須由酶动力学着手
1909年,Sorenson指出 对酶活力的影响 年 指出pH对酶活力的影响 指出 1913年,Michaelis和Menten用简单的平衡或 年 和 用简单的平衡或 准平衡概念推导出了单底物的酶促反应方程
Maud Menten
Leonor Michaelis
German-American biochemist
早期公式推导1-根据快速平衡 早期公式推导 根据快速平衡 根据 得出的解离常数Ks 得出的解离常数
形成E+S的解离常数为 ,则有 的解离常数为Ks,则有: 设ES形成 形成 的解离常数为
(1)
平衡时: 平衡时: [E]=[E0]-[ES] , 由(1)得: ) Ks[ES]=[E][S]=([E0]-[ES])[S] [ES](Ks+[S])=[E0][S]
动力学基础概念
反应速率
反应分子数
反应中真正参加反应的分子数
A+B
P+Q
A
P
反应级数
一级反应
二级反应
零级反应
发展历史
19世纪末 世纪初,人们致力于研究酶的催化作用并 世纪末20世纪初 世纪末 世纪初, 希望用数学原理和质量作用定律解释酶反应的进程 1902年,Henri和Brown 年 和 分别提出了酶促反应中有 底物络合物的生成, 酶—底物络合物的生成, 底物络合物的生成 并推导出了数学关系式
浓度因素(酶浓度、 浓度因素 酶浓度、底物 酶浓度 浓度及效应物浓度)、 浓度及效应物浓度 、
最基本的影响因素, 最基本的影响因素,从 浓度因素的有关实验求 出速度常数, 出速度常数,进一步考 察各种影响因素的相互 关系, 关系,这是酶反应动力 学的主要内容。 学的主要内容。
影响酶反应 速度的因素
one of the first women doctors in Canada in 1911
1925年,Briggs和Haldane对 年 和 对 酶动力学引入了稳态的概念; 60年代,尝试用平衡态和稳态概念 年代, 年代 解释双底物和三底物的酶促反应; 解释双底物和三底物的酶促反应; 后来, 后来,King和Altman建立了一种推导复杂的稳 和 建立了一种推导复杂的稳 态反应图解法,通过Cleland系数转换规则,可 系数转换规则, 态反应图解法,通过 系数转换规则 将复杂的酶促反应表示成简单的动力学方程 1965年,Monod等建立了变构酶动力学模型 年 等建立了变构酶动力学模型
(5)
或推导2 或推导2-平衡概念
ES的生成速度: ES的生成速度:k1([E0]- ES])[S] 的生成速度 ) ES的分解速度 的分解速度: ES的分解速度:k-1[ES] ( k2<<k1,k-1,k2[ES]忽略) 忽略 快速平衡: 快速平衡 k1([E0]-[ES])[S] = k-1[ES] )
代入6-6可得 (4)若v=1/2Vm代入 可得 ) 代入 可得:
Ks=[S]
(5)Ks的倒数 的倒数1/Ks为亲和常数 ) 的倒数 为亲和常数
代表E和 形成中间 代表 和S形成中间 复合物ES的亲和力 的亲和力, 复合物 的亲和力, Ks越小,亲和力越大, 越小, 越小 亲和力越大, ES不易解离。 不易解离。 不易解离
2. Briggs-Haldane稳态学说 稳态学说
k2>k-1时,快速平衡不一定能成立 普遍性公式: 普遍性公式
稳态(Stady-State)学说: 稳态(Stady-State)学说: 测初速度时,[S]减少,[P]增加,[ES]增高一 测初速度时,[S]减少,[P]增加,[ES]增高一 减少 增加 段时间后保持恒定,ES生成速度和消失速度相 段时间后保持恒定,ES生成速度和消失速度相 达到动态平衡,即所谓“稳态” 等,达到动态平衡,即所谓“稳态”。即将米 氏的第三点“平衡”假设改成“稳态”假设。 氏的第三点“平衡”假设改成“稳态”假设。
KS也称为底物常数
解离常数Ks 解离常数
的解离常数。 (1)Ks=k-1/k1为ES的解离常数。 ) 的解离常数 (2)米氏方程表达了反应初速度与底物浓度的关系 ) (3)若作 )若作v—[S]图,是一条矩形双曲线 图
可见解离常数Ks就是当反应初 可见解离常数 就是当反应初 速度v为最大速度 为最大速度Vm的一半时 速度 为最大速度 的一半时 所需的底物浓度。 所需的底物浓度。
底物数目与结构
产物、抑制剂、 产物、抑制剂、激活 剂、酶的结构与性质 、 反应环境(温度、 、离子强度、压力) 反应环境 温度、pH、离子强度、压力 温度
