药物临床试验总结表-邵逸夫医院
邵逸夫医院药剂科参观报告

2009 年度《药物分析》自主学习总结——邵逸夫医院药剂科参观报告2006 级药学专业汪琼玥组员:金苗苗、朱灵芝、沈莉慧2008 年 3 月 10 日,我们借着药物分析课自主学习环节,在 98 级药理硕士毕业生赵老师的指导下参观了邵逸夫医院的药剂科,收获颇丰。
本文将对此行所见所感与所思进行一个整理与回顾。
一、邵逸夫医院药剂科简介邵逸夫医院药剂科始建于 1993 年医院成立之际,在医院和中美专家的共同努力下,以形成一种新的医院药学服务体系,实现了医院药学工作由传统的药品供应保障型向临床药学和现代科学研究相结合的技术服务型的转变。
目前药剂科员工总数 87 人,其中主任药师 2 人,副主任药师 8 人,主管药师 18 人,药师 28 人,药士 30 人。
除门诊药房、病区药房、配置中心、制剂室等常规工作外,药剂科还开展了多项药学监护服务,包括治疗药物监测,临床药师查房,合理用药咨询、不良反应监测等。
二、参观过程我们一行坐车至红菱新村,步行来到邵逸夫医院。
透过门前的“小桥流水”与来往人群,我们看到了“邵逸夫医院”5个金色楷体大字,刚劲有力,与红色大理石地面交相辉映。
它的两边写着两家合作单位的名字,分别为浙江大学和美国罗马琳达大学。
沿着里面的走道,我们对医院环境进行了简单的了解,面积不大,但是布局紧凑、利用度高;医务工作者们各司其职,整体情况井然有序。
由于离约定时间还有些早,我们便在门诊大厅里稍作休息。
这个环状大厅设计得很有特色,白色的墙壁、红色的柱子,各式的绿色植物沐浴在从头顶射入的阳光中,温暖而又宁静。
开阔的环境,温馨的格调,宁静的氛围都给我们以深刻的印象。
后在赵老师的带领下,我们沿着门诊病房——病区病房——配置中心——药剂室的顺序对药剂科进行了整体参观,并对各个科室的职能进行了解。
门诊药房位于门诊大厅右侧,负责为门诊病人配药发药。
开阔的柜台式设计和上面的电子公告牌都方便了药师和病人及时有效地交换信息。
医院药物临床试验项目结题总结表
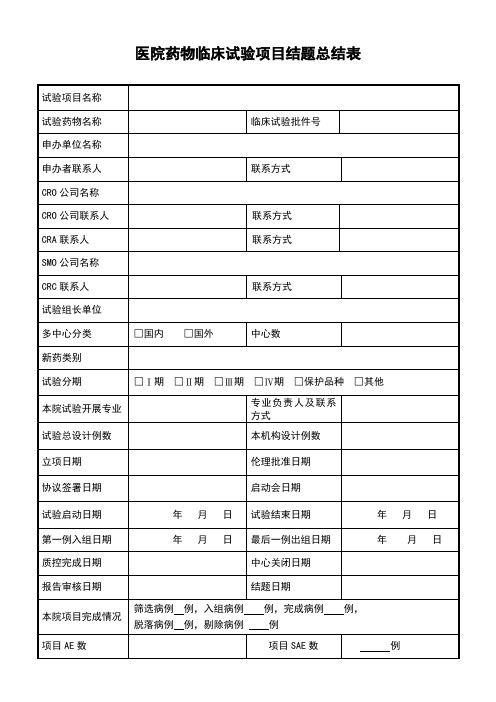
专业负责人及联系方式
试验总设计例数
本机构设计例数
立项日期
伦理批准日期
协议签署日期
启动会日期
试验启动日期
年 月 日
试验结束日期
年 月 日
第一例入组日期
年 月 日
最后一例出组日期
年 月 日
质控完成日期
中心关闭日期
报告审核日期
结题日期
本院项目完成情况
筛选病例例,入组病例例,完成病例例,
脱落病例例,剔除病例例
项目AE数
项目SAE数
例
死亡人数
例
数据核查
□省局(本省/外省) □第三方 □申办方 □机构 □其他
数据核查单位
项目检查情况
稽查情况
生物样本测定单位
备注:申报注册状态 □拟申报注册 □暂缓注册 □放弃注册
医院药物临床试验项目结题总结表
试验项目名称
试验药物名称
临床试验批件号
申办单位名称
申办者联系人
联系方式
CRO公司名称
CRO公司联系人
联系方式
CRA联系人
联系方式
SMO公司名称
CR类
□国内 □国外
中心数
新药类别
试验分期
□Ⅰ期 □Ⅱ期 □Ⅲ期 □Ⅳ期 □保护品种 □其他
邵逸夫医院药物临床试验资料存档交接单

申办单位:(CRO):
承担科室:
项目名称及方案编号:(编号:)
临床试验保存期限:保存年,年月日 —年月日
资料到期后联系人及联系方式一:
资料到期后联系人及联系方式二:
序号
归档材料名称
要求
备注
是否完整
一、文件资料
1.1
立项材料
1.1.1首次通过伦理审查的批件
原件
□是 □否 □不适用
□是 □否 □不适用
1.1.19严重不良事件报告表样本
□是 □否 □不适用
1.1.20设盲试验的破盲规程
□是 □否 □不适用
1.1.21保险条款或相关文件
□是 □否 □不适用
1.1.22中心伦理同意批件复印件
□是 □否 □不适用
1.1.23申办方资质(营业执照,生产许可证,GMP证书)
□是 □否 □不适用
必要时
□是 □否 □不适用
1.3.4其他:
□是 □否 □不适用
1.4
遗传办批件
□是 □否 □不适用
1.5
临床试验合同及补充协议
原件
□是 □否 □不适用
1.6
经授权参与临床试验的医生、护士、药师等研究人员签名的履历和其他资质证明(包含更C备案材料、CRC三方协议
原件
□是 □否 □不适用
2.4.5剩余药物退还给申办方的记录
□是 □否 □不适用
2.4.6试验用药品销毁证明(若在临床试验机构销毁)
2.4.7药物温湿度记录
□是 □否 □不适用
2.4.8其他药物管理记录:
□是 □否 □不适用
2.5
受试者筛选入选表
原件
□是 □否 □不适用
邵逸夫医院临床药学总结

审核、配制化疗药物的注意事项化疗药物有别于其他药物,其特点是毒性大、大多价格昂贵,一旦未发现不合理用药,不但会给病人造成意外的伤害,也会造成很大的经济损失。
为确保化疗药物的用药合理性,作为审方药师必须对每个化疗药物非常了解,如配制每个化疗药物所对应的溶媒、推荐剂量、给药途径、特殊的配制方法、化疗前后其他辅助用药的使用等注意事项,药师只有在充分了解化疗药物的特性后,才能协助临床医生合理使用化疗药物。
现将我院现有的化疗药物的特性及注意事项总结如下。
以下均摘自药物说明书或《药物临床信息参考》美康,仅供参考。
1.吉西他摈(泽菲、健泽):用≤NS250ml化,浓度不得超过40mg/ml,严格静脉给药。
配制好的溶液应贮存在室温并在24h内使用,不得冷藏(15-30℃保存)以防结晶析出。
推荐剂量单药化疗为1000mg/m2, 静滴30分钟,静滴时间延长或增加用药频率可增加药物的毒性。
qw连续3周,4周重复1次。
与顺铂联合治疗:三周疗法可为1250mg/m2,第1,8天给药;四周疗法为1000 mg/m2,第1,8,15天给药。
放疗的同时给予1000mg/m2的吉西他摈可导致严重的肺或食管病变,有报告连续治疗后,在以前放疗过的部位出现严重的皮肤和皮肌炎类型的肌肉病征。
如果要与放射治疗连续给予,间隔至少4周。
2.奥沙利铂(乐沙定、艾恒、奥铂、奥正南):用5%GS250-500ml化,qiw,需输注2-6h。
无需水化,须在5-FU前滴注,用完后需用液体冲洗通道。
不要使用含铝的材料(会降解),不要与盐溶液或任何含氯的盐溶液混合。
配制时应使用注射用水或5%GS。
推荐剂量乐沙定为85 mg/ m2,艾恒、奥正南为130mg/m2。
3.萘达铂(捷伯舒,奥先达):需NS500ml化,不能用PH5以下的酸性输液(如电解质补液、5%GS、GNS)、氨基酸溶液配制。
忌与含铝器皿接触,存放和滴注时应应避免直接日光照射。
滴注时间>1h,滴完后续滴输液1000ml以上。
邵逸夫医院药剂科参观报告

2009年度《药物分析》自主学习总结——邵逸夫医院药剂科参观报告2006级药学专业 汪琼玥组员:金苗苗、朱灵芝、沈莉慧2008年3月10日,我们借着药物分析课自主学习环节,在98级药理硕士毕业生赵老师的指导下参观了邵逸夫医院的药剂科,收获颇丰。
本文将对此行所见所感与所思进行一个整理与回顾。
一、邵逸夫医院药剂科简介邵逸夫医院药剂科始建于1993年医院成立之际,在医院和中美专家的共同努力下,以形成一种新的医院药学服务体系,实现了医院药学工作由传统的药品供应保障型向临床药学和现代科学研究相结合的技术服务型的转变。
目前药剂科员工总数87人,其中主任药师2人,副主任药师8人,主管药师18人,药师28人,药士30人。
除门诊药房、病区药房、配置中心、制剂室等常规工作外,药剂科还开展了多项药学监护服务,包括治疗药物监测,临床药师查房,合理用药咨询、不良反应监测等。
二、参观过程我们一行坐车至红菱新村,步行来到邵逸夫医院。
透过门前的“小桥流水”与来往人群,我们看到了“邵逸夫医院”5个金色楷体大字,刚劲有力,与红色大理石地面交相辉映。
它的两边写着两家合作单位的名字,分别为浙江大学和美国罗马琳达大学。
沿着里面的走道,我们对医院环境进行了简单的了解,面积不大,但是布局紧凑、利用度高;医务工作者们各司其职,整体情况井然有序。
由于离约定时间还有些早,我们便在门诊大厅里稍作休息。
这个环状大厅设计得很有特色,白色的墙壁、红色的柱子,各式的绿色植物沐浴在从头顶射入的阳光中,温暖而又宁静。
开阔的环境,温馨的格调,宁静的氛围都给我们以深刻的印象。
后在赵老师的带领下,我们沿着门诊病房——病区病房——配置中心——药剂室的顺序对药剂科进行了整体参观,并对各个科室的职能进行了解。
门诊药房位于门诊大厅右侧,负责为门诊病人配药发药。
开阔的柜台式设计和上面的电子公告牌都方便了药师和病人及时有效地交换信息。
药房里面柜架林立,药品总类五花八门,这些药品按照功能不同被放置到不同区域,并且和药品库存实行计算机网络化管理。
药物临床试验机构年度工作总结报告模板

药物临床试验机构年度工作总结报告模板
XX (机构名称)
XXXX年度药物临床试验机构年度工作总结报告
一、组织管理体系建设
1.机构基本信息变更
2.备案专业/试验现场的变更情况(变更类别包括新增、取消、变更地址,如为新增和取消,不用填写变更前和变更后情况。
)
3.主要研究者变更情况(变更类型包括新增和取消,说明新增主要研究者参加3个药物临床试验的情况)
上一年度组织培训共—人次(其中组织管理机构工作人员—人次,研究人员—人次,质量管理人员—人次,
药品管理人员—人次,伦理委员—人次,CRC一人次)
三、文件体系变更情况
1.变更情况列表
口无口有变更
如有变更,请填下表:
注:类别包括制度、SOP,填写变更前和变更后的文件名称,如变更前和变更后文件名称相同,可填写版本号
及版本日期以示区别。
2.其他情况说明
5.简述年度审查发现的问题和处理情况
6.其他情况说明
六、接受境内外检查情况
1.接受国内药品监管部门检查情况
口否口是接受国内药品监管部门检查次数:次如接受过国内药品监管部门检查,请填下表:
2.接受境外药品监管部门检查情况
口否口是接受境外药品监管部门检查次数:次如接受过境外药品监管部门检查,请填下表:
七、下一年度计划
简要叙述下一年度将针对药物临床试验机构管理的哪些方面进行加强或改善
注:本表中药物临床试验是指以药品上市注册为目的,按照《中华人民共和国药品管理法》《药品注册管理办法》等有关规定开展的药物临床试验。
附表1
XX (机构名称)
XXXX年度开展的药物临床试验项目情况。
药物临床试验分中心小结中期分析阶段性小结签认表

项目名称
PI
申办方指定人员确认内容签名日期一级质控员
械止至XXXX年XX月XX日的数据申报的分中心小结(或中期分析、阶段性小结)已进行了检查,符合要求
主要研究者
截止至XXXX年XX月XX日的数据申报的分中心小结(或中期分析、阶段性小结)已进行了检查,符合要求
监查员
截止至XXXX年XX月XX日的研究费用已支付
监查员
截止至XXXX年XX月XX日的数据申报的分中心小结(或中期分析、阶段性小结)已进行了检查,符合要求
申办方/CRO
1、截止至XXXX年XX月XX日的研窕费用已支付;
2、研究者承诺将按照试验方案继续对受试者进行治疗和随访;
3、申办方承诺将按照试验方案继续免费提供试验材料和相关检查给受试者。如受试者发生与试验相关损害,将按知情同意书、临床试验合同及相关法律法规的要求进行处理;
4、研究结束后,CRA将协助研究者共同完成试验的结题及文件归档等工作。
(如有其它情况可补充说明)
联系人:CRA姓名、邮箱地址、手机号码
PM姓名、邮箱地址、手机号码
PM签字:
日期:
药物临床试验的分中心小结表
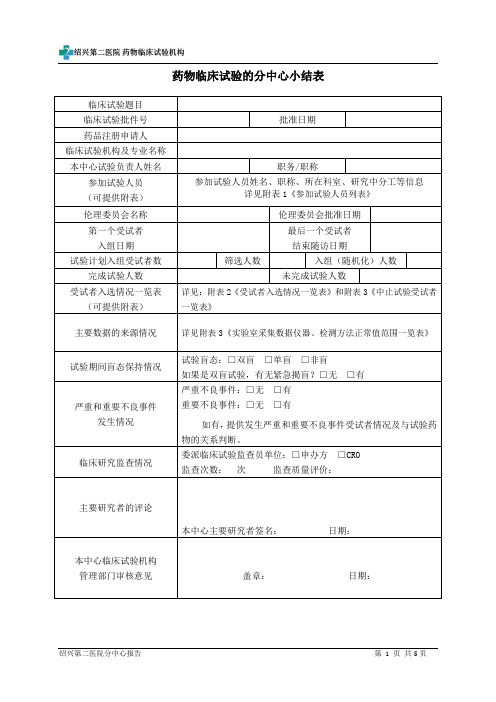
药物临床试验的分中心小结表临床试验题目临床试验批件号批准日期药品注册申请人临床试验机构及专业名称本中心试验负责人姓名职务/职称参加试验人员(可提供附表)参加试验人员姓名、职称、所在科室、研究中分工等信息详见附表1《参加试验人员列表》伦理委员会名称伦理委员会批准日期第一个受试者入组日期最后一个受试者结束随访日期试验计划入组受试者数筛选人数入组(随机化)人数完成试验人数未完成试验人数受试者入选情况一览表(可提供附表)详见:附表2《受试者入选情况一览表》和附表3《中止试验受试者一览表》主要数据的来源情况详见附表3《实验室采集数据仪器、检测方法正常值范围一览表》试验期间盲态保持情况试验盲态:□双盲□单盲□非盲如果是双盲试验,有无紧急揭盲?□无□有严重和重要不良事件发生情况严重不良事件:□无□有重要不良事件:□无□有如有,提供发生严重和重要不良事件受试者情况及与试验药物的关系判断。
临床研究监查情况委派临床试验监查员单位:□申办方□CRO 监查次数:次监查质量评价:主要研究者的评论本中心主要研究者签名:日期:本中心临床试验机构管理部门审核意见盖章:日期:附表1参加试验人员列表姓名职称科室研究中的职务研究中分工附表2受试者入选情况一览表受试者筛选号/姓知情同意日期筛选失败原因入组日期药物编号名缩写附表3中止试验受试者一览表药物编号中止日期中止原因附表4实验室采集数据仪器、检测方法正常值范围一览表检测项目单位正常值范围检测方法采集数据仪器血常规血红蛋白HGB g/L 115-150电阻法全自动五分类血球红细胞RBC ×1012/L 3.8-5.1白细胞WBC ×109/L 3.5-9.5血细胞压积HCT L/L 0.35-0.45血小板计数PLT ×109/L 125-350粒细胞分类数NEU 0.4-0.75尿常规葡萄糖GLUC 阴性试纸分析法全自动尿液分析仪蛋白质PRO 阴性尿白细胞ULEU 个/ul 0-25尿红细胞URBC 个/ul 0-20血生化白蛋白 ALB g/L 40.0-55.0终点法速率法全自动生化分析仪球蛋白 GLOB g/L 20.0-40.0丙氨酸氨基转移酶ALT IU/L 7-40天门冬氨酸氨基转移酶AST IU/L 13-35尿素氮UREA mmol/L 2.6-7.5肌酐CREA µmol/L41-81血糖GLU mmol/L 3.89-6.11钾K mmol/L 3.5-5.3钠 NA mmol/L 137.0-147.0氯 CL mmol/L 99.0-110.0总胆固醇CHO mmol/L 3-5.7甘油三酯TG mmol/L <1.70根据试验具体情况增补修改。
Ⅱ期临床试验病例报告总结计划标准表格样板

XXXXXX临床研究临床批件号试验中心编号药物编号患者姓名缩写XXXXXX(X日用药组)□□□□□□□□XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX临床研究病例报告表(X日用药)受试者姓名缩写□□□□药物编号:□□□试验中心编号:□试验开始日期年月日1XXXXXX临床研究临床批件号试验中心编号药物编号患者姓名缩写XXXXXX(X日用药组)□□□□□□□□填表说明1.请用签字笔填写,字迹应清楚,易于辨别。
2.受试者姓名按汉语拼音首字母缩写靠左对齐填写。
3.在全部选择项目中,请在相应的方框中划“×”;难过强度(PI)和难过缓解度等数字表示项目请在选择的相应数字上画圈“○”。
4.每项填写内容务必正确,不得任意涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容,并注名更正者及日期。
不要用任何方式(橡皮、涂改液等)涂抹原记录。
5.不要改变病例报告表的格式,如发现表中没有地址填写记录者希望记录的资料时,请将相关信息记录于后边的空白附页中,并保留以上记录副本。
6.知情赞成书一般为患者签字。
如患者有特别情况,可由患者法定代理人签名。
2XXXXXX临床研究临床批件号试验中心编号药物编号患者姓名缩写XXXXXX(X日用药组)□□□□□□□□试验观察流程图入组前(天)用药时间(天)停药后(天)项目1234567170-6-1知情×赞成书×入选标准消除标准×病史×体格检查××生×活质量检查实验室×检查×××用药×及记×录××××××生×命体×征××××观察×镇×痛效×果××××××××观×不良反应察×3XXXXXX临床研究临床批件号试验中心编号药物编号患者姓名缩写XXXXXX(X日用药组)□□□□□□□□入组优选表1.受试者应为:是否□□年龄:18-70岁癌症患者(一般情况尚好,可合适放宽)□□性别不限□□预计生计期2个月以上的住院患者□□难过强度为中到重度,评分≥4□□并吻合一下条件之一(请在符合的项目上画圈)1)入选前1周内曾使用XX,日剂量为40-60mg,难过强度可缓解到≤2;2)入选前1周内曾使用其他镇痛药,其整天剂量相当于40-60mgXX剂量,难过强度可缓解到≤2□□非放疗期或难过部位为非照射部位□□间歇期的化疗者,应由主管医生确认化疗后无止痛作用□□该患者可否赞成参加本试验,并已签署知情赞成书如以上任何一个答案为“否”,此受试者不能够参加否2.受试者消除标准:是□□本研究开始前4周内曾参加过其他临床试验□□正在服用或本试验开始前2周内曾服用MAO控制剂者(如优降宁、苯乙肼等)□□小时内用过XX类镇痛药,或5日内用过□□癌痛骨转移患者,近4周内接受同位素内放疗或/和双磷酸盐类药物治疗□□呼吸控制、(肺)气道拥塞或组织缺氧□□胆道疾病□□心脏疾患(即Ⅱ级和Ⅱ级以上心功能)□□血压高于正常值□□血液系统疾病□□肝、肾功能明显异常(即指标高于正常值一倍以上)□□脑部疾病,判断能力异常□□药耐受、过敏,或曾在使用时因不良反应停药□□药物及∕或酒精滥用□□孕妇或哺乳期妇女如以上任何一个答案为“是”,此受试者不能够参加□结论:该患者可否吻合上述要求,赞成入组□医生签字:______日期____年___月___日4XXXXXX临床研究临床批件号试验中心编号药物编号患者姓名缩写XXXXXX(X日用药组)□□□□□□□□病历简况检查日期:年月日.2受试者病历号:出寿辰期:年月.2性别:□1男.□2.女.3临床诊断:分期□□3.M□.4现接受的抗癌治疗:□1放.疗间歇期□2化.疗间歇期□3中.医药□4手.术□5无.□6.其他(请注明).50难过强度:□轻1.(评分)□中2.(评分)□重3.(评分).51难过性质:□1.急性难过□2慢.性连续性难过□3间.歇性(规律或无规律)□4.连续性痛伴一过性加剧□5其.他.52难过主要部位:□1头.面部□2.颈部□3四.肢□4胸.背部□5腹.部□6骨.关节□7.会阴□8其.他(请注明).53疼痛可否自行缓解:□1能.□2有.时能□3不.能.60入选前接受的镇痛治疗:□1无.□2.吗啡、度冷丁、二氢埃托啡、美散痛、芬太尼等一般制剂□3.缓控释吗啡、多瑞吉□4.自控泵□5.可待因及其复方制剂□6.曲马多□7.解热镇痛药□8.其他如有,请回答:.61药品名称用药剂量:.62用药方式:□1口.服□2静.注□3肌.注□4其.他.63用药时间:□1近.四周内□2近.三天□3其.他.64其他与镇痛相关合并用药,如有,请详述:5XXXXXX临床研究临床批件号试验中心编号药物编号患者姓名缩写XXXXXX(X日用药组)□□□□□□□□既往史.1药物过敏史□1无.□2有..2脑部疾患□1无.□2有..3心脏疾患□1无.□2有..4哮喘□1无.□2有..5胆道疾患□1无.□2有..6习惯性便秘□1.无□2有..7肾脏疾患□1无.□2有..8糖尿病□1.无□2有.如有,请描述:1. 2.体格检查.1.℃次/分次/分mmHg mmHg6.身高cm7.体重Kg.2皮肤粘膜□1无.□2苍.白□3.黄染□4紫.绀□5皮.疹.3浅表淋奉迎□1.无肿大□2有.肿大.4双侧瞳孔□1.等大等圆□2.不等大□3.不等圆.50呼吸节律.51肺部罗音□1规.则□2不.规则□1无.□2有..60心律.61心脏各瓣膜区杂音□1齐.□2不.齐□1无.□2.有.70腹部.71腹部压痛□1软.□2硬.□1无.□2有..72腹部包块.73搬动性浊音□1无.□2有..□1无.□2有..74肝区叩痛.75肝脏肿Ⅱ期临床试验病例报告总结计划标准表格样板大□1无. □2有.□1无.□2有..76脾脏肿大.77肾区叩痛□1无.□2有.□1无.□2有..80生理反射□1存.在□2部.分存在□3不.存在.81病理反射□1未.引出□2.有引出6XXXXXX临床研究临床批件号试验中心编号药物编号患者姓名缩写XXXXXX(X日用药组)□□□□□□□□5.入组前可能与镇痛药物相关的基础症状(若是患者出现没有表记的症状,请自行填写文字)症状名称有(入组时)无(入组时)症状出现时间///恶心、呕吐□□年(/月/日)///便秘□□年(/月/日)///排尿困难□□年(/月/日)///嗜睡□□年(/月/日)///眩晕□□年(/月/日)///呼吸困难□□年(/月/日)///胆绞痛□□年(/月/日)///头痛□□年(/月/日)///腹痛□□年(/月/日)///厌食□□(年/月/日)//年/月/日)□□/(//年□/月□/日()///年/月/□□日)///年/月/日)□□/(//□□年(/月/日)///年/月/日)□/□( //年□/月□/日()///年/月/□□日)填表医生签字:______日期____年___月___日7XXXXXX 临床研究 临床批件号 试验中心编号药物编号患者姓名缩写XXXXXX (X 日用药组)□□□□□□□□给药前生活质量记录表表现012345678910食欲很好 极差0睡眠很好 极差一般活动正常 卧床 0精神状态很好 极差 情绪很好 极差0与人交往正常严重搅乱012345678910生活兴趣 正常严重搅乱观察医师签字日期年月日8XXXXXX 临床研究 临床批件号试验中心编号药物编号患者姓名缩写 XXXXXX (X 日用药组) □□□□□□□□入组时实验室检查血老例检查如异常测定项目测定值单位是12是□2否□1 否正常有无临床意义1有□2无□RBC 10/L1是□2否□ Hb g/L1是□2否□1是□2否□9 是□ WBC10/L12否□1是□2否□ PLT910/L1是□2否□尿老例检查如异常测定项目测定值单位可否正常有无临床意义1是□2否□白细胞个/HP(或定性)1是□2否□1是□2否□红细胞个/HP(或定性)1是□2否□1是□2否□蛋白G/L(或定性)1是□2否□血液生化检验如异常测定项目测定值单位可否正常有无临床意义1是□2否□ ALT Iu/L是1□2否□1是□2否□A STIu/L1是□2否□1是□2否□BILμmol/L是□12否□1是□2否□BUN mmol/L1是□2否□1是□2否□Cr μmol/L1是□2否□心电图检查可否正常:是□否□如异常有无临床意义:是□否□异常心电图详细描述:医生签字:______日期____年___月___日9XXXXXX临床研究临床批件号试验中心编号药物编号患者姓名缩写XXXXXX(X日用药组)□□□□□□□□入组时检验报告粘贴单10XXXXXX临床研究临床批件号试验中心编号药物编号患者姓名缩写XXXXXX(X日用药组)□□□□□□□□用药情况记录表用药天数用药次数用药时间(24小时制)用药剂量(支)医生签字备注D1D2D3D4D5D 6711XXXXXX临床研究临床批件号试验中心编号药物编号患者姓名缩写XXXXXX(X日用药组)□□□□□□□□镇痛收效记录表1难过缓解度难过强度用记01234突发性难过用观药录未轻中明完无剧察2节气缓度度显全药纪录痛痛者数间解慢慢慢慢轻中重解解解解8:00(用药前)012345678910用药后1h01234567891001234D 14h012345678910012348h01234567891001 23412h012345678910012348:00(用药前)01 2345678910用药后1h01234567891001234D24h012345678910012348h0123456789100123412h012345678910012348:0(用药前)012345678910用药后1h01234567891001234D34h012345678910012348h0123456789100123412h012345678910012348:0(用药前)012345678910用药后1h01234567891001234D44h012345678910012348h0 12345678910123412h0123456789100123401234012456789108:0020013D5:003 23013401234567891 08:00D620:00012340123456789100 2348:00D720:00012 4012345678910说明度:未缓解(难过未减少);度:轻度缓解(难过减少约1/4);2度:中度缓解(难过减少约1/2);3度:明显缓解(难过减少约3/4以上);4度:完满缓解(难过消失)。
临床试验结果总结

临床试验结果总结一、背景介绍临床试验是指将新的药物、治疗方法或诊断工具应用到病人身上,通过对试验结果的观察和分析,评估其疗效、安全性和可行性。
临床试验结果的总结是对试验的数据和分析结果进行综合梳理,得出客观、准确的结论。
本文将对XXX药物的临床试验结果进行总结。
二、试验设计与方法XXX药物的临床试验采用了随机对照双盲的方法,共选取了XXX名患者作为研究对象。
其中,一组接受XXX药物治疗,另一组接受安慰剂治疗作为对照。
试验过程中,严格按照XXX药物的使用说明进行给药,并定期记录患者的症状、体征等指标。
通过统计学方法对试验数据进行分析,评估XXX药物的疗效和安全性。
三、临床试验结果1. 疗效评估根据试验数据分析结果显示,XXX药物在治疗XXX疾病方面表现出显著的疗效。
与对照组相比,治疗组的患者在症状缓解、体征改善等方面有明显的优势。
治疗组的患者疾病进展缓慢,生存期显著延长。
这些结果表明XXX药物能够有效改善XXX疾病的症状和预后,对患者的生活质量有明显改善。
2. 安全性评估在临床试验过程中,参试者服用XXX药物后出现的不良反应进行了记录和分析。
结果显示,XXX药物的不良反应较轻,多为轻微过敏反应、胃肠道不适等症状。
与对照组相比,治疗组的不良反应发生率低,并且均可通过适当的处理和用药调整得到缓解。
因此,综合评估XXX药物的安全性,认为其在规定剂量和使用方法下是安全可靠的。
3. 适应症范围评估临床试验结果还显示,XXX药物在治疗XXX疾病的适应症范围方面存在一定差异。
试验数据表明,在早期疾病阶段,XXX药物的疗效明显优于对照组。
但在晚期疾病阶段,其疗效差异不明显。
这些结果提示,对于XXX疾病的早期治疗,XXX药物可能更为有效,但对于晚期病例,应综合考虑其他治疗方案。
四、结论与展望综合以上试验结果,可以得出以下结论:1. XXX药物在治疗XXX疾病方面具有显著的疗效,能够改善患者的症状和生活质量。
2. XXX药物的安全性较高,在规定剂量下可安全使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
邵逸夫医院专业药物临床试验总结表
项目名称:
方案编号:
CFDA临床试验批件号:批准日期:
申办方: CRO:
试验药名:药品类别:
参加项目研究者:
试验启动日期:年月日第一例受试者入组日期:年月日试验结束日期:年月日最后一例受试者出组日期:年月日合同签订入组人数例,筛选人数例,入组人数例,完成例数例,
脱落例,剔除例,严重不良事件例,不良事件例
小结:主要数据来源情况
主要研究者(PI)签名:负责项目协调研究者签名:
监查员签名:临床试验机构办公室审核签名:
监查员联系方式:
临床试验机构负责人签名:
日期:年月日
附表::
受试者情况登记表
项目名称
方案编号专业组(科室)主要研究者
受试者筛选号
受试者
姓名缩写
受试者
病历号
受试者
身份证号码
签署第一
份ICF日期
受试者
筛选日期
是否
入选
筛选失败
原因
入组
日期
受试者
入组随机号
是否完
成试验
SAE
例数
退出试验
日期及原因
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
受试者筛选号
受试者
姓名缩写
受试者
病历号
受试者
身份证号码
签署第一
份ICF日期
受试者
筛选日期
是否
入选
筛选失败
原因
入组
日期
受试者
入组随机号
是否完
成试验
SAE
例数
退出试验
日期及原因
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
□是
□否
注:与实际情况不符处,请填“不适用”
PI签字:日期:。
