矿泉水中氯离子,氟离子含量测定
氯离子的检验

赤峰学院本科生论文题目:生活用水中氯离子的检验姓名:李久鹏学号:专业:建筑环境与能源应用工程摘要:生活用水常用氯化物做除污剂,生活用水出厂时必须对氯离子浓度做检验,过高的氯离子浓度的生活用水会影响水质引发疾病。
关键词:氯离子;水质影响;检测方法。
1 概述氯化物是水和废水中一种常见的无机阴离子。
几乎所有天然水中都有氯离子存在,它的含量范围变化很大。
在河流、湖泊、沼泽地区,氯离子含量一般较低,而在海水、盐湖及某些地下水中,含量可高达数十克/L。
在人类的生存活动中,氯化物有很重要的生理作用及工业用途。
正因为如此,在生活污水和工业废水中,均含有相当数量的氯离子。
若饮水中氯离子含量达到250mg/L,相应的阳离子为钠时,会感觉到咸味;水中氯化物含量高时,会损害金属管道和建筑物,并妨碍植物的生长。
附表1:氯离子水质标准2 方法选择测定氯化物的方法较多,其中:离子色谱法是目前国内外最通用的方法,简便快捷。
硝酸银滴定法、硝酸汞滴定法所需仪器设备简单适合于清洁水测定,但硝酸汞滴定法适用的汞盐剧毒,因此这里不做推荐。
电位滴定法和电极流动法适合于测定带色或污染水样,在污染源监测中使用较多。
同时把电极法改为流通池测量,可保证电极的持久使用,并能提高测量精度。
(一)离子色谱法(1)方法原理本法利用离子交换的原理,连续对多种阴离子进行定性和定量分析。
水样注入碳酸盐-碳酸氢盐溶液并流经系列的离子交换树脂,基于待测阴离子对低容量强碱性阴离子树脂(分离柱)的相对亲和力不同而彼此分开。
被分开的阴离子,在流经强酸性阳离子树脂(抑制柱)室,被转换为高电导的酸型,碳酸盐-碳酸氢盐则转变成弱电导的碳酸(消除背景电导)。
用电导检测器测量转变为相应酸型的阴离子,与标准进行比较,根据保留时间定性,峰高或峰面积定量。
一次金阳可连续测定六种无机阴离子(-F 、-Cl 、-2NO 、-3NO 、-24HPO 和-24SO )(2)干扰及消除当水的负峰干扰F -或Cl -的测定时,可用于100ml 水样中加入1ml 淋洗贮备液来消除负峰的干扰。
b二、任务3:饮用水氟离子含量的测定

非晶体膜电极(crystalline membrane electrodes)
刚性基质电极(rigid matrix electrodes) 流动载体电极(electrodes with a mobile carrier) 敏化电极(sensitized electrodes) 气敏电极(gas sensing electrodes) 酶电极(enzyme electrodes)
定量方法
标准曲线法 以所测得电动势E为纵坐标,浓度c的负对数-lgcF-为横坐标,绘制 标准曲线;根据待测溶液的电池电动势,查得其浓度值。
定量方法
标准加入法 在一定实验条件下,先测定体积为Vx,浓度为Cx的试液电池的
电动势Ex,然后在其中加入浓度为cs,体积为Vs的含待测离子
的标准溶液(要求:Vs约为试液体积的,而cs则为cx的100倍左 右)在同一实验条件下再测其电池的电动势Ex+s,则25℃时
配制方法
1mol/L的NaCl,使溶液保持基本稳定的离子强度 0.25mol/L的HAc和0.75mol/L的NaAc, 使溶液pH保持 在5左右 0.001mol/L的柠檬酸钠,掩蔽Fe3+、Al3+等干扰离子 其它影响因素 温度、电动势的测量、溶液酸度、干扰离子、溶液的浓度
和迟滞效应。
RT E E ln ai zF
3、离子选择电极的特性
(1)膜电位及其选择性
E膜 K RT ln a阳离子 zF
RT E膜 K ln a阴离子 zF
共存的其它离子对膜电位产生有贡献吗? 若测定离子为i,电荷为zi ;干扰离子为j ,电荷为zj
离子色谱法测定氯离子、氟离子、溴离子、硝酸根和硫酸根

离子色谱法测定氯离子、氟离子、溴离子、硝酸根和硫酸根1. 适用范围本方法适用于地下水中氯离子,氟离子,溴离子,硝酸根和硫酸根的测定。
进样100μL时,本方法的最低检测浓度为:Cl-0.1mol/L,SO42-0.2mol/L,NO3-0.02 mol/L,F-0.006mol/L,Br-0.03mol/L。
检测上限为:Cl-12.0mg/L,SO42-12.0 mg/L,NO3-10.0 mg/L,F-1.0 mg/L,Br-1.6 mg/L。
2. 原理水样注入仪器后,在淋洗液的携带下,流经填充了低容量阴离子交换树脂的分离柱。
由于待测离子的离子半径大小,电荷多少和其它性质的不同,它们对阴离子交换树脂的亲合力各异,故在淋洗液和交换树脂之间的分配系数也不相同。
在分离柱中,经过多次洗脱与交换后,按F-,Cl-,Br-,NO3-,SO42-的顺序依次被分离开来,然后流过阴离子抑制柱以降低溶液的背景电导,最后通过电导检测器,依次对它们进行测量。
从同样条件下绘制的标准曲线上,即可求出水样中F-,Cl-,Br-,NO3-,SO42-的含量。
3. 试剂除非另有说明,本方法所用试剂均为分析纯,水为电导率<1μs/cm的重蒸馏水或去离子水。
3.1 淋洗液:称取2.5203g碳酸氢钠(NaHCO3)溶于适量水中,另称取2.6498 g无水碳酸钠(Na2CO3)溶于适量水中,将上述两种溶液倒入10L塑料桶中(事先在10L 处作好标记),以重蒸馏水冲稀至标线。
注:增加淋洗液的浓度,能缩短各离子的保留时间,但对每种离子的影响程度不同。
保留时间长的SO42-,缩短时间的幅度较大;而保留时间短的F-,缩短的幅度就比较小,增加淋洗液的流量,也会产生上述情况,但变化程度较小。
因此,通过改变淋洗液的浓度和流量,可以改变色谱图形,从而选择灵敏度高,分辨率好,速度快的最佳分析条件。
但应注意不同的柱子对淋洗液的组成和浓度有不同的要求。
水中氟离子含量测定
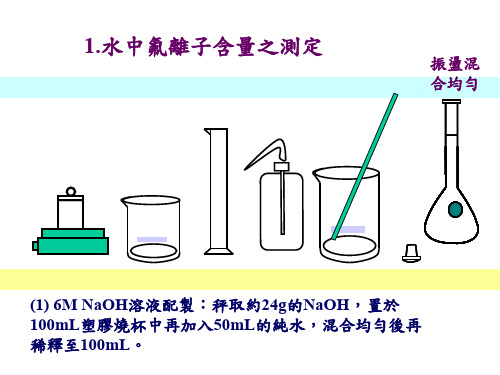
振盪混 合均勻
(1) 6M NaOH溶液配製:秤取約24g的NaOH,置於 100mL塑膠燒杯中再加入50mL的純水,混合均勻後再 稀釋至100mL。
2.水中氟離子含量之測定
NaOH
冰
醋
酸
NaCl
0,2,4,5,6
7,8,9,10,12,14
(2) 離子強度調整溶液(TISAB):於500mL燒杯中依 次將28.5mL冰醋酸, 29g氯化鈉, 2g Titriplex IV 加入 250mL純水混合均勻,再以6M之NaOH溶液調整pH值 至5.0與5.5間,最後以純水稀釋至500mL
3.水中氟離子含量之測定
B.氟離子儲備溶液
500mL
粗秤-精秤 (3)精秤乾燥後的NaF約0.11g,置於250mL燒杯中加入約 100mL純水溶解之,再移入500mL量瓶中加純水稀釋至刻 線。計算此儲備溶液之濃度。
4.水中氟離子含量之測定
C:檢量ห้องสมุดไป่ตู้線之製作
5.0
10
25
50
(4)將25mL的氟離子儲備溶液稀釋至250mL。將此溶液分 別取出5mL、10mL、25mL、50mL分別置於100mL量瓶 中,加入50mL的TISAB,再加純水稀釋至刻度,倒入 150mL燒杯中。
5.水中氟離子含量之測定
C:檢量曲線之製作
7 ﹒2 0
(5)固態氟離子電極經潤濕並以拭鏡紙拭乾後,放入上述 溶液中攪拌,並測定其電位,至穩定。以最小平方法計算 濃度對數與電位之關係及相關係數。
6.水中氟離子含量之測定
C:檢量曲線之製作
7﹒2 0
(6)取未知濃度試樣溶液50mL置於100mL量瓶 中,加入50mL之TISAB後,以固態氟離子電極 測定其電位並由前述之檢量曲線換算得到濃度。
生活饮用水中氟离子含量的测定

生活饮用水中氟离子含量的测定龚建康;唐永龙;叶坪;张正彪【摘要】为获取昭通市昭阳区生活饮用水中氟离子含量的科学数据和检测氟离子含量是否在国家规定标准要求内,通过氟离子选择电极法对昭通市昭阳区八个地方的生活饮用水中氟离子含量进行了测定,测得各水样的pH值在6.66~7.63之间,氟离子含量在0.0551~0.1512 mg/L之间,且氟含量都符合国家标准值(0.05~1.0 mg/L).所测定的氟离子加标回收率范围在93%~97%,RSD在0.15%~1.18%之间,说明本实验所采取的方法便捷有效,氟离子选择电极法测定准确,可靠.【期刊名称】《广州化工》【年(卷),期】2019(047)007【总页数】3页(P105-107)【关键词】生活饮用水;氟离子含量;氟离子选择电极法【作者】龚建康;唐永龙;叶坪;张正彪【作者单位】昭通学院化学化工学院, 云南昭通 657000;昭通学院化学化工学院, 云南昭通 657000;昭通学院化学化工学院, 云南昭通 657000;昭通学院化学化工学院, 云南昭通 657000【正文语种】中文【中图分类】O69氟是人类和动物体内所必须一种微量无机元素,特别是人体对氟的吸收获取最为重要。
人体中的氟大部分来自于饮用水。
氟对人体而言不仅对牙齿的形成具有重要的作用,而且还有利于骨骼的形成。
适量的氟对人体大有裨益,能够预防龋齿的发生[1]。
但是,人类长期的饮用超标含氟水,人体容易患氟斑牙和氟骨症和表现出慢性“氟中毒”的症状,严重者甚至会威胁到人类的生命安全[2]。
由于人体内的氟主要来自于饮用水,饮用水中对人体有利的氟含量为0.5~1.0 mg/L(我国的标准)。
曾经有报道,昭通市是著名的“燃煤污染型”地方型污染地区[3],其中地方病“氟中毒”比较严重[4],因此,获取昭通市生活饮用水中氟离子含量的科学数据,对于地方氟中毒的预防具有非常重要的现实意义。
目前,氟离子的测定方法主要有氟离子选择电极法,茜素磺酸锆目视法,分光光度法,离子色谱法等[5-7]。
氯离子检测方法

氯离⼦检测⽅法氯离⼦测定⽅法⼩结1、摩尔法测定范围适⽤于天然⽯、循环冷却⽔、以软化⽔为补给⽔的锅炉炉⽔中氯离⼦含量的测定测定范围为5mg/L~150mg/L。
测定原理以铬酸钾为指⽰剂在pH为5~9.5的范围内⽤硝酸银标准滴定溶液滴定。
硝酸银与氯化物作⽤⽣成⽩⾊氯化银沉淀当有过量硝酸银存在时则与铬酸钾指⽰剂反应⽣成砖红⾊铬酸银表⽰反应达到终点。
⽅法来源GB/T15453-2008⼯业循环冷却⽔和锅炉⽤⽔中氯离⼦的测定摩尔法注意事项测定终点因⼈⽽异误差较⼤。
2、电位滴定法测定范围适⽤于天然⽯、循环冷却⽔、以软化⽔为补给⽔的锅炉炉⽔中氯离⼦含量的测定测定范围为5mg/L~150mg/L。
测定原理以双液型饱和⽢汞电极为参⽐电极以银电极为指⽰电极⽤硝酸银标准滴定溶液滴定⾄出现电位突跃点即理论终点即可从消耗的硝酸银标准滴定溶液的体积算出氯离⼦含量。
⽅法来源GB/T15453-2008⼯业循环冷却⽔和锅炉⽤⽔中氯离⼦的测定电位滴定法注意事项需要额外配备电磁搅拌器、电位滴定计、双液型饱和⽢汞电极、银电极。
溴、碘、硫等离⼦存在⼲扰。
3、共沉淀富集分光光度法测定范围适⽤于除盐⽔、锅炉给⽔中氯离⼦含量的测定测定范围为10µg/L~100µg/L。
测定原理基于磷酸铅沉淀做载体共沉淀富集痕量氯化物经⾼速离⼼机分离后以硝酸铁-⾼氯酸溶液完全溶解沉淀加硫氰酸汞-甲醇溶液显⾊⽤分光光度法间接测定⽔中痕量氯化物。
⽅法来源GB/T15453-2008⼯业循环冷却⽔和锅炉⽤⽔中氯离⼦的测定共沉淀富集分光光度法注意事项需要额外配备分光光度计460nm波长、30mm吸收池、⾼速离⼼机转速5000r/min配有250mL聚⼄烯离⼼管。
4、汞盐滴定法测定范围适⽤于天然⽔、锅炉⽔、冷却⽔中氯离⼦含量的测定测定范围为1mg/L~100mg/L超过100mg/L时可适当地减少取样体积稀释⾄100mL后测定。
测定原理在pH2.3~2.8的⽔溶液中氯离⼦与汞离⼦反应⽣成微解离的氯化汞。
离子色谱法对生活饮用水中氟、氯、硫酸根、硝酸根阴离子的测定

82
常规检测法(mg/ L) 0 .2 0 1 .0 0 0 .5 0 5 .0 0
图 1 色谱图
3 结果与讨论
3.1 色谱 图
在 上 述 仪器 条 件 下 , 得 到 的 色 谱图 , 出峰 顺 序
依 次为 1 氟离子 、2 氯离 子、5 硝 酸根 、7 硫酸 根。达
到 较好 的分 离效果 , 满足 分析 的要 求。
1 前言
2 实验部分
测 定生 活 饮 用 水中 氟 、氯、硫 酸 根 、硝 酸 根 阴 离 子目 的 是 掌 握水 中 氟 化物 、氯化 物 硫 酸 盐 、硝 酸 盐 。 氟化 物在 自然 界 广泛 存在 , 适量 的氟 被认 为 是对 人 体 有益 的 元 素, 摄 入量 过 多 对人 体 有 害 , 可致 急 、慢 性中 毒 ( 慢 性中 毒主 要表 现 为氟 斑牙 和氟 骨 症) ; 饮 用水 中氯 化物 浓 度过 高, 可使 水产 生 咸味 , 并 对配 水 系统 具有 腐蚀 作 用; 对 硫 酸盐 含量 过 高的 水, 新来 的 人和 偶然 使 用者 通常 出现 轻 泻作 用, 但短 时 间后 可 逐渐 适应 , 对 多数 饮用 者 来说 , 当 饮用 水中 硫 酸盐 浓 度 为 300mg/L~400mg/L 时 , 开 始 察 觉 水 有 味 ; 硝 酸 盐在 水中 经 常被 检出 , 含 量 过高 可引 起人 工 喂养 婴 儿的 变性 血 红蛋 白血 症, 虽 然对 较年 长人 群 无此 问 题, 但 有人 认 为某 些癌 症( 膀胱 癌 、卵 巢癌 、非 霍奇 金 淋巴 癌等) 可能 与较 高浓 度的 硝酸 盐含 量有 关。因 此 《 生活 饮用 水 卫生 标准》GB5749- 2006 规定 饮 用水 中 氟 化物 ≤1.0 mg/L、 氯 化 物≤250 mg/L、 硫 酸 盐≤ 250mg/L、硝 酸盐( 以 N 计) ≤10mg/L。
离子色谱法测定水中氟和氯

广东化工2018年第18期·176 · 第45卷总第380期离子色谱法测定水中氟和氯周游,叶蔓莉(贵州省产品质量监督检验院,贵州贵阳550014)[摘要]本文采用离子色谱法测定水中氟离子和氯离子的含量。
水样经直径0.2 μm水系滤膜过滤,上离子色谱仪测定氟离子和氯离子,经AG19保护柱及AS19分离柱分离,以20.00 mmol·L-1氢氧化钾溶液为淋洗液,采用连续自动再生化学抑制器检测。
F-和Cl-的质量浓度在0.1~1.5 mg/L范围内与峰面积呈线性关系,Cl-的质量浓度在0.15~2.5 mg/L范围内与峰面积呈线性关系,线性相关系数在0.9992~0.9994,氟离子与氯离子的相对标准偏差(RSD)为0.15 %~0.17 %,方法回收率为98.3 %~104.3 %,满足分析要求。
[关键词]离子色谱法;复肥;氟;氯[中图分类号]O65 [文献标识码]A [文章编号]1007-1865(2018)18-0176-01Determination of Fluoride and Chloride in Complex Fertilizer by IonChromatographyZhou You, Ye Manli(Institution of Supervision and Inspection Product Quality of Guizhou Province, Guiyang 550014, China) Abstract: The content of fluoride and chloride ions in composite fertilizer was determined by ion chromatography. Water was taked the supernatant by 0.22 microns in diameter drainage membrane filter, ion chromatograph on determination of fluorine ion and chloride ion, through AS19 separation column separation and AG19 protect column, tendency, at 20.00 L-1 as the eluent, potassium hydroxide solution by continuous automatic regeneration chemical suppressor detection. F - concentration within 0.1~1.5 mg/L has a linear relation with the peak area, Cl - concentration within 0.15~2.5 mg/L has a linear relation with the peak area, the linear correlation coefficient is 0.9992~0.9994, fluorine ion and chloride ion of relative standard deviation (RSD) is 0.15 %~0.17 %, the method of recovery is 98.3 % ~ 104.3 %, and satisfies the requirement of analysis.Keywords: Ion chromatography;Compound fertilizers. Fluoride;Chlorine目前国家标准GB/T 5750.5-2006[1]中氯离子的测定是硝酸银容量法、离子色谱法和硝酸汞容量法,氟离子的测定是离子选择性电极法、离子色谱法、氟试剂分光光度法、双波长系数倍率氟试剂分光光度法和锆盐茜素比色法,两种离子单独测定操作步骤繁琐,耗时长,因此,选择离子色谱法同时、快速、准确的测定水中氟离子、氯离子含量,离子色谱法具有操作简便、灵敏度和分离度高、检出限低等优点,在分析测试样品中,离子色谱法已广泛应用于各个行业[2-5],本文应用离子色谱法同时测定水中氟离子与氯离子,满足分析要求。
饮用水中氟化物测定

【实验名称】饮用水中氟化物测定
【实验目的】
1.饮用水中氟化物测定
【实验原理】
1.氟电极与饱和甘汞电极组成一对电化学电池。
利用电动势(E)与氟离子活度(a)对数值
的线性关系,直接求出水样中氟离子浓度。
【实验步骤】
1.标准曲线的制备
2.标准曲线(standard curve)的绘制---半对数坐标纸
3.水样测定:自来水、纯净水(蒸馏水)、矿泉水、茶叶水
吸取10ml水样于50ml干燥的小烧杯中,加入10ml离子强度缓冲液,测定E,于标准曲线上查其含氟量.
【实验结果】
【实验分析】
1.水中含氟量为(我国饮用水水质标准规定:氟化物不允许大于1mg/L)
2.离子选择电极误差电极老化及电极绝缘性能不良或静电感应对膜电位的影响,以及干
扰离子及离子强度变化影响膜电位的数值。
3.参比电极误差主要来自参比电极电位漂移,温度波动引起的误差。
4.电极电位仪的误差主要来自输入阻抗,输入电流,电子元器件的质量以及这些元器件
随温度变化和电磁干扰等引起的漂移。
5.标准溶液误差来自配置过程中的试剂、天平、容量器皿或试剂放置过久储存不当等。
6.操作误差包括电极的洗涤和预处理,电极校正的方法或使用不当,搅拌速率过快,平
衡电位的读数不准,数据记录作图与计算上的不当以及取样和预处理等(标曲配制、实验污染、起始电压、电极深度、温度、搅拌速率)。
饮用天然矿泉水氯化物测定(精)

饮用天然矿泉水氯化物测定GB/T 8538─19951. 硝酸银滴定法1.1 测定范围一般矿泉水中氯离子含量在2~100mg/L之间,本方法适用。
溴化物及碘化物均能起相同反应,但其在矿泉水中一般含量较低。
硫化物,亚硫酸盐,硫代硫酸盐及超过15mg/L耗氧量可干扰测定。
硫化物等可用过氧化氢氧化除去干扰。
耗氧量较高的水样可用高锰酸钾氧化或蒸干灰化等方法处理。
1.2 方法提要:硝酸银与氯化物作用生成氯化银沉淀,当有多余的硝酸银存在时,则与铬酸钾指示剂反应,生成红色铬酸银沉淀,指示反应达到终点。
1.3 试剂1.3.1 铬酸钾溶液(50g/L):称取5g铬酸钾(K2CrO4)溶于少量纯水中,加入硝酸银溶液至红色不褪,混匀,放置过夜,过滤。
将过滤液用纯水稀释至100mL。
此溶液质量浓度为50g/L。
1.3.2 氢氧化铝悬浮液:称取12.5g硫酸铝钾〔KAl(SO4)2·12H2O)〕或硫酸铝铵〔NH4Al(SO4)2·12H2O〕,溶于1000mL纯水中,加热至60℃,慢慢加入55mL浓氨水,使成氢氧化铝沉淀。
充分搅拌后静置,弃去上层清液。
反复用纯水洗涤沉淀,至倾出液无氯化物离子(用硝酸银检定)为止。
最后加入300mL纯水成悬浮液。
使用前振荡摇匀。
1.3.3 酚酞指示剂:称取0.5g酚酞(C20H14O4)溶于50mL95%乙醇中,加入50mL纯水,再滴加0.05mol/L氢氧化钠溶液,使溶液呈微红色。
1.3.4 硫酸溶液(0.025mol/L):吸取1.4mL浓硫酸加放纯水中,并稀释至1000mL 1.3.5 氢氧化钠溶液〔c(NaOH)=0.05mol/L):称取0.2g氢氧化钠,溶于纯水中,并稀释至100mL。
1.3.6 过氧化氢(p(H2O2)=30%)。
1.3.7 硝酸银标准溶液:称取2.4g硝酸银(AgNO3),溶于纯水中,并定容至000mL,按1.3.7.1至1.3.7.2 方法标定其准确浓度。
HJ84-2016《水质无机阴离子(F-、Cl-、SO42-)的测定离子色

HJ842016《水质无机阴离子(F、Cl、SO42)的测定离子色谱法》操作指南一、概述HJ842016《水质无机阴离子(F、Cl、SO42)的测定离子色谱法》是一种用于检测水质中无机阴离子(氟离子、氯离子和硫酸根离子)含量的方法。
本指南将为您详细介绍该方法的具体操作步骤、注意事项及数据处理,帮助您更好地掌握和应用此技术。
二、实验原理离子色谱法是通过离子交换原理,将水样中的无机阴离子分离出来,并通过检测器进行定量分析。
该方法具有操作简便、灵敏度高、准确度好等特点。
在本方法中,我们采用离子色谱仪,以氢氧根离子为淋洗液,实现对F、Cl、SO42的分离和检测。
三、实验仪器与试剂1. 实验仪器:离子色谱仪、阴离子交换柱、超纯水系统、真空抽滤装置、注射器等。
2. 试剂:氢氧化钠(分析纯)、氟离子标准溶液、氯离子标准溶液、硫酸根离子标准溶液、去离子水等。
四、实验步骤1. 样品前处理:取适量水样,经0.45μm微孔滤膜过滤,去除悬浮物和颗粒物。
2. 色谱条件设置:根据仪器说明书,设置合适的淋洗液浓度、流速、检测器温度等参数。
3. 标准曲线制备:分别配制不同浓度的F、Cl、SO42标准溶液,依次进样,绘制标准曲线。
4. 样品测定:将处理后的水样注入离子色谱仪,记录各无机阴离子的峰面积,根据标准曲线计算其浓度。
5. 结果计算:根据样品中各无机阴离子的浓度,计算其在水样中的含量。
五、注意事项1. 实验过程中,确保试剂和样品纯净,避免交叉污染。
2. 色谱柱使用前后,需进行充分冲洗,防止柱效降低。
3. 定期检查仪器性能,确保检测结果的准确性。
4. 实验操作人员需具备一定的专业技能,严格按照操作规程进行实验。
六、数据分析与质量控制1. 数据分析:在完成样品测定后,应对数据进行仔细分析。
检查色谱峰的形状、分离度是否良好,确保定量分析的准确性。
若出现异常峰,需排查原因,必要时重新进样分析。
每批样品测定时,同时测定标准曲线中间浓度点的标准溶液,以监控仪器的稳定性。
氯离子的检验

学院本科生论文题目:生活用水中氯离子的检验:久鹏学号:专业:建筑环境与能源应用工程摘要:生活用水常用氯化物做除污剂,生活用水出厂时必须对氯离子浓度做检验,过高的氯离子浓度的生活用水会影响水质引发疾病。
关键词:氯离子;水质影响;检测方法。
1 概述氯化物是水和废水中一种常见的无机阴离子。
几乎所有天然水中都有氯离子存在,它的含量围变化很大。
在河流、湖泊、沼泽地区,氯离子含量一般较低,而在海水、盐湖及某些地下水中,含量可高达数十克/L。
在人类的生存活动中,氯化物有很重要的生理作用及工业用途。
正因为如此,在生活污水和工业废水中,均含有相当数量的氯离子。
若饮水中氯离子含量达到250mg/L,相应的阳离子为钠时,会感觉到咸味;水中氯化物含量高时,会损害金属管道和建筑物,并妨碍植物的生长。
附表1:氯离子水质标准2 方法选择测定氯化物的方法较多,其中:离子色谱法是目前国外最通用的方法,简便快捷。
硝酸银滴定法、硝酸汞滴定法所需仪器设备简单适合于清洁水测定,但硝酸汞滴定法适用的汞盐剧毒,因此这里不做推荐。
电位滴定法和电极流动法适合于测定带色或污染水样,在污染源监测中使用较多。
同时把电极法改为流通池测量,可保证电极的持久使用,并能提高测量精度。
(一)离子色谱法(1)方法原理本法利用离子交换的原理,连续对多种阴离子进行定性和定量分析。
水样注入碳酸盐-碳酸氢盐溶液并流经系列的离子交换树脂,基于待测阴离子对低容量强碱性阴离子树脂(分离柱)的相对亲和力不同而彼此分开。
被分开的阴离子,在流经强酸性阳离子树脂(抑制柱)室,被转换为高电导的酸型,碳酸盐-碳酸氢盐则转变成弱电导的碳酸(消除背景电导)。
用电导检测器测量转变为相应酸型的阴离子,与标准进行比较,根据保留时间定性,峰高或峰面积定量。
一次可连续测定六种无机阴离子(-F 、-Cl 、-2NO 、-3NO 、-24HPO 和-24SO )(2)干扰及消除当水的负峰干扰F -或Cl -的测定时,可用于100ml 水样中加入1ml 淋洗贮备液来消除负峰的干扰。
实验44 离子选择性电极法测定饮用水中氟的含量

化学电池,测定其电动势,绘制E~ pF曲线;
( 2 ) 在相同条件下,测定由试样溶液和电极组成电池的
电动势 Ex ,并从标准曲线上查出对应的 pFx, 求出待 测离子浓度。
标准曲线法的特点
适用:可测范围广,适合批量样品分析
优点:即使电极响应不完全服从Nernst方程,也 可得到满意结果 要求:标准溶液的组成与试液组成相近,离子强 度一致,活度系数相同, 温度相同
B)电动势的测定 将标准溶液分别倒入塑料烧杯中,放入搅拌磁子, 插入洗净的两支电极,待读数不变稳定2min后记录电动 势的值。按照浓度由低到高的顺序逐次测定,每测量一 份溶液,无需清洗电极,只需用滤纸沾去电极上的水珠 即可, 分别用E6、E5、E4、E3、E2表示。
将处理好的试样溶液倒入塑料烧杯中,放入搅拌磁 子,插入洗净的两支电极,待读数不变稳定2min后记录 电动势Ex。
3 用一次标准溶液加入法进行测定
在干燥的烧杯中分别加入样品25.00mL、 TISAB5.00mL、二次水20.00mL,搅拌均匀,放入搅 拌磁子,插入洗净的两支电极,待读数不变稳定2min 后记录电动势的值。再向此烧杯中准确加入1.00mL pF=1.00的NaF标准溶液,搅拌均匀,再次记录电动势 的值。两次差值用△E表示。
四、数据处理
标准曲线法:
绘制E~pF曲线,查出pFx, 则 pF= pFx-1,求出F-的浓度。 一次标准溶液加入法:
Cx= CsVs Vx+Vs (10△E/S-1)-1 (mol/L)
五、思考题
1.氟离子选择电极在使用时应注意哪些问题?
答:氟离子选择电极在使用前,应在含10-4 mol.L-1 F-或更低浓度的 F-溶液中浸泡(活化)约30 min。使用时,先用去离子水吹洗电极, 再在去离子水中洗至电极的纯水电位(空白电位)。其方法是将电 极浸入去离子水中,在离子计上测量其电位,然后,更换去离子水, 观察其电位变化,如此反复进行处理,直至其电位稳定并达到它的 纯水电位为止。氟离子选择性电极的纯水电位与电极组成(LaF3单 晶的质量,内参比溶液的组成)有关,也与所用纯水的质量有关, 一般为-300 mV左右。氟离子选择电极若暂不使用,宜于干放。 在使用时,一定要注意把溶液的pH控制在5~6之间。因为氟离子 选择性电极有较好的选择性,主要干扰离子是OH-。
离子电极法测定饮用水中氟的含量

测定饮用水中氟的含量吕培银(四川农业大学理学院,四川雅安625000)摘要:本实验为离子电极法测定饮用水中氟的含量,实验目的是掌握电位法的基本原理;学会使用离子选择电极的测量方法和数据处理方法;学习氟系列标准溶液的配置及标准曲线的绘制。
由标准曲线计算出水样中氟的浓度约为0.09μg/mL,用标准加入法的结果同样为0.09μg/mL。
关键词:饮用水;氟;离子电极法Determination of fluorine in drinking waterLv Peiyin(Sichuan Agricultural University School of Science, Sichuan Ya'an 625000) Abstract: This experiment measures the content of fluorine in drinking water by ion electrode method, the purpose of the experiment is to master the basic principle of potential method, to learn to use the measurement method of ion selection electrode and data processing method, to learn the configuration of the standard solution of fluorine series and the drawing of the standard curve. The concentration of fluorine in the water sample is calculated by the standard curve by about 0.09 ?g/mL, and the result of the standard join method is also 0.09 g/mL.Keywords: drinking water; fluorine; ion electrode method1 前言离子选择性电极是一种电化学传感器,它能将溶液中特定的离子的活度转换成相应的电位。
离子色谱法测定神东矿区饮用水中F—、Cl—和SO42—三种阴离子的含量

离子色谱法测定神东矿区饮用水中F—、Cl—和SO42—三种阴离子的含量分析了神东矿区的饮用水现状,探讨了离子色谱法测定饮用水中氟化物、氯化物和硫酸盐的方法,以及测定结果对神东矿区水质改善的意义。
标签:神东矿区;饮用水;离子色谱法氟化物、氯化物和硫酸盐在自然中普遍存在。
天然水中氟化物的含量一般为0.3-0.5mg/L,人每天从食物和水中摄入一定量的氟,有利于牙齿及骨骼的生长,但是长期过量摄入,则可能导致慢性中毒。
饮用水中含有少量的硫酸盐对人体的健康影响不大,但是含量超过250mg/L时,有轻度腹泻作用;含量超过400mg/L 时,有涩苦味。
饮用水中氯化物的含量低于100mg/L时,对人类的健康没有影响;当水中氯化物的含量超过500mg/L时,可使水产生的令人厌恶的苦咸味。
精准地检测水中氟化物、氯化物和硫酸盐的含量,并有效控制其在生活用水中的含量具有重要的意义。
1 神东矿区饮用水现状神东煤炭集团公司位于陕西和内蒙的交界处,矿区地处乌毛素沙漠的边缘,属于半干旱地区,全年平均降水量只有310~490mm,矿区的生活和生产用水的供应十分紧张。
近年来,神东矿区致力于生态建设和地下蓄水库的建设,增加矿区地表和地下的蓄水量,用以缓解矿区水资源缺乏的困境。
地下水通过采空区沉淀过滤后,强排至净水厂,处理后成为生活饮用水。
目前,神东矿区生活用水的主要来源为考考赖净水厂和哈拉沟净水厂。
考考赖净水厂的水源为乌兰木伦井下强排水、石圪台井下强排水和地表水,水质中硫酸盐和氟化物的含量相对较高。
哈拉沟净水厂的水源为哈拉沟井下强排水,水质中硫酸盐的含量相对较高。
受煤矿开采和地质情况的影响,强排水的水质必须得到精准有效地检测,才能在净水处理厂有针对性的进行深度处理,保证出厂水符合饮用水标准。
2 矿区饮用水中氟化物、氯化物和硫酸盐的主要检测方法目前,神东矿区针对氟化物的检测方法有离子色谱法和锆盐茜素比色法;氯化物检测方法为离子色谱法和硝酸银容量法;硫酸盐的检测方法为离子色谱法和硫酸钡比浊法。
生活饮用水中氯离子含量测定

四、实验步骤
配制0.1mol/LAgNO3标准溶液-:称取 8.5g硝酸银,溶于500ml不含Cl 的蒸馏 水,储于棕色瓶中摇匀静置 标定0.1mol/LAgNO3标准溶液:准确 称取0.12g~0.15g基准NaCl,加50mL蒸 馏水,加入1mL铬酸钾溶液.在不断摇动 下,用硝酸银标准溶液滴定,直到产生淡 橙色为止.平行做三份并做空白.
六、数据处理
计算公式:
m NaCl1000 C ( AgNO3 ) VAgNO3 V0 M ( NaCl)
c ( AgNO ) V ( AgNO ) M ( Cl ) 3 3 p(Cl ) 1000 V水样
六、数据处理 1.AgNO3标准溶液的标定
项目 1 2 3
m(NaCl)
谢谢
目
实验目的 实验原理 试剂与仪器 实验步骤 注意事项 数据处理
录
一、实验目的
掌握莫尔法测定水中氯离子含 量的基本原理,操作方法和计算
学会铬酸指示剂确定终点的判 断
二、实验原理
莫尔法:以铬酸钾K2CrO4为指示剂的银量法称为莫 尔法。 Ag+ + Cl- = AgCl↓(白色) 2Ag+ + CrO42- = Ag2 CrO4↓(砖红色) 在中性或弱酸性水溶液中,以K2CrO4作指示剂,用 AgNO3标准滴定溶液滴至终点 因为AgCl的溶解度比Ag2CrO4的溶解度小,所以 + 滴定时,AgCl先析出沉淀,待滴定剂 Ag 与 Cl 达 + 到化学计量点时,微过量的Ag 与CrO4 反应析出 砖红色沉淀,指示滴定终点的到达
五、注意事项
说明 ① 莫尔法只适用于AgNO3标准溶液直接滴定Cl-和 Br-,而不适用于滴定I-和SCN-,由于AgI和AgSCN 沉淀更强烈地吸附I-和SCN-,使终点变色不明显, 误差较大。 ②莫尔法只能用于测定水中的Cl-和Br-的含量,但不 能用NaCl标准溶液直接滴定Ag+。 ③凡能与Ag+生成沉淀的阴离子(如PO43- 、CO32- 、 2222C2O4 、S 、SO3 );能与指示剂CrO4 生成沉淀 的阳离子(如Ba2+ 、Pb2+)以及能发生水解的金属离 子(如Al3+ 、Fe3+ 、Bi3+ 、Sn4+)干扰测定
饮用水中氟含量的测定

4. 最好使用聚乙烯苯塑料杯,因为F-与玻璃会起作用。 5. 标准加入法测定时应注意待测液体积已知且准确。 6. 测定过程中搅拌溶液的速度应恒定。
需要在pH5~7之间使用,pH高时,溶液中的OH-与氟化镧晶体膜中的F-交换,pH较低时,溶液中的F -生成HF或HF2- 。
的正负极,将pH-mv 内参比电极:Ag-AgCl电极(管内)。
将系列标准液由稀到浓依次转入各小烧杯中,插入已洗净的两电极(电极表面水分要吸干),在电磁搅拌2~4分钟后,读取平衡电位值, 每次测定后电极都应清洗至340mv以上,然后再使用。
把饱和甘汞电极和 将系列标准液由稀到浓依次转入各小烧杯中,插入已洗净的两电极(电极表面水分要吸干),在电磁搅拌2~4分钟后,读取平衡电位值,
每次测定后电极都应清洗至340mv以上,然后再使用。
氟电极分别接酸度计 TISAB:57mL冰醋酸+58g NaCl+12g 二水合柠檬酸钠 + 500mL 蒸馏水→NaOH(6mol/L)调pH值5.
E与lgcF-成线性
lgcF-
将系列标准液由稀到浓 依次转入各小烧杯中,插 入已洗净的两电极(电极 表面水分要吸干),在电 磁搅拌2~4分钟后,读取平 衡电位值,每次测定后电 极都应清洗至340mv以上, 然后再使用。 以lgCF-为横坐标,E(mv) 为纵坐标,做标准曲线
3、水样的测定
10.00mL水样+10.00mL TISAB→蒸馏水定容至 50.00mL
膜、内参比电极、内参比溶液、电极腔 计算水样中的氟含量。
注:电极不要插入太
参比电极(饱和甘汞电极)
