注射用青霉素钾质量标准2015
青霉素试验结果判断标准

青霉素试验结果判断标准全文共四篇示例,供读者参考第一篇示例:青霉素是一种常用的抗生素,被广泛用于治疗多种细菌感染。
对于临床医生来说,对于患者接受青霉素治疗后的效果进行判断至关重要。
而青霉素试验结果的判断标准就显得尤为重要。
下面将详细介绍关于青霉素试验结果判断标准的相关内容。
要了解青霉素试验结果的判断标准,就需要了解青霉素的药理作用。
青霉素是一种β-内酰胺类抗生素,其主要作用机制是通过抑制细菌的细胞壁合成而发挥抗菌作用。
在临床使用青霉素治疗患者时,需要根据患者的病情以及细菌感染的类型来选择适当的青霉素药物,并根据患者的体重、肝肾功能等因素来调整用药剂量。
青霉素试验结果判断标准主要包括以下几个方面:疗效评价、副作用监测、治疗方案调整等。
在评价治疗效果时,主要根据患者的临床症状、体温、实验室检查结果等指标来判断。
一般来说,如果患者在接受青霉素治疗后症状明显好转,体温下降,相应的实验室检查结果也恢复正常,那么可以认为治疗效果良好。
反之,如果患者在接受治疗后症状没有明显改善,体温持续升高,实验室检查结果也没有改善,那么就需要重新评估治疗方案,考虑是否需要调整青霉素的药物选择或剂量。
治疗方案的调整也是青霉素试验结果判断的重要环节。
在实际临床应用中,很多因素都可能影响患者对青霉素的治疗效果,例如患者的耐药情况、感染类型的复杂程度、青霉素的药剂使用以及患者个体差异等。
在评估青霉素治疗效果时,需要结合患者的具体情况来进行综合判断,根据需要及时调整治疗方案,以确保患者获得最佳的治疗效果。
第二篇示例:青霉素是一种广泛应用于医疗领域的抗生素药物,它主要用于治疗细菌感染。
在医学实践中,为了确定细菌对青霉素的敏感性,通常需要进行青霉素试验。
青霉素试验结果的判断标准对于临床医生选择合适的治疗方案非常重要。
下面将详细介绍青霉素试验结果判断标准。
青霉素试验通常包括在培养基上培养细菌,并在培养基上施加青霉素。
通过观察细菌在青霉素作用下的生长表现,可以确定细菌对青霉素的敏感性。
青霉素类制药挥发性有机物和恶臭特征污染物排放标准(DB 13_2208-2015)

2015 - 07 - 21 发布
2015 - 07 - 21 实施 发 布
河北省质量技术监督局 河 北 省 环 境 保 护 厅
DB13/ 2208—2015
前
言
本标准根据《中华人民共和国大气污染防治法》第七条之规定,并依据GB/T 1.1-2009给出的规则 起草。 本标准由河北省环境保护厅提出。 本标准起草单位: 河北科技大学、 华北制药集团环境保护研究所有限公司、 河北省环境监测中心站、 石家庄市环境监测中心。 本标准主要起草人:郭斌、任爱玲、赵文霞、宋玉、韩静、段二红、杜昭、律国黎、王勇军、周崇 辉、邢志贤、李亚卿、冯媛、俞磊、王欣、姜建彪、赵鑫、杨丽丽。 本标准由河北省环境保护厅负责解释。
a
最高允许排放限值 a 排气筒高度 ≥20m 现有源 3000 新源 2000
指发酵尾气排气筒臭气浓度限值,厂区内其他排气筒及厂界臭气浓度限值仍执行 GB14554 中规定的限值。
4.2 最低处理效率限值 挥发性有机物处理设施的处理效率执行表4所列标准。 表4 挥发性有机物(VOCs)处理设施的最低处理效率
表2 挥发性有机物排放限值
序号 污染物 最高允许排放浓度 (mg/m3) 排气筒高度(m) 15 20 1 乙酸丁酯 200 30 40 50 60 15 20 李玉洲 (木子) 2 正丁醇 100 30 40 50 60 15 20 3 丙酮 60 30 40 50 60 4 最高允许排放速 率(kg/h) 1.3 2.5 6.7 12 19 27 0.92 1.8 4.9 8.9 14 20 0.73 1.5 4.4 7.6 12 17 0.60 0.90 1.2 无组织排放监控浓度 限值(mg/m3)
2
DB13/ 2208—2015 无组织排放 fugitive emission 大气污染物不经过排气筒的无规则排放,主要包括作业场所有机溶剂存放、开放式灌装、输送,以 及设备、管线挥发性有机气体泄漏等。 3.12 无组织排放监控浓度限值 concentration limit at fugitive emission reference point 温度273K,压力101325 Pa状况下,监控点(根据HJ/T 55确定)的大气污染物任何1h质量浓度平均 值不得超过的限值。 3.13 现有污染源 existing ቤተ መጻሕፍቲ ባይዱollution source 本标准实施日前, 已投产或环境影响评价文件已通过审批的青霉素类生产过程排放大气污染物的设 施,或排放大气污染物的建筑构造(如车间等)。 3.14 新污染源 new pollution source 本标准实施日起, 环境影响评价文件通过审批的新建、 改建和扩建青霉素类生产过程排放大气污染 物的设施,或排放大气污染物的建筑构造(如车间等)。 4 污染物排放控制要求 4.1 大气污染物排放限值 4.1.1 自标准实施之日起至 2016 年 6 月 30 日,现有污染源执行表 1、表 3 所列排放限值。 4.1.2 自 2016 年 7 月 1 日起,现有污染源执行表 2、表 3 所列排放限值。 4.1.3 自标准实施之日起,新污染源执行表 2、表 3 所列排放限值。
青霉素钾质量标准

青霉素钾质量标准制定人: 日期: 审核人: 日期: 批准人: 批准日期:生效日期: 河北新世纪药业有限公司青霉素钾Qingmeisujia Benzylpenicillin PotassiumC 16H17KN2O4S 372.49本品为(2S,5R,6R)-3,3-二甲基-6-(2-苯乙酰氨基)-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钾盐。
按无水物计算,含青霉素按C16H17KN2O4S计算,不得少于96.0%。
[性状]本品为白色结晶性粉末;无臭或微有特异性臭;有引湿性;遇酸、碱或氧化剂等即迅速失效,水溶液在室温放置易失效。
本品在水中极易溶解,在乙醇中略溶,在脂肪油或液状石蜡中不溶。
[鉴别](1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照的图谱一致。
(3)本品显钾盐的火焰反应(附录20页)[检查] 吸收度取本品,加水制成每1ml中含1.88mg的溶液,照紫外-可见分光光度法(附录23页)测定,在280nm的波长测定吸光度,不得大于0.10;在264nm的波长处有最大吸收,吸收度应为0.80-0.88。
结晶性取本品少量,依法检查(附录86页),应符合规定。
酸碱度取本品,加水制成每1ml中含30mg的溶液,依法测定(附录51 页),PH值应为5.0~7.5。
溶液的澄清度与颜色取本品5份,各0.3g分别加水5ml使溶解,溶液应澄清无色;如显浑浊,与1号浊度标准液(附录83页)比较,均不得更浓;如显色,与黄色或黄绿色1号标准比色液(附录79页,第一法)比较,均不得更深。
水分取本品,照水分测定法(附录69页,第一法A)测定,含水分不得过0.5%。
青霉素聚合物照分子排阻色谱法(附录41页)测定。
色谱条件与系统适用性试验用葡聚糖凝胶G-10(40~120μm )为填充剂,玻璃柱内径1.3~1.6cm,柱高度30~40cm。
2015版药典注射剂

0102注射剂注射剂系指原料药物或与适宜的辅料制成的供注入体内的无菌制剂。
注射剂可分为注射液、注射用无菌粉末与注射用浓溶液等。
注射液 系指原料药物或与适宜的辅料制成的供注入体内的无菌液体制剂。
包括溶液型、乳状液型或混悬型等注射液。
可用于皮下注射、皮内注射、肌 内注射、静脉注射、静脉滴注等。
其中,供静脉滴注用的大容量注射液(除另有 规定外,一般不小于 100ml,生物制品一般不小于 50ml)也称输液。
中药注射剂 一般不宜制成混悬型注射液。
注射用无菌粉末 系指原料药物或与适宜辅料制成的供临用前用无菌溶液配制成注射液的无菌粉末或无菌块状物。
可用适宜的注射用溶剂配制后注射,也 可用静脉输液配制后静脉滴注。
注射用浓溶液 系指原料药物与适宜辅料制成的供临用前稀释后静脉滴注用的无菌浓溶液。
生物制品一般不宜制成注射用浓溶液。
注射剂在生产与贮藏期间应符合下列规定。
一、溶液型注射液应澄清;除另有规定外,混悬型注射液中药物粒径应控 制在 15μm 以下,含 15~20μm(间有个别 20~50μm)者,不应超过 10%,若 有可见沉淀,振摇时应容易分散均匀。
混悬型注射液不得用于静脉注射或椎管注 射;乳状液型注射液,不得有相分离现象,不得用于椎管注射;静脉用乳状液型 注射液中 90%的乳滴粒径应在 1μm 以下,不得有大于 5μm 的乳滴。
除另有规定 外,静脉输液应尽可能与血液等渗。
二、注射剂所用的原辅料应从来源及生产工艺等环节进行严格控制并应符 合注射用的质量要求。
除另有规定外,制备中药注射剂的饮片等原料药物应严格 按各品种项下规定的方法提取、纯化、制成半成品,以半成品投料配制成品。
制 备生物制品注射剂所用的生物制品原液、 半成品和成品的生产及质量控制应符合 相关品种要求。
三、注射剂所用溶剂应安全无害,并与其他药用成分兼容性良好,不得影 响活性成分的疗效和质量。
一般分为水性溶剂和非水性溶剂。
(1)水性溶剂最常用的为注射用水,也可用 0.9%氯化钠溶液或其他适宜的 水溶液。
青霉素类抗生素稳定性的影响因素及有关物质测定方法

青霉素类抗生素稳定性的影响因素及有关物质测定方法作者:王伟来源:《科学与财富》2015年第23期【摘要】临床上,青霉素是使用最为广泛的抗生素,此种抗生物不仅具有良好的抗菌效果,而且其不良反应也比较少,但是青霉素的应用也有很大的问题,比如会发生过敏,具权威机构调查分析,青霉素应用过程中发生过敏的概率居于首位,因此,对于青霉素的使用,医生也需要慎重。
影响青霉素类抗生素稳定性的因素有很多,其物质测定方法也有很多种,本文正是从这两方面对青霉素类抗生素进行了介绍,仅供参考借鉴。
【关键词】青霉素抗生素;稳定性;影响因素;测定方法青霉素类抗生素无论是在生产过程中,还是在保存期间,都会受到众多因素的影响,使其发生降解,产生其他的物质。
人们服用已经发生降解繁荣青霉素类抗生素之后,非常容易发生过敏,影响患者的健康。
通过大量的调查研究发现,高分子杂质含量越高,青霉素类抗生素越容易发生过敏反应,因此高分子杂质是其造成人体过敏的最重要的因素。
但是除此之外,还有很多因素会影响此类抗生素的稳定性。
一、青霉素类抗生素稳定性的影响因素在平稳的条件下,青霉素类抗生素不会产生降解,基本上保持着稳定的状态,但是一旦条件发生了变化,其稳定性就会发生变化,产生降解物质,经过研究测定,主要有两种降解物质,第一种是降解产物,第二种是高分子杂质。
其具体的影响因素如下:1、溶液PH青霉素类抗生素中具有很多不稳定因素的存在,因此当条件改变时,其会产生降解物质。
其分子结构中,比较不稳定的就是β—内酰胺环,其在酸性以及碱性作用下,会进行降解形成一定的产物,如果是碱性条件,有可能会生成聚合物。
正常而言,青霉素类抗生素的PH保持在6-7之间则比较稳定。
青霉素生产期间,PH应该保持在2-2.2,之后借助醋酸丁酯来完成萃取工作,但是因为降解,因此损失严重。
研究人员通过改进萃取工艺或者是利用新型的分离技术,使其PH条件发生了变化,则降低了青霉素在生产中的损失,降低成本的同时,也使得产品质量得以提高。
再论细菌内毒素限值的确定

再论细菌内毒素限值的确定中国药品生物制品检定所北京 100050王思理张国来蔡彤国家药典委员会北京 100061王平张莜红中国药典2000年版已经正式出版,并将于2000年7月1日正式执行。
细菌内毒素检查法应用指导原则及附件细菌内毒素定量检测法(动态浊度法和显色基质法)均被列入新版药典。
指导原则中对细菌内毒素限值的确定有非常明确清楚的规定:"细菌内毒素限值的确定药品、生物制品的细菌内毒素限值(L)一般按以下公式确定:L=K/M式中 L为供试品的细菌内毒素限值,以EU/ml、EU/mg、EU/u表示。
K为按规定的给药途径,人用每公斤体重每小时最大可接受的内毒素剂量,以EU/(kg·hr)表示。
注射剂,K=5EU/(kg·hr);其中放射性药品注射剂,K=2.5 EU/(kg·hr);鞘内用注射剂,K=0.02 EU/(kg·hr)。
M为人用每公斤体重每小时最大剂量,以ml/ (kg·hr)、mg/(kg·hr)、u/(kg·hr)表示,人均体重按60kg计算,注射时间小于1小时,按1小时计算。
按人用剂量计算L值时,如遇特殊情况,可根据生产和临床用药实际作必要调整。
应该说,今后国内对细菌内毒素限值(L)的确定可以统一了。
然而,从目前发表的文章和笔者审核的成果报告等都发现在药品的细菌内毒素检查法建立时对关键性的细菌内毒素限值(L)的确定尚存在不少问题。
主要问题是对"M为人用每公斤体重每小时最大剂量"作了如下的解释:其一、把最大剂量解释成"热原检查法剂量"。
例如:"注射用硝普钠中细菌内毒素的检查注射用硝普钠的内毒素限值(L):根据药品内毒素限值的计算方法,K=5.0EU/Kg,注射用硝普钠热原检查剂量M=1mg/KgL=K/M=(5.0EU/Kg)/(1mg/Kg)=5EU/mg。
青霉素及青霉素注射剂

百度文库- 让每个人平等地提升自我青霉素及青霉素注射剂【摘要】现在,青霉素的利用愈来愈普遍,本文通过学习青霉素的发现进程、作用机理、利用范围、不良反映和青霉素在我国的利用情况,进一步了解青霉素注射剂的作用与用途、用法用量、药效学、药动学和不良反映。
【关键词】青霉素注射剂青霉素注射剂1.青霉素青霉素是B-内酰胺抗生素,是一种高效、低毒、临床应用普遍的重要抗生素。
其钠盐或钾盐均为白色结晶性粉末、无臭、有吸湿性,易溶于水、生理食盐水或葡萄糖溶液中,微溶于乙醇,且易失效,不溶于脂肪油或液状石蜡,在近中性(PH=6~7)溶液中较为稳定,遇酸、碱、氧化剂、重金属等也易失效,尤其在碱性溶液中分解极快。
1-1.青霉素的发现青霉素的发现者弗莱明是英国细菌学家。
1922年,他发现人的眼泪、唾沫及伤风后的鼻涕里都含有一种能溶解细菌的物质,并为它取名为溶菌酶。
1928年夏天,弗莱明发现其中一只培育皿内的霉菌有点特别,霉菌周围没有细菌生长,但远处的细菌却正常生长。
分析后发现,该霉菌能杀死炭疽杆菌、白喉杆菌、葡萄球菌、链球菌等凶猛的革兰氏阳性菌,而革兰氏阴性菌如痢疾杆菌、流感杆菌、伤寒杆菌等都不受影响。
按照长期研究溶菌酶的经验,弗莱明推断这种霉菌必然是产生了一种抗菌物质,而这种抗菌物质有可能成为击败细菌的有效药物。
1929年6月,弗莱明把这种青霉菌分泌的抗菌物质称为青霉素[1]。
1-2.青霉素作用机理青霉素通过抑制细菌细胞壁四肽侧链和五肽交连桥的结合而阻碍细胞壁合成而发挥杀菌作用。
青霉素的结构与细胞壁的成份粘肽结构中的D-丙氨酰-D-丙氨酸近似,可与后者竞争转肽酶,阻碍粘肽的形成,造成细胞壁的缺损,使细菌失去细胞壁的渗透屏障,对细菌起到杀灭作用[2]。
其对革兰阳性菌有效,由于革兰阴性菌缺乏五肽交连桥而青霉素对其作用不大。
1-3. 青霉素利用范围①感染,如咽炎、、、丹毒、和等。
②肺炎如肺炎、、和菌血症等。
③不产青霉素酶。
④。
注射用青霉素钾

注射用青霉素钾【药品名称】通用名称:注射用青霉素钾英文名称:Benzylpenicillin Potassium for Injection【成份】青霉素钾。
【适应症】用于敏感细菌所致各种感染,如脓肿、菌血症、肺炎和心内膜炎等。
【用法用量】青霉素由肌内注射或静脉滴注给药。
1 成人:肌内注射,一日80万~200万单位,分3~4 次给药;静脉滴注:一日200万~2000万单位,分2~4次给药。
2 小儿:肌内注射,按体重2.5万单位/kg,每12小时给药1次;静脉滴注:每日按体重5万~20万/kg,分2~4次给药。
3 新生儿(足月产):每次按体重5万单位/kg,肌内注射或静脉滴注给药;出生第一周每12小时1次,一周以上者每8小时1次,严重感染每6小时1次。
4.早产儿:每次按体重3万单位/kg,出生第一周每12 小时1次,2~4周者每8小时1次;以后每6小时1次。
5.肾功能减退患者:轻、中度肾功能损害者使用常规剂量不需减量,严重肾功能损害者应延长给药间隔或调整剂量。
当内生肌酐清除率为10~50ml/min时,给药间期自8 小时延长至8~12小时或给药间期不变、剂量减少25%;内生肌酐清除率小于10ml/min时,给药间期延长至12~18小时或每次剂量减至正常剂量的25%~50%而给药间期不变。
6.肌内注射时,每50万单位青霉素钾溶解于1ml灭菌注射用水,超过50万单位则需加灭菌注射用水2ml,不应以氯化钠注射液为溶剂;静脉滴注时给药速度不能超过每分钟50万单位,以免发生中枢神经系统毒性反应。
【不良反应】1 过敏反应:青霉素过敏反应较常见,包括荨麻疹等各类皮疹、白细胞减少、间质性肾炎、哮喘发作等和血清病型反应;过敏性休克偶见,一旦发生,必须就地抢救,予以保持气道畅通、吸氧及使用肾上腺素、糖皮质激素等治疗措施。
2 毒性反应:少见,但静脉滴注大剂量本品或鞘内给药时,可因脑脊液药物浓度过高导致抽搐、肌肉阵挛、昏迷及严重精神症状等(青霉素脑病)。
青霉素钠质量标准
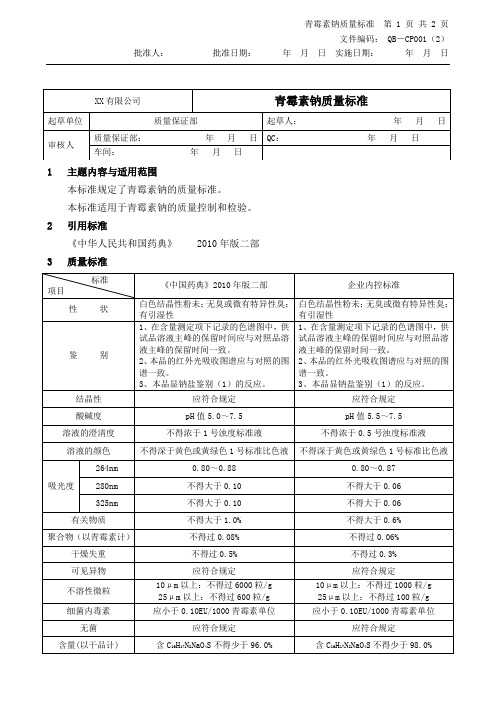
青霉素钠质量标准
起草单位
质量保证部
起草人:年月日
审核人
质量保证部:年月日
QC:年月日
车间:年月日
1主题内容与适用范围
本标准规定了青霉素钠的质量标准。
本标准适用于青霉素钠的质量控制和检验。
2引用标准
《中华人民共和国药典》2010年版二部
3质量标准
标准
项目
《中国药典》2010年丁醇
——
不得过0.2%
乙酸乙酯
——
不得过0.2%
贮藏
严封,在凉暗干燥处保存
有效期
48个月
备注
4文件发放范围及数量
总经理1份、。
5文件变更历史
版本号
实施日期
变更描述
变更人
1
2
25μm以上:不得过600粒/g
10μm以上:不得过1000粒/g
25μm以上:不得过100粒/g
细菌内毒素
应小于0.10EU/1000青霉素单位
应小于0.10EU/1000青霉素单位
无菌
应符合规定
应符合规定
含量(以干品计)
含C16H17N2NaO4S不得少于96.0%
含C16H17N2NaO4S不得少于98.0%
性状
白色结晶性粉未;无臭或微有特异性臭;有引湿性
白色结晶性粉未;无臭或微有特异性臭;有引湿性
鉴别
1、在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
2、本品的红外光吸收图谱应与对照的图谱一致。
3、本品显钠盐鉴别(1)的反应。
1、在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
青霉素钾盐-华星

青霉素工业钾盐1. 目的1.1为了保证原材料检验的准确性和具有可追溯性,便于抽查、复查,满足监督管理要求、分清质量责任,特制定本检验规程。
2. 职责2.1 公司质管部负责本制度的编制、修订和解释。
3. 范围3.1 本标准规定了本品的技术要求、试验方法、检验规则、贮存。
本标准适应于6-APA用原料。
4. 结构式及分子式C16H17KO4N2S 372.495. 引用标准《中华人民共和国药典》2005年版二部《中华人民共和国药典》2005年版二部附录ⅧL 干燥失重测定法《中华人民共和国药典》2005年版二部附录ⅥE 旋光度测定法;《中华人民共和国药典》2005年版二部附录ⅥH PH值测定法;《中华人民共和国药典》2005年版二部附录ⅨA 溶液颜色检查法;《中华人民共和国药典》2005年版二部附录ⅨB澄清度检查法;《中华人民共和国药典》2005年版二部附录ⅧH 重金属检查法;HNPZ07-05《化验采样、留样管理制度》。
6. 技术要求7. 试验方法:7.1 外观:目力检测。
7.2 鉴别:7.2.1 本品的红外光吸收图谱与对照的图谱一致。
7.2.2 本品显钾盐的火焰反应。
7.3 酸碱度(PH):取供试样品0.90g于小烧杯中,加水30mL溶解制成每1mL中含30mg的溶液,按《中华人民共和国药典》2005年版二部附录ⅥH PH值测定法7.4 干燥失重:精密称取供试品5g,按《中华人民共和国药典》2005年版二部附录ⅧL 干燥失重测定法测定。
7.5 透光率:取供试品2.5g于25mL具塞试管中,加水使成25mL溶液摇匀,于400nm波长处测定透光率。
7.6 颜色:取供试品0.6g加水10mL溶解后制成每10mL中含60mg的供试溶液,倒入25mL比色管中,与黄色2号或黄绿色2号标准比色液按《中华人民共和国药典》2005年版二部附录ⅨA进行比较。
7.7 澄清度:取供试品0.6g加水10mL溶解后制成每10mL中含60mg的供试溶液,倒入25mL比色管中,与2号标准浊度液按《中华人民共和国药典》2005年版二部附录Ⅸ B 进行比较。
兽用粉针注射用青霉素钾生产工艺规程

注射用青霉素钾工艺规程年月日发布年月日实施文件编号:JB/GY/03-01起草(修订)部门:起草人:日期:年月日审核人:日期:年月日技术审阅:日期:年月日批准人:日期:年月日颁发部门:颁发单位:颁发份数:日期:年月日复制份数:生效日期:年月日目录一、产品概述 (4)二、处方 (5)三、非最终灭菌无菌粉末注射剂工艺流程及环境区域划分示意图 (5)四、操作过程及工艺条件 (5)五、原料质量标准和检验操作规程 (8)六、成品质量标准和检验操作规程 (9)七、包装材料质量标准和检验操作规程 (9)八、说明书文字说明 (10)九、工艺卫生要求 (11)十、设备一览表及主要设备生产能力 (11)十一、技术安全和劳动保护 (11)十二、劳动组织、岗位定员 (11)十三、原料、包装材料消耗定额 (11)十四、综合利用和环境保护 (12)十五、物料平衡以及其他指标计算公式 (12)十六、工艺过程中所需的主要SOP名称 (12)十七、非最终灭菌无菌粉末注射剂质量控制点 (12)一、产品概述:产品特点:本品为青霉素钾的无菌粉末。
含青霉素按C16H17KN2O4S计算,不得少于95.5% 。
按平均装量计算,含青霉素钾应为标示量的90.5-114.5%。
剂型:非最终灭菌无菌粉末注射剂。
性状:本品为白色结晶性粉末。
药理作用:本品通过抑制细菌粘肽链的交叉联合而直接抑制菌体细胞壁的合成,又破坏菌体蛋白质的合成。
本品主要对革兰氏阳性菌和阴性菌有抑制和杀灭作用。
本品肌注后吸收迅速,约0.5小时达血药峰浓度,对多数敏感菌的有效血药浓度可维持6-8小时作用与用途:抗生素类药。
主用于革兰氏阳性菌感染,亦用于放线菌及钩端螺旋体等的感染。
用法用量:肌内注射一次量每1kg体重马、牛1万~2万单位羊、猪、驹、犊2万~3万单位犬、猫3万~4万单位禽5万单位一日2-3次连用2-3日临用前,加适量灭菌注射用水适量使溶解。
不良反应:少数家禽可发生过敏反应。
常见药品的使用说明

常见药品的使用说明2011-4通用名:注射用青霉素钾英文名:Benzylpenicillin Potassium for Injetion主要成分:青霉素钾性状:白色结晶粉末【药理作用】:(1)药效学青霉素属杀菌性抗生素,抗菌活性强,其抗菌作用机理主要是抑制细菌细胞壁黏肽的合成。
青霉素为一窄谱抗生素,主要对多种革兰氏阳性菌和少数革兰氏阴性菌有作用。
主要病原菌有:葡萄球菌、链球菌、猪丹毒杆菌、棒状杆菌、破伤风梭菌、放线菌、炭疽、螺旋体等。
青霉素适用于敏感菌所致的各种疾患,如:猪丹毒、炭疽、气肿疽、恶性水肿、放线菌病、马腺疫、关节炎、坏死杆菌病、肾盂肾炎、钩端螺旋体病、乳腺炎、皮肤组织感染、子宫炎、肺炎、败血症、破伤风(与破伤风抗毒素合用)等。
(2)药动学青霉素内服后在胃酸环境中极易水解,很少吸收,肌内注射后吸收迅速,15-30分钟,达血药峰浓度,青霉素小部分在肝内代谢,大部分以原行排泄。
在肾功能正常的情况下,约50%-75%自肾脏排出,其中90%通过肾小管分泌,因排出迅速,故体内消除较快。
【适应症】:抗生素类药。
主用于革兰氏阳性菌引起的感染性疾病,如猪丹毒、炭疽、放线菌病、坏死杆菌病、肾盂肾炎、乳腺炎、子宫炎、肺炎、败血症等。
亦用于钩端螺旋体病。
用法用量:肌注:一次量,每1kg体重,马、牛1万-2万单位;羊、猪、驹、犊2万-3万单位;犬、猫3万-4万单位;禽5万单位。
一日2-3次,连用2-3日。
临用前加灭菌注射用水适量使其溶解。
【注意事项】:(1)青霉素易溶于水,水溶液不稳定,很易水解,水解率水温度上升而加速,因此注射液应在临用前配制。
必须保存时,应置冰箱中(2-8度),可保存7日,在室温只能保存24小时。
(2)1氯霉素、红霉素、四环素类、磺胺类可干扰本品活性,故不宜同瓶滴注。
2丙磺舒、阿司匹林、吲哚美辛、保泰松和磺胺药减少青霉素的肾小管分泌而延长本品的血清半衰期。
青霉素可增强华法林的抗凝作用。
3本品与重金属,特别是铜、锌、汞呈配伍禁忌。
中华人民共和国农业部禁用兽药名录

中国农业部禁用兽药名录1、禁用于所有食品动物的兽药(11类)(1)兴奋剂类:克仑特罗、沙丁胺醇、西马特罗及其盐、酯及制剂;(2)性激素类:己烯雌酚及其盐、酯及制剂;(3)具有雌激素样作用的物质:玉米赤霉醇、去甲雄三烯醇酮、醋酸甲孕酮及制剂;(4)氯霉素及其盐、酯(包括:琥珀氯霉素)及制剂;(5)氨苯砜及制剂;(6)硝基呋喃类:呋喃西林和呋喃妥因及其盐、酯及制剂;呋喃唑酮、呋喃它酮、呋喃苯烯酸钠及制剂;(7)硝基化合物:硝基酚钠、硝呋烯腙及制剂;(8)催眠、镇静类:安眠酮及制剂;(9)硝基咪唑类:替硝唑及其盐、酯及制剂;(10)喹噁啉类:卡巴氧及其盐、酯及制剂;(11)抗生素类:万古霉素及其盐、酯及制剂。
2、禁用于所有食品动物、用作杀虫剂、清塘剂、抗菌或杀螺剂的兽药(9类)(1)林丹(丙体六六六);(2)毒杀芬(氯化烯);(3)呋喃丹(克百威);(4)杀虫脒(克死螨);(5)酒石酸锑钾;(6)锥虫胂胺;(7)孔雀石绿;(8)五氯酚酸钠;(9)各种汞制剂包括:氯化亚汞(甘汞)、硝酸亚汞、醋酸汞、吡啶基醋酸汞。
3、禁用于所有食品动物用作促生长的兽药(3类)(1)性激素类:甲基睾丸酮、丙酸睾酮、苯丙酸诺龙、苯甲酸雌二醇及其盐、酯及制剂;(2)催眠、镇静类:氯丙嗪、地西泮(安定)及其盐、酯及其制剂;(3)硝基咪唑类:甲硝唑、地美硝唑及其盐、酯及制剂。
4、禁用于水生食品动物用作杀虫剂的兽药(1类)双甲脒。
最新增添农业部2292号公告:禁止在饲料和动物饮用水中使用的药物品种(5类40种)1、肾上腺素受体激动剂盐酸克仑特罗、沙丁胺醇、硫酸沙丁胺醇、莱克多巴胺、盐酴多巴胺、西巴特罗、硫酸特布他林。
2、性激素己烯雌酚、雌二醇、戊酸雌二醇、苯甲酸雌二醇、氯烯雌醚(Chlorotriansene)、炔诺醇、炔诺醚(Quinestml)、醋酸氯地孕酮、左炔诺孕酮、炔诺酮、绒毛膜促性腺激素(绒促性素)、促卵泡生长激素(尿促性素主要含卵泡刺激FSHT和黄体生成素LH)3、蛋白同化激素碘化酷蛋白、苯丙酸诺龙及苯丙酸诺龙注射液。
9.10青霉素钠钾

青霉素钠和青霉素钾的检查
青霉素聚合物检查
青霉素钠和青霉素钾的检查
分子排阻色谱法原理: l 又称凝胶色谱法,使用具有一定孔径的柱填料,
被分离组分因分子大小的不同而被分离。 l 本法使用葡聚糖凝胶G-10为固定相,分子量
青霉素钠和青霉素钾及其制 剂的分析
化学结构与性质
青霉素钠和青霉素钾属β-内酰胺类抗生素。以青霉素钠为例,其结构如下:
青霉素类药物的结构由母核和侧链两部分组 成。母核为6-氨基青霉烷酸,由β-内酰胺环 和氢化噻唑环并合而成,C3上有一个羧基。 不同的侧链构成不同的药物。
青霉素钠(钾)的侧链为苄基,母核上的羧基 形成钠盐为青霉素钠,形成钾盐即为青霉素钾。
注射用青霉素钠和注射用青霉素钾的分析
1.注射用青霉素钠
l注射用青霉素钠为青霉素钠的无菌粉末。《中国药典》规定,按无水物计算, 本品含青霉素钠不得少于96.0%,按平均装量计算,含青霉素钠应为标示量的 95.0%~115.0%。 l注射用青霉素钠的鉴别试验与青霉素钠相同;检查的项目有:溶液的澄清度与 颜色、青霉素聚合物(≤0.10%)、水分(≤1.0%)、酸碱度、细菌内毒素、无菌等。 注射用青霉素钠的含量测定方法与青霉素钠相同。
测定方法:
按外标法以峰面积计算,其结果乘以1.0658,即为供试品中青霉素钠 (C16H17N2NaO4S)的含量,每1mg青霉素钠(C16H17N2NaO4S)相当于 1670青霉素单位。
青霉素钠和青霉素钾的含量测定
含量测定方法说明:
1.以上方法使用C18为固定相,为反相高效液相色谱法。使用酸性的流动相是为 了使青霉素成为分子状态,以利于分离。
兽用青霉素钾(钠)含量的非随行标准高效液相色谱测定法

兽用青霉素钾(钠)含量的非随行标准高效液相色谱测定法陈锡龙【摘要】为解决实践中检测青霉素钾(钠)样本数量多,次数频繁,需耗费大量的标准品造成资源浪费问题,建立兽用青霉素钾(钠)含量的非随行标准高效液相色谱测定法.以C18为固定相,0.5 mol/L磷酸二氢钾溶液(用磷酸调节pH值到3.5)∶醇∶水=10∶30∶60为流动相A,0.5 mol/L磷酸二氢钾溶液(用磷酸调节pH值到3.5)∶甲醇∶水=10∶50∶40为流动相B,A∶B =30∶70,流速为1.0 mL/min,柱温30℃,检测波长为225 nm.采用外标法定量计算含量.青霉素的线性范围为20~1 000μg/mL,回归方程为Area=5.790 4×Amt-30.007(n=5),相关系数大于0.999.在不更换色谱柱的情况下,使用该方法可以仅采集1次标准溶液的数据就能够对不同时间测量的青霉素样品进行定量,从而可以节约大量的检测成本.【期刊名称】《贵州畜牧兽医》【年(卷),期】2016(040)001【总页数】6页(P14-19)【关键词】青霉素钾(钠);含量;非随行标准;高效液相色谱;测定【作者】陈锡龙【作者单位】贵州省兽药饲料监察所,贵州贵阳550003【正文语种】中文【中图分类】S859.79+6目前,检测机构在使用高效液相色谱法测定化合物的含量时,几乎都是使用随行(或同行)标准来对其进行定性和定量。
所谓定性和定量分析中的随行(或同行)标准,以下简称随行标准,就是在运行样品的同时,也运行一组已知浓度的标准溶液,通过比较未知样品色谱峰和标准溶液色谱峰之间的相对保留时间和峰面积的对应关系,从而达到对未知样品进行定性和定量的目的。
随行标准分析方法似乎只是行业内一个约定俗成的惯例,其依据可能主要是进行定性定量时要求色谱条件与标准样品相同[1~3]。
随行标准无疑能够满足这一条件,且有利于提高定性和定量的准确性及精度,但是它也有非常明显的缺点,就是需要耗费比较多的标准物质。
注射用青霉素钠说明书

注射用青霉素钠说明书【药品名称】通用名:注射用青霉素钠英文名:Benzylpenicillin Sodium for Injection汉语拼音:Zhusheyong Qingmeisuna【成份】本品的主要成份为青霉素钠。
化学名称:(2S,5R,6R)-3,3-二甲基-6-(2-苯乙酰氨基)-7-氧代-4-硫杂-1-氮杂双环[3.2.0]庚烷-2-甲酸钠盐。
化学结构式:分子式:C16H17N2NaO4S分子量:356.38Cas No:69-57-8【性状】本品为白色结晶性粉末。
【适应症】青霉素适用于敏感细菌所致的各种感染,如脓肿、菌血症、肺炎和心内膜炎等。
其中青霉素为以下感染的首选药物:1.溶血性链球菌感染,如咽炎、扁桃体炎、猩红热、丹毒、蜂窝织炎和产褥热等。
2.肺炎链球菌感染如肺炎、中耳炎、脑膜炎和菌血症等。
3.不产青霉素酶葡萄球菌感染。
4.炭疽。
5.破伤风、气性坏疽等梭状芽孢杆菌感染。
6.梅毒(包括先天性梅毒)。
7.钩端螺旋体病。
8.回归热。
9.白喉。
10.青霉素与氨基糖苷类药物联合用于治疗草绿色链球菌心内膜炎。
青霉素亦可用于治疗:1.流行性脑脊髓膜炎。
2.放线菌病。
3.淋病。
4.奋森咽峡炎。
5.莱姆病。
6.鼠咬热。
7.李斯特菌感染。
8.除脆弱拟杆菌以外的许多厌氧菌感染。
风湿性心脏病或先天性心脏病患者进行口腔、牙科、胃肠道或泌尿生殖道手术和操作前,可用青霉素预防感染性心内膜炎发生。
【规格】0.48g(80万单位)【用法用量】青霉素由肌内注射或静脉滴注给药。
1.成人:肌内注射,一日80万~200万单位,分3~4次给药;静脉滴注:一日200万~2000万单位,分2~4次给药。
2.小儿:肌内注射,按体重2.5万单位/kg,每12小时给药1次;静脉滴注:每日按体重5万~20万/kg,分2~4次给药。
3.新生儿(足月产):每次按体重5万单位/kg,肌内注射或静脉滴注给药;出生第一周每12小时1次,一周以上者每8小时1次,严重感染每6小时1次。
医院青霉素过敏试验实施标准

文档序号:XXYY-WWY-001
文档编号:WWY-20XX-001
XXX医院
青霉素过敏试验实施标准
编制科室:知丁
日期:年月日
青霉素过敏试验实施标准
一、准备质量标准
1.个人准备:衣帽整齐,戴口罩,洗手。
2.物品准备:
(1)800000U青霉素1瓶。
(2)1ml注射器,4.5~5号针头。
(3)无菌生理盐水。
(4)75%酒精,2.5%碘酒,棉签。
(5)5ml或2m1注射器,7号针头。
(6)0.1%肾上腺素1支。
二、操作程序
1.了解患者有无过敏史。
2.配制皮试液:80万U青霉素内注入无菌生理盐水4ml 则每毫升含20万U。
取0.1ml加生理盐水至1ml,每毫升含2万U。
再取0.1ml加生理盐水至1ml,每毫升含2000U,每次配制时须将溶液混合均匀。
3.取青霉素皮试液0.1ml(含20U),做皮内注射,20分钟后观察结果。
4.结果判定
(1)阴性:皮丘无改变,周围不红肿,无自觉症状。
(2)阳性:局部出现中心晕团和周围红斑,直径大于1cm
或红晕周围有伪足、痒感,严重时可出现过敏性休克。
三、注意事项
1.皮试液现配现用,不宜放置过久。
2.出现可疑阳性时,可在对侧前臂做盐水对照试验。
知丁
3.患者停药3日以上或改换批号,均需重新做过敏试验。
4.一旦发现过敏性休克者,应立即就地抢救。
四、评价标准
评价标准见下表:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注射用青霉素钾
Lu s hen g hua Qingm eisujia Benzylpenicillin potassium for lnjection
本品为青霉素钾的结晶性无菌粉末。
按无水物计算,含C
16H
17
KN
2
O
4
S不得少于96.0%;按
平均装量计算,含C
16H
17
KN
2
O
4
S应为标示量的95.0%~115.0%
【性状】本品为白色结晶性粉末。
【鉴别】取本品,照青霉素钾项下的鉴别试验,显相同的结果。
【检查】溶液的澄清度与颜色照注射用青霉素钠项下的方法检查,应符合规定。
青霉素聚合物取装量差异项下的内容物,精密称取适量,照青霉素钠项下的方法测定。
含青霉素聚合物以青霉素计不得过0.10%
干燥失重取本品,在105℃干燥,减失重量不得过1.0%(附录78页)。
,
不溶性微粒取本品,按标示量加微粒检查用水制成每1ml中含50mg的溶液,依法检查(附录95页),标示量为1.0g以下的折算为每1.0g样品中含10um以上的微粒不得过6000粒,含25um以上的微粒不得过600粒。
酸碱度、有关物质、细菌内毒素与无菌照青霉素钠项下的方法检查,均应符合规定。
其他应符合注射剂项下有关的各项规定(附录6页)。
【含量测定】取装量差异项下的内容物,精密称取适量,照青霉素钾项下的方法
测定即得。
每1mg的C
16H
17
KN
2
O
4
S相当于1598青霉素单位。
【类别】同青霉素钾
【规格】按C
16H
17
KN
2
O
4
S计算(1)0.25g(40万单位) (2)0. 5g(80万单位)
(3)0.625g(100万单位) (4)1.0g(160万单位) (5)2.5g(400万单位)【贮藏】密闭,在凉暗干燥处保存。
