第六章 合成子与极性转换 ppt课件
合集下载
《结构化学》课件

《结构化学》ppt课件
contents
目录
• 结构化学简介 • 原子结构与性质 • 分子的电子结构与性质 • 晶体结构与性质 • 结构化学实验结构化学的定义
总结词
结构化学是一门研究物质结构与 性质之间关系的科学。
详细描述
结构化学主要研究原子的排列方 式、电子分布和分子间的相互作 用,以揭示物质的基本性质和行 为。
晶体的电导率、热导率等性质取决于其内 部结构,不同晶体在这些方面表现出不同 的特性。
晶体的力学性质
晶体材料的应用
晶体的硬度、韧性等力学性质与其内部原 子排列密切相关,这些性质决定了晶体在 不同工程领域的应用价值。
晶体材料广泛应用于电子、光学、激光、 半导体等领域,如单晶硅、宝石等。了解 晶体的性质是实现这些应用的关键。
分子的选择性
分子的选择性是指分子在化学反应中对反应物的选择性和对产物的选择性。选择性强的分 子可以在特定条件下优先与某些反应物发生反应,产生特定的产物。
04
晶体结构与性质
晶体结构的基础知识
晶体定义与分类
晶体是由原子、分子或离子在空 间按一定规律重复排列形成的固 体物质。根据晶体内部原子、分 子或离子的排列方式,晶体可分 为七大晶系和14种空间点阵。
电子显微镜技术
• 总结词:分辨率和应用 • 电子显微镜技术是一种利用电子显微镜来观察样品的技术。相比光学显微镜,
电子显微镜具有更高的分辨率和更大的放大倍数,因此可以观察更细微的结构 和组分。 • 电子显微镜技术的分辨率一般在0.1~0.2nm左右,远高于光学显微镜的分辨 率(约200nm)。因此,电子显微镜可以观察到更小的晶体结构、病毒、蛋 白质等细微结构。 • 电子显微镜技术的应用范围很广,例如在生物学领域中,可以用于观察细胞、 病毒、蛋白质等生物样品的结构和形态;在环境科学领域中,可以用于观察污 染物的分布和形态;在材料科学领域中,可以用于观察金属、陶瓷、高分子等 材料的表面和断口形貌等。
contents
目录
• 结构化学简介 • 原子结构与性质 • 分子的电子结构与性质 • 晶体结构与性质 • 结构化学实验结构化学的定义
总结词
结构化学是一门研究物质结构与 性质之间关系的科学。
详细描述
结构化学主要研究原子的排列方 式、电子分布和分子间的相互作 用,以揭示物质的基本性质和行 为。
晶体的电导率、热导率等性质取决于其内 部结构,不同晶体在这些方面表现出不同 的特性。
晶体的力学性质
晶体材料的应用
晶体的硬度、韧性等力学性质与其内部原 子排列密切相关,这些性质决定了晶体在 不同工程领域的应用价值。
晶体材料广泛应用于电子、光学、激光、 半导体等领域,如单晶硅、宝石等。了解 晶体的性质是实现这些应用的关键。
分子的选择性
分子的选择性是指分子在化学反应中对反应物的选择性和对产物的选择性。选择性强的分 子可以在特定条件下优先与某些反应物发生反应,产生特定的产物。
04
晶体结构与性质
晶体结构的基础知识
晶体定义与分类
晶体是由原子、分子或离子在空 间按一定规律重复排列形成的固 体物质。根据晶体内部原子、分 子或离子的排列方式,晶体可分 为七大晶系和14种空间点阵。
电子显微镜技术
• 总结词:分辨率和应用 • 电子显微镜技术是一种利用电子显微镜来观察样品的技术。相比光学显微镜,
电子显微镜具有更高的分辨率和更大的放大倍数,因此可以观察更细微的结构 和组分。 • 电子显微镜技术的分辨率一般在0.1~0.2nm左右,远高于光学显微镜的分辨 率(约200nm)。因此,电子显微镜可以观察到更小的晶体结构、病毒、蛋 白质等细微结构。 • 电子显微镜技术的应用范围很广,例如在生物学领域中,可以用于观察细胞、 病毒、蛋白质等生物样品的结构和形态;在环境科学领域中,可以用于观察污 染物的分布和形态;在材料科学领域中,可以用于观察金属、陶瓷、高分子等 材料的表面和断口形貌等。
键的极性和分子的极性ppt课件
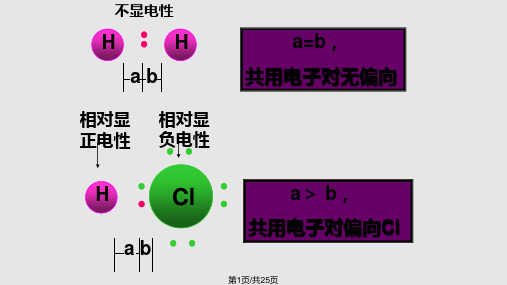
非极性分子组成的溶质溶于非极性分子的溶剂,难 溶于极性分子组成的溶剂,这个经验规律又叫相似相溶 原理。
例如氯化氢易溶于水难溶于汽油,碘易溶于CCl4 , 难溶于水。
C.极性分子在电场或磁场力的作用下会发生偏移。
自学: 科学视野—表面活性剂和细胞膜
思考: 1、什么是表面活性剂?亲水基团?疏水基团?肥皂和 洗涤剂的去污原理是什么? 2、什么是单分子膜?双分子膜?举例说明。 3、为什么双分子膜以头向外而尾向内的方式排列?
性
非极性分子
H2、N2、O2、 P4、C60
极性分子 CO、HCl
非极性分子 CO2、CH4
极性分子 HCN、H2O、
NH3、CH3Cl
对于ABn型分子极性判别方法
(1)孤对电子法
在ABn型分子中,若中心原子A无孤对电子(未成对
电子),则是非极性分子,若中心原子A有孤对电子则是
极性分子。
例如:C02、CH4、SO3中心原子(C、S)无孤对电子, 是非极性分子。而像H20、NH3、NP3中心原子(O、N)有孤 对电子,则为极性分子。
直线型 直线型
非极性 极性
三原 子分 子
四原 子分 子
CO2
H2O NH3 BF3
极性 180º 直线型 非极性
极性 104º30’ V型 极性 107º18' 三角锥型
极性 极性
极性 120º 平面三角形 非极性
五原 子
CH4
极性
109º28 ' 正四面体型 非极性
(4)化合价法 ABn型分子中中心原子的化合价的绝
答案
• 1. 极性分子:HCl
• 非极性分子:H2 O2 Cl2 • 2. 都是非极性分子
• 3. 极性分子:HCN H2O NH3 • 非极性分子:CO2 BF3 CH4
例如氯化氢易溶于水难溶于汽油,碘易溶于CCl4 , 难溶于水。
C.极性分子在电场或磁场力的作用下会发生偏移。
自学: 科学视野—表面活性剂和细胞膜
思考: 1、什么是表面活性剂?亲水基团?疏水基团?肥皂和 洗涤剂的去污原理是什么? 2、什么是单分子膜?双分子膜?举例说明。 3、为什么双分子膜以头向外而尾向内的方式排列?
性
非极性分子
H2、N2、O2、 P4、C60
极性分子 CO、HCl
非极性分子 CO2、CH4
极性分子 HCN、H2O、
NH3、CH3Cl
对于ABn型分子极性判别方法
(1)孤对电子法
在ABn型分子中,若中心原子A无孤对电子(未成对
电子),则是非极性分子,若中心原子A有孤对电子则是
极性分子。
例如:C02、CH4、SO3中心原子(C、S)无孤对电子, 是非极性分子。而像H20、NH3、NP3中心原子(O、N)有孤 对电子,则为极性分子。
直线型 直线型
非极性 极性
三原 子分 子
四原 子分 子
CO2
H2O NH3 BF3
极性 180º 直线型 非极性
极性 104º30’ V型 极性 107º18' 三角锥型
极性 极性
极性 120º 平面三角形 非极性
五原 子
CH4
极性
109º28 ' 正四面体型 非极性
(4)化合价法 ABn型分子中中心原子的化合价的绝
答案
• 1. 极性分子:HCl
• 非极性分子:H2 O2 Cl2 • 2. 都是非极性分子
• 3. 极性分子:HCN H2O NH3 • 非极性分子:CO2 BF3 CH4
极性反转

R1 O δR1 OH δ+
2
OH R2
O
R2 u m p o lu n g S S
R 1C H O
R
对α-氨基酸在α-碳和羧基间进行切断,得到一个不 合理的羧基碳负离子合成子。 解决这一问题的办法是在切断前首先进行官能团转 变,把羧基变成氰基,这样切断后就变成了一个合 理的氰基负离子合成子。
极性反转(umpolung) --在逆合成转化中的应 用
碳-杂原子键(C-X)通常是极 化的,含杂原子官能团化合物有 沿碳骨架给、吸电子反应性交替 这一现象。
X δ1 δ+
这一现象在逆合成分析中选定合 成子对时十分有用。
7 8 δ δ+
6 δ-
5 δ
+
3 4 δ2 δ+ δ
-
在上述的逆合成分析中,我们通 常选择具有常规反应性的合成子, 这样的选择比较稳当,因为常规 反应性经常意味着对应于已知的 反应,由此设计的合成路线成功 机会大。
C O 2H NH2 FGI CN NH2 HN R δ+ +
-
R HN δ+ +
-
C O 2H
CN
RCHO
+
NH3
1,4-双官能团的切断
O O O δδ+ O u m p o lu n g O Br O
一个由有机金属化合物造成的极性转化的例子,也 是生成酰基负离子等价物。
O O δ+ O u m p o lu n g O O C 2H 5 2C u L i δ-
概念:当卤代烷分解成R+和X-时,烷基是正离子。当它形 成格氏试剂后,烷基就变成了负离子,这就叫极性反转。 在逆合成分析中,如拆分的合成元极性与正常的相反,则 必须改变原来目标分子或合成元中的电性,以得到试剂。 有了极性反转这一技术,同一基团即可成正离子,又可成 负离子。这无疑扩大了可能进行的有机合成范围。
2
OH R2
O
R2 u m p o lu n g S S
R 1C H O
R
对α-氨基酸在α-碳和羧基间进行切断,得到一个不 合理的羧基碳负离子合成子。 解决这一问题的办法是在切断前首先进行官能团转 变,把羧基变成氰基,这样切断后就变成了一个合 理的氰基负离子合成子。
极性反转(umpolung) --在逆合成转化中的应 用
碳-杂原子键(C-X)通常是极 化的,含杂原子官能团化合物有 沿碳骨架给、吸电子反应性交替 这一现象。
X δ1 δ+
这一现象在逆合成分析中选定合 成子对时十分有用。
7 8 δ δ+
6 δ-
5 δ
+
3 4 δ2 δ+ δ
-
在上述的逆合成分析中,我们通 常选择具有常规反应性的合成子, 这样的选择比较稳当,因为常规 反应性经常意味着对应于已知的 反应,由此设计的合成路线成功 机会大。
C O 2H NH2 FGI CN NH2 HN R δ+ +
-
R HN δ+ +
-
C O 2H
CN
RCHO
+
NH3
1,4-双官能团的切断
O O O δδ+ O u m p o lu n g O Br O
一个由有机金属化合物造成的极性转化的例子,也 是生成酰基负离子等价物。
O O δ+ O u m p o lu n g O O C 2H 5 2C u L i δ-
概念:当卤代烷分解成R+和X-时,烷基是正离子。当它形 成格氏试剂后,烷基就变成了负离子,这就叫极性反转。 在逆合成分析中,如拆分的合成元极性与正常的相反,则 必须改变原来目标分子或合成元中的电性,以得到试剂。 有了极性反转这一技术,同一基团即可成正离子,又可成 负离子。这无疑扩大了可能进行的有机合成范围。
有机化学 06第六章 卤代烃2

离去基团的影响:
R-Cl
R-Br
R-I
反应速度增大
6.3.2 消除反应 E (Elimination reaction)
βα
醇
R CH CH 2 + NaOH △
HX
RCH=CH 2 + NaX + H 2O
从分子中脱去一个简单小分子,如HX、H2O等,同时 产生不饱和键的反应称为消除反应。
反应中除α碳脱去X外,在β碳上脱去H,故称为β-消 除反应。
C2H5O- + CH3
CH3 C CH3
Br
[C2H5O-
进攻-H
] H
CH3
CH2 C CH3
Br
CH 3 CH3 C =CH2 + C2H5OH + Br-
SN2反应机理
HO- + CH3Br
[ ] H H HO C Br
进攻-C H
CH3OH + Br-
试剂碱性强,升高温度有利于E2反应。
四、亲核取代反应与消除反应的关系
醇溶液
胺RNH2 + HX
RONO2 + Ag X
硝酸酯
亲核取代反应通式:
RCδ+H2 Xδ- + Nu -
RCH2Nu + X -
反应底物
亲核试剂
产物
离去基团
卤代烷
HO- 、CN- 、 OR-、NH3 ONO-2等
醇、腈、 醚、胺 硝酸酯等
卤素离子
由试剂的负离子部分或未共用电子对去进攻而引
发反应,进攻试剂都有较大的电子云密度,能提供一
写出下列反应的主要产物
CH3
Br NaOH ,C2H5OH
合成子与极性转换

合成子
不饱和吸电子基团影响α-碳上碳氢键的活化
a合成子,产物无官能团。
合成子的加合——a合成子与d合成子的反应
烷基a + 烷基d:
CH3Li
+ (CH3)3SBr
(a)
CH3CH3
+
(CH3)2S +
LiBr
(d)
产物为无官能团化合物。
a1 + d1:
R H OH OH
[H]
+
HCN
R
CN
H
R
NH2
(a1)
(d1)
产物为1,2-双官能团化合物。
反应机理:
因此:
CN
HO
C
-
O
是
的等价物
Example 2:二噻烷碳负离子的形成
醛(如乙醛)可以和1,3-丙二硫醇形成二噻烷。由 于硫对碳负离子具有特殊的稳定性,故邻位的碳有
酸性,用正丁基锂在低温四氢呋喃中处理,得到相
应的亲核性碳负离子。该锂化的碳负离子作为亲核 试剂,可以和卤代烃(溴化苄)、其他羰基化合物 (环己酮)以及环氧乙烷衍生物(苯基环氧乙烷) 等合成子发生亲核取代,生成的产物水解,又得回
的等价物。
合成子极性转换的具体应用
Example 1:安息香缩合反应
安息香缩合是羰基极性转换的代表,也是人们最早知道的极性转 换的例子。反应物苯甲醛中的羰基碳原子是亲电性的。首先发生 氰离子对羰基碳的亲核加成,然后质子由碳转移到氧上,形成一 个碳负离子,其中的碳发生了极性转换,是亲核性的。然后该碳 原子亲核进攻另一分子的苯甲醛的亲电性羰基碳,质子转移,氰 离子离去,得到产物安息香。
O H 3C H O
不饱和吸电子基团影响α-碳上碳氢键的活化
a合成子,产物无官能团。
合成子的加合——a合成子与d合成子的反应
烷基a + 烷基d:
CH3Li
+ (CH3)3SBr
(a)
CH3CH3
+
(CH3)2S +
LiBr
(d)
产物为无官能团化合物。
a1 + d1:
R H OH OH
[H]
+
HCN
R
CN
H
R
NH2
(a1)
(d1)
产物为1,2-双官能团化合物。
反应机理:
因此:
CN
HO
C
-
O
是
的等价物
Example 2:二噻烷碳负离子的形成
醛(如乙醛)可以和1,3-丙二硫醇形成二噻烷。由 于硫对碳负离子具有特殊的稳定性,故邻位的碳有
酸性,用正丁基锂在低温四氢呋喃中处理,得到相
应的亲核性碳负离子。该锂化的碳负离子作为亲核 试剂,可以和卤代烃(溴化苄)、其他羰基化合物 (环己酮)以及环氧乙烷衍生物(苯基环氧乙烷) 等合成子发生亲核取代,生成的产物水解,又得回
的等价物。
合成子极性转换的具体应用
Example 1:安息香缩合反应
安息香缩合是羰基极性转换的代表,也是人们最早知道的极性转 换的例子。反应物苯甲醛中的羰基碳原子是亲电性的。首先发生 氰离子对羰基碳的亲核加成,然后质子由碳转移到氧上,形成一 个碳负离子,其中的碳发生了极性转换,是亲核性的。然后该碳 原子亲核进攻另一分子的苯甲醛的亲电性羰基碳,质子转移,氰 离子离去,得到产物安息香。
O H 3C H O
第六章 植物生长物质

GA
特点
矮生 → 正常
图片
⑴ 促进整株植物生长 ⑵ 促进节间的伸长 ⑶ 不存在超最适浓度的抑制作用
施用5µg GA3 施用 后第7天 后第 天
对照
GA3 对 矮生型 豌豆的 效应
GA3诱导甘蓝茎的伸长 , 诱导产生超长茎
2. 打破休眠
mg· 0.5 — 1 mg L-1 马铃薯
3. 诱导抽苔开花
五、生长素的作用机理 1.生长素作用的酸生长学说— 生长素作用的酸生长学说—
质膜上存在ATP酶 质子泵,生长素作为酶的变构效应剂, 质膜上存在ATP酶-质子泵,生长素作为酶的变构效应剂, ATP 与质子泵的蛋白质结合,并使质子泵活化, 与质子泵的蛋白质结合,并使质子泵活化,把细胞质内 的质子( 分泌到细胞壁去,导致细胞壁环境酸化, 的质子(H+)分泌到细胞壁去,导致细胞壁环境酸化, 一些对酸不稳定的键 对酸不稳定的键( 易断裂。此外, 一些 对酸不稳定的键 ( 如 H键 ) 易断裂 。 此外, 在酸性 环境中,有些存在于细胞壁的水解酶被活化 细胞壁的水解酶被活化, 环境中,有些存在于细胞壁的水解酶被活化,把固定形 式的多糖转变为水溶性单糖, 式的多糖转变为水溶性单糖,使细胞壁纤维素结构间的 交织点断裂、联系松驰、细胞壁变软、可塑性增加。 交织点断裂、联系松驰、细胞壁变软、可塑性增加。由 于生长素和酸性溶液都可同样促进细胞伸长,因此, 于生长素和酸性溶液都可同样促进细胞伸长,因此,把 生长素诱导细胞壁酸化并使其可塑性增大而导致细胞伸 长的理论,称为酸-生长学说(下图) 长的理论,称为酸-生长学说(下图)。
§7-1植物生长物质的概念和种类 §7-2生长素类 §7-3赤霉素类 §7-4细胞分裂素类 §7-5脱落酸 §7-6乙烯 §7-7其它植物生长物质 §7-8植物生长物质在农业生产上的应用
特点
矮生 → 正常
图片
⑴ 促进整株植物生长 ⑵ 促进节间的伸长 ⑶ 不存在超最适浓度的抑制作用
施用5µg GA3 施用 后第7天 后第 天
对照
GA3 对 矮生型 豌豆的 效应
GA3诱导甘蓝茎的伸长 , 诱导产生超长茎
2. 打破休眠
mg· 0.5 — 1 mg L-1 马铃薯
3. 诱导抽苔开花
五、生长素的作用机理 1.生长素作用的酸生长学说— 生长素作用的酸生长学说—
质膜上存在ATP酶 质子泵,生长素作为酶的变构效应剂, 质膜上存在ATP酶-质子泵,生长素作为酶的变构效应剂, ATP 与质子泵的蛋白质结合,并使质子泵活化, 与质子泵的蛋白质结合,并使质子泵活化,把细胞质内 的质子( 分泌到细胞壁去,导致细胞壁环境酸化, 的质子(H+)分泌到细胞壁去,导致细胞壁环境酸化, 一些对酸不稳定的键 对酸不稳定的键( 易断裂。此外, 一些 对酸不稳定的键 ( 如 H键 ) 易断裂 。 此外, 在酸性 环境中,有些存在于细胞壁的水解酶被活化 细胞壁的水解酶被活化, 环境中,有些存在于细胞壁的水解酶被活化,把固定形 式的多糖转变为水溶性单糖, 式的多糖转变为水溶性单糖,使细胞壁纤维素结构间的 交织点断裂、联系松驰、细胞壁变软、可塑性增加。 交织点断裂、联系松驰、细胞壁变软、可塑性增加。由 于生长素和酸性溶液都可同样促进细胞伸长,因此, 于生长素和酸性溶液都可同样促进细胞伸长,因此,把 生长素诱导细胞壁酸化并使其可塑性增大而导致细胞伸 长的理论,称为酸-生长学说(下图) 长的理论,称为酸-生长学说(下图)。
§7-1植物生长物质的概念和种类 §7-2生长素类 §7-3赤霉素类 §7-4细胞分裂素类 §7-5脱落酸 §7-6乙烯 §7-7其它植物生长物质 §7-8植物生长物质在农业生产上的应用
第六章 还原反应

O O 2 Li,NH3(l) Et2O, 33 ¡ æ OLi (1) CH3 H (2) Br CH3 O NH4Cl CH3
CH3
6.3
金属还原剂
3 .以锂(钠)金属将苯还原成双烯类( diene ),称为 Brich 还原反应。此反应需在含质子溶剂中进行。
OCH3 Li,NH3 t BuOH OCH3 H3+O O
6. 2 金属氢化物还原
3. 硼烷(BH3)
硼烷(borane)是由硼氢化钠与三氟化硼制备,以
二硼烷 B2H6(diborane)的形式存在。
3 NaBH4 + 4 BF3
H B H H H B H H
2 B2H6 + 3 NaBF4
硼烷和二硼烷具有 Lewis Acid 的 特性,因此反应性与 NaBH4 或 LiAlH4 不同。 它容易与羧酸及烯烃反应,却 不与酰卤,卤代烷,砜或硝基化合物 等作用。
O H2,(Ph3P)3RhCl PhH, 25 ¡ æ ,1 atm O
6.1 催化氢化(加氢反应)
一般官能团化合物的加氢反应
反应性 最高 反应物 RCOCl RCH2NO2 RC≡CR′ RCHO RCH=CHR′ RCOR′ ArCH2X RC≡N RCO2R′ RCONHR′ 氢化产物 RCHO RCH2NH2 RCH=CHR′(Z,Cis) RCH2OH RCH2CH2R′ RCH(OH)R′ ArCH3 RCH2NH2 RCH2OH + R′OH RCH2NHR
6. 2 金属氢化物还原
1. 氢化锂铝
一般官能团化合物与氢化锂铝 LiAlH4 作用 反应性 最高 C=O COOR 递 减 CN CONR2 C-NO2 CHBr 最低 CH2OSO2Ar 反应物 CHOH CH2OH CH2NH2 CH2NR2 CNH2 CH2 CH3 氢化产物
CH3
6.3
金属还原剂
3 .以锂(钠)金属将苯还原成双烯类( diene ),称为 Brich 还原反应。此反应需在含质子溶剂中进行。
OCH3 Li,NH3 t BuOH OCH3 H3+O O
6. 2 金属氢化物还原
3. 硼烷(BH3)
硼烷(borane)是由硼氢化钠与三氟化硼制备,以
二硼烷 B2H6(diborane)的形式存在。
3 NaBH4 + 4 BF3
H B H H H B H H
2 B2H6 + 3 NaBF4
硼烷和二硼烷具有 Lewis Acid 的 特性,因此反应性与 NaBH4 或 LiAlH4 不同。 它容易与羧酸及烯烃反应,却 不与酰卤,卤代烷,砜或硝基化合物 等作用。
O H2,(Ph3P)3RhCl PhH, 25 ¡ æ ,1 atm O
6.1 催化氢化(加氢反应)
一般官能团化合物的加氢反应
反应性 最高 反应物 RCOCl RCH2NO2 RC≡CR′ RCHO RCH=CHR′ RCOR′ ArCH2X RC≡N RCO2R′ RCONHR′ 氢化产物 RCHO RCH2NH2 RCH=CHR′(Z,Cis) RCH2OH RCH2CH2R′ RCH(OH)R′ ArCH3 RCH2NH2 RCH2OH + R′OH RCH2NHR
6. 2 金属氢化物还原
1. 氢化锂铝
一般官能团化合物与氢化锂铝 LiAlH4 作用 反应性 最高 C=O COOR 递 减 CN CONR2 C-NO2 CHBr 最低 CH2OSO2Ar 反应物 CHOH CH2OH CH2NH2 CH2NR2 CNH2 CH2 CH3 氢化产物
极性和非极性分子PPT课件
H
XY3型 NH3:
N
H
H
三角锥型, 不对称,键的极 性不能抵消,是极性分子
107º18'
BF3: F1
F3
平面三角形,对称,
120º 键的极性互相抵消
F’
第1F7页2/共2(性5页 分F合子=0) ,是非极
H
H
H
H
109º28' C
CCl4
正四面体型 ,对称结构,C-H键的极性 互相抵消( F合=0) ,是非极性分子
NO
第11页/共25页
均为直线型
思考
含有极性键的分子一定是极性分子吗?
分析方法:从力的角度分析
在ABn分子中,A-B键看作AB原 子间的相互作用力,根据中心原子A 所受合力是否为零来判断,F合=0,为 非极性分子(极性抵消), F合≠0, 为极性分子(极性不抵消)
第12页/共25页
O
C
O
C=O键是极性键,但
一、 非极性键和极性键
非极性键:
共用电子对无偏向 (电荷分布均匀)
如:H2(H-H) Cl2(Cl-Cl) N2(N N)
极性键
共用电子对有偏向 (电荷分布不均匀)
如:HCl(H-Cl) H2O(H-O-H)
第3页/共25页
[练习]指出下列物质中的共价键类型
1、O2 2 、CH4 3 、CO2 4、 H2O2 5 、Na2O2 6 、NaOH
从分子总体而言CO2 是直线型分子,两个
C=O键是对称排列的,
两键的极性互相抵消
F1
F合=0
F2
( F合=0),∴整个 分子没有极性,电荷
分布均匀,是非极性
180º
5 合成子与极性转换 华南理工大学

a1 + d1
H
+
HCN
CN
a2 + d1
Br O
+
NaCN
NC O
O
a 3 + d2
O
+
O O
5.4
•
合成子的极性转换的方法
5.4.1 杂原子交换
Br PPh3
Ph3P
-HBr
a1 > d1
Br
MgBr
Mg
O
SH
SH S
S
Base
S S
H
•
5.4.2 引入杂原子
O
d1,2 > a1,2
d
d
RCO3H
d 合成子
• • • • d0 d1 d2 d3 CH3SH KCN CH3CH=O LiC≡CCH2NH2 CH3SCN-CH CH=O 2 -C≡CCH NH 2 2
a 合成子
a0 Me2PCl
+
PMe2
O
O
a1
a2
Br O O
a3
O OH
合成子的加合: d-合成子与a 合成子的反 应
OH O
3
2
CH2OH H
C
C
3;
3) 合成子是否一定实际存在?
1
R R R R R R R R
3
2
CH2OH H
1
C
C
C1/C2
R C R C H
+
CH2OH
3
2
CH2OH H
1
C
C
C1/C2
R C R C H
+
CH2OH
高二化学非极性分子和极性分子PPT优秀课件

第六节 非极性分子和极性分子
一、非极性键和极性键
1、非极性键:共用电子对不发生偏 移 (同种原子间形成的共价键)
非金属单质、过氧化物。如H2、CL2 N2、Na2O2、H2O2
2、极性键:共用电子对发生偏移 (不同原子间形成的共价键) 共价化合物、强碱等
如:HCL、H2O、NH3、NaOH、 NH4Cl
3、配位键:共用电子对由某一 原子单方面提供而与另一原子共 用。 形成条件:是一方有空轨道,另外 一方有孤对电子。
NH4+、H3O+
二、极性分子和非极性分子
1、极性分子:分子中正负电荷中
心不重合,从整个分子来看,电荷 的分布是不均匀的,不对称的,这 样的分子为极性分子。
如HCL、H2O、NH3、H2S、HF
(2)影响不同:化学键影响物质的 化学性质(稳定性),分子间作用力 影响物质的物理性质如熔沸点、溶解 度等。
(3)强度不同:分子间作用力比化 学键弱得多。化学键一般在几十千 焦到几百千焦,分子间作用力一般 在几千焦到十几千焦。
3、影响分子间作用力的因素:结构相似的分 子晶体,分子量大分子间作用力越强。ຫໍສະໝຸດ 2、非极性分子:分子中正负电荷中
心重合,从整个分子来看,电荷的分 布是均匀的,对称的,这样的分子为 非极性分子。 如、N2、CL2、H2
3、判断方法
(1)双原子分子:
极性键形成的双原子分子为极性分 子 HCL 、HF
非极性键形成的双原子分子为非极 性分子 H2、CL2
(2)多原子分子
由极性键构成的多原子分子,如果 结构对称,则为非极性分子。
F2、Cl2、Br2、I2熔沸点顺序为:
4、相似相溶:极性分子易溶于极性溶
剂中;非极性分子易溶于非极性溶剂中。
一、非极性键和极性键
1、非极性键:共用电子对不发生偏 移 (同种原子间形成的共价键)
非金属单质、过氧化物。如H2、CL2 N2、Na2O2、H2O2
2、极性键:共用电子对发生偏移 (不同原子间形成的共价键) 共价化合物、强碱等
如:HCL、H2O、NH3、NaOH、 NH4Cl
3、配位键:共用电子对由某一 原子单方面提供而与另一原子共 用。 形成条件:是一方有空轨道,另外 一方有孤对电子。
NH4+、H3O+
二、极性分子和非极性分子
1、极性分子:分子中正负电荷中
心不重合,从整个分子来看,电荷 的分布是不均匀的,不对称的,这 样的分子为极性分子。
如HCL、H2O、NH3、H2S、HF
(2)影响不同:化学键影响物质的 化学性质(稳定性),分子间作用力 影响物质的物理性质如熔沸点、溶解 度等。
(3)强度不同:分子间作用力比化 学键弱得多。化学键一般在几十千 焦到几百千焦,分子间作用力一般 在几千焦到十几千焦。
3、影响分子间作用力的因素:结构相似的分 子晶体,分子量大分子间作用力越强。ຫໍສະໝຸດ 2、非极性分子:分子中正负电荷中
心重合,从整个分子来看,电荷的分 布是均匀的,对称的,这样的分子为 非极性分子。 如、N2、CL2、H2
3、判断方法
(1)双原子分子:
极性键形成的双原子分子为极性分 子 HCL 、HF
非极性键形成的双原子分子为非极 性分子 H2、CL2
(2)多原子分子
由极性键构成的多原子分子,如果 结构对称,则为非极性分子。
F2、Cl2、Br2、I2熔沸点顺序为:
4、相似相溶:极性分子易溶于极性溶
剂中;非极性分子易溶于非极性溶剂中。
第六章 合成子与极性转换

第六章 合成子与极性转换
第一页,共73页。
6.1 合成子基本理论
• 6.1.1 合成子的概念
合成子(Corey E.J.):凡是能用已知的
,或合理的操作连接成分子的结构单元均称为合成
子。
第二页,共73页。
• Synthons are defined as units which can be joined to (organic) molecules by known or conceivable synthetic operations. (E.J.Corey 1967)
O
+
EtONa
O
O
O
• 其碎片是
:
O
-
不稳定
与
H+
O
实际存在的
第十一页,共73页。
Example 2:用环己烯酮合成β-乙酰基 环己酮
O
O
CH3CO
• 此时的合成子是CH3CO-,但这是不存在的。合成时,必须用它 的对等物,而等价物是实际存在的。
第十二页,共73页。
相关概念:
• 合成等价物:一种能起合成子作用的试剂。 合成子通常由于其本身的不太稳定而不能直 接使用。
正确解:
O
[OH-]
(d2)
O C-
O
+ H3C
H
(a1)
O
O
H3C H
OH O
H2O
H3C H
O
第四十六页,共73页。
• a2 + d2:
O
COOCH3
(d2)
(1)NaOH
(2)H3+O
O
+ Br
CO2CH3
第一页,共73页。
6.1 合成子基本理论
• 6.1.1 合成子的概念
合成子(Corey E.J.):凡是能用已知的
,或合理的操作连接成分子的结构单元均称为合成
子。
第二页,共73页。
• Synthons are defined as units which can be joined to (organic) molecules by known or conceivable synthetic operations. (E.J.Corey 1967)
O
+
EtONa
O
O
O
• 其碎片是
:
O
-
不稳定
与
H+
O
实际存在的
第十一页,共73页。
Example 2:用环己烯酮合成β-乙酰基 环己酮
O
O
CH3CO
• 此时的合成子是CH3CO-,但这是不存在的。合成时,必须用它 的对等物,而等价物是实际存在的。
第十二页,共73页。
相关概念:
• 合成等价物:一种能起合成子作用的试剂。 合成子通常由于其本身的不太稳定而不能直 接使用。
正确解:
O
[OH-]
(d2)
O C-
O
+ H3C
H
(a1)
O
O
H3C H
OH O
H2O
H3C H
O
第四十六页,共73页。
• a2 + d2:
O
COOCH3
(d2)
(1)NaOH
(2)H3+O
O
+ Br
CO2CH3
有机合成中的合成子

+ M eI -L iI
N N M e3 N N M e3
(9 0 % )
(1 0 % )
(1)二甲基腙(二甲氨基)的取向总是远离大基团, (2)并且锂离子倾向于定域在取代基少的碳原子上,因此
有利于立体选择性和区域选择性的形成碳负离子。
3、d3—合成子及等效试剂
2 3
2 3
COOR
O OR
S
C
C C NH2
Li
NH2
C
C COR
HC
C COR
COR
烷基
CH3
CH3Li
a
1
CH3
P(CH3)2
OH C CH3
(CH3)2PCl
O C CH3 CH3
P(CH3)2
a
C
O
O
O
H2C
C
CH3
H2C
C
CH3
Br
a
2
C
O
H2C
CH
H2C
CH2
O CH3
a
3
烷基
CH3
(C H 3 ) 3 O B F 4
N Li
双(三甲硅烷基)氨化锂
H2N
NH K
KAPA
3-氨基丙氨钠
O Li
1,1-二(三甲基硅烷基)-3-甲基丁醇锂
SiMe3 SiMe3
N M e2
CH2
CH
n
N
(2)酮形成d2合成子的区域选择性和立体选择性
动力学控制: 过量的强碱,优先生成酸性大、位阻小的质
子。在取代较少处生成烯醇,反应很快完成。
(R , S ) 0%
注:环状亚砜反应时,对映体产物的选择性比开链亚砜还 要高,硫原子的手性可以更有效的转移到邻近碳原子上。
《细胞生物学》细胞极性 ppt课件

ZO-1、ZO-2、和ZO-3与微丝骨架相联系。
ppt课件
10
This drawing shows the transmembrane claudin and occludin proteins
in a tight junction. The claudins are the main components of the sealing
?scrib复合物功能丧失与肿瘤发生密切相关?par复合物异常激活参与肿瘤的形成?scrib复合物和par复合物相互拮抗功能的失调可能是肿瘤发生的基础?crumbs复合物蛋白异常定位与癌症发生发展密切相关emt?上皮细胞间质转化epithelialmesenchymaltransitionemt过程中细胞顶底极性丧失同时伴随上皮细胞表型的丢失及间质表型前后极性的形成
ctn: catenin; p:phosphorylation
ppt课件
29
ppt课件
30
ppt课件
31
ppt课件
32
ppt课件
33
细胞极性与肿瘤
• 人类大多数的癌变起源于具有顶-底极性的 上皮组织细胞,癌变通常会伴随细胞极性 丧失和组织结构紊乱等表型,因此,细胞 极性丧失是癌症诊断的一个重要指标。
细胞极性 Cell Polarity
ppt课件
1
• 细胞极性(cell polarity):细胞,尤其是组织 中的细胞的三维形态常常不是随机或均匀的, 而会表现出轴向性(axialization),即一个方向 明显不同于其它方向的形态特征。如果一个 细胞中的亚细胞(subcellular)结构或者分子总 是沿着某个或某几个轴向呈不对称分布,这 样的细胞就具有极性。
ppt课件
ppt课件
10
This drawing shows the transmembrane claudin and occludin proteins
in a tight junction. The claudins are the main components of the sealing
?scrib复合物功能丧失与肿瘤发生密切相关?par复合物异常激活参与肿瘤的形成?scrib复合物和par复合物相互拮抗功能的失调可能是肿瘤发生的基础?crumbs复合物蛋白异常定位与癌症发生发展密切相关emt?上皮细胞间质转化epithelialmesenchymaltransitionemt过程中细胞顶底极性丧失同时伴随上皮细胞表型的丢失及间质表型前后极性的形成
ctn: catenin; p:phosphorylation
ppt课件
29
ppt课件
30
ppt课件
31
ppt课件
32
ppt课件
33
细胞极性与肿瘤
• 人类大多数的癌变起源于具有顶-底极性的 上皮组织细胞,癌变通常会伴随细胞极性 丧失和组织结构紊乱等表型,因此,细胞 极性丧失是癌症诊断的一个重要指标。
细胞极性 Cell Polarity
ppt课件
1
• 细胞极性(cell polarity):细胞,尤其是组织 中的细胞的三维形态常常不是随机或均匀的, 而会表现出轴向性(axialization),即一个方向 明显不同于其它方向的形态特征。如果一个 细胞中的亚细胞(subcellular)结构或者分子总 是沿着某个或某几个轴向呈不对称分布,这 样的细胞就具有极性。
ppt课件
化合物的极性与非极性37页PPT

谢谢!
36、自己的鞋子,自己知道紧在哪里。——西班牙
37、我们唯一不会改正的缺点是软弱。——拉罗什福科
xiexie! 38、我这个人走得很慢,但是我从不后退。——亚伯拉罕·林肯
39、勿问成功的秘诀为何,且尽全力做你应该做的事吧。——美华纳
1、不要轻言放弃,否则对不起自己。
2、要冒一次险!整个生命就是一场冒险。走得最远的人,常是愿意 去做,并愿意去冒险的人。“稳妥”之船,从未能从岸边走远。-戴尔.卡耐基。
梦 境
3、人生就像一杯没有加糖的咖啡,喝起来是苦涩的,回味起来却有 久久不会退去的余香。
化合物的极性与非极性 4、守业的最好办法就是不断的发展。 5、当爱不能完美,我宁愿选择无悔,不管来生多么美丽,我不愿失 去今生对你的记忆,我不求天长地久的美景,我只要生生Байду номын сангаас世的轮 回里有你。
40、学而不思则罔,思而不学则殆。——孔子
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第六章 合成子与极性转换
12
相关概念:
• 合成等价物:一种能起合成子作用的试剂。 合成子通常由于其本身的不太稳定而不能直 接使用。
• 试剂:实际使用的代表合成子的化合物。例 如MeI是合成子Me+的试剂。它能在相应的的 合成中起反应,给出中间体或目标分子。它 是合成子的合成等价物。
第六章 合成子与极性转换
第六章 合成子与极性转换
3
其它定义: • 1. 在切断时所得到的概念性的分子碎片,
通常为一个正离子或负离子。它们可以是 相应反应中的一个中间体,也可以不是。 • 2. 指可用于有机反应中的合成单位。是与 反应物(称为试剂reagent)对等的。
第六章 合成子与极性转换
4
• 一)合成子是有机合成反应的基本单元 合成反应最普通的表示方式是,一个正
R
OH
C
R’ CN
24
• 小常识:
氰化氢有剧毒,且挥发性较大(沸点 26.5℃),故在羰基化合物与氰化氢加成时,为 了避免直接使用氰化氢,通常是把无机酸加入醛 (酮)和氰化钠水溶液的混合物中,以便HCN一生 成就立即与醛(酮)作用,但在加酸时应注意控 制溶液的pH值,使之始终偏于碱性(pH约为8), 以利于反应的进行。
C2H5 O C2H5 R-Mg-X
第C六2H章 5合成O子与极C性2H转换5
15
• 当卤代烷分解成R+与X-时,烷基是正离子,当 它通过格式试剂再分解时,烷基就成了负离 子,这就称为极性转换;
• 同一基团既可成为正离子,也可成为负离子。
第六章 合成子与极性转换
16
• 极性转换(英文:Umpolung),也称极性 翻转、极性反转、极性颠倒,指有机化学 中官能团极性的改变,是有机合成重要概 念之一。
第六章 合成子与极性转换
10
Example 1:
O
+
EtONa
O
O
O
• 其碎片是: 不稳定
O
-与
H+
O
第六章 合成子与极性转换
实际存在 的
11
Example 2:用环己烯酮合成β-乙酰基 环己酮
O
O
CH3CO
• 此时的合成子是CH3CO-,但这是不存在的。合成时, 必须用它的对等物,而等价物是实际存在的。
• 此概念首先由德国化学家Dieter Seebach
(迪特尔·泽巴赫)与美国化学家艾里亚
斯·詹姆斯·科里提出,极性转换的英文
名称Umpolung也由德语的Umpolung得来,
意为极性倒转。
第六章 合成子与极性转换
17
• Example:用环己烯酮合成β-乙酰基 环己酮
O
O
O
CH3C -
CH3CO
• 问题:反应机理?
第六章 合成子与极性转换
21
• 实际合成步骤:
O H
NaOH
+ HCN
OH CH3-CH
C2H5OCH=CH2
CN
OC2H5
OC2H5
O C-CH3 CH3-CH H
LiNR2
O C-CH3 CH3-C - H
CN
CN
O
H+
O
CH3CO
第六章 合成目子与标极性分转子换
22
• 6.1.3 合成子与稳定性 • 先看下列分子的拆开:
• 由于CH3CO-是实际不存在的合成子,需要从带正电 的结构体通过极性转换,变成带负电的结构体,但
如何处理?
第六章 合成子与极性转换
18
• 处理方法:
O
A与B
R-C-X
OA R-C-X
B
OA
R-C - + X+
B
OA
O
R-C - +
B
O
H+
OA C RB
第六章 合成子与极性转换
O
H3+O
RC O
离子和一个负离子键接在一起成为一个分 子:
A-
负极性离子 (电负性) 电子供应者
+ B+
正极性离子 (电正性) 电子接受者
A—B
产物分子 (中性)
• A-和B+就可以称为“合成子”。
第六章 合成子与极性转换
5
• 二)合成子的有效性 有机分子的拆解通常有多种拆解方法,如:
O Ph
O
OCH3 OCH3
OCH3
O
OCH3
+ H+
O
第六章 合成子与极性转换
8
• 它们可以通过Michael加成反应合成目标物:
OO
Ph
OCH3 +
OCH3 O
EtONa
O Ph
O
OCH3 OCH3
O
第六章 合成子与实际存在
“合成子”是一个人为的,概念化的名 词,有别于实际存在的起反应的离子、自 由基或分子。合成子可能是实际存在的, 也可能是一个实际不存在的抽象化的东西。
R OH C
R’ X
R
C O + X- + H+
R’
• 这种拆开方法是否可行,要看X-的稳定性。
第六章 合成子与极性转换
23
• 例如:
R
OH
C
R’ CN
R
C O + CN- + H+
R’
• 氰基(CN-)是很稳定的负离子,易与羰基 发生亲核加成反应:
R
C O + CN-
H+
R’
第六章 合成子与极性转换
O
有哪些拆解方法?是否合理?
第六章 合成子与极性转换
6
以下拆解方法那些是合理的?
1
O OCH3
Ph
2
3 O
4
OCH3 O5
有些碎片是有效的,有些是无效的,合成子 是分子拆开后在有机合成中确实有效的碎片。
第六章 合成子与极性转换
7
• 上述分子中只有下列两个碎片才是有效的:
OO
Ph - OCH3
和
+
19
• 技术关键:选用什么样的A与B? • 针对本例:B用-CN,即:
为何不用酸
O
NaOH
OH
H + HCN
CH3-CH
CN
• 问题:反应机理?
第六章 合成子与极性转换
20
• A用:
OC2H5 -C-CH3
H
C2H5OCH=CH2
OH
+ CH3-CH
CN
O
CH3-CH CN
OC2H5 C-CH3 H
13
• 6.1.2 合成子的极性转换 • Example:卤代烷的取代反应
R-X Mg 醚 RMgX
R+ + X-
Nu
R-Nu
亲核反应
R- + MgX+
E
R-E
第六章 合成子与极性转换
亲电反应
14
知识点回顾:
• 格氏试剂:一卤代烷与金属镁在绝对乙醚 (无水、无醇的乙醚)中作用生成有机镁化 合物,产物能溶于乙醚,不需分离即可直接 用于各种合成反应,也称为格利雅试剂。
第六章 合成子与极性转换
第六章 合成子与极性转换
1
6.1 合成子基本理论
• 6.1.1 合成子的概念
合成子(Corey E.J.):凡是能用已 知的,或合理的操作连接成分子的结构单 元均称为合成子。
第六章 合成子与极性转换
2
• Synthons are defined as units which can be joined to (organic) molecules by known or conceivable synthetic operations. (E.J.Corey 1967)
