分子的空间构型
化学键与分子的空间构型

化学键与分子的空间构型化学键是化学中的一个重要概念,它是描述原子之间结合的力。
在化学键的形成中,电子在原子之间转移、共享或重排,从而形成化学键。
通过化学键,原子可以组合成分子,并且这些分子的三维空间构型对它们在化学反应中的性质和活性起着至关重要的影响。
分子的空间构型是指分子中原子的空间排列方式。
原子之间的化学键的性质决定了分子的空间构型。
例如,共价键是由共享电子形成的一种连接形式。
共价键的键长和键角对分子的结构起着重要作用。
不同键长和键角会导致分子的不同构型。
例如,氨分子(NH3)和水分子(H2O)中的键角不同,从而使得氨分子呈现三角锥形构型,而水分子呈现微弯的构型。
除了共价键,离子键也是分子空间构型的一个重要因素。
离子键是由原子之间的电荷吸引力形成的。
正离子和负离子通过电荷吸引力相互结合形成离子键。
离子键的键能较高,使得离子在晶体中排列有序。
这种有序排列决定了离子晶体的空间构型。
例如,氯化钠晶体中,钠离子和氯离子以菱形密堆积的方式排列,形成立方晶系的构型。
另一种常见的化学键类型是金属键。
在金属中,金属原子之间通过顺滑的电子云相互结合形成金属键。
由于金属键的性质,金属具有良好的导电性和导热性。
金属键的强度和金属原子之间的排列方式决定了金属的物理性质和力学性质。
例如,钢中的铁原子通过金属键排列有序,形成具有高强度和韧性的晶格结构。
还有一种特殊的化学键类型是氢键。
氢键是由氢原子与较电负的原子(如氮、氧、氟)之间的电荷吸引力形成的键。
氢键通常较强,但比共价键和离子键弱。
氢键在生物体系中起着重要的作用。
例如,DNA分子的螺旋结构就是由氢键稳定的,这使得DNA能够保存遗传信息。
化学键的性质和分子的空间构型是相互关联的。
化学键的类型和强度决定了分子的整体结构。
分子的空间构型会影响分子的性质和反应性质。
例如,如果一个分子具有线性构型,那么它的极性可能较强,从而影响溶解度和反应性。
此外,分子的空间构型还与分子之间的相互作用有关,从而影响化学反应的速率和选择性。
分子的空间构型(课件PPT)

为平面正三角形。
BF3分子形成
2s
2p
激发 2s
2p
正三角形
B的基态
激发态
F
B
120°
F
F
sp2 杂化态
碳的sp2杂化轨道
sp2 杂 化 : 三 个 夹 角 为 120° 的 平 面 三 角 形 杂 化轨道。
等性sp 杂化
同一原子中 ns-np 杂化成新轨道:一个 s 轨道和一个 p 轨 道杂化组合成两个新的 sp 杂化轨道。
4、教学必须从学习者已有的经验开始。——杜威 5、构成我们学习最大障碍的是已知的东西,而不是未知的东西。——贝尔纳 6、学习要注意到细处,不是粗枝大叶的,这样可以逐步学习摸索,找到客观规律。——徐特立 7、学习文学而懒于记诵是不成的,特别是诗。一个高中文科的学生,与其囫囵吞枣或走马观花地读十部诗集,不如仔仔细细地背诵三百首诗。——朱自清 8、一般青年的任务,尤其是共产主义青年团及其他一切组织的任务,可以用一句话来表示,就是要学习。——列宁 9、学习和研究好比爬梯子,要一步一步地往上爬,企图一脚跨上四五步,平地登天,那就必须会摔跤了。——华罗庚 10、儿童的心灵是敏感的,它是为着接受一切好的东西而敞开的。如果教师诱导儿童学习好榜样,鼓励仿效一切好的行为,那末,儿童身上的所有缺点就会没有痛苦和创伤地不觉得难受地逐渐消失。——苏霍姆林斯基
BeCl2分子形成
2p 2s
2p 2s
激发
直线形 杂化
Be基态
Cl
180
Be Cl
激发态
键合
sp杂化态 直线形
化合态
碳的sp杂化轨道
sp 杂 化 : 夹 角 为 180° 的直线形杂化轨道。
化学分子的空间构型和立体异构体

非对映异构体(非对映体)
01
02
03
定义
在含有两个或多个手性中 心的分子中,具有不同空 间构型的异构体,但它们 不是镜像关系。
性质
非对映异构体具有不同的 物理和化学性质,包括旋 光性、溶解度和生物活性 等。
命名
通常使用系统命名法或习 惯命名法来区分不同的非 对映异构体。
外消旋混合物和内消旋化合物
反应速率
立体异构体在化学反应中的反应 速率可能存在差异,这与其分子
结构和反应机理有关。
反应选择性
立体异构体可能对某些化学反应具 有不同的选择性,即优先发生某种 反应。
稳定性
立体异构体的稳定性可能存在差异 ,这与其分子内的相互作用和能量 状态有关。
生物活性差异
药效差异
在药物化学中,立体异构体可 能具有不同的药效,即治疗作
手性药物合成策略
手性源合成
利用天然手性化合物或手性试剂进行合成,获得具有特定立体构 型的药物分子。
手性助剂法
在反应过程中加入手性助剂,通过与底物形成暂时的手性环境来 引导反应按照特定立体构型进行。
手性催化剂法
利用手性催化剂对底物进行不对称催化反应,获得具有特定立体 构型的产物。
不对称催化反应在药物合成中应用
分子轨道形成原理与能量关系
线性组合原子轨道(LCAO)
01
分子轨道由原子轨道线性组合而成,形成成键轨道、反键轨道
和非键轨道。
能量关系
02
成键轨道能量低于原子轨道,反键轨道能量高于原子轨道,非
键轨道能量与原子轨道相近。
洪特规则与泡利不相容原理
03
在填充分子轨道时,需遵循洪特规则和泡利不相容原理,即电
不对称氢化反应
解析有机物分子中原子共平面、共直线问题_【最全面】

解析有机物分⼦中原⼦共平⾯、共直线问题_【最全⾯】如何分析有机物分⼦中原⼦共平⾯的问题分⼦内原⼦共线、共⾯的判定,仅为⼀维、⼆维想象,但存在线⾯、⾯⾯的交叉,所以有⼀定的难度。
⼀、⼏个特殊分⼦的空间构型1.常见分⼦的空间构型:①CH4分⼦为正四⾯体结构,其分⼦最多有3个原⼦共处同⼀平⾯。
②⼄烯分⼦中所有原⼦共平⾯。
③⼄炔分⼦中所有原⼦共直线。
④苯分⼦中所有原⼦共平⾯。
⑤H—CHO分⼦中所有原⼦共平⾯。
(1)熟记四类空间构型中学有机化学空间结构问题的基⽯是甲烷、⼄烯、⼄炔和苯的分⼦结构。
甲烷型:正四⾯体结构,4个C—H健不在同⼀平⾯上凡是碳原⼦与4个原⼦形成4个共价键时,空间结构都是正四⾯体结构以及烷烃的空间构型 5个原⼦中最多有3个原⼦共平⾯。
⼄烯型:平⾯结构。
六个原⼦均在同⼀平⾯上凡是位于⼄烯结构上的六个原⼦共平⾯。
⼄炔型:直线型结构。
四个原⼦在同⼀条直线上凡是位于⼄炔结构上的四个原⼦共直线。
苯型:平⾯正六边形结构。
六个碳原⼦和六个氢原⼦共平⾯凡是位于苯环上的12个原⼦共平⾯。
(2)理解三键三⾓三键:C—C键可以旋转,⽽C=C键、C≡C键不能旋转。
三⾓:甲烷中的C—H键之间的夹⾓为109°28′,⼄烯和苯环中的C—H键之间的夹⾓为120°,⼄炔中的C—H键之间的夹⾓为180°。
2.单键的转动思想有机物分⼦中的单键,包括碳碳单键、碳氢单键、碳氧单键等可转动。
⼆、结构不同的基团连接后原⼦共⾯分析例1请分析苯⼄炔(C CH)分⼦中最多有多少个原⼦共平⾯?分析:与C CH直接相连的苯环上的碳原⼦相当于C C HH分⼦中1个氢原⼦所处的位置,应与C CH在同⼀条直线上;与苯环相连的C CH中碳原⼦相当于苯分⼦中氢原予所处的位置,应在苯环所在的平⾯内。
由此可知C CH所在直线上有两点在苯环的平⾯内,所以苯⼰炔分⼦中所有原⼦均在同⼀平⾯,即苯⼄炔分⼦中8个碳原⼦、6个氢原⼦均在同⼀平⾯内。
分子的空间构型

SP3杂化
由1个s轨道和3个p轨道混杂并重新组合成4个能量 与形状完全相同的轨道。由于每个轨道中都含有1/4 的s轨道成分和3/4的p轨道成分,因此我们把这种轨 道称之为 sp3杂化轨道。
为了四个杂化轨道在空间尽可能远离,使轨道间的排 斥最小,四个杂化轨道的伸展方向分别指向正四面体 的四个顶点.
种轨道称之为sp2杂化轨道。
sp2杂化轨道的形成和空间取向示意图
sp2杂化轨道的形成和特点:
由1个s轨道与2个p轨道组合成3个sp2 杂化轨
道的过程称为sp2 杂化。每个sp2 杂化轨道中含有1/3 的s轨道成分和2/3的p轨道成分。
为使轨道间的排斥能最小,3个sp2杂化轨道呈正 三角形分布,夹角为1200。当3个sp2杂化轨道分别与 其他3个相同原子的轨道重叠成键后,就会形成平面 三角形构型的分子。
SP 2 2 180° 直线形 BeCl2 CO2 HgCl2 [Ag(NH3)2]+
SP2 3 3 120° 平面三 角形 BF3 COCl2 NO3— CO32—
SP3 4 4 109.5° 四面体 CH4 CCl4 CHCl3 PO43— 三角 双锥 PCl5 八面体 SF6
价电子 对数目 杂化类 型 理想几 何构型
注:在化合物中以等电子观点看:O- 和F、Cl、NH2相当,O和CH2、NH相当。 则:
NO2 NOCl NO3 NO2 Cl
1个O 换 成 1个Cl
-
1个O 换 成1个Cl
-
CO3 COCl2
CH 3CH 2 CH 3 CH 3OCH 3
第一单元
分子构型与物质的性质
一 分子的空间构型
分子的空间构型 三原子分子的空间构型有直线型和V型两种.如 CO2分子为直线型,而水的空间构型为V型,键角为 104.5°
分子的空间构型(cc)

交流与讨论:
s轨道和p轨道参加的杂化,其杂化类型除了sp3杂化外,还 有sp2杂化、sp杂化等,杂化轨道的空间分布见课本图4—4。
结合BF3和BeCl2分子模型的动画,请思考下列问题: 1、为了满足生成BF3和BeCl2的要求,B、Be原子的价电子排
2、杂化轨道理论为我们认识、理解分子的 空间构型打开了一扇窗户。
激发态
sp2 杂化轨 (道平面正三角形)
三、Be原子 sp 杂化和BeCl2分子的空间构型
2p
2p
2p
2s
激发 2s
பைடு நூலகம்杂化
Be原子的基态
激发态
sp杂化轨道 (直线型)
科学探究:
试用杂化轨道理论分析乙烯和乙炔分子的成 键情况。(提示:杂化轨道只用于形成σ键或用 来容纳未参与成键的孤对电子)
1、C原子的价电子排布应如何改变?请用轨 道表示式表示C原子的价电子结构的改变。
2、C原子各用哪几个原子轨道参与杂化?形 成了几个什么类型的杂化轨道?
3、试分析C2H4和C2H2分子中共价键的成键情 况以及分子的空间构型。
请注意分析分子中π键(两个原子p轨道和p 轨道“肩并肩”的重叠)的形成
本课小结:
1、本堂课学习了sp3、sp2和sp三种主要的 原子轨道杂化的类型,通过杂化轨道理论很好的 解释了CH4、BF3、BeCl2和C2H4等常见分子的空间 构型。
布应如何改变?用轨道表示式表示B、Be原子的价电子结构的改 变。
2、B、Be原子各用哪几个原子轨道参与杂化?形成了几个 什么类型的杂化轨道?
3、试分析BF3和BeCl2分子中共价键的成键情况以及分子的 空间构型。
《分子的空间构型》PPT课件

2、下列各组分子中,都属于含有
极性键的非极性分子的是( C ) 3 A CH4和Br2 B NH3和H2O
4 C C2H4和CO2 D H2S和
C2H2
3 、下列分子中:SO2、SiF4、H2S、 H分2子O2的、NSiHF34、、BPFC3l3,、属BF于3,极属性于分非子极的性有
SO2、H2S、H2O2、NH3、PCl3
[探究一] 用毛皮摩擦的玻璃棒靠近 CCl4液流,观察现象
[探究二] 用上述橡胶棒靠近水流, 观察现象
编辑ppt
7
二、分子的极性
[问题组一]
1.水分子中氧原子和氢原子得电子能力 相比哪个强,为什么?
2.哪个原子带负电荷,哪个原子带正电 荷?
3.正电荷的重心和负电荷的重心分别在空间 的哪个位置,是否重叠?
分子极性
X2Y型 CO2
SO2
极性键
非极性分子
直线型
极性键 角形
极性分子
类型 实例
结构
XY3型 BF3
NH3
键的极性 分子极性
极性键
非极性分子
平面三角形
极性键
极性分子
三角锥形
判断非极性分子和极性分子子 HCl,CO,NO 非极性键→非极性分子 H2,O2,N2
多原子分子
4.四氯化碳和水的空间结构有什么区别?
5.为什么水分子有正负极而四氯化碳不存 在?
水和四氯化碳
编辑ppt
10
二、非极性分子和极性分子
(一) 非极性分子:整个分子的电荷分 布均匀的、正负电荷重心重合的分 子是非极性分子。如: H2、Cl2、N2、 O2等。
二、非极性分子和极性分子
(二) 极性分子:整个分子中电荷分 布不均匀、正负电荷重心不重合的分 子叫做极性分子。 如:HCl、H2O、NH3等。
分子的空间构型

注:杂化轨道一般形成σ 键,π 键是由没有杂化的p轨道形成。
一、常见的杂化轨道类型
杂化类型 参与杂化的轨道 形成的杂化轨道数目
sp
1个S、1个P 2 直线形 180°
sp2
1个S、2个P 3
sp3
1个S、1个P 4 正四面体
杂化轨道空间构型
键 实 角 例
平面正三角形
120°
10928'
CH4
BeCl2、CH≡CH BF3、CH2=CH2
分 子 类 型
电子对的排布 方式
分子构型
实 例
4
0
AB4
正四面体
CH4
4
四面 体
3
1
AB3
三角锥形
NH3
2
2
AB2
角形
H2O
价层 电子 对数
价层 电子 对排 布
成键 电子 对数
孤对 电子 对数
分子 电子对的排 分子构型 类型 布方式
实 例
5 4 5 三角 双锥 3
0 1
AB5 AB4
三角双锥 变形四面 体
注:杂化轨道一般形成σ 键,π 键是由没有杂化的p轨道形成。
C2H2分子形成
C原子在形成乙炔分子时,每个碳原子的2s轨道 与1个2p轨道发生杂化,形成2个sp杂化轨道,形成 直线型。
2s 2p 激发 2s 2p 杂化 直线形
C的基态
激发态
sp杂化态
每个碳原子1个sp杂化轨道与1个氢原子的1s轨道 结合形成1个C—Hσ 键。各自剩余的1个sp杂化轨道相互 形成1个C—Cσ 键。2个碳原子的未杂化2p轨道分别在Y 轴和Z轴方向重叠形成2个C—Cπ 键。所以乙炔分子中叁 键由1个σ 键和2个π 键构成。
判断分子空间几何构型的简单方法
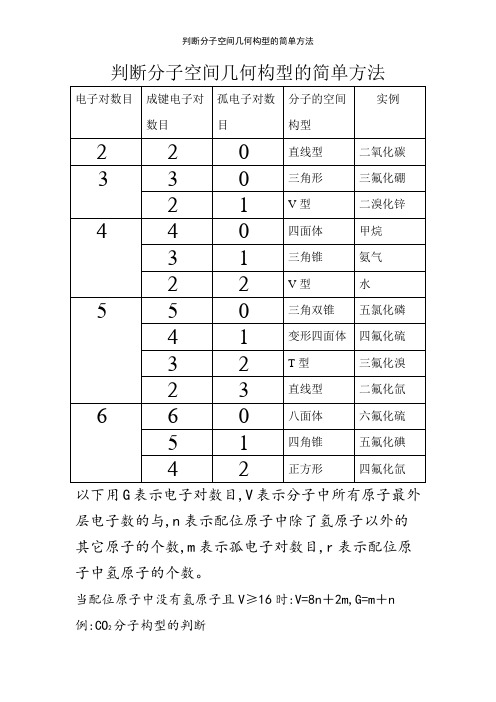
判断分子空间几何构型的简单方法以下用G表示电子对数目,V表示分子中所有原子最外层电子数的与,n表示配位原子中除了氢原子以外的其它原子的个数,m表示孤电子对数目,r表示配位原子中氢原子的个数。
当配位原子中没有氢原子且V≥16时:V=8n+2m,G=m+n 例:CO2分子构型的判断V=4+6×2=8n+2m,这里n=2,∴m=0,∴G=m+n=0+2=2,所以CO2的分子构型为直线型BF3分子构型的判断V=3+7×3=8n+2m,这里n=3,∴m=0,∴G=m+n=0+3=3,所以BF3的分子构型为三角形PCl5分子构型的判断V=5+7×5=8n+2m,这里n=5,∴m=0,∴G=m+n=0+5=5,所以PCl5的分子构型为三角双锥SF4分子构型的判断V=6+7×4=8n+2m,这里n=4,∴m=1,∴G=m+n=1+4=5,所以SF4的分子构型为变形四面体BrF3分子构型的判断V=7+7×3=8n+2m,这里n=3,∴m=2,∴G=m+n=2+3=5,所以BrF3的分子构型为T型SF6分子构型的判断V=6+7×6=8n+2m,这里n=6,∴m=0,∴G=m+n=0+6=6,所以SF6的分子构型为八面体XeF4分子构型的判断V=8+7×4=8n+2m,这里n=4,∴m=2,∴G=m+n=2+4=6,所以XeF4的分子构型为正方形当配位原子中有氢原子且V<16时:V=2r+8n+2m, G=m+n+r。
例:CH4分子构型的判断V=4+1×4=2r+8n+2m,这里r=4,n=0,∴m=0, ∴G=m+n+r=0+0+4=4,所以CH4的分子构型为四面体NH3分子构型的判断V=5+1×3=2r+8n+2m,这里r=3,n=0,∴m=1,∴G=m+n+r=1+0+3=4,所以NH3的分子构型为三角锥 H2O分子构型的判断V=6+1×2=2r+8n+2m,这里r=2,n=0,∴m=2,∴G=m+n+r=2+0+2=4,所以H2O的分子构型为V型HClO分子构型的判断V=1+7+6=2r+8n+2m,这里r=1,n=1,∴m=2,∴G=m+n+r=2+1+1=4,所以HClO的分子构型为V型HNO分子构型的判断V=1+5+6=2r+8n+2m,这里r=1,n=1,∴m=1,∴G=m+n+r=1+1+1=3,所以HNO的分子构型为V型HCN分子构型的判断V=1+4+5=2r+8n+2m,这里r=1,n=1,∴m=0,∴G=m+n+r=0+1+1=2,所以HCN的分子构型为直线型注:以上所介绍的方法只有当V为偶数时才适用,当V为奇数时,只需将V与G瞧成比它们大1的偶数即可!。
分子的空间构型与分子性质 PPT课件

2s
2p
激发 2s
2p
正四面体形
C的基态
H
C
H
H
H
激发态
109.5°
sp3 杂化态
等性sp3 杂化
原子形成分子时,同一个原子中能量相近的一个 ns 轨道与三个 np 轨道进行混合组成四个新的原子轨道称为 sp3 杂化轨道。
sp3杂化: 三个夹角为109 28 ′的正 四面体型形杂化轨道。
等性sp2 杂化
价层电子对数
2
3
4
5
6
电子对排布方式 直线形 平面三角形 四面体 三角锥 八面体
价层电子对互斥理论的应用实例
(一) CH4 的空间构型
在CH4 中,C 有4个电子,4个H 提供4个电子,C 的价 层电子总数为8个,价层电子对为4对 。C 的价层电子对 的排布为正四面体,由于价层电子对全部是成键电子对, 因此 CH4 的空间构型为正四面体。
价层 电子 对数
价层
电子
对排 布
成键 电子 对数
孤对 电子 对数
分子 电子对的排 分子构型 类型 布方式
实例
5
0 AB5
三角双锥 PCl5
4 三角 5 双锥
3
1 AB4 2 AB3
变形四面 体
SF4
T形
ClF3
2
3 AB2
直线形
I
3
价层 价层电 成键 孤对 分子 电子对的排 分子构型 实 例
电子 子对排 电子 电子 类型 布方式
极性分子和非极性分子
极 性 分 子:分子中正负电荷中心不重合,从整个分子来电 荷的分布是不均匀的,不对称的,这样的分子为 极性分子。
非极性分子:分子中正负电荷中心重合,从整个分子来看, 电荷的分布是均匀的,对称的,这样的分子为极 性分子。
判断分子空间几何构型的简单方法
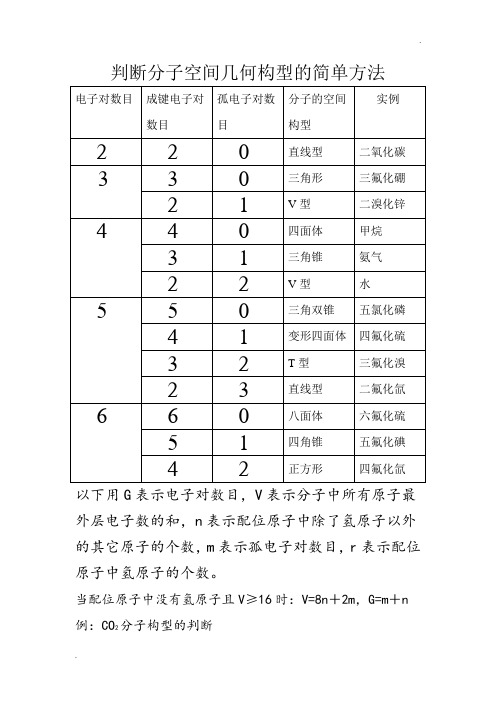
判断分子空间几何构型的简单方法以下用G表示电子对数目,V表示分子中所有原子最外层电子数的和,n表示配位原子中除了氢原子以外的其它原子的个数,m表示孤电子对数目,r表示配位原子中氢原子的个数。
当配位原子中没有氢原子且V≥16时:V=8n+2m,G=m+n 例:CO2分子构型的判断V=4+6×2=8n+2m,这里n=2,∴m=0,∴G=m+n=0+2=2,所以CO2的分子构型为直线型BF3分子构型的判断V=3+7×3=8n+2m,这里n=3,∴m=0,∴G=m+n=0+3=3,所以BF3的分子构型为三角形PCl5分子构型的判断V=5+7×5=8n+2m,这里n=5,∴m=0,∴G=m+n=0+5=5,所以PCl5的分子构型为三角双锥SF4分子构型的判断V=6+7×4=8n+2m,这里n=4,∴m=1,∴G=m+n=1+4=5,所以SF4的分子构型为变形四面体BrF3分子构型的判断V=7+7×3=8n+2m,这里n=3,∴m=2,∴G=m+n=2+3=5,所以BrF3的分子构型为T型SF6分子构型的判断V=6+7×6=8n+2m,这里n=6,∴m=0,∴G=m+n=0+6=6,所以SF6的分子构型为八面体XeF4分子构型的判断V=8+7×4=8n+2m,这里n=4,∴m=2,∴G=m+n=2+4=6,所以XeF4的分子构型为正方形当配位原子中有氢原子且V<16时:V=2r+8n+2m, G=m+n+r。
例:CH4分子构型的判断V=4+1×4=2r+8n+2m,这里r=4,n=0,∴m=0,∴G=m+n+r=0+0+4=4,所以CH4的分子构型为四面体NH3分子构型的判断V=5+1×3=2r+8n+2m,这里r=3,n=0,∴m=1,∴G=m+n+r=1+0+3=4,所以NH3的分子构型为三角锥 H2O分子构型的判断V=6+1×2=2r+8n+2m,这里r=2,n=0,∴m=2,∴G=m+n+r=2+0+2=4,所以H2O的分子构型为V型HClO分子构型的判断V=1+7+6=2r+8n+2m,这里r=1,n=1,∴m=2,∴G=m+n+r=2+1+1=4,所以HClO的分子构型为V型HNO分子构型的判断V=1+5+6=2r+8n+2m,这里r=1,n=1,∴m=1,∴G=m+n+r=1+1+1=3,所以HNO的分子构型为V型HCN分子构型的判断V=1+4+5=2r+8n+2m,这里r=1,n=1,∴m=0,∴G=m+n+r=0+1+1=2,所以HCN的分子构型为直线型注:以上所介绍的方法只有当V为偶数时才适用,当V 为奇数时,只需将V和G看成比它们大1的偶数即可!。
分子的空间构型杂化轨道理论

难以给出精确的预测。
杂化轨道理论的发展方向
扩展到非共价分子
发展能够适用于非共价分 子的杂化轨道理论,以更 好地解释金属、离子等分 子的性质。
引入量子力学
将量子力学原理与杂化轨 道理论相结合,以更精确 地描述电子行为和分子性 质。
复杂分子结构研究
深入研究复杂分子结构, 发展更精确的模型和方法, 以解释和预测复杂分子的 性质和行为。
杂化后的轨道称为杂化轨道,它们具有与原始原子轨道不同的形状和取向,可以与其他原子 轨道相互作用形成更稳定的化学键。
杂化轨道理论可以用来预测分子的空间构型和化学键的性质,是现代化学键理论的重要组成 部分。
杂化轨道理论的发展历程
01
1930年代
德国化学家鲍林和美国化学家斯莱特提出了杂化轨道理论的基本概念,
杂化轨道理论在化学反应机理、物质结构和性质预测等方 面具有广泛的应用。通过了解分子的杂化方式,可以预测 分子的性质和反应活性,从而指导化学反应的设计和合成 。
在药物设计和材料科学中,了解分子的杂化方式对于预测 分子的生物活性、稳定性、导电性等性质至关重要。通过 合理设计分子的杂化方式,可以开发出具有特定功能的新 型药物或材料。
3
分子所处的环境
温度、压力、溶剂等环境因素对分子构型有一定 影响。
分子构型与化学反应的关系
01
02
03
反应活性
某些特定的分子构型有利 于化学反应的进行,如碳 正离子的平面构型更易发 生亲电取代反应。
选择性
在某些化学反应中,特定 的分子构型可能导致产物 具有更高的选择性。
反应机理
分子构型影响化学反应的 机理,如环己烯的椅式构 型有利于顺式加成反应的 进行。
分子的空间构型杂化轨道理论
分子的空间构型 PPT

BeCl2分子形成
2p 2s
2p
2s 激发
杂化 直线形
Be基态
180
Cl Be
激发态
Cl
键合
sp杂化态 直线形
化合态
根据以下事实总结:如何判断一个化合物 的中心原子的杂化类型?
sp3
C-C
sp2
C=C
sp
C≡C
2、判断中心原子的杂化类型一般方法
(1)看中心原子有没有形成双键或叁键,如果有1 个叁键,则其中有2个π键,用去了2个p轨道,形成 的是sp杂化;如果有1个双键则其中有1个π键,形成 的是sp2杂化;如果全部是单键,则形成的是sp3杂化。
思考:CH4、H2O、NH3分子中的中心原 子均采用SP3杂化,但为何键角存在差异?
等电子体原理
具有相同的通式——ABm,而且价电子总数相等的分子 或离子具有相同的结构特征,这个原理称为“等电子体原理”。 这里的“结构特征”的概念既包括分子的立体结构,又包括 化学键的类型,但键角并不一定相等,除非键角为180或90 等特定的角度。
2s
2p
激发 2s
2p
杂化 正四面体形
C的基态
H
C
H
H
H
激发态
109°28’
sp3 杂化态
sp3 杂化
原子形成分子时,同一个原子中能量相近的一个 ns 轨道与三个 np 轨道进行混合组成四个新的原子轨道称为 sp3 杂化轨道。
SP2
思考题:为了满足生成BF3和BeCl2的 要求,B和Be原子的价电子排布应如何改 变?用轨道式表示B和Be原子的价电子结 构的改变。
CO2 和 N2O 。
Li Be B C N O F Ne
分子的空间构型_杂化轨道理论

3
AB3 三角锥形
等电子体原理
具有相同的通式——ABm,而且价电子总数和原子数目 相等的分子或离子具有相同的结构特征,这个原理称为“等电 子体原理”。这里的“结构特征”的概念既包括分子的立体 结构,又包括化学键的类型,但键角并不一定相等,除非键 角为180或90等特定的角度。
(1)CO2、CNS–、NO2+、N3–具有相同的通式—AX2, 价电子总数16,具有相同的结构—直线型分子,中心原子上 没有孤对电子而取sp杂化轨道,形成直线形s-骨架,键角为 180。
(4)SO42–、PO43–等离子具有AX4的通式,总价电子数 32,中心原子有4个s-键,故取sp3杂化形式,呈正四面体立 体结构;
(5)PO33–、SO32–、ClO3–等离子具有AX3的通式,总 价电子数26,中心原子有4个s-轨道(3个s-键和1对占据s-轨 道的孤对电子),VSEPR理想模型为四面体,(不计孤对电 子的)分子立体结构为三角锥体,中心原子取sp3杂化形式, 没有p-pp键或p-p大键,它们的路易斯结构式里的重键是 d-p大键。
n=1/2[A的价电子数+X提供的价电子数×m
原则:
±离子电荷数
②配体X:H和卤素每个原子各提供一个价电 子, 规定氧与硫不提供价电子;
③正离子应减去电荷数,负离子应加上电荷数。
•确定电子对的空间构型: n=2 直线形 n=3 平面三角形 n=4 正四面体
•确定中心原子的孤对电子对数,推断分子 的空间构型。
平面 三角形
109.5º 正四面体
杂化轨道 数目
2
3
4
思考
BF3分子形成过程
2s
2p
激发 2s
2p
正三角形
分子构型的名词解释

分子构型的名词解释分子构型是指分子中原子的空间排列方式,描述分子在空间中的形态和几何结构。
分子构型的研究对于了解物质的性质、反应行为和相互作用至关重要。
本文将就分子构型的概念、分子构型的影响因素、分子构型与化学性质的关系进行探讨。
一、概念解析分子构型是指分子中各个原子的相对位置和它们之间的化学键的结合方式。
分子构型可以通过三维空间中的坐标来描述,即通过原子之间的距离、角度和二面角来确定。
分子构型的确定需要考虑到各个原子的电子云排布,以及原子间的电子云相互作用。
分子构型的不同可以导致化学性质和物理性质的差异。
二、影响因素分子构型的形成受到许多因素的影响,其中包括分子内部的原子数目、原子的电子排布、键长、键角等。
首先,分子内原子的数目决定了构型的复杂性,例如含有较少原子的分子可能只有线性或平面结构,而含有更多原子的分子可以存在更多种构型。
其次,原子的电子排布会影响到构型的稳定性,例如电子云的密度分布不均匀可能导致分子的形状扭曲。
此外,化学键的存在与否以及键长、键角的大小也会对分子构型产生重要影响。
三、构型与化学性质分子构型与化学性质之间存在着紧密的联系。
分子构型决定了分子的立体异构体是否存在,而立体异构体的存在又决定了分子的一些物理和化学性质。
例如,支链构型的烷烃与直链构型的烷烃具有不同的沸点和溶解度,这是由于它们的分子构型导致的。
此外,分子构型也可以影响分子之间的相互作用及反应行为。
例如,分子构型的扭曲可能导致化学键的断裂难度增加,从而影响反应速率与选择性。
四、应用前景分子构型的研究具有广阔的应用前景。
在新材料的设计和合成过程中,分子构型的优化可以帮助寻找最稳定和最理想的结构,从而实现目标性能。
此外,分子构型的研究也对药物设计、生物化学和环境科学等领域具有重要意义。
例如,通过研究分子构型,可以深入理解药物与生物体分子之间的作用机制,从而指导新药的开发和优化。
对于环境科学来说,分子构型的研究可以帮助解析和预测环境污染物的传输和转化过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
P4
正四面体
C2H2
直线形 180°
60°
同为三原子分子,CO2 和 H2O 分子的空间结构却不 同,什么原因?
同为四原子分子,CH2O与 NH3 分子的的空 间结构也不同,什么原因?
二、价层互斥理论
1.内容
对ABm型的分子或离子,中心原子A价层电子对 (包括成键σ键电子对和未成键的孤对电子对)之 间由于存在排斥力,将使分子的几何构型总是采取 电子对相互排斥最小的那种构型,以使彼此之间斥 力最小,分子体系能量最低,最稳定。
氧和硫作为配位原子按不提供电子计算。
阳离子:中心原子的最外层电子数减去离子 的电荷数;
阴离子: 中心原子的最外层电子数加上离子 的电荷数)
二、价层互斥理论
剖析内容
排斥力最小 对ABn型的分子或离子,中心原子A价层电子对 (包括成键σ键电子对和未成键的孤对电子对)之 间由于存在排斥力,将使分子的几何构型总是采取 电子对相互排斥最小的那种构型,以使彼此之间斥 力最小,分子体系能量最低,最稳定。
ห้องสมุดไป่ตู้ 课堂练习:
1、多原子分子的立体结构有多种,三原子分子的立体结构有__ _直线 形和 V 形,大多数四原子分子采取 平面三角 形和 _ 三角锥 形两种立体结构,五原子分子的立体结构中最常见的是 __ 正四面体 形。 D 2 、下列分子或离子中,不含有孤对电子的是 ___ A、H2O、B、H3O+、C、NH3、D、NH4+ 3 、下列分子①BCl3、②CCl4、③H2S、④CS2中,其键角由小到大 ③②①④ 的顺序为___ 4、以下分子或离子的结构为正四面体,且键角为109°28′ 的是_ C ___ ①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42A、①②③ B、①②④ C、①②⑤ D、①④⑤
2
2
AB2
知识拓展二:
三.等电子原理
具有相同价电子数(价电子总数)和相同 原子数的分子或离子具有相同的结构特征, 这一原理称为“等电子原理”。
1.若ABn型分子的中心原子A上没有未用于形 成共价键的孤对电子,运用价层电子对互斥模 型,下列说法正确的(C ) A.若n=2,则分子的立体构型为V形 B.若n=3,则分子的立体构型为三角锥形 C.若n=4,则分子的立体构型为正四面体形 D.以上说法都不正确 D 2.用价层电子对互斥模型判断SO3的分子构型 __ _ A、正四面体形 B、V形 C、三角锥形 D、平面 三角形
0 AB2 0 AB3
直线形
CO2 BeCl2
CH2O BF3 CO32SO2
平面三角形 V形
2 1 AB2
价 VSEPR 层 模型 电 子 对 数
成键 电子 对数
孤对 电子 对数
分 子 类 型
实 例
电子对的排布 模型 分子构型
4
4
正四 面 体
0 1
AB4 AB3
3
CH4 正四面体 SiCl4 CH4 NH4+ NH3 三角锥形 NCl3 SO32V形 H2O H2 S
分子的空间构型
第一课时 价层互斥理论
厦大附中 罗丹
一、形形色色的分子
1、三原子分子立体结构
CO2
直线形
H2O
V形 105°
180°
一、形形色色的分子
2、四原子分子立体结构
HCHO
平面三角形
NH3
三角锥形
120°
107°
一、形形色色的分子
3、五原子分子立体结构
正四面体
CH4
一、形形色色的分子
4、其它
A
二、价层互斥理论
3.价电子对的空间构型即VSEPR模型
电子对数目:2 VSEPR模型: 直线
3
平面三角形
4
正四面体
二、价层互斥理论
中心原子的孤对电子也要占据中心原子的空间,并与成 4. VSEPR模型应用——预测分子立体构型 键电子对互相排斥。推测分子的立体模型必须略去 VSEPR模型及名称 分子的立体 VSEPR 分子或 模型中的孤电子对 价层电子对 离子 数 构型及名称 CO2 O O C 2
2 3 4
2 1 0
4 4 4 2
2
0
价层电子对数 =δ键个数+中心原子上的孤对电子对个数 δ键电子对数 = 与中心原子结合的原子数
•分子中价层电子对数的确定:
以ABm为例 (A—中心原子,B—配位原子) :
[A的价电子数+B提供的价电子数×m] n= 2
配位原子中卤素原子、H原子提供1个价电子,
直线形
直线形
CO3 SO2
2-
O
3
O
平面三角形
平面三角形
O
C
O
S
3
平面三角形
V形O
二、价层互斥理论
4.价电子对的空间构型即VSEPR模型应用
分子或 离子 价层电子对数 VSEPR模型及名 分子的立体构 称 型及名称
H
CH4
NH3
4
正四面体
H
C
H
H 正四面体
4 H2O
N
正四面体
H H
三角锥形
O H
H
二、价层互斥理论
2.价层电子对(σ键电子对和未成键的孤对电子对)
代表 物 H2O NH3 CH4 CO2 电子式 H :O:H H : N :H H H H : C :H H : : :O::C::O: : : : :: : 中心原子结合 σ键电子 孤对电 价层电 原子数 对 子对 子对数
2 3 4 2
4
正四面体
H
V形
应用反馈
化学式
价层电子对数
VSEPR模型
空间构型 V形 平面三角形 V形
H2S BF3 NH2SO42-
4
四面体 平面三角形 四面体
3
4
ABn 型分子的VSEPR模型和立体结构
价 成 孤 层 VSEPR 键 对 分子 电子对的排 电 电 电 类型 布模型 立体结构 子 模型 子 子 对 对 对 数 数 数 2 直线 2 形 平面 3 3 三角 形 实 例
