pH温度
pH标准缓冲溶液(pH=10.00)
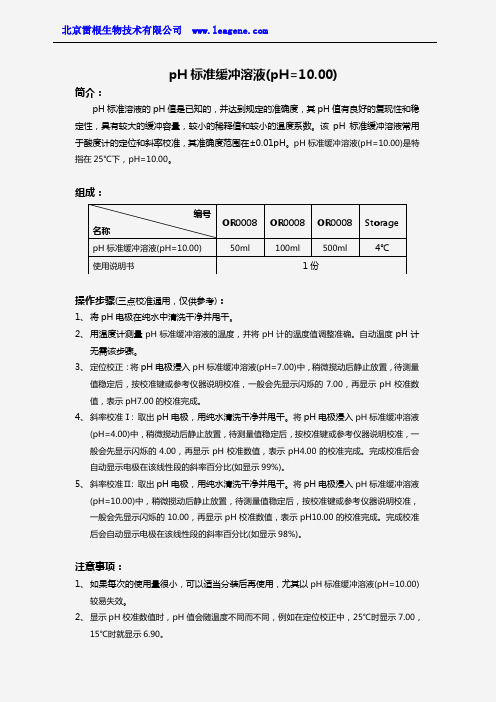
pH 标准缓冲溶液(pH=10.00)简介:pH 标准溶液的pH 值是已知的,并达到规定的准确度,其pH 值有良好的复现性和稳定性,具有较大的缓冲容量,较小的稀释值和较小的温度系数。
该pH 标准缓冲溶液常用于酸度计的定位和斜率校准,其准确度范围在±0.01pH 。
pH 标准缓冲溶液(pH=10.00)是特指在25℃下,pH=10.00。
组成:操作步骤(三点校准通用,仅供参考):1、 将pH 电极在纯水中清洗干净并甩干。
2、 用温度计测量pH 标准缓冲溶液的温度,并将pH 计的温度值调整准确。
自动温度pH 计无需该步骤。
3、 定位校正:将pH 电极浸入pH 标准缓冲溶液(pH=7.00)中,稍微搅动后静止放置,待测量值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的7.00,再显示pH 校准数值,表示pH7.00的校准完成。
4、 斜率校准Ⅰ: 取出pH 电极,用纯水清洗干净并甩干。
将pH 电极浸入pH 标准缓冲溶液(pH=4.00)中,稍微搅动后静止放置,待测量值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的4.00,再显示pH 校准数值,表示pH4.00的校准完成。
完成校准后会自动显示电极在该线性段的斜率百分比(如显示99%)。
5、 斜率校准Ⅱ: 取出pH 电极,用纯水清洗干净并甩干。
将pH 电极浸入pH 标准缓冲溶液(pH=10.00)中,稍微搅动后静止放置,待测量值稳定后,按校准键或参考仪器说明校准,一般会先显示闪烁的10.00,再显示pH 校准数值,表示pH10.00的校准完成。
完成校准后会自动显示电极在该线性段的斜率百分比(如显示98%)。
注意事项:1、 如果每次的使用量很小,可以适当分装后再使用,尤其以pH 标准缓冲溶液(pH=10.00)较易失效。
2、 显示pH 校准数值时,pH 值会随温度不同而不同,例如在定位校正中,25℃时显示7.00,15℃时就显示6.90。
ph电极温度补偿

ph电极温度补偿在电化学测量中,PH电极温度补偿是一种常见的技术,用于校正PH值随温度变化而产生的影响。
PH值是指溶液中氢离子浓度的负对数,而温度的变化可能会影响溶液中离子的活性,从而影响PH值的准确性。
以下是PH电极温度补偿的基本原理和方法:原理:PH电极的响应是温度敏感的,通常随着温度的升高,电极的响应也会变化。
为了准确测量PH值,需要对测量进行温度补偿,以消除温度变化对PH值测量的影响。
方法:1.温度补偿电路:•现代PH测量仪器通常配备了内置的温度传感器和温度补偿电路。
•温度传感器监测溶液的温度变化,并将这一信息传递给温度补偿电路。
2.温度补偿算法:•温度补偿电路使用特定的算法来调整PH测量,以确保在不同温度下测量的PH值是准确的。
•常见的温度补偿算法包括Nernst方程的扩展,以考虑温度对PH电极响应的影响。
3.校准:•在使用PH电极进行测量之前,通常需要在不同温度下进行校准。
•使用标准缓冲溶液(pH 4.01、7.00、10.01等)在不同温度下进行校准,以确保仪器能够正确地进行温度补偿。
4.参考温度:•一些PH测量仪器提供用户选择参考温度的选项。
在这种情况下,用户可以选择将PH值温度补偿到特定的参考温度。
5.外部温度补偿:•在某些情况下,用户可能需要手动进行外部温度补偿,特别是当PH电极不配备内置温度传感器时。
•外部温度传感器可以通过外部连接与PH测量仪器相连,用户需要手动输入温度数据或使用仪器提供的温度传感器。
PH电极的温度补偿是确保PH测量准确性的重要步骤,特别是在变化较大的温度环境中。
确保PH测量仪器正常运行,并根据制造商的建议进行校准和维护,以确保准确和可靠的PH测量。
标准缓冲液pH值与温度对照表

标准缓冲液pH值与温度对照表温度℃四草酸氢钾 0。
05M邻苯二甲酸氢钾0.05M混合磷酸盐0.025M硼砂0。
01M5 1.67 4.00 6。
95 9.3910 1。
67 4.00 6.02 9。
3315 1.67 4。
00 6.90 9。
2820 1。
68 4.00 6。
88 9.2325 1.68 4.00 6。
86 9.1830 1。
68 4。
01 6。
85 9。
1435 1。
69 4.02 6.84 9.11常用缓冲溶液的配制方法1.甘氨酸-盐酸缓冲液(0.05mol/L)X毫升0。
2 mol/L甘氨酸+Y毫升0。
2 mol/L HCI,再加水稀释至200毫升pH X Y pH X Y2.0 50 44.0 3。
0 50 11。
42.4 50 32.4 3。
2 50 8.22.6 50 24.23.4 50 6。
42。
8 50 16.8 3。
6 50 5。
0 甘氨酸分子量=75。
07, 0.2 mol/L甘氨酸溶液含15。
01克/升。
2.邻苯二甲酸-盐酸缓冲液(0。
05 mol/L)X毫升0。
2 mol/L邻苯二甲酸氢钾+ 0。
2 mol/L HCl,再加水稀释到20毫升pH(20℃)X Y pH(20℃)X Y2。
2 5 4.0703。
2 5 1。
4702.4 53.9603。
4 5 0.9902.6 53.2953。
6 5 0.597 2。
8 5 2。
6423.8 5 0.2633。
0 5 2。
022邻苯二甲酸氢钾分子量=204.23, 0。
2 mol/L邻苯二甲酸氢溶液含40。
85克/升3.磷酸氢二钠-柠檬酸缓冲液pH 0。
2mol/LNa HPO(ml) 0。
1mol/L柠檬酸 (ml)pH 0.2mol/L Na HPO (ml) 0。
1mol/L 柠檬酸 (ml) 2.2 0.40 10。
60 5。
2 10.72 9。
28 2.4 1.24 18.76 5.4 11.15 8.85 2。
ph的计算方法

ph的计算方法1、稀溶液的ph值通常在7左右,它是根据浓度和温度的关系计算出来的。
计算方法为:溶液的ph=-lgc。
溶液的浓度或温度越大,ph值越小,反之越大。
2、浓溶液的ph值通常在10左右,它也是根据浓度和温度的关系计算出来的。
计算方法为:溶液的ph=lgc。
溶液的浓度或温度越大, ph值越小,反之越大。
浓溶液通常情况下比稀溶液要显酸性,原因是:当溶液浓度较大时,水的电离程度很小,而水中氢离子的浓度较大,与水电离出的氢氧根离子和氢离子结合成水合氢离子。
由于氢离子浓度远远大于氢氧根离子的浓度,所以水合氢离子的浓度要大于氢离子的浓度,即电离出的氢氧根离子和氢离子结合生成的氢氧根离子浓度要小于水电离出的氢离子和氢氧根离子的浓度,即电离出的氢离子浓度要小于水电离出的氢离子和氢氧根离子的浓度,即电离出的氢离子浓度要小于水电离出的氢离子和氢氧根离子的浓度。
因此,形成的水合氢离子比氢离子多,所以ph值要小于10。
我们还可以用下面的方法测定酸碱度。
把ph计插入被测溶液中,这时指示剂开始变色,若颜色逐渐加深,说明被测溶液为酸性;若颜色逐渐减浅,说明被测溶液为碱性。
注意:当溶液为酸性时,显红色,即粉红色;当溶液为碱性时,显蓝色,即无色。
有时,不同物质的溶液具有相同的ph值。
如:盐酸是中性的,但硫酸却是酸性的。
这是因为某些盐与某些酸反应时,生成的不是中性的氢氧化物,而是酸性的氢盐,所以在做有关酸性和碱性的实验时,必须分别使用酸性和碱性的溶液进行试验。
3、强酸的ph值一般小于4,弱酸的ph值一般大于4。
如:当ph<4时,用石蕊试纸测ph值大于4。
强碱的ph值一般大于10,弱碱的ph值一般小于10。
4、稀醋酸的ph=2。
一般情况下,只有强酸的ph>4,弱酸的ph<4。
以上我们就会算了。
当然,有时可能强酸和弱酸是共存的,这时的ph值就需要乘以2,再把结果算出来。
除此之外,大家还知道哪些测量溶液酸碱度的办法?欢迎你在留言板上写出来!按照上述的办法来算,我们就能轻松地学会计算溶液的酸碱度了。
浅谈温度对pH值的影响

浅谈温度对 pH值的影响摘要:本文通过理论与实际两方面分析探讨温度对氨溶液pH值的影响,找出温度与pH值的变化关系,以便在实际分析过程中对测量值进行修正,更好的开展化学监督工作。
关键词:pH;温度;电离常数;离子积常数引言:火力发电厂汽水系统的化学监督是保障机组安全经济运行的重要手段,现如今机组的容量、参数越来越高,对汽水监督要求也越来越严格。
而在汽水监督中,许多化学反应都受溶液pH值控制,尤其是金属腐蚀与水质pH值有很大关系。
为了防止给水系统、锅炉本体等热力设备的腐蚀、结垢、积盐,必须严格控制给水、炉水pH值,使机组在最佳水汽品质工况下运行。
一、pH计测量原理pH的测量是对溶液中H+的测量,电极的电位对离子浓度变化的响应可应用能斯特方程描述:E=E+2.3RTlga/nF式中:E-平衡电极电位,mv;-标准电极电位,mv;ER-气体常数,8.314J/(K.mol);T热力学温度,t+273.15 K;F-法拉第常数,96485C/mol;n-得失电子数,[H+]是一价为+1;a-溶液中离子的浓度,mol/L。
从上式中可以看出,温度变化影响能斯特方程的斜率变化,从而影响溶液的PH值。
二、思考温度不同,同一溶液的pH值也不同。
化学监督标准中的pH值是指在25℃时的测量值。
为消除温度对pH值的影响,在线pH计与手工pH计按测量原理(能斯特方程)对温度进行了补偿。
那么手工测量与在线测量数据应基本相同。
实际生产过程中,水样pH值在按规定要求取样、测量的情况下,水样温度的不同导致手工测量值与在线测量值出入却很大。
人工汽水取样架仅采用闭式循环冷却水进行降温处理,未同在线仪表一样进行恒温处理,所取水样温度不会正好25℃,而是随着季节、冷却水温、样水流量变化而变化。
一般情况下夏季水样温度都高于25℃,我厂水样最高温度可达40℃,此时在线测量值与手工测得值偏差较大,pH值相差甚至达到0.4。
而给水pH一般控制在9.2~9.6之间,如此巨大的测量误差无法满足水质控制要求,造成了加药量大,甚至影响到汽水品质。
PH温度影响.ppt

1S 2S
VKm’ = Ks ·1+ V[Hm+]/K1+ K2/[H+]
假设:
1 + [1H++][/HK+1]S/K+1KS+2KS/[2HS/[+H] +]
(1)EH解离,EHS不解离:K1S→∞ K2S=0
Vm’ = Vm
Km’= Ks (1+ [H+]/K1 + K2/[H+])
当 [H+]>> K1>>K2 ,即:[H+]/K1>>1, K2/[H+] << 1
当L[oHg最+V]<m适<’K=PLH2So<=g<PVKKm11SS++P2KPK2S-2PSH; PKm’=PKs –PK2S+PH 当K2S << [H+] << K1S
Log Vm’=Log Vm; PKm’= PKs
(3) EH和EHS都解离:
Vm’= V/ (1 + [H+]/K1S + K2S/[H+])
PH
2. 底物解离的影响: 假设:① 酶和底物都只结合一个氢离子 ② 只有ESH可形成产物
(1)质子化的底物与未质子化的酶结合:
SH+ + E Ks EHS+
E + HP+
K
Ke
S EH+
V= Vm[S0]
Km’+ [S0]
[S0] =[SH+] + [S]
Km’= Km ( 1+ K )(1+ [H+] )
蛋白酶保存条件温度ph

蛋白酶保存条件温度ph
蛋白酶是一种重要的酶类蛋白质,在实验室和工业生产中具有
广泛的应用。
对于蛋白酶的保存条件,温度和pH是两个关键因素。
首先,让我们来看蛋白酶的保存温度。
一般来说,蛋白酶应该
在低温下保存,通常在-20°C或更低的温度下冷冻保存。
这可以有
效地减缓蛋白酶的降解和失活过程,延长其保质期。
如果蛋白酶是
在溶液中保存,那么最好使用含有保护剂(如甘油或明胶)的冻存
液来冷冻保存,以防止蛋白酶的冻融过程中发生变性或失活。
其次,让我们来看蛋白酶的保存pH条件。
大部分蛋白酶在中性
或微酸性条件下都能保持稳定。
一般来说,pH值在6.5至8.5之间
是比较适宜的保存条件。
如果蛋白酶是以溶液形式保存,可以考虑
加入缓冲液来维持适当的pH值。
另外,避免暴露在极端的酸碱条件
下也是非常重要的,因为这些条件可能会导致蛋白酶的失活或降解。
综上所述,蛋白酶的保存条件涉及到温度和pH两个方面。
在冷
冻温度下保存,并且维持适当的pH值,可以有效延长蛋白酶的稳定
性和活力,从而保证其在实验室和工业生产中的有效应用。
希望这
些信息能够对你有所帮助。
7种PH标准溶液不同温度下的pH值

1.671
——
3.996
6.921
7.467
9.330
13.011
15
1.673
——
3.996
6.898
7.445
9.276
12.820
20
1.676
——
3.998
6.879
7.426
9.226
12.637
25
1.680
3.559
4.003
6.864
7.409
9.182
12.460
30
1.684
3.551
4.010
6.852
7.395
9.142
12.292
35
1.688
3.547
4.019
6.844
7.386
9.105
12.130
37
——
——
——
6.839
7.383
———
——
40
1.694
3.547
4.029
6.838
7.380
9.072
11.975
45
1.700
3.550
4.042
6.834
KHC 8H4O4
0.05
10.12
10.21
B6
磷酸氢二钠
Na2HPO4
0.025
3.533
3.549
磷酸二氢钾
KH2PO4
0.025
3.387
3.402
B7
磷酸氢二钠
Na2HPO4
0.03043
4.303
4.320
磷酸二氢钾
KH2PO4
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
6×10634.5-1.2×20934-15.4×15449.3=
191098.1KJ/M3 191098.1÷6=31849.7 每小时的生物热为31849.7KJ/M3
五、利用温度控制提高产量
例1 利用热冲击处理技术提高发酵甘油的产量
背景:
(1)酵母在比常规发酵温度髙10~200C的温度下经受一 段时间刺激后,胞内海藻糖的含量显著增加。
发酵时间(h) 糖 谷氨酸 尿素 菌体 玉米浆
0~6 -37
6~12 -30.3 5.9
12~18 -24.0 15.4 -6.0 1.2 -0.6
18~31 -41.7 23.9
-2.9 4.8 -2.4
6.0 -3.0
发酵12~18小时的生物热为: Q生物=24×159555.9+0.6×12309.2+
Q发酵=GCm(T出-T进)
Cm——水的比热, G——冷却水流量 另一种是根据罐温上升速率来计算。先自控,让发酵液 达到某一温度,然后停止加热或冷却,使罐温自然上升 或下降,根据罐温变化的速率计算出发酵热。
根据化合物的燃烧值估算发酵过程生物热的近似值。
因为热效应决定于系统的初态和终态,而与变化途径无关, 反应的热效应可以用燃烧值来计算,特别是有机化合物, 燃烧热可以直接测定。反应热效应等于反应物的燃烧热总 和减去生成物的燃烧热的总和。
变温培养的正交设计
结论:前60h按31℃控制,缩短了适应期使发酵提前转
入生产阶段,同时菌丝体已有相当量的积累,为大量
分泌抗生素提供了物质基础。 60小时后将罐温降至3O℃使与抗生素合成有关的酶 的活性增强,抗生素分泌量有所增加,同时因分泌 期的延长有利于进一步积累抗生素。 发酵进入后期罐温再回升至31℃ ,使生产菌在生命的 最后阶段最大限度的合成和排出次级代谢产物。
好氧:产生287.2千焦耳热量, 183千焦耳转变为高能 化合物,104.2千焦以热的形式释放。 厌氧:产生22.6千焦耳热量, 9.6千焦耳转变为高能化 合物, 13千焦以热的形式释放。
二个例子中转化为高能化合物分别为63.7%和42.6%。
培养过程中生物热的产生具有强烈的时间性。
生物热的大小与呼吸作用强弱有关
pH pH
7.0
效价
t 不调pH 调pH
例:培养基初始pH值对漆酶分泌的影响
pH在4~7范围内产酶最高
2、pH对发酵的影响
(1)pH影响酶的活性。当pH值抑制菌体某些酶 的活性时使菌的新陈代谢受阻。
(2)pH值影响微生物细胞膜所带电荷的改变,从
而改变细胞膜的透性,影响微生物对营养物质的吸 收及代谢物的排泄,因此影响新陈代谢的进行 。 (3)pH值影响培养基某些成分和中间代谢物 的解离,从而影响微生物对这些物质的利用。
ΔH=∑(△H)反应物-∑(△H)产物
如谷氨酸发酵中主要物质的燃烧热为: 葡萄糖 159555.9KJ/Kg
谷氨酸
玉米浆 菌体
15449.3KJ/Kg
12309.2KJ/Kg 20934KJ/Kg
尿素
10634.5KJ/Kg
可根据实测发酵过程中物质平衡计算生物热。例如某味 精厂50M3发酵罐发酵过程测定结果的主要物质变化如表:
(NH4)2SO4或酸,发酵液pH可迅速升到8.0以上,阻碍或抑制某些
酶系,使林可霉素增长缓慢,甚至停止。对照罐发酵66小时pH达
7.93,以后维持在8.0以上至115小时,菌丝浓度降低,NH2-N升高, 发酵不再继续。 发酵15小时左右,pH值可以从消后的6.5左右下降到5.3,调节这 一段的pH值至7.0左右,以后自控pH,可提高发酵单位。
1、根据菌种及生长阶段选择
微生物种类不同,所具有的酶系及其性质不同, 所要求的温度范围也不同。 如黑曲霉生长温度为370C, 谷氨酸产生菌棒状杆菌的生长温度为30~ 320C, 青霉菌生长温度为300C。
根据生长阶段选择
在发酵前期由于菌量少,发酵目的是要尽快达到大量 的菌体,取稍高的温度,促使菌的呼吸与代谢,使菌 生长迅速;
主要内容
1.发酵过程pH变化的原因
2.pH对发酵影响 3.pH的控制
一、发酵过程pH变化的原因
1、基质代谢 (1)糖代谢 特别是快速利用的糖,分解成小分子酸、
醇,使pH下降。糖缺乏,pH上升,是补料的标志之一. (2)氮代谢 当氨基酸中的-NH2被利用后pH会下
降;尿素被分解成NH3,pH上升,NH3利用后pH下 降,当碳源不足时氮源当碳源利用pH上升。 (3)生理酸碱性物质利用后pH会上升或下降。
四、发酵过程引起温度变化的因素
(一)发酵热Q发酵 发酵热是引起发酵过程温度变化的原因。 所谓发酵热就是发酵过程中释放出来的净热量。 什么叫净热量呢? 在发酵过程中产生菌分解基质产生热量,机械搅拌产生 热量,而罐壁散热、水分蒸发、空气排气带走热量。 这各种产生的热量和各种散失的热量的代数和就叫做 净热量。 Q发酵 = Q生+Q搅拌-Q蒸发-Q显- Q辐射 Q发酵 = Q生+ Q搅拌-Q蒸发-Q显- Q辐射 发酵热引起发酵液的温度上升。 发酵热大,温度上升快,发酵热小,温度上升慢。
原因:
1、乳糖被用于合成菌体和其它蛋白,减少了合成 SOD的原料,随着温度升高,蛋白和菌浓都增加。
2、高温下可能SOD降解速率增加,杂蛋白增加 3、低温下由于比生长速率低,质粒脱落减少 4、低温下菌的衰老减缓,死亡率低
六、工业发酵温度
的控制
一般不需加热,因 释放了大量的发酵热, 需要冷却的情况多。 用夹套或蛇形管,通 冷却水。
(2)Lewis发现热冲击能提高细胞对盐渗透压的耐受力。 (3)Toshiro发现热冲击可使胞内3-磷酸甘油脱氢酶的 活力提高15~25%,并导致甘油产量提高。
实验:甘油发酵是在髙渗透压环境中进行的,因此 可望通过热冲击来提高发酵甘油的产量 正交条件A 冲击温度(0C) 40,45,50 B 开始时机(h) 8,16,30
1、生物热Q生物
在发酵过程中,菌体不断利用培养基中的营养物 质,将其分解氧化而产生的能量,其中一部分用
于合成高能化合物(如ATP)提供细胞合成和代
谢产物合成需要的能量,其余一部分以热的形式 散发出来,这散发出来的热就叫生物热。
生物热与发酵类型有关
微生物进行有氧呼吸产生的热比厌氧发酵产生的热多
一摩尔葡萄糖彻底氧化成CO2和水。
2、搅拌热Q搅拌
在机械搅拌通气发酵罐中,由于机械搅拌带动发 酵液作机械运动,造成液体之间,液体与搅拌器 等设备之间的摩擦,产生可观的热量。
搅拌热与搅拌轴功率有关,可用下式计算: Q搅拌=P×860×4186.8(焦耳/小时) P——搅拌轴功率 4186.8——机械能转变为热能的热功当量
电机功率P=
C 冲击时间(分) 15,30,60 结果发酵16小时,450C冲击30分钟最佳,发酵96 小时后甘油浓度提高32.6%,发酵罐实验见图 (A)16h,450C,30min
(B)12h,450C,30min
A 温度;B 开始时机;C 冲击时间
A比B好
例2 重组大肠杆菌人Cu/Zn-SOD的高表达 Lac启动子,用乳糖作诱导剂 270C SOD 比活 蛋白 OD600 4966 810 6.129 7.41 300C 14270 1471 9.70 10.72 340C 6590 679 9.79 11.78 370C 4638 526 11.88 24.77
第二节
温度对发酵的影响和及其控制
一、温度对生长的影响 二、温度对发酵的影响与控制
1、温度影响反应速率 3 、 温度基质溶解度 2、温度影响发酵方向
三、最适温度的选择
四、发酵过程引起温度变化的因素
五、温度的控制实例
六、温度控制
三、最适温度的选择
所谓最适温度是指在该温度下最适于菌的生长或产 物的合成。对不同的菌种、不同的培养条件、不同 的酶反应以及不同的生长阶段,最适温度有所不同。
思考题
1. 生物热、发酵热的定义
2. 发酵过程温度的选择有什么依据?
3.发酵过程的温度会不会变化?为什么
4. 生物热的大小与哪些因素有关?
6. 温度对发酵有哪些影响?
第三节
发酵过程的pH控制
pH是微生物代谢的综合反映,又影响代谢的
进行,所以是十分重要的参数。
发酵过程中pH是不断变化的,通过观察pH变化规律 可以了解发酵的正常与否。
3EI cos
E——额定电压 I——额定电流 cosφ——功率因素,1千瓦时=860×4186.8焦耳
3、蒸发热Q蒸发
通气时,引起发酵液的水分蒸发,水分蒸发所需的 热量叫蒸发热。此外,排气也会带走部分热量叫显 热Q显热,显热很小,一般可以忽略不计。 4、辐射热Q辐射 发酵罐内温度与环境温度不同,发酵液中有部分
在培养初期,菌体处于适应期,菌数少,呼吸作用缓慢, 产生热量较少。 菌体在对数生长期时,菌体繁殖迅速,呼吸作用激烈, 菌体也较多,所以产生的热量多,温度上升快,必须注 意控制温度。 培养后期,菌体已基本上停止繁殖,主要靠菌体内 的酶系进行代谢作用,产生热量不多,温度变化不 大,且逐渐减弱。 培养基营养越丰富,生物热也越大。
2、根据培养条件选择
温度选择还要根据培养条件综合考虑,灵活选择。 通气条件差时可适当降低温度,使菌呼吸速率 降低些,溶氧浓度也可髙些。
培养基稀薄时,温度也该低些。因为温度高
营养利用快,会使菌过早自溶。
3、根据菌生长情况 菌生长快,维持在较高温度时间要短些; 菌生长慢,维持较高温度时间可长些。 培养条件适宜,如营养丰富,通气能满足,那 么前期温度可髙些,以利于菌的生长。 总的来说,温度的选择根据菌种生长阶段及培养条 件综合考虑。要通过反复实践来定出最适温度。
根据生长阶段选择温度
例:林可霉素发酵的变温培养 问题的提出
