【高优指导】2017版高三化学一轮复习 第6单元 化学反应与能量转化 第3节 化学能转化为电能-电池课件 鲁科版
高优指导2017版高三化学一轮复习第6单元化学反应与能量(精)

②为保证酸完全中和,采取的措施是碱稍过量。 ③因为弱酸或弱碱存在电离平衡,电离过程需要吸热,实验中若 使用弱酸、弱碱则测得的反应热偏小。 ④实验操作时动作要快,减少热量的损失。 ⑤两个近似处理:近似认为溶液的比热等于水的比热,忽略量热 计的比热。 ⑥测定三次温度:测定加入量热计的酸溶液的初始温度T1,调节碱 溶液的温度与酸溶液的温度相同,测定酸碱混合后溶液达到的最高 温度T2。
-14基础梳理 考点突破
例2未来新能源的特点是资源丰富,在使用时对环境无污染或污 染很小,且可以再生。下列符合未来新能源标准的是( ) ①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能 A.①②③④ B.⑤⑥⑦⑧ C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧ ,核能有污染且不可再生,均 天然气、煤、石油属于常规能源且不可再生
例 3(2015 陕西榆林模拟)燃烧热是指通常状况下 1 mol 纯物质 完全燃烧生成稳定的化合物所放出的热量。下列说法中正确的是 ( ) A.通常状况下,1 g 氢气燃烧生成液态水时放出热量 142.9 kJ,则 表示氢气燃烧热的热化学方程式为 2H2(g)+O2(g) 2H2O(l) 关闭 ΔH= -571.6 kJ· mol-1 表示氢气燃烧热的热化学方程式中可燃物质 H2(g)的化学计量数应为1,A -1 项错误 ;气体变为液体时要放出能量 ,所以 1 mol 氢气与 1 mol 氟气反应生成 B.已知 :H2(g)+F2(g) 2HF(g) ΔH= -270 kJ· mol ,则 1 mol 氢 2 mol1 液态氟化氢放出的热量比生成 2 mol气态氟化氢放出的热量多 ,即大 气与 mol 氟气反应生成 2 mol 液态氟化氢放出的热量小于 270 kJ 于270 kJ,B项错误;C项,此反应为可逆反应,故投入0.5 mol的氮气,最终参 C.500 ℃、30 MPa 下 ,将因此热化学方程式中 0.5 mol N2 和 1.5 mol 2 置于密闭的容 加反应的氮气一定小于 0.5 mol, ΔHH 应小于 -38.6 器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为 kJ· mol-1,另外不是通常状况时应标明反应条件 ,C项错误;物质本身具有的 能量越低则越稳定 ,由热化学方程式知 ,石墨具有的能量低 ,比金刚石稳 关闭 N 2NH mol-1 2(g)+3H2(g) 3(g) ΔH=-38.6 kJ· 定,D项正确。 D已知:C(s,金刚石) D. C(s,石墨) ΔH=-1.5 kJ· mol-1,说明石墨比金 解析 答案 刚石稳定
【高优指导】2017版高三化学一轮复习 第6单元 化学反应与能量转化 第2节 电能转化为化学能-电解课件 鲁科版

电能转化为化学能 ——电解
-2-
考纲要求:1.了解电解池的工作原理,能写出电极反应和电池反应方 程式。 2.理解电解原理的应用,并能进行相关计算。
-3基础梳理 考点突破
1.电解 让直流电通过电解质溶液或熔融的电解质,在两个电极上分别发 生氧化反应和还原反应的过程叫电解。 2.电解池 将电能转化为化学能的装置叫做电解池。电解池是由直流电源、 固体电极材料以及电解质溶液或熔融电解质组成的。 3.电解池的工作原理(电解CuCl2溶液)
关闭 例 2(2015 北京东城期末)用惰性电极电解 CuSO4 溶液一段时间
由加入 0.1 mol Cu(OH)2 恰好反应时溶液浓度恢复至电解前,H2SO4+Cu(OH)2 后 ,停止电解 ,向所得溶液中加入 0.1 mol Cu(OH)2,恰好反应时溶液 CuSO 4+2H2O 可知,电解过程中消耗 CuSO4 和 H2O 的物质的量分别为 0.1 mol、 0.2 mol。 浓度恢复至电解前。关于该电解过程的说法不正确的是 (2O)的物质的 又根据 2CuSO4+2H2O 2Cu+2H2SO4+O2↑可知,此过程中消耗 CuSO4 和 H 量应相等。实际电解过程中消耗 H2O 的物质的量大于 CuSO4,所以整个电解过程可分为 A.生成 Cu 的物质的量是 0.1 mol 两个阶段 :第一阶段消耗 0.1 mol CuSO4(同时消耗 B.转移电子的物质的量是 0.2 mol0.1 mol H2O),第二阶段电解稀硫酸(实 际上是电解水 ),消耗 0.1 mol H2O,反应方程式依次为 C.随着电解的进行溶液的 pH 减小 2CuSO4+2H2O 2Cu+2H2SO4+O2↑、 2H2O 2H2↑+O2↑,两反应中转移的电子分别为 0.2 mol 、0.2 mol,共 0.4 mol,B 项错误; + D.阳极反应是 2H2O-4e O2↑+4H 根据上述分析可知生成 Cu 的物质的量为 0.1 mol,A 项正确;电解的第一阶段生成硫酸,溶 液的 pH 逐渐减小,第二阶段电解水,硫酸的浓度逐渐增大,溶液的 pH 逐渐减小,C 项正确; 关闭 该电解池的阳极反应是 2H2O-4eO2↑+4H+,D 项正确。
【一轮参考】全优指导2017化学人教版一轮6.1化学反应与能量变化

第六单元
基础梳理 考点突破
第1节
考点一 考点一
化学反应与能量变化
考点二 考点三 实验探究
-10-
1.理解焓变的“四”注意 (1)任何化学反应都是旧键断裂,新键形成的过程,都伴随着能量 的变化。 (2)焓变不取决于部分反应物能量和部分生成物能量的相对大小。 (3)物质的物理变化过程中,也会有能量的变化,但不属于吸热反 应或放热反应。在进行反应热的有关计算时,必须要考虑到物理变 化时的热效应,如物质的三态变化。 (4)化学反应是放热还是吸热与反应发生的条件没有必然联系。 如吸热反应Ba(OH)2· 8H2O与NH4Cl在常温常压下即可进行,而很多 放热反应需要在加热的条件下进行。 2.熟记反应热ΔH的基本计算公式 ΔH=生成物的总能量-反应物的总能量 ΔH=各反应物的键能之和-各生成物的键能之和
第六单元
基础梳理 考点突破
第1节
考点一 考点一
化学反应与能量变化
考点二 考点三 实验探究
-8-
自主巩固 判断正误,正确的画“√”,错误的画“×”。 (1)(2013天津理综)1 mol H2燃烧放出的热量为H2的燃烧热 ( × ) (2)(2012安徽理综)科学家最近研究出一种环保、安全的储氢方 法,其原理可表示为NaHCO3+H2 HCOONa+H2O。储氢、释 氢过程均无能量变化 ( × ) (3)(2012浙江理综)利用太阳能在催化剂参与下分解水制氢是把 光能转化为化学能的绿色化学方法 ( √ )
解析 答案
第六单元
基础梳理 考点突破
第1节
考点一 考点一
化学反应与能量变化
考点二 考点三 实验探究
-18-
4.(2015 浙江理综,28 节选 )乙苯催化脱氢制苯乙烯反应: H2(g) 已知:
2017《优化方案》高考化学(鲁教版)一轮复习课件第6章化学反应与能量转化第3讲

化学反应与能量转化
第3讲
化学能转化为电能——原电池
第六章
化学反应与能量转化
1.了解原电池的工作原理。 应和电池反应方程式。
2.能写出电极反
3.了解常见化学电源的种类及其工作
原理。 4.理解金属发生电化学腐蚀的原因, 金属腐蚀的危害, 防止金属腐蚀的措施。
考点一 原电池工作原理及应用
[知识梳理]
- 2+ Fe - 2e ===Fe 负极:_____________________________________。
方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证 Fe、 Cu 活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同):
把一个光洁的铁片插入到 CuSO4 溶液中,观察现象 _____________________ ,
A 项,原电池反应是自发进行的氧化还原反应,银器中 Ag2S 被还原成 Ag,质量减轻,故 A 项错误。 D 项, 黑色退去的原因是黑色的 Ag2S 转化为 Ag, 故 D 项错误。
6. 某校化学研究性学习小组欲设计实验验证 Fe、 Cu 的金属活 动性,他们提出了以下两种方案。请你帮助他们完成有关实验 项目: 方案Ⅰ:有人提出将大小相等的铁片和铜片,分别同时放入稀 硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活 动性。该原理的离子方程式为 Fe+2H+===Fe2++H2↑ ________________________________。
A.A>B>C>D>E B.A>C>D>B>E C.C>A>B>D>E D.B>D>C>A>E
解析:金属与稀 H2SO4 溶液组成原电池,活泼金属为负极,失 去电子发生氧化反应,较不活泼的金属为正极,H+在正极电极 表面得到电子生成 H2,电子方向由负极→正极,电流方向则由 正极→负极。在题述原电池中,AB 原电池,A 为负极;CD 原电池,C 为负极;AC 原电池,A 为负极;BD 原电池,D 为负极;E 先析出,E 不如 B 活泼。综上可知,金属活动性: A>C>D>B>E。
高中化学一轮复习 第6章 化学反应与能量转化 第3节 化
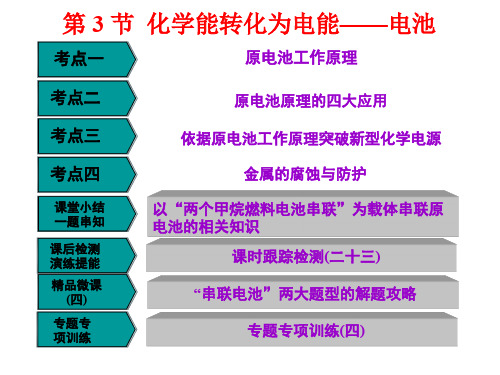
2.(2014·新课标卷Ⅱ)2013 年 3
月我国科学家报道了如图所
示的水溶液锂离子电池体
系。下列叙述错误的是( C ) A.a 为电池的正极
AB..由电图池示充分电析反,应金为属Li锂M易n2O失4=电=子=L,i1-由xM原n电2O池4+原xL理i 可知, 含BC.电有.池锂放电的充时一电,端时a为极原电锂电解的池池化的,合负反价极应发,式生即为变原b化电 为负池极反,应a的为逆正反极应,, 故D正.确放电。C时.放,电溶时液,中aL极i+为从原b 电向池a 的迁正移极,发生还原反应的 D是.放M电n 时元为素原,电锂池元,素锂的离化子合为价阳没离有子变,化应,向故正不极正(a 确极。)迁移, 故正确。
(1)在原电池中,发生氧化反应的一极一定是负极
(√)
(2)在原电池中,负极材料的活泼性一定比正极材料强 (×)
(3)在原电池中,正极本身一定不参与电极反应,负极本身一
定要发生氧化反应
(×)
(4)带有“盐桥”的原电池比不带“盐桥”的原电池电流持续
时间长
(√ )
(5)在“锌-硫酸铜溶液-铜”原电池中,锌为负极,发生还原
2.判断原电池正、负极的 5 种方法
[说明] 原电池的正极和负极与电极材料的性质有 关,也与电解质溶液有关,不要形成活泼电极一定作负 极的思维定势。
原电池电极反应式的书写
3.(2016·泗洪模拟)如图是某同学设计的原电池装置,下列叙述中正确
的是
(C )
A.电极Ⅰ上发生还原反应,作原电池的负极 B.电极Ⅱ的电极反应式为 Cu2++2e-===Cu C.该原电池的总反应为 2Fe3++Cu===Cu2++2Fe2+
2017届高三化学一轮复习 第六章 化学反应与能量本章体系构建课件

2-
BaSO4↓
基础专题整合
4.完成下列反应的离子方程式: (1)1 mol Cl 2 通入含 1 mol FeBr 2 的溶液中:2Fe +Cl2 2Fe3++2Cl-。 (2)1 mol Cl 2 通入含 1 mol FeI2 的溶液 中:2Fe2++2I-+2Cl2 2Fe3++4Cl-+I2。 (3)CuSO4 溶液与 Ba(OH)2 溶液混合:Ba2++SO4
①镀层金属接电源正极,待镀 金属接电源负极 ②电镀液必须含有镀层金属的 离子(电镀过程浓度不变)
电 极 名 称
阳极:金属电极失电子 阴极:电镀液中镀层金属阳离 子得电子(在电镀控制的条件 下,水电离产生的 H+及 OH-一 般不放电)
基础专题整合
原电池
电解池
电镀池
同电解池
(1)同一原电池的正、负极的电极反应得、失电子数相等 联 系 (2)同一电解池的阴极、阳极电极反应中得、失电子数相等 (3)串联电路中的各个电极反应得、失电子数相等。上述三种情况下 ,在写 电极反应式时,得、 失电子数要相等;在计算电解产物的量时,应按得、 失电 子数相等计算
+
(1)负 Pb-2e-+SO4
2-
PbSO4 (2)H2-2e-+2 OH2H2O
制成燃料电池,则负极反应式为 CH4-8e-+8OHCO2↑+4H2O。 (3)O2+4e-+4 (5)为了贯彻“绿色环保”理念,某汽车尾气研究小组根据汽油 (用 H+ 2H2O C4H10 表示)燃料电池的工作原理(一个电极通入空气,另一个电 (4)CH4-8e-+ 极通入汽油蒸气,掺杂了 Y2O3 和 ZrO2 晶体作电解质,其在高温 10OH2下传导 O )设计汽油燃料电池,从而减少废气的排放。其正极反 2CO3 +7H2O 应式为 O2+4e +2H2O 4OH 。 (5)O2+4e(6)Cu2O 是一种半导体材料,基于绿色化学理念设计的制取 2O2Cu2O 的装置示意图如下图,电极总反应:2Cu+H2O (6)Cu+2OH-Cu2O+H2↑。 2eCu2O↓+H2O 其阳极反应式为 Cu-2eCu2+。
高优指导2017版高三化学一轮复习考点规范练16化学反应与能量变化新人教版

考点规范练16 化学反应与能量变化(时间:45分钟满分:100分)一、选择题(本题共10小题,每小题5分,共50分,每小题只有一个选项符合题目要求)1.(2015安徽安庆示范高中联考)H2与O2发生反应的过程用模型图表示如下(“—”表示化学键):下列说法不正确的是( )A.过程Ⅰ是吸热过程B.过程Ⅲ一定是放热过程C.该反应过程所有旧化学键都断裂,且形成了新化学键D.该反应的能量转化形式只能以热能的形式进行答案:D解析:过程Ⅰ是旧化学键断裂的过程,为吸热过程,而过程Ⅲ为新化学键形成的过程,是放热过程,A、B、C均正确;该反应可通过燃料电池实现化学能到电能的转化,D错误。
2.(2015陕西西安联考)下列关于化学反应的描述中正确的是( )A.需要加热才能发生的反应一定是吸热反应B.已知NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,也放出57.3 kJ的热量C.CO(g)的燃烧热是283.0 kJ·mol-1,则表示CO(g)的燃烧热的热化学方程式为2CO(g)+O2(g)2CO2(g) ΔH=-283.0 kJ·mol-1D.已知2C(s)+2O2(g)2CO2(g) ΔH=a kJ·mol-1,2C(s)+O2(g)2CO(g) ΔH=b kJ·mol-1,则b>a〚导学号25730357〛答案:D解析:木炭、镁条等物质的燃烧,需要加热才能发生,但均为放热反应,A项错误;CH3COOH电离时要吸热,因此含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3 kJ,B项错误;燃烧热是指25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物所放出的热量,表示CO燃烧热的热化学方程式中CO的化学计量数应为1,C项错误;2CO(g)+O2(g)2CO2ΔH=(a-b) kJ·mol-1,该反应为放热反应,故a-b<0,即b>a,D项正确。
高优指导高三化学一轮复习 第6单元 化学反应与能量转化 第3节 化学能转化为电能电池考点规范练 鲁科版
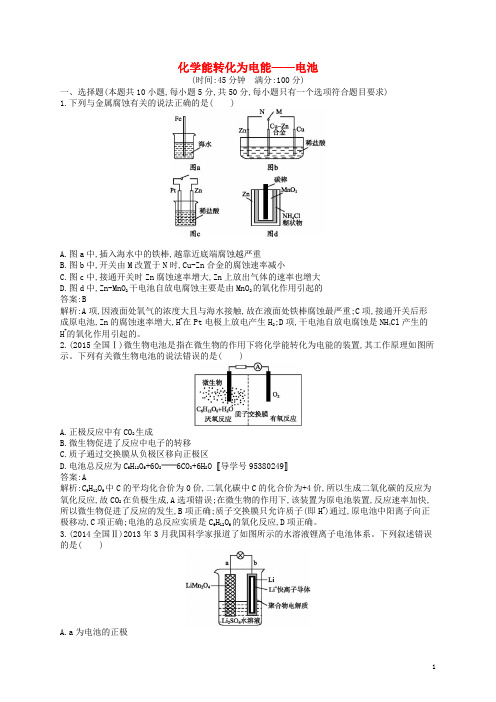
化学能转化为电能——电池(时间:45分钟满分:100分)一、选择题(本题共10小题,每小题5分,共50分,每小题只有一个选项符合题目要求)1.下列与金属腐蚀有关的说法正确的是( )A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的答案:B解析:A项,因液面处氧气的浓度大且与海水接触,故在液面处铁棒腐蚀最严重;C项,接通开关后形成原电池,Zn的腐蚀速率增大,H+在Pt电极上放电产生H2;D项,干电池自放电腐蚀是NH4Cl产生的H+的氧化作用引起的。
2.(2015全国Ⅰ)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的是( )A.正极反应中有CO2生成B.微生物促进了反应中电子的转移C.质子通过交换膜从负极区移向正极区D.电池总反应为C6H12O6+6O26CO2+6H2O〚导学号95380249〛答案:A解析:C6H12O6中C的平均化合价为0价,二氧化碳中C的化合价为+4价,所以生成二氧化碳的反应为氧化反应,故CO2在负极生成,A选项错误;在微生物的作用下,该装置为原电池装置,反应速率加快,所以微生物促进了反应的发生,B项正确;质子交换膜只允许质子(即H+)通过,原电池中阳离子向正极移动,C项正确;电池的总反应实质是C6H12O6的氧化反应,D项正确。
3.(2014全国Ⅱ)2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。
下列叙述错误的是( )A.a为电池的正极B.电池充电反应为LiMn2O4Li1-x Mn2O4+x LiC.放电时,a极锂的化合价发生变化D.放电时,溶液中Li+从b向a迁移答案:C解析:由题给图可知:该电池的b极电极反应为Li-e-Li+,所以b极为负极,a极为正极,A项正确;B项正确;C项放电时,负极Li价态发生变化,a为正极,Li+价态不变,C项错误;D项放电时阳离子移向正极,D项正确。
高考化学一轮总复习 第6章 化学反应与能量 第3节 化学能转化为电能-电池课后分层训练 鲁科版(20

2018版高考化学一轮总复习第6章化学反应与能量第3节化学能转化为电能-电池课后分层训练鲁科版编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2018版高考化学一轮总复习第6章化学反应与能量第3节化学能转化为电能-电池课后分层训练鲁科版)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2018版高考化学一轮总复习第6章化学反应与能量第3节化学能转化为电能-电池课后分层训练鲁科版的全部内容。
化学能转化为电能—-电池A组专项基础达标(建议用时:30分钟)1。
(2017·泉州模拟)课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。
下列结论错误的是( )A.原电池是将化学能转化成电能的装置B.原电池由电极、电解质溶液和导线等组成C.图中a极为铝条、b极为锌片时,导线中会产生电流D.图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片D[D项,a极为负极,电子由负极(锌片)流出。
]2.根据下图判断,下列说法正确的是()A.装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-===Fe2+B.装置Ⅰ和装置Ⅱ中正极反应均是O2+2H2O+4e-===4OH-C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大D[A项,装置Ⅰ中的负极为Zn;B项,装置Ⅱ中的正极反应为2H++2e-===H2↑;C项,阳离子向正极移动,装置Ⅰ中向左侧移动。
]3.(2013·全国卷Ⅱ)“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔.下列关于该电池的叙述错误..的是( )A.电池反应中有NaCl生成B.电池的总反应是金属钠还原三价铝离子C.正极反应为:NiCl2+2e-===Ni+2Cl-D.钠离子通过钠离子导体在两电极间移动B[A项,在负极Na失电子生成Na+,正极反应为NiCl2+2e-===Ni+2Cl-,故电池反应中有NaCl生成;B项,电池的总反应是金属钠还原二价镍离子;C项,正极上NiCl2发生还原反应,电极反应为NiCl2+2e-===Ni+2Cl-;D项,钠在负极失电子,被氧化生成Na+,Na+通过钠离子导体在两电极间移动。
2017版高考化学人教版(全国)一轮复习真题专训 第6章 化学反应与能量变化 基础课时1 含答案

基础课时1 化学反应的热效应1.(2014·新课标全国卷Ⅱ,13)室温下,将1 mol 的CuSO 4·5H 2O (s)溶于水会使溶液温度降低,热效应为ΔH 1,将1 mol 的CuSO 4(s )溶于水会使溶液温度升高,热效应为ΔH 2,CuSO 4·5H 2O 受热分解的化学方程式为:CuSO 4·5H 2O(s)=====△CuSO 4(s )+5H 2O(l),热效应为ΔH 3。
则下列判断正确的是( )A .ΔH 2>ΔH 3B .ΔH 1〈ΔH 3C .ΔH 1+ΔH 3=ΔH 2D .ΔH 1+ΔH 2>ΔH 3 解析 1 mol CuSO 4·5H 2O (s )溶于水会使溶液温度降低,为吸热反应,故ΔH 1>0,1 mol CuSO 4·5H 2O(s)溶于水可以分为两个过程,先分解成1 mol CuSO 4(s)再溶于水CuSO 4·5H 2O 的分解为吸热反应,即ΔH 3>0,根据盖斯定律得到关系式ΔH 1=ΔH 2+ΔH 3,分析得到答案:ΔH 1<ΔH 3。
答案 B2.(2013·课标全国Ⅱ,12)在1 200 ℃时,天然气脱硫工艺中会发生下列反应 H 2S(g )+错误!O 2(g )===SO 2(g )+H 2O(g) ΔH 12H 2S (g)+SO 2(g)===错误!S 2(g )+2H 2O (g ) ΔH 2H 2S(g )+错误!O 2(g )===S (g )+H 2O (g ) ΔH 32S(g )===S 2(g) ΔH 4则ΔH 4的正确表达式为( )A .ΔH 4=错误!(ΔH 1+ΔH 2-3ΔH 3)B .ΔH 4=错误!(3ΔH 3-ΔH 1-ΔH 2)C .ΔH 4=错误!(ΔH 1+ΔH 2-3ΔH 3)D.ΔH4=错误!(ΔH1-ΔH2-3ΔH3)解析②式中含有S2(g)、③式中含有S(g),根据盖斯定律可知,②×错误!-③×2得2S(g)+错误!SO2(g)+错误!H2O(g)===错误!H2S(g)+S2(g)+O2(g),然后再加①×错误!得2S(g)===S2(g),所以ΔH4=ΔH2×错误!+ΔH1×错误!-ΔH3×2。
高优指导2017版高三化学一轮复习 第6单元 化学反应与能量转化 第2节 电能转化为化学能-电解

电能转化为化学能——电解(时间:45分钟满分:100分)一、选择题(本题共10小题,每小题5分,共50分,每小题只有一个选项符合题目要求)1.(2014海南化学)以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉)。
下列说法错误的是( )A.阴极附近溶液呈红色B.阴极逸出气体C.阳极附近溶液呈蓝色D.溶液的pH变小答案:D解析:惰性电极电解碘化钾溶液,阴极氢离子得电子生成氢气,同时生成氢氧化钾,因此溶液变红(碱使酚酞变红),A、B说法正确;阳极产生碘单质,碘使淀粉变蓝,C说法正确;阴极氢离子得电子生成氢气,同时生成氢氧化钾,碱性增强,D说法错误。
2.利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。
下列说法中正确的是( )A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4C.电镀工业中,X是待镀金属,Y是镀层金属D.外加电流的阴极保护法中,Y是待保护金属答案:D解析:电解饱和食盐水时,阴极区得到H2和NaOH;铜的电解精炼时,应用粗铜作阳极、纯铜作阴极;电镀时,应以镀层金属作阳极、待镀金属作阴极。
3.(2015广西南宁模拟)一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法中正确的是( )A.外电路电子的移动方向:A→电源→BB.气体X在反应中通常体现还原性C.电极D为惰性电极,E为活泼电极D.电极D的电极反应式为C6H6+6H++6e-C6H12答案:D解析:A项,由图示知,电极D是苯得到电子发生还原反应生成环己烷,即该电极是电解池的阴极,所以A是电源的负极,所以外电路电子流动方向:B→电源→A,错误;B项,电极E附近OH-失去电子发生氧化反应生成O2,O2在反应中通常体现氧化性,错误;C项,若E是活泼电极,则阳极是电极先放电而得不到O2,错误。
第3题图第4题图4.若用如图所示装置(X 、Y 是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是( )相同条件下答案:C解析:A 项电解Na 2SO 4溶液,a 为阳极,OH -失电子破坏水的电离平衡,阳极周围呈酸性,不会使酚酞变红;B 项电解硝酸银溶液,a 为阳极,电极反应式为4OH --4e -2H 2O+O 2↑,b 为阴极,电极反应式为Ag ++e -Ag,B 项错误;C 项电解KCl 和CuCl 2的混合溶液,先电解CuCl 2,再电解KCl,随着反应的进行,继续电解则为电解水,阳极依次生成Cl 2、O 2,阴极依次生成Cu 和H 2,两极产生气体的总体积可能相等,C 项正确;D 项为电泳,Fe(OH)3胶粒带正电,向阴极移动,a 管颜色加深。
2017版高考化学一轮复习第6章化学反应与能量转化排查落实练十化学反应与能量试题鲁科版

排查落实练十化学反应与能量一、概念正误判断1. HCI和NaOH反应的中和热△ H= —57.3 kJ • mol,贝U HSQ和Ca(OH)2反应的中和热△ H—1=2X ( —57.3) kJ • mol ( x)2. CO(g)的燃烧热是283.0 kJ • mol —1,则反应2CQ(g)===2CO(g) + Q2(g)的反应热△ H= 2x283.0 kJ • mol (V)3. 1 mol甲烷燃烧生成气态水和CQ所放出的热量是甲烷的燃烧热(x)4 .应用盖斯定律,可计算某些难以直接测量的反应的焓变(V)5. 同温同压下,H2(g) +Cl2(g)===2HCI(g)在光照和点燃条件下的△ H不同(x)6 •根据电流方向或电子流向可判断原电池正负极;外电路中,电流由正极流向负极,电子由负极流向正极(V)7. 根据两极发生的反应类型可判断原电池的正负极:负极上总是发生氧化反应,正极上总是发生还原反应(V)8. 电解池的工作原理:电解池中与直流电源正极相连的是阳极,阳极发生氧化反应;与电源负极相连的是阴极,阴极发生还原反应。
通电时,电子的流向为负极一T阴极一T电解质一T阳极一-正极(x)二、热化学方程式的书写1. 沼气是一种能源,它的主要成分是CH,常温下,0.5 mol CH完全燃烧生成CO(g)和液态水时,放出445 kJ热量,则热化学方程式为CH(g) + 2Q(g)===CQ(g) + 2fO(l) △ H=—890 kJ • mol —1。
2 .已知H b S完全燃烧生成SQ(g)和HaO(l) , H2S的燃烧热为a kJ • mol —1,写出H2S燃烧的热化学方程式2H,S(g) + 3Q(g)===2SQ(g) + 2H,O(l) △ H= —2a kJ • mol —1。
3 .已知H- H 键能436 kJ • mol , H- N键能391 kJ • mol , N^N 键能945.6 kJ • mol , 试写出N2和H2反应生成NH的热化学方程式N2(g) + 3f(g)===2NH3(g) △ H= —92.4 kJ • mol —1 。
高优指导2017版高三化学一轮复习 第6单元 化学反应与能量转化单元质检卷 鲁科版

化学反应与能量转化(时间:45分钟满分:100分)一、选择题(本题共7小题,每小题8分,共56分,每小题只有一个选项符合题目要求)1.下列叙述不正确的是( )A.需要加热才能发生的反应不一定是吸热反应B.热化学方程式中的化学计量数表示物质的量,可以是分数C.应用盖斯定律可计算某些难以直接测量的反应焓变D.同温同压下,H2(g)+Cl2(g)2HCl(g)在光照和点燃条件下ΔH不同答案:D解析:反应的吸放热与反应条件无关,有些放热反应也需要加热,如燃烧反应等,故A项正确;热化学方程式中物质前的化学计量数表示物质的量,故B项正确;某些难以直接测量的反应焓变,可以通过盖斯定律进行计算求得,故C项正确;在相同条件下,对于固定的化学方程式其焓变(ΔH)是不变的,故D项错误。
2.(2015山东潍坊模拟)利用如图装置进行实验,开始时,a、b两处液面相平,密封好,放置一段时间。
下列说法中不正确的是( )A.a管发生吸氧腐蚀,b管发生析氢腐蚀B.一段时间后,a管液面高于b管液面C.a处溶液的pH增大,b处溶液的pH减小D.a、b两处具有相同的电极反应式:Fe-2e-Fe2+答案:C解析:a管中生铁发生吸氧腐蚀,总反应为2Fe+O2+2H2O2Fe(OH)2,Fe(OH)2难溶于水,该侧溶液pH 变化不大;b管中生铁发生析氢腐蚀,总反应为Fe+2H+Fe2++H2↑,该侧溶液的pH增大,而不是减小。
3.用石墨电极电解CuCl2溶液(见右图)。
下列分析正确的是( )A.a端是直流电源的负极B.通电使CuCl2发生电离C.阳极上发生的反应:Cu2++2e- CuD.通电一段时间后,在阴极附近观察到黄绿色气体答案:A解析:阳离子向阴极移动、阴离子向阳极移动,可知a为负极、b为正极,A选项正确;阳极发生失电子的反应生成Cl2、阴极发生得电子的反应生成Cu,C、D选项错误;电解质的电离与是否通电无关,B选项错误。
4.(2015福建理综)某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。
【鲁科版】2017届高考一轮复习:第6章《化学反应与能力转化》教学案(含答案)

第1讲化学反应的热效能考点一焓变与反应热1.化学反应的实质与特征(1)实质:反应物中化学键断裂和生成物中化学键形成。
(2)特征:既有物质变化,又伴有能量变化;能量转化主要表现为热能的变化,还表现为光能、电能等变化。
2.焓变、反应热(1)反应热:化学反应过程中放出或吸收的能量。
(2)焓变:在恒温恒压条件下进行的反应的热效应,符号:ΔH,单位:kJ·mol-1。
3.吸热反应与放热反应(1)从能量高低角度理解(2)从化学键角度理解(3)常见放热反应①可燃物的燃烧反应;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化。
(4)常见吸热反应①大多数分解反应;②盐的水解和弱电解质的电离;③Ba(OH)2·8H2O与NH4Cl的反应;④碳和水蒸气、C和CO2的反应。
1.判断正误(正确的打“√”,错误的打“×”)(1)放热反应不需要加热就能反应,吸热反应不加热就不能反应()(2)物质发生化学变化都伴有能量的变化()(3)伴有能量变化的物质变化都是化学变化()(4)吸热反应在任何条件都不能发生()(5)Na转化为Na+时,吸收的能量就是该过程的反应热()(6)水蒸气变为液态水时放出的能量就是该变化的反应热()(7)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同()(8)可逆反应的ΔH表示完全反应时的热量变化,与反应是否可逆无关()2.在相同条件下,同质量的硫粉在空气中燃烧和在纯氧中燃烧,哪一个放出的热量多,为什么?提示: 1.(1)×(2)√(3)×(4)×(5)×(6)×(7)×(8)√2.在空气中燃烧放出的热量多,因在纯氧中燃烧火焰明亮,转化成的光能多,故放出的热量少。
题组一利用图象,理清活化能与反应热的关系1.某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-17基础梳理 考点突破
自主巩固 已知电极材料:铁、铜、银、石墨、锌、铝;电解质溶液:CuCl2 溶液、NaOH 溶液、盐酸,按要求回答下列问题。 (1)电工经常说的一句口头禅:“铜接铝,瞎糊弄”,所以电工操作 上规定不能把铜导线与铝导线连接在一起使用,说明原因:铜铝接触, 在潮湿的环境中形成原电池,加快了铝的腐蚀,易造成电路断路。 (2)通常说的燃料电池都以铂为电极,将燃烧反应的化学能转化 为电能,在燃料电池中,可燃物在负极反应,助燃物在另一极反应。 (3)请运用原电池原理设计实验,验证 Cu2+、Fe3+氧化性的强弱。 请写出电极反应,负极:Cu-2eCu2+,正极:2Fe3++2e2Fe2+,并在 方框内画出实验装置图。
-8基础梳理 考点突破
原电池反应为 Zn+CuSO4 ZnSO4+Cu。Cu 电极作正极,Cu 在正极得电子,发生还 22原反应,A 项错误;由于两半池中的阴离子 SO4 不能透过半透膜,故 c(SO4 )都不变,B 项错 误;甲池中由于生成 Zn2+,而乙池中 Cu2++2eCu,则乙池中的 CuSO4 部分变为 ZnSO4, 关闭 导致乙池中溶液总质量变大 ,C 项正确;阴离子不能透过半透膜,D 项错误。 C
第3节
化学能转化为电能 ——电池
-2-
考纲要求:1.了解原电池的工作原理,能写出电极反应和电池反应方 程式。 2.了解常见化学电源的种类及其工作原理。 3.理解金属发生电化学腐蚀的原因、金属腐蚀的危害、防止金属 腐蚀的措施。
-3基础梳理 考点突破
原电池及其工作原理 1.定义 原电池是将化学能转变为电能的装置。 2.构成条件 (1)两个活动性不同的电极(金属和金属或金属和非金属导体)。 (2)将电极插入电解质溶液(或熔融电解质)中。 (3)用导线连接电极构成闭合回路(或两电极接触)。 (4)能自发进行的氧化还原反应。 3.工作原理
-22基础梳理 考点突破
(1)酸性电解质溶液环境下电极反应式: O2+4H++4e2H2O。 (2)碱性电解质溶液环境下电极反应式:O2+2H2O+4e4OH-。 (3)固体电解质(高温下能传导 O2-)环境下电极反应式:O2+4e2O2-。 (4)熔融碳酸盐(如熔融 K2CO3)环境下电极反应式:O2+2CO2+4e2CO3 。 第三步:根据电池总反应式和正极反应式写出电池的负极反应 式。 电池的总反应式-电池正极反应式=电池负极反应式,注意在将两 个反应式相减时,要约去正极的反应物 O2。
解析
答案
-9基础梳理 考点突破
归纳总结: 原电池中的“三”个方向“两”个反应 (1)电子流向:电子从负极流出经外电路流入正极。 (2)电流方向:电流从正极流出经外电路流入负极。 (3)离子的迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向 正极迁移。当有离子交换膜时则只有阴离子或阳离子移向另一极 保持电荷守恒。 (4)正极反应:还原反应。 (5)负极反应:氧化反应。
A.b 电极为该电池的负极
关闭
-
C
D.中间室:Na+移向左室,Cl-移向右室
解析 答案
-13基础梳理 考点突破
化学电源及原电池原理的应用 1.化学电源 (1)一次电池(碱性锌锰干电池): 碱性锌锰干电池的工作原理如图:
负极(Zn),电极反应式:Zn+2OH--2eZnO+H2O。 正极(MnO2),电极反应式:MnO2+2H2O+2eMn(OH)2+2OH-。 总反应:Zn+MnO2+H2O ZnO+Mn(OH)2。
关闭
2������ -
关闭
C
解析 答案
-12基础梳理 考点突破
3.(2015江苏南京、盐城模拟)一种三室微生物燃料电池污水净化 系统原理如图所示,图中有机废水中有机物可用C6H10O5表示。有 关说法中正确的是( )
由图示可知左侧有机物发生氧化反应生成 CO2,右侧 NO3 发生还原反 B.b 电极附近溶液的 pH 减小 应:2NO N2↑+12OH ,故 a 电极为负极,b 电极为正极,电极附近 pH 升高;电 3 +6H2O+10e - ,即左室移动。 池工作时阳离子 Na+向正极室 ,Cl 向负极室 C.a 电极反应式 :C6,即右室移动 H10O5+7H 6CO2↑+24H+ 2O-24e 关闭
-7基础梳理 考点突破
注意:原电池的正、负极判断应根据原电池的工作原理:发生氧 化反应的电极为负极,发生还原反应的电极为正极,而不能简单地 依据金属的活动性来判断。如Mg-Al-NaOH溶液构成的原电池,不 活泼的Al被氧化,作负极;Fe-Cu-HNO3(浓)构成的原电池,Fe常温下 在浓硝酸中钝化,不活泼的Cu被氧化,作负极。即原电池正负极的 判断,不仅要分析电极的活动性,还要考虑到电解质溶液的性质。
例1(2015天津理综)锌铜原电池装置如图所示,其中阳离子交换膜 只允许阳离子和水分子通过。下列有关叙述正确的是( ) A.铜电极上发生氧化反应 2c(S O B.电池工作一段时间后,甲池的 4 ) 减小 C.电池工作一段时间后,乙池溶液的总质量增加 D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电 关闭 荷平衡 2+
装置图 单液原电池
双液原电池
-4基础梳理 考点突破
续表 电极名称 电极材料 电极反应 反应类型 电子流向 离子迁 移方向 电池反应 两类装置 的不同点 负极 正极 锌片 铜片 Zn-2eZn2+ Cu2++2eCu 氧化反应 还原反应 由锌片沿导线流向铜片(由负极流向正极) 阴离子向负极迁移;阳离子向正极迁移 Zn+Cu2+ Zn2++Cu(或 Zn+CuSO4 ZnSO4+Cu) 还原剂 Zn 与氧化剂 Cu2+ Zn 与氧化剂 Cu2+不直接 直接接触,既有化学能转 接触,仅有化学能转化为 化为电能,又有化学能转 电能,避免了能量损耗, 化为热能,造成能量损耗 故电流稳定,持续时间长
-14基础梳理 考点突破
(2)二次电池(以铅蓄电池为例):
Ⅰ.放电时的反应。 ①负极反应:Pb+SO4 -2e2-
PbSO4;
2-
②正极反应:PbO2(s)+4H+(aq)+SO4 (aq)+2ePbSO4(s)+2H2O(l); ③总反应:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)。 Ⅱ.充电时的反应。 ①阴极反应:PbSO4+2ePb+SO4 ;
D
C.电池工作时,CO3 向电极 B 移动
D.电极 B 上发生的电极反应为 O2+2CO2+4e-
2CO3
2-
解析
答案
-21基础梳理 考点突破
归纳总结: 燃料电池电极反应式的书写 第一步:写出电池总反应式。 燃料电池的总反应与燃料的燃烧反应一致,若产物能和电解质 反应则总反应为加和后的反应。 如甲烷燃料电池(电解质:NaOH 溶液)的反应式为 CH4+2O2 CO2+2H2O ① CO2+2NaOH Na2CO3+H2O ② ①式+②式得燃料电池总反应式为 CH4+2O2+2NaOH Na2CO3+3H2O。 第二步:写出电池的正极反应式。 根据燃料电池的特点,一般在正极上发生还原反应的物质都是 O2,电解质溶液不同,其电极反应有所不同,其实,我们只要熟记以下 四种情况:
2-
-23基础梳理 考点突破
1.(2015甘肃联考)液体燃料电池相对于气体燃料电池具有体积小 等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池 用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液。下列关于 该电池的叙述中正确的是 ( )
关闭
电极 b 极发生氧化反应 极发生的反应:O2+2H2O+4e4OH-,发生还原反应,A 项错误;在碱性环境中, A.b 有氢氧根离子参加电极反应,产物是 N2 和 -H2O,B 项正确;电流是由正极流向负极,由 b 极 B.a 极的反应式:N2H4+4OH -4e N2↑+4H2O 经外电路流向 a 极,C 项错误;左侧消耗 OH-,故为使电池持续放电 ,离子交换膜需选用阴离 关闭 子交换膜 ,D 项错误。 C.放电时 ,电流从 a 极经过负载流向 b 极
C C.当杠杆为导体时,A端低B端高;杠杆为绝缘体时,A端高B端低 D.当杠杆为导体时,A端高B端低;杠杆为绝缘体时,A解析 端低B端 答案
-11基础梳理 考点突破
2.(2015 河北正定模拟)镁及其化合物一般无毒(或低毒)、无污 染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研 制绿色原电池的焦点。其中一种镁原电池的反应为 xMg+Mo3S4 MgxMo3S4。 下列说法中错误的是( ) A.放电时 Mg2+向正极迁移 B.充电时阳极反应为 Mo3S4 -2xeMo3S4 C.充电时 Mo3S4 发生氧化反应 D.放电时负极反应为 xMg-2xexMg2+
-5基础梳理 考点突破
自主巩固 下图所示的装置中
可以形成原电池的是 B,并写出形成原电池的电极材料及电极 反应。正极:Ag、2Ag++2e2Ag;负极:Cu、Cu-2eCu2+;电解质 溶液中的阴离子向负极移动,阳离子向正极移动,形成电流。
-6基础梳理 考点突破
1.原电池工作原理示意图
2.正、负极的判断方法
关闭
CH4 中的 C 为-4 价,反应后生成的 CO 中 C 为+2 价,1 mol CH4 转移 6 mol e ,A 项错误 ; 由示意图可看出 , 电解质离子中没有 OH ,B 项错误 ; A.反应 CH4+H2O 3H2+CO,每消耗 1 mol CH4 转移 12 mol 2− 该燃料电池中,O2 在正极反应,CO 和 H2 在负极反应,原电池中 CO3 电子 移向负极 ,C A 项错误 ;由示意图可看出 ,电极 处 CO 结合 ,转化 - 2和 B. 上 H2 参与的电极反应为 H2B +2OH -2e- O2 2H 2电极 − 2O 为 CO3 ,D 项正确。 2关闭
