人教版高中化学必修一高一第一章测试题
高一化学必修一第一章测试题

高一化学必修一第一章测试题一、选择题(每小题只有一个选项符合题意,每小题 3 分,共 45 分)1、下列实验操作中错误的是()A 用规格为 10 mL 的量筒量取 6 mL 的液体B 用药匙或者纸槽把粉末状药品送入试管的底部C 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上D 如果没有试管夹,可以临时手持试管给固体或液体加热2、下列有关化学实验安全问题的叙述中,不正确的是()A 少量的浓硫酸沾到皮肤上时,迅速用大量水冲洗B 取用化学药品时,应特别注意观察药品包装容器上的安全警示标志C 凡是给玻璃仪器加热,都要加垫石棉网,以防止仪器炸裂D 闻任何化学药品的气味都不能使鼻子凑近药品3、下列分离和提纯的实验操作中,正确的是()A 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热B 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处C 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出D 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大4、下列说法中正确的是()A 1 mol 任何物质都含有 602×10²³个分子B 1 mol 氦气中含有 2×602×10²³个原子C 1 mol 水中含有 2 mol 氢和 1 mol 氧D 摩尔是国际单位制中七个基本物理量之一5、设 N A 表示阿伏加德罗常数的值,下列说法中正确的是()A 1 mol 氧气中含有的氧原子数为 N AB 1 mol 氢气所占的体积约为 224 LC 1 mol 任何物质所含的粒子数均为 N AD 05 N A 个氯气分子的物质的量是 05 mol6、下列关于物质的量浓度的表述中,正确的是()A 03 mol·L⁻¹的 Na₂SO₄溶液中含有 Na⁺和 SO₄²⁻的总物质的量为 09 molB 将 585 g NaCl 溶解在 1 L 水中,所得溶液的物质的量浓度为 1 mol·L⁻¹C 1 L 水中溶解 585 g NaCl 所形成的溶液的物质的量浓度是 01 mol·L⁻¹D 配制 500 mL 05 mol·L⁻¹的 CuSO₄溶液,需 80 g 胆矾7、下列溶液中,氯离子浓度最大的是()A 100 mL 1 mol·L⁻¹的 NaCl 溶液B 150 mL 1 mol·L⁻¹的 MgCl₂溶液C 200 mL 1 mol·L⁻¹的 HCl 溶液D 10 mL 1 mol·L⁻¹的 AlCl₃溶液8、下列实验操作能达到实验目的的是()A 用长颈漏斗分离出乙酸与乙醇反应的产物B 用向上排空气法收集铜粉与稀硝酸反应产生的 NOC 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释D 将 Cl₂与 HCl 混合气体通过饱和食盐水可得到纯净的 Cl₂9、下列叙述中正确的是()A 同温同压下,相同体积的物质,其物质的量一定相等B 任何条件下,等物质的量的甲烷和一氧化碳所含的分子数一定相等C 1 L 一氧化碳气体一定比 1 L 氧气的质量小D 相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等10、某学生配制一定物质的量浓度的氢氧化钠溶液时,造成所配溶液浓度偏高的原因是()A 所用氢氧化钠已经潮解B 向容量瓶中加水未到刻度线C 有少量氢氧化钠溶液残留在烧杯里D 用带游码的托盘天平称 24 g NaOH 时误用了“左码右物”方法11、实验室需用 480 mL 01 mol·L⁻¹的硫酸铜溶液,以下操作正确的是()A 称取 768 g 硫酸铜,加入 500 mL 水B 称取 120 g 胆矾配成 500 mL 溶液C 称取 80 g 硫酸铜,加入 500 mL 水D 称取 125 g 胆矾配成 500 mL 溶液12、同温同压下,等质量的 O₂和 CO₂相比较,下列叙述正确的是()A 体积比为 8∶11B 分子个数之比为 11∶8C 物质的量之比为 11∶8D 原子个数之比为 11∶1213、下列溶液中的氯离子数目与 50 mL 1 mol·L⁻¹的 AlCl₃溶液中氯离子数目相等的是()A 150 mL 1 mol·L⁻¹的 NaClB 75 mL 2 mol·L⁻¹的 CaCl₂C 150 mL 3 mol·L⁻¹的 KClD 75 mL 2 mol·L⁻¹的 NH₄Cl14、某氯化镁溶液的密度为 118 g·cm⁻³,其中镁离子的质量分数为 51%,300 mL 该溶液中 Cl⁻的物质的量约等于()A 037 molB 063 molC 074 molD 15 mol15、已知 301×10²³个 X 气体分子的质量为 16 g,则 X 气体的摩尔质量是()A 16 gB 32 gC 64 g·mol⁻¹D 32 g·mol⁻¹二、填空题(共 35 分)16、(6 分)选择下列实验方法分离物质,将分离方法的序号填在横线上。
人教版高中高一化学必修一--第一单元 1.1 化学实验基本方法 练习题(含答案)
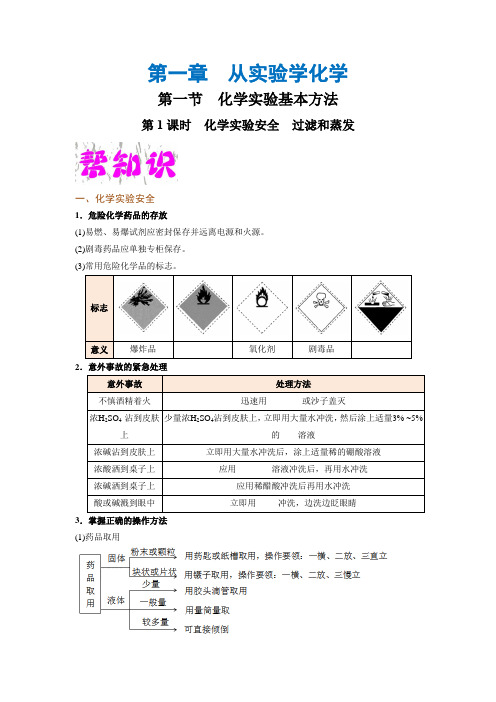
第一章 从实验学化学第一节 化学实验基本方法第1课时 化学实验安全 过滤和蒸发一、化学实验安全1.危险化学药品的存放(1)易燃、易爆试剂应密封保存并远离电源和火源。
(2)剧毒药品应单独专柜保存。
(3)常用危险化学品的标志。
2.意外事故的紧急处理3.掌握正确的操作方法 (1)药品取用(2)物质加热(3)收集气体的方法:排水法和排空气法(包括向上和向下)。
4.重视并逐步熟悉污染物和废弃物的处理方法(1)实验用剩的试剂一般不放回原试剂瓶,以防止污染试剂,应放到指定的容器中。
(2)实验后的废液用废液缸收集,集中处理。
二、过滤和蒸发三、粗盐的提纯1.不溶性杂质的除去粗盐中含有泥沙、氯化钙、氯化镁、硫酸盐等杂质,要通过________、________、________进行提纯。
以上操作都要用到玻璃棒,它们的作用依次是:(1)________溶解。
(2)引流。
(3)________________________。
注:若所得液体如仍浑浊则需再过滤一次。
2.可溶性杂质的除去3.加试剂的先后顺序为使杂质离子完全除去,要加入过量的试剂。
后续试剂要能够将前面所加过量的试剂除去,由此可知Na2CO3 溶液要在BaCl2溶液之后加入,通常加入试剂的几种顺序为:①BaCl2溶液→NaOH溶液→Na2CO3溶液→盐酸;②NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸;③BaCl2溶液→Na2CO3溶液→NaOH溶液→盐酸。
四、盐中2SO-的检验方法4【答案】一、1.易燃品腐蚀品2.湿布NaHCO3Na2CO3水二、固体液体可溶性固体三、1.溶解过滤蒸发(1)加速(3)搅拌、防止液体溅出2.BaCl2BaSO4↓ +2NaCl NaOH Mg(OH)2↓+2NaCl Na2CO3CaCO3↓+2NaCl四、稀盐酸BaCl2溶液无明显现象白色沉淀一、化学实验安全1.判断化学实验是否存在安全隐患,可以从以下六个方面考虑。
(人教版)武汉高中化学必修一第一章《物质及其变化》测试题(含答案解析)

一、选择题1.离子方程式23222H =CO BaC H O O Ba +++↑++中的H +不能代表的物质是①HCl ②H 2SO 4 ③HNO 3 ④NaHSO 4 ⑤CH 3COOHA .①③B .①④⑤C .②④⑤D .①⑤2.下列有关说法正确的是①“84”消毒液是纯净物,在“新冠战疫”中发挥了重要作用②明矾溶于水可水解生成Al(OH)3胶体,因此可用明矾对自来水进行杀菌消毒 ③分解、电解、潮解、裂解都是化学变化④胶体与其它分散系的本质区别是分散质粒子直径的大小⑤胆矾、冰水混合物都是纯净物,氨水、王水、双氧水都是混合物⑥元素处在最高价态时只有强氧化性,最低价态时只有强还原性⑦固态NaCl 不导电,熔融态的HCl 可以导电⑧H ++OH -=H 2O 仅代表强酸、强碱生成可溶性盐的离子方程式A .1个B .2个C .3个D .4个3.下列离子方程式中,正确的是A .钠投入冷水中:Na+2H 2O=Na ++2OH - +H 2↑B .将稀硫酸滴在铜片上:Cu+2H +=Cu 2++H 2↑C .醋酸和氢氧化铜反应:Cu(OH)2+2H +=Cu 2++2H 2OD .用烧碱和氯气制取漂白液:Cl 2+2OH - =Cl -+ClO -+H 2O4.准确书写离子方程式是学好化学的基本素养之一,下列离子方程式书写正确的是 A .氢氧化镁与稀硫酸反应: H + +OH - =H 2OB .用饱和氯化铁溶液制取氢氧化铁胶体: Fe 3+ + 3H 2OΔFe(OH)3+3H + C .石灰乳与碳酸钠溶液反应: Ca(OH)2+CO 2-3=CaCO 3+ 2OH -D .向水中加入一小块钠:2Na+2H 2O= Na + +2OH - +H 2 ↑5.某无色溶液中只可能含有K +、Ag +、Ba 2+、Cu 2+、Cl -、OH ﹣、2-3CO 、24SO -中的一种或几种,对其进行如下实验操作:(1)取少量溶液,滴加无色酚酞试液,酚酞变红;(2)另取少量溶液,加入足量BaCl 2溶液,产生白色沉淀;(3)向(2)所得混合物中加足量盐酸,沉淀部分溶解,并有无色气体生成;(4)将(3)所得混合物过滤,向滤液中加入AgNO 3溶液,有白色沉淀生成。
高一化学必修一第一章单元测试题(含答案及解析)[1]
![高一化学必修一第一章单元测试题(含答案及解析)[1]](https://img.taocdn.com/s3/m/cb2758ccf605cc1755270722192e453611665b78.png)
高一化学必修一第一章单元测试题(含答案及解析)[1]高一化学必修一第一章单元测试题一、选择题(只有一个正确答案)1.中国食盐产量居世界首位。
下列实验室中的操作类似“海水煮盐”原理的是()。
A。
蒸馏B。
蒸发C。
过滤D。
搅拌2.下列有关仪器的使用正确的是()。
A。
手持试管给试管内的物质加热B。
用燃着的酒精灯去点燃另一盏酒精灯C。
用天平称量药品时用手直接拿砝码D。
用滴管滴加液体时滴管应垂直悬垂在上方且不能触及内壁3.下列说法中不正确的是()。
A。
1 mol氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4 LB。
1 mol臭氧和1.5 mol氧气含有相同的氧原子数C。
等体积、浓度均为1 mol/L的磷酸和盐酸,电离出的氢离子数之比为3∶1D。
等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1∶6,氧原子数之比为1∶34.设NA表示阿伏加德罗常数,下列说法正确的是()。
A。
1 mol氦气中有2NA个氦原子B。
14 g氮气中含NA个氮原子C。
2 L 0.3 mol·L-1 Na2SO4溶液中含0.6NA个NaD。
18 g水中所含的电子数为8NA5.已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是()。
A。
16 gB。
32 gC。
64 g/molD。
32 g/mol6.下列实验操作正确的是()。
A。
当某实验没有准确的药品用量说明时,为看到明显现象,取用药品越多越好B。
取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管C。
胶头滴管取完一种试液后,可直接取另一种不与其反应的试液D。
取用粉末状固体或固体小颗粒时,应用药匙或纸槽,取用块状固体时,应用镊子夹取7.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为()。
A。
加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸B。
人教版高中化学必修一 第一章 从实验学化学 单元综合 单元测试卷

高中化学学习材料金戈铁骑整理制作必修1 第一章从实验学化学单元综合单元测试卷相对原子质量:H-1 C-12 O-16 S-16 Na-23 Cl-35.5 Cu-64一、选择题(本题包括16小题,每小题3分,共48分。
)1.1998年诺贝尔化学奖授予科恩(美)和波普尔(英),以表彰他们在理论化学领域作出的重大贡献。
他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命性的变化。
下列说法正确的是()A.化学不做实验,就什么都不知道 B.化学不再需要实验C.化学不再是纯实验科学D.未来化学的方向是经验化2.对危险化学品要在包装标签上印有警示性标志。
氢氧化钠溶液应选用的标志是()A B C D3.下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是()①过滤②蒸发③溶解④向容量瓶转移液体A.①和②B.①和③C.③和④D.①和④4.已知丙酮(C3H6O)通常是无色液体,不溶于水,密度小于1g·mL-1,沸点约为55℃。
要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是( ) A.蒸馏B.分液C.过滤D.蒸发5.在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后()A.整个溶液变紫色B.整个溶液变为棕黄色C.上层为无色,下层为紫红色D.下层无色,上层紫红色6.下列各种仪器:①漏斗;②容量瓶;③滴定管;④分液漏斗;⑤天平;⑥量筒;⑦胶头滴管;⑧蒸馏烧瓶。
常用于物质分离的是()A.①③⑦B.②⑥⑦C.①④⑧D.④⑥⑧7.过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤过滤正确的操作顺序是()A.③②①⑤④B.①②③⑤④C.②③①④⑤D.③⑤②①④8.下列叙述正确的是()A.1molH2O的质量为18g/molB.CH4的摩尔质量为16gC.3.01×1023个SO2分子的质量为32gD.标准状况下,1mol任何物质体积均为22.4L/mol9.等物质的量的SO2和SO3相比较,下列结论错误的是()A.它们的分子数目之比是1∶1 B.它们的氧原子数目之比为2∶3C.它们的质量之比为1∶1 D.它们所含原子数目之比为3∶410.已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是()A.16g B.32g C.64g /mol D.32g /mol11.下列溶液中Cl-的物质的量浓度最大的是()A.200mL 2mol/L MgCl2溶液B.1000mL 2.5mol/L NaCl溶液C.250mL 1mol/L AlCl3溶液D.300mL 5mol/L KClO3溶液12.配制一定物质的量浓度的KOH溶液时,导致浓度偏低的原因可能是()A.容量瓶中原有少量的蒸馏水B.移液时,不慎将液体流到瓶外C.容量瓶盛过KOH溶液,使用前未洗涤D.定容时俯视刻度线和液面13.实验室里需用480mL0.1mol/L的硫酸铜溶液,现选取500mL容量瓶进行配制,以下操作正确的是()A.称取7.68g硫酸铜,加入500mL水B.称取12.0g胆矾,配成500mL溶液C.称取8.0g硫酸铜,加入500mL水D.称取12.5g胆矾,配成500mL溶液14.在自来水的生产中,常通入适量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。
高中化学(必修一)第一章 燃烧热练习题(含答案解析)

高中化学(必修一)第一章 燃烧热 练习题(含答案解析)学校:___________姓名:___________班级:___________考号:___________一、单选题1.已知2H 2(g)+O 2(g)=2H 2O(l) ΔH=-571.6 kJ·mol -1,则下列关于方程式2H 2O(l)=2H 2(g)+O 2(g)的ΔH 的说法中正确的是A .方程式中的化学计量数表示分子数B .该反应ΔH 大于零C .该反应ΔH=-571.6 kJ·mol -1D .该反应可表示36 g 水分解时的热效应 2.环氧乙烷()可用作生产一次性口罩的灭菌剂。
工业上常用乙烯氧化法生产环氧乙烷,其原理是:2CH 2=CH 2(g)+O 2(g)2(g) ∆H 。
已知下列两个反应,则ΔH 为①122222l CH =CH (g)+3O (g)2CO (g)+2H O(g)ΔH =1323kJ mol --⋅①122225+O (g)2CO (g)+2H O(g)ΔH =1218kJ mol 2--⋅A .1210kJ mol -+⋅B .1210kJ mol --⋅C .1175kJ mol --⋅D .1105kJ mol --⋅3.已知丙烷的燃烧热12215kJ mol H -∆=-⋅,()()22H O l H O g = 144.0kJ mol H -∆=+⋅,若一定量的丙烷完全燃烧后生成18g 水蒸气,则放出的热量为 A .2039kJB .509.75kJC .553.75kJD .597.75kJ4.甲烷燃烧的热化学方程式,可用下列两种方程式表示:()()()()42221CH g 2O g CO g 2H O g Q kJ +=++,()()()()422222CH g 4O g 2CO g 4H O l Q kJ +=++,1Q 与2Q 的关系为A .12Q =QB .12Q >QC .122Q <QD .122Q >Q5.下列说法正确的是A .将NaOH 溶液分多次缓慢注入盐酸中,或一次性快速注入盐酸中,都不影响中和热的测定B .已知中和热为ΔH =-57.3kJ·mol -1,则稀H 2SO 4与稀Ba(OH)2溶液反应的反应热ΔH =-2×57.3kJ·mol -1C .燃烧热是指在101kPa 时1mol 可燃物完全燃烧时所放出的热量,故S(s)+32O 2(g)=SO 3(g) ΔH =-315kJ·mol -1即为硫的燃烧热D .已知冰的熔化热为6.0kJ·mol -1,冰中氢键键能为20.0kJ·mol -1,假设1mol 冰中有2mol 氢键,且熔化热完全用于破坏冰中的氢键,则最多只能破坏1mol冰中15%的氢键6.已知CH4气体的燃烧热为802 kJ∙mol-1,1mol CH4不完全燃烧生成CO和H2O(l)时放出的热量为519 kJ。
高中化学必修一第一章测试题

高中化学必修一第一章测试题测试题一:选择题1. 下列不属于物态变化的是:A. 凝固B. 溶解C. 燃烧D. 蒸发2. 物质的化学性质主要取决于:A. 物质的数量B. 物质的颜色C. 物质的分子大小D. 物质的分子结构3. 燃烧是许多物质发生的常见化学反应,其中不包括:A. 火炬燃烧产生的火光B. 铁锈生成的过程C. 电池中化学反应所产生的电流D. 纸张燃烧产生的热量4. 下列物质中不是化合物的是:A. 水B. 二氧化碳C. 氧气D. 氮气5. 反应物和生成物质量的关系是由下列法则描述的:A. 质量守恒定律B. 能量守恒定律C. 动量守恒定律D. 运动守恒定律6. 化学方程式中,以下反应物质是实质不变的示例是:A. 双氧水分解生成氧气和水B. 烧热得到二氧化碳和水C. 电解氯化钠得到氯气和氢氧化钠D. 铁和硫反应生成硫化铁7. 化学方程式中,下列反应中生成物质为气体的是:A. 氯气和氢气反应生成盐酸B. 铁和氧气反应生成氧化铁C. 铜和硝酸反应生成硝酸铜D. 硫化氢溶液和氯水反应生成硫酸8. 下列摩尔比例中符合正确摩尔配比的是:A. 2 moles A: 3 moles BB. 4 moles A: 1 mole BC. 5 moles A: 8 moles BD. 1 mole A: 5 moles B9. "O"是氧元素的化学符号,"Na"是钠元素的化学符号,它们的主要区别是:A. 钠元素中有3个氧核素B. 氧元素只有一个钠核素C. 钠元素的质量比氧元素的质量大D. 氧元素常态下是固体,钠元素常态下是气体10. 化学符号"H2O"代表了什么物质?A. 氰气B. 乙醇C. 氧化亚铜D. 水测试题二:简答题1. 解释物质的分子结构对其性质的影响。
2. 铝元素和氯元素在常温下是否会反应?为什么?3. 解释化学方程式中,化学符号的含义以及配比的重要性。
人教版高一化学必修一第一章单元测试题

单元测评(一)一、选择题(本题包括15小题,每小题4分,共60分。
每小题只有一个正确答案)1.下列有关化学实验操作正确的是( )A.称取NaOH固体B.稀释浓H2SO4C.将乙醇与水分离D.检查装置的气密性图CA112.如下实验数据正确的是( )A.用pH试纸测得某溶液的pH为3.5B.用托盘天平测得某药品的质量为2.15gC.用量筒量取3.57mL的试剂D.用250mL的容量瓶配制250mL1mol·L-1NaOH溶液3.以下实验装置不能用于分离物质的是( )图CA124.如图CA13表示配制一定物质的量浓度的NaCl溶液的部分操作示意图,其中有错误的是( )图CA135.科学家刚刚发现了某种元素的原子,其质量是a g ,12C 的原子质量是b g ,N A 是阿伏伽德罗常数的值,下列说法不正确的是( )A .由已知信息可得:N A =12bB .W g 该原子的物质的量一定是WaN A molC .W g 该原子中含有W a 个该原子D .该原子的摩尔质量是aN A g6.某校化学兴趣小组在实验室中发现一瓶溶液,标签上标有“CaCl 20.1mol ·L -1”的字样,下面是该小组成员对溶液的叙述,正确的是( )A .配制1L 该溶液,可将0.1molCaCl 2溶于1L 水中B .Ca 2+和Cl -的物质的量浓度都是0.1mol ·L -1C .从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.05mol ·L -1D .将该瓶溶液稀释一倍,则所得溶液的c (Cl -)为0.1mol ·L -17.把5%的氢氧化钠溶液蒸发掉324g 后,溶液变成84.8mL ,溶质的质量分数变为21.2%,则浓缩后氢氧化钠溶液的物质的量浓度为( )A .5mol ·L -1B .6.25mol ·L -1C .2.5mol ·L -1D .7.5mol ·L -18.设N A 表示阿伏伽德罗常数的值,下列叙述中正确的是( )A .常温常压下,11.2LCO 2所含的原子数为1.5N AB .常温常压下,48gO 3含有的氧原子数为3N AC .标准状况下,22.4LSO 3中所含原子数为4N AD .标准状况下,1L 水所含分子数为122.4N A 9.标准状况下,V L 氨气溶解在1L 水中(水的密度近似为1g/mL)所得溶液的密度为ρg/mL ,质量分数为w ,物质的量浓度为c mol/L ,则下列关系中不正确的是( )A .c =1000ρw 17B .w =17c 1000ρC .w =17V 17V +22400D .c =V ρ17V +2240010.下列叙述正确的是( )A .同温同压下,相同体积的物质,它们的物质的量必相等B .任何条件下,等物质的量的氧气和一氧化碳所含的分子数必相等C .1L 一氧化碳气体一定比1L 氧气的质量小D.等压等体积的N 2和CO 2两种气体的分子数一定相等11.将标准状况下的a LHCl 气体溶于100mL 水中,得到的盐酸的密度为b g ·mL -1,则该盐酸的物质的量浓度是( )A.10a 22.4mol ·L -1B.10a 22.4(a +0.1)mol ·L -1C.ab 22400+36.5a mol ·L -1D.1000ab2240+36.5a mol ·L -112.下列说法正确的是( )A .同温同压下,相同数目的分子必具有相同的体积B .等质量的O 2和H 2的物质的量之比为16∶1C .不同的气体若体积不等,则它们所含的分子数一定不等D .同温同体积下,两种气体的物质的量之比等于压强之比13.碳酸铜和碱式碳酸铜[Cu 2(OH)2CO 3]均可溶于盐酸转化为氯化铜。
人教版普通高中化学必修第一册第一章单元测试题《物质及其变化》(附答案)

普通高中化学必修第一册第一章单元测试题《物质及其变化》一、选择题(每小题只有1个选项符合题意)1.据报道,科学家研制了一种间距为50 nm 的“镊子”,利用它可以操控活细胞中的DNA 分子等。
下列分散系中分散质的粒子直径与该“镊子”间距相近的是( )。
A .溶液B .胶体C .悬浊液D .乳浊液2.下列物质中,属于电解质且能导电的是( )。
A .MgCl 2固体B .NaCl 溶液C .液态HClD .熔融的KOH3.下列生活中的现象与氧化还原反应无关的是( )。
A .铜铸雕像上出现铜绿[Cu 2(OH )2CO 3] B .充有氢气的气球遇明火爆炸 C .大理石雕像被酸雨腐蚀毁坏 D .铁质菜刀生锈4.以下是碳及其化合物的转化关系。
CCO 2H 2CO 3CaCO 3CO 2其中涉及的基本反应类型依次是( )。
A .化合、置换、分解、复分解 B .置换、复分解、化合、分解 C .置换、化合、复分解、分解D .置换、化合、分解、复分解5.下列离子方程式中,书写正确的是( )。
A .铁与稀盐酸反应:2Fe +6H +=2Fe 3++3H 2↑B .稀硫酸与氢氧化钡溶液反应:Ba 2++H ++OH -+24SO -=H 2O +BaSO 4↓C .碳酸钙与稀盐酸反应:CaCO 3+2H +=Ca 2++CO 2↑+H 2OD .铜片跟硝酸银溶液反应:Cu +Ag +=Cu 2++Ag6.在强酸性无色透明溶液中,下列各组离子能大量共存的是( )。
A .Fe 3+、K +、Cl -、3NO -B .Ag +、Na +、3NO -、Cl -C .Mg 2+、Al 3+、24SO -、Cl -D .Na +、4NH +、Cl -、23CO -7.下列各组物质中,按“氧化物—酸—碱—盐” 顺序排列的是( )。
Ca (OH )2H 2OCuO高温A.HClO HCl Mg(OH)2MgCl2B.CO2H2CO3CaCO3Ca(HCO3)2C.H2O HNO3Ba(OH)2NH4NO3D.SO3NaHSO4NaOH Na2SO48.下列反应中,铁元素被氧化的是( )。
(人教版)郑州高中化学必修一第一章《物质及其变化》经典练习题(含答案解析)

一、选择题1.下列指定反应的离子方程式不正确的是 A .向氯化钙溶液中通入2CO 气体:2223Ca CO H O=CaCO 2H ++++↓+B .醋酸除水垢离子方程式:2333222CH COOH CaCO 2CH COO Ca H O CO -++++=+↑C .石灰水与过量碳酸氢钠溶液反应:223323=2HCO Ca 2OH CaCO H O CO -+--++↓++D .制备3Fe(OH)胶体:3++23ΔFe +3H O Fe(OH)(胶体)+3H 答案:A 【详解】A .氯化钙为强酸强碱盐,盐酸的酸性强于碳酸的酸性,所以氯化钙溶液与2CO 气体不反应,故A 不正确;B .醋酸为弱酸,水垢的主要成分为碳酸钙,两者反应生成可溶性的醋酸钙、二氧化碳和水,则2333222CH COOH CaCO 2CH COO Ca H O CO -++++=+↑,故B 正确;C .石灰水与过量碳酸氢钠溶液反应生成难溶性的碳酸钙、可溶性的碳酸钠和水:223323=2HCO Ca 2OH CaCO H O CO -+--++↓++,故C 正确;D .FeCl 3加热水解制备3Fe(OH)胶体:3++23ΔFe +3H O Fe(OH)(胶体)+3H ,故D 正确; 答案选A 。
2.下列离子方程式,正确的是A .单质钠与水的反应:Na+H 2O=Na ++OH -+H 2↑B .过量NaHSO 4溶液与少量Ba(OH)2溶液反应:H ++SO 24-+Ba 2++OH -= BaSO 4↓+H 2O C .含等个数的氢氧化钡溶液与碳酸氢铵溶液混合:Ba 2++2OH -+NH 4++HCO 3-=BaCO 3↓+NH 3·H 2O+H 2OD .氯化钙溶液中通入二氧化碳气体:Ca 2++CO 2+H 2O=CaCO 3↓+2H + 答案:C 【详解】A .单质钠与水反应生成氢氧化钠和氢气,离子方程式为:+-222Na+2H O=2Na +2OH +H ↑,A 项错误;B .过量NaHSO 4溶液与少量Ba(OH)2溶液反应,离子方程式为:+2-2+-4422H +SO +Ba +2OH = BaSO +2H O ↓,B 项错误;C .含等个数的氢氧化钡溶液与碳酸氢铵溶液混合,反应的离子方程式为:2+-+-433322Ba +2OH +NH +HCO =BaCO +NH H O+H O ↓⋅,C 项正确;D .氯化钙溶液中通入二氧化碳气体,氯化钙与二氧化碳不反应,D 项错误; 答案选C 。
高一化学必修一第一章单元测试题(含答案及解析)

高一化学必修一第一章单元测试题2018/9/24(本试卷共26个题,满分100分。
考试时间:45分钟)姓名___________ 班级____________ 学号___________ 得分___________一、选择题(只有一个正确答案,每小题2分,共36分)1.中国食盐产量居世界首位。
下列实验室中的操作类似“海水煮盐”原理的是()A.蒸馏B.蒸发C.过滤D.搅拌2.下列有关仪器的使用正确的是()A.为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体B.用燃着的酒精灯去点燃另一盏酒精灯C.用天平称量药品时用手直接拿砝码D.用滴管滴加液体时滴管应垂直悬垂在容器上方且不能触及容器内壁3.对危险化学品要在包装标签上印上警示性标志。
下列的化学药品名称与警示标志名对应不正确的是 ( )A.酒精——易燃品B.浓硫酸——腐蚀品C.烧碱——剧毒品D.氯酸钾——强氧化剂4.下列说法中不正确的是()A.1 mol 氧气中含有12.04×1023个氧原子,在标准状况下占有体积22.4LB.1 mol臭氧和1.5 mol氧气含有相同的氧原子数C.等体积、浓度均为1 mol/L的磷酸和盐酸,电离出的氢离子数之比为3∶1 D.等物质的量的干冰和葡萄糖(C6H12O6)中所含碳原子数之比为1∶6,氧原子数之比为1∶35.设N A表示阿伏加德罗常数,下列说法正确的是()A.1 mol氦气中有2N A个氦原子B.14 g氮气中含N A个氮原子C.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6 N A个Na+D.18 g水中所含的电子数为8N A6.已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是()A.16 g B.32 gC.64 g/mol D.32 g/mol7.下列实验操作正确的是()A.当某实验没有准确的药品用量说明时,为看到明显现象,取用药品越多越好B.取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管C.胶头滴管取完一种试液后,可直接取另一种不与其反应的试液D.取用粉末状固体或固体小颗粒时,应用药匙或纸槽,取用块状固体时,应用镊子夹取8.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为()A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸9.在下列操作中,一般情况下不能相互接触的是()A.过滤时,玻璃棒与三层滤纸B.分液时,分液漏斗下端与烧杯内壁C.过滤时,烧杯内壁与漏斗下端D.用胶头滴管向试管内滴加液体时,胶头滴管尖端与试管内壁10.下列关于容量瓶的使用操作中正确的是()A.使用容量瓶前应先检漏B. 容量瓶先用蒸馏水洗净,再用待测液润洗C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到液面距刻度线1~2cm处,再改用胶头滴管滴加蒸馏水至刻度线D.浓硫酸稀释后马上转移到容量瓶中11.实验中的下列操作正确的是()A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中B.Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道C.用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中12.若某原子的摩尔质量是Mg·mol-1,则一个该原子的真实质量是()A.Mg B.1 M gC.M6.02×1023g D.6.02×1023M g13.下列溶液中,物质的量浓度最大的是()A.1 L H2SO4溶液中含98 g H2SO4B.0.5 L含49 g H2SO4的溶液C.98 g H2SO4溶于水配成2 L溶液D.0.1 L含24.5 g H2SO4的溶液14.用N A表示阿伏加德罗常数,下列叙述正确的是()A.64 g SO2含有氧原子数为1N AB.物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为1 N AC.标准状况下,22.4 L H2O的分子数为1N AD.常温常压下,14 g N2含有分子数为0.5 N A15.下列一定量的各物质所含原子个数按由大到小的顺序排列的是()①0.5 mol氨气②标准状况下22.4 L氦气③4 ℃时9 mL水④0.2 mol磷酸A.①④③②B.④③②①C.②③④①D.①④②③16.某非金属单质A和氧气发生化合反应生成B,B为气体,其体积是反应掉氧气体积的两倍(同温同压)。
(人教版)西安高中化学必修一第一章《物质及其变化》经典测试(含答案解析)

一、选择题1.已知常温下可用:Co 2O 3制备Cl 2,反应前后存在六种微粒:Co 2O 3、H 2O 、Cl 2、H +、Cl -和Co 2+。
下列叙述不正确的是( )A .氧化产物为Cl 2B .氧化剂与还原剂的物质的量之比为1∶2C .若有1molCl 2生成,则反应前HCl 的物质的量为6molD .当该反应生成4.48LCl 2时,反应中有0.2mol 电子转移2.火星大气中含有95%的二氧化碳。
某课题组研制出“Na ﹣CO 2”电池,其工作原理为:3CO 2+4Na=2Na 2CO 3+C 。
下列分析错误的是( )A .CO 2部分发生还原反应B .1molNa 完全反应失去1mole ﹣C .氧化剂与还原剂物质的量之比为3∶4D .该研究可能为火星探测提供一种潜在能源系统3.化学与生活密切相关。
下列分析不正确的是A .“方家以磁石磨针锋,则能指南”中涉及物理变化B .食品添加剂可以改善食品品质及延长食品保存期,对其用量不必严格控制C .丝绸和头发的主要成分是蛋白质D .“浮梁巧烧瓷,颜色比琼玖”的“瓷”是硅酸盐产品4.已知酸性:H 2SO 3>CH 3COOH>H 2CO 3>HClO 。
离子反应的一条规律,即酸性较强的物质发生H +转移反应,可以生成酸性相对较弱的物质,例如2CH 3COOH+2-3CO =2CH 3COO -+H 2O+CO 2↑可进行。
依照该规律,判断下列离子反应不能发生的是A .CO 2+H 2O+ClO -=-3HCO +HClOB .2-3SO +2CH 3COOH=SO 2↑+2CH 3COO -+H 2OC .SO 2+2-3CO =2-3SO +CO 2D .ClO -+CH 3COOH=HClO+CH 3COO -5.下列离子能在强碱性溶液中大量共存,且溶液为无色透明的是A .K +、4MnO -、Mg 2+、Cl -B .Na +、Ba 2+、3HCO -、3NO -C .Na +、3NO -、23CO -、Cl -D .K +、H +、Cl -、24SO - 6.下列各组离子一定能大量共存的是A .含有大量Ba 2+的溶液中:Cl -、K +、24SO -、23CO -B .含有大量H +的溶液中:Mg 2+、Na +、23CO -、24SO -C .含有大量Na +的溶液中:H +、K +、24SO -、3NO -D .含有大量OH -的溶液中:Cu 2+、3NO -、24SO -、23CO -7.下列离子方程式书写正确的是A .铜和硝酸银溶液反应:Cu +Ag +=Cu 2++AgB .钠和水反应:Na +2H 2O =Na ++2OH -+H 2↑C .碳酸钙与稀盐酸反应:CaCO 3+2H +=Ca 2++CO 2↑+H 2OD .硫酸铜溶液与氢氧化钡溶液反应:Cu 2++2OH -=Cu(OH)2↓8.在一定条件下,2PbO 与3Cr +反应,产物是227Cr O -和2Pb +,则生成2271molCr O - 所需2PbO 的物质的量为() A .3.0mol B .1.5mol C .1.0mol D .0.75mol9.下列离子方程式中,正确的是A .铁片投入稀盐酸中:2Fe+6H +=2Fe 3++3H 2↑B .醋酸除去水垢:2H + + CaCO 3=Ca 2+ + CO 2↑+ H 2OC .铜和硝酸银溶液反应:Cu+ Ag +=Cu 2+ + AgD .氯化钡溶液滴入硫酸钠溶液中:Ba 2+ + SO 2-4=BaSO 4↓10.下列反应的离子反应方程式正确的是( )A .Na 与CuSO 4溶液的反应:2Na+Cu 2+=Cu+2Na +B .CuSO 4溶液与Ba(OH)2溶液反应:Cu 2++2OH -=Cu(OH)2↓C .NaHCO 3溶液与NaOH 溶液混合:HCO 3-+OH -=H 2O+CO 23-D .Ca(ClO)2溶液中通入少量CO 2:Ca(ClO)2+CO 2+H 2O=CaCO 3↓+2H ++2ClO - 二、填空题11.请根据要求书写出方程式。
高一化学必修1第一章及第二章综合测试题

高一化学必修1第一章及第二章综合测试题
1、有机物中的碳有下列那种结构:
A、碳纤维结构
B、螺状结构
C、矩状结构
D、环状结构
答案:D环状结构。
有机物中的碳一般呈环状结构。
2、碳氢化合物中碳的极性是:
A、很弱
B、中等
C、很强
D、无极性
答案:A很弱。
由于碳氢化合物碳原子内的电子极性很弱,有机物中
的键向碳原子的极性相对较弱,所以碳的极性是很弱的。
3、有机物燃烧的加成反应的反应式是:
A、CnH2n+2+5O2→nCO2+2H2O
B、2CxHy+2x+2yO2→xCO2+yH2O
C、CxHy+3O2→xCO2+yH2O
D、CxHy+2x+yO2→xCO2+yH2O
答案:CCxHy+3O2→xCO2+yH2O。
有机物在氧气中燃烧的反应式为
CxHy+3O2→xCO2+yH2O。
4、硫氟醚释放有毒物质的原因是:
A、硫氧键的极性强
B、它含有氟原子
C、它含有硫原子
D、碳原子的
极性强
答案:B它含有氟原子。
硫氟醚释放有毒物质的原因是它含有氟原子,氟原子具有较强的挥发性,因此释放有毒物质。
5、HCl是一种弱酸,其原因是:
A、HCl只有一个氢离子
B、HCl物质极性高
C、HCl只有一个氯离子
D、HCl含有强电荷
答案:CHCl只有一个氯离子。
HCl是一种有机物,其结构中只有一个
氯离子,因此具有较弱的碱性,所以它是一种弱酸。
人教版高中化学必修一高一第一章练习题.docx

高中化学学习材料唐玲出品高一化学第一章练习题一、选择题1.下列实验基本操作(或实验注意事项)中,主要是处于实验安全考虑的是()A.实验剩余的药品不能放回原试剂瓶B.可燃性气体的验纯C.气体实验装置在实验前进行气密性检查D.滴管不能交叉使用2.已知丙酮通常是无色的液体,不溶于水,密度小于1 g•cm-3,沸点约为55℃。
要从水与丙酮的混合物中将丙酮分离出来,应选用()A.过滤 B.蒸馏 C.分液 D.蒸发3.在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的()4.下列说法中正确的是()A.摩尔是物质质量的单位,用“mol”表示B.标准状况下,气体摩尔体积约为22.4 mol/LC.阿伏伽德罗常数的真实值为6.02×1023D.物质的量浓度的常用单位是mol/L5. 有关化学实验的下列操作中,一般情况下不能相互接触的是()A.过滤操作中,玻璃棒与三层滤纸B.过滤操作中,漏斗径与烧杯内壁C.分液操作中,分液漏斗径与烧杯内壁D.用胶头滴管向试管滴液体时,滴管尖端与试管内壁6. 下列关于物质分类的叙述错误的是()A.饱和食盐水属于混合物 B.Na2CO3既属于钠盐又属于碳酸盐C.CuSO4·5H2O属于混合物 D.纯净物一般可分成单质和化合物两类7.有一种气体的质量是14.2 g,体积是4.48 L(STP),该气体的摩尔质量是()A.28.4B.28.4g·mol-1C.71D.71g·mol-18. 同温同压下,等质量的下列气体所占有的体积最大的是()A.H2 B.CH4 C.CO2 D.SO29.现有三组溶液:①汽油和氯化钠溶液②39%的乙醇溶液⑧氯化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是()A.分液、萃取、蒸馏B.萃取、蒸馏、分液C.分液、蒸馏、萃取D.蒸馏、萃取、分液10.实验中的下列操作叙述正确的是()A.蒸馏时沸石的作用是防止液体受热时突然沸腾B.蒸馏操作时,需要将温度计水银球插入到蒸馏液体的液面以下C.用蒸发方法使NaCl从溶液中析出时,应加热至蒸发皿中溶液全部蒸干D.用浓硫酸配制稀硫酸时,可将量取好的浓硫酸直接转移至容量瓶后再加水定容11.已知1.505×1023个X气体分子的质量为8g,则X气体的相对分子质量是()A.16 B.32 C.64g /mol D.32g /mol12. 20℃时,KCl的溶解度为34g,若忽略固体溶解引起的溶液体积变化,则在该温度下,所配KCl 溶液中KCl的物质的量浓度不可能是()A.2 mol/LB.3 mol/LC.4 mol/LD.5 mol/L13.欲除去NaNO3中少量Na2SO4、Ca(NO3)2杂质,所用试剂及其加入顺序正确的是()A.Na2CO3、Ba(NO3)2、HNO3 B.BaCl2、Na2CO3、HClC.Ba(NO3)2、Na2CO3、HNO3 D.Ba(NO3)2、K2CO3、HNO314. 300mL某浓度的NaOH溶液中含有60g溶质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学学习材料
金戈铁骑整理制作
高一化学第一章测试题
相对原子质量:H:1 C:12 O:16 Na: 23 Cl:35.5 S:32 Mg:24 Al:27 N:14
(请将你选择题的所选答案填到以下的答案表格中,否则此题不记分!)
一.选择题(只有一个选项符合题意,每题3分,共30分)
1.要从食盐水溶液中分离得到食盐固体可采用的实验操作是( )
A、分液 B、过滤 C、蒸馏 D、蒸发
2.下列实验中不需要用到玻璃棒的是( )
A、配制0.1mol/L食盐溶液500mL B、过滤
C、 溶解 D、分液
3.从碘水中萃取碘的实验中,不能用作萃取剂的是( )
A、四氯化碳(CCl4) B、乙醇(酒精)
C、苯 D、汽油
4.实验室要配制0.5mol/L硫酸溶液500mL,需要用10mol/L的硫酸溶液的体积是
( )
A、25 B 、25L C 、25mL D 、50mL
5.金属钠的摩尔质量为( )
A、23 B、23g C、 23mol D 、 23g/mol
6.下列物质中,其物质的量为0.2mol的是( )
A、2.2g CO2 B、 4.8gMg C 、4.48L O2 D、49g H2SO
4
7.在0.5molNa2SO4中,含有的Na+离子数是( )个。
A、3.01×1023 B、 6.02×1023 C、 0.5 D 、 1
8.在相同条件下,与0.5mol由N2和CO组成的混合气具有相同的体积的是( )
A 1g H2 B 10g O2 C 11g CO2 D 16g CH4
9.除去NaNO3中少量NaCl、Ca(NO3)2杂质,所用试剂及顺序正确的是:
A Na2CO3 AgNO3 HNO3 B AgNO3 Na2CO3 HCl
C AgNO3 Na2CO3 HNO3 D AgNO3 K2CO3 HNO3
10.下列溶液中c(Cl-)最大的是( )
A 65mL1mol/L的KCl溶液 B 25mL3mol/L的NaCl溶液
C 20mL2mol/L的MgCl2溶液 D 10mL1.5mol/L的AlCl3溶液
二.选择题
(每小题有一个或二个选项符合题意,每题全对给3分,如有两个正确选项,但
只选一个且正确的给1分,凡有多选或错选的不给分。共15分)
11.在下列实验操作中错误的是: ( )
A分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出。
B蒸馏时,应使温度计的水银球靠近蒸馏烧瓶的瓶底。
C 过滤时,玻璃棒在引流过程中应放在三层滤纸处。
D称量时,称量物放在称量纸上,置于托盘天平左盘,砝码直接放在托盘天
平右盘。
12.下列说法不正确的是( )
A 物质的量是用来研究微观粒子的一个国际基本物理量,其单位是摩尔。
B气体的摩尔体积与温度和压强有关,压强越大,体积越大。
C 若x个N(氮)原子的质量是1克,则阿佛加德罗常数可表示为28x/mol
D 任何一种微观粒子,当摩尔质量以g/mol为单位时,其数值与这种粒子的
相对分子质量或相对原子质量相同。
13.下列叙述正确的是( )
A 250C 101KPa条件下,1摩尔任何气体的体积都是22.4升。
B 同质量的O2和O3所含的氧原子数相同。
C 同温同压下两种气体,只要分子数相同,所占体积相同,质量也相同。
D 标准状况下,体积是22.4升的物质,其物质的量可能是1摩尔。
14. 对于amolH2O和amolCO2的说法正确的是( )
A相同条件下体积一定相同 B 相同条件下的密度一定相同
C 分子个数与原子个数对应相同 D 质量比是9:22
15.物质的量浓度相同的NaCl MgCl2 AlCl3三种溶液,当溶液的体积比为3:2:1
时,三种溶液中Cl-的物质的量之比为( )
A 1:1:1 B 1:2:3 C 3:2:1 D 3:4:3
高一化学第一章测试题
______班 学号_____ 姓名____________
一选择题答案表(每题3分,共45分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
二.填空题(每空2分,共30分)
16在进行分液和配制物质的量浓度溶液时,首先要分别对分液漏斗、容量瓶进
行____________。
17在进行分液操作实验时用到的玻璃仪器是 .
18选择下列实验方法分离物质,将分离方法的序号填在横线上
A 萃取分液法 B 结晶法 C 分液法 D 蒸馏法 E 过滤法
①_____分离饱和食盐水与沙子的混合物。
②_____分离水和汽油的混合物。
③______分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
④_____从碘的水溶液里提取碘。
⑤______从硝酸钾和氯化钠的混合液中获得硝酸钾。
19在配制1mol/L 的NaCl溶液100mL 时,需要使用的玻璃仪器有量筒、烧杯、
玻璃棒和_______。操作步骤为 :计算、____、溶解、转移、____、定容和摇匀
等;如烧杯未洗涤或洗涤后未把溶液转移到容量瓶中,则实际浓度会偏______。
20 3.6克的H2O的物质的量是_______,分子个数是______ _,
氢原子的物质的量是_____ ,氧原子个数是____ ___。
三.实验探究题(8 分):
21.已知苯是一种重要的有机溶剂,不溶于水。现在一个分液漏斗中,有水和苯
的混合物,静置后,液体明显分为二层。请在滴管、烧杯、水、苯中选择器材和
药品,用实验说明哪一层是水,哪一层是苯。
四.计算题(共17分)
22.将00C 101KPa条件下的氯化氢(HCl)气体44.8L,通入492ML水中,(已知
水的密度为:1.00g/ML),得到密度为1.13g/ML的盐酸(即氯化氢的水溶液)。
(1)求此盐酸的质量分数?(5分)(计算结果保留一位小数)
(2)求此盐酸的物质的量浓度?(4分)(计算结果保留一位小数)
23.5.3g Na2CO3 正好与20mL盐酸完全反应。问这种盐酸的物质的量浓度为多少?
产生的CO2在标准状况下的体积是多少?(8分)
高一化学第一章测试题答案
一选择题(每题3分,共45分)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
D D B C D B B A C D BD BC BD CD D
二.填空题(每空2分,共30分)
16.检漏 17. 分液漏斗、烧杯
18.①E ②C ③D ④A ⑤ B
19.100mL容量瓶 称量 洗涤 低
20.0.2mol 1.204×1023 0.4mol 1.204×1023
21.先在烧杯中加入少量水,(1分)然后用滴管从分液漏斗中取几
滴上层液,(1分)把它滴入烧杯中,(1分)若两种液体互溶,没有
分层,(2分)则分液漏斗中的上层液体是水,否则是苯.(3分) (只
要合理,都可给分)
22.(1) 12.9% (2)4.0moI/L
23.c(HCl)=5.0mol/L V(CO2)=1.12L
