全球药研新动态-2011年第12期
2011年全球新药研发盘点

不知不觉,2012年到了,回首2011年,对于制药行业来说是一个“多事之秋”,行业在推出前景看好的治疗药物上似乎显得略为平淡。
Gilenya:副作用引关注2011年4月,当诺华生产的药物Gilenya在英国上市时,成为该国市场上第一只用于治疗多发性硬化症(MS)的口服药物。
这是MS治疗领域取得的一个重大进步,预计在未来几年中,这一领域将会出现更多的竞争对手。
Gilenya(fingolimod)被用来治疗高度活跃的复发‐缓解型多发性硬化症(在β干扰素注射药物治疗失败之后),但患者的病情还没有严重到足以需要输液治疗。
一名患者使用Gilenya治疗的费用每年平均为19665英镑,这其中包括患者在使用第一剂药物时的一次性观察费用502英镑。
总的来说,其治疗费用要比它最接近的竞争对手——Biogen公司生产的输液治疗药物Tysabri(natalizumab)便宜。
Gilenya在临床试验阶段给人留下了深刻印象,其中一项重要研究显示,与干扰素β‐1AIM相比,Gilenya使MS在1年内的复发率降低了52%。
但是,它确实会引发一些常见的、潜在性严重副作用,其中包括心脏节律不规则以及肠胃炎。
出于这些原因,诺华将被要求添加Gilenya的一项药物警戒。
Benlysta:将开展上市后评价2011年3月,葛兰素史克(GSK)与人类基因组科学(HGS)公司合作研发的狼疮治疗药物Benlysta在美国获批上市,但是从长远来看,如果它想继续留在市场上销售,将必须证明其具有安全记录。
Benlysta是FDA过去50多年来批准的第一只狼疮治疗新药,由于认识到该药可能将是这一疾病治疗领域取得的一大进步,FDA在对它的审批中运用了快速通道。
Benlysta(belimumab)可被用于患自身抗体阳性的系统性红斑狼疮(SLE)成年人的治疗。
狼疮是一种潜在致命性自身免疫性疾病,美国大约有30万~150万名患者,这一疾病更多地影响到女性特别是非洲裔美国妇女。
全球药研新动态-2011年第7期_图文(精)

中国医药数字图书馆产品名称注册类型进展现有国产批文数治疗大类 治疗小类激素类药褪黑素 3.1 在审评 0 内分泌及代谢调节用药下丘脑垂体激素及有关药下丘脑垂体激素及有关药创伤药妇科抗真菌制剂女用避孕药女用避孕药其它抗消化性溃疡药质子泵抑制剂 beta-阻滞剂 beta-阻滞剂调血脂抗动脉粥样硬化药(降血脂药)复方降压药复方降压药血管紧张素转换酶抑制剂(ACEI)抗贫血药血浆代用品解毒药头孢菌素类抗代谢药褪黑素缓释片复方羧甲司坦烧伤膏硝酸布康唑醋酸优力司特醋酸优力司特片奥美拉唑碳酸氢钠干混悬剂复方奥美拉唑胶囊盐酸奈必洛尔盐酸奈必洛尔片苯磺酸氨氯地平辛伐他汀片氨氯缬沙噻嗪片坎地沙坦酯氨氯地平片群多普利片富马酸亚铁叶酸片羟乙基淀粉 130/0.4 醋酸钠林格注射液盐酸戊乙奎醚片盐酸头孢卡品酯卡培他滨片3.1 1.5 3.1 3.1 3.1 3.2 3.2 3.1 3.1 1.5 3.2 3.2 在审评在审评在审评在审评在审评在审评制证完毕在审评在审评在审评在审评在审评 0 0 0 0 0 0 0 0 0 0 0 0 内分泌及代谢调节用药皮肤科用药生殖系统用药及性激素生殖系统用药及性激素生殖系统用药及性激素消化系统用药消化系统用药心血管系统用药心血管系统用药心血管系统用药心血管系统用药心血管系统用药 3.1 3.2 3.2 2 3.1 3.4 制证完毕在审评在审评在审评在审评在审评 0 0 0 0 1 4 心血管系统用药血液和造血系统用药血液和造血系统用药杂类抗感染药抗肿瘤药 2011 年 3 月申报临床研究取得进展生物制品品种产品名称重组人肝细胞生长因子裸质粒注射液门冬胰岛素门冬胰岛素 30 注射液 3 15 15 在审评在审评在审评 0 0 0 消化系统用药内分泌及代谢调节用药内分泌及代谢调节用药肝病用药胰岛素类似物胰岛素类似物注册类型进展现有国产批文数治疗大类治疗小类中国医药工业信息中心第 14 页中国医药数字图书馆产品名称门冬胰岛素注射液吸附无细胞百白破联合疫苗 ACYW135 群脑膜炎球菌多糖疫苗流感病毒裂解疫苗 15 15 在审评在审评2 12 生物技术药物生物技术药物 15 在审评 2 生物技术药物 注册类型 15 进展在审评现有国产批文数 0 治疗大类内分泌及代谢调节用药治疗小类胰岛素类似物预防性疫苗预防性疫苗预防性疫苗 4 进口药品申请月度分析本月取得进展的进口药品注册申请有 63 件,其中申报临床研究项目 36 个,申请上市或再注册项目 26 个,复审项目 1 个。
100种全球正在研发的新药 ( 2008年8月30)hz

100种全球正在研发的新药2008年8月30新药研发是一个耗资巨大的漫长过程。
目前,发达国家研究开发一个新分子实体药物,平均需要8亿美元,费时10年。
而一个新药一旦成功上市,年销售额可望达10亿美元以上。
因此,新药研发被视为企业增长的驱动力。
国家发改委医药工业信息中心站根据国外医药工业核心杂志上发表的最新资料,整理了100个全球主要在研药物,包括新分子实体药物62个、新生物药物29个、新制剂7个、新适应证用药2个。
这些药物是从数千个在研产品中精选出来的,拥有优于已上市产品的许多特点。
国家发改委医药工业信息中心站诚望国内制药企业能从中了解全球新药研发的最新方向,寻找到适合自己的研发模式,成功地推出新产品,在实现企业利润强劲增长的同时促进我国参与全球药品研发领域的竞争。
1. AGI-1067 82. ALFIMEPRASE 83. ALAGEBRIUM CHLORIDE(ALT-711)94. 阿尼芬净(ANIDULAFUNGIN)95. SORAFENIB(BAY-43-9006)116. BMS-488043 127. GLYMINOX GEL(C31G GEL)138. R-744(CERA)139. NXY-059(CEROVIVE)1310. CLOFARABINE 1411. COMBRETASTATIN A-4 PRODRUG 1612. 盐酸度洛西汀(DULOXETINE HYDROCHLORIDE,CYMBALTA)1713. 地西他滨(DECITABINE,DACOGEN) 1814. DALBAVANCIN 2015. 罗氟司特(ROFLUMILAST,DAXAS)2116. DEXANABINOL 2317. EDIFOLIGIDE SODIUM 2418. XIMELAGATRAN(EXANTA)2419. EXENATIDE 2520. FTY-720 2621. GCS-100LE(GCS-100) 2722. OBLIMERSEN SODIUM(GENASENSE) 2823. ICA-17043 2924. IDN-6556 2925. 伊罗夫文(IROFULVEN)2926. 哌立福新(PERIFOSINE,KRX-0401)3127. LAF-237 3228. LAX-101 3229. 奈拉滨(NELARABINE)3330. NS-2330 3431. 卢比替康(RUBITECAN,ORATHECIN)3432. 2-甲氧雌二醇(2-METHOXYESTRADIOL,PANZEM)3633. PHENSERINE 3634. PLD-118 3735. 普瑞巴林(PREGABALIN)3936. VATALANIB(PTK-787)4037. QAB-149 4138. DIFLOMOTECAN(R-1536) 4239. RAMELTEON 4340. 雷莫拉宁(RAMOPLANIN)4441. 雷诺嗪(RANOLAZINE,RANEXA)4542. 醋酸阿奈可他(ANECORTAVE ACETATE,RETAANE)4643. REVLIMID 4644. RIMONABANT 4845. 阿贝莫司钠(ABETIMUS SODIUM,RIQUENT)4946. ROTIGOTINE 5047. RSD-1235 5148. EFAPROXIRAL SODIUM(RSR-13)5149. 沙铂(SATRAPLATIN)5350. SCIO-469 5451. SPP-100 5552. SQUALAMINE 5553. BATABULIN SODIUM(T-67)5654. ERLOTINIB(TARCEVA)5855. TECADENOSON 5956. TLK-286(TELCYTA)5957. 二盐酸诺拉曲塞(NOLATREXED DIHYDROCHLORIDE,THYMITAQ)6158. 替拉那韦(TIPRANAVIR)63(2004年10月25勃林格殷格翰公司提交tipranavir(替拉那韦)新药)59. 替唑生坦(TEZOSENTAN,VELETRI)6460. VIRULIZIN 6461. 莫特沙芬钆(MOTEXAFIN GADOLINIUM,XCYTRIN)6662. 盐酸考尼伐坦(CONIVAPTAN HYDROCHLORIDE,YM-087) 68个例分析-新生物药物7063. PANITUMUMAB(ABX-EGF)7064. INGN-201(ADVEXIN)7065. AMB A1 LINKED MOLECULE(AIC) 7166. 那他珠单抗(NATALIZUMAB,ANTEGREN)7267. AXOKINE 7368. V-10153(BB-10153) 7469. 癌症疫苗(CANVAXIN)7470. CERTOLIZUMAB PEGOL(CDP870)7571. CTLA4-IG 7672. DX-88 7673. ECULIZUMAB 7774. ETC-216 7775. HSPE7-1ST GENERATION(HSPE7)7876. 人乳头状瘤病毒疫苗(HPV VACCINE) 7977. HUMAX-IL-15 7978. ISEGANAN HYDROCHLORIDE 8079. BELIMUMAB(LYMPHOSTAT-B)8080. 脑膜炎疫苗(MENACTRA)8181. NBI-3001 8282. NBI-6024 8283. 豹蛙酶(RANPIRNASE,ONCONASE) 8384. ONCOPHAGE 8385. OREGOVOMAB(OVAREX)8486. ALX1-11(PREOS)8587. PRO-542 8588. PROVENGE 8689. SPHERAMINE 8690. SA-IGIV(VERONATE)8791. 透明质酸酶(VITRASE)88个例分析-新制剂8992. 紫杉醇纳米制剂(ABRAXANE)8993. 阿托伐他汀+TORCETRAPIB (ATORVASTATIN+TORCETRAPIB)9094. 胰岛素纳米制剂(BASULIN)9095. 吸入型胰岛素(EXUBERA)9196. 长春新碱脂质体制剂(ONCO TCS VINCRISTINE)9197. 普拉睾酮(PRASTERONE,PRESTARA)9298. 聚谷氨酸紫杉醇(PACLITAXEL POLYGLUTAMATE,XYOTAX)93 个例分析-新适应证用药9599. 舒洛地昔(SULODEXIDE,KRX-101)95100. 米那普仑(MILNACIPRAN)95。
《世界在研新药精选》

《世界在研新药精选》--2003版我公司在2002 年11 月推出了《世界在研新药精选-2002 版》,得到了广大读者的认可。
2004 年1 月我们根据最新数据和信息编辑了这本《世界在研新药精选-2003 版》。
本书精选了100 种国外在研新药进行详细介绍。
内容包括产品的开发背景、开发状态、化学结构、药代动力学、药效学、不良反应、临床试验、产品的市场信息与商业前景等全面的信息。
对大部分产品我们进行了跟踪,提供产品至2003 年11 月最新的研发动态和商业动态。
2003 版和2002 版在内容上不重复,两者结合使用将使您全面了解2002-2003 年世界新药开发最新信息与动态。
本书是本公司推出的《世界新药研发丛书-2003 版》系列之一,全书12 万字。
《世界新药研发丛书》系列将在近期陆续推出,该系列丛书是您了解世界新药开发现状,指导投资立项的绝佳参考。
定价:158元。
目录第1章心血管系统疾病治疗药物选介1. 基因工程动脉粥样硬化症治疗药物:ETC-642 12. 心、肾功能衰竭治疗药物:Candoxatrilat 23. 冠脉栓塞及外周血管疾病治疗药物:伊非曲班34. 充血性心力衰竭和肺动脉高压治疗药物:enrasentan 45. 心律失常治疗药物:司美利特46. 来自蝙蝠唾液的溶栓药:Desmoteplase 57. 肺动脉高压症治疗药物:Sitaxsentan Sodium 58. 心绞痛治疗药物:雷诺嗪79. 新上市的降脂药物:Colesevelam 810. 新型动脉粥样硬化症治疗药物:AGI-1067 9第2章中枢神经系统疾病治疗药物选介11. 帕金森氏病治疗药物:Brasofensine 1212. 帕金森氏病治疗药物:Istradefylline 1213. 抗癫痫药物:Carabersat 1314. 中枢神经系统损伤治疗药物:CP 101606 1415. 新型镇痛药:Cizolirtine citrate 1416. 记忆增强剂:CX516 1617. 帕金森氏病相关运动障碍治疗药物:盐酸fipamezole 17第3章眼科疾病治疗药物选介18. 眼科术后瘢痕预防药物:CA T-152 1919. 视网膜剥离症治疗药物:INS 37217 1920. 近视眼治疗药物:哌仑西平眼用凝胶剂(pirenzepine)20第4章泌尿生殖系统疾病治疗药物选介21. 膀胱过动症及尿失禁治疗药物:Darifenacin 2222. 尿毒症性瘙痒治疗药物: hydrochloride 2323. 女性性功能障碍治疗药物:Estradiol-vaginal 2424. 早泄治疗药物:Dapoxetine 2625. 间质性膀胱炎治疗药物:Resiniferatoxin 2626. 慢性肾功能衰竭高磷血症治疗药物:Lambda 2727. 女性不孕症治疗药物:Iturelix 2828. 治疗良性前列腺增生天然药物:PHL 00801 29第5章艾滋病治疗药物选介29. 日服一次抗HIV药物atazanavir sulfate及其竞争潜力分析3030. 非核苷逆转录酶抑制剂:Emivirine 3131. HIV蛋白酶抑制剂:KNI-272 3232. 艾滋病治疗药物:Capravirine 3333. 逆转录酶抑制剂:R 82913 34第6章在研抗病毒药物选介34. 抗乙肝病毒药物:Entecavir 3635. 乙肝治疗药物:ACH-126443 3736. 抗病毒药物:干扰素-ω3837. 小核糖核酸病毒感染治疗和预防药物:WIN 54954 3938. 筛选中的SARS病毒感染治疗药物:AG7088 4039. 巨细胞病毒感染治疗药物:BAY 384766(tomeglovir)4140. 甲型肝炎/乙型肝炎联合疫苗:AmBirixTM 4241. 乙型肝炎DNA疫苗43第7章在研抗生素药物选介42. 三唑类抗真菌药物:Posaconazole 4443. 新型口服链阳霉素类抗生素:Efepristin 4544. 新型抗菌药物:ABT 719 4645. 碳青霉烯类抗生素前药:Tebipenem 4746. 喹诺酮类抗生素:Olamufloxacin 4847. 口服碳青霉烯类抗生素:CS 834 8548. 胃滞留环丙沙星5049. 呼吸道细菌感染治疗药物:LW 50020 5250. 微孢子虫病治疗药物:Fumagillin 5251. 糖肽类抗生素:雷莫拉宁5352. 糖肽类抗生素:Oritavancin 5453. 新一代喹诺酮类抗菌素:加替沙星55第8章消化系统疾病治疗药物选介54. 功能性消化不良治疗药物:Z-338 5755. 抗焦虑及呕吐治疗药物:Zatosetron 5856. 化疗止吐药:Aprepitant 5957. 功能性消化不良治疗药物:Alemcinal 6058. 胰腺炎及炎症反应治疗药物:L Y 315920 6259. 肠易激惹综合征治疗药物:非多托秦6360. 肠易激惹综合征治疗药物:替加色罗6461. 便秘治疗药物:alvimopan 65第9章呼吸系统疾病治疗药物选介62. 成人呼吸窘迫综合征与炎症性疾病治疗药物:CAB-2 6863. 急性肺损伤和肺纤维化治疗药物:Sivelestat 6964. 中性粒细胞弹性蛋白酶抑制剂:DMP 777 7165. 肺纤维化治疗药物:Pirfenidone 7266. 先天性肺气肿治疗药物:重组α1抗胰蛋白酶7367. 白三烯B4拮抗剂:Atreleuton 7368. 哮喘治疗药物:Salmeterol inhalation aerosol 7469. 血栓烷A2受体拮抗剂:Domitroban 7470. 哮喘治疗药物:IPL 576092 76第10章代谢性疾病治疗药物选介71. 前列腺癌及性早熟治疗药物:Deslorelin 7772. 甲状旁腺功能亢进症治疗药物:Cinacalcet hydrochloride 7873. 开发中的利尿剂:SR 121463 8074. 天然胰岛素受体激动剂:CLX-0901 8075. 鼻内给药降钙素:SB 205614 8176. 肢端肥大症治疗药物:Pegvisomant 8177. 生长激素释放因子类似物:Examorelin 8378. 生长激素释放激素拮抗剂:Vapreotide 8479. 促性腺激素释放激素类似物:SPD 424 8580. 重组促甲状腺素85第11章其他世界在研新药81. 重组骨保护素(Osteoprotegerin)8782. 重组睫状神经营养因子8883. 重组血管内皮细胞生长因子(rhVEGF165)8984. 重组转化生长因子-α9085. 5-脂氧酶/环氧酶抑制剂:ER 34122 9186. 血小板增多症治疗药物:Anagrelide 9187. 类风湿性关节炎治疗药物:S 2474 9388. CDK选择性小分子抑制剂:R-roscovitine(CYC-202) 9489. 胃促胰肽酶抑制剂:NK-3201 9590. 阿片μ受体激动/拮抗剂:Propiram 9691. 化疗与放疗增敏剂:依他硝唑9792. 第一个蛋白酶体抑制剂Bortezomib及其竞争潜力分析9893. 类胰蛋白酶抑制剂:APC 2059 10094. 磷酸胆碱乙酰转移酶抑制剂:Ilmofosine 10095. 选择性雌激素受体调节剂:Pipendoxifene 10196. 淋巴瘤治疗药物:Epratuzumab 10297. 纤维蛋白原刺激剂:KABI 2161 10398. 慢性淋巴细胞白血病治疗药物:Campath-1H 10499. 头孢菌素类抗生素:Cefmatilen 104100. 磷酸二酯酶抑制剂:Bemoradan 106。
全球药品研发进展_2010_09_

本月全球药品研发进展取得成效的药物有40个,比上月增加8个,除进入Ⅲ期临床研究阶段的药品数量较上月减少2个外,进入注册和注册前研究阶段的药品数量均有不同程度的增加。
进入注册阶段的有19个,比上月增加4个。
其中7个为全球首次注册的新活性物质和新制剂,其余12个均为在新市场补充注册。
本月全球首次注册的7个药品中3个新活性物质,4个为新制剂(其中1个同属新适应证)。
3个新活性物质分别为治疗复发-缓解型多发性硬化症的盐酸芬戈莫德(神经系统用药)、治疗流行性感冒病毒感染的laninamivir (抗感染药)和治疗房颤的盐酸维那卡兰(心血管系统用药)。
4个新制剂为全身用透黏膜制剂、其它口服制剂、PEG 化制剂和固定剂量复方制剂(同属治疗经前综合征及痤疮的新适应证)。
本月在新市场补充注册的12个药物中,10个为新活性物质,2个为新适应证。
6个新活性物质分属生物技术药物、呼吸系统药物、骨骼与肌肉用药等8个治疗类别。
2个新适应证分别为TO-194用于治疗季节性过敏性鼻炎、乙酸格拉替雷用于治疗视神经炎。
进入注册前阶段的有9个,比上月增加7个。
其中6个为新活性物质,3个为新制剂。
6个新活性物质分别为凡德他尼、LAS-41005、rilpivirine 、acotiamide hydrochlorid 、darexaban maleate 和tafamidis ,分属抗肿瘤药、抗感染药、消化系统用药等6个类别。
3个新制剂分别为5-氨基乙酰丙酸的纳米制剂、恩曲他 滨+ 替诺福韦+ rilpivirine 固定剂量复方制剂、阿仑膦酸钠增溶口服制剂。
进入Ⅲ期临床研究的有12个,比上月减少2个。
全球药品研发进展(2010.09)Progress in Global Pharmaceutical R&D in September 2010黄志红(中国医药工业信息中心,上海 200040)HUANG Zhihong(China National Pharmaceutical Industry Information Center, Shanghai 200040)中图分类号:R95 文献标志码:C 文章编号:1001-8255(2011)05-A44-04其中9个为新活性物质,3个为新制剂。
药物警戒快讯2011年度第2期(总第94期)

药物警戒快讯2011年第2期(总第94期)2011年02月24日发布内容提要英国发布噻托溴铵吸入剂的安全性研究信息EMA对含重组人生长激素的药物进行评估英国警告舒尼替尼合并双膦酸盐治疗的颌骨坏死风险他莫昔芬在某些患者中出现治疗应答降低的风险英国发布人乳头瘤病毒疫苗的安全性审查结果英国发布噻托溴铵吸入剂的安全性研究信息英国药品和健康产品管理局(MHRA)在2010年第4期《Drug Safety Update》中发布了关于吸入型抗胆碱药噻托溴铵(Tiotropium)的安全性研究信息。
噻托溴铵是一个长效毒蕈碱受体拮抗剂,批准作为处方药用于维持支气管扩张的治疗,以减轻慢性阻塞性肺疾病(COPD)的症状。
商品名思力华(Spiriva),有两种制剂:用药粉吸入器HandiHaler从一粒含有18μg噻托溴铵的胶囊中吸入药粉,每天一次;用软雾吸入器Respimat给药,每揿2.5μg噻托溴铵,2喷,在每天的同一时间给药一次。
MHRA之前已经注意到,近期关于吸入型抗胆碱药的安全性研究结果存在不一致性。
尽管一些公布的研究已经表明与这些药物的使用有关的心血管死亡、心肌梗死或卒中的风险增加,但是一个大型的4年期安慰剂对照随机、双盲试验显示,与安慰剂相比用药粉吸入器HandiHaler给药的噻托溴铵与全因死亡、心肌梗死或卒中风险的非显著性降低有关。
在一项最近完成的安全性研究中发现,与安慰剂相比,日剂量为5μg的思力华Respimat改善了COP D患者的肺功能、COPD恶化状况和生活质量,但其全因死亡率增加。
对包括6096例患者的3个1年期和1个6个月治疗期的安慰剂对照试验进行回顾性合并分析,结果显示思力华药物组患者的全因死亡率有非显著性的增加:在计划治疗期内,思力华组68例患者死亡(发生率[IR]2.64例/100患者年)与安慰剂组51例患者死亡(IR 1.98例/100患者年)相比,发生率比为1.33(95%CI 0.93-1.92)。
FDA 全球2011新药数量与2010持平

FDA 全球2011新药数量与2010持平Retrospection and Prospection: The Number of New Drugs in 2011 Equal to That of 2010 Worldwide2010年,FDA共批准21个新药,是近年来批准新药较少的年份。
虽然有几只具有“重磅炸弹”潜力的新药获批,但一些被寄予高度厚望的新药被推迟到2011年。
反映出FDA批准新药的门槛越来越高,如基于安全考虑被拒或延迟批准的减肥药、糖尿病药和其它一些类别药物。
根据FDA批准新药报告,2010年共有21个新药获得FDA批准(不包括新组分和新适应症),比2009年的25个和2004年的24个略低,高于2007年的18个。
加大安全考虑新批准药物包括一些重要的生物制剂,如安进一年2次治疗绝经后妇女注射型的骨质疏松药物狄诺塞麦(Prolia),罗氏旗下的基因泰克静脉给药的治疗类风湿性关节药物炎药物Actemra。
勃林格殷格翰的达比加群酯胶囊(Pradaxa)于去年10月19日获得FDA批准,是一种心节律不规律患者卒中预防的血液稀释剂,成为大型制药公司中华法林替代药物领域的领跑者。
而阿斯利康的抗凝血药物Brilinta在2010年最后一个月遭遇挫折,FDA要求提供更详细的研究信息。
10月,首个多发性硬化症口服药物诺华的Gilenya获FDA批准,而在年初,FDA还批准Acorda公司的改善多发性硬化症的药物Ampyra。
8月,FDA批准一种新的紧急避孕药ella,该避孕药可以在无保护性交之后5日内服用以避免意外怀孕,该药由法国HRA Pharma制造,在美国由Watson制药代销。
4月,曾被拒批过的Dendreon公司的前列腺癌药物Provenge获批,该药可调动患者自身的免疫系统对抗癌症,成为一种新型的抗癌药。
不过,2010年还有一些被看好的药物被FDA拒绝,也有一些被要求退市。
FDA推迟批准FDA推迟了安进和礼来的糖尿病特效药Byetta的长效新版本Brilinta,要求提供更多临床数据以消除心血管安全方面的担忧。
全球药品研发进展_2010_05_

杂类
(新市场)
Pharmaceuticals
注
在美国上市)
注册 新制剂/固定剂 (新市场) 量复方制剂,
ketoprofen + omeprazole (酮洛芬+奥美拉唑)
Meda
环氧合酶1、2抑制剂,H+、 K+转运ATP酶抑制剂
口服
类风湿性关节炎,强直 意大利,波兰,葡萄 抗炎和抗风湿药 骨骼与肌肉用药 性脊柱炎,骨关节炎, 牙,西班牙(2010年首
本月在新市场补充注册的药物有 7 个,其中有 4 个新活性物质,分属骨骼与肌肉用药 (Berinert-P)、 抗感染药 ( 肺炎球菌疫苗 )、皮肤科用药 ( 阿利维 A 酸 ) 和杂类 ( 乙酰半胱氨酸 )。3 个新制剂,分属骨骼与 肌肉用药的酮洛芬 + 奥美拉唑固定剂量复方制剂 ( 同 属 24 h 内缓释制剂,口服肠溶制剂 )、生殖系统用药 及性激素的地诺孕素 + 雌二醇固定剂量复方制剂 ( 同 属其它口服制剂 ),以及神经系统用药的芬太尼其它 缓释制剂 ( 同属局部用透黏膜制剂和全身用透黏膜制 剂 )。
中国医药工业杂志 Chinese Journal of Pharmaceuticals 2011, 42(3)
· XXI ·
全球药品研发进展(2010.05)
Progress of Global Pharmaceutical R&D in May 2010
刘玲玲
(中国医药工业信息中心,上海 200040)
意大利,卢森堡公国 (2009年首次在美国上
市) 印度,土耳其(2010年
首次在美国上市)
抗炎和抗风湿药 疫苗
骨骼与肌肉用药 抗感染药
中国医药工业杂志 Chinese Journal of Pharmaceuticals 2011, 42(3)
全球药研新动态-2010年第12期

2 本月全球首次注册药品
本月全球首次获得注册的药品有 3 个,较上月减少 6 个。这些产品中“新制剂” (创新度值为 3)产品 2 个。另一个产品的创新程度不详。
从产品的市场前景来看,这些产品中诺华公司(Novartis)的阿利吉仑+氨氯地平 (aliskiren + amlodipine)和 Gruenenthal 公司的盐酸曲马多(tramadol hydrochloride)市场 价值指数最高,均为 4(目标市场规模在 50 亿~100 亿美元之间)。另一个产品的目标 市场规模不详。
抗精神病药
利培酮 氯氮平
凝胶剂(外用) 片剂(分散片) 片剂(口腔崩解片)
抗感染药 抗肿瘤药
抗肝炎病毒药 喹诺酮类 头孢菌素类
抗代谢药
恩替卡韦
原料药,片剂(分散 片)
加替沙星
片剂(分散片)
头孢甲肟
注射剂
头孢克洛
片剂(分散片)
头孢他美
片剂(分散片)
奥替拉西+吉美嘧啶+替加 胶囊剂
氟,复方
吉美嘧啶
原料药
抗感染药 血液和造血系统用药
神经系统用药 心血管系统用药 生殖系统用药及性激素
生物技术药物 内分泌及代谢调节用药
精神障碍用药 呼吸系统药物 骨骼与肌肉用药
4 从创新性来看,新制剂产品最多, 3 共有 7 个;其次是 me-too 化合物产品, 3 有 2 个产品。
2 1 1
已成熟治疗 策略 5.6%
me-too化合 物
11.1%
1
不详
1
38.9%
1
1
先导化合物 5.6%
新制剂 38.9%
2011年FDA上半年批准20个新药

2011年FDA上半年批准20个新药2005年FDA批准新药数量严重下滑之后,到2010年一直处于低谷。
据统计,2005年FDA批准的新药数量为20个,比2004年少了14个。
2006年批准数量为18个,2007年为17个,达历史最低,2008年为24个,2009年为25个,2010年21个。
持续6年的低迷之后,在2011年制药行业新药研发终于有了复苏的迹象。
截至2011年7月底,FDA批准了20个新药。
这一令人鼓舞的转变,得益于制药公司改变了新药研发策略,从已知有良好治疗效果的me-too药物聚焦到了未知全新治疗领域药物的开发。
也许正是这样的勇气,让了无生机的制药行业有了久逢甘露的喜悦。
上半年新药超去年同期据美联社报道,FDA药品研究与评价部(CDER)主任Janet Woodcock日前在FDA 的新闻发布会上说:“我们看到的创新数不胜数,根本就记不过来。
”根据FDA的报告,今年前两季度已经批准的“新分子实体”数量已和去年全年水平相当。
与临床上已有的药品相比,这些药物在作用机制或治疗效果上都具有明显优势。
最近FDA 批准了首个可延长晚期黑素瘤(一种致死性皮肤癌)患者生存期的药物,以及50年来批准的首个治疗狼疮的药物。
此外还批准了治疗效果明显优于现有治疗药物的2个丙肝药物。
Janent Woodcock 指出,药物研发当下正处在“转折点”。
她补充解释道:“如果你是一位得了癌症或其它严重疾病的患者,看到这些新药获批备受鼓舞。
”现有新药的研发速度及批准数量已不能满足制药公司的需求。
因为制药巨头们的畅销药物正在逐一失去专利保护,其中包括排名第一的辉瑞的降胆固醇药阿托伐他汀钙(立普妥)。
该药将于今年11月失去专利保护。
据预测,到2015年辉瑞将因仿制药竞争,损失累计达1000亿美元。
这些新药品种并不能扭转“专利悬崖”所带来的冲击,但能起到缓冲作用。
根据Credit Suisse分析师Catherine Arnold预计:未来3年,将有20多个年销售额有望达到甚至超过10亿美元的创新性新药获得FDA批准(见下表)。
2011年FDA批准上市新药及全球新药研究最新进展_陈玲

与聚乙二醇化盐酸多柔比星脂质体 ( PLDH ) 联合应 用, 用于以铂类为主的治疗 6 个月后复发的卵巢癌。 2009 年 10 月, 欧洲药品管理局批准 trabectedin 在欧盟上市, 用于治疗复发性卵巢癌。 此前的 7 月 美国 FDA 就同一适应症驳回了 trabectedin, 并举出 了对不良反应和证据不足的担忧。 由于 trabectedin 生产商未提交任何在复发性卵巢癌患者中直接比较 trabectedin + PLDH 治疗方案与以铂类为主的化疗 方案的证据, 而只是将 trabectedin + PLDH 治疗方案 与不含铂的用药方案进行了比较, 因此英国国家健 康与临床优化研究所 ( NICE ) 评审员对此药亦尚存 有顾虑。2011 年 4 月 NICE 就复发性卵巢癌这一适 应症对本品做出最终裁决, 称不推荐使用本品。 1. 6 转移性软组织或骨肉瘤治疗药 2011 年 6 月默沙东和 Ariad 制药公司最新公布 表1
[2 ] 快速进 展 或 疾 病 负 荷 大 的 患 者 。 而 随 着 vemurafenib 的获准上市, 这些问题或将迎刃而解。 由于
这是第 1 个对间变性淋巴瘤激酶( ALK) 进行靶向治 疗的药品, 用于治疗通过 FDA 批准的检测确认为 ALK 阳 性 的 晚 期 或 转 移 性 的 非 小 细 胞 肺 癌 ( NSCLC ) 。ALK 基因变异被认为是 NSCLC 等癌症 发生的关键驱动因素。 ALK 在非鳞状细胞癌、 无吸 烟史或轻度吸烟史患者中较为常见, 但也在吸烟和 鳞状细胞癌组织患者中也有发现 。 crizotinib 是 FDA 6 年多来批准的第 1 个治疗肺 癌的新药, 表明 NSCLC 治疗模式正在发生转变, 有 望为肺癌个体化治疗开创新局面 。 1. 4 髓样甲状腺癌治疗药 2011 年 4 月 6 日, 阿斯利康公司的 vandetanib ( 凡德他尼, 商品名: Zactima ) 在美国获准用于治疗 不能手术、 局部晚期或转移的有症状或进展的髓样 MTC ) , 甲状腺癌 ( medullary thyroid carcinoma, 成为 第一个批准治疗髓样甲状腺癌药物 。 vandetanib 是口服的小分子多靶点酪氨酸激酶 抑制剂( TKI) , 每日给药 1 次, 其选择性地靶向参与 肿瘤扩散和生长的关键细胞信号传导途径 , 包括血 管内皮生长因子受体( VEGFR) 和表皮生长因子受体 ( EGFR) 。此外, 它还抑制驱动某些肿瘤生长和存活 并据信对 mtc 通路有重要意义的 RET 激酶 1. 5 卵巢癌治疗药
2011年全球创新药物研究内容及热点
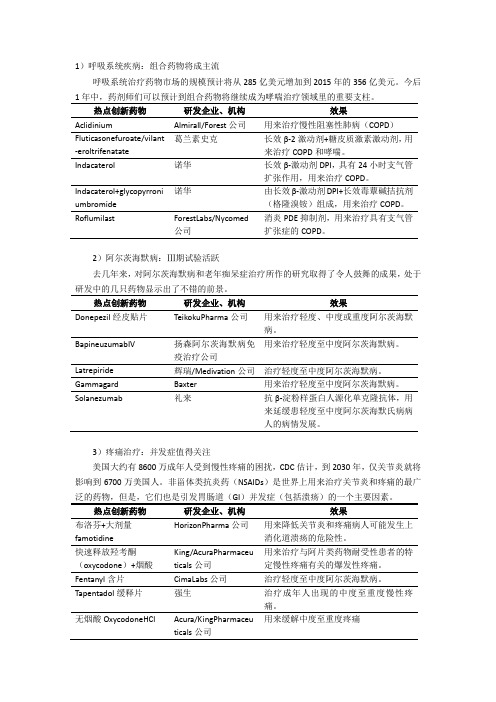
1)呼吸系统疾病:组合药物将成主流呼吸系统治疗药物市场的规模预计将从285亿美元增加到2015年的356亿美元。
今后1年中,药剂师们可以预计到组合药物将继续成为哮喘治疗领域里的重要支柱。
Almirall/Forest公司用来治疗慢性阻塞性肺病(COPD)Fluticasonefuroate/vilant -eroltrifenatate 葛兰素史克长效β-2激动剂+糖皮质激素激动剂,用来治疗COPD和哮喘。
Indacaterol 诺华长效β-激动剂DPI,具有24小时支气管扩张作用,用来治疗COPD。
Indacaterol+glycopyrroni umbromide 诺华由长效β-激动剂DPI+长效毒蕈碱拮抗剂(格隆溴铵)组成,用来治疗COPD。
Roflumilast ForestLabs/Nycomed公司消炎PDE抑制剂,用来治疗具有支气管扩张症的COPD。
2)阿尔茨海默病:Ⅲ期试验活跃去几年来,对阿尔茨海默病和老年痴呆症治疗所作的研究取得了令人鼓舞的成果,处于研发中的几只药物显示出了不错的前景。
热点创新药物研发企业、机构效果Donepezil经皮贴片TeikokuPharma公司用来治疗轻度、中度或重度阿尔茨海默病。
BapineuzumabIV 扬森阿尔茨海默病免疫治疗公司用来治疗轻度至中度阿尔茨海默病。
Latrepiride 辉瑞/Medivation公司治疗轻度至中度阿尔茨海默病。
Gammagard Baxter 用来治疗轻度至中度阿尔茨海默病。
Solanezumab 礼来抗β-淀粉样蛋白人源化单克隆抗体,用来延缓患轻度至中度阿尔茨海默氏病病人的病情发展。
3)疼痛治疗:并发症值得关注美国大约有8600万成年人受到慢性疼痛的困扰,CDC估计,到2030年,仅关节炎就将影响到6700万美国人。
非甾体类抗炎药(NSAIDs)是世界上用来治疗关节炎和疼痛的最广泛的药物,但是,它们也是引发胃肠道(GI)并发症(包括溃疡)的一个主要因素。
全球药研新动态-2011年第10期

国内药品研发进展
国产新药注册批准情况………………7 进口药品注册批准情况………………8 国产新药申请月度分析………………9 进口新药申请月度分析………………12
版权所有,如有转载, 请注明出处。
欲知更为详尽的资讯,请参阅中国医药 数字图书馆()及药 物综合数据库等专业资讯平台。 专业为本,客户至上!
市场潜力
Nulojix Viibryd Potiga Trobalt Actikerall
抗移植排异药
belatacept
日光性角化症治疗药
Actikerall
本月,百时美施贵宝公司的免疫调节剂 belatacept (Nulojix)在美国上市, 获准与皮质激素、 basiliximab 和霉酚酸酯联用,用于预防成年肾移植 患者的急性排斥反应。本品为人 IgG1 免疫球蛋白的 Fc 片段与 CTLA-4 的胞外域连接而成的融合蛋白。 给 药方式为 30 min 内静脉输注。 已有 2 项开放性、多中心、随机对照的Ⅲ期临床 研究对本品的疗效进行了评估,患者随机分组给予小 剂量本品、大剂量本品或对照环孢素 A 治疗。结果显 示,术后 2 年时三组在患者和移植肾存活率方面均相 似,小剂量本品组、大剂量本品组和环孢素 A 组分别 为 95%、94%和 91%。本品治疗的肾脏获益(根据肾 小球率过滤判断)持续至术后 2 年。 本品附带一个黑框警示:本品可能增加移植后淋 巴增生性障碍(PTLD)的风险,这是一种器官移植后白 细胞失控增长的癌症。从未接触过 EB 病毒(EBV)(单 核细胞增多症的病因) 的接受过移植手术的患者患上 PTLD 的风险是很高的。患者应当对 EBV 进行测试。 另外的黑框警示,同样也是其他免疫抑制剂的黑框警 示警告了可能增加严重感染和其他癌症的风险。
全球药品研发进展(2009.07)

中国医药工业杂志 Chinese Journal of Pharmaceuticals 2010, 41(6) · ·477全球药品研发进展(2009.07)Progress of Global Pharmaceutical R&D in July 2009吴霖萍(上海医药工业研究院信息中心,上海 200040)WU Linping(Pharmaceutical Industry Information Center, Shanghai Institute of Pharmaceutical Industry, Shanghai 200040)中图分类号:R95文献标志码:C文章编号:1001-8255(2010)06-0477-04本月全球药品研发进展取得成效的药物有46个,较上月增加了1个。
进入注册阶段的有31个(13个为全球首次注册的新活性物质和新制剂,18个为在新市场补充注册),比上月增加了6个。
本月全球首次注册的药物为13个,其中有5个新活性物质,分属骨骼与肌肉用药、抗感染药(2个)、内分泌及代谢调节用药(同属生物技术药物)和心血管系统用药。
8个新制剂,分别为paliperidone的纳米制剂和24 h以上缓释制剂(精神障碍用药),芬太尼(fentanyl)的其它缓释制剂、局部用透黏膜制剂和全身用透黏膜制剂,盐酸多奈哌齐凝胶(donepezil hydrochloride jelly)的其它口服制剂,芬太尼(fentanyl)的全身用透黏膜制剂,舒马普坦(sumatriptan)的无针头非胃肠道制剂(4个均属神经系统用药),treprostinil sodiums的其它吸入剂(内分泌及代谢调节用药),顺铂(cisplatin)的脂质体制剂(抗肿瘤药;同时也是新适应证,用于治疗鳞状细胞癌)以及Bioerodible Mucoadhesive film的制剂技术(制剂)。
全球在研药物概况

按来源分类
在研药物数
占比(%)
生物技术药物
3184
25.85
化学药物
8470
68.76
天然来源药物
540
4.38
其它
124
1.01
合计
12318
100.00
二 治疗类别:抗肿瘤药物研究占据首位
按治疗类别分类,这些在研药物在各治疗类别中的分布情况见下表。其中,由于某些药物可能跨多个治疗类别,因此加数总和比12318大。本表主要反映了在研药物所属领域的侧重情况。其中,在研的制剂产品有2435个,所占的比例为11.74%。
803
3.87
心血管系统药物
1192
5.75
肌肉骨骼系统药物
1356
6.54
制剂
2435
11.74
消化/代谢系统药物
1710
8.24
抗感染药物
2184
10.53
神经精神系统药物
2366
11.41
生物技术产品
2441
11.77
抗肿瘤药物
2746
13.24
合计
20743
100.00Байду номын сангаас
三 适应证:神经精神系统疾病用药领街
占比(%)
临床前
4805
39.01
临床(未标明阶段)
3
0.02
I期临床
1427
11.58
II期临床
1811
14.70
III期临床
573
4.65
注册前
141
1.14
已注册(未上市)
81
0.66
2013年12期 全球药物创新快讯

剂型 注射剂 片剂 胶囊剂 霜剂 胶囊剂 缓释片 注射剂 咀嚼片 血病
适应证 慢性淋巴细胞白
上市许可持有者 GENENTECH SUNOVION PHARMS INC PHARMACYCLI CS INC MEDICIS JANSSEN AND DEV RES SHARP
批准时间 11/01 11/08 11/13 11/14 11/22 11/25 11/25 11/27
<<延伸阅读>> FDA 批准 Gazyva 用于治疗慢性淋巴细胞性白血病 美国食品药品监督管理局(FDA)于 2013 年 11 月 1 号批准 Gazyva (obinutuzumab) 与苯丁酸氮芥联用治疗初治型慢性淋巴细胞白血病 (CLL) 患者。 CLL 是一种缓慢加重的渐进性血液与骨髓系统疾病。根据美国国家癌症研究所估计,2013 年将有 15680 名美国人被确诊患有该疾病,4580 人因 CLL 死亡。 Gazyva 有助于免疫系统的某些细胞攻击癌细胞,并且需要与另一种 CLL 治疗药物——苯丁 酸氮芥合用。 在对重症 CLL 患者的治疗过程中,Gazyva 在安全性和有效性方面表现出显著改善,此外, FDA 还授予此药优先审查和孤儿药地位。
癫痫部分性发作 套细胞淋巴瘤 足癣 丙肝病毒感染
侵 袭 性 曲 霉 菌 和 MERCK DOHME 念珠菌感染预防 静脉曲张 高磷血症
polidocanol (NDA # 205098) VELPHORO sucroferric (NDA # 205109) oxyhydroxide
PROVENSIS VIFOR FRESENIUS
《全球药研新动态》 2013 年第 12 期
审 阅:朱建英 编 写:华颖菲 美 编:钱苗苗 信息来源:医药地理
全球药品研发进展_2009_07_

全球药品研发进展(2009.07)Progress of Global Pharmaceutical R&D in July 2009吴霖萍(上海医药工业研究院信息中心,上海 200040)WU Linping(Pharmaceutical Industry Information Center, Shanghai Institute of Pharmaceutical Industry, Shanghai 200040)中图分类号:R95文献标志码:C文章编号:1001-8255(2010)06-0477-04本月全球药品研发进展取得成效的药物有46个,较上月增加了1个。
进入注册阶段的有31个(13个为全球首次注册的新活性物质和新制剂,18个为在新市场补充注册),比上月增加了6个。
本月全球首次注册的药物为13个,其中有5个新活性物质,分属骨骼与肌肉用药、抗感染药(2个)、内分泌及代谢调节用药(同属生物技术药物)和心血管系统用药。
8个新制剂,分别为paliperidone的纳米制剂和24 h以上缓释制剂(精神障碍用药),芬太尼(fentanyl)的其它缓释制剂、局部用透黏膜制剂和全身用透黏膜制剂,盐酸多奈哌齐凝胶(donepezil hydrochloride jelly)的其它口服制剂,芬太尼(fentanyl)的全身用透黏膜制剂,舒马普坦(sumatriptan)的无针头非胃肠道制剂(4个均属神经系统用药),treprostinil sodiums的其它吸入剂(内分泌及代谢调节用药),顺铂(cisplatin)的脂质体制剂(抗肿瘤药;同时也是新适应证,用于治疗鳞状细胞癌)以及Bioerodible Mucoadhesive fi lm的制剂技术(制剂)。
本月在新市场补充注册的药物有18个,其中有14个新活性物质,分属精神障碍用药、抗感染药、抗肿瘤药(4个)、泌尿系统用药、内分泌及代谢调节用药、骨骼与肌肉用药(同属生物技术药物)、消化系统用药(2个,1个同属生物技术药物)、生殖系统用药及性激素、心血管系统用药和血液和造血系统用药。
药品技术审评论坛2011年第一期目录

药品技术审评论坛FORUM OF DRUG EVALUATION2011年第1期总第31期目 次组织管理 (1)药品审评中心工作动态 .............................................................................. 药品审评中心讨论与交流 (4)关于中药、天然药物概念与范畴的思考 ...............................................................张永文 (10)高效、准确、快捷地测定大批量溶出度样品 .....................................................谢沐风(14)除菌过滤器验证(一):法规要求概述 ........................................................... 黄晓龙等(22)除菌过滤器验证(二):除菌效率验证 ...............................................................谢婷等(29)重视非临床安全性评价供试品的检测 ............................................................. 胡晓敏等(31)浅谈WHO 国家疫苗监管体系评估及其上市许可板块要求 ........................... 李敏 孔漫进展与动态 (40)研究药械组合产品审评审批相关工作 ..................................................... 药品审评中心全球首批新药 (42)美国FDA 2010年11-12月批准新药简介 ...........................................................汤仲明 (55)2010年FDA 批准的新化学药品(NDAs )和生物制品(BLAS )情况介绍..................................................................................................................... 药品审评中心国外信息 (9)FDA 批准度洛西汀(Cymbalta )治疗慢性肌肉疼痛 (13)FDA 建议基因泰克公司撤消阿瓦斯汀治疗乳腺癌适应症 (21)EMA 宣布诺华公司撤回唑来膦酸扩大适应症申请 (28)FDA 批准人乳头瘤病毒疫苗Gardasil 预防肛门癌 (64)FDA 批准盐酸维拉佐酮治疗重度抑郁症 (64)FDA 批准Xgeva 用于辅助预防癌症引起的骨骼损伤 (65)2010年11-12月FDA 批准的首仿药相关信息 (67)《日本医疗用药品品质情报集》多条溶出曲线及溶出度质量标准(四) (67)品种1:薁磺酸钠 (69)品种2:薁磺酸钠・L-谷氨酰胺(复方谷氨酰胺) (73)品种3:乙酰谷酰胺铝 (74)品种4:乙酰苯丁脲 (76)品种5:醋磺己脲 (78)FDA 发布安全信息通告:房颤/房扑治疗药决奈达隆(商Multaq )可能导致肝损害 (90)FDA 发布安全信息通告:止吐药多拉司琼(Anzemet )可引起心律异常 其他 (79)药品审评中心2010年度工作总结和2011年重点工作 (85)药品审评中心2011年药物研发与评价研讨班总体安排 (88)《药品技术审评论坛》2011年稿约主办单位:国家食品药品监督管理局药品审评中心 编 辑 部: 研究与评价部责任编辑:邵 颖 单位地址:北京市海淀区复兴路甲1号 联系电话: 68585566传 真: 68584216邮政编码: 100038E-mail :shaoy@药品审评中心版权所有,转载须先获许可Sponsored by Center for Drug Evaluation,State Food and Drug AdministrationEditing Office:Office of Research & EvaluationResponsible Editor: shao yingAdd: Jia-1, Fuxing Rd. Beijing 100038Tel :68585566药品技术审评论坛FORUM OF DRUG EVALUATION2011 No.1ContentsMANAGEMENT AND POLICY(1) CDE Works Trends…………………………………..……………………..……….………..….…….. CDERESEARCH AND DISCUSSION(4) Viewpoints on the Conception and Category of Chinese Traditional Medicines and Natural Medicinal Materials……………………………………………………………………………………….. Zhang Yongwen (10) High-efficient and Accurate Method for Determination of Multi-Dissolution Samples…….... Xie Mufeng (14) Validation of Sterilizing Grade Filters (Ⅰ):Overall Review of Regulatory Requirements …………………………………………………………………………………………….. Huang Xiaolong, et al (22) Validation of Sterilizing Grade Filters (Ⅱ):Sterilization Efficiency….…………………….. Xie Ting, et al (29) Emphasis on test samples assay for non-clinical safety study……………………………Hu Xiaomin, et al (31)Discussion on the National Regulatory Authority Assessment of WHO Focus on the Market Authorization and Licensing Activities Function……………………………………………………………Li Min Kong ManDEVELOPMENT TREND(40) recent work on registration of drug-medical equipment combination products……………………..…CDEGLOBAL NEW DRUG APPLICATION(42) Introduction of New Drug Application of FDA in November and December 2010…..…Tang Zhongming (55) Introduction of 2010 NDAs and BLAs of FDA……………………………………………………....... CDEOTHERS(79) 2010 Annual Performance Report and 2011 Work Plan of CDE………………………………………CDE (85) Notice for 2011 CDE Workshops………………………………………………………………………CDE (88) Notice to Contributors…………………………………………………………………………………CDE。
全球药品研发进展_2011_06_

全球药品研发进展(2011.06)Progress in Global Pharmaceutical R&D in June 2011吴霖萍(中国医药工业信息中心,上海 200040)WU Linping(China National Pharmaceutical Industry Information Center, Shanghai 200040)中图分类号:R95 文献标识码:C 文章编号:1001-8255(2012)02-A16-05本月全球药品研发进展取得成效的药物有42个,较上月减少了7个,除进入注册前阶段的药物数量与上月持平以外,进入注册阶段和Ⅲ期临床研究阶段的药品数量均较上月有所减少。
进入注册阶段的有18个,比上月减少5个。
其中2个为全球首次注册的新制剂,其余16个均为在新市场补充注册。
本月进入注册阶段的品种为皮肤科药物过氧苯甲酰的局部用透皮制剂和神经系统药物羟考酮的速释制剂。
其中羟考酮为全球首次注册。
本月在新市场补充注册16个药物,较上月增加3个。
其中11个新活性物质分别为骨骼与肌肉用药、抗肿瘤药、泌尿系统用药、免疫调节剂(2个,其中1个同属生物技术药物)、神经系统用药(4个)、血液和造血系统用药(2个,1个同属生物技术药物)。
5个新制剂分别为内分泌及代谢调节用药依泽那太的24 h以上缓释制剂,感觉器官用药溴芬酸的局部用透黏膜制剂,皮肤科用药硝酸甘油的局部用透黏膜制剂,神经系统用药芬太尼的全身用透黏膜制剂,以及泌尿系统用药奥昔布宁的全身用透皮制剂和24 h内缓释制剂。
进入注册前阶段的有7个,与上月数量持平。
5个新活性物质,分别为呼吸系统用药、抗肿瘤药(2个)、皮肤科用药以及血液和造血系统用药。
另2个新制剂为神经系统用药哌甲酯的其他缓释制剂,以及感觉器官用药丝裂霉素的其他非胃肠道制剂和其他缓释制剂(同为罕用药)。
进入Ⅲ期临床研究的有17个,比上月减少2个。
其中12个为新活性物质,分属抗肿瘤药(3个,2个同属生物技术药物)、杂类(2个)、骨骼与肌肉用药(同属生物技术药物)、血液和造血系统用药(同属生物技术药物)、感觉器官用药、呼吸系统用药、抗感染药、泌尿系统用药和消化系统用药。
全球药品研发进展(2009.08)

全球药品研发进展(2009.08)
刘玲玲
【期刊名称】《中国医药工业杂志》
【年(卷),期】2010(41)7
【摘要】本月全球药品研发进展取得成效的药物有35个,较上月大幅减少了11个。
进入注册阶段的有27个(10个为全球首次注册的新活性物质和新制剂,17个为在新市场补充注册),比上月减少了4个。
【总页数】4页(P555-558)
【关键词】研发;药品;活性物质;注册;药物;制剂
【作者】刘玲玲
【作者单位】上海医药工业研究院信息中心
【正文语种】中文
【中图分类】R95
【相关文献】
1.全球药品研发进展(2009.02) [J], 刘玲玲
2.全球药品研发进展(2009.10) [J], 吴霖萍
3.全球药品研发进展(2009.03) [J], 吴霖萍
4.全球药品研发进展(2009.11) [J], 刘玲玲
5.全球药品研发进展(2009.9) [J], 黄志红
因版权原因,仅展示原文概要,查看原文内容请购买。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
9
hits
6
3
0 2010.08 2010.09 2010.10 2010.11 2010.12 2011.01 2011.02 2011.03 2011.04 2011.05 2011.06 2011.07 2011.08
中文通用名
博舒替尼
原研企业
Pfizer Ironwood Pharmaceuticals Takeda NeoProbe Allergan 病
版权所有,如有转载, 请注明出处。
欲知更为详尽的资讯, 请参阅中国医 药数字图书馆 ()及药物综合 数据库等专业资讯平台。 专业为本,客户至上!
中国医药工业信息中心
监控全球研发热点,把握中国新药脉搏!
第- 1 -页
中国医药工业信息中心
申请适应证
慢性粒细胞白血 肠易激综合征, 慢 性便秘 高血压 诊断癌症 粉刺
给药途径
口服 口服 口服 注射 局部用
国家
欧盟 欧盟 台湾 美国 美国
创新点
新分子实体 新分子实体 新分子实体 新分子实体 新制剂
市场潜力
白血病治疗药 博舒替尼 bosutinib
本月,Pfizer 公司向欧洲药品管理局递交了博舒 替尼(bosutinib)用于治疗新诊断费城染色体阳性 (Ph +)慢性髓性白血病慢性期(CML-CP)成人患者的 上市申请。 Bosutinib 为一种口服 Src 和 Abl 激酶双重抑制 剂,被认为可抑制慢性髓性白血病肿瘤细胞的生长、 生存和繁殖中的信号传导。 Ⅱ期临床研究观察 98 例抗 IM 和不耐受或曾用过 dasatinib 或 nilotinib 的 CML-CP 患者,用量为 500mg/d, 中位治疗 5 个月, 70%以上可获得完全缓 解 (CHR) 。 主要细胞遗传学缓解率 (MCyR) 42%, 主 要分子遗传学缓解率(MMoR)33%.。有/无突变者 有效率相同。耐受性好,血细胞下降率 8%~9%,有 少数患者发生水潴留或胸水。另报道治疗 57 例抗伊 马替尼和抗二代酪氨酸酶抑制剂的加速期/急变期 CML 患者,中位治疗 2.7 个月, 约 1/3 患者达 CHR 和 MCyR, 达 MCyR 时间为 8.9~12 周。维持 MCyR 已 18 周。 19 例受分子学检测者中有 4 例获 MMoR, 3 例获 CMoR。除 T315I 外可抑制多种突变。少数患者 发生血液毒性和水潴留。证明了本品对已上市的 TKIs 有抗药的各期 CML 均有一定的疗效。
英文通用名
abiraterone acetate amlodipine + perindopril
9
6
hits
3
0 2010.08 2010.09 2010.10 2010.11 2010.12 2011.01 2011.02 2011.03 2011.04 2011.05 2011.06 2011.07 2011.08
Adcetris Zelboraf Xalkori
avanafil emtricitabine + rilpivirine + tenofovir DF mometasone furoate 恩曲他滨+利 匹韦林+替诺 福韦 糠酸莫米松 Btripla Complera Eviplera Adcetris
上市
注册
注册前
III 期
抗肿瘤药和感觉器官用药领域取得 进展药品较多,分别有 6 个和 4 个产品 取得进展,具体见下图。
抗肿瘤药, 6 感觉器官用 药, 4 心血管系统用 药, 3 消化系统用 药, 3 抗感染药, 2 皮肤科用药, 2 杂类, 1 神经系统用 药, 1 内分泌及代谢 调节用药, 1 泌尿系统用 药, 1 精神障碍用 药, 1
Eisai
Gastaut 综 合 征
口服
美国
( 口 服 混悬剂)
抗前列腺癌药 阿比特龙 abiraterone
本月,BTG 公司的前列腺癌治疗药阿比特龙 (abiraterone,Zytiga)在美国上市,适应证为与泼尼 松联用治疗既往接受过多西他赛化疗的去势难治性 晚期(转移性)前列腺癌患者。 本品是肝药酶细胞色素 P450 17A1(CYP17A1) 抑制剂,这种酶在睾酮的生成过程中起着重要作用。 本品通过降低睾丸酮的生成来减少激素对癌细胞生 长的促进作用。 FDA 通过优先审批程序批准了本品。FDA 药物 审评和研究中心的肿瘤药品室主任 Richard Pazdur, M.D.表示: “Zytiga 延长了既往接受过多种治疗的已 经没有多少治疗选择的晚期前列腺癌患者的寿命” 。 临床研究显示,接受本品和泼尼松联用治疗的患 者的中位生存时间为 14.8 个月,而接受安慰剂和泼 尼松治疗患者的中位生存时间为 10.9 个月。
中文通用名
乙酸阿比特 龙 氨氯地平 + 培 哚普利 卢非酰胺
商品名
原研企业
批准 适应证
前列腺癌
给药 途径
口服
上市地
创新点
新 分 子 实体 新制剂 新 制 剂
市场潜力
Zytiga CoversylAM Banzel , Inovelon
BTG
欧盟
Servier
高血压 Lennox -
口服
印度
rufinamide
监控全球研发热点,把握中国新药脉搏!
第- 3 -页
中国医药工业信息中心
3
本月全球首次进入审批阶段药品
12
Aug :5
注册前 其中新分子实体药物 4 个。
英文通用名
bosutinib linaclotide acetate azilsartan medoxomil tilmanocept tazarotene 他扎罗汀
目
全球药品研发进展
录
《全球药研新动态》 2011 年第 12 期
上海数图健康医药科技有限公司 地址:上海市北京西路 1320 号 (200040) 编写:赖树清 审核:朱建英 电话:021-62890730 传真:021-62890581 E-mail:info@pharmadl.com
2011 年 8 月,全球共有 25 个(剔除重复项目)药物研发项目取得关键进展,其 中首次上市的药品 3 个,首次注册的药品 6 个,新进入审批阶段的药品 5 个,新进 入 III 期临床研究的药品 11 个。
25 20 15 10 5 0
20 10 .0 9 20 10 .1 0 20 10 .1 1 20 10 .0 8 20 10 .1 2 20 11 .0 3 20 11 .0 4 20 11 .0 5 20 11 .0 6 20 11 .0 7 20 11 .0 1 20 11 .0 2 20 11 .0 8
抗癫痫药 卢非酰胺 rufinamide
本月,日本卫材制药公司推出的卢非酰胺口服混 悬液制剂(rufinamide,Banzel)在美国上市。卫材 表示,Banzel 口服混悬液制剂与目前市场上出售的 Banzel 片剂具有生物等效性(片剂已于 2007 年上 市) 。本品获准作为辅助药物治疗 Lennox-Gastaut 综合征,适用人群为 4 岁以上儿童以及成年人。 Lennox-Gastaut 综合征是癫痫的一种罕见类 型, 占儿童癫痫的 1%~4%, 发病年龄介于 1~8 岁之 间, 发病高峰年龄为 3~5 岁。 其特征性表现是一组临 床三联征,即脑电图呈棘-慢波样改变、认知功能受 损以及包括强直性发作在内的多种癫痫发作类型,发 作类型以非典型失神发作和失张力性发作最为常见。 本品在结构上和已经上市的癫痫药物不同,主要 通过限制神经元钠依赖性活动电位的点燃来发挥抗 痉挛作用。由于本品的治疗窗口宽,对之前治疗耐受 的局部或返还性癫痫病人仍对本品产生反应。
这些产品中包括新分子实体药物 14 个, 新制剂产品 11 个 (具体见下图)。
新制剂 48. 0%
新分子实体 52. 0%
ቤተ መጻሕፍቲ ባይዱ
监控全球研发热点,把握中国新药脉搏!
第- 1 -页
中国医药工业信息中心
1
本月全球首次上市药品
12
Aug 3
上市 : 其中新分子实体药物 1 个。
监控全球研发热点,把握中国新药脉搏!
第- 2 -页
中国医药工业信息中心
2
本月全球首次注册药品
12
Aug :6
注册 其中新分子实体药物 4 个。
英文通用名
brentuximab vedotin vemurafenib crizotinib
9
hits
6
3
0 2010.08 2010.09 2010.10 2010.11 2010.12 2011.01 2011.02 2011.03 2011.04 2011.05 2011.06 2011.07 2011.08
肠易激综合征治疗药
linaclotide
本 月 , Ironwood Pharmaceuticals 公 司 与 Forest Laboratories 公司在美国递交了 linaclotide 用于治疗便秘型肠易激综合征与慢性便秘的上市申 请,支持此项申请的数据来自于 4 项Ⅲ期空白对照研 究与 2 项长期开放标签的安全性研究,超过 2800 名 受试者参加了 4 项Ⅲ期研究。 本品为一种新一类口服药物,为 c 型鸟苷酸环化 酶激动剂,一天用药 1 次。肠易激综合征指的是一组 包括腹痛、腹胀、排便习惯改变和大便性状异常、粘 液便等表现的临床综合征。 在一项 803 名受试者参加的 III 期临床研究中, 本品受试组用药 3 个月后在缓解腹痛/腹部不适和减 轻 IBS 病情方面的疗效较安慰剂对照组理想。此外, 本品在研究中也达到了次要临床终点,其中包括增加 排便次数和减轻腹胀等。研究显示腹泻是最常见的不 良反应。在这次临床研究中,尽管本品受试组有 8% 的人因不良反应而中途退出研究,而安慰剂对照组仅 有 3%的人因此退出,但根据观察结果,本品在安全 性方面与之前进行的研究相一致。
