化学必修二化学能与电能
人教版高中化学必修二课件第二节 化学能与电能(第一课时)

柠檬(ningmeng) 别名 :洋柠檬,益母果 英文名:lemon
柠檬中含有丰富的柠檬酸,因 此被誉为“柠檬酸仓库”。它
的果实汁多肉脆,有浓郁的芳 香气。因为味道特酸,故用来 调制饮料菜肴、化妆品和药品。
按座位分成12个小组,对 各个小组表现评价,最后 评出第一名,给予奖励!
作
两个组合(可重复),证 明谁能产生电流?
电 极
药物动力学研究
要
动手操作:
形
将两个电极分别 成
插入两个柠檬中。 闭
合
试试看,行吗?为什么呢?
回 路
药物动力学研究
动手操作:
电
将电极从柠檬 解
中拔出,清洗, 质
擦干,再插入到 溶
花生油中
液
两个不同的 导体作电极
处方
条件
闭合回路
电解质溶液
药物动力学研究
请评价各组表现!
锂 电 池
低碳世博
电 动 车
1、课后
土
第三题
豆
供
2、查阅资料,
电
了解各种电池
学习的道路上 不要轻言放弃 希望就在前方
谢谢各位同学合作 谢谢各位老师指教
河南省开封市第二十五中 学 侯艳华
正是合作、质疑,张扬自己的时代, 亲爱的朋友,愿你的小组成功!
药物动力学研究
铁铁钉钉/铁钉2 铁 铁铅钉钉笔//铅 牙签笔2 铅 铅牙笔笔签//铅 牙笔 签2
牙签/牙签
药物动力学研究
镁镁带带镁//镁铜带带钥2匙
两 个
镁铜铜带钥钥匙/吸/匙管铜钥2匙 铜钥吸匙管/吸2管
吸管/吸管
不 同 导
2.2.3 化学能与电能 知识点归纳

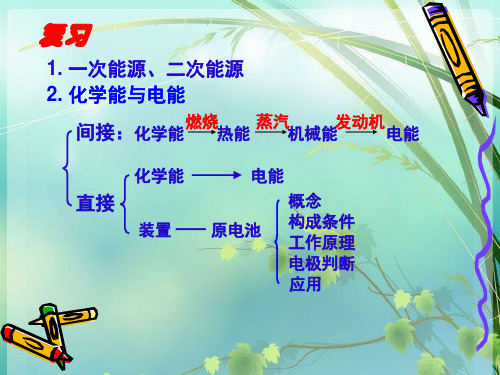
必修二第二章第二节化学能与电能一次能源和二次能源点拨:电能是当今社会应用最广泛的二次能源。
化学能转化为电能1.化学能间接转化为电能——火力发电(1)过程:(2)关键:燃烧(氧化还原反应)是使化学能转换为电能的关键。
2.化学能直接转化为电能——原电池(1)实验探究(2)原电池①定义:将化学能转变为__电能__的装置。
点拨:原电池反应的本质是一个自发的放热的氧化还原反应。
原电池原理的应用问题探究:1.NaOH+HCl===NaCl+H2O,能利用这个反应设计成原电池吗?为什么?2.锌与稀硫酸反应制H2时向溶液中加少量CuSO4后,为什么反应速率加快?原电池原理的应用探究提示:1.不能。
因为该反应不是氧化还原反应。
2.锌置换出的铜附着在锌上,铜、锌、稀硫酸构成原电池。
知识归纳总结:1.加快氧化还原反应的速率:(1)原理:原电池中,氧化反应和还原反应分别在两极进行,使溶液中离子运动时相互的干扰减小,使反应速率增大。
(2)实例:实验室用Zn和稀硫酸反应制取氢气时,可滴入几滴硫酸铜溶液,形成原电池,加快反应速率。
2.比较金属活泼性强弱:(1)原理:一般原电池中,活泼金属作负极,发生氧化反应,不活泼金属作正极,发生还原反应。
(2)实例:有两种金属A和B,用导线连接后插入稀硫酸中,观察到A 极溶解,B极上有气泡产生。
由原电池原理可知,金属活动性A>B。
3.设计原电池:(1)依据:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(电解质溶液中的阳离子)在正极上被还原。
(2)选择合适的材料。
①电极材料:电极材料必须导电。
负极材料一般选择较活泼的金属材料,或者在该氧化还原反应中,本身失去电子的材料。
②电解质溶液:电解质溶液一般能与负极反应。
(3)实例以Fe+CuSO4===FeSO4+Cu为例原电池的工作原理问题探究:1.在铜锌原电池中,电子是怎样移动的?电子能否通过电解质溶液?如果不能,电流是如何形成的?2.若将稀硫酸换作硫酸铜溶液,能否产生电流?电极反应有何不同?原电池的工作原理探究提示:1.由于金属锌比金属铜活泼,锌失去电子,电子通过导线2+流向铜片。
苏教版高中化学必修二第6讲:化学能与电能的转化

化学能与电能❖教学目标1.理解原电池的原理及其应用2.电极反应和电池反应的书写3.了解钢铁的电化学腐蚀4.电解池中两极电极反应的书写5.电解池、原电池的区别6.电解饱和食盐水、电镀、电解法冶炼金属的原理❖知识梳理知识点一.原电池原理1.实验探究实验装置实验现象结论或反应式锌片:不断溶解铜片:有气泡产生电流计:指针发生偏转锌片上的反应:Zn-2e-===Zn2+铜片上的反应:2H++2e-===H2↑反应过程中有电流产生2.原电池(1)定义:将化学能转变为电能的装置。
(2)工作原理:(以锌—铜—稀硫酸原电池为例)Zn电极Cu电极现象锌片逐渐溶解铜片上产生气泡得失电子失电子得电子正负极判断负极正极电子流向流出流入反应类型氧化反应还原反应电极反应式Zn-2e-===Zn2+2H++2e-===H2↑总反应式Zn+2H+===Zn2++H2↑(3)构成条件:①能进行自发的氧化还原反应;②两个活泼性不同的金属(或金属与非金属); ③电极插入电解质溶液中; ④构成闭合回路。
3.钢铁的电化学腐蚀 (1)电化学腐蚀:金属跟电解质溶液接触――→发生 原电池反应――→结果比较活泼的金属失去电子而被氧化。
(2)钢铁的腐蚀: ①构成条件:电极-铁与少量的碳形成两电极电解质溶液-钢铁表面水膜中溶有少量H +和OH -,还溶解了氧气等气体。
②电极反应:负极(铁)- 2Fe -4e -===2Fe 2+正极(碳)-O 2+4e -+2H 2O===4OH -总反应- 2Fe +O 2+2H 2O===2Fe(OH)2后续反应:4Fe(OH)2+O 2+2H 2O===4Fe(OH)3,Fe(OH)3易分解生成铁锈(Fe 2O 3·x H 2O)。
4.正负极的判断知识点二.化学电源 1.原理及优点化学电源依据原电池反应原理,能量转化率是燃料燃烧无法比拟的。
2.常见化学电源(1)一次电池:Zn +2NH 4Cl +2MnO 2===Zn(NH 3)2Cl 2+2MnO(OH), 负极:Zn ;正极:碳棒,电解质溶液:NH 4Cl 等。
人教版化学必修二2.2 化学能与电能-原电池 同步讲课课件优质课件PPT

为什么在海水中行驶的船特别容易腐蚀?
为了解决这个问题,在船底绑 很多的锌块,这是什么原理呢?
填空:锌铜-硫酸铜电池
负
氧化
锌片: 极 ,Z发n-生2e-=反Zn应2+,
电极反应: ________________
铜片:_正__极 发生 _还__原___反应,
电极反应:__C_u_2_+_+_2_e_-__=_C_u_____
锌极发生的反应: Zn - 2e- = Zn2+ 铜极发生的反应: 2H+ + 2e- = H2
稀硫酸溶液
Zn + CuSO4= ZnSO4+Cu 书写该反应的离子方程式: 总式: Zn + Cu2+ = Zn2+ +Cu 锌极发生反应:Zn - 2e- = Zn2+ 铜极发生反应:Cu2+ + 2e- = Cu
ZN+CU2+===ZN2++CU,此反应,也很容易被一次次的失败打垮。但是人生不容许我们停留在失败的瞬间,如果不前进,不会自我激励的话,就注定只能被这个世界抛弃。自我激励能力是人自我调节系统中 重要的组成部分,主要表现在对于在压力或者困境中,个体自我安慰、自我积极暗示、自我调节的能力,在个体克服困难、顶住压力、勇对挑战等情况下,都发挥着关键性的作用。具备自我激励 能力的人,富有弹性,经常表现出反败为胜、后来居上、东山再起的倾向,而缺乏这种能力的人,在逆境中的表现就大打折扣,表现为过分依赖外界的鼓励和支持。一个小男孩在自家的后院练习 棒球。在挥动球棒前,对自己大喊:“我是世界上最棒的棒球手!”然后扔出棒球,挥动……但是没有击中。接着,他又对自己喊:“我是世界上最棒的棒球手!”扔出棒球,挥动依旧没有击中。 男孩子停下来,检查了球棒和球,然后用更大的力气对自己喊:“我是世界上最棒的棒球手!”可是接下来的结果,并未如愿。男孩子似乎有些气馁,可是转念一想:我抛球这么刁,一定是个很 棒的挥球手。接着男孩子又对自己喊:“我是世界上最棒的挥球手!”其实,大多数情况下,很多人做不到这看似荒谬的自我鼓励,可是,这故事却深深反映了这个男孩子自我鼓励下的执著,而 这执著是很多人并不具备的……而许多奇迹往往是执著者造成的。许多人惊奇地发现,他们之所以达不到自己孜孜以求的目标,是因为他们的主要目标太小、而且太模糊不清,使自己失去动力。 如果你的主要目标不能激发你的想象力,目标的实现就会遥遥无期。因此,真正能激励你奋发向上的是确立一个既宏伟又具体的远大目标。实现目标的道路绝不是坦途。它总是呈现出一条波浪线, 有起也有落,但你可以安排自己的休整点。事先看看你的时间表,框出你放松、调整、恢复元气的时间。即使你现在感觉不错,也要做好调整计划。这才是明智之举。在自己的事业波峰时,要给 自己安排休整点。安排出一大段时间让自己隐退一下,即使是离开自己挚爱的工作也要如此。只有这样,在你重新投入工作时才能更富激情。困难对于脑力运动者来说,不过是一场场艰辛的比赛。 真正的运动者总是盼望比赛。如果把困难看作对自己的诅咒,就很难在生活中找到动力,如果学会了把握困难带来的机遇,你自然会动力陡生。所以,困难不可怕,可怕的是回避困难。大多数人 通过别人对自己的印象和看法来看自己。获得别人对自己的反映很不错,尤其正面反馈。但是,仅凭别人的一面之辞,把自己的个人形象建立在别人身上,就会面临严重束缚自己的。因此,只把 这些溢美之词当作自己生活中的点缀。人生的棋局该由自己来摆。不要从别人身上找寻自己,应该经常自省。有时候我们不做一件事,是因为我们没有把握做好。我们感到自己“状态不佳”或精 力不足时,往往会把必须做的事放在一边,或静等灵感的降临。你可不要这样。如果有些事你知道需要做却又提不起劲,尽管去做,不要怕犯错。给自己一点自嘲式幽默。抱一种打趣的心情来对 待自己做不好的事情,一旦做起来了尽管乐在其中。所以,这次犯错,是为了下次接受挑战后,要尽量放松。在脑电波开始平和你的中枢神经系统时,你可感受到自己的内在动力在不断增加。你 很快会知道自己有何收获。自己能做的事,放松可以产生迎接挑战的勇气。事过境迁,面对人生,面对社会,面对工作,一切的未来都需要自己去把握。人一定要靠自己。命运如何眷顾,都不会 去怜惜一个不努力的人,更不会去同情一个懒惰的人,一切都需要自己去努力。谁都不可能一生一世的帮你,一时的享受也只不过是过眼云烟,成功需要自己去努力。当今社会的快速发展,各行 各业的疲软,再加上每年几百万毕业生涌向社会,社会生存压力太大,以至于所有稍微有点意识的年轻人都想努力提高自己。看着身边一个个同龄人那么优秀,看着朋友圈的老同学个个事业有成、 买房买车,我们心急如梵,害怕被这个社会抛弃。所以努力、焦躁、急迫这些名词缠绕着越来越多的年轻人,我们太想改变自己,太想早一日成为自己梦想中的那个自己。收藏各种技能学习资料, 塞满了电脑各大硬盘;报名流行的各种付费社群,忙的人仰马翻;于是科比看四点钟的洛杉矶成为大家励志的手段,纷纷开始早起打卡行动。其实……其实我们不觉得太心急了吗?这是有一次自 己疲于奔命,病倒了,在医院打点滴时想到的。我时常恐慌,害怕自己浪费时间,就连在医院打点滴的时候,都觉得是对时间的一种浪费。想快点结束,所以乘着护士不在,自己偷偷的拨快了点 滴速度。刚开始自己还能勉强受得了,过了差不多十分钟,真心忍不住了,只好叫护士帮我调到合适的速度。打完点滴走在回家的路上,我就在想,平时做事和打点滴何尝不是一样,都是有一个 度,你太急躁了、太想赶超,身体是受不了的。身体是革命的本钱,我们还年轻,还有大把的时间够我们改变,够我们学习成长。身体就像是1000前面的那个若是1都不存在了,后面再多的0又有 什么用?我是一个急性子,做事风风火火的,所以对于想改变自己,是比任何人都要心急。这次病倒了,个人感觉完全是没有方向、不分主次的一通乱忙乎才导致的,病倒换来的努力根本是一钱 不值。生病的那几天,我跟自己的大学老师打了一个电话,想让老师帮我解惑一下,自己到底是怎么了。别人也很努力啊,而且他们取得的成就远远超过我了,为啥他们反到身体倍棒而一无所获 的自己却病倒了?老师开着电脑,给我分享了两个小故事讲的第一个故事是“保龄球效应”,保龄球投掷对象是10个瓶子,你如果每次砸倒9个瓶子,最终得分是90分,而你如果每次能砸倒10个 瓶子,最终得分是240分。故事讲完,老师问我明白啥意思没?我说大概猜到一点,你让我再努力点,对吗?不对!你已经够努力了,都累病了,我讲这个故事是告诉你,你现在就是那个每次砸 倒9个瓶子的人。你累倒的原因是因为你同时在几个场馆玩,每一个场馆得分都是90分,而有些人,则是只在一个场馆玩,玩多了,他就能砸倒10个瓶子,他就能比你轻松十倍,得分却还是远远 超过你。老师讲的第二故事是“挖水井”,一个人选择好一处地基,就在那里一直坚持不懈的挖下去,而另一个人则是到处选地基,这边挖几米,那边挖几米。第一个人早早的就挖出水来了,而 另一个人则是直到累死也没有挖出一滴水。首先,你必须承认努力是必须的,只要你比别人努力了那么一点,你确实能超过一些人。只是人的精力也是有限的,你这样分散精力去努力,最终得到 的结果只会是永远装不满水桶的半桶水。和老师通完电话后,我调整了几天,也对自己手头上的事物做一些大改变。将目前摆在面前的计划一一列出来,挑出最重要的、最必须的,写在第一行, 再以此类推,排完手中所有的计划。对于那些不是很急的,对目前生活和工作不是特别重要的,先果断放弃。我现在最迫切的目标是什么?当然是七月份的转行新媒体咯,那么学习历练新媒体技 能就是第一位。而新媒体所需学习的技能又有很多,那怎么办呢?先挑自己有点底子的,有点基础的,把巩固持续加强。个人感觉自己写还是有点小基础的,所以就给自己一个小目标,每周必须 持续输出几篇文字,加强文案方面的训练。而另外PS也是做运营的必备条件之一,所以在训练文案的同时,还得练习PS,给自己的要求是每天练习PS半小时。还有别的吗?不敢有了,两样训练加 上还要上班已经差不多了。一直很喜欢作家刘瑜的一段话:每当我一天什么也没干的时候,我就开始焦虑。每当我两天什么都没干的时候,我就开始烦躁。每当我三天什么都没干的时候,我就开 始抓狂。不行啊,不行了,我三天什么都没干啊,我寝食难安……这正是我三个月前的真实写照。多年来,我已经养成一种习惯,绝不让任何一分钟死有余辜:我在堵车的时候听日语,在等人的 时候写文章,在上厕所的时候看书,在任意两件事的衔接点那里扒出细缝,用来回邮件、回短信……我以为这就是所谓的勤奋,也心安理得地享受着同伴的钦佩。但我很快就发现,我的工作时间 越来越长,我的休息时间越来越短,我的情绪越来越焦躁,只要有十分钟的无作为,我就会变得非常慌张!而我的社交时间也不得不尽量地缩短,我甚至不再有功夫交朋友。更可怕的是,我的工 作量明明没有变化,可看起来每一天它都在成倍地递增。我开始害怕夜幕降临的那一刻,因为那意味着这一天有更多的事情被贴上了“没完成”的标签。我责备那是自己“无能”的表现,直到我 意识到问题的关键“没有效率的勤奋,就是懒惰。”
人教版高中化学必修二2-2化学能与电能 PPT课件 图文
电动剃须刀等
③锂离子电池:
是新一代可充电的绿色电池,现已成为笔记本电脑、 移动电话、数码相机、摄像机等低功耗电器的主流 电源
3.燃料电池
(1)原理:利用原电池的工作原理,将燃料和 氧化剂(如O2)反应所放出的化学能直 接转化为电能
a. 燃料电池是一种高效、环境友好的发电装置 b.它的电极材料一般为活性电极,具有很强的
线两两相连组成原电池。若a、b相连时,a为负 极;c、d相连时,电流由d到c;a、c相连时,c 极上产生大量气泡,b、d相连时,b上有大量气 泡产生,则四种金属的活动性顺序由强到弱的 为( B )
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
分析:①a>b ② c>d ③ a>c ④ d>b
负极:电子流出的电极——失电子,发生氧化反应 (较活泼的金属)
正极:电子流入的电极——得电子,发生还原反应 (较不活泼的金属、石墨等)
2.原电池的工作原理
Zn
Cu
发生失电子的氧化反应
Zn - 2e- = Zn2+
发生得电子的还原反应
2H+ + 2e- = H2↑
负极
H2SO4
e- 外电路
正极
阴离子 溶液中 阳离子
催化活 性,如铂电极,活性炭电极等 c. 燃料电池由3个主要部分组成
负极——燃料电极 正极——氧气或空气电极 电解质溶液 d. 两电极材料均为惰性电极,电极本身不发生反应, 而是由引入到两电极上的物质发生反应
(2)常见的燃料电池:
高中电化学

必修二2化学能与电能1.一次能源:直接从自然界获取的能量。
二次能源:经过加工转换得到的。
煤气、电力都是二次能源。
2.氧化剂+还原剂=氧化产物+还原产物氧化性顺序:氧化剂>氧化产物还原性顺序:还原剂>还原产物氧化还原反应在进行过程中伴随着能量的变化,将氧化反应和还原反应分别在两个不同的区域进行。
一、化学能转化为电能(一)形成原电池的要素和作用作用:1.把化学能转化电能。
2.对反应起加速作用。
要素:1.形成闭合回路。
(外电路+内电路)外电路:自由电子导电内电路:离子导电外电路和内电路交界的地方有电子和离子的转换。
2.化学要素:自发的放热的氧化反应自发反应:在对应条件下自发的反应3.电极参加反应的情况下需要活泼性不同的电极。
(二)原电池中的微粒流动自由电子:负极正极阳离子:负极正极具体微粒离子阴离子:正极负极电流(正电荷):外:负极正极抽象物体内:正极负极负电荷:外:正极负极内:负极正极(三)原电池的正负极的判断1、电流方向,电子流动方向和离子流动方向2、氧化性和还原性:负氧正还电极质量减小:被氧化,作负极金属单质:被还原,作正极电极质量增加(析出固体)非金属单质(一般不考虑):被氧化被还原产生气体吸收气体3、活泼金属一定做负极吗?特例:Al-Mg-NaOH反应正极反应:负极反应:Fe-Cu-HNO3 (浓)反应铁在浓硫酸浓硝酸中会钝化正极反应:负极反应:关键是比较两个电极失电子能力,有些两边都可以失电子,如牺牲负极的正极保护法。
(四)电极PH的升降判断:反应为主,离子移动和生成水为次。
Mg-Al-NaOH:正极反应:PH变化负极反应:PH变化总反应:PH变化海水电池(Al-O2-H2O)正极反应:PH变化负极反应:PH变化总反应:PH变化(五)钢铁的腐蚀与保护(六)一些零碎的知识点1、纯锌与电解质反应较慢,含有杂质的锌会反应较快。
做原电池加快反应的实验时(Zn-HCL)通常向溶液中滴入几滴CuSO4 加快反应。
必修二化学2.2.1化学能转化为电能

必修二化学第二章第二节化学能与电能第1课时化学能转化为电能1.能举例说明化学能转化成电能的实例,并了解及应用。
2.理解原电池概念。
3.初步了解原电池工作原理及构成条件。
(重点)化学能转化为电能阅读教材P39到P42[实践活动]内容,完成下列问题。
1.能源的分类定义举例一次能源直接从自然界中取得的能源流水、原煤、天然气、风力、石油等二次能源一次能源经加工、转化得到的能源蒸汽、电力等2.化学能转化为电能的两种方式(1)火电(火力发电):化学能――→燃烧热能――→蒸汽机械能――→发电机电能;缺点:污染环境、低效。
(2)原电池:将化学能直接转化为电能;优点:清洁、高效。
3.原电池(1)实验实验装置实验现象铜片:有气泡产生锌片:溶解变小电流表:指针偏转结论有电流产生,装置中化学能转化为电能(2)原电池概念:将化学能转变为电能的装置。
(3)铜锌原电池工作原理电极材料电子转移电极反应式反应类型Zn 失电子Zn-2e-===Zn2+氧化反应Cu 得电子2H++2e-===H2↑还原反应总电池反应:Zn+2H+===Zn2++H2↑(4)反应本质:原电池反应的本质是氧化还原反应。
【判断】1.HCl+NaOH===NaCl+H2O是放热反应,可以设计成原电池。
(×)2.将铜片和锌片用导线连接插入酒精中,电流表指针发生偏转。
(×)3.在铜锌稀硫酸原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液到达锌。
(×)4.原电池中阳离子向正极移动。
(√)原电池的构成条件及正负极的判断方法1.构成原电池的“一个依据,三个必须”2.原电池正、负极的判断方法负极正极电极材料活动性较强的金属活动性较弱的金属或导电的非金属电子流动方向电子流出一极电子流入一极电流方向电流流入一极电流流出一极电解质溶液中离子的移动方向阴离子移向的一极阳离子移向的一极发生的反应氧化反应还原反应反应现象电极溶解电极增重或有气泡放出【活学活用】1.下列装置中,能构成原电池的是( )A.只有甲B.只有乙C.只有丙 D.除乙均可以【解析】甲装置不能构成闭合回路,乙装置两极材料相同,丁装置酒精不是电解质溶液,只有丙装置具备原电池的构成条件,故选C。
人教版高中化学必修二课件化学能与电能新 (恢复)

小医生?
在伦敦上流社会,有一位贵族夫人格林太太,幼 年时因蛀牙补过一颗不锈钢的假牙。不料后来,她又 因为车祸又掉了一颗牙,为了显示她的富有,她装了 一颗黄金假牙。自此以后,她就经常出现头痛、失眠、 心情烦躁等症状。更奇怪的是,众多的医学专家为她 检查后,都找不到病因,这位夫人整日感到精神萎靡, 找遍各大医院会诊也不见效果。格林太太的病因到底 是什么呢? 聪明的同学们,请运用本节课学习的知识帮格林 太太找出她的病因到底是什么呢?
思考:能否将化学能直接转化为电能?
实验探究
⑴ 将Zn片插入H2SO4溶液 中有什么现象?为什么?
⑵将Cu片插入H2SO4溶液中 有什么现象?为什么?
⑶将一Zn片,Cu片平行插入 H2SO4溶液中,有什么现象? 为什么?
⑷若将Zn片,Cu片用一导线连 接再浸在H2SO4溶液中,有什 么现象?为什么?
第二节
化学能与电能
学习目标
1、了解实现化学能与电能转化的装置 ----原电池的工作原理。 2、会判断电源的正负极及电流方向。 会书写简单的电极反应。 3、了解原电池的形成条件。 4、感受化学电源给生产生活带来的便 捷,形成环保意识。
2001年我国发电量构成图
火力发电厂工作原理
自主学习
阅读教材结合火力发电原理图归纳火力发电过程 中的能量形式转化,并讨论归纳火力发电的缺点。
动画
原电池:将化学能转化为电能的装置。
、
锌片: Zn-2e-=Zn2+ 铜片: 2H++2e-=H2↑
氧化反应 还原反应
思考:从氧化还原的角度分析铜片和锌片上 各发生什么反应。
分析探究
已知电流计的指针偏向可以指示电源的正负极, 请根据图1的指示判断图2中的电池的正负极及 电子和电流的方向。
化学必修二第二章 第二节 化学能与电能

纪文教育学科教师辅导讲义一.化学能与电能的相互转化格林太太有一口整齐的牙齿,但其中有两颗假牙:一颗是黄金的——这是格林太太富有的象征;另一颗是不锈钢的——这是一次车祸留下的痕迹。
但自从车祸后,她经常头疼,夜间失眠,心情烦躁……尽管吃了不少药物,但病症未有丝毫的减轻,你想知道她真正的病因吗?化学能与电能的相互转化1.间接转化:在我国发电总量构成上,火力发电居首位。
燃煤发电过程中的能量转化过程为化学能――→燃烧热能――→蒸汽机械能――→发电机电能。
思考题1 在火力发电过程中使化学能转化为电能的关键是什么?2.直接转化——原电池(1)原电池是将化学能转变为电能的装置。
在原电池中氧化反应和还原反应分别在两个不同的区域进行,使其间电子发生转移,在闭合回路下形成电流。
可见原电池反应的本质是氧化还原反应。
思考题2 是不是所有的反应都能设计成原电池?(2)在铜锌原电池中,锌易失去电子被氧化成Zn 2+进入溶液,电子由锌片通过导线流向铜片,溶液中的H +从铜片端获得电子被还原成氢原子,再结合成氢分子从铜片上逸出。
锌片上的反应为Zn -2e -===Zn 2+,铜片上的反应为2H ++2e -===H 2↑。
思考题3 在铜、锌和稀硫酸构成的原电池中,溶液的pH 如何变化?SO 42-浓度呢?注意:一、原电池的构成条件及工作原理1.原电池的构成条件:(1)具有活动性不同的两种电极材料(金属和金属或金属和能导电的非金属)。
(2)电极材料与电解质溶液接触。
(3)组成闭合回路。
2.原电池的工作原理:较活泼金属发生氧化反应,电子由较活泼金属通过导线流入不活泼金属,溶液中氧化性较强的阳离子在不活泼金属上得到电子被还原。
[特别提醒]①自发进行的氧化还原反应,理论上可组成原电池。
②形成闭合回路的方式有多种,可以是导线连接两个电极,也可以是两电极接触。
如下图:二、原电池正负极的判断方法1.根据组成原电池两极的材料判断。
一般是活动性较强的金属为负极,活动性较弱的金属或能导电的非金属为正极。
高一化学人教版必修二第二章第2节《化学能与电能》知识点总结

第2节 化学能与电能一、能源的分类1.化学能间接转化为电能(在能量的转化过程中存在能量的损失)—比如火力发电 ①转化过程火力发电是通过化石燃料的燃烧,使化学能转化为热能,加热水使之汽化为蒸汽以推动蒸汽轮机,然后带动发电机发电.燃煤发电是从煤中的化学能开始的一系列能量转化过程.化学能−−→−燃烧热能−−→−蒸汽机械能−−→−发电机电能 ①转化原理燃烧(氧化还原反应)是使化学能转化为电能的关键.因此燃烧一定发生氧化还原反应,氧化还原反应必定有电子的转移,电子的转移引起化学键的重新组合,同时伴随着体系能量的变化. 拓展点1:火力发电的优缺点优点:①我国煤炭资源丰富①投资少,技术成熟,安全性能高缺点:①排出大量的能导致温室效应的气体CO 2以及导致酸雨的含硫氧化物,比如SO 2①消耗大量的不可再生的化石燃料资源①能量转化率低①产生大量的废渣、废水.2.化学能直接转化为电能(在能量的转化过程中不存在能量的损失)—原电池(将氧化还原反应所释放的化学能直接转化为电能)(1)原电池的工作原理实验现象产生的原因分析2+会逐渐溶解,而由Zn失去的电子则由Zn片通过导线流向Cu片,因此Zn片上会带有大量的正电荷,Cu片上会带有大量的负电荷,而电解质溶液中含有阳离子(H+、Zn2+)以及阴离子(OH-、SO42-),由于正负电荷相互吸引,所以电解质溶液中的阳离子会移向Cu片去中和Cu片上带负电荷的电子,阴离子则移向Zn片去中和Zn片上的正电荷,但是由于溶液中的H+得电子能力比Zn2+强,所以H+就移向Cu片去获得Cu片上由Zn片失去的电子而被还原为H原子,H 原子再结合成H分子即H2从Cu片上逸出,因此Cu片上有无色气泡产生.通过电流表指针发生偏转并且指针偏向于Cu片这一边,可以得出该装置产生了电流(而电流的形成是因为电子发生了定向移动),并且电流移动的方向与电子移动的方向相反,所以电流是从Cu片流出,Zn片流进,即Cu片作为正极;Zn片作为负极.原电池工作原理的总结归纳:①原电池中电流的流向:正极→负极①原电池中电子的流向:负极→导线→正极(注意:在该过程中,电子是永远都不会进入到电解质溶液中,因为电子只在金属内部运动并且电解质溶液中的自由移动的阴阳离子也不能在导线中通过)①原电池中电解质溶液中阴、阳离子的移动方向:阳离子→正极阴离子→负极①原电池工作原理的本质:发生自发的氧化还原反应即将氧化还原反应的电子转移变成电子的定向移动,将化学能转化为电能的形式释放.(所谓自发就是指该氧化还原反应不需要借助外在的力量即本身就能够自己发生)①原电池中的负极发生氧化反应,通常是电极材料或还原性气体失去电子被氧化,电子从负极流出;原电池的正极发生还原反应,通常是溶液中的阳离子或O2等氧化剂得到电子被还原,电子流入正极.(2)原电池的构成条件(两极一液一回路,反应要自发)①两极:正极和负极是两种活泼性不同的电极材料,包括由两种活泼性不同的金属材料构成的电极或者是由一种金属与一种非金属导体(如石墨)构成的电极,一般活泼性较强的金属作为负极.①一液(电解质溶液):包括酸、碱、盐溶液.①一回路(构成闭合的电路):即两电极由导线相连或直接接触以及两电极必须插入到同一种电解质溶液中或者分别插入到一般与电极材料相同的阳离子的两种盐溶液中,两盐溶液之间用盐桥相连形成闭合回路.比如以下装置:①氧化还原反应要自发:指电解质溶液至少要与作为负极的金属电极材料发生自发的氧化反应.(3)电极反应式①定义:原电池中的正极和负极所发生的反应①电极反应式的书写方法:补充:复杂电极反应式的书写如CH4碱性燃料电池负极反应式的书写:CH4+2O2+2OH-===CO2-3+3H2O……总反应式2O2+4H2O+8e-===8OH-……正极反应式CH4+10OH--8e-===7H2O+CO2-3……负极反应式注意:①电极反应式的书写必须遵守离子方程式的书写要求,比如难溶物、弱电解质、气体等均应写成化学式形式.①注意电解质溶液对正、负极反应产物的影响.如果负极反应生成的阳离子能与电解质溶液中的阴离子反应,则电解质溶液中的阴离子应写入电极反应式中,例如Fe与Cu在NaOH溶液中形成原电池,负极反应式为:Fe+2e-+2OH-=Fe(OH)2.三、原电池的应用(1)比较金属的活动性强弱①原理:一般原电池中活动性较强的金属作负极,活动性较弱的金属作正极.①应用:比如A、B两种金属用导线连接或直接接触后插入到稀H2SO4电解质溶液中,若A极溶解,B极有气泡产生,由此可判断A是负极,B是正极,活动性:A>B.(2)加快氧化还原反应的速率①原理:在原电池中,氧化反应与还原反应分别在两极进行,溶液中的粒子运动时相互间的干扰小,从而使化学反应速率加快.①应用:比如实验室中用Zn和稀H2SO4制取H2时,通常滴入几滴CuSO4溶液,能够加快产生H2的速率.原因在于Zn 与置换出的Cu构成了原电池,加快了反应的进行.(3)防止金属被腐蚀(比如要保护一个铁闸,可用导线将其与一Zn块相连,使Zn作原电池的负极,铁闸作正极)补充:金属腐蚀①定义:指金属或合金与周围接触到的气体或液体发生化学反应,使金属失去电子变为阳离子而消耗的过程.②金属腐蚀的分类:化学腐蚀和电化学腐蚀在金属腐蚀中,我们把直接发生氧化还原反应且不构成原电池的腐蚀称为化学腐蚀;而由不纯的金属与电解质溶液接触时形成的原电池反应而引起的腐蚀称为电化学腐蚀,电化学腐蚀又分为吸氧腐蚀和析氢腐蚀:在潮湿的空气中,钢铁表面吸附一层薄薄的水膜,里面溶解了少量的O2、CO2等气体,含有少量的H+和OH-从而形成电解质溶液.A.当电解质溶液呈中性、弱碱性或弱酸性时,它跟钢铁里的Fe和少量的C形成了无数个微小的原电池,Fe作负极,C 作正极,因此钢铁发生吸氧腐蚀.电极反应式为:负极(Fe):2Fe-4e-=2Fe2+ 正极(C):O2+2H2O+4e-=4OH-总反应式为:2Fe+O2+2H2O=Fe(OH)2B.当电解质溶液的酸性较强时,钢铁则发生析氢腐蚀.电极反应式为:负极(Fe):Fe-2e-=Fe2+ 正极(C):2H++2e-=H2↑总反应式为:Fe+2H+=Fe2+ +H2↑(4)制作各种化学电源(比如制作干电池、铅蓄电池、新型高能电池等)(5)设计制作原电池①设计电路原电池的设计要满足构成原电池的四个条件:(a)由两种活动性不同的金属或由一种金属与其他导电的材料(非金属或某些氧化物)作为电极材料;(b)两个电极必须浸在电解质溶液中;(c)两个电极之间要用导线连接形成闭合回路;(d)有自发进行的氧化还原反应.②电极材料的选择电池的电极必须导电.电池中的负极必须能够与电解质溶液反应,容易失去电子,因此负极一般是活泼的金属材料.正极和负极之间只有产生电势差,电子才能定向移动,所以正极和负极一般不用同一种材料.③电解质溶液的选择电解质是使负极材料放电的物质.因此电解质溶液一般要能够与负极发生反应,或电解质溶液中溶解的其他物质与负极发生反应(如空气中的O2).但是如果两个半反应分别在两个容器中进行(中间连接盐桥),则左、右两个容器中的电解质溶液一般选择与电极材料相同的阳离子的盐溶液.比如Cu-Zn-硫酸盐原电池中,负极金属Zn浸泡在含有Zn2+的电解质溶液中.④设计示例拓展点2:原电池的正、负极的判断方法(1)根据组成原电池两电极的材料判断:一般是活泼性较强的金属作为负极,活泼性较弱的金属或能导电的非金属作为正极.(2)根据电流方向或电子流动的方向判断:电流方向(在外电路)是由正极流向负极,电子的流动方向是由负极流向正极.(3)根据原电池中电解质溶液内阴、阳离子的定向移动方向判断:在原电池的电解质溶液中,阳离子移向正极,阴离子移向负极.(4)根据原电池两电极发生的反应类型判断:原电池的负极总是失电子发生氧化反应,其正极总是得电子发生还原反应.(5)根据电极质量的变化判断:原电池工作后,X极质量增加,说明溶液中的阳离子在X极(正极)放电,X极活动性弱;反之,X极质量减少,说明X极金属溶解,X极为负极,活动性强.(6)根据电池中的现象判断:若某电极上有气泡冒出,则是因为析出了H2,说明该电极为正极,活动性弱.上述判断方法可简记为:特别提醒:①在判断原电池正、负极时,不能只根据金属活泼性的相对强弱判断,有时还要考虑电解质溶液,比如Mg、Al和NaOH溶液构成的原电池中,由于Mg不与NaOH溶液反应,虽然金属性Mg>Al,但是在该条件下却是Al作负极.因此要根据具体情况来判断正、负极.又比如说Fe、Cu在稀H2SO4溶液中,Fe作负极,Cu作正极;而Fe、Cu在浓HNO3溶液中,Fe作正极,Cu作负极.①原电池的负极材料可以参加反应,表现为电极溶解,但有的原电池(比如燃料电池)负极材料不参加反应;原电池的正极材料通常不参加反应.四、发展中的化学电源1.化学电源的分类2PbSOSO4放电充电锌银蓄电池的负极是锌,正极是Ag电极反应:O+H O+2e- =2Ag+2OH2Ag+Zn(OH)2Zn+Ag2O+H2O放电充电五、燃料电池燃料电池是一种能连续地将燃料和氧化剂的化学能直接转换成电能的化学电池.燃料电池的最大优点在于能量转化率高,可以持续使用,无噪音,不污染环境.燃料电池的电极本身不参与氧化还原反应,只是一个催化转化元件.它工作时,燃料和氧化剂连续地由外部供给,在电极上不断地进行反应,生成物不断地被排出,于是电池就连续不断地提供电能.(1)氢氧燃料电池2H+O=2H O1)燃料电池正极反应式的书写因为燃料电池正极反应物一般是O2,即正极都是氧化剂—O2得到电子的还原反应,故正极反应的基础都是O2+4e-=2O2-,O2-的存在形式与燃料电池的电解质的状态以及电解质溶液的酸碱性有着密切的联系.①电解质为酸性电解质溶液(如稀硫酸)在酸性环境中,O2-离子不能单独存在,可供O2-离子结合的微粒有H+离子和H2O,O2-离子优先结合H+离子生成H2O.这样在酸性电解质溶液中,正极反应式为O2+4H++4e-=2H2O.①电解质为中性或碱性电解质溶液(如氯化钠溶液或氢氧化钠溶液)在中性或碱性环境中,O 2-离子也不能单独存在,O 2-离子只能结合H 2O 生成OH -离子,故在中性或碱性电解质溶液中,正极反应式为O 2+2H 2O +4e -=4OH -.①电解质为熔融的碳酸盐(如Li 2CO 3和Na 2CO 3熔融盐混和物)在熔融的碳酸盐环境中,O 2-离子也不能单独存在,O 2-离子可结合CO 2生成CO 32-离子,则其正极反应式为O 2+2CO 2 +4e -=2CO 32-.①电解质为固体电解质(如固体氧化锆—氧化钇)该固体电解质在高温下可允许O 2-在其间通过,故其正极反应为O 2+4e -=2O 2-.2)燃料电池负极反应式的书写燃料电池负极反应物种类比较繁多,可为氢气、水煤气、甲烷、丁烷、甲醇、乙醇等可燃性物质.不同的可燃物有不同的书写方式,要想先写出负极反应式相当困难.一般燃料电池的负极反应式都是采用间接方法书写,即按上述要求先正确写出燃料电池的总反应式和正极反应式,然后在电子守恒的基础上用总反应式减去正极反应式即得负极反应式.比如以H 2、C 3H 8为燃料的碱性电池为例说明如下: H 2-2e - =2H +或H 2-2e -+2OH -=2H 2O;C 3H 8−−→−--e 203CO 2−−→−-OH 63CO 32-(3个C 整体从-8价升高到+12价,失去20e -),则有:C 3H 8-20e -+aOH -=3CO 32-+bH 2O,由电荷守恒知a=26;由H 原子守恒知b=17,所以电极反应式为C 3H 8-20e -+26OH -=3CO 32-+17H 2O(3)燃料电池与一次电池、二次电池的主要区别①氧化剂与燃料在工作时不断地由外部供给.①生成物不断地被排出.(4)废弃电池的处理废弃电池中含有重金属和酸碱等有害物质,随意丢弃,对生态环境和人体健康有很大的危害.若把它当作一种资源,加以回收利用,既可以减少对环境的污染,又可以节约资源.因此,应当重视废弃电池的回收.。
人教版高中化学必修二课件化学能与电能4月15日

水电 17% 火电 79%
其他 4%
水电 其他 火电
优势:投资较少,建厂Βιβλιοθήκη ,技术成熟, 安全性能高,原料较充分。
火电站工作原理示 2001年我国发电总量构成图
火力81.2%
水电17.6%
其他1.2%
化学能
(煤)
燃烧
热能
蒸汽
机械能
发电机
电能
一、化学能转化为电能
–火力发电中能量是如何转化的呢?
• 化学能
动手动脑
2、一个电池反应的总方程式是Zn+Cu2+=Zn2++Cu, 该反应的的原电池正确组合是()
C
动手动脑
交流后讨论,你能 为格林太太开个有 效的处方么?
动手动脑
4、阅读课本P
,完成学案火力发电内容。 39
知识延伸
5、阅读学案知识拓展部分,解释原电池中电子为 什么舍近求远,绕道而行?
核电站
河南省鹤壁高中岳心敬
《化学2》第二章第二节
化学能与电能
• 橙子真的可以为iphone充电么?
模型对比
原电池定义
化学能
电能
1、能量转化角度:化学能直接转化为电能
2、化学反应角度:使氧化还原反应分别在两个电极上进行。
控制变量法
改变电极材料
改变溶液
形成闭合回路
原电池形成条件
两电极的活泼性不同
发电机
燃烧
蒸汽
化学能
热能
机械能
电能
能不能直接转化?
•
缺点:对环境污染较重,所需原料为不可再生的化石燃料,能源利用率低。
原电池原理
问题1:如何确定电极名称?
问题2:电极上分别发生了哪种类型的反应?
高中化学人教版必修二《第二章化学反应与能量第2节化学能与电能第1课时原电池-化学能转化为电能》课件

Cu-Zn原电池 Zn片上Zn溶解,Zn 失电子,发 生 氧化反应。 可表示为:
Zn: Zn-2e=Zn2+
Cu片上产生气泡,H+ 得电子,发生 还原 反应。 可表示为:
Cu:2H++2e=H2↑
定义2:在原电池中,电子流出的一极叫负极, 负极发生氧化反应;电子流入的一极叫正极, 正极发生还原反应。
[实验现象]:铜片上有气泡产生,锌片不断溶解,电流表的指 针发生偏转。
[实验结论]:导线中有电流通过。
实验结论:
1.该装置实现了将__化__学__能转化为_电____能。 2.该装置的化学反应本质是:_氧__化__还_原__反__应_____.
2. 原电池
定义1:使化学能转化为电能的的装置,叫做原 电池。
例1.如图装置中,明显有电流产生的是( C )
解析:A项中酒精不是电解质溶液,不能构成原电池;B项中的两电极材料 与电解质溶液不能发生自发的氧化还原反应,因而也不能构成原电池;D项 中的装置没有构成闭合回路,不能构成原电池;只有C选项中的装置符合原 电池的构成条件。
例2.[2019·河南省实验中学高一检测]关于原电池及其电极名称的下列 叙述中正确的是( C ) a. 原电池的正极和负极必须是两种活动性不同的 属 b. 正极上发生还原反应,一定产生气体 c. 电子流出的一极为负极 d. 阴离子在电解质溶液中向正极移动 解析:a错,构成原电池正极和负极的必须是两种活动性不同的电极,可 以是两种不同 属,也可以是一种 属、一种非 属。b错,原电池中正极上 发生还原反应,但不一定产生气体。c对,原电池中电子流出的一极为负 极,电子由负极流向正极。d错,原电池放电时,电解质溶液中阴离子向 负极移动。
2020高中化学人教版必修二教师用书:2-2-1 化学能与电能 Word版含答案

姓名,年级:时间:第二节化学能与电能第一课时化学能转化为电能一、一次能源和二次能源二次能源中的电能是应用最广泛,使用最方便,污染最小的能源。
二、化学能转化为电能1.燃煤发电的能量转化(1)过程:化学能错误!热能错误!机械能错误!电能(2)化石燃料的燃烧(氧化还原反应)是使化学能转换为电能的关键。
2.原电池(1)实验(2)原电池概念:将化学能转变为电能的装置(3)铜锌原电池工作原理电池总反应:Zn+H2SO4===ZnSO4+H2↑。
(4)反应本质:原电池反应的本质是氧化还原反应.(5)构成原电池的条件理论上,自发的氧化还原反应均可设计成原电池。
①两个活动性不同的电极(或一个为金属,一个为能导电的非金属)电极。
②具有电解质溶液。
③形成闭合回路。
1.正误判断(1)HCl+NaOH===NaCl+H2O是放热反应,可以设计成原电池()(2)在铜—锌—稀硫酸原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液到达锌()(3)原电池中阳离子向正极移动 ( )(4)原电池中的负极反应一定是电极材料失电子()(5)把锌粒放入盛有盐酸的试管中,加入几滴CuCl2溶液,气泡放出速率加快( )[答案] (1)×(2)×(3)√(4)×(5)√2.下列叙述不正确的是( )A.根据一次能源和二次能源的划分,氢气为二次能源B.电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源C.火力发电是将燃料中的化学能直接转化为电能的过程D.在火力发电过程中,化学能转化为热能实际上是氧化还原反应发生的过程,伴随着能量的变化[答案]A3.下列设备工作时,将化学能转化为电能的是( )[答案]C4.(1)下列装置属于原电池的是________。
(2)在选出的原电池中,________是负极,发生________反应,________是正极,该极的现象是________________.(3)此原电池反应的化学方程式为______________________。
苏教版化学必修二2.3 化学能与电能的转化(解析版)

2.3.1化学能转化为电能 化学电源1.构成原电池的条件 (1)有活泼性不同的两个电极; (2)电极插入电解质溶液中; (3)电极间形成闭合回路; (4)能自发地发生氧化还原反应。
2.原电池工作原理口诀原电池分两极(正、负);负极氧化正(极)还原;电子由负(极)流向正(极);阳(离子)向正(极)阴(离子)向负(极)。
3.原电池正、负极的判断化合价升高―→失去电子―→发生氧化反应―→负极; 化合价降低―→得到电子―→发生还原反应―→正极。
4.钢铁发生电化学腐蚀的电极反应和总反应 负极反应:Fe -2e -===Fe 2+,正极反应:O 2+4e -+2H 2O===4OH -, 总反应:2Fe +O 2+2H 2O===2Fe(OH)2, 4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
原电池及其工作原理1.实验探究[实验1]把一块锌片和一块铜片分别插入盛有稀硫酸的烧杯中,观察实验现象。
[实验2]把一块锌片和一块铜片同时插入盛有稀硫酸的烧杯中,观察实验现象。
实验1、2现象:实验1、2中现象相同,均为锌片周围有气泡产生,铜片周围无明显现象。
实验结论:锌在金属活动性顺序中位于氢前面,能置换酸中氢;铜片在金属活动性顺序中位于氢后面,不能置换酸中氢。
[实验3]用导线把实验2中的锌片和铜片连接起来,观察实验现象。
[实验4]在导线中间接一个灵敏电流计,观察实验现象。
实验3、4现象:锌片周围无气泡产生,铜片周围有气泡产生;电流计指针发生偏转。
实验结论:锌、铜用导线连接后插入稀硫酸溶液中,导线中有电流产生。
2.原电池(1)概念:将化学能转变为电能的装置。
(2)工作原理(以锌-铜-稀H2SO4原电池为例):(3)构成条件a.有活泼性不同的两个电极b.电极插入电解质溶液中c.电极间构成闭合回路d.能自发地发生氧化还原反应(4)原电池的电极反应负极→流出电子→发生氧化反应,正极→流入电子→发生还原反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一次能源: 直接从自然界取得的能源。
如:风力、原煤、天然气、石油、流水。
二次能源:
一次能源经过加工、转换得到的能源。 如:电力,蒸汽。
一、化学能与电能的转化: (一)火力发电:
2001年我国发电总量构成图
火电站工作原理示意图
化学能
燃烧
热能
蒸汽
机械能
发电机
电能
思考与交流 火 力 存 发 在 电 有 优 什 点 么 优 存 点 在 和 缺 缺 点 点
我国煤炭资源丰富,廉价方便 电能清洁安全 快捷方便、节省时间 煤炭资源毕竟有限、非可再生 排出大量温室效应气体 可能导致酸雨并且有废气
有一定局限性 能量转化效率低 问:如何把化学能直接转化为电能呢?
【实验一】分别把锌片和铜片插 入到稀H2SO4中,观察现象。
锌片:产生大量的气泡
铜片:无明显现象
【实验二】再用导线把锌片和铜片 连接起来,观察铜片上有无气泡产 生?
放电之后不能充电 (1)一次性电池: 内部的氧化还原反应是不可逆的 (2)普通锌锰电池:
1.干电池
Zn-2e- =Zn2+ 负极? Zn 2MnO2+2NH4++2e正极? C =Mn2O3+2NH3+H2O 电解质: NH4Cl 缺点: 使用寿命短,易泄漏
(3)碱性锌锰电池: 负极? Zn Zn-2e-+2OH- =Zn(OH)2 2MnO2 + 2H2O + 2 e- = C 正极? 2MnO(OH) + 2OH- 电解质: KOH 优点: 使用寿命长,不易泄漏 (4)应用:卡式录音机、闪光灯、电动玩具、袖珍电视机等
练习
有A、B、C、D四种金属分别浸入稀 H2SO4中,A、B产生气泡缓慢而C、D产生气 泡较激烈;把A、B两种金属用导线连接后浸入 稀H2SO4中,气泡从A金属表面析出,把C、D 两种金属用导线连接后浸入稀H2SO4中组成原 电池,电流由C→D,根据实验现象,可知A、 B、C、D四种金属的活动性顺序。
跟相同质量的其它金属作负极相比,使用寿命 延长,高能、质轻、电压高、工作效率高、储存寿 命长。
3、燃料电池——高效、环境友好的化学电池
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电 能的化学电池。 它的电极材料一般为活性电极,具有很强的催化活性,如铂电极, 活性炭电极等。 (例如:H2和O2的燃料电池,CH4和O2的燃料电池)
(根据电子流动 电子流入的极 ——正极 方向)
宏观判断:方法四
较活泼的电极材料 ——负极 ①根据电极材料
②根据原电池电极 发生的反应
较不活泼的电极材料——正极 发生氧化反应的极 ——负极
发生还原反应的极 ——正极 质量增加的电极 ——正极 ③根据电极增重还是减重 工作后 质量减少的电极 ——负极 ④根据电极有气泡冒出: 工作后,有气泡冒出的电极为正极
D>C>B>A
二、发展中的化学电源:
碱性电池
蓄电池
干电池
锂电池
干电池是一种伏打电池,利用 某种吸收剂(如木屑或明胶) 使内含物成为不会外溢的糊 状。常用作手电筒照明、收 音机等的电源。
(1)普通锌锰干电池 酸性锌锰干电池是最早进入市场的实用电池 优点:制作简单、价格便宜。 缺点:放电时间短,电压下降快。
(不可以)
(可以)
(不可以)
原电池的形成条件 (1)能自发地发生的氧化还原反应:
(2)电解质溶液: 参与电极反应或构成内电路 (3)两导体作电极:
①活动性不同的金属(或一种金属和一种非金属导 体石墨),与电解质溶液反应的活泼金属为负极。 ②两不活泼的导体-石墨或Pt等。(燃料电池电极)
①电极和电解质溶液 ②两电极上分别有还原剂和氧化剂(燃料电池)
锂离子电池
锂离子电池是新一代可充电的绿色电池。 特点:高能电池,电压高,质量轻,贮存时间长等。
用途:现已成为笔记本电脑、移动电话、摄像机、手表、 心脏起搏器等低功耗电器的主流。
笔记本电脑专用电池
发展中的电池
锂电池(有机溶剂电解液)
负极:2Li-2e—=2Li+ 正极:I2+2e—=2I— 总反应:2Li+I2=2LiI
化学反应中的能量变化 第二节 化学能与电能
学习目标: 1.掌握原电池的形成条件,理解原电池的工作原理; 2.能够正确地判断原电池的两极,能够正确地书写电极反应及总反 应; 3.了解常见化学电源的种类及特点,能够认识和书写几种新型电池 的电极及电极反应。
能源:
流水
风力
石油
电力
原煤
天然气
蒸汽
能源的分类:
负极 正极 负极 正极
2H2 - 4e- = 4H+ O2 + 4e- + 4H+ = 4H2O 2H2 - 4e- = 4H+ O2 + 4e- + 2H2O = 4OH2H2 - 4e- +4OH- = 4H2O O2 + 4e- + 2H2O = 4OH-
中性
负极 碱性(KOH)
(记这个)
正极
(∨)
(∨ )
负极: Zn-2e-=Zn2+
正极: 2H++2e-=H2↑
总反应:Zn+2H+=Zn2++H2↑
3.判断下面装置是否可以组成原电池,如果 可以请写出电极反应和总反应。
负极: Fe-2e
-
=Fe2+
正极: 2Ag++2e- =2Ag 总反应: Fe + 2Ag+ = Fe2+ + 2Ag
4.原电池本质
氧化还原反应 ①反应类型。 负极发生氧化反应,正极发生还原反应。 ②电子的移动方向。 从负极流出,经导线流向正极。 ③离子的移动方向。 阳离子向正极移动,阴离子向负极移动。
探究形成原电池的条件: 第一组实验
(可以)
(可以)
(不可以)
第二组实验
(可以)
第三组实验
1、干电池
碱性电池
(2)碱性干电池 电解液:酸性 NH4Cl→碱性KOH (离子导电性更好) 负极:锌片→锌粉(反应面积成 倍增长,使放电电流大幅度提高) 优点:比能量和储存时间有 所提高,适用于大电流和连 续放电 碱性电池是个人音响、照相机 等地首选电源。
二、发展中的化学电源
[课本P39]、[设计P43]
充电
2PbSO4+2H2O
②镍镉充电电池:
镍 镉 电 池
负极: Cd 正极: NiO(OH) 电解质: KOH 具有残留性记忆,可重复使用500次以上,体积小; 优缺点:
但镉有致癌作用,如不回收,会产生严重污染
应用:
广泛用于收录机、无线对讲机、电子闪光灯、 电动剃须刀等
镉有致癌作用,有被镍氢电池取代的趋势。
(4) 形成闭合回路。
(两电极用导线连接,或接触。)
下列装置是否能构成原电池?
Cu Zn Ag
酒精
H2SO4溶液
∨
H2SO4溶液
Zn
Cu
Zn 盐桥
Cu
ZnSO4溶液
CuSO4溶液 Fe Cu
∨
ZnSO4溶液 CuSO4溶液
练习:
1.判断下列哪些装置构成了原电池?若不是,请说明理 由;若是,请指出正负极名称,并写出电极反应式.
现象
铜片 铜片上有气泡产生 锌片逐渐溶解,不 锌片 产生气泡 电流 电流表指针发生偏 表 转
(二)原电池 1.概念:将化学能直接转变为电能的装置
I
e-
负极 Zn
A
正极 Cu
H+ SO42-H+
2.原电池的电极反应:
锌片: Zn - 2e- = Zn2+ (负极)
+ + 2e- = 2H 铜片: (正极)应:2H2 + O2 =2H2 O
通入的气体在电极表面放电,电池只是作为一个反应器。 与其它电池区别:反应物不是储存在电池内。 用途:氢氧燃料电池目前已应用于航天、军事通讯、 电视中继站等领域
*氢氧燃料电池的电极反应
介质
酸性
(H2SO4)
电池反应: 2H2 +O2 = 2H2O
一定要会判断:酸性有H+ (肯定没OH- ); 碱性有OH- (肯定没 H+ )
⑵甲烷氧气燃料电池 该电池用铂片插入KOH溶液中作电极,在两极 上分别通甲烷和氧气 负极: CH4+10OH——8e—=CO32—+7H2O
正极:
2O2+4H2O+8e—= 8OH—
放电总反应式: CH4+ 2O2+2KOH =K2CO3 +3H2O
【小结】
一.原电池:把化学能转化为电能的装置
二.原电池的构成:
1.可自发发生的氧化还原反应 2.两个电极 3. 内部有离子导电体(通常是电解质溶液)
4.形成闭合电路
三.原电池的工作原理:
四.原电池正负极的判断方法:
设计原电池: 练习1:Zn片,Ag片,AgNO3溶液为组装材料,设 计原电池。 练习2:利用下述反应:2FeCl3+Fe=3FeCl2设计一个 原电池装置。①画出装置图;②标明电极材料和 电解质溶液;③写出电极反应式。 (先写出离子反应) 负极(Fe):2Fe - 2e- = Fe2+ 正极(C): 2Fe3++2e- = 2Fe2+
充电
放电:化学能转化为电能 负极?
充电:电能转化为化学能 电解质?
正极?
铅蓄电池:
放电时:
正极材料是 PbO2 负极材料是 Pb 电解质是 。 H2SO4 ,
负极:
