高一化学必修二第二章第二节化学能与电能ppt课件
合集下载
人教版化学必修二2.2 化学能与电能 课件品质课件PPT

正极
得电子 还原反应
原电池
•
长风破浪会有时,直挂云帆济沧海。努力,终会有所收获,功夫不负有心人。以铜为镜,可以正衣冠;以古为镜,可以知兴替;以人为镜,可以明得失。前
反思、关照自己的不足,学习更多东西,更进一步。穷则独善其身,达则兼济天下。现代社会,有很多人,钻进钱眼,不惜违法乱纪;做人,穷,也要穷的
C.c > a > b > d D.b > d > c > a
4.原电池的电极反应不仅与电极材料的性质有关,也与 电解质溶液有关。下列说法中不正确的是 ( C ) A、由Al、Cu、稀硫酸组成原电池,负极反应式
Al-3e-===Al3+ B、由Mg、Al、NaOH溶液组成原电池,负极反应式
Al-3e-+4OH-===AlO2-+2H2O C、由Fe、Cu、FeCl3溶液组成原电池,负极反应式
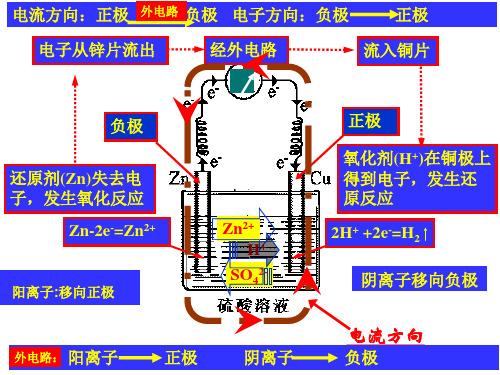
铜片:2H++2e-=H2↑
(还原反应)
总反应:
H+
Zn+2H+=Zn2++H2↑
H+
稀硫酸
外电路
原电池工作原理图
负极 阴 离 子
氧化反应
还原反应 正极
电解质溶液
阳 离 子
内电路
实 验 探 如果更换铜-锌原电池中的部 究 分电极材料或电解质,电流计
的指针依旧会发生偏转吗?
2
探究二、原电池构成 条件
胸怀大志,腹有良策,有包藏宇宙之机,吞吐天地之志者也英雄气概,威压八万里,体恤弱小,善德加身。老当益壮,宁移白首之心;穷且益坚,不坠青云
体,心灵可以永远保持丰盛。乐民之乐者,民亦乐其乐;忧民之忧者,民亦忧其忧。做领导,要能体恤下属,一味打压,尽失民心。勿以恶小而为之,勿以
人教版高中化学必修二第二章第二节《化学能与电能》课件(共29张PPT)

发展中的新型电池
(1)钮扣电池(Ag-Zn电池):不锈钢 制成一个由正极壳和负极盖组成的小 圆盒,盒内靠正极一端填充由Ag2O和少 量石墨组成的正极活性材料,负极盖 一端填充锌汞合金作负极活性材料, 电解质溶液为浓KOH溶液,已知电池内 Zn的氧化产物为ZnO。
电池反应:
负极:Zn+ 2OH- -2e- =ZnO+H2O 正极:Ag2O+ H2O +2e- =2Ag+ 2OH总反应: Ag2O+ Zn =ZnO+ 2Ag
3、燃料电池——高效、环境友好的化学电池
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电 能的化学电池。 它的电极材料一般为活性电极,具有很强的催化活性,如铂电极, 活性炭电极等。 (例如:H2和O2的燃料电池,CH4和O2的燃料电池)
小型高性能燃料 电池
氢氧燃料电池工作原理:
总反应:2H2 + O2 =2H2 O
笔记本电脑专用电池
锂电池(有机溶剂电解液)
负极:2Li-2e—=2Li+ 正极:I2+2e—=2I— 总反应:2Li+I2=2LiI
跟相同质量的其它金属作负极相比,使用寿命 延长,高能、质轻、电压高、工作效率高、储存寿 命长。
资料:对自然环境威胁最大的 五种物质即铬、镉、铜、铅、 汞。电池包含三种镉,汞,铅
• 综上所述:这些电池有什么缺陷呢 ?
废旧电池的回收利用
电池中含有大量的重金
属如锌、铅、镉、汞、锰等。
有机汞中毒,患者手足失调,步行困据难专,家运测动试障,碍一,节听纽力扣及电言池
语障碍,肢端麻木
能污染60万升水;一节一号
感觉障碍,视野缩小,重者神经错乱电,池痉烂挛在,地最里终,死能亡使一平方
人教版高中化学必修二第二章第二节《化学能与电能》课件(共33张PPT)

存
排出大量温室气体
在
缺
可能导致酸雨
点
能量转化效率低
? 化学能
电能
演示探究 Zn Cu
稀H2SO4
实验现象
锌表面有气泡 产生,铜表面 无明显现象
Zn +2H+ = Zn 2+ +H2↑
1.反应中,哪种物质失电子,哪种物质得电子 2.什么方法可使Zn与H+分开,不让H+ቤተ መጻሕፍቲ ባይዱ接在 Zn表面得电子?
用导线将锌表面的电子引出来
电流表发生偏转。
稀H2SO4
电子由Zn 导线 铜片 H+ 定向移 动产生电流,故电流表的指针发生偏转
1.电子从Zn到H+经历了哪些途径? 2.你认为这个过程能量是如何转化的?
化学能直接转化为电能
二.化学能直接转化为电能
1.原电池的概念、前提
概念: 将化学能转化为电能的装置
前提: 能自发发生氧化还原反应
2019/8/11
最新中小学教学课件
33
谢谢欣赏!
2019/8/11
最新中小学教学课件
34
小结
化
间接:化学能燃烧热能蒸汽机械能发动机电能
学
能
与
装置
直接:
原电池
电
能
工 作
概
构 成
原念 条
理
件
习题一: 原电池的判断
1.下列装置中能组成原电池形成电流的是( C )
A
A
Cu Cu
Zn Cu
A
B
H2SO4
A Zn Cu
酒精 A
Zn
Cu
C
H2SO4
D
高一化学必修Ⅱ人教新课标第二章第二节2.2化学能和电能(共22张ppt)
H2SO4为电解质溶液的氢氧燃料电池的电极反应 式
负极:2H2–4e-===4H+ 正极:O2+4H++4e-====2H2O
电解质溶液为KOH溶液的氢氧燃料电池的电极反应式该如何写?
负极:2H2 + 4OH--4e- ==== 4H2O 正极:O2 + 2H2O +4e-====4OH碱性条件下 ——有效地防止电解质溶液对外壳的腐蚀
2、根据电流方向或电子流动方向判断:
电流是由正极流向负极;
电子流动方向是由负极流向正极。
3、根据原电池两极发生的变化来判断: 原电池的负极总是失电子发生氧化反应,
正极总是得电子发生还原反应。
4、电极反应现象.
不断溶解,质量减少为负极;有气体产生 加或不变为正极
(H2),或质量增
8.下列化学电池不易造成环境污染的是 ( A )
A. 氢氧燃料电池 B.锌锰电池
C.镍镉电池
D. 铅蓄电池
9.对于锌一铜一稀酸组成的原电池装置中,当导线中有1 mol 电子通过时,理论上的两极变化是( A )。
①锌片溶解了32.5g
②锌片增重32.5g
③铜片上析出lg H2
④铜片上析出1mol H2
A.正极附近的SO42-离子浓度逐渐增大 B.电子通过导线由铜片流向锌片
C.正极有O2逸出 D.铜片上有H2逸出
2.一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu, 该反应的原电池的正确组成是( C )
AB
C
正极
Zn Cu Cu
负极
Cu Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4
14.关于用水制取二级能源氢气,以下研究方向不正确的是( AD )。 A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不
负极:2H2–4e-===4H+ 正极:O2+4H++4e-====2H2O
电解质溶液为KOH溶液的氢氧燃料电池的电极反应式该如何写?
负极:2H2 + 4OH--4e- ==== 4H2O 正极:O2 + 2H2O +4e-====4OH碱性条件下 ——有效地防止电解质溶液对外壳的腐蚀
2、根据电流方向或电子流动方向判断:
电流是由正极流向负极;
电子流动方向是由负极流向正极。
3、根据原电池两极发生的变化来判断: 原电池的负极总是失电子发生氧化反应,
正极总是得电子发生还原反应。
4、电极反应现象.
不断溶解,质量减少为负极;有气体产生 加或不变为正极
(H2),或质量增
8.下列化学电池不易造成环境污染的是 ( A )
A. 氢氧燃料电池 B.锌锰电池
C.镍镉电池
D. 铅蓄电池
9.对于锌一铜一稀酸组成的原电池装置中,当导线中有1 mol 电子通过时,理论上的两极变化是( A )。
①锌片溶解了32.5g
②锌片增重32.5g
③铜片上析出lg H2
④铜片上析出1mol H2
A.正极附近的SO42-离子浓度逐渐增大 B.电子通过导线由铜片流向锌片
C.正极有O2逸出 D.铜片上有H2逸出
2.一个原电池的总反应的离子方程式是Zn+Cu2+=Zn2++Cu, 该反应的原电池的正确组成是( C )
AB
C
正极
Zn Cu Cu
负极
Cu Zn Zn
电解质溶液 CuCl2 H2SO4 CuSO4
14.关于用水制取二级能源氢气,以下研究方向不正确的是( AD )。 A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不
高一人教版化学必修2第二章第二节化学能和电能课件 (共21张ppt)

化学能与电能的转化
1、【实验探究一】
分组合作探究,用与铜锌导电装置连接好的酒精去接触电流计 是否有偏转,再用与铜锌导电装置连接好的柠檬去接触电流计, 然后观察分析得出结论:
相互对比
酒精
柠檬
①必须有电解质溶液。
化学能与电能的转化
2、【实验探究二】
将电极全部换成碳棒或锌片插入柠檬中,观察电 流计的指针是否偏转?
化学能与电能的转化
(2)原电池工作原理 工作原理: Zn+ H2 SO4 =ZnSO4+H2
2eZn + 2H+ = Zn2+ + H2↑
电极反应式: 负极(:Zn) Zn -2e- = Zn2+ 氧化反应
正极:(Cu)2H++2e- = H2 ↑还原反应
(铜片在这里起传导电子的作用)
化学能与电能的转化 ቤተ መጻሕፍቲ ባይዱ展巩固
化学能与电能的转化
板书设计
化学能转化为电能 1.定义:把化学能直接转化为电能的装置叫做原电池 负极:活泼性较强的金属 正极:活泼性较弱的金属或非金属 2、电极反应: 负极:Zn-2e-=Zn2+(氧化反应) 正极:2H+ +2e-=H2(还原反应) 总反应式:Zn+2H+=Zn2+ +H2 ↑(氧化还原反应) 3、形成条件: ①有电解质溶液 ②活泼型相同的电极 ③自发进行的氧化还原反应 ④形成闭合回路
化学能与电能的转化
原电池形成的条件:
①必须有电解质溶液。 ②必须是两个活泼型不同的电极。 ③必须能自发进行的氧化还原反应。 ④必须形成闭合回路。
化学能与电能的转化
【巩固提升】
H2SO4溶液
(可以)
化学必修二化学能与电能 ppt课件

次充电使用。
用途:目前汽车上使用的电瓶大多仍是铅蓄电池,它还
广泛用于国防、生产、生活等领域。
PPT课件
35
2、充电电池
二次电池:氧化还原反应在充电时 可以逆向进行。 优缺点: 可充电,比干电池使用
寿命长;但体积大,有污染
应用: 汽车上使用的电瓶等 总反应:
放电
铅蓄电池 2PbSO4+2H2O
PbO2+Pb+2H2SO4
(二)原电池 1.概念:将化学能直接转变为电能的装置
I
e-
负极 Zn
A
正极 Cu
H+ SO42-H+
PPT课件 9
2.原电池的电极反应:
锌片: Zn - 2e- = Zn2+ (负极)
+ + 2e- = 2H 铜片: (正极)
氧化反应
H2 ↑ 还原反应
电池反应: Zn (总反应)
+
2H+ =
Zn2+ +
PPT课件
22
微观判断
电子流出的极 ——负极
原电池的正负极的判断方法
(根据电子流动 电子流入的极 ——正极 方向)
宏观判断:方法四
较活泼的电极材料 ——负极 ①根据电极材料
②根据原电池电极 发生的反应
较不活泼的电极材料——正极 发生氧化反应的极 ——负极
发生还原反应的极 ——正极 质量增加的电极 ——正极 ③根据电极增重还是减重 工作后 质量减少的电极 ——负极 ④根据电极有气泡冒出: 工作后,有气泡冒出的电极为正极
镉有致癌作用,有被镍氢电池取代的趋势。
PPT课件 38
锂离子电池
锂离子电池是新一代可充电的绿色电池。 特点:高能电池,电压高,质量轻,贮存时间长等。
用途:目前汽车上使用的电瓶大多仍是铅蓄电池,它还
广泛用于国防、生产、生活等领域。
PPT课件
35
2、充电电池
二次电池:氧化还原反应在充电时 可以逆向进行。 优缺点: 可充电,比干电池使用
寿命长;但体积大,有污染
应用: 汽车上使用的电瓶等 总反应:
放电
铅蓄电池 2PbSO4+2H2O
PbO2+Pb+2H2SO4
(二)原电池 1.概念:将化学能直接转变为电能的装置
I
e-
负极 Zn
A
正极 Cu
H+ SO42-H+
PPT课件 9
2.原电池的电极反应:
锌片: Zn - 2e- = Zn2+ (负极)
+ + 2e- = 2H 铜片: (正极)
氧化反应
H2 ↑ 还原反应
电池反应: Zn (总反应)
+
2H+ =
Zn2+ +
PPT课件
22
微观判断
电子流出的极 ——负极
原电池的正负极的判断方法
(根据电子流动 电子流入的极 ——正极 方向)
宏观判断:方法四
较活泼的电极材料 ——负极 ①根据电极材料
②根据原电池电极 发生的反应
较不活泼的电极材料——正极 发生氧化反应的极 ——负极
发生还原反应的极 ——正极 质量增加的电极 ——正极 ③根据电极增重还是减重 工作后 质量减少的电极 ——负极 ④根据电极有气泡冒出: 工作后,有气泡冒出的电极为正极
镉有致癌作用,有被镍氢电池取代的趋势。
PPT课件 38
锂离子电池
锂离子电池是新一代可充电的绿色电池。 特点:高能电池,电压高,质量轻,贮存时间长等。
人教版高中化学必修二第二章第二节《化学能与电能》课件(共27张PPT)

利用燃料(煤)燃烧放热,加热水, 不再生;
形成高温高压过热蒸汽,推动气轮机 旋转,带动发电机转子(电磁场)旋
能块锌片和铜片分
别插入盛有稀硫酸的烧杯里。
Zn片有气泡产生,铜片没有。
实验2:用导线将锌片和铜片 连接起来。 Zn片溶解,铜片有气泡产生。
Zn
成 H2 ,被 还原 。
e-
A
e-
Cu
Cu片起到传导 电子的作用,
不参加反应
H+ SO42-H+
负极发生氧化反应,正极发生还原反应
外电路:电子从负极经外电路流向正极
内电路:阳离子移向正极,阴离子移向负极(正正负负)
3.★电极、电解质溶液和电极反应式
负极:(失电子,氧化反应) Zn片:Zn -2e- = Zn2+
Zn-2e-=Zn2+
经外电路
流入铜极.
Zn2+
H+ SO42-
正极 氧化剂(H+)在铜 极上得到电子, 发生还原反应 2H+ +2e-=H2
电流方向
1.下列装置中能组成原电池形成电流的是( C )
A
Cu Cu
A
Zn Cu 两
A
B
极
H2SO4 A
Zn Cu
C
H2SO4
酒精
一
A
液
Zn
Cu 一
D
H2SO4
氢氧燃料电池
是以H2为燃料,产物为H2O的一种高效低污染的 新型电池,主要用于航天领域。
它的电极材料一般为铂电极和活性炭电极(两 极均不参加反应),而是由外设备提供燃料和氧 化剂,反应时H2从负极进入,O2从正极进入,电 解质溶液一般为40%的KOH溶液或稀硫酸溶液。
人教版高中化学必修二:2.2《化学能与电能 》 课件 (共23张PPT)

2、根据原电池构成条件的实验探索,结合实际 (如经济条件、美观要求、口腔实际环境等),你 现在开的处方是什么?
五、教学反思与自我评价
本节课最大的亮点就是原电池工作原理、 构成条件均由学生动手实验探究来完成。 亲自动手实验探究的过程让学生体验真实 的化学课堂; 贺卡优美的音乐声和水果电池及果汁电池 让学生感到有趣的化学课堂; 原电池设计方案的自由选择让学生体验自 主的化学课堂。
2、学情分析
学生已经学习了元素化合物、电解质及氧 化还原反应等有关知识; 在能力上,学生已经初步具备了观察能力、 实验能力、思维能力。 学生在生活中对电池也有所了解。学生喜 欢通过实验探究化学反应的实质,由实验现象 推测反应原理,学生对本节课会有所期待。
3、教学目标
(1)知识目标:
认识原电池概念, 掌握原电池工作原理和构成条件。
六、板书设计
1.原电池:将化学能转变为电能的装置。 锌片: Zn-2e-=Zn2+ 铜片:2H+ +2e- =H2 总反应方程式:Zn + 2H+ =Zn2+ + H2 2.形成原电池的条件: (1)自发的发生氧化还原反应。 (2)活泼性不同的两电级。 (3)电解质溶液。 (4)构成闭合回路。
阴离子
eZn
原电池工作原理小结
Cu
A
再将图像定格,让学生归纳,共同完 成以下问题
还 反 氧化 化学能 电能 1、化学反应总伴随着能量变化 ,此装置将化学能转化为什么 原 应
H2SO4 (aq)
能量呢? 2、结合物理学知识,由电子流向确定铜锌 电极的名称 ?书 2+ 负极(锌):Zn-2e =Zn 氧化反应 e写电极反应式 ,从得失电子的角度分析 + - 反应类型?
【最新】人教版高一化学必修二第二章第二节化学能与电能(共31张PPT).ppt

编号 1
电极材料 Mg、Al
电解质溶液 稀盐酸
电流计指针 偏转情况
偏向Al
2
Al、Cu
稀盐酸
偏向Cu
3
Al、C(石墨) 稀盐酸
偏向石墨
4
Mg、Al
5
Al、Zn
氢氧化钠溶 液
浓硝酸
偏向Mg 偏向Al
二、发展中的化学电源
1、干电池 (-)Zn | NH4Cl | C(+) 负极(锌筒): Zn-2e-=Zn2+ 正极(石墨棒): 2NH4++2e- +2MnO2= 2NH3+Mn2O3+H2O
锂电池 3、氢氧燃料电池(把化学能转变为电能): (-)Pt(H2) | KOH | Pt(O2)(+)
负极:2H2+4OH--4e-=4H2O 正极:2H2O+O2+4e-=4OH总反应方程式为: 2H2+O2=2H2O
负极: 较活泼金属(电子流出的极) 正极: 较不活泼的金属 (或能导电的非金属)(电子流入的 极)
负极: 氧化反应, 一般是金属失电子 正极: 还原反应,溶液中的阳离子得电子或者氧气得电子( 吸氧腐蚀)
负极
正极
溶液中带电 阳离子向正极移动(阳正阴负) 粒子的移动 阴离子向负极移动
3、原电池工作原理:
转化成电能呢
1、锌片和铜片分别插入硫酸有何现象发生?
2、锌片和铜片用导线连接后插入硫酸中,
有何现象,为什么? 3、锌片和铜片用导线连接后插入硫酸中, 导线上接上一个电流计有何现象, 为什么?
下列实验现象有何不同
导线
G
e-
e-
Zn
Cu
人教版高中化学必修二第二章第二节《化学能与电能》课件(共26张PPT)

C
D
小试牛刀
2.X、Y、Z都是金属,把X浸入Z的硝酸盐溶 液中,X的表面有Z析出。X与Y组成原电池时, Y为电池的负极。X、Y、Z三种金属的活动性 顺序为( C ) A、X>Y>Z B、X>Z>Y C、Y>X>Z D、Y>Z>X
请你当医生
假牙!!是假 牙!!!病根 就是她的假牙!
帮忙帮到底, 给格林太太支个招儿, 让她尽快好起来
善于质疑的意大利物理学家伏打在看到这篇文章后, 提出了疑问: 为什么青蛙腿只有与铜器和铁器接触时才发生抽搐? 伏打又进行了如下实验: 实验1:将青蛙腿放在铜盘里,用解剖刀去接触,蛙腿抽搐。 实验2:将青蛙腿放在木盘里,用解剖刀去接触,蛙腿不动。 经过一番研究,伏打用实验推翻了伽伐尼的结论,他 发现两种活泼性不同的金属同时接触蛙腿,蛙腿就会抽搐, 蛙腿只是起了显示电流通过的作用,所谓特殊的“动物电” 是不存在的。
(4)用接有电流计的两根导线分别接触锌片和铜片,
观察实验现象。
(思考讨论)
问题讨论一
1.在盛有稀硫酸的培养皿中同时加入Zn片和Cu片,两 Zn片上有气泡产生 ,有关的离子 者不接触,现象:___________________ Zn+2H+=Zn2++H2↑ 方程式:___________________ 。 2.用导线将Zn片与Cu片连接起来, Cu片上有气泡产生, 现象:_________________ 2H++ 2eˉ=H2↑ Cu片上发生的电极反应:_______________, Zn- 2eˉ= Zn2+ Zn片上发生的电极反应:_________________, Zn+2H+=Zn2++H2↑ 。 两式相加得的总反应式:___________________
高中化学必修2第二章第二节 化学能与电能PPT课件

二次能源: 一次能源经过加工、转换得 到的能源称为二次能源。如: 电力、蒸汽等
3
二、化学能转化为电能
火力发电原理及过程
思考:火力发电的过程能量是怎样转化的?
化学能 燃烧 热 蒸汽 机械能
发电机 电
(燃料)
能
(涡轮机)
能4
化学能 直接? 电能
▪ 化学能——化学反应
▪
氧化还原反应
▪ 电能——电流(电子流动)
发生的反应
负极 Zn-2e-=Zn2+ 氧化反应
Cu片
正极
2H++2e- 还原反应
总的离子反应方程式 Zn+2H+=Zn2=+H+H2↑2↑(两个电极反应之
和)
9
(4)原理: 外电路: 负极e→- 正极
e-→ e-
↓
内电路: 阳离子→正极 阴离子→负极
e↑ -
_பைடு நூலகம்
⊕
这样整个电路构成了闭合回路,带电粒 子的定向移动产生电流
为( C )
(A)X>Y>Z (B)X>Z>Y (C)Y>X>Z (D)Y>Z>X
20
把a、b、c、d四块金属片浸入稀硫酸中,用导 线两两相连组成原电池。若a、b相连时,a为负 极;c、d相连时,电流由d到c;a、c相连时,c 极上产生大量气泡,b、d相连时,b上有大量 气泡产生,则四种金属的活动性顺序由强到弱 的为B( )
其中较活泼金属为负极。较不活泼金属(或 非金属)为正极(正极一般不参与电极反应, 只起导电作用);
② 电解质溶液
③ 形成闭合回路
④ 能自发地发生氧化还原反应
17
原电池的判断
Zn A Cu Zn A Cu Fe A C(石墨) Zn A Cu
3
二、化学能转化为电能
火力发电原理及过程
思考:火力发电的过程能量是怎样转化的?
化学能 燃烧 热 蒸汽 机械能
发电机 电
(燃料)
能
(涡轮机)
能4
化学能 直接? 电能
▪ 化学能——化学反应
▪
氧化还原反应
▪ 电能——电流(电子流动)
发生的反应
负极 Zn-2e-=Zn2+ 氧化反应
Cu片
正极
2H++2e- 还原反应
总的离子反应方程式 Zn+2H+=Zn2=+H+H2↑2↑(两个电极反应之
和)
9
(4)原理: 外电路: 负极e→- 正极
e-→ e-
↓
内电路: 阳离子→正极 阴离子→负极
e↑ -
_பைடு நூலகம்
⊕
这样整个电路构成了闭合回路,带电粒 子的定向移动产生电流
为( C )
(A)X>Y>Z (B)X>Z>Y (C)Y>X>Z (D)Y>Z>X
20
把a、b、c、d四块金属片浸入稀硫酸中,用导 线两两相连组成原电池。若a、b相连时,a为负 极;c、d相连时,电流由d到c;a、c相连时,c 极上产生大量气泡,b、d相连时,b上有大量 气泡产生,则四种金属的活动性顺序由强到弱 的为B( )
其中较活泼金属为负极。较不活泼金属(或 非金属)为正极(正极一般不参与电极反应, 只起导电作用);
② 电解质溶液
③ 形成闭合回路
④ 能自发地发生氧化还原反应
17
原电池的判断
Zn A Cu Zn A Cu Fe A C(石墨) Zn A Cu
人教版高中化学必修二第二章第二节《化学能与电能》课件(共53张PPT)

H+在铜表面得到的电子是否为铜本 身失去的?为什么?电子从哪来?
•⑸导线间接一电流计有何 现象产生?为什么?
问题探究
1)电流计指针为什么会发生偏转?
2) 从能量变化的角度分析这是一种什么装置?
3)锌片的质量有无变化?溶液中C(H+)如何变化? 4)请分别写出锌片和铜片上变化的离子方程式,再 写出总反应的离子方程式。
[练习] 由碳棒、铁片和200mL稀H2SO4组成的原 电池中,当在碳棒上共放出3.36L(标准状况) 气体时,求消耗铁多少克?有多少个电子通过了
电线?
解:
负极反应: Fe – 2e— = Fe2+
正极反应: 2H+ + 2e— = H2 ↑
总反应: Fe + 2H+ = Fe2+ + H2 ↑
56g
6)电流流动的方向如何?
电流由铜片经导线流向锌片
7)硫酸溶液中的阴、阳离子应该怎样 运动?为什么?
H+向Cu片定向移动;SO42-向Zn片定向移动; 保证电解质溶液中“电荷守恒”。
小结
电子流向、电流流向:
e-
外电路:电子由负极→正极, 电流由正极→负极。
内电路:阴离子移向负极, 阳离子移向正极; 电流由负极→正极
原电池工作原理图示
外电路
e-
负极 氧化反应
还原反应 正极
阴
阳
离 子
电解质溶液
离 子
内电路
练习2:请在图上标出电子的流动方向和电流方向,
并判断正负极,写出电极反应式和总反应式.
I e-
e- I
Ag
Fe
Zn
Cu
H2SO4 (aq)
•⑸导线间接一电流计有何 现象产生?为什么?
问题探究
1)电流计指针为什么会发生偏转?
2) 从能量变化的角度分析这是一种什么装置?
3)锌片的质量有无变化?溶液中C(H+)如何变化? 4)请分别写出锌片和铜片上变化的离子方程式,再 写出总反应的离子方程式。
[练习] 由碳棒、铁片和200mL稀H2SO4组成的原 电池中,当在碳棒上共放出3.36L(标准状况) 气体时,求消耗铁多少克?有多少个电子通过了
电线?
解:
负极反应: Fe – 2e— = Fe2+
正极反应: 2H+ + 2e— = H2 ↑
总反应: Fe + 2H+ = Fe2+ + H2 ↑
56g
6)电流流动的方向如何?
电流由铜片经导线流向锌片
7)硫酸溶液中的阴、阳离子应该怎样 运动?为什么?
H+向Cu片定向移动;SO42-向Zn片定向移动; 保证电解质溶液中“电荷守恒”。
小结
电子流向、电流流向:
e-
外电路:电子由负极→正极, 电流由正极→负极。
内电路:阴离子移向负极, 阳离子移向正极; 电流由负极→正极
原电池工作原理图示
外电路
e-
负极 氧化反应
还原反应 正极
阴
阳
离 子
电解质溶液
离 子
内电路
练习2:请在图上标出电子的流动方向和电流方向,
并判断正负极,写出电极反应式和总反应式.
I e-
e- I
Ag
Fe
Zn
Cu
H2SO4 (aq)
人教版高中化学第二章第二节《化学能与电能》(共32张PPT)教育课件

3.Zn片和Cu片接触插入稀 H2SO4 (不接电流表)
Cu片上有何现象?推 测原因.
4.Zn片和Cu片用导线连接(中间 电流表指针有何变化? 接电流表)插入稀H2SO4(偏向?) 说明了什么?
5.尝试用干电池判断实验中 的正负极
说明你判断的方法?
化学能
电能 ?(看书P35页第二、三段,回答问题)
其他电池
空气电池
–
凡 事都 是多 棱镜 ,不同 的角 度会 看到 不同 的结 果。若 能把 一些 事看 淡了 ,就会 有个 好心 境, 若把 很多 事 看开了 ,就 会有 个好 心情。 让聚 散离 合犹 如月 缺月 圆那样 寻常 ,
凡 事都 是多棱 镜, 不同 的角 度会
凡 事都是 多棱 镜, 不同 的角度 会看 到不 同的 结果 。若 能把一 些事 看淡 了, 就会 有个好 心境 ,若 把很 多事 看开 了 ,就会 有个 好心 情。 让聚散 离合 犹如 月缺 月圆那 样寻 常, 让得失 利弊 犹如花 开花 谢那 样自然 ,不 计较, 也不 刻意执 着;让 生命 中各 种的喜 怒哀 乐,就 像风 儿一 样,来 了, 不管是 清风 拂面 ,还是 寒风 凛冽, 都报 以自 然 的微笑 ,坦然 的接 受命 运的馈 赠, 把是非 曲折 ,都 当作是 人生 的
锌片在锌,铜(稀硫酸)原
电池中作为负极,也被腐 原电池的负极
蚀。(电化学腐蚀)
被腐蚀得更快。
分析锌,铁(稀硫酸)原 电池中的电极反应。
你感受到作为正极,铁 被保护了吗?
原电池的金属 正极被保护。
原电池设计思路: ①释放能量的氧化还原反应(放热反应)
② 通常须两活性不同的电极 ③ 电解质溶液 ④ 还原剂在负极失电子,发生氧化反 应;氧 化剂在正极得电子,发生还原反应.
人教版化学必修二第二章第二节化学能与电能(共13张PPT)

(1)、微观判断(根据电子流动方向):
C中、相D互相接连触,)D;上有气泡逸出;正极:电流流出,经外电路,流入负极
探究——简单原电池的设计:
②、根据原电池电极发生的反内应:电路:阳离子移向正极
A、A>B>C>D
B、A>C>B>D
C、A>C>D>B
D、B>D>C>A
阴离子移向负极
中相互接触);
第 二 章 化学反应与能量
(氧化反应)
-
(还原反应)
Zn2+
H+
SHO+24
负极 阴离子 阳离子 正极
第 二 章 化学反应与能量
化学能与电能
探究——简单原电池的设计:
将反应CuCl2 + Fe === FeCl2+Cu设计成原电池。 画出装置图,判断正负极并标出电子移动方向。
总结:设计简单原电池 应如何选择“两 极一液”?
电子流入的一极——正极;
(2)、电解质溶液(一般与活泼性强
负极:电子流出,经外电路,流入正极
③、根据电极增重还是减重:
电解质溶液:CuCl2溶液
的活泼性顺序由大到小排列为 (
)。
√
×
√ ×
第 二 章 化学反应与能量
化学能与电能
2、把A、B、C、D四块金属泡在稀H2SO4中,用导线 两两相连可 以组成各种原电池。若A、B相连时, A为负极;C、D相连,D上有气泡逸出;A、C相 连时A极减轻;B、D相连, B为正极。则四种金属
Fe
Cu
A
B
C
电解质溶液均为稀H2SO4溶液
第 二 章 化学反应与能量
化学能与电能
铜片 锌片 电流表
现象 有气泡产生 逐渐溶解、变细 指针发生偏转
C中、相D互相接连触,)D;上有气泡逸出;正极:电流流出,经外电路,流入负极
探究——简单原电池的设计:
②、根据原电池电极发生的反内应:电路:阳离子移向正极
A、A>B>C>D
B、A>C>B>D
C、A>C>D>B
D、B>D>C>A
阴离子移向负极
中相互接触);
第 二 章 化学反应与能量
(氧化反应)
-
(还原反应)
Zn2+
H+
SHO+24
负极 阴离子 阳离子 正极
第 二 章 化学反应与能量
化学能与电能
探究——简单原电池的设计:
将反应CuCl2 + Fe === FeCl2+Cu设计成原电池。 画出装置图,判断正负极并标出电子移动方向。
总结:设计简单原电池 应如何选择“两 极一液”?
电子流入的一极——正极;
(2)、电解质溶液(一般与活泼性强
负极:电子流出,经外电路,流入正极
③、根据电极增重还是减重:
电解质溶液:CuCl2溶液
的活泼性顺序由大到小排列为 (
)。
√
×
√ ×
第 二 章 化学反应与能量
化学能与电能
2、把A、B、C、D四块金属泡在稀H2SO4中,用导线 两两相连可 以组成各种原电池。若A、B相连时, A为负极;C、D相连,D上有气泡逸出;A、C相 连时A极减轻;B、D相连, B为正极。则四种金属
Fe
Cu
A
B
C
电解质溶液均为稀H2SO4溶液
第 二 章 化学反应与能量
化学能与电能
铜片 锌片 电流表
现象 有气泡产生 逐渐溶解、变细 指针发生偏转
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H2SO4
C Zn
②③
H2SO4 A
⑥
A
Zn Zn
H2SO4
H2SO4 Zn
A
①
Zn
实验探究
A
Zn
Cu
① A
Zn
C
② A
Zn
Zn
H2SO4
H2SO4
H2SO4
偏转
不偏转
两极材料不同
有两种活泼性不同的金 属(或非金属)作电极
.
实验探究
A
Zn
Cu
③ A
ZnCu④ A NhomakorabeaZn
Cu
H2SO4
HCl
酒精
偏转
不偏转
HCl 酒精
A
A
C
⑤
Cu
Zn
A
.
Cu Zn
④
HCl Cu
A
试着说说原电池的构成有什么条件?
************************************************************************************* *************************************************************************************
(不可以) . (不可以)
实验探究形成原电池的条件
(可以)
(不可以)
形成条件二:电极需插进电解质溶液中;
.
实验探究形成原电池的条件
(不可以)
形成条件三:必须形成闭合回路
.
7.如何书写电极反应方程式
负极(锌片): Zn -2e - = Zn 2+ 正极(石墨): 2H++2e - = H2 ↑ 总反应: Zn + 2H+ = Zn 2+ + H2 ↑
旧键断裂和新键形成、体系能量变化
.
a.我国煤炭资源丰富,廉价方便. b.电能清洁安全,又快捷方便.
a.排出大量的温室效应气体. b.有废气可能导致酸雨 c.废料废水 d.储量有限 e.能量转换效率低
.
? 化学能
电能
.
化学能
电能 ?(看书P35页第二、三段,回答问题)
1、当氧化剂和还原剂直接接触进行反应时,化学 能要经过一系列能量转换才能转换为电能。
.
[实验现象]:铜片上有气泡产生,锌片不断溶 解,电流表的指针发生偏转。
[实验结论]:导线中有电流通过
.
二.化学能直接转化为电能
1.原电池的概念、前提
概念: 将化学能转化为电能的装置
2.前提: 能自发发生氧化还原反应
.
3.原电池的工作原理
能量转变 化学反应
原电池
将化学能直接转化为 电能
氧化还原反应中电子 转移 (负极失去电子 经过导线定向的流入 正极)
2、把氧化剂和还原剂分开,使氧化反应和还原反 应在两个不同区域进行。
3、需要在氧化剂和还原剂之间架设桥梁使电子从 氧化剂区域流向还原剂区域。
4、考虑氧化反应和还原反应发生的条件和环境, 化学物质的选择。
5、从电学角度考虑仪器选择和组装问题。
.
演示探究 Zn Cu
稀H2SO4
实验现象
锌表面有气泡 产生,铜表面 无明显现象
Zn
Zn2+
H+
SO24 -
H+
H2
Cu
.
4.原电池化学反应本质: 氧化还原反应
较活泼的金属发生氧化反应,电子从较活 泼的金属(负极)通过外电路流向较不活泼的 金属(正极)
.
5.电荷流向电流流向:
外电路:电子由负极流向正极,负极 电流由正极流向负极
内电路:阴离子移向负极,阳离 子移向正极,电流由负 极流向正极
.
一、化学能与电能的相互转化 1,火力发电原理及过程
燃烧
蒸汽
发电机
化学能 热能
机械能
电能
.
火力发电的原理分析。
化学能 燃烧 热能 蒸汽 机械能 发电机 电能
.
2、火力发电的化学深层本质分析
火力发电
过程
将化学能经一系列能量转化为电能
关键
燃烧
本质
氧化还原反应
本质
氧化剂与还原剂之间发生电子的转移
引起
要求书写时,正负极得失电子数相等。
溶液不同 电极材料均插入 电解质溶液中
.
实验探究
A
Zn
Cu
⑤
A
C
Cu
H2SO4
H2SO4
不偏转 电极材料不同
能自发地发生氧化还原反应
.
实验探究
A
A
Zn
Cu
Zn
Cu
⑥
H2SO4
H2SO4
H2SO4
不偏转 容器不同
两极相连形成闭合回路
.
例2
C
H2SO4
(可以)
(不可以)
条件一:有活泼性不同的两种金属或非 金属
e-
正极
.
6.原电池形成条件:两极一液一连线
① 两种活泼性不同的金属(或其中一种 为能导电的非金属,如“碳棒”)作电极。
其中较活泼金属为负极。较不活泼金 属(或非金属)为正极(正极一般不参与 电极反应,只起导电作用)。
② 电解质溶液 ③ 形成闭合电路 ④ 能自发地发生氧化还原反应
.
Cu
Cu
H2SO4
.
Zn-2e-=Zn2+ 氧化反应
2H++2e-
还原反应
=H2Z↑n+2H+=Zn2++H2↑
负极 正极
.
锌铜原电池原理
Zn片 溶解
失
Zn-2e-= Zn2+
负极
有气
体产 得 2H+ + 2e-= 正极
生
H2↑
Zn+2H+=
负极出电子,. 电Z子n回2+正+H极2↑
e-
- 负极
电流表
I 正极 +
2018年4月11日
.
.
直接从自然界取得的能源称为一次能源
水电站.
电能是现代社会 中应用最广泛、使用 最方便、污染最小的 一种二次能源,又称 为电力。
.
一次能源经加工、转换得到的能源称为二次能源
火电. 站
2001年我国发电总量构成图
火力发电占据绝大部分 什么是火力发电? 火电站的工作原理如何?
Cu起传导电子的作用。 可用电流表测电流及方向。
.
演示探究 A
Zn
Cu
锌表面无气泡, 实验现象 铜表面有气泡,
电流表发生偏转。
稀H2SO4
电子由Zn 导线 铜片 H+ 定向移动 产生电流,故电流表的指针发生偏转
1.电子从Zn到H+经历了哪些途径? 2.你认为这个过程能量是如何转化的?
化学能直接转化为电能
负极(锌片): Zn -2e - = Zn 2+ 正极(铜片): Cu2+ + 2e - = Cu 总反应: Zn + Cu2+ = Zn 2+ + Cu
.
电极反应方程式的书写方法
负极:较活泼金属(a)
电极反应:a-ne-=an+ (氧化反应)
正极:较不活泼金属或非金属(b)
电极反应: Cm+ + me- = C(还原反应)
Zn +2H+ = Zn 2+ +H2↑
1.反应中,哪种物质失电子,哪种物质得电子 2.什么方法可使Zn与H+分开,不让H+直接在 Zn表面得电子?
用导线将锌表面的电子引出来
.
演示探究
Zn
Cu
大量气泡从铜 实验现象 片逸出,锌片
部分溶解
稀H2SO4
Zn + 2H+ = Zn 2+ +H2↑
1.H+得到的电子是Cu失去的吗? 2.在这个过程中Cu起什么作用? 3.你怎样才能知道导线中有电子通过?
