高中化学必修二《化学键与离子键》课件
合集下载
人教版高中化学必修二第一章第三节《化学键》课件(共38张PPT)
活泼的金属元素和酸根离子形成的盐 把NH4+看作是活泼的金属阳离子
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
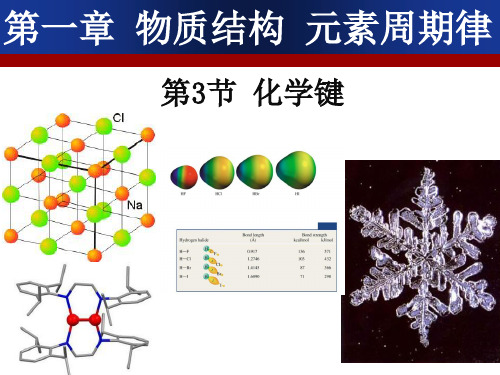
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
金属氧化物:Na2O,Al2O3等
强碱:NaOH Ba(OH)2等
如何表示氯化钠的形成过程--电子式
•资料卡片
电子式 为方便起见,我们在 元素符号周围用“ · ”或 “×”来表示原子的最外 层电子(价电子)。这种 式子叫做电子式。例如:
归纳:分子间作用力与化学键的比较
作用微粒 作用力大小
意义
化学键 相邻原子间 作用力大 范德华力 分子之间 作用力小
影响化学性质和 物理性质
影响物理性质 (熔沸点等)
一些氢化物的沸点
讨论: 为什么HF、H2O和NH3的沸点会反
常呢?
2.氢键
1)形成条件:原子半径较小,非金属性很强的 原子(N、O、F)与H原子形成强极性共价键 ,与另一个分子中的半径较小,非金属性很强 的原子Y (N、O、F),在分子间H与Y产生
1.原子、离子都要标出最外层电子,离子须标明 电荷;
2.阴离子要用方括号括起来;
3.相同的原子可以合并写,相同的离子要单个写 ;
4.不能把“→”写成“====”;
⑴ 用电子式表示氧化镁的形成过程 ⑵ 用电子式表示硫化钾的形成过程
氢气在氯气中燃烧
写出该过程的化学方程式和实验现象 思考:活泼的金属元素和活泼非金属元素化 合时形成离子键。请思考,非金属元素之间 化合时,能形成离子键吗?为什么?
较强的静电吸引,形成氢键
2)表示方法:X—H…Y—H(X.Y可相同或不 同,一般为N、O、F)。
3)氢键能级:比化学键弱很多,但比分子间作 用力稍强
特征:具有方向性。
氢键作用:使物质有较高的熔沸点(H2O、HF 、 NH3) 使物质易溶于水
苏教版高中化学必修二1.2.1 离子键 课件 (共14张PPT)

Na+ Cl-
Na
Cl
LOGO
【问题1】请用原子结构示意图表示氯化钠 的形成过程?
Na +11 2 8 1
e-
Na+ Cl-
Cl +17 2 8 7
LOGO
二、离子键
1. 离子键的概念:使带相反电荷的阴、阳离 子结合的相互作用,称为离子键。
【问(1)题成2】键微粒: 阴、阳离子 (1()2离) 成子键键本成质键:微静粒电是作什用么? (2()3离) 成子键键元是素否:就活是泼阴金、属阳元离素子与间活的泼一非种金静属元
Company Logo
【问题5】下面是几种阳离子和阴离子的电子 式,请同学们归纳它们的书写规律。 阳离子: Na+、Mg2+、Al3+ 阴离子: [ O ]2-、[ F ]-、[ Cl ]阳离子的电子式: 该阳离子的离子符号。 阴离子的电子式: 画出最外层电子,加方括 号,括号右上角标出离子所带电荷。
Company Logo
ห้องสมุดไป่ตู้
小结电子式书写:
原子的电子式: 原子的最外层有几个电子, 就在原子的元素符号的周围标上几个点或×。
阳离子的电子式: 该阳离子的离子符号。 阴离子的电子式: 画出最外层电子,加方括 号,括号右上角标出离子所带电荷。
离子化合物的电子式: 将组成该离子化合物的 阳离子和阴离子的电子式组合起来。
专题1 微观结构与物质的多样性
第二单元 微粒之间的相互作用力
离子键
LOGO
爬行的壁虎
氯化钠晶体结构
一、化学键
1.化化学学键键英的译概:念ch:em物i质ca中l b直on接d。相邻的原子 bo或nd离的子中之文间意存思在之的一强:烈结的合相力互、作强用烈。的相 互作用,我们称之为“键”。
人教版高中化学必修2《化学键》PPT(28页)

高一化学必修《2》 第一章 物质结构元素周期律
第三节 化学键
教学目标
知识与技能 使学生认识离子键和共价键及其化合物的
概念,能用电子式表示其化合物的形成。
过程与方法 通过教学过程,培养学生的抽象思维,提
高对微观粒子运动的认识。
情感态度与价值观
加强对立统一规律的认识,渗透由感性认识 上升到理性认识,再运用理论指导实践的认识 规律。
人教版高中化学必修2《化学键》PPT( 28页)
人教版高中化学必修2《化学键》PPT( 28页)
4. 电子式
在元素符号周围用小黑点“•” (或×)来表示原子的最外层电子
的式子。
原 子H O
Cl Mg Na
离 子 Cl
2-
O
Mg2
Na
离 子 Na Cl 化合物 Cl Mg2 Cl
人教版高中化学必修2《化学键》PPT( 28页)
含有离子键的化合物,叫做离子化合物。
人教版高中化学必修2《化学键》PPT( 28页)
2.离子键的成键特点
成键的粒子: 阴、阳离子 成键的本质: 静电作用
3.离子键的成键规律
活泼金属与活泼非金属之间,例如:大部分 的IA、IIA族和VIA、VIIA族
大部分盐、金属氧化物、过氧化物等 (含NH4+的盐)
﹕﹕
练习1〉 下列说法中正确的是 ( C) (A)含有共价键的物质一定是共价分子
也可能是离子化合物,如 NaOH, Na2O2 。
(B)只含有共价键的物质一定是共价化合物
也可能是单质分子,如氯气,氮气。
(C)离子化合物中可能含有极性共价键或非极性共价 键 正确 (D)氦分子中含有共价键
氦气是单原子分子,不存在化学健。
第三节 化学键
教学目标
知识与技能 使学生认识离子键和共价键及其化合物的
概念,能用电子式表示其化合物的形成。
过程与方法 通过教学过程,培养学生的抽象思维,提
高对微观粒子运动的认识。
情感态度与价值观
加强对立统一规律的认识,渗透由感性认识 上升到理性认识,再运用理论指导实践的认识 规律。
人教版高中化学必修2《化学键》PPT( 28页)
人教版高中化学必修2《化学键》PPT( 28页)
4. 电子式
在元素符号周围用小黑点“•” (或×)来表示原子的最外层电子
的式子。
原 子H O
Cl Mg Na
离 子 Cl
2-
O
Mg2
Na
离 子 Na Cl 化合物 Cl Mg2 Cl
人教版高中化学必修2《化学键》PPT( 28页)
含有离子键的化合物,叫做离子化合物。
人教版高中化学必修2《化学键》PPT( 28页)
2.离子键的成键特点
成键的粒子: 阴、阳离子 成键的本质: 静电作用
3.离子键的成键规律
活泼金属与活泼非金属之间,例如:大部分 的IA、IIA族和VIA、VIIA族
大部分盐、金属氧化物、过氧化物等 (含NH4+的盐)
﹕﹕
练习1〉 下列说法中正确的是 ( C) (A)含有共价键的物质一定是共价分子
也可能是离子化合物,如 NaOH, Na2O2 。
(B)只含有共价键的物质一定是共价化合物
也可能是单质分子,如氯气,氮气。
(C)离子化合物中可能含有极性共价键或非极性共价 键 正确 (D)氦分子中含有共价键
氦气是单原子分子,不存在化学健。
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)

人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
Q4:哪些元素倾向于形成离子键?
活泼 失电子 活泼
金属元素
非金属元素
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
《化学键——离 子键》
Q1:能把球形砖垒起来吗?
方砖
球形砖
Funny Game 试着把老师提供的两组乒乓球垒起来
Replace
Analogy
球形砖
乒乓球
原子
连接作用
Chemical Bond
直接相邻的原
键:
子或离子之间存在 《词典》 使轴与齿轮连接并
固定在一起的零件。
的强烈相互作用叫 《电学》 电键,即控制电路
Ionic Compound
1.定义: 由离子键构成的化合物叫做离子化合物。 2.类别:(1)大多数盐
(2)强碱 (3)金属氧化物、金属过氧化物 (4)金属氢化物
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT) 人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
形成离子键 形成???
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
Homework
人教版高中化学必修二 1.3 化学键——离子键 课件(20张PPT)(共20张PPT)
高中化学必修二1.3《化学键-离子键及离子化合物》课件

第三层级 技能应用与拓展 基础智能检测
1 下列叙述中错误的是( A )。 A.任何离子键在形成的过程中必定有电子的得与失 B.离子化合物中不一定含金属元素 C.钠原子和氯原子作用生成NaCl后,其结构的稳定性增强 D.NaCl中除Na+和Cl-静电吸引作用外,还存在电子与电子、 原子核与原子核之间的排斥作用
不正确;同种原子的电子式不能同时用“•”和 “×”表示。
第二层级 思维探究与创新 重难点探究
离子化合物电子式的书写
互动探究
(1)举例说明如何书写原子的电子式。
..
探究拓展
(2)阳离子的电子式怎样书写?阴离子的电子式又如何书写?
书写离子的电子式时,简单阳离子是原子失去最外层
电子后形成的,只写其元素符号,并在右上角注明所带
..
x. .. .. .. .. .
。 。
(4)书写离子化合物的电子式时,阴阳离子的排列应遵循
什么原则?
遵循阴阳离子交替出现的原则。
互动探究
1
2 由非金属元素组成的化合物可能是离子化合物吗? 可能,如NH4Cl由非金属元素组成,它是离子化合物。
名师点拔
一、电子式的书写
1 阳离子电子式:主族元素的简单离子中,阳离子的电子 式就是离子符号,如Na+既是离子符号,又是钠离子的电 子式。
N: _______ O: ________F: ________
基础学习交流
1 “离子键就是阴阳离子之间的吸引力”,这种说法正 确吗?说明理由。 不正确;离子键是阴阳离子之间的静电作用,该作 用力不仅只是阴阳离子之间的吸引力,还包括电子 与电子、原子核与原子核之间的排斥力。
2 镁原子的电子式:•Mg×,这种书写方式是否正确?说明理 由。
高中化学必修二第一章 第三节化学键 课时1 离子键和共价键(共59张PPT)

•
下列有关离子化合物的说法正确的
是( )
• A.离子化合物一定易溶于水
• B.离子化合物由非金属元素和金属元素共
同组成
• C.熔融状态下能够导电的物质,一定是离
子化合物
• D.离子化合物在晶体状态下有离子存在,
但不导电
【解析】 离子化合物不一定易溶于水,如 AgCl、BaSO4等;离子化合物不一定由非金 属元素和金属元素共同组成,如NH4Cl等铵 盐全部由非金属元素组成;熔融状态能导电 的物质,不一定是离子化合物,如金属单质; 离子化合物由阴、阳离子构成,在晶体状态 下,离子不能自由移动,故不能导电。
• 【答案】 D
• 4.氯化钠是日常生活中人们常用的调味品。 在下列事实中,可以证明NaCl中一定存在离 子键的是( )
• (3)证明某化合物一定存在离子键的方法是看在熔融 状态下能否导电。
• 3.离子化合物
• (1)定义:由离子键构成的化合物叫做离子化 合物。
• (2)构成微粒:阴离子、阳离子。
• (3)主要物理性质:熔、沸点较高,硬度较大。
• (4)导电性:固态时不导电,溶于水或受热熔 化后导电。
• (5)溶解性:大多数离子化合物易溶于水,难 溶于汽油、苯、四氯化碳等有机溶剂。
子化合物 • C.离子化合物一定能导电 • D.只有在活泼金属元素和活泼非金属元素
化合时,才能形成离子键
• 【解析】 正确理解离子键和离子化合物的 内涵和外延才能解答本题。
• A项,离子键是指阴、阳离子间的静电作用, 包括引力和斥力二者的平衡;B项,离子键 形成的只能是离子化合物;C项,离子化合 物在熔融状态或水溶液里才能导电,D项NH 与活泼非金属元素之间也可形成离子键。
人教版高中化学必修二第一章第三节《化学键》课件(共20张PPT)

吸引、排斥 离
达到平衡
子 键
✓成键本质: 静电作用(吸引与排斥) 注意:
1、某些金属与非金属元素不以离子键互相结合。如 AlCl3
2、非金属元素之间也可能形成离子键。如NH4+与Cl-
二、离子化合物 ——由离子键构成的化合物叫做离子化合物。
常见的离子化合物:
(1)活泼金属氧化物,如Na2O、K2O等; (2)强碱: 如NaOH、KOH、Ba(OH)2等; (3)大多数盐:如NaHCO3、Na2CO3、BaSO4等; (4)铵盐: 如NH4Cl等。
× [:Na:]+
2-
O
Na+
× [:S:]-2
2-
S
2、写出下列原子或离子的电子式
3-
N3— ___N_____
Ca2+ ___C__a_2_+_____
Br —___B__r____
C _____C____
(3)用电子式表示离子化合物的形成过程
用电子式表示NaCl的形成过程:
Na ·+
·
C····l :→
小试牛刀
1、判断下列说法正确的是( B )
A.离子键就是使阴、阳离子结合成化合物的静电引力 B.活泼金属与活泼非金属化合时,能形成离子键 C.由非金属元素形成的化合物一定不是离子化合物 D .所有金属与所有非金属原子之间都能形成离子键
2、下列物质中含有离子键的是(A、B、D、E) A、NaOH B、CaCl2 C、AlCl3 D、NH4Cl E Na2O F、H2SO4
用电子式表示K2O的形成过程:
K ·+ ··O··+ ·K → K + [:O:]2- K + ··
::
人教版高中化学必修二1.3《化学键(第一课时)》课件最新课件

2.箭号右方写离子化合物的电子式。写时要注意二标: 标正负电荷、阴离子标[]。
3.箭号左方相同的微粒可以合并写,箭号右方相同的 微粒不可以合并写。
4.在标正负电荷时,特别要注意正负电荷总数相等。
5.不能把 “→” 写成 “ = ”
6.用箭头表明电子转移方向
一、离子键
小结
使阴阳离子结合成化合物的静电作用,叫做 离子键。 含有离子键的化合物一定是离子化合物 区分: 用电子式表示微粒或物质
一、离子键
[ 练习] 写出下列微粒的电子式:
硫原子、硫离子、溴原子、溴离子
·S····· [:S····:]2-
··
·· B·r··
[:B··r:]··
用电子式可以直观地
看到原子结构特点与键之间的关系。 也可以表示出原子或离子之间是怎样结合的
一、离子键
电子式书写注意:
(1)原子的电子式:常把其最外层电子数用 小黑点“.”或小叉“×”来表示。
元素(VIA,VIIA)之间的化合物。 2、 活泼的金属元素和酸根离子形成的盐
酸根离子:SO42-、NO3-、Cl-等
3、铵盐子和酸根离子(或活泼非金属元素) 形成的盐。
把NH4+看作是活泼的金属阳离子
5、离子化合物:含有离子键的化合物。
H
元素周期表
Li Be
NOF
Na Mg
P S Cl
K Ca ……
Mg2+[:O··:]2··
(2)用电子式表示硫化钾的形成过程
·· 2K·+ ·S··· →
K+ [:S····:]2- K+
注 箭头左方相同的原子可以合并, 意 箭头右方相同的微粒不可以合并。
一、离子键
3.箭号左方相同的微粒可以合并写,箭号右方相同的 微粒不可以合并写。
4.在标正负电荷时,特别要注意正负电荷总数相等。
5.不能把 “→” 写成 “ = ”
6.用箭头表明电子转移方向
一、离子键
小结
使阴阳离子结合成化合物的静电作用,叫做 离子键。 含有离子键的化合物一定是离子化合物 区分: 用电子式表示微粒或物质
一、离子键
[ 练习] 写出下列微粒的电子式:
硫原子、硫离子、溴原子、溴离子
·S····· [:S····:]2-
··
·· B·r··
[:B··r:]··
用电子式可以直观地
看到原子结构特点与键之间的关系。 也可以表示出原子或离子之间是怎样结合的
一、离子键
电子式书写注意:
(1)原子的电子式:常把其最外层电子数用 小黑点“.”或小叉“×”来表示。
元素(VIA,VIIA)之间的化合物。 2、 活泼的金属元素和酸根离子形成的盐
酸根离子:SO42-、NO3-、Cl-等
3、铵盐子和酸根离子(或活泼非金属元素) 形成的盐。
把NH4+看作是活泼的金属阳离子
5、离子化合物:含有离子键的化合物。
H
元素周期表
Li Be
NOF
Na Mg
P S Cl
K Ca ……
Mg2+[:O··:]2··
(2)用电子式表示硫化钾的形成过程
·· 2K·+ ·S··· →
K+ [:S····:]2- K+
注 箭头左方相同的原子可以合并, 意 箭头右方相同的微粒不可以合并。
一、离子键
高中化学必修二课件-1.3化学键11-人教版

离子化合物 含有离子键
共价化合物(单质) 只含有共价键
布置作业
1.课后认真体会本节内容。 2.完成课时训练40分钟。
谢谢
那么非金属元素之间是靠什么作用力结 合在一起的呢?
氢气在氯气中燃烧
点燃
H2+Cl2===2HCl
H2 气体分子
Cl2气体分子
分开后,她们为什么不高兴?让我们听听她们 说些什么?
我只有一个电 子,太少了
我也少一 个电子
e
+1 1
H 原子
7 8 2 +17
Cl 原子
二位好!我有一个好办法.你们每人 拿出一个电子共用,就象共同分享快 乐一样共同拥有.行吗?
第三节 化学键
知识回顾
1、什么是离子键 ? 2、离子键的作用力是什么? 3、形成离子键的微粒是什么? 4、什么元素化合容易形成离子键 ? 5、什么是离子化合物?
思考与讨论
活泼的金属元素和活泼非金属元素化合 时形成离子键。请思考,非金属元素之间化 合时,能形成离子键吗?为什么?
不能,因非金属元素的原子均有获得电子 的倾向,难以形成阴阳离子。
2.作用力: 共用电子对 3.成键粒子: 原子 4.成键元素: 同种或不同种非金属元素之间
;部分金属元素原子与非金属 元素原子之间,如AlCl3
例如:H2 N2 H2O HF 等均以共价键形成分子
5、共价键的表示方法:电子式 ★氢分子的形成:
H ·+ ·H → H H H﹣H(结构式)
··
★氯化氢分子的形成
1、判断下列物质是离子化合物还是共价化合物 :HCl 、CO2 、 N2 、KCl、NaOH
2、下列说法中正确的是( AD)
A.含有离子键的化合物必是离子化合物 B.具有共价键的化合物就是共价化合物 C.共价化合物可能含离子键 D.离子化合物中可能含有共价键 E.有金属和非金属元素组成的化合物一定是离子 化合物
高中化学必修二课件-1.3化学键20-人教版

1)活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)形成的化 合物,如NaCl、Na2O、Na2O2等。
2)活泼的金属元素和酸根离子形成的盐。如Na2CO3、MgSO4
3) 铵盐。如NH4Cl 4)强碱。如NaOH
试一试:
下列物质中含有离子键的是( 你能说出它们存在哪些离子吗?
方程式:
<实验1-2评价>
<改进实验>
1、钠预先在空气中加热, 会生成氧化物,可能影响钠 在氯气中的燃烧。
思考:
1、组装完仪器,添加药品 前进行什么操作?
2、预先收集的氯气在课堂 演示时可能不够
2、点燃酒精灯时机选择? 3、改进优点?
3、实验中会产生少量污染
1、避免副反应发生 2、安全可靠、污染少
题组2 电子式的书写正误判断 3.下列离子化合物的电子式书写正确的是( )
【答案】 D
4.写出下列微粒的电子式
(1)O 和 O2- (2)K 和 K+ (3)KCl
(4)用电子式表示 K2S 的形成过程
··
··
··
(4)2K·+ ·S·→K+[ S ]2- K+
··
··
·· ··
··
谢谢
D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键
2.下列叙述中不正确的是( )
【答案】 B
A.活泼金属元素与活泼非金属元素化合时,能形成离子键
B.阴、阳离子通过静电引力所形成的化学键叫做离子键
C.离子所带电荷的符号和数目与原子成键时得失电子有关
D.阴、阳离子间通过离子键形成的化合物一定是离子化合物
第三节 化学键
第三节 化学键 第一课时 离子键
2)活泼的金属元素和酸根离子形成的盐。如Na2CO3、MgSO4
3) 铵盐。如NH4Cl 4)强碱。如NaOH
试一试:
下列物质中含有离子键的是( 你能说出它们存在哪些离子吗?
方程式:
<实验1-2评价>
<改进实验>
1、钠预先在空气中加热, 会生成氧化物,可能影响钠 在氯气中的燃烧。
思考:
1、组装完仪器,添加药品 前进行什么操作?
2、预先收集的氯气在课堂 演示时可能不够
2、点燃酒精灯时机选择? 3、改进优点?
3、实验中会产生少量污染
1、避免副反应发生 2、安全可靠、污染少
题组2 电子式的书写正误判断 3.下列离子化合物的电子式书写正确的是( )
【答案】 D
4.写出下列微粒的电子式
(1)O 和 O2- (2)K 和 K+ (3)KCl
(4)用电子式表示 K2S 的形成过程
··
··
··
(4)2K·+ ·S·→K+[ S ]2- K+
··
··
·· ··
··
谢谢
D.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键
2.下列叙述中不正确的是( )
【答案】 B
A.活泼金属元素与活泼非金属元素化合时,能形成离子键
B.阴、阳离子通过静电引力所形成的化学键叫做离子键
C.离子所带电荷的符号和数目与原子成键时得失电子有关
D.阴、阳离子间通过离子键形成的化合物一定是离子化合物
第三节 化学键
第三节 化学键 第一课时 离子键
高中化学人教版必修二《1.3.1化学键——离子键》课件

电子式书写规律: ··
原子的电子式:
·O· ····
··
Na · ·Mg · Cl ·
··
离子的电子式:
原子的电子式:在元素符 号周围用小点“.”或小叉 “×”来表示其最外层电子 数。
H+ Na+ 阳离子的电子式:简单阳离子的电
子式就是它的离子符号,复杂阳离
Mg2+ Ca2+ 子(NH4+)例外。
Na Cl
Na Cl
➢用电子式表示溴化钙的形成过程
:B····r ·+·Ca·+:B····r ·→ [:B····r:]-Ca2+[:B····r:]-
[ 练习]
⑴ 用电子式表示氧化镁的形成过程
·Mg ·+
·O·····→
Mg2+[:O··:]2··
⑵ 用电子式表示硫化钾的形成过程
·· 2K·+ ··S·· →
思考
主族中有哪些常见的活泼金属元素和非金属元 素,它们可以相互作用结合成哪些化合物?
例如:KCl MgCl2 CaCl2 MgO Na2S NaF
H 元素周期表
Li Be
Na Mg
K Ca ……
Rb Sr Cs Ba Fr Ra
NOF P S Cl As Se Br Sb Te I Bi Po At
如:NaOH、KOH、MgO、Na2O2、
K2SO4、Na2CO3、Mg(NO3)2
ห้องสมุดไป่ตู้
NH4Cl
[NH4]2SO4 [NH4]2S等
练习1
下列是离子化合物的是( 2、3、5、7、8 )
1、H2O 33、、NNaaOOHH
55、、NNaa22OO 77、、MMggCCll22
高中化学《化学键》课件必修2.ppt

思考 哪些物质能形成离子键?
1 ·活泼的金属元素(IA,IIA)和活泼的非 金属元素(VIA,VIIA)之间的化合物。
2·活泼的金属元素和酸根离子、氢氧根离 子形成的化合物
3·铵根离子和酸根离子形成的盐。
含有离子键的化合物就是离子化合物。
常见离子化合物包括:
①大多数盐;如 NaCl、KNO3、铵盐等; 注:AlCl3不是离子化合物,不存在离子键。
(2)Na3N与盐酸反应生成__________种盐, 其电子式是__________。
(3)Na3N与水的反应属于__________反应。 (4)比较Na3N中两种微粒的半径:
r(Na+)__________r(N3-)(填
“>”“=”“<”符号)。
(2)阴阳离子的电子与电子、
原子核与原子核间的相互排斥作用
2.阴阳离子结合在一起,彼此电荷是否会中和 呢?
不可能!因阴阳离子接近到某一定距离 时,吸引和排斥作用达到平衡,阴阳离子间 形成稳定的化学键。
一·离子键
1、定义: 使阴阳离子结合成化合物的静 电作用,叫做离子键。
成键微粒:阴阳离子
键的实质:静电作用(静电引力和斥力) 成键过程: 阴阳离子接近到某一定距离时,吸引和排斥 达到平衡,就形成了离子键。
即其中没有Al3+,Cl-
②强碱;如 NaOH、KOH、Ba(OH)2等; ③大多数碱性氧化物;如 Na2O、CaO、MgO等
2、电子式
①概念:在元素符号周围用“ · ” 或“×”来表示原子最外层电子的式 子,叫电子式
②表示方法:
原子的电子式:
H·
Na ·
·Mg
·
·Ca
·
·· ·O···
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
刘建东
书山有路勤为径●▂●学海无涯苦
1
作舟
H H
H H
H H
H HHH NhomakorabeaH H
H H
H
H H
H
H
H
H
H
H H 书山有路勤为径●▂●学海无涯苦
作舟
H
2
思考:这些H之间是否存在着什么作用呢?
静电吸引
原子核与电子
相互作用
静电作用
原子之间
静电排斥
书山有路勤为径●▂●学海无涯苦 作舟
原子核之间、电子之间 3
1、原子间强烈的相互作用; 2、原子形成稳定的结构;
3、体系的能量降低。
成键的微粒:阴、阳离子。
成键的本质:静电作用。
当两种离子接近到某一定距离时,吸引和排斥 作用达到了平衡书,山有于路勤为是径●形▂●成学海了无涯苦稳定的化学键。7
作舟
离子化合物: 由离子键构成的化合物。
用电子式表示离子化合 物的形成过程:
NaCl、CaBr2
书山有路勤为径●▂●学海无涯苦
8
作舟
相邻的两个或多个原子之间强烈的 相互作用叫做化学键。
化 学
离子键 阴阳离子之间通过静电 作用所形成的化学键。
键 的
共价键
类
型
金属键
书山有路勤为径●▂●学海无涯苦
4
作舟
— +
书山有路勤为径●▂●学海无涯苦
5
作舟
_ _ __ _ _
++++++ _
书山有路勤为径●▂●学海无涯苦
6
作舟
成键的主要原因:
书山有路勤为径●▂●学海无涯苦
1
作舟
H H
H H
H H
H HHH NhomakorabeaH H
H H
H
H H
H
H
H
H
H
H H 书山有路勤为径●▂●学海无涯苦
作舟
H
2
思考:这些H之间是否存在着什么作用呢?
静电吸引
原子核与电子
相互作用
静电作用
原子之间
静电排斥
书山有路勤为径●▂●学海无涯苦 作舟
原子核之间、电子之间 3
1、原子间强烈的相互作用; 2、原子形成稳定的结构;
3、体系的能量降低。
成键的微粒:阴、阳离子。
成键的本质:静电作用。
当两种离子接近到某一定距离时,吸引和排斥 作用达到了平衡书,山有于路勤为是径●形▂●成学海了无涯苦稳定的化学键。7
作舟
离子化合物: 由离子键构成的化合物。
用电子式表示离子化合 物的形成过程:
NaCl、CaBr2
书山有路勤为径●▂●学海无涯苦
8
作舟
相邻的两个或多个原子之间强烈的 相互作用叫做化学键。
化 学
离子键 阴阳离子之间通过静电 作用所形成的化学键。
键 的
共价键
类
型
金属键
书山有路勤为径●▂●学海无涯苦
4
作舟
— +
书山有路勤为径●▂●学海无涯苦
5
作舟
_ _ __ _ _
++++++ _
书山有路勤为径●▂●学海无涯苦
6
作舟
成键的主要原因:
