《3.2 物质组成的表示之化学式的有关计算》2010年同步练习
表示物质组成的化学式教案及练习题

新课程有效教学案例之一教学案例学校名称:赤峰市翁旗乌丹五中课程名称:化学内容主题:4.4表示物质组成的化学式教材版本:科学粤教版教师姓名:456教龄:26年附件一:《表示物质组成的化学式》问题导读——评价单姓名:班级:学号:设计者:组织学生带如下预习问题自读:1、什么是相对分子质量?2、如何求相对分子质量?3、如何计算组成化合物各元素的质量比?4、如何计算化合物中某一元素的质量分数?附件二:《表示物质组成的化学式》问题训练——评价单姓名: 班级: 学号: 设计者:一、填空类型1、 多少克尿素中所含氮元素的质量与132g 硫酸铵所含氮元素的质量相等? 某碳酸氢铵样品经测定含氮16%(杂质不含氮元素),求样品的纯度?2、 要想使四氧化三铁与三氧化二铁中所含铁元素的质量相等,则所需两种物质的质量之比为:3、小明同学为补充维生素,服用“管用”牌多维元素片,该药品的标签如图所示。
请你计算: (1)小明同学按标签所示方法服用该药片,则每天服用维生素C 为 mg ;(2)维生素B 2的相对分子质量为 (3)维生素E 中氢、氧两种元素的质量比为 4、钙离子是维持神经、肌肉和骨骼正常功能所必须的物质,它能促进骨骼与牙齿的钙化。
维生素D 2磷酸氢钙片(其有效成分是CaHPO 4)就是一种补钙用品。
请仔细阅读右边的说明书,回答下列问题:(1)磷酸氢钙中钙元素的质量分数为计算式为 (2)儿童服用这种钙片一天,最少补钙 mg 。
5、锌是人体生长发育、维持器官正常功能不可缺少的微量元素,人体缺锌会引起多种疾病,缺锌者可在医生的指导下通过服用葡萄糖酸锌等含锌保健品来补锌。
已知葡萄糖酸锌的化学式为C12H22O14Zn相对分子质量为455,试回答:(1)葡萄糖酸锌是由元素组成的。
(2)葡萄糖酸锌中所含锌元素的质量分数为。
(3)现有一支20mL某品牌的葡萄糖酸锌口服液,其中含锌元素6.5mg,则该口服液中含葡萄糖酸锌的质量为mg(计算结果精确到0.1mg)6.鲨鱼是世界上唯一一种不患癌症的动物,研究发现其体内含有角鲨烯(化学式为C30H50)有抗癌作用。
3.3物质组成的表示和分析+依据化学式的计算2025学年九年级化学沪教版(全国)(2024)上册

H为1,O为16
___C_为__1_2_,__O__为__1_6___________________
2.明确H2O中原子的个数比: 氢原子数:氧原子数=2: 1
2.__明__确__C_O_2_中__原__子__的__个__数__比__:_________ ___碳__原__子__数__:__氧__原__子__数__=__1_:_2________
根据化肥的种类,分析营养元素, 计算化肥中营养元素的质量。
观察思考
化合物的化学式不仅可以表示组成物质的各种元素,而且清楚地显示出所含
元素的原子数之比。请回答以下问题:
1个CO2分子中碳、氧原子的个数比? 1:2 2个CO2分子中碳、氧原子的个数比? 1:2 大量的CO2分子中碳、氧原子的个数比? 1:2
.
4、阳信鸭梨,素有“天生甘露”之称,富含糖、维生素C、钙、磷、铁等营养 成分。其中维生素C(C6H8O6)具有抗氧化性,强健骨骼和牙齿,增强免疫力,
预防感冒等疾病及等作用。下列关于维生素C的说法中错误的是( C )
A. 维生素C的相对分子质量是176 B. 维生素C中氢元素的质量分数为4.5% C. 维生素C中C、H、O三种元素的质量比为3:4:3 D. 一个维生素C分子由6个碳原子、8个氢原子和6个氧原子构成
3、某种含硫酸亚铁(FeSO4)的药物可于治疗缺铁性贫血,某贫血 患者每天要补充1.4g铁元素,服用的药物中含硫酸亚铁的质量是
(D)
A.3.18g B.6.95g C.10g D.3.8g
FeSO4中铁元素的质量分数为 = —56—+3—25+—616—×—4 ×100%=36.8% 某元素的质量=物质的质量×该元素的质量分数 病人需要服用的药物中应含硫酸亚铁的质量= —316—.4.8g—% ≈3.8 g
化学九年级上册考点归纳汇总3.3物质的组成-物质组成的有关计算方法-沪教版

一、考点突破此部分内容在中考化学中的要求如下:二、重难点提示重点:利用相对原子质量、相对分子质量进行物质组成的简单计算。
难点:根据某些商品标签上的内容进行简单的计算。
考点精讲:考点一:计算物质的化学式量和相对分子质量定义:化学式中各原子的相对原子质量之和。
对于由分子构成的物质,化学式量又叫做相对分子质量。
说明:化学式量和相对分子质量也是一个比值,不能用“g”或“kg”作单位。
【难点剖析】计算化学式量时相同元素原子之间用乘法,不同元素原子之间用加法。
思考:某叶绿素的化学式为:C55H70MgN4O6,其化学式量(或相对分子质量)为___________。
答案:相对分子质量为12×55+1×70+24+14×4+16×6=894易错点:加法和乘法要分清楚。
【重要提示】化学式中原子团右下角的数字表示其个数,计算时可先求出一个原子团的式量,再乘以其个数。
例如:Ca(OH)2化学式量为40+(16+1)×2=74考点二:化合物中各元素质量比=各元素的相对原子质量×原子个数之比【要点诠释】化学式中元素符号右下角数字之比=原子个数之比例题2CO中C和O元素的质量比=12:(16×2)=3:8。
易错点:化合物中各元素质量比不是化学式中元素符号右下角数字之比。
【重要提示】可以通过化合物中各元素质量比求化学式例题已知某铁的氧化物中Fe、O元素的质量比为7:3,求化学式。
思路分析:设铁的氧化物中Fe、O的原子个数为x、y,则由Fe、O元素的质量比为7:3,得:56x:16y=7:3解之得:x:y=2:3则铁的氧化物的化学式为:Fe2O3。
考点三:化合物中元素的质量分数=⨯⨯相对原子质量原子个数相对分子质量100%例题(泰州)豆浆被称为“植物奶”,其中含有的异黄酮(C15H10O2)具有防癌功能,下列说法正确的是()A. 异黄酮中共含有27个原子B. 异黄酮中碳元素质量分数最大C. 异黄酮中C、H、O三种元素的质量比为15:10:2D. 豆浆中富含的营养成分主要是糖类思路分析:A. 异黄酮由异黄铜分子构成的,一个异黄酮分子中含有27个原子,故选项说法错误。
初中化学中考总复习:物质组成的表示——化学式与化合价(基础) 知识讲解含答案

中考总复习:物质组成的表示——化学式与化合价(基础)【考纲要求】1.掌握化学式的书写方法和读法;掌握化学式所表达的意义。
2.了解化合价的含义,能运用化合价规律书写化学式或计算化学式中某元素的化合价。
3.能应用化学式进行相关计算,从量的角度理解物质组成。
【知识网络】【考点梳理】考点一、化学式1.化学式的定义:用元素符号和数字的组合表示物质组成的式子,叫做化学式。
2.化学式的意义:化学式的意义以CO2为例说明宏观上表示一种物质表示二氧化碳这种物质表示该物质由哪些元素组成表示组成元素的质量比表示二氧化碳由碳元素和氧元素组成m (C)∶m (O)=3∶8微观上表示该物质的一个分子表示一个二氧化碳分子表示该物质的构成表示一个二氧化碳分子由一个碳原子和两个氧原子构成表示该物质的一个分子中原子个数比n (C)∶n (O)=1∶23.化学式的读写方法:物质类型化学式的写法化学式的读法单质金属元素名称:Fe——铁稀有气体“某气”:He——氦气非金属固态元素名称:S——硫气态在元素符号的右下角写一小数字表示。
如:氧气——O2、氮气——N2、臭氧——O3“某气”:O2——氧气化合物氧化物氧元素符号在后,另一元素符号在前。
如:CO2、CuO等从后向前读作“氧化某”,如:CuO——氧化铜;有时需读出原子个数,如:Fe3O4——四氧化三铁由金属元素和非金属元素组成的化合物非金属元素符号在后,金属元素符号在前。
如:ZnS、KCl等从后向前读作“某化某”,如:ZnS——硫化锌;有时需读出原子个数,如:FeCl3——三氯化铁【要点诠释】铁——Fe用元素符号表示氦气——He硫——S1.当表述物质组成和构成时要“宏观对宏观”“微观对微观”“个数对个数”。
如CO 2由碳元素和氧元素组成,1个CO 2分子由1个碳原子和2个氧原子构成。
也可简单记忆为“见分子用原子,不见分子用元素”。
2.化学式书写规则:书写步骤可概括为:正左、负右、标价、化简、交叉、检查。
北京版化学-九年级上册第5章第2节物质组成的表示——化学式同步测试

《物质组成的表示——化学式》同步练习1 1.牛磺酸(C2H7NO3S)是一种特殊的氨基酸,能增强人体的免疫力。
下列关于牛磺酸的说法中正确的是A.牛磺酸属于有机高分子化合物B.牛磺酸中氧元素与硫元素的质量比为3∶2C.牛磺酸的相对分子质量为125 gD.5%的牛磺酸溶液中氧元素的质量分数为38.4%2.下列符号中,能表示2个氢分子的是A.H2B.2H C.2H+D.2H23.下列化学用语表示正确的是A.铜离子—Cu+2B.两个氢分子—2HC.纯碱—Na2CO3D.氧化铁—FeO4.单宁酸又称鞣酸,是一种多酚化合物,存在于柿子、茶叶、咖啡、石榴等植物组织中,单宁酸的化学式为C76H52O46。
下列说法错误..的是A.单宁酸为有机化合物B.单宁酸是由76个碳原子、52个氢原子和46个氧原子构成的C.单宁酸中碳、氧元素的质量比为57:46D.单宁酸中氢元素的质量分数最小5.如图是反映某个化学反应里各物质质量与时间的变化关系,下列对此变化的描述中,正确的是()A.充分反应后,乙+丙=甲的质量B.物质甲的相对分子质量大于乙C.此化学反应中,不遵守质量守恒定律D.此化学反应是分解反应6.现有H、C、S、Ca、O、Na六种常见的元素,请选用其中的元素写出符合下列要求的物质各一种(用化学式表示):①厨房里常用的酸性调味品____________;②大理石的主要成分____________;③除锈的酸____________;④用来改良酸性土壤的碱____________;⑤炉具清洁剂中的碱____________;⑥用于炼钢的气体是____________。
7.已知甲醛的结构式为,则其化学式为,其相对分子质量为,其含氧元素的质量分数等于(结果精确到0.1%)。
8.判断下列化学符号中数值“2”所代表的意义,并将其序号填在相应的横线上:a.Mg2+b.H2O c.2CO d. e.2H+(1)表示分子个数的是;(2)表示离子的个数的是;(3)表示离子所带电荷数的是;(4)表示元素化合价的是;(5)表示一个分子中某原子个数的是.9.已知青蒿素的化学式为C15H22O5,则C15H22O5 中含有种元素,C15H22O5的相对分子质量,C15H22O5中碳、氢、氧三种元素的质量比是,C15H22O5中碳元素的质量分数为。
(新版)沪教版九年级化学全册_3.1.2_物质组成的表示方法同步测试(含解析)

《3.1.2 物质组成的表示方法》一、选择题:1.下列关于相对分子质量的分析中,不正确的是()A.一种纯净物的相对分子质量是确定的值B.由分子构成的物质的相对分子质量与分子质量成正比C.相对分子质量和相对原子质量一样也是一种比值,单位为1D.不同物质的相对分子质量不可能相同2.由化学式难以确定的是()A.物质的相对分子质量 B.物质的质量C.物质的组成 D.物质中各元素的质量比3.在MgSO4中,镁元素、硫元素、氧元素的质量比是()A.1:1:4 B.2:1:3 C.3:4:8 D.3:1:44.要使三氧化二铁和四氧化三铁含有相同质量的铁元素,则三氧化二铁和四氧化三铁的质量比是()A.3:2 B.1:1 C.30:29 D.29:305.下面根据化学式的计算,正确的是()A.H2O的相对分子质量=1×2×16=32B.2HCl的相对分子质量总和=2×1+35.5=37.5C.H2SO4中氢、硫、氧三种元素的质量比是2:16:32D.22gCO2中含氧元素为16g6.某正二价元素M的氧化物中,M元素与氧元素的质量比为7:2,则该元素的相对原子质量为()A.24 B.27 C.56 D.647.某碳、氢元素组成的化合物中,碳、氢元素的质量比为3:1,这种化合物是()A.C2H2B.CH4C.C2H4D.C2H68.某药物的主要成分为C9H8O4(其它成分不含碳元素),已知该药物的含碳量为48%,则该药物中C9H8O4的质量分数为()A.40% B.60% C.80% D.90%9.现有①CH4②C2H2③C2H4④C2H5OH四种含碳化合物中碳元素的质量分数由高到低的排列顺序是()A.①>②>③>④ B.③>②>①>④ C.②>③>①>④ D.④>②>③>①10.维生素C(C6H8O6)主要存在于蔬菜和水果中,它能促进人体生长发育,增强人体对疾病的抵抗力,近年来科学家还发现维生素C有防癌作用.下列关于维生素C的说法中错误的是()A.一个维生素C分子中含有6个碳原子,8个氢原子和6个氧原子B.维生素C是一种氧化物C.维生素C中C、H、O 三种元素的质量比为9:1:12D.青少年多吃蔬菜水果,切忌偏食二、填空题:11.2003年我国部分地区突发的“非典型肺炎”威胁着人们的身体健康.过氧乙酸可以起到消毒作用,其化学式为CH3COOOH,则过氧乙酸的相对分子质量为;C、H、O三种元素的质量比为;氧元素的质量分数为.12.蛋白质是机体生长及修补受损组织的主要原料,人体通过食物获得的蛋白质在胃肠中与水反应生成氨基酸,蛋氨酸(化学式为C5H11O2NS)就是其中的一种.请回答下列问题:(1)蛋氨酸中各元素的质量比C:H:O:N:S= .(2)蛋氨酸中氮元素的质量分数为.(3)合格奶粉每100g中含蛋白质约18g,蛋白质中氮元素的平均质量分数为16%,则每100g合格奶粉中氮元素的质量为g;现测定某奶粉每100g中含有氮元素的质量为0.5g.则这种奶粉属于(填“合格”或“不合格”)奶粉.13.相等质量的H2、SO2、O2、N2、CO2,按所含分子数由少到多排列,其顺序为,具有相同分子数的上述物质,其质量由小到大的顺序为.14.由(NH4)2S、(NH4)2SO4、(NH4)2HPO4组成的混合物中,已知氮元素的质量分数为28%,则混合物中氧元素的质量分数为.三、计算题:15.小明同学打算给自家菜园的蔬菜施用氮肥,原计划用2.4kg硝酸铵(NH4NO3),现改用某尿素化肥(该化肥外包装袋上的说明如图所示),需用这种尿素kg,才能保证施用的氮元素质量与原计划相当.16.某CO与CO2的混合气体中碳元素的质量分数为36%,求混合气体中CO2的质量分数是多少?一、选择题:17.硫酸亚铁可用于治疗缺铁性贫血.某贫血患者每天需补充1.12g铁元素,则他服用的药物中含硫酸亚铁的质量至少为()A.3.80g B.6.95g C.10g D.3.04g18.现有①FeO;②Fe2O3;③Fe3O4;④FeS四种含铁化合物,其中含铁元素的质量分数由大到小的排列顺序是()A.③>②>①>④ B.①>③>②>④ C.④>③>②>① D.①>②>③>④19.由硫酸亚铁和硫酸铁组成的混合物,经测定其中含硫元素的质量分数为a%,则混合物中铁元素的质量分数为()A.1﹣a% B.1﹣2a% C.1﹣3a% D.无法计算20.已知在Fe3O4中铁、氧元素的质量之比为21:8.现有由FeO、Fe2O3、Fe3O4组成的某混合物,经实验测定其铁、氧元素的质量之比为21:8,则此混合物中FeO、Fe2O3、Fe3O4三者的质量之比可能为()A.9:20:3 B.1:2:3 C.20:9:5 D.6:5:321.在H2SO4和H3PO4各10个分子中一样多的是()A.氧分子个数 B.氧元素个数 C.氧原子个数 D.氢原子个数22.X和Y两种元素化合可生成A和B两种化合物.A中X元素分数为75%,B中X元素的质量分数为80%,已知A的化学式为XY4,则B的化学式为()A.XY3B.X2Y3C.X3Y2D.XY223.血红蛋白的式量为68000,含铁元素的质量分数为0.33%,则平均每个血红蛋白分子中铁原子的个数是()A.1 B.2 C.3 D.424.氧化镁与另一种金属氧化物组成的混合物4g,含氧元素1.8g,另一种金属氧化物是()A.CuO B.Fe2O3C.Al2O3D.CaO二、填空题:25.在化合物A2B3中,A与B两种元素的质量比为7:3,则A与B的相对原子质量之比为.26.相同质量的氢气和氧气中所含分子个数比为;相同分子个数的氢气和氧气,其质量比为.27.维生素C主要存在于水果中,它能促进人体生长发育,增强人体对疾病的抵抗力,近年来科学家发现维生素C有防癌作用,已知维生素C的化学式为C6H8O6,可知它由种元素组成,它的一个分子中共有个原子,维生素C的相对分子质量为,其碳、氧两种元素的质量比为.28.3.6克水中含氧元素克;克硝酸铵(NH4NO3)中含氮元素14克.29.将只含有碳、氢两种元素的气体燃料放入足量的氧气中燃烧,并使生成的气体全部通入如图所示的装置中(假定气体全部被吸收),实验中测得有关数据如下:实验前实验后干燥剂+U形管101.3g 103.1g石灰水+广口瓶313.0g 315.2g根据实验数据填写下列各空白处:(1)实验结束后生成物中水的质量为,二氧化碳的质量为.(2)生成的水中氢元素的质量为,二氧化碳中碳元素的质量为.(3)该燃料中碳元素与氢元素的质量比为,该燃料的化学式为.三、计算题:30.医药上用的阿斯匹林的组成里含4.5%的氢、35.5%的氧、60%的碳,相对分子质量为180,则阿斯匹林的化学式是什么?(通过计算回答)沪教版九年级全册《3.1.2 物质组成的表示方法》同步练习卷参考答案与试题解析一、选择题:1.下列关于相对分子质量的分析中,不正确的是()A.一种纯净物的相对分子质量是确定的值B.由分子构成的物质的相对分子质量与分子质量成正比C.相对分子质量和相对原子质量一样也是一种比值,单位为1D.不同物质的相对分子质量不可能相同【考点】相对分子质量的概念及其计算;相对原子质量的概念及其计算方法.【专题】化学计算.【分析】根据相对分子质量的概念分别分析即可判断正误.要注意:相对分子质量是相对值,所以为无量纲量,单位为1.【解答】解:根据相对分子质量的概念可知相对分子质量是化学式中各原子的相对原子质量的总和,也可看成物质分子的平均质量与碳﹣12原子质量的的比值,所以A、一种纯净物的相对分子质量是确定的值,正确;B、由分子构成的物质的相对分子质量与分子质量成正比,正确;C、相对分子质量和相对原子质量一样也是一种比值,单位为1,正确;D、不同物质的相对分子质量也可能相同,如硫单质的相对分子质量是32,氧气的相对分子质量也是32(N2和CO的分子量都是28),故选项错误.故选D.【点评】主要考查了相对分子质量的概念.化学式中各原子的相对原子质量的总和,就是相对分子质量.相对分子质量也可看成物质分子的平均质量与碳﹣12原子质量的的比值.注意:由于是相对分子质量是相对值,所以为无量纲量,单位为1.2.由化学式难以确定的是()A.物质的相对分子质量 B.物质的质量C.物质的组成 D.物质中各元素的质量比【考点】化学式的书写及意义;有关化学式的计算和推断.【专题】化学式的计算;物质的微观构成与物质的宏观组成;化学用语和质量守恒定律.【分析】根据物质的化学式可以判断物质的元素组成、元素质量比,可以求出物质的相对分子质量.【解答】解:A、根据物质的化学式可以确定物质的相对分子质量,例如水的化学式为H2O,可以求出水的相对分子质量为:1×2+16=18.故选项错误;B、由化学式难以确定物质的质量,因为从化学式中不能判断物质的量.故选项正确;C、根据物质的化学式可以确定物质的组成,例如水的化学式为H2O,水是由氢元素和氧元素组成的.故选项错误;D、根据物质的化学式可以确定物质中各元素的质量比,例如水的化学式为H2O,氢元素和氧元素的质量比为:1:8.故选项错误.故选B.【点评】解答本题要充分理解化学式的含义,根据化学式的含义对各项内容进行分析、判断,从而得出正确的结论.3.在MgSO4中,镁元素、硫元素、氧元素的质量比是()A.1:1:4 B.2:1:3 C.3:4:8 D.3:1:4【考点】元素质量比的计算.【专题】化学式的计算.【分析】根据MgSO4的化学式可知,其中镁元素、硫元素、氧元素的质量比=(镁的相对原子质量×镁原子个数):(硫的相对原子质量×硫原子个数):(氧的相对原子质量×氧原子个数).【解答】解:根据MgSO4的化学式可知,其中镁元素、硫元素、氧元素的质量比=24:32:(16×4)=24:32:64=3:4:8.故选C.【点评】本题主要考查学生运用化学式和元素的相对原子质量进行计算的能力.4.要使三氧化二铁和四氧化三铁含有相同质量的铁元素,则三氧化二铁和四氧化三铁的质量比是()A.3:2 B.1:1 C.30:29 D.29:30【考点】有关化学式的计算和推断;元素的质量分数计算.【专题】化学式的计算;化学计算中“1”的应用.【分析】根据两物质的化学式,分别计算化合物中铁元素的质量分数,由铁元素质量等于化合物质量与元素质量分数的乘积,计算两物质的质量比.【解答】解:三氧化二铁和四氧化三铁含有相同质量的铁元素,设三氧化二铁的质量为X,四氧化三铁的质量为Y,可得X××100%=Y××100%,解答=故选C.【点评】化合物中某组成元素的质量=化合物的质量×化合物中该元素的质量分数.5.下面根据化学式的计算,正确的是()A.H2O的相对分子质量=1×2×16=32B.2HCl的相对分子质量总和=2×1+35.5=37.5C.H2SO4中氢、硫、氧三种元素的质量比是2:16:32D.22gCO2中含氧元素为16g【考点】有关化学式的计算和推断;相对分子质量的概念及其计算;元素质量比的计算;化合物中某元素的质量计算.【专题】化学式的计算.【分析】A、相对分子质量为:该分子中所有原子的相对原子质量的总和.B、多个分子的相对分子质量为:分子个数×该分子的相对分子质量.C、组成元素的质量比:各元素的相对原子质量×分子中原子个数的比.D、某纯净物中所含元素的质量为:该纯净物的质量×纯净物中该元素的质量分数.【解答】解:A、H2O的相对分子质量应为1×2+16=18,故选项A错误;B、2HCl的相对分子质量总和应为2×(1+35.5)=73,故选项B错误;C、H2SO4中氢、硫、氧三种元素的质量比应是:(1×2):32:(16×4)=2:32:64=1:16:32,故选项C错误;D、22gCO2中含氧元素为:22g××100%=16g,故选项D正确.故选D.【点评】本题着重训练学生对化学式的理解和计算应用能力,通过此题的训练使学生明确宏观计算与微观计算的区别和联系.6.某正二价元素M的氧化物中,M元素与氧元素的质量比为7:2,则该元素的相对原子质量为()A.24 B.27 C.56 D.64【考点】相对原子质量的概念及其计算方法;化合价规律和原则;元素质量比的计算.【专题】化学计算.【分析】先根据题意写出氧化物的化学式MO,设M元素的相对原子质量为x,根据M元素与氧元素的质量比也可用相对质量表示,列出方程求解即可.【解答】解:根据题意可知该氧化物是MO,设M元素的相对原子质量为x,因为M元素与氧元素的质量比为7:2,所以x:16=7:2解得x=56故选C.【点评】主要考查了相对原子质量的概念及其应用.原子的相对质量的比值可反映原子的实际质量之比.利用方程思想可简化计算,使思路更清晰.相对原子质量是以一个碳﹣12原子质量的作为标准,任何一个原子的真实质量跟一个碳﹣12原子质量的的比值,称为该原子的相对原子质量.7.某碳、氢元素组成的化合物中,碳、氢元素的质量比为3:1,这种化合物是()A.C2H2B.CH4C.C2H4D.C2H6【考点】有关化学式的计算和推断.【专题】化学式的计算.【分析】根据化合物由C、H元素组成,可设出化学式,利用碳、氢元素的质量比为3:1来解答.【解答】解:设碳、氢元素组成的化合物的化学式为C x H y,由碳、氢元素的质量比为3:1,则12×x:1×y=3:1解得x:y=1:4,即化合物的化学式为CH4,故选:B.【点评】本题考查物质化学式的推断,可采用正向思维方式先设出物质的化学式,再利用化学式进行元素质量比的计算.8.某药物的主要成分为C9H8O4(其它成分不含碳元素),已知该药物的含碳量为48%,则该药物中C9H8O4的质量分数为()A.40% B.60% C.80% D.90%【考点】物质组成的综合计算;元素的质量分数计算;有关化学式的计算和推断.【专题】化学式的计算.【分析】先求出C9H8O4(中含碳元素的质量分数,再根据物质的纯度=×100%,进行解答.【解答】解:C9H8O4(中含碳元素的质量分数=×100%=60%;根据物质的纯度=×100%,可得药物中C9H8O4的质量分数=×100%=80%;故选C.【点评】本题考查学生对物质的纯度的计算方法的理解与掌握,并能灵活应用的能力.9.现有①CH4②C2H2③C2H4④C2H5OH四种含碳化合物中碳元素的质量分数由高到低的排列顺序是()A.①>②>③>④ B.③>②>①>④ C.②>③>①>④ D.④>②>③>①【考点】元素的质量分数计算.【专题】化学式的计算.【分析】化合物中碳元素的质量分数=×100%.【解答】解:①CH4中碳元素的质量分数为:×100%=75%;②C2H2中碳元素的质量分数为:×100%≈92.3%;③C2H4中碳元素的质量分数为:×100%≈85.7%;④C2H5OH中碳元素的质量分数为:×100%≈52.2%;∵92.3%>85.7%>75%>52.2%,∴四种含碳化合物中碳元素的质量分数由高到低的排列顺序是:②>③>①>④.故选C.【点评】本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.10.维生素C(C6H8O6)主要存在于蔬菜和水果中,它能促进人体生长发育,增强人体对疾病的抵抗力,近年来科学家还发现维生素C有防癌作用.下列关于维生素C的说法中错误的是()A.一个维生素C分子中含有6个碳原子,8个氢原子和6个氧原子B.维生素C是一种氧化物C.维生素C中C、H、O 三种元素的质量比为9:1:12D.青少年多吃蔬菜水果,切忌偏食【考点】化学式的书写及意义;从组成上识别氧化物;元素质量比的计算.【专题】化学用语和质量守恒定律.【分析】A.根据分子的原子构成考虑;B.根据氧化物的判断方法考虑;C.根据元素质量的计算考虑;D.根据题意,维生素C(C6H8O6)主要存在于蔬菜和水果中,它能促进人体生长发育,增强人体对疾病的抵抗力,进行分析判断.【解答】解:A.右下角数字表示一个分子中的原子个数,故说法正确;B.氧化物是只含有两种元素且其中一种元素是氧元素的化合物,维生素C含有碳、氢、氧三种元素,不属于氧化物,故说法错误;C.维生素C中C、H、O三种元素的质量比为(12×6):(1×8):(16×6)=9:1:12,故说法正确;D.由题意,维生素C(C6H8O6)主要存在于蔬菜和水果中,它能促进人体生长发育,增强人体对疾病的抵抗力,故青少年应多吃蔬菜水果,切勿偏食,故选项说法正确.故选B.【点评】本题难度不大,考查同学们结合新信息、灵活运用化学式的含义与有关计算进行分析问题、解决问题的能力.二、填空题:11.2003年我国部分地区突发的“非典型肺炎”威胁着人们的身体健康.过氧乙酸可以起到消毒作用,其化学式为CH3COOOH,则过氧乙酸的相对分子质量为76 ;C、H、O三种元素的质量比为6:1:12 ;氧元素的质量分数为63.2% .【考点】有关化学式的计算和推断;相对分子质量的概念及其计算;元素质量比的计算;元素的质量分数计算.【分析】根据过氧乙酸的化学式CH3COOOH可知由C、H、O三种元素组成,在化学式中元素符号右下角的数字表示该元素的原子个数.(1)过氧乙酸的相对分子质量的计算方法是:各元素的原子个数×相对原子质量.(2)碳元素、氢元素和氧元素的质量比的计算方法是(碳原子的个数×碳原子的相对原子质量):(氢原子的个数×氢原子的相对原子质量):(氧原子的个数×氧原子的相对原子质量).(3)氧元素的质量分数的计算方法是:氧原子的个数×氧原子的相对原子质量与过氧乙酸的相对分子质量的比.【解答】解:(1)过氧乙酸的相对分子质量为2×12+3×16+1×4=76(2)C、H、O三种元素的质量比为(2×12):(1×4):(3×16)=6:1:12(3)氧元素的质量分数为(3×16):(2×12+3×16+1×4)×100%=63.2%故则过氧乙酸的相对分子质量为76;C、H、O三种元素的质量比为6:1:12;氧元素的质量分数为63.2%..【点评】理解求物质中各元素的比值,计算某分子的相对分子质量,求某物质中某元素的质量分数都是基本的计算,要求掌握.注意各元素的原子的个数一定要数清.12.蛋白质是机体生长及修补受损组织的主要原料,人体通过食物获得的蛋白质在胃肠中与水反应生成氨基酸,蛋氨酸(化学式为C5H11O2NS)就是其中的一种.请回答下列问题:(1)蛋氨酸中各元素的质量比C:H:O:N:S= 60:11:32:14:32 .(2)蛋氨酸中氮元素的质量分数为9.4% .(3)合格奶粉每100g中含蛋白质约18g,蛋白质中氮元素的平均质量分数为16%,则每100g合格奶粉中氮元素的质量为 2.88 g;现测定某奶粉每100g中含有氮元素的质量为0.5g.则这种奶粉属于不合格(填“合格”或“不合格”)奶粉.【考点】元素质量比的计算;元素的质量分数计算;混合物中某元素的质量计算.【专题】课本知识同类信息;压轴实验题;化学式的计算.【分析】根据物质的化学式可以计算出物质中元素的质量比和元素的质量分数;根据物质的质量和元素的质量分数可以计算出元素的质量.【解答】解:(1)蛋氨酸中各元素的质量比为C:H:O:N:S=12×5:1×11:16×2:14:32=60:11:32:14:32.(2)蛋氨酸中氮元素的质量分数为×100%≈9.4%.(3)每100g合格奶粉中氮元素的质量为18g×16%=2.88g>0.5g因此现有的奶粉不合格.故答案为:(1)60:11:32:14:32(2)9.4%(3)2.88g;不合格【点评】本题主要考查元素质量比的计算、元素的质量分数的计算、元素质量的计算,难度稍大.计算时,应注意相对原子质量必须与相应的原子个数相乘.13.相等质量的H2、SO2、O2、N2、CO2,按所含分子数由少到多排列,其顺序为SO2、CO2、O2、N2、H2,具有相同分子数的上述物质,其质量由小到大的顺序为H2、N2、O2、CO2、SO2.【考点】相对分子质量的概念及其计算;物质的微粒性.【专题】化学式的计算.【分析】先计算出这写分子的相对分子质量,由小到大排列,再根据质量相等,则相对分子质量越小所含的分子数越多来排列所含分子数的顺序.【解答】解:H2的相对分子质量为:1×2=2,SO2的相对分子质量为:32+16×2=64;O2的相对分子质量为:16×2=32;N2的相对分子质量为:14×2=28;CO2的相对分子质量为:12+16×2=44.因为2<28<32<44<64,所以具有相同分子数的上述物质,其质量由小到大的顺序为H2、N2、O2、CO2、SO2;如果质量相等,则相对分子质量越小所含的分子数越多.故答案为:SO2、CO2、O2、N2、H2;H2、N2、O2、CO2、SO2.【点评】本题主要考查学生运用化学式进行计算的能力.14.由(NH4)2S、(NH4)2SO4、(NH4)2HPO4组成的混合物中,已知氮元素的质量分数为28%,则混合物中氧元素的质量分数为32% .【考点】混合物中某元素的质量计算.【专题】压轴实验题;化学式的计算.【分析】观察三种化合物的结构,不难发现只有最后一种存在磷元素,三种化合物中相对原子质量存在一定的比例关系,即:(NH4)2S中(NH4)2S和N的关系是68:28、(NH4)2SO4中也是、(NH4)HPO4中(NH4)2HP和N的关系是68:28,所以已知氮元素的质量分数,可以求出(NH4)2S或(NH4)2HP的质量分数,进一步可求出氧元素的质量分数.2【解答】解:已知氮元素的质量分数为28%,则(NH4)2S或(NH4)2HP的质量分数=×28%=68%,氧元素的质量分数为:1﹣68%=32%.故答案为32%.【点评】此题考查混合物中某元素的质量计算,需要仔细观察所给物质的化学式,从中找出元素组成规律,才能正确解答.三、计算题:15.小明同学打算给自家菜园的蔬菜施用氮肥,原计划用2.4kg硝酸铵(NH4NO3),现改用某尿素化肥(该化肥外包装袋上的说明如图所示),需用这种尿素 2 kg,才能保证施用的氮元素质量与原计划相当.【考点】化合物中某元素的质量计算;元素的质量分数计算;标签上标示的物质成分及其含量.【专题】标签图示型;化学计算.【分析】欲正确解答本题,需先计算出硝酸铵(NH4NO3)中氮元素的质量分数,进而计算出2.4kg 硝酸铵(NH4NO3)中含氮元素的质量,然后根据质量分数公式即可计算出使用尿素的质量.【解答】解:硝酸铵(NH4NO3)中氮元素的质量分数为:×100%=35%,2.4kg硝酸铵(NH4NO3)中含氮元素的质量2.4kg×35%=0.84kg.0.84kg÷42%=2kg故答案为:2kg.【点评】本题主要考查学生运用元素的质量分数公式进行计算的能力.16.某CO与CO2的混合气体中碳元素的质量分数为36%,求混合气体中CO2的质量分数是多少?【考点】物质组成的综合计算;混合物中某元素的质量计算.【专题】化学计算.【分析】此题可先通过CO与CO2的化学式计算出各自中碳元素的质量分数,进而计算出各自中碳元素的质量,用所设定的字母表示;然后根据题中已知量,找出二者之间的质量关系,在根据混合物中纯净物质量分数的公式计算出CO2的质量分数.【解答】解:设CO的质量为A; CO2的质量为B.(用到的相对原子质量:C:12 O:16 )(1)①CO中碳元素的质量═CO的质量×CO中碳元素的质量分数═A××100%═A××100%═ A②CO2中碳元素的质量═CO2的质量×CO2中碳元素的质量分数═B××100%═B××100%═ B(2)因为:×100%═36% 所以:⇒B═ A(3)混合气体中CO2的质量分数═×100%═×100%═44%故混合气体中CO2的质量分数是44%【点评】此题主要考查物质与元素质量的关系、物质中某元素的质量分数、纯净物与混合物的质量关系等.此题重在寻找CO与CO2的质量关系.在整个题中主要体现了“质量分数”公式的练习.利用题中所给的已知量求出CO与CO2的质量关系,进而求出混合气体中CO2的质量分数.一、选择题:17.硫酸亚铁可用于治疗缺铁性贫血.某贫血患者每天需补充1.12g铁元素,则他服用的药物中含硫酸亚铁的质量至少为()A.3.80g B.6.95g C.10g D.3.04g【考点】化合物中某元素的质量计算.【专题】化学式的计算.【分析】此题需要先计算硫酸亚铁的含铁质量分数,然后利用铁的质量除以铁的质量分数即可求出硫酸亚铁的质量.【解答】解:先计算硫酸亚铁中铁的质量分数,然后用铁的质量除以其质量分数即可.硫酸亚铁中铁的质量分数是:×100%=36.8%需硫酸亚铁的质量是1.12g÷36.8%=3.04g故选D【点评】此题是对化学式计算的考查,主要利用了元素的质量等于物质的质量乘以元素的质量分数的计算方法,属基础性化学计算题.18.现有①FeO;②Fe2O3;③Fe3O4;④FeS四种含铁化合物,其中含铁元素的质量分数由大到小的排列顺序是()A.③>②>①>④ B.①>③>②>④ C.④>③>②>① D.①>②>③>④【考点】有关化学式的计算和推断.【专题】化学式的计算.【分析】要比较四种含铁的化合物中铁元素的质量分数大小,可以根据某元素的质量分数=×100%先一一计算出每种化合物的中铁的质量分数,然后再进行比较其大小.【解答】解:①FeO铁元素的质量分数=×100%≈77.8%;②Fe2O3铁元素的质量分数=×100%=70%;③Fe3O4铁元素的质量分数=×100%=72.4%;④FeS铁元素的质量分数=×100%=63.6%;根据计算可知铁元素的质量分数由大到小的排列顺序:①>③>②>④.故选:B.【点评】本题是考查根据化学式通过计算比较铁元素的质量分数的大小,题目涉及的知识点比较单一,只要记住求元素的质量分数计算公式即可解答.19.由硫酸亚铁和硫酸铁组成的混合物,经测定其中含硫元素的质量分数为a%,则混合物中铁元素的质量分数为()A.1﹣a% B.1﹣2a% C.1﹣3a% D.无法计算【考点】元素的质量分数计算.【专题】化学式的计算.【分析】根据由于混合物是由Fe2(SO4)3和FeSO4组成的,而每有1个S,就有4个O,所以若硫元素的质量分数为a%,则氧元素的质量分数为2a%,可据此解答本题.【解答】解:硫酸铁[Fe2(SO4)3]和硫酸亚铁[FeSO4]均由Fe、S、O三种元素组成,因此其混合物中Fe%+S%+O%=100%,现已知硫元素的质量分数为a%,则只要算出氧元素的质量分数即可求出铁的质量分数.经仔细分析,这两种化合物中S、O原子个数比相同,都为1:4,所以它们的质量比也成恒比,为32:(16×4)=1:2,即若硫元素的质量分数为a%,则氧元素的质量分数为2a%,所以铁元素的质量分数为:100%﹣2a%﹣a%=1﹣3a%;故选:C.【点评】根据混合物组成中两化合物的中组成元素的质量特别关系,确定混合物中元素的质量分数,此类问题通常存在这种特点.20.已知在Fe3O4中铁、氧元素的质量之比为21:8.现有由FeO、Fe2O3、Fe3O4组成的某混合物,经实验测定其铁、氧元素的质量之比为21:8,则此混合物中FeO、Fe2O3、Fe3O4三者的质量之比可能为()A.9:20:3 B.1:2:3 C.20:9:5 D.6:5:3【考点】元素质量比的计算.【专题】化学式的计算.【分析】因Fe3O4中铁元素和氧元素的质量比为21:8,要满足混合物中铁、氧元素的质量之比也为21:8,则样品中含有任意量的Fe3O4都可以;关键是FeO和Fe2O3中的元素的质量比,而FeO和Fe2O3的分子个数比为1:1时,两种物质的混合物中铁元素和氧元素的质量比也恰好为21:8.【解答】解:因Fe3O4中铁元素和氧元素的质量比为21:8,则任意量都可满足混合物中铁、氧元素的质量之比为21:8;当FeO和Fe2O3的分子个数比为1:1时,两种物质的混合物中铁元素和氧元素的质量比也恰好为21:8,故二者的质量比为:(56+16):(56×2+16×3)=9:20故选A【点评】本题考查利用化学式的计算,明确元素的质量比的计算,在解题过程中注意Fe3O4中铁元素和氧元素的质量比恰好为21:8是关键信息.21.在H2SO4和H3PO4各10个分子中一样多的是()A.氧分子个数 B.氧元素个数 C.氧原子个数 D.氢原子个数【考点】分子和原子的区别和联系.【专题】物质的微观构成与物质的宏观组成.【分析】化学式的微观意义是表示一个分子中有多少个原子;化学式宏观表示物质是由哪些元素组成的.。
九年级化学3.2《物质组成的表示》课件鲁教版

原子结构模型及核外电子排布
原子结构模型
原子由原子核和核外电子构成, 原子核位于原子中心,由质子和 中子组成,核外电子绕核运动。
核外电子排布
核外电子按能量由低到高分层排 布,离核最近的为第一层,次之 为第二层,依次类推。每层最多 容纳的电子数为2n^2(n为电子
层数)。
原子半径
原子半径的大小取决于核外电子 层数和核电荷数。一般来说,电 子层数越多,原子半径越大;核
氢键是一种较强的分子间作用力,对物质的熔点、沸点、溶解度等性质有显著影响。例如,HF的沸点 比HCl高,就是因为HF分子之间存在氢键。
范德华力在物质性质中作用
范德华力定义
范德华力是存在于中性分子或原子之间的一种弱碱性的电性吸引力。
对物质性质影响
范德华力主要影响物质的物理性质,如熔点、沸点、蒸气压等。范德华力越强,物质的熔点、沸点越高,蒸气压 越低。例如,烷烃的熔点和沸点随着碳原子数的增加而升高,就是因为碳原子数增加使得分子间范德华力增强。
06 物质组成表示方法总结
化学式书写规则及注意事项
单质的化学式
金属、稀有气体及固态非金属通常直接用元 素符号表示它们的化学式;而氧气、氢气、 氮气、氯气等非金属气体的分子由双原子构 成,其化学式表示为$O_2$、$H_2$、 $N_2$、$Cl_2$ 。
化合物的化学式
正价元素符号(或原子团)写在左边,负价 元素符号(或原子团)写在右边,同时要注 意化合价数值交叉法确定原子(或离子)的
九年级化学3.2《物质组成的表示 》课件鲁教版
contents
目录
• 物质组成基本概念 • 原子结构与元素周期表 • 离子键、共价键及金属键 • 分子间作用力与氢键 • 晶体类型与性质差异 • 物质组成表示方法总结
【同步测试】《物质组成的表示—化学式》同步练习4

《物质组成的表示—化学式》同步练习2一、选择题1.二甲醚(C2H6O)作为一种新能源,有关说法正确的是A.二甲醚的相对分子质量为48B.二甲醚属于氧化物C.二甲醚由2个碳原子、6个氢原子和1个氧原子构成D.二甲醚中碳元素与氢元素的质量比为4︰12.酚酞是实验室常用的化学试剂,其化学式是C20H14O4,下列说法不正确的是A.在“分子运动现象的实验”中,酚酞分子扩散到氨水中,使氨水变红色B.酚酞溶液有酒精的气味,猜想配制酚酞溶液时用到了乙醇C.酚酞中氢元素质量分数的计算式是14/ 318×100%D.一个酚酞分子由20个碳原子、14个氢原子、4个氧原子构成3.我国推广食用的加碘盐是在食盐中加入一定量的碘酸钾(KIO3)。
在碘酸钾中碘元素化合价为()A.-1 B.-5 C.+1 D.+54.日本大地震引发核泄漏事故,工作人员注入硅酸钠(Na2SiO3)等阻水材料成功堵住了高辐射污水流入大海。
硅酸钠中硅元素的化合价为A.+2 B.+3 C.+4 D.+55.煅烧石灰石可制得氧化钙(假设石灰石中的杂质不参与反应,且不含钙、碳元素).测得煅烧后剩余固体中钙元素与碳元素的质量比为20:3.则已分解的碳酸钙占原碳酸钙的质量分数为()A.40% B.60% C.30% D.50%6.北京奥运会“祥云”火炬采用的燃料是丙烷(分子结构模型如图),下列关于丙烷分子的说法不正确的是()A.丙烷由丙烷分子构成B.丙烷中含有11个原子C.丙烷分子由碳原子和氢原子构成D.丙烷中碳元素的质量分数为81.8%7.用N、H、O三种元素组成下列物质或微粒:(用符号填写)(1)一种气体单质(2)一种酸(3)相对分子质量最小的氧化物(4)一种带正电的根的离子8.亚硝酸铵(NH4NO2)中有关N的化合价判断正确的是A.两个N原子均为+1 B.第一个N原子为+3C.第二个N原子为-5 D.第二个N原子为+39.硫元素的化合价为+4的物质是A.H2S B.S C.SO2 D.SO310.在密闭容器中,将1molCO和1molO2混合,一定条件下充分反应。
物质组成的表示同步练习八年级化学鲁教版(五四制)全一册

鲁鲁鲁鲁鲁鲁鲁鲁鲁鲁鲁3.3鲁鲁鲁鲁鲁鲁鲁鲁鲁一、单选题1.2020年,我国在抗击新冠肺炎战役中取得了阶段性重大成果。
为防控疫情,通常在公共场所使用84消毒液(主要成分是NaClO)进行消毒。
NaClO中氯元素的化合价是A. −1B. 0C. +1D. +72.下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是()A. OB. ZnC. 2ND. CO3.推理是学习化学的一种思维方法。
以下推理正确的是()A. 阳离子是带正电的粒子,则带正电的粒子一定是阳离子B. 化合物由不同种元素组成,则由不同种元素组成的纯净物一定是化合物C. 因为H2O和H2O2的组成元素相同,所以它们的化学性质相同D. 在同一化合物中,若金属元素显正价,则非金属元素一定显负价4.下列含氯的物质中,氯元素的化合价最低的是()A. Cl2B. Ca(ClO)2C. KClO3D. AlCl35.电子产品触摸屏的主要材料是氧化铟(In2O3)。
氧化铟中铟元素的化合价是()A. +1B. +2C. +3D. +46.对于下列几种化学符号有关说法正确的是()①H②NH3③H2SO4④Fe3+⑤A. 表示物质组成的化学式有①②③B. ②中氮元素的化合价为+3C. ③中数字“4”表示硫酸中有4个氧原子D. 表示阳离子的有④⑤7.推理是学习化学的一种重要方法,但盲目类推又可能得出错误结论.以下类推正确的是()A. 由同种分子构成的物质一定是纯净物,所以纯净物一定是由同种分子构成的B. 在化合物里,正负化合价的代数和为零,所以在同一化合物中金属元素显正价,则非金属元素一定都显负价C. 离子是带电荷的微粒,所以带电荷的微粒一定是离子D. 氧化物一定含氧元素,含氧元素的物质不一定是氧化物8.下列符号中,表示2个氯原子的是()A. Cl2B. 2Cl2C. 2ClD. 2Cl−9.亚硒酸钠有钠、硒、氧三种元素组成,具有抗衰老作用。
鲁教版五四制化学八年级全册3.3《物质组成的表示》同步练习3

第三节物质组成的表示同步练习3一、选择题〔每题只有一个正确答案〕1.以下根据化学式的计算,正确的选项是〔〕A、Cu〔OH〕2的相对分子质量是〔64+16+1〕×2B、3CaO的相对分子质量总和是3×40+16C、硫酸〔H2SO4〕中各元素的质量比是1:32:16D、硫酸铵[〔NH4〕2SO4]中氮元素的质量分数计算式为14×2/132×102.某气体单质和氧气的相对分子质量比为7:8,那么该气体可能是〔〕A、COB、CO2C、N2D、Cl23.含硫的煤燃烧时生成的两种元素质量比为1:1,且能污染空气的气体是〔〕A.一氧化碳 B.二氧化硫 C.二氧化碳 D.二氧化氮4.世界卫生组织〔WHO〕将某氧化物RO2列为A组高效平安灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。
实验测得该氧化物中R与O的质量比为71:64,R2O的化学式为〔〕A、CO2B、ClO2C、SO2D、NO25.氮元素的一种氧化物中氮元素与氧元素质量之比为7:12,那么该氧化物的化学式为〔〕A、NOB、N2O3C、NO2D、N2O56.以下几种化合物,含铁元素的质量分数最高的是〔〕A、Fe3O4B、Fe2O3C、FeOD、FeS7.农村经常使用氮肥硝酸铵,化学式NH4NO3,经过测定含氮量为37%,该化肥中只含有一种杂质,那么该化肥中可能混有以下物质中的哪种氮肥〔〕A.氯化铵〔NH4Cl〕 B.硫酸铵[(NH4)2SO4] C.尿素[CO(NH2)2] D.碳铵8.某种NH4NO3样品中混有不含氮元素的杂质,测得该NH4NO3样品中含氮的质量分数为%,那么样品中NH4NO3的质量分数为〔〕A、24.5%B、49%C、70%D、80%9.化学式为H2R2O3的物质,其相对分子质量为114,那么R的相对原子质量为〔〕A.32gB.64g10.山茶油是一种绿色保健品,其主要成分是柠檬醛。
现从山茶油中提取76g 柠檬醛,将其在氧气中完全燃烧,生成二氧化碳220g,水72g,那么柠檬醛的组成中〔相对原子质量:H-1C-12O-16〕〔〕A、只含有碳、氢元素B、一定含有碳、氢、氧元素C、一定含有碳、氢元素,可能含有氧元素D、一定含有碳、氧元素,可能含有氢元素二、填空题。
《物质组成的表示》 学习任务单

《物质组成的表示》学习任务单一、学习目标1、理解元素符号的含义,能够正确书写常见元素的符号。
2、掌握化学式的概念,能够根据元素化合价写出常见物质的化学式。
3、学会根据化学式计算物质的相对分子质量、组成元素的质量比和某元素的质量分数。
二、学习重难点1、重点(1)元素符号的书写和含义。
(2)化学式的书写规则和意义。
(3)有关化学式的计算。
2、难点(1)化合价的理解和应用。
(2)根据化学式进行复杂的计算。
三、学习资源1、教材:《化学》(具体版本)相关章节。
2、在线课程:列举一些相关的在线课程平台和课程名称3、科普视频:推荐一些科普视频网站和相关主题的视频四、学习方法1、预习教材内容,标记出不理解的知识点。
2、观看在线课程和科普视频,加深对知识的理解。
3、做练习题巩固所学知识,及时总结错题。
五、学习过程1、元素符号(1)元素符号的定义:元素符号是用来表示元素的化学符号。
(2)元素符号的书写规则:①由一个字母表示的元素符号要大写,如 H、O 等;②由两个字母表示的元素符号,第一个字母大写,第二个字母小写,如 Cu、Fe 等。
(3)元素符号的意义:①宏观上表示一种元素;②微观上表示这种元素的一个原子。
例如,H 表示氢元素,也表示一个氢原子。
2、化学式(1)化学式的定义:用元素符号和数字的组合表示物质组成的式子。
(2)化学式的书写规则:单质化学式的书写:由原子构成的单质,直接用元素符号表示,如金属单质(Cu、Fe 等)、稀有气体单质(He、Ne 等)。
由分子构成的单质,在元素符号右下角写上分子中所含原子的个数,如氧气(O₂)、氮气(N₂)等。
化合物化学式的书写:正价在前,负价在后。
交叉法确定原子个数。
(3)化学式的意义:宏观意义:表示一种物质;表示该物质的元素组成。
微观意义:表示该物质的一个分子;表示一个分子的原子构成。
3、化合价(1)化合价的定义:元素在形成化合物时表现出来的一种性质。
(2)常见元素和原子团的化合价:记住一些常见元素(如氢、氧、钾、钠等)和原子团(如硫酸根、硝酸根等)的化合价。
化学化学式的计算练习题

化学化学式的计算练习题化学式是化学元素组成化合物的简化表示法,它能够明确地表示出其中所含元素以及它们的相对比例。
化学式的计算是化学中的基础知识,它需要我们掌握有关元素的原子量以及化合物的相对分子量。
以下是几个化学化学式的计算练习题,通过这些练习题的实践,我们可以更好地巩固和加深对化学式计算的理解。
练习题一:计算硫酸二铁的化学式硫酸是由硫元素、氧元素和氢元素组成的化合物,其化学式为H₂SO₄。
而二价铁离子为Fe²⁺,根据阿伦尼乌斯规则,它与氧元素形成的化合物中,每个氧原子与两个金属离子相结合。
因此,硫酸二铁的化学式为FeSO₄。
练习题二:计算乙酸钠的化学式乙酸是由碳元素、氢元素和氧元素组成的化合物,其化学式为CH₃COOH。
钠离子为Na⁺。
在乙酸钠中,一个乙酸离子中的一个氢原子被钠离子所取代,形成CH₃COONa。
因此,乙酸钠的化学式为C₂H₃O₂Na。
练习题三:计算硫酸镁的化学式硫酸是由硫元素、氧元素和氢元素组成的化合物,其化学式为H₂SO₄。
镁离子为Mg²⁺。
在硫酸镁中,一个硫酸离子中的一个氢原子被镁离子所取代,形成MgSO₄。
因此,硫酸镁的化学式为MgSO₄。
练习题四:计算氧化铜的化学式氧化铜是由铜元素和氧元素组成的化合物。
根据化合价的原则,铜的化合价为+2,氧的化合价为-2。
因此,氧化铜的化学式为CuO。
练习题五:计算硫化铁的化学式硫化铁是由铁元素和硫元素组成的化合物。
根据化合价的原则,铁的化合价为+2,硫的化合价为-2。
因此,硫化铁的化学式为FeS。
通过对以上化学式的计算练习,我们可以看到,化学式的计算需要根据元素的化合价以及离子的配位规律进行推导。
通过大量的练习,我们可以更加熟练地进行化学式的推导和计算,并深入理解元素间相对比例的关系。
总结:化学式的计算是化学中的基础知识,通过对化学式的练习题的实践,可以加深对元素化合物组成方式的理解。
在进行化学式计算时,需要掌握好元素的原子量以及化合物的相对分子量,并根据化合价和离子配位规律进行推导。
中考化学总复习物质组成的表示——化学式与化合价综合训练(1)

中考化学总复习物质组成的表示——化学式与化合价综合训练(1)一.选择题1.三氧化二铋(Bi2O3)俗称铋黄,是制作防火纸的材料之一。
三氧化二铋中铋元素的化合价为()A.+6B.+3C.+2D.-22.下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是()A.O B.Fe C.N2 D.CO3.蚊虫叮咬时分泌的蚁酸(HCOOH)会使人体皮肤肿痛。
下列说法正确的是()A.蚁酸由五种元素组成B.蚁酸中氢元素的质量分数最小C.蚁酸中碳、氧元素的质量比为1:2D.蚁酸是由1个碳原子、2个氢原子、2个氧原子构成4.“塑化剂”是一种重要的化工原料,属2B类致癌物,曾被添加到食品中,造成了“塑化剂”风暴。
已知“塑化剂”的化学式为C24H34O4,下列说法正确的是()A.该“塑化剂”属于有机物B.该“塑化剂”中碳、氢、氧三种元素的质量比为12:17:2C.该“塑化剂”中碳的质量分数为24%D.该“塑化剂”是由24个碳原子、34个氢原子、4个氧原子构成5.科研人员发现维生素P 能封住病毒的侵占途径.已知维生素P 的化学式为C27H30O16,关于维生素P的叙述中正确的是()A.维生素P是由27个碳原子、30个氢原子和16个氧原子构成B.维生素P是一种氧化物C.维生素P相对分子质量为610gD.将维生素P在足量的氧气中充分燃烧,产物为CO2和H2O6.下列关于化合价的说法正确的是( )A.在化合物中,氧元素通常显-2价B.在化合物中,非金属元素一定显负价C.氢气中氢元素的化合价为+1D.一种元素只有一种化合价7.下面是对“2”的含义的解释,其中错误的是()A.Fe2+:一个带2个单位正电荷的亚铁离子B .2M g :带2个单位正电荷的镁离子C .Ba(OH)2:氢氧化钡的化学式中钡离子和氢氧根离子的个数比是1∶2D .2SO 42-:2个硫酸根离子,每个硫酸根离子带2个单位的负电荷8.甲型H1N1流感,感染早期用达菲治疗有效。
化学式计算的练习题与答案

化学式计算的练习题与答案化学式计算的练习题与答案化学式计算是化学中的一项基础技能,它涉及到了元素的相对原子质量、化合价以及化学反应的平衡等知识。
通过化学式计算,我们可以推导出物质的化学式和化学方程式,进而深入了解化学反应的本质和特点。
下面,我们将介绍几个化学式计算的练习题,并给出详细的解答。
1. 计算氧化铁的化学式。
氧化铁是由铁和氧两种元素组成的化合物。
根据氧化铁的化学性质,我们可以推测它的化学式为FeO。
在FeO中,铁的化合价为+2,氧的化合价为-2,两者化合后电荷相互抵消,形成了中性的化合物。
2. 计算硫酸铜的化学式。
硫酸铜是由铜、硫和氧三种元素组成的化合物。
根据硫酸铜的化学性质,我们可以推测它的化学式为CuSO4。
在CuSO4中,铜的化合价为+2,硫的化合价为+6,氧的化合价为-2。
根据化合价的平衡原则,硫的化合价需要乘以2,使得硫酸铜的总电荷为0。
3. 计算硝酸铵的化学式。
硝酸铵是由铵离子(NH4+)和硝酸根离子(NO3-)组成的化合物。
根据硝酸铵的化学性质,我们可以推测它的化学式为NH4NO3。
在NH4NO3中,铵离子的化合价为+1,硝酸根离子的化合价为-1。
根据化合价的平衡原则,铵离子的数量需要与硝酸根离子的数量相等,使得硝酸铵的总电荷为0。
4. 计算硫酸钠的化学式。
硫酸钠是由钠、硫和氧三种元素组成的化合物。
根据硫酸钠的化学性质,我们可以推测它的化学式为Na2SO4。
在Na2SO4中,钠的化合价为+1,硫的化合价为+6,氧的化合价为-2。
根据化合价的平衡原则,钠的数量需要乘以2,使得硫酸钠的总电荷为0。
5. 计算硫酸铁的化学式。
硫酸铁是由铁、硫和氧三种元素组成的化合物。
根据硫酸铁的化学性质,我们可以推测它的化学式为Fe2(SO4)3。
在Fe2(SO4)3中,铁的化合价为+3,硫的化合价为+6,氧的化合价为-2。
根据化合价的平衡原则,铁的数量需要乘以2,使得硫酸铁的总电荷为0。
通过以上几个化学式计算的练习题,我们可以发现化学式计算是根据元素的化合价和电荷平衡原则进行推导的过程。
初中化学九年级上册-九年级化学上册 3.2 原子的结构 同步练习(有答案)

3.2原子的结构一、选择题:1、据报导,科学家发现了新的氢微粒。
这种氢微粒由3个氢原子核(只含质子)和 2个电子构成。
下列说法中正确的是()A.该微粒不显电性B.该微粒比一个普通H2分子相对分子质量多3C.该微粒可用H3-表示D.该微粒比一个普通H2分子多一个氢原子核2、图为溴原子的核外电子排布,该溴原子的相对原子质量是80,下列说法错误的是()A.X的值是35 B.溴化钙的化学式是CaBrC.溴属于非金属元素D.该溴原子的中子数是453、利家计划用质子数为20的钙离子,轰击核电荷数为98的元素靶,使两元素的原子核合并在一起,合成核电荷数为118的新元素。
下列理解错误的是()A.变化过程中元素种类发生了改变B.新元素的原子序数为118C.新元素的原子核外电子数为118D.新元素的相对原子质量为11814、钛被认为是21世纪的重要金属材料,钛原子核内有22个质子,相对原子质量为48,则下列有关说法正确的是()A.钛元素的元素符号为TI B.钛原子的核电荷数为22C.该原子核内有22个中子D.该原子核外有26个电子5、关于钠原子(Na)和钠离子(Na+)的叙述中判断正确的是()①核电荷数相同②核外电子数相同③钠离子(Na+)较稳定④核内质子数相等A.①②③B.①③④6、如图某变化的示意图,其中①②③表示三种原子,“”、“”、“”表示原子中的不同微粒,下列说法错误的是()A.“”是中子B.②是氢原子C.该变化不属于化学变化D.①②③属于同种元素的原子7、推理是学习化学的一种重要方法,但推理必须科学、严谨。
下列推理正确的是()A.木炭在氧气中能燃烧,所以氧气具有可燃性B.分子、原子都是不带电的微粒,但不带电的微粒不一定都是分子、原子C.原子核是由质子和中子构成的,故所有原子核中都一定含有质子和中子D.催化剂在反应前后质量不变,因此反应前后质量不变的物质一定是催化剂8、我国科学家利用“天眼”在银河系内发现了9颗中子星。
科粤教版初中化学九年级全册《物质组成的表示式》同步练习3新版精选汇总

①Mg2+ ②SO2 ③2CO ④CuO ⑤2PO3-4 ⑥2O ⑦2SO3 ⑧2H+ (1)表示分子个数的是________; (2)表示一个离子所带电荷数的是________; (3)表示元素化合价的是________; (4)表示一个分子中所含原子个数的是________。 10.(1)用化学用语填空: ①2 个氮分子________________;②m 个铝离子________________; ③硫酸铁________________;④能保持氧气化学性质的粒子 ________________。 (2)写出下列化学符号中数字“2”的含义:
科粤教版初中化学
科粤教版初中化学 重点知识精选
化学是一门非常有意思的学科,充满了新奇的实验! 科粤教版初中化学 和你一起共同进步学业有成!
3.4 物质组成的表示式 专项训练一:化学符号周围数字的意义
TB:小初高题库
科粤教版初中化学
专项概述
化学符号周围的数字因其位置不同而具有不同的意义,可归纳如下:1.化学符 号前面的数字:表示粒子的个数。即:元素符号前面的数字,表示几个某原
TB:小初高题库
科粤教版初中化学
+2
①Fe2+___________________________;②Mg
O____________________________。 专项训练二:化学式 专项概述
化学式的有关知识是历年中考考查的重点和热点。主要考查化学式的意义,根 据化学式确定物质的元素组成和分子构成,判断物质的类别,根据化学式确定
TB:小初高题库
科粤教版初中化学
B.CO 表示一个一氧化碳分子 C.Zn2+表示锌元素的化合价为+2 价 D. M+ 2g表示一个镁离子带两个单位正电荷 6.(2015·泰安)下列化学符号中数字“2”表示的意义不符合的是( ) A.2NH+4 :两个铵根离子 B.H2O:一个水分子中含有一个氢分子 C. Mg2+:一个镁离子带两个单位的2015·烟台)化学用语是国际通用的化学语言。下列化学符号及含义正确的是
2.3.2 物质组成的定量表示2024-2025学年九年级化学上册同步学与练(鲁教版2024)
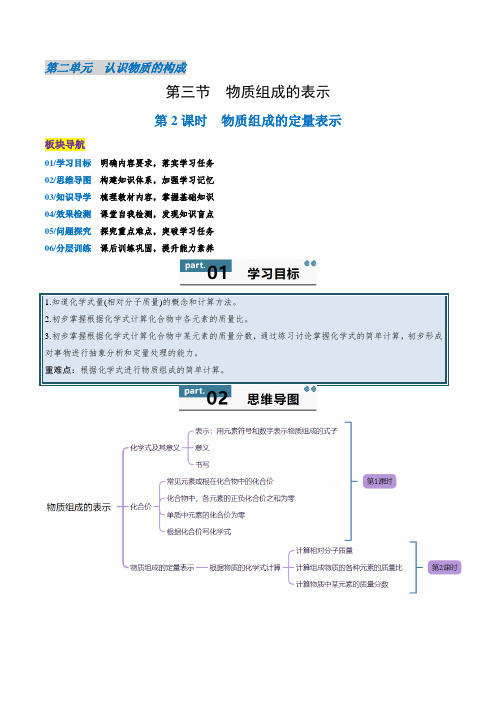
第二单元认识物质的构成第三节物质组成的表示第2课时物质组成的定量表示板块导航01/学习目标明确内容要求,落实学习任务02/思维导图构建知识体系,加强学习记忆03/知识导学梳理教材内容,掌握基础知识04/效果检测课堂自我检测,发现知识盲点05/问题探究探究重点难点,突破学习任务06/分层训练课后训练巩固,提升能力素养一、化学式量1.定义:化学式中各原子的相对原子质量的总和,就是该物质的化学式量。
对于由分子构成的物质,其化学式量也叫相对分子质量。
2.意义:组成物质的各元素之间存在着固定的质量关系,而化学式就反映了物质中的这种质量关系。
3.计算方法:相对分子质量=相对原子质量与相应原子个数的乘积和。
如C4H4O4的相对分子质量=12×4+1×4+16×4=116。
二、根据物质的化学式进行计算1(1)计算公式是:。
(2例:CO2中碳元素和氧元素的质量比为(12×1)∶(16×2)=3∶8。
2.元素质量分数计算:(1)某元素的质量分数(2)化合物中某元素的质量=化合物的质量×该元素的质量分数。
(3)化合物的质量=某元素的质量÷化合物中该元素的质量分数。
例:CO2中碳元素的质量分数为12×112×1+16×2×100%≈27.3%。
3.化合物中某元素的质量计算化合物中某元素的质量计算是指利用化合物的化学式先求出某元素的质量分数,然后结合化合物的质量来1.计算下列物质的相对分子质量(写出计算过程)。
(1)2CO的相对分子质量为。
(2)4KMnO的相对分子质量为。
(3)3Al(OH)的相对分子质量为。
(4)25C H OH的相对分子质量为。
2.试计算水(2H O)中氧元素的质量分数。
(1)水是由构成的,n个水分子中有个氧原子和个氢原子。
(2)水中氧元素的质量分数=[(×氧原子质量)/ 个水分子的质量]×100%=[(1×氧原子质量)/1个水分子的质量]×100%,由于原子的实际质量很小,常采用相对原子质量计算。
鲁教五四新版八年级上册 3.3 物质组成的表示 同步练习卷(含解析)

鲁教五四新版八年级上册 3.3 物质组成的表示同步练习卷(含解析)鲁教五四新版八年级上册《3.3 物质组成的表示》2023年同步练习卷一、选择题1.如图所示,小林对二氧化碳化学式表示的意义有如下四种理解,你认为不正确的是()A.表示二氧化碳气体B.表示二氧化碳由碳、氧两种元素组成C.表示二氧化碳的一个分子D.表示二氧化碳由1个碳原子和2个氧原子构成2.下列符号表示氢气化学式的是()A.H B.H2 C.2H2 D.H2O3.下列符号中既能表示物质的元素组成,又能表示该物质的一个分子的是()①Cu ②N ③H2O ④NaCl ⑤NH3A.①②③④⑤ B.③⑤ C.①③⑤ D.①②③⑤4.下列化学符号中,既能表示一种元素,又能表示一个原子,还能表示一种物质的是()A.2C B.N2 C.Fe D.O5.下列物质的化学式书写正确的是()A.氢气H B.氦气He C.镁MG D.氩气Ar26.对于化学式“H2O”的各种表述错误的是()A.表示水这种物质B.表示水分子由氢元素和氧元素组成C.表示1个水分子D.表示1个水分子由2个氢原子和1个氧原子构成7.如图,这四位同学描述的是同一化学符号,此化学符号是()A.CO2 B.HCN C.O3 D.NH38.下列符号表示的意义不正确的是()A.铁的化学式——Fe B.氯气的化学式——Cl2C.碳的化学式——C D.氧气的化学式——O39.如图是氮气的微观图,对于氮气认识错误的是()A.氮气是纯净物B.一个氮气分子由两个氮原子构成C.氮气化学式是N2D.氮气是由氮原子直接构成10.下列化学用语与所表述的意义相符的是()A.Na—一个钠元素B.2N——一个氮分子是由2个氮原子构成的C.O2——2个氧原子D.Ca2+——一个钙离子11.葡萄糖的分子式为C6H12O6.则下列有关葡萄糖的说法正确的是()A.葡萄糖是由碳、氢气和氧气组成B.葡萄糖由三种元素组成C.葡萄糖由24个原子构成D.葡萄糖分子由碳原子和水分子构成二、填空题12.由原子直接构成的物质有、等几类物质,用即可以表示这些物质的化学式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《3.2物质组成的表示之化学式的有关计算》2010
年同步练习
《3.2 物质组成的表示之化学式的有关计算》2010
年同步练习
一、选择题(共20小题,每小题4分,满分80分)
4.(4分)“非典”是一种新发现的传染病,威胁着人们的健康.防范“非典”的措施是科学洗手、勤通风,定期消毒,
7.(4分)某牌子的天然矿泉水的成分有:钠46.31mg/l,钙35.11mg/l,碘0.05mg/l等,问多少瓶350ml
12.(4分)市售的“脑黄金”(DHA)是从深海鱼油中提取的,其主要成分的化学式为:C35H51COOH,则该物质属于
14.(4分)苏丹一号(C16H l2N2O)是一种染料.根据2004年4月的MSDS数据,该物质存在致癌证据,故不能
15.(4分)由A、B两种元素组成的化合物中,已知A与B的相对原子质量之比为12:1,质量之比为6:1,则
.
H3K O3O2Na2O3C
24O2O2O
二、填空题(共5小题,每小题5分,满分25分)
21.(5分)2004年诺贝尔化学奖授予以色列化学家阿龙•切哈诺沃、阿夫拉姆•赫什科和美国科学家欧文•罗斯,以表彰他们发现了泛素调节蛋白质水解的作用.泛素是一种由76个氨基酸组成的多肽链,其水解产物中有一种分子式为C3H7O2NS的氨基酸,该氨基酸由_________种元素组成,每个分子含有_________个原子.
上述图表说明了什么?_________.
23.(5分)二氧化碳里碳元素的质量分数为_________,11g二氧化碳中含有_________g碳元素,_________ g二氧化碳里含有6g碳元素.
24.(5分)某元素的氧化物的化学式为R2O5,若R与O元素的质量比为7:20,则R元素的相对原子质量为
_________.
25.(5分)人类发明并使用氟里昂(主要用作致冷剂)若干年后,科学家发现氟里昂在紫外线的照射下能分解出氯原子破坏臭氧层,其破坏臭氧的循环示意图如下:
(1)请写出臭氧的化学式_________;
(2)上述反应属于化合反应的是(填序号)_________;
(3)经过上述①②③的反应过程后,反应物氯原子的个数是否发生变化?_________(答:“是”或“否”).(4)诺贝尔奖获得者莫里纳博士指出:“少量的氟里昂就能对臭氧层产生巨大的影响”,请你根据循环示意图论证他的观点._________
(5)在科学家的建议下,许多国家签署了停止使用和消费氟里昂的协议,使得大气中氟里昂的含量得到了控制.请你根据本题提供的信息就怎样有效保护我们的环境谈一点建议或认识:_________.
三、解答题(共3小题,满分0分)
为他买了哪种肥料?
27.(1)露天烧烤不仅产生大量有害气体污染环境,而且烧焦肉类中还含有强烈的致癌物质3,4﹣苯并芘,其化学式为C20H12.求该物质126g中含碳元素多少克?
(2)其化肥厂生产一批尿素,经测定,其含氮元素的质量分数为42%(杂质不含氮).按规定,产品中含尿素[CO (NH2)2]的质量分数在95%以上为一等品,试根据计算判断该厂所生产的尿素能否按一等品出售?
28.焚烧生活垃圾场会产生二恶英,其中毒性较大的一种物质中所含元素的质量分数C%﹣44.72%,H%﹣1.24%,O%﹣9.94%,Cl﹣44.1%,已知该物质其的相对分子质量为322,试确定该物质化学式.
《3.2 物质组成的表示之化学式的有关计算》2010
年同步练习
参考答案与试题解析
一、选择题(共20小题,每小题4分,满分80分)
=
=
×
×
×
、
4.(4分)“非典”是一种新发现的传染病,威胁着人们的健康.防范“非典”的措施是科学洗手、勤通风,定期消毒,
,可得×
7.(4分)某牌子的天然矿泉水的成分有:钠46.31mg/l,钙35.11mg/l,碘0.05mg/l等,问多少瓶350ml
×
12.(4分)市售的“脑黄金”(DHA)是从深海鱼油中提取的,其主要成分的化学式为:C35H51COOH,则该物质属于
=
14.(4分)苏丹一号(C16H l2N2O)是一种染料.根据2004年4月的MSDS数据,该物质存在致癌证据,故不能
15.(4分)由A、B两种元素组成的化合物中,已知A与B的相对原子质量之比为12:1,质量之比为6:1,则
=:=1
.
H3K O3O2Na2O3C
24O2O2O
二、填空题(共5小题,每小题5分,满分25分)
21.(5分)2004年诺贝尔化学奖授予以色列化学家阿龙•切哈诺沃、阿夫拉姆•赫什科和美国科学家欧文•罗斯,以表彰他们发现了泛素调节蛋白质水解的作用.泛素是一种由76个氨基酸组成的多肽链,其水解产物中有一种分子式为C3H7O2NS的氨基酸,该氨基酸由5种元素组成,每个分子含有14个原子.
上述图表说明了什么?人体来自大自然,生命诞生于原始海洋之中,人体不但不存在大自然所没有的元素,而且与其诞生的环境元素成分很接近.
23.(5分)二氧化碳里碳元素的质量分数为27.3%,11g二氧化碳中含有3g碳元素,22g二氧化碳里含有6g碳元素.
×
二氧化碳里碳元素的质量分数为:
×
÷=22g
24.(5分)某元素的氧化物的化学式为R2O5,若R与O元素的质量比为7:20,则R元素的相对原子质量为14.
25.(5分)人类发明并使用氟里昂(主要用作致冷剂)若干年后,科学家发现氟里昂在紫外线的照射下能分解出氯原子破坏臭氧层,其破坏臭氧的循环示意图如下:
(1)请写出臭氧的化学式O3;
(2)上述反应属于化合反应的是(填序号)②;
(3)经过上述①②③的反应过程后,反应物氯原子的个数是否发生变化?否(答:“是”或“否”).
(4)诺贝尔奖获得者莫里纳博士指出:“少量的氟里昂就能对臭氧层产生巨大的影响”,请你根据循环示意图论证他的观点.反应过程中氯原子没有损耗,而是在循环消耗臭氧,导致少量的氯原子就能对臭氧层产生巨大影响(5)在科学家的建议下,许多国家签署了停止使用和消费氟里昂的协议,使得大气中氟里昂的含量得到了控制.请你根据本题提供的信息就怎样有效保护我们的环境谈一点建议或认识:治理污染要从禁止污染源开始.
三、解答题(共3小题,满分0分)
为他买了哪种肥料?
27.(1)露天烧烤不仅产生大量有害气体污染环境,而且烧焦肉类中还含有强烈的致癌物质3,4﹣苯并芘,其化学式为C20H12.求该物质126g中含碳元素多少克?
(2)其化肥厂生产一批尿素,经测定,其含氮元素的质量分数为42%(杂质不含氮).按规定,产品中含尿素[CO (NH2)2]的质量分数在95%以上为一等品,试根据计算判断该厂所生产的尿素能否按一等品出售?
××
÷×
28.焚烧生活垃圾场会产生二恶英,其中毒性较大的一种物质中所含元素的质量分数C%﹣44.72%,H%﹣1.24%,O%﹣9.94%,Cl﹣44.1%,已知该物质其的相对分子质量为322,试确定该物质化学式.
参与本试卷答题和审题的老师有:zlfzlf;pipi;blq728;fqk;xzoldman;海影;易水寒;727056;lsj1660;liying123;zqy;zzz;QYPX;ls0906;one115(排名不分先后)
菁优网
2013年3月1日。
