高中化学离子浓度大小比较专练
高中化学离子浓度大小比较练习题(附答案)
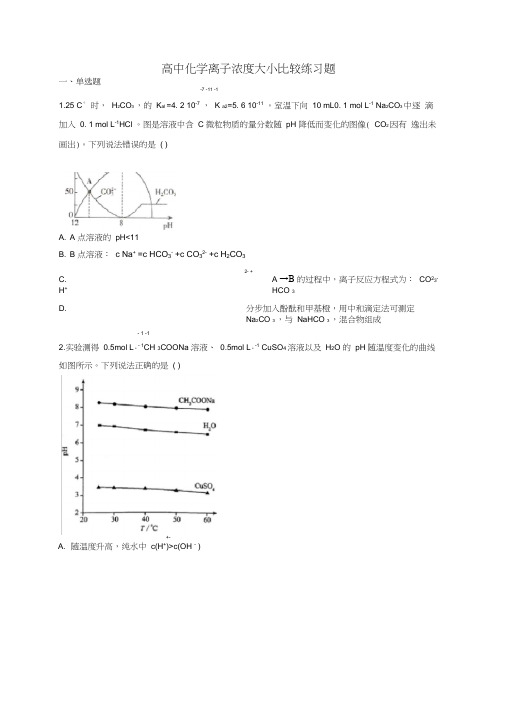
高中化学离子浓度大小比较练习题一、单选题-7 -11 -11.25 C° 时,H2CO3 ,的K al =4. 2 10-7,K a2=5. 6 10-11。
室温下向10 mL0. 1 mol L-1 Na2CO3 中逐滴加入0. 1 mol L-1HCl 。
图是溶液中含 C 微粒物质的量分数随pH 降低而变化的图像( CO2 因有逸出未画出)。
下列说法错误的是( )A. A 点溶液的pH<11B. B 点溶液:c Na+=c HCO3-+c CO32-+c H2CO32- +C. A →B 的过程中,离子反应方程式为:CO23-H+HCO 3D. 分步加入酚酞和甲基橙,用中和滴定法可测定Na2CO 3 ,与NaHCO 3 ,混合物组成- 1 -12.实验测得0.5mol L·- 1CH 3COONa 溶液、0.5mol L·-1 CuSO4 溶液以及H2O 的pH 随温度变化的曲线如图所示。
下列说法正确的是( )+-A. 随温度升高,纯水中c(H+)>c(OH - )c R( COOH )c(RCOOH)+c(RCOO -)CH 3CH 2COOH)溶液中 δRCOOH 与 pH 的关系如图所示。
下列说法正确的是 ( )A. 图中 M 、N 两点对应溶液中的 c(OH )比较:前者 >后者B. 丙酸的电离常数 K= 10 4.88C. 等浓度的 HCOONa 和CH 3CH 2 COONa 两种榕液的 pH 比较:前者 > 后者D. 将 0. 1 mol/L 的 HCOOH 溶液与 0. 1 mol/L 的 HCOO-Na 溶 液 等 体 积 混 合 , 所 得 溶 液中 :c Na >c H COOH >c H - COOH - >cc HO +4. 常温下 ,Ksp(CaF 2)=4×10-9,Ksp (CaSO 4)=9.1×10-6。
高中化学-第四课时 离子浓度大小比较10

OH–
因此:
为得到质子后的产物, 为失去质子后的产物,
c(H+) + c(CH3COOH) = c(OH–)
例1:在0.1 mol/L的NH3·H2O溶液中,关系正确的是
A.c (NH3·H2O) > c (OH–) > c (NH4+) > c (H+)
A B.c (NH4+) > c (NH3·H2O) > c (OH–) > c (H+)
七、电解质溶液中的守恒关系(考点)
3、质子(H+)守恒
电解质溶液中分子或离子得到或失去质子 (H+)的物质的量应相等。
如:NH4Cl溶液中 H3O+(H+) NH3·H2O、OH–、
因此:
为得到质子后的产物, 为失去质子后的产物,
c(H+) = c(NH3·H2O) + c(OH–)
如:CH3COONa溶液中
V1 > V2(填 “ > ”、“ < ” 或 “ = ” ),
各离子浓度由大到小的关系: c(Cl-) = c(NH4+) > c(H+) = c(OH-) 。
NH3·H2O 的电离 > NH4Cl 中NH4+的水解 【例6】V1 mL 0.1 mol/L 的氨水和 V2 mL 0.1
mol/L 的盐酸混合, c. 若V1 : V2 = 2:1,
c(Na+) > c(OH-) > c(HCO3-) > c(H+) C. Na2CO3 溶液:
c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) D. 25 ℃时,pH = 4.75、浓度均为0.1 mol/L 的
溶液中离子浓度大小比较专题强化训练

溶液中离子浓度大小比较专题强化训练一、关于水的电离的有关叙述:例1、100℃时纯水电离出的氢离子是25℃纯水电离出的氢离子的多少倍(已知:100℃时Kw=1×10-12;25℃时Kw=1×10-14( )A 10-2B 2倍C 102D 10倍练习1:25℃时PH=3的盐酸溶液中由水电离出c(H+)是PH=5的盐酸溶液中由水电离出的c(H+)的多少倍( )A 103B 10-2C 10-3D 2练习2:常温下某溶液由水电离出的c(H+)=1×10-11mol/L,则该溶液的PH值可能等于( ) A 11 B 3 C 8 D 7练习3:25℃时,PH=11的NaOH溶液和NaCN溶液中,由水电离出的c(H+)的关系( )A 相等B 后者是前者的11倍C 后者是前者的108 D前者是后者的108练习4:将固体苛性钠溶于水配成100mL溶液,当溶液中由水本身电离产生的c(OH-)=1×10-13mol/l,则加入的苛性钠的质量为( )A 0.8gB 0.4gC 4gD 40g练习5:下列四种溶液(1)pH=0的盐酸溶液(2)0.1mol/L的盐酸溶液(3)0.01mol/L的NaOH (4)pH=11的NaOH溶液由水电离出的c(H+)浓度之比( )A 1:10:100:1000B 0:1:11:11C 14:13:12:11D 100;10:1:0练习6:在由水电离出的c(H+)=10-13mol·L-1的溶液中,一定能大量共存的离子组是( )A、 K+、Fe2+、 Br-、 NO3-B、 Ba2+、Na+、Cl-、 NO3-C、 NH4+、Na+、HCO3-、SO42-D、 Na+、Al3+、NO3-、Cl-二、单一溶质溶液中离子浓度大小关系:例2、H2S溶液中,各离子浓度大小关系为________________________________________,例3、Na2S溶液中有哪些微粒?_________________________________________________,例4、在2mol/L的CH3COONa溶液中,存在哪些平衡?存在哪些守恒关系?练习7: 在NH4Cl溶液中,离子浓度大小排队正确的是( )A、c(NH4+)> c(Cl-)> c(OH-)> c(H+)B、c(Cl-)> c(NH4+)> c(OH-)> c(H+)C、c(Cl-)>c(NH4+)> c(H+)> c(OH-)D、 c(NH4+)> c(Cl-)> c(H+)> c(OH-)练习8:常温下,下列关于0.1mol/LNH4Cl溶液的说法正确的是( ) ①c(NH4+)=0.1mol·L-1 ; ②溶液中 c(H+)· c(OH-)=1.0×10-14 ;③水电离出来的 c(H+)= c(OH-); ④溶液的pH=1 ;⑤ c(OH-)= c(NH4+)+ c(H+)- c(Cl-); ⑥升高温度,溶液的pH增大;⑦加热蒸干溶液,将得不到固体物质; ⑧ c(NH4+)+ c(NH3·H2O)=0.1mol·L-1;⑨ c(OH-)+ c(NH3·H2O)= c(H+); ⑩ NH4Cl水解的离子方程式为: NH4++OH-== NH3·H2O、练习9: Na2S溶液中各种离子的物质的量浓度关系不正确的是( )A、c(Na+)>c(S2-)>c(OH-)>c(HS-)B、c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)C、c(Na+)=2c(HS-)+2c(S2-)+2c(H2S)D、c(OH-)=c(H+) + c(HS-)练习10、在0.1 mol·L-1的NaHCO3溶液中,下列关系式正确的是( )A、c(Na+)>c(HCO3-)>c(H+)>c(OH-)B、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-)C、c(Na+)=c(HCO3-)>c(OH-)>c(H+)D、c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-)练习11、已知某温度下0.1mol·L-1的NaHB(强电解质)溶液中c(H+)> c(OH-),则下列有关说法或关系式一定正确的是( )①HB-的水解程度小于HB-的电离程度;②c(Na+)=0.1mol·L-1≥ c(B2-);③溶液的pH=1;④ c(Na+)= c(HB-)+2 c(B2-)+ c(OH-)、A、①②B、②③C、②④D、①②③练习12、已知某酸的酸式盐NaHY的水溶液的pH=8,则下列说法中正确的是( )A、在Na2Y、NaHY、H2Y的溶液中,阴离子的种类不同B、NaHY的溶液中,离子浓度大小顺序为:c(Na+)> c(Y-)> c(HY-)> c(OH-)> c(H+)C、HY-的水解离子方程式为:HY-+H2O Y-+H3O+D、相同物质的量浓度的Na2Y和NaHY溶液,前者的pH大于后者三、两种溶液混合后不同离子浓度的比较:1、两种物质混合不反应:例4、用物质的量都是0.1 mol的CH3COOH与CH3COONa配成1 L混合溶液,已知其中c(CH3COO-)大于c(Na+),对该混合溶液下列判断正确的是( )A、c(H+)>c(OH-)B、c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1C、c(CH3COOH)>c(CH3COO-)D、c(CH3COO-)+c(OH-)=0.1 mol·L-1练习13、CH3COOH与CH3COONa等物质的量混合配制成稀溶液,pH值为4.7,下列说法错误的( ) A、CH3COOH的电离作用大于CH3COONa的水解作用 B、CH3COOH的存在抑制了CH3COONa的水解C、CH3COONa的水解作用大于CH3COOH的电离作用D、CH3COONa的存在抑制了CH3COOH的电离2、两种物质恰好完全反应:例5:100 mL 0.1 mol·L-1 醋酸与50 mL 0.2 mol·L-1 NaOH溶液混合,在所得溶液中( )A、c(Na+)>c(CH3COO-)>c(OH-)>c(H+)B、c(Na+)>c(CH3COO-)>c(H+)>c(OH-)C、c(Na+)>c(CH3COO-)>c(H+)=c(OH-)D、c(Na+)=c(CH3COO-)>c(OH-)>c(H+)练习14:在甲酸溶液中加入一定量NaOH溶液,恰好完全反应,对于生成的溶液,下列判断一定正确的是( )A、c(HCOO-)<c(Na+)B、c(HCOO-)>c(Na+)C、c(OH-)>c(HCOO-)D、c(OH-)<c(HCOO-)练习15:等体积等浓度的醋酸与NaOH溶液相混合,所得溶液中离子浓度由大到小的顺序是( )A、c(Na+)>c(Ac-)>c(OH-)>c(H+)B、c(Na+)=c(Ac-)>c(OH-)>c(H+)C、c(Na+)>c(OH-)>c(Ac-)>c(H+)D、c(Na+)>c(OH-)>c(H+)>c(Ac-)如果一定量的醋酸和氢氧化钠混合后,溶液的pH=7,则各离子浓度的关系为()A、c(Na+)>c(Ac-)B、c(Na+)=c(Ac-)C、c(Na+)<c(Ac-)D、c(OH-)>c(H+)3、两种物质反应,其中一种有剩余:例6、把0.02 mol·L-1 HAc溶液与0.01 mol·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( )A、c(Ac-)>c(Na+)B、c(HAc)>c(Ac-)C、2c(H+)=c(Ac-)+c(HAc)D、c(HAc)+c(Ac-)=0.01 mol·L-1例7、将0.2 mol·L-1 CH3COOK 与0.1 mol·L-1盐酸等体积混合后,溶液的pH<7,则溶液中下列微粒的物质的量浓度的关系正确的是( )A、c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH)B、c(CH3COO-)=c(Cl-)>c(CH3COOH)>c(H+)C、c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH)D、c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)练习16:将0.4mol/LNH4Cl溶液和0.2mol/LNaOH溶液等体积混合后,溶液中下列微粒的物质的量关系正确的是( )A 、c(NH4+)=c(Na+)=c(OH-)>c(NH3·H 2O)B、c(NH4+)=c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)C、c(NH4+)>c(Na+)>c(OH-)>c(NH3·H2O)D、c(NH4+)>c(Na+)>c(NH3·H2O) >c(OH-)>c(H+)4、未指明酸碱的强弱:例8、一元酸HA溶液中,加入一定量强碱MOH溶液后,恰好完全反应,反应后的溶液中,下列判断正确的是( )A.[A-]≥[M+] B.[A-]≤[M+]C.若MA不水解,则[OH-]<[A-] D.若MA水解,则[OH-]>[A-]练习17、实验测得常温下0.1mol/L某一元酸(HA)溶液的pH值等于1, 0.1mol/L某一元碱(BOH)溶液里[H+]/[OH-]=10-12、将此两种溶液等体积混合后,所得溶液呈的各离子的浓度由大到小排列的顺序是( )A.[B+]>[A-]>[OH-]>[H+] B.[A-]>[B+]>[H+]>[OH-]C.[B+]=[A-]>[H+]=[OH-] D.[B+]>[A-]>[H+]>[OH-] 5、pH之和等于14的酸和碱溶液的混合:例9、将pH=3的盐酸和pH=11的氨水等体积混合后溶液呈_____性,溶液中c(NH4+)与c(Cl-)的大小关系是___________________;练习18:将pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后,所得的混合溶液中,下列关系式正确的是( )A、 c(Na+)>c(CH3COO-)>c(H+) >c(OH-)B、 c(CH3COO-)>c(Na+)>c(H+)>c(OH-)C、 c(CH3COO-)>c(H+)>c(Na+)>c(OH-)D、c(CH3COO-)>c(Na+)> c(OH-) >c(H+)练习19:将pH=2的盐酸与pH=12的氨水等体积混合,在所得的混合溶液中,下列关系式正确的是( )A、c(Cl-)>c(NH4+)>c(OH-)>c(H+)B、c(NH4+)>c(Cl-)> c(OH-)>c(H+)C、c(Cl-)=c(NH4+)>c(H+)=c(OH-)D、c(NH4+)>c(Cl-)>c(H+)>c(OH-)四、不同物质相同离子浓度的比较:练习20:物质的量浓度相同的下列溶液①(NH4)2CO3 ② (NH4)2SO4 ③NH4HCO3④NH4HSO4⑤NH4Cl ⑥NH3·H2O;按c(NH4+)由小到大的排列顺序正确的是( )A.③⑤④⑥①③B.⑥③⑤④①②C.⑥⑤③④①②D.⑥③⑤④②①高考模拟:1.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A H++HA-,HA-H++A2-已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:A.0.01 mol·L-1的H2A溶液B.0.01 mol·L-1的NaHA溶液C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液据此,填写下列空白(填代号):(1) c(H+)最大的是,最小的是。
高中化学(新人教版)选择性必修一同步习题:溶液中粒子浓度的大小关系(同步习题)【含答案及解析】

专题强化练3 溶液中粒子浓度的大小关系1.(2020湖南益阳高二上期末,)有关醋酸钠溶液中离子浓度大小的比较,下列关系式中正确的是( )A.c(CH3COO-)>c(Na+)B.c(Na+)=c(CH3COO-)+c(OH-)C.c(Na+)=c(CH3COOH)+c(CH3COO-)D.c(Na+)=c(CH3COO-)2.(2020浙江台州高二上期末,)下列关于盐类水解的说法错误的是(深度解析)A.pH相等的①NaHCO3溶液、②Na2CO3溶液、③NaOH溶液,其溶质的物质的量浓度大小顺序为①>②>③B.浓度均为0.1 mol·L-1的①(NH4)2CO3溶液、②(NH4)2SO4溶液、③NH4HCO3溶液中,c(N H4+)的大小顺序为②>①>③C.0.2 mol·L-1的CH3COONa溶液中c(OH-)是0.1 mol·L-1的CH3COONa溶液中c(OH-)的2倍D.0.1 mol·L-1的NaX、NaY、NaZ溶液的pH依次增大,可得出HX、HY、HZ的酸性依次减弱3.(2020广西北海中学高二上期末,)乙酸钙[(CH3COO)2Ca·H2O]常用作食品稳定剂和抑霉剂,下列有关0.1 mol·L-1乙酸钙溶液中粒子浓度的比较中不正确的是( )A.c(H+)+2c(Ca2+)=c(CH3COO-)+c(OH-)B.c(OH-)=c(H+)+c(CH3COOH)C.c(CH3COO-)>c(Ca2+)>c(OH-)>c(H+)D.c(CH3COO-)+c(CH3COOH)=0.1 mol·L-14.(2020福建泉州高二上期末,)25 ℃时,Na2SO3溶液吸收SO2,溶液pH随n(S O32-)∶n(HS O3-)变化的关系如下表,以下离子浓度关系的判断正确的是( )n(S O32-)∶n(HS O3-) 91∶91∶19∶91pH 8.2 7.2 6.2A.NaHSO3溶液中c(H+)<c(OH-)B.Na2SO3溶液中c(Na+)>c(S O32-)>c(HS O3-)>c(OH-)>c(H+)C.当吸收液中n(S O32-)∶n(HS O3-)=1∶1时,c(Na+)=c(S O32-)+c(HS O3-)D.当吸收液呈中性时,c(Na+)>c(HS O3-)+c(S O32-)5.(2020湖南张家界高二上期末,)常温下,下列关于溶液中粒子浓度大小关系的说法正确的是(易错)A.0.1 mol/L Na2CO3溶液中:c(Na+)=2c(C O32-)+c(HC O3-)+c(H2CO3)B.0.1 mol/L NH4Cl溶液和0.1 mol/L NH3·H2O溶液等体积混合后的溶液中:c(Cl-)>c(N H4+)>c(OH-)>c(H+)C.醋酸钠溶液中滴加醋酸溶液,则混合溶液一定有:c(Na+)<c(CH3COO-)D.0.1 mol/L NaHS溶液中:c(OH-)+c(S2-)=c(H+)+c(H2S)6.()常温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
化学二轮题型必练——不同溶液中离子浓度大小的比较

2020届高考化学二轮题型对题必练——不同溶液中离子浓度大小的比较1.关于水溶液中的离子平衡,下列说法正确的是A. 往稀溶液中加入NaOH固体,溶液中变大B. 等物质的量浓度的 、 、 三种溶液中,的大小顺序为:C. 常温下的溶液和的NaOH溶液等体积混合,溶液中离子浓度大小顺序为:D. 的溶液中:2.下列说法正确的是A. 相同物质的量浓度的下列溶液中,、、、;由大到小的顺序:B. 某物质的溶液中由水电离出的,若时,则该溶液的pH一定为C. 物质的量浓度相等的和NaHS混合溶液中:D. AgCl悬浊液中存在平衡:,往其中加入少量NaCl粉末,平衡会向左移动,溶液中离子的总浓度会减小3.已知HA的酸性弱于HB的酸性。
时,用NaOH固体分别改变物质的量浓度均为的HA溶液和HB溶液的溶液的体积变化忽略不计,溶液中、的物质的量浓度的负对数与溶液的pH的变化情况如图所示。
下列说法正确的是()A. 曲线Ⅰ表示溶液的pH与的变化关系B.C. 溶液中水的电离程度:D. N点对应的溶液中点对应的溶液中4.某温度下,某二元弱碱的、,向稀溶液中滴加等物质的量浓度的盐酸,、、的物质的量分数与溶液的变化关系如图所示。
下列说法正确的是A. 交点a处对应加入盐酸的体积为B. 当加入盐酸的体积为时,存在C. 交点b处D. 当加入盐酸的体积为时,存在5.剧毒物氰化钠固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。
已知部分弱酸的电离平衡常数如下表:下列选项错误的是A. 向NaCN溶液中通入少量的发生的离子反应为:B. 处理含废水时,如用NaOH溶液调节pH至9,此时C. 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者D. 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者6.下列说法正确的是A. 等物质的量浓度的溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为B. 常温下电离常数为Ka的酸HA的溶液中C. 常温下同浓度的强酸和强碱溶液等体积混合后,由水电离出的D. 已知298K时氢氰酸的,碳酸的、,据此可推测出将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生7.已知常温下氢硫酸的电离平衡常数为,。
高中化学离子浓度大小比较练习题 附答案

高中化学离子浓度大小比较练习题附答案1. 将0.5mol/L的NaCl溶液和0.3mol/L的CaCl2溶液混合,哪个离子浓度更大?答:Ca2+离子浓度更大。
2. 将0.3mol/L的Na2SO4溶液和0.4mol/L的NaCl溶液混合,哪个离子浓度更大?答:Na+离子浓度相同。
3. 将0.2mol/L的K2SO4溶液和0.1mol/L的MgSO4溶液混合,哪个离子浓度更大?答:SO42-离子浓度相同。
4. 将0.1mol/L的Na3PO4溶液和0.2mol/L的Na2SO4溶液混合,哪个离子浓度更大?答:Na+离子浓度更大。
5. 将0.4mol/L的NaCl溶液和0.2mol/L的KCl溶液混合,哪个离子浓度更大?答:Cl-离子浓度相同。
6. 将0.3mol/L的Ca(NO3)2溶液和0.2mol/L的Na2CO3溶液混合,哪个离子浓度更大?答:Ca2+离子浓度更大。
7. 将0.1mol/L的NaOH溶液和0.2mol/L的HCl溶液混合,哪个离子浓度更大?答:H+离子浓度更大。
8. 将0.2mol/L的K2CO3溶液和0.1mol/L的CaCl2溶液混合,哪个离子浓度更大?答:CO32-离子浓度更大。
9. 将0.3mol/L的NaCl溶液和0.1mol/L的MgCl2溶液混合,哪个离子浓度更大?答:Cl-离子浓度相同。
10. 将0.2mol/L的FeSO4溶液和0.1mol/L的MgSO4溶液混合,哪个离子浓度更大?答:SO42-离子浓度相同。
11. 将0.1mol/L的Na3PO4溶液和0.2mol/L的Ca(NO3)2溶液混合,哪个离子浓度更大?答:Na+离子浓度更大。
12. 将0.3mol/L的KCl溶液和0.1mol/L的CaCl2溶液混合,哪个离子浓度更大?答:Cl-离子浓度相同。
13. 将0.2mol/L的Na2CO3溶液和0.1mol/L的NaOH溶液混合,哪个离子浓度更大?答:Na+离子浓度更大。
高中化学《离子浓度大小比较》专题讲解及例题分析

离子浓度大小比较专题一、电离理论和水解理论1.电离理论:⑴弱电解质的电离是微弱的,电离消耗的电解质及产生的微粒都是少量的,同时注意考虑水的电离的存在;例如NH3·H2O溶液中微粒浓度大小关系。
【分析】由于在NH3·H2O溶液中存在下列电离平衡:NH3·H2O NH4++OH-,H2O H++OH-,所以溶液中微粒浓度关系为:c(NH3·H2O)>c(OH-)>c(NH4+)>c(H+)。
⑵多元弱酸的电离是分步的,主要以第一步电离为主;例如H2S溶液中微粒浓度大小关系。
【分析】由于H2S溶液中存在下列平衡:H2S HS-+H+,HS-S2-+H+,H2O H++OH-,所以溶液中微粒浓度关系为:c(H2S)>c(H+)>c(HS-)>c(OH-)。
2.水解理论:⑴弱酸的阴离子和弱碱的阳离子因水解而损耗;如NaHCO3溶液中有:c(Na+)>c(HCO3-)。
⑵弱酸的阴离子和弱碱的阳离子的水解是微量的(双水解除外),因此水解生成的弱电解质及产生H+的(或OH-)也是微量,但由于水的电离平衡和盐类水解平衡的存在,所以水解后的酸性溶液中c(H+)(或碱性溶液中的c(OH-))总是大于水解产生的弱电解质的浓度;例如(NH4)2SO4溶液中微粒浓度关系。
【分析】因溶液中存在下列关系:(NH4)2SO4=2NH4++SO42-,+2H2O 2OH-+2H+,2NH3·H2O,由于水电离产生的c(H+)水=c(OH-)水,而水电离产生的一部分OH-与NH4+结合产生NH3·H2O,另一部分OH-仍存在于溶液中,所以溶液中微粒浓度关系为:c(NH4+)>c(SO42-)>c(H+)>c(NH3·H2O)>c(OH-)。
⑶一般来说“谁弱谁水解,谁强显谁性”,如水解呈酸性的溶液中c(H+)>c(OH-),水解呈碱性的溶液中c(OH-)>c(H+);⑷多元弱酸的酸根离子的水解是分步进行的,主要以第一步水解为主。
高中化学-溶液中粒子浓度大小比较

【练3】常温下,Ka1(H2C2O4)=10-1.3,Ka2(H2C2O4)=10-4.2。 用0.1000 mol/L NaOH溶液滴定10.00 mL 0.1000 mol/L H2C2O4溶 液所得滴定曲线如图。
A.点①所示溶液中:c(Na+) >c(HC2O4-)>c(H2C2O4)>c(C2O42-)
13
四、酸碱中和滴定曲线分析
【例1】室温时,用0.1mol/L NaOH溶液滴定20 mL 0.1mol/L HA溶液, (1)Ka(HA)=? Ka(HA)的数量级为? (2)点溶液中各粒子 浓度大小?
(3)点溶液中各粒子 浓度大小?
(4)五点中水的电离程度大小? 点—点:水的电离程度逐渐增大 点之后:水的电离程度逐渐减小
物料守恒关系式:c(NH4+)+ c(NH3·H2O)=2c(Cl-)
5【注意】NH3·H2O 的电离程度 > NH4Cl 中NH4+的水解程度
(5)0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合, 所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)。( )
14
【练1】化学上常用AG表示溶液中的lg c(OH-)/c(H+)。25 ℃时,用 0.100 mol/L的NaOH溶液滴定20.00 mL 0.100 mol/L的HNO2溶液, AG与所加NaOH溶液的体积(V)的关系如图所示,
B.25 ℃时,HNO2的电离常 数Ka≈1.0×10-4.5
C.b点溶液中存在2c(H+)- 2c(OH-)=c(NO2-)-c(HNO2)
【例1】V1 mL 0.1 mol/L 的氨水和 V2 mL 0.1mol/L 的盐酸混合, (1)若 V1 = V2, 所得溶液中溶质为 NH4Cl ,溶液呈 酸 性,
高中化学复习考点知识专题训练43---溶液中离子浓度的大小比较(含答案解析)

D.向 0.1mol·L-1 的氨水中加入少量硫酸铵固体,则溶液中 c(OH-)/c(NH3·H2O)增大
7.物质的量浓度相同的下列溶液:①
Na2CO3 ②
NaHCO3 ③
H2CO3 ④
( NH4
) 2
CO3
按
c(CO32− ) 由小到大顺序排列正确的是( )
A.④<③<②<①
B.③<②<①<④
C.③<②<④<①
c(CH3COO- )- C(CH3COOH) =[2 × (10-4 –l0-10)] mol • L-1
D.室温时,加水稀释 0.1 mol • L-1 CH3COONa 溶液,溶液中 c(CH3COOH) • C(OH)/C(CH3COO- )的值不断增大
11.将 10 mL0.2 mol/L 氨水和 10 mL0.1 mol/L 盐酸混合后,溶液里各种离子物质的量浓 度的关系是 ( )
( ) ( ) ( ) D. c H+ + c (H2RO3 ) = c RO32− + c OH−
( 13.四甲基氢氧化铵
( CH3
) 4
NOH
是强碱,常温下甲胺
CH3 NH2 ⋅ H2O) 的电离常数为
Kb ,且 pKb = -lgKb =3.38 。常温下,在体积均为 20 mL、浓度均为 0.1 mol ⋅ L-1 的四甲基
A. c (OH-) = c( NH+4 ) + c (H+)
B.
c
(Cl-)>
c(
NH
+ 4
)>
c
(H+)
>
c
(OH-)
C.
c(
高中化学复习知识点:盐溶液中离子浓度大小的比较

高中化学复习知识点:盐溶液中离子浓度大小的比较一、单选题1.常温下,用0.0100 mol/L 的NaOH 溶液滴定10. 00 mL 0.0100 mol/L 的二元酸H 2A ,滴定过程中加入NaOH 溶液的体积(V)与溶液中的()()c H lg c OH -+关系如图所示,下列说法正确的是( )A .H 2A 的电离方程式为:H 2A=A 2-+2H +B .B 点显酸性的原因是HA 的电离程度大于其水解程度C .C 点溶液显中性,所以 c (Na +)=c (A 2-) +c (HA -)D .常温下K h (Na 2 A)的数量级约为10-42.将浓度均为0.5mol·L -1的氨水和KOH 溶液分别滴入到两份均为20mLc 1mol·L -1的AlCl 3溶液中,测得溶液的导电率与加入碱的体积关系如图所示。
下列说法正确的是A .c 1=0.2B .b 点时溶液的离子浓度:c(C1-)>c(NH 4+)>c(OH -)>c(H +)C .ac 段发生的反应为:A1(OH)3+OH -==[Al(OH)4]-D .d 点时溶液中:c(K +)+c(H +)==[Al(OH)4]-+c(OH -)3.25℃时,向20mL0.1mol·L -1四氯金酸( HAuCl 4)溶液中滴加0.1mol·L -1NaOH 溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随pH 变化关系如图2,则下列说法不正确的是A .b 点溶液中存在关系:2c(H +)+ c(HAuCl 4)=2c(OH -)+ c(AuCl 4-)B .X 点描述的是滴定曲线中b 点含氯微粒的物质的量分数δ与pH 的关系C .c 点溶液中存在关系:c(Na +)=c(AuCl 4-)D .d 点时,溶液中微粒浓度的大小关系为c(Na +)>c(AuCl 4-)>c(OH -)>c(H +)4.向某Na 2CO 3、NaHCO 3的混合溶液中加入少量的BaCl 2,测得溶液中2-32-3c(CO )lg c(HCO )与2+-lgc(Ba )的关系如图所示,下列说法正确的是A .该溶液中-233-2-33c(H CO )c(HCO )>c(HCO )c(CO )B .B 、D 、E 三点对应溶液pH 的大小顺序为B>D>EC .A 、B 、C 三点对应的分散系中,A 点的稳定性最差D .D 点对应的溶液中一定存在2c(Ba 2+ ) +c(Na + )+c(H + )=c(CO 32- )+c(OH - )+c(Cl - ) 5.一定温度下,测定某溶液中只含NH 4+、Cl -、H +、OH -四种离子,下列说法一定正确的是A .溶液中四种粒子之间满足:c(Cl -)>c(H +)>c(NH 4+)>c(OH -)B .若溶液中粒子间满足:c(NH 4+)>c(Cl -)>c(OH -)>c(H +),则溶液中溶质为:NH 3·H 2O 和NH 4ClC .若溶液中粒子间满足:c(Cl -)>c(NH 4+)>c(H +)>c(OH -),则溶液中溶质只有NH 4ClD .若溶液中c(NH 4+)= c(Cl -),则该溶液pH 等于76.25 ℃时,用0.1 mol/LNaOH 溶液滴定某二元弱酸H 2A,H 2A 被滴定分数、pH 及物种分布分数()()()-2-2n(x)δδ(x)=n H A +n HA +n A ⎡⎤⎢⎥⎢⎥⎣⎦如图所示:下列说法错误的是A .用NaOH 溶液滴定0.1 mol·L -1NaHA 溶液可用酚酞作指示剂B .0.1 mol·L -1NaA 溶液中: ()()()+-2-c Na <c HA +2c A C .0.1 mol·L -1NaHA 溶液中: ()()()()+-2-2c Na>c HA >c A >c H A D .H 2A 的K 2=1×10-7 7.常温下,向100mL 0.1mol/L 的H 2A 溶液中滴加0.1mol/LNaOH 溶液,含A 元素相关微粒物质的量随pH 的变化如图所示。
离子浓度大小比较专题训练

离子浓度大小比较专题训练考纲要求:它能掌握强弱电解质、电离平衡、水的电离、溶液的pH、离子反应、盐类水解等基本概念。
掌握程度及对这些知识的综合运用能力。
知识精讲:一、离子浓度关系一顺序:大小顺序:①给出量大的>给出量小的。
如Na2CO3溶液中c(Na+)>c(CO32-);②直接给出的>过程产生的。
电离和水解过程一般较微弱,产生的离子的浓度一般都较小。
如氯化铵溶液中c(Cl-)和c(NH4+)一定大于电离或水解产生的c(H+)和c(OH-)。
③主要过程产生的>次要过程产生的。
碳酸氢钠溶液中,碳酸氢根离子即能发生电离又能发生水解,但水解程度大于电离程度,故c(H+)<c(OH-)。
三守恒:理解三种守恒关系以0.1mol/LNa2CO3溶液为例,分析在存在的反应有(写离子方程式)1、大小顺序:。
2、电荷守恒:。
3、物料守恒:考虑水解前后C元素守恒,。
4、质子守恒:由水电离出的c(H+)水=c(OH―)水。
得质子守恒关系为:二、解题思路:确定溶质成分→书写发生的过程方程式→确定过程的主次→排出离子浓度大小顺序.三、典型题型:Ⅰ、单一溶液离子浓度比较:1、弱酸或弱碱溶液例1、在0.1mol/L的H2S溶液中,下列关系错误的是()A.c(H+)=c(HS-)+c(S2-)+c(OH-)B.c(H+)=c(HS-)+2c(S2-)+c(OH-)C.c(H+)>[c(HS-)+c(S2-)+c(OH-)]D.c(H2S)+c(HS-)+c(S2-)=0.1mol/L例2、室温下,0.1mol/L 的氨水溶液中,下列关系式中不正确的是( )A. c(OH -)>c(H +)B.c(NH 3·H 2O)+c(NH 4+)=0.1mol/L C.c(NH 4+)>c(NH 3·H 2O)>c(OH -)>c(H +) D.c(OH -)=c(NH 4+)+c(H +)2、一元强酸弱碱盐或弱酸强碱盐溶液: 例3、 CH 3COONa 溶液中存在如下关系:大小顺序: 电荷守恒: 物料守恒: 质子守恒: 跟踪练习:在氯化铵溶液中,下列关系正确的是( )A.c(Cl -)>c(NH 4+)>c(H +)>c(OH -)B.c(NH 4+)>c(Cl -)>c(H +)>c(OH -)C.c(NH 4+)=c(Cl -)>c(H +)=c(OH -) D.c(Cl -)=c(NH 4+)>c(H +)>c(OH -)3、多元强酸弱碱盐或弱酸强碱盐溶液: 例4、Na 2S 溶液中存在如下关系:大小顺序: 电荷守恒: 物料守恒: 质子守恒: 4.多元弱酸酸式盐溶液:①以水解为主呈碱性的:NaHCO 3 、NaHS 、Na 2HPO 4等; ②以电离为主呈酸性的:NaHSO 4 、NaHSO 3、NaH 2PO 4等。
离子浓度大小比较专题(有答案)

离子浓度大小比较专题1、在0.1mol/L 的NH 3·H 2O 溶液中,下列关系正确的是( A )A 、C(NH 3·H 2O)>C(OH -)>C(NH 4+)>C(H +)B 、C(NH 4+)>C(NH 3·H 2O)>C(OH -)>C(H +)C 、C(NH 3·H 2O)>C(NH 4+)= C(OH -)>C(H +)D 、C(NH 3·H 2O) >C(NH 4+)>C(H +)>C(OH -)2、在氯化铵溶液中,下列关系式正确的是【 A 】A .C (Cl -)>C(NH 4+)>C(H +)>C(OH -)B .C(NH 4+)>C (Cl -)>C(H +)>C(OH -)C .C (Cl -)=C(NH 4+)>C(H +)=C(OH -)D .C(NH 4+)=C (Cl -)>C(H +)>C(OH -)3、在Na 2S 溶液中存在多种微粒,下列关系正确的是【 B 】A .C(OH -) = C (HS -)+ C(H +) + C(H 2S) B. C(OH -) = C (HS -)+ C(H +)+2 C(H 2S)C .C(Na +) = C(S 2-)+ C (HS -) + C(H 2S)D .C(Na +) = C(S 2-)+ C (HS -)+2 C(H 2S)4、用物质的量都是0.1 mol 的CH 3COOH 和CH 3COONa 配制成1L 混合溶液,已知其中C(CH 3COO -)>C(Na +),对该混合溶液的下列判断正确的是【B 】A .C(H +)<C(OH -)B .C(CH 3COOH)+C(CH 3COO -)=0.2mol/LC .C(CH 3COOH)>C(CH 3COO -)D .C(CH 3COO -)+C(OH -)=0.2 mol/L5、某二元弱酸的酸式盐NaHA 溶液,若PH< 7, 则下列关系不正确的是【 B 】A .C(Na +)>C(HA -)> C(H +)>C(A 2-)> C(OH -) B. C(H +) + C(A 2-) = C(OH -)+ C(H 2A)C .C(Na +)+ C(H +) = C(HA -)+2 C(A 2-)+ C(OH -)D .C(Na +)= C(HA -) +C(H 2A) + C(A 2-)6、标准状况下,向3mol/L 的NaOH 溶液100 ml 中缓缓通入4.48LCO 2气体,充分反应后溶液中离子浓度大小排列顺序正确的是【 D 】A. C(Na +) > C(CO 32-) > C(HCO 3-) > C(OH -) > C(H +-)B. C(Na +) > C(CO 32-) = C(HCO 3-) > C(OH -) > C(H +-)C. C(Na +) > C(HCO 3-) > C(OH -) > C(CO 32-) > C(H +-)D. C(Na +) > C(HCO 3-) > C(CO 32-) > C(OH -) > C(H +-)7、某酸式盐NaHY 的水溶液显碱性,下列叙述正确的是【 C 】A .H 2Y 的电离方程式:H 22H + + Y 2-B .HY - 离子水解方程式:HY - + H 23O + + Y 2-C .该酸式盐溶液中离子浓度关系C(Na +) 〉C(HY -) 〉C(OH -) 〉C(H +)〉C(Y 2-)D .该酸式盐溶液中离子浓度关系C(Na +) 〉C(HY -) 〉C(OH -)〉C(Y 2-) 〉C(H +)8、用物质的量都是0.01mol 的HCN 和NaCN 配成1L 混合溶液,已知其中C(CN -)<C(Na +),对该溶液的下列判断不正确的是( A )A 、C(H +)>C(OH -)B 、C(OH -)>C(H +)C 、C(HCN)>C(CN -)D 、C(HCN)+ C(CN -)=0.02mol/L。
高中化学盐溶液中的离子浓度大小比较专项练习(附答案)

2020年03月21日高中化学盐溶液中的离子浓度大小比较专项练习学校:___________考号:___________注意事项:注意事项:1 2、请将答案正确填写在答题卡上第1卷一、单选题-)=0.1mol 的HA 、NaA 混合物溶于水形成1 L 溶液,溶液中c (HA)、c (A -)与pH 的关系如图所示。
下列叙述中正确的是( )A.a 线表示的是c (A -)的变化B.pH=6 时,c (Na +)+c (HA)>0.1 mol/LC.298 K 时,A -的水解平衡常数(K h )的数量级为10-10D.若将等物质的量的HA 、NaA 溶于水中,所得溶液pH 恰好为4.752.常温下,某化学学习小组对某些电解质溶液作出如下分析。
其中正确的是( ) ①将1mL pH=3的强酸溶液加水稀释至100mL 后,溶液的pH=1②1L 0.50mol·L -1的NH 4Cl 溶液与2L 0.25mol·L -1的NH 4Cl 溶液相比,前者所含+4NH 的物质的量大③pH=8.3的NaHCO 3溶液:[Na +]>[-3HCO ]>[2-3CO ]>[H 2CO 3]④pH=4、浓度均为0.1mol·L -1的CH 3COOH 、CH 3COONa 的混合溶液:[CH 3COO -]-[CH 3COOH]=2×(10-4-10-10)mol·L -1A.①②B.②③ C .①③ D.②④3.将0.2mol·L -1NaHCO 3溶液与0.1mol·L -1KOH 溶液等体积混合,下列关于所得溶液的关系式正确的是( )A.0.2mol·L -1=c(HCO 3-)+c(CO 32-)+c(H 2CO 3) B.c(Na +)>c(K +)>c(HCO 3-)>c(CO 32-)>c(OH -)>c(H +)C.c(OH-)+c(CO32-)=c(H+)+c(H2CO3)+0.1mol·L-1D.3c(K+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)4.室温下向10mL 0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
(完整word版)高中化学离子浓度大小比较练习题(附答案).doc

高中化学离子浓度大小比较练习题一、单选题1.25 C°时, H2 CO3,的 K al =4. 2 10-7 , K a2 =5. 6 10-11。
室温下向 10 mL0. 1 mol L-1 Na 2 CO3中逐滴加入 0. 1 mol L-1 HCl 。
图是溶液中含 C 微粒物质的量分数随 pH 降低而变化的图像( CO2因有逸出未画出)。
下列说法错误的是( )A.A 点溶液的pH<11B.B点溶液: c Na+ =c HCO3- +c CO32- +c H2 CO3C.A →B的过程中,离子反应方程式为:CO23-H +HCO 3D.分步加入酚酞和甲基橙,用中和滴定法可测定Na 2CO 3,与 NaHCO 3,混合物组成- 1- 12.实验测得0.5mol ·L CH 3COONa 溶液、 0.5mol L· CuSO4溶液以及 H 2O 的 pH 随温度变化的曲线如图所示。
下列说法正确的是( )A. 随温度升高,纯水中c(H +)>c(OH - )B.随温度升高, CH3COONa 溶液的 c(OH - )减小C.随温度升高, CuSO4溶液的 pH 变化是 K w改变与水解平衡移动共同作用的结果D.随温度升高, CH3COONa 溶液和 CuSO4溶液的 pH 均降低,是因为 CH 3COO -、 Cu 2+水解平衡移动方向不同3.25 C°时,改变0. 1 mol/L弱酸RCOOH溶液的pH,溶液中RCOOH 分子的物质的量分数δRCOOH 随之改变 [ 已知δ(RCOOH )=c(RCOOH )- ] ,甲酸(HCOOH) 与丙酸c(RCOOH )+c( RCOO )(CH 3CH 2COOH ) 溶液中 δRCOOH 与 pH 的关系如图所示。
下列说法正确的是( )A. 图中 M 、 N 两点对应溶液中的c(OH - ) 比较:前者 >后者B.丙酸的电离常数 K= 104.88C.等浓度的 HCOONa 和 CH 3 CH 2 COONa 两种榕液的pH 比较:前者 > 后者D. 将 0. 1 mol/L 的 HCOOH 溶液与 0. 1 mol/L 的 HCOO-Na 溶 液 等 体 积 混 合 , 所 得 溶 液中 :c Na >c HCOOH >c HCOO - >c OH ->c H +4.常温下 ,Ksp(CaF 2)=4 × 10 -9,K sp (CaSO 4 )=9.1×10 -6。
高中化学每日一练--离子浓度大小

每日一练•■离子浓度大小1. CH3COOH、H2CO3、H2SO3的电离常数如表所示。
(1)①NaHSOs溶液中电荷守恒表达式_____②NaHSO3溶液中各离子浓度大小顺序:(2)_________________________________________ ①用离子方程式表示Na2C03溶液碱性的原因______________________②写出Na2C03溶液中物料守恒表达式 ____③写出NaHCO3溶液中质子守恒表达式_____(3)常温下,物质的量浓度相同的以下溶液:①NHK1②NH4HCO3③(NH.J)2S04 ④NH4HSO4⑤(NH4)2Fe (SO4)2溶液中c (NH4+)从大到小排列顺序为 ______ (填序号)(4)常温下,物质的量浓度均为O.lniol/L的六种溶液①NaOH、②NaCK @Na2C03.④H2SO3、⑤CH3COONa.⑥H2SO4, pH从大到小排列顺序为 ____ (填序号)(5)常温时,AIC13的水溶液呈酸性,原因是(用离了方程式表示): ____ 将A1C13溶液蒸干,灼烧,最后得到的固体产物主要是 ____ (填化学式)(6)证明CH3COOH是弱电解质的简单且可行的方法是:(7) _______ 以下混合溶液中,各离了浓度的大小顺序或等量关系正确的选项是A.10 mL 0.1 mol/L 氨水与10 mL 0.1 mol/L 盐酸混合:c (Cl ) >c (NH「)>C (OH ) >c (H )B.10 mL 0.1 mol/L NH4CI 溶液与5 mL 0.2 mol/L NaOH 溶液混合:c (Na*) =c (CD >c (OH ) >c (H )C.10 mL 0.1 mol/L CH3COOH 溶液与5 mL 0.2 mol/L NaOH 溶液混合:c (Na*) =c (CH3COC) >c (OH ) >c(H+)D.10 mL 0.5 moi/L CHsCOONa 溶液与6 mL 1 moi/L 盐酸混合:c (C「)>c (Na ) >c (OH- ) >c (H )+ 2E.在NaHSOi 溶液中,c (H ) =c (OH ) +c (SOi。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
.离子浓度大小比较专练1(07年山东理综·14)氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是A .在通入少量氯气,)()(-+ClO c H c 减小 B .通入少量SO 2,溶液的漂白性增强C .加入少量固体NaOH ,一定有c(Na +)=c(Cl -)+c(ClO -)D .加入少量水,水的电离平衡向正反应方向移动解析:在氯水中存在如下平衡:Cl 2+H 2O 错误!未找到引用源。
HCl +HClO 、H 2O 错误!未找到引用源。
H ++OH -、HClO 错误!未找到引用源。
H ++ClO -。
A 中在通入少量氯气,平衡右移,生成的次氯酸和盐酸增多,氢离子浓度增大有两个方面原因,次氯酸浓度增大和盐酸完全电离,而次氯酸根的增大只受次氯酸浓度增大的影响,故该值增大,错误;B 中通入二氧化硫,其与氯气反应生成无漂白性的盐酸和硫酸,漂白性减弱,错误;C 中加入少量固体氢氧化钠反应后的溶液仍是电中性的,但酸碱性不为中性,应为弱酸性。
溶液中阴阳离子所带正负电荷总数相等,故存在c(H +)+c(Na +)=c(OH -)+c(Cl -)+c(ClO -),但是c(H +)应该大于c(OH -),故此等式不成立,错误;D 中加水,即稀释氯水溶液的酸性减弱,即c(H +)减小,所以水的电离平衡向正向移动,正确。
答案:D2.(07年广东化学·15)下列各溶液中,微粒的物质的量浓度关系正确的是A .0.1mol·L -1 Na 2CO 3溶液:c (OH -)=c (HCO 3-)+c (H +)+2c (H 2CO 3)B .0.1mol·L -1NH 4Cl 溶液:c (NH 4+)=c (Cl -)C .向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c (Na +)>c (CH 3COO -)>c (H +)>c (OH -)D .向硝酸钠溶液中滴加稀盐酸得到的pH =5的混合溶液:C (Na +)=c (NO 3-)解析:溶液中离子浓度大小比较要综合运用电离平衡,盐类水解知识,要记住三个守恒:电荷守恒、物料守恒、质子守恒。
A根据质子守恒,水电离出的H+和OH-的物质的量相等,Na2CO3溶液中H+分别以HCO3-、H+、H2CO3形式存在,故A对,B中由于NH4+水解,c(NH4+与c(Cl-)不等,B错,C中根据电荷守恒有:c(Na+)+ c(H+)==c(OH-)+ c(CH3COO-),因为c(H+)>c(OH-),故c(CH3COO-)>c(Na+),C错。
D中Na+、NO3-不水解加入稀盐酸后二者的物质的量浓度比仍是1:1,故D对。
答案:AD3.(08年广东化学·17)盐酸、醋酸和碳酸氢钠是生活中常见的物质。
下列表述正确的是A.在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH-B.NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-)C.10 mL0.10 mol·L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中离子的浓度由大到小的顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)D.中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同解析:A中,生成Na2CO3溶液,CO32-会发生水解,生成HCO3-,所以A错;电荷守恒:C(H+)+C(Na+)=C(HCO3-)+2C(CO32-)+C(OH-)物料守恒:C(Na+)=C(HCO3-)+C(CO32-)+C(H2CO3)两式相减得:C(H+)+C(H2CO3)=C(CO32-)+C(OH-) 所以B错误。
C中,生成NaAc,Ac-水解呈碱性,故C正确;相同PH,相同体积的HCl和HAc,因为HAc为弱酸,所以HAc的物质的量浓度大,HAc所消耗的NaOH的物质的量多,D错。
答案:C4.(08年江苏化学·12)下列溶液中有关物质的量浓度关系正确的是A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) == c(OH-) + c(A-) B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)解析:选项A中根据电荷守恒,此关系式正确;选项B中pH相等,溶液中的c(OH -)相等,根据酸性越弱,水解越强,所以溶液中c(Na2CO3)<c(CH3COONa);选项C 中根据电荷守恒得:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)……①,由于c(CH3COOH)=c(CH3COONa),且它们等体积混合,由原子守恒得:2c(Na+)=c(CH3COO-)+c(CH3COOH)……②,将①×2-②得:c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH);选项D中NaHA溶液的pH=4,溶液呈酸性,即c(H+)>c(OH-),同时也可以判断HA-以电离为主,所以离子浓度的大小顺序是:c(HA-)>c(A2-)>c(H+)>c(H2A)。
答案:A、C5.(08年江苏化学·12)下列溶液中有关物质的量浓度关系正确的是A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) == c(OH-) + c(A-) B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH)D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)解析:选项A中根据电荷守恒,此关系式正确;选项B中pH相等,溶液中的c(OH -)相等,根据酸性越弱,水解越强,所以溶液中c(Na2CO3)<c(CH3COONa);选项C 中根据电荷守恒得:c(H+)+c(Na+)=c(OH-)+c(CH3COO-)……①,由于c(CH3COOH)=c(CH3COONa),且它们等体积混合,由原子守恒得:2c(Na+)=c(CH3COO-)+c(CH3COOH)……②,将①×2-②得:c(CH3COO-) +2c(OH-) == 2c(H+) + c(CH3COOH);选项D中NaHA溶液的pH=4,溶液呈酸性,即c(H+)>c(OH-),同时也可以判断HA-以电离为主,所以离子浓度的大小顺序是:c(HA-)>c(A2-)>c(H+)>c(H2A)。
答案:A、C6(09年安徽理综·13)向体积为0.05mol·L-1CH3COOH溶液中加入体积为V b的0.05mol·L-1KOH溶液,下列关系错误..的是A.V a>V b时:c (CH3COOH) +c (CH3COO-)>c (K+)B.V a=V b时:c (CH3COOH) +c (H+)>c (OH-)C.V a<V b时:c (CH3COO-)>c (K+)> c (OH-)> c (H)D.V a与V b任意比时:c (K+)+ c (H+) =c (OH-)+ c (CH3COO-):若V a>V b,醋酸过量,根据物料守恒可知,n(CH3COOH)+n(CH3COO-)=0.05V a,n(K+)= 0.05VV b,则A选项正确;若V a=V b,反应后为CH3COOK溶液,由于的CH3COO -水解而显碱性,根据质子守恒可知,B选项正确;若V a<V b,说明碱过量,当碱液加的量足够多,则可以存在c(K+)>c(CH3COO-),C选项错误;D选项符合电荷守恒,正确。
答案:A、C7(09年广东化学·9)下列浓度关系正确的是A.氯水中:c(Cl2)=2c(ClO-)+c(Cl-)+C(HCl)}B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-)D.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)解析:氯气在水中与水反应是可逆反应,物料守恒不成立,A错误;Cl2+H2O=HCl+HClO,HCl中电离的H+与Cl-浓度相等,再加上HClO会电离出H+,所以H+浓度一定大于Cl-浓度,B错误;等体积等浓度的氢氧化钠与醋酸混合恰好完全反应生成醋酸钠,因CH3COO-水解,所以Na+浓度大于CH3COO-的浓度,C错误。
答案:D8(09年江苏化学·13)下列溶液中微粒的物质的量浓度关系正确的是A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)B.0.1mol·L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)D.25℃时,pH=4.75、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)的浓度永大于OH-浓度,故错;D项,由电荷守恒有:c(CH3COO-)+c(OH-)=c(H+)+c(Na+) ,由物料守恒可得:2c(Na+)= c(CH3COO-)+ c(CH3COOH),将两式中的c(Na +) 消去,可得c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)。
所以c(CH3COO-)+c(OH-)-c(H+)-c(CH3COOH)= c(H+)-c(OH-),因为pH=4.75,故c(H +)-c(OH-)>0,所以D项不等式应为”>” ,故错。
答:A,C【考点分析】①混合溶液中离子浓度的关系,电荷守恒。
②等pH的溶液中物质的量浓度的大小关系③电离和水解的相互关系④酸式盐溶液中离子的浓度大小关系。
