质量信息传递表模板
质量信息前馈反馈流程

1. 目的为提高整车质量,加强对车辆缺陷溢出的遏制,确保冲压区域发现或发生的重大质量问题信息得到及时传递,并有效支持生产线的质量控制,特制定本细则。
2. 编制和适用范围本规定由冲压车间编制,适用于冲压车间各区域。
3. 术语前馈:指对存在或潜在影响产品质量的本工序各类信息,向后道相关工序进行及时有效的传递,以便对溢出相关区域的问题实施有效的控制。
反馈:指对已经发生的或潜在的影响产品质量的各类信息,向前道相关被影响的工序进行及时有效的传递,以便相关问题产生区域及时采取有效的控制措施。
突发的质量问题:冲压线发现零件开裂、隐伤等问题或批量性质量问题且问题的可疑批次无法完全追溯有潜在质量风险的问题:经生产工段长评估后不会对后道相关工序产生影响的质量问题4.规定:4.1 前馈规定:4.1.1 对于符合质量信息前馈条件的突发质量问题,当班生产工段长及时通知相关车间及质量部,填写质量信息前馈单并通知质量工程师。
冲压车间对外质量问题的接口是生产工段,若涉及冲压工艺,零件尺寸等生产无法解决的问题,应告知质量工程师和模具工程师。
前馈信息要由生产值班经理或其授权人签字确认。
4.1.2 对有潜在质量风险的问题,当班生产工段长拉动QE工程师评估后确认是否需要发前馈单通知相关人员。
4.2反馈规定4.2.1当班生产班组长在发生零件质量问题后或接到外部的质量反馈后,由生产工段长和模修工程师确认评估翻库情况和零件检查区域。
4.2.2如果怀疑冲压件质量问题是由板料引起:- 模修工程师或生产班组长通知开卷线工段长和班组长- 开卷线班组长对可疑板料贴可疑品标签,查库并确认库存数量。
对同一卷号的板料都要贴上可疑品标签。
- 可疑板料是否能再上线,需要当班生产工段长和模修工段长确认。
- 可疑板料上线,开卷线班组长需要提前预警,通知生产工段长和模修工段长,并在板料标签上进行标注。
- 可疑板料退料,必须马上贴上可疑品标签。
5.2.3如怀疑冲压件质量问题由设备引起,模修工程师通知机修班组长和工程师确认。
质量管理文化墙模板

质量管理文化墙模板
质量管理文化墙模板是一种用于组织内部质量管理宣传与传达的工具。
它通过
在工作场所中设置文化墙来传递关于质量管理的信息,提高员工的质量意识和质量水平。
一个高效的质量管理文化墙模板应该包括以下几个关键要素:
1. 质量方针和目标:首先,文化墙上应该展示公司的质量方针和目标。
这可以
帮助员工理解公司对质量的重视程度以及所要达到的目标。
2. 质量管理流程和标准:文化墙上还应该包括公司的质量管理流程和相关标准。
这可以帮助员工了解工作中应遵循的流程和标准,确保产品和服务的质量符合要求。
3. 质量管理成就和奖励:文化墙上可以展示公司过去的质量管理成就和获得的
奖励。
这可以激励员工不断追求卓越,提高自身的质量水平。
4. 质量改进倡议和反馈机制:文化墙上可以设立一个质量改进倡议的板块,鼓
励员工提出改进意见和建议,并设立一个反馈机制,确保这些意见得到认真考虑和及时回应。
除了以上关键要素,质量管理文化墙模板还可以根据公司的具体情况进行定制。
例如,可以加入一些员工关于质量管理的心得体会、问题解决经验或者案例分享等,以激发员工之间的交流和学习。
总之,质量管理文化墙模板是一种宣传和传达质量管理理念的有力工具。
通过
使用合适的模板,公司可以提高员工的质量意识和质量水平,从而提升整体的质量管理表现。
ISO9000记录表单汇编

记录表格格式受控状态:分发号:目录1.质量治理体系文件更改单(表CX4231) (5)2.治理评审报告(表CX5611-1) (6)3.评审组成员签字表(表5611-2) (7)4.设备购置申请单(表CX6311-1) (8)5.设备维修、三保验收单(表CX6311-2) (9)6.工艺装备设计申请单表(CX6312-1) (10)7.(工艺装备加工申请单表CX6312-2) (11)3 / 1498. 工艺装备验收单(表CX6312-3) (12)9.工艺装备周期检验单(表CX6312-4) (13)10.工艺装备返修单(表CX6312-5) (14)11.工艺装备报废单(表CX6312-6) (15)12.吊具周期检验单(表CX6312-7) (16)13.过程(4M1E)监督检查记录(表CX6411-1) (17)14.质量信息传递表(表CX6511-1) (18)15.车间月质量考核报表(表CX6511-2) (19)16.合同评审报告(表CX7211-1) (20)17.合同更改记录(表CX7211-2) (21)18.合同评审会签单(表CX7211-3) (22)19.合同评审组成员签字表(表CX7211-4) (23)20.首件鉴定目录表(表CX7382-1) (24)21.首件生产总结(表CX7382-2) (25)22.首件检验总结(表CX7382-3) (27)23.首件鉴定证书(表CX7382-4) (29)24.鉴定组成员签字表(表CX7382-5) (30)25.采购产品检验请托单(表CX7411-1) (31)26.紧急放行单(表5 / 149CX7411-2) (32)27.代料单(表CX7411-3) (33)28.供方产品质量保证能力评价记录(表CX7411-4) (34)29.合格供方名录(表CX7411-5) (35)30.产品交接清单(表CX7511-1) (36)31.技术通知单(表CX7511-2) (38)32.试件交接清单(表CX7511-3) (39)33.技术问题处理单(表CX7511-4) (40)34.工艺问题处理单(表CX7511-5) (41)35.专门过程确认表(表CX7511-6) (42)36.试制和生产预备状态检查报告(表CX7512-1) (43)37.工艺审查意见表(表CX7513-1) (48)38.固体推进剂性能预示评审报告(表CX7514-1) (49)39.转批单(表CX7531-1) (51)40.质量复查报告单(表CX7571-1) (52)41.产品质量复查报告(表CX7571-2) (53)42.型号产品质量复查问题统计表(表CX7571-3) (57)43.产品质量评审证书(表CX7572-1) (58)44.评审组成员签字表(表CX7572-2) (59)7 / 14945.产品总装测试通知单(表CX7572-3) (60)46.工艺评审打算表(表CX7381-1) (61)47.国营红峡化工厂信息顾客反馈表(表CX7573-1) (62)48.产品售后服务报告单(表CX7573-2) (63)49.顾客反馈信息处理单(表CX7573-3) (64)50.购置测量设备申请表(表CX7611-1) (65)51.测量设备送检通知单(表CX7611-2) (66)52.测量设备处置单(表CX7611-3) (67)53.测量设备报废通知单(表CX7611-4) (68)54.测量设备封存申请单(表CX7611-5) (69)55.测量设备启封申请单(表CX7611-6) (70)56.测量设备报废申请单(表CX7611-7) (71)57.内部质量审核不合格项报告(表CX8221-1) (72)58.质量治理体系内部审核报告(表CX8221-2) (73)59.例外放行单(表CX8241-1) (74)60.检验结果通知单(表CX8241-2) (75)61.不格品审理单(表CX8311-1) (76)62.质量成本统计表(表CX8412-1) (77)63.质量本分析表(表CX8412-2) (78)9 / 14964.技术归零报告(表CX8521-1) (79)65.治理归零报告(表CX8521-2) (83)表CX4231质量治理体系文件更改单编号:11 / 149表CX5611-1管理评审报告表CX5611-2评审组成员签字表编号:GS年月日表CX6311-1设备购置申请单申请单位:年月日15 / 149一式四份:1、机动处;2、供销处;3、财务处;4、打算生产处表CX6311-2设备维修、三保验收单使用单位:年月日17 / 149表CX6312-1工艺装备设计申请单编号:表CX6312-2工艺装备加工申请单编号:19 / 149表CX6312-3工艺装备验收单编号:21 / 149表CX6312-4工艺装备周期检验单编号:表CX6312-523 / 149工艺装备返修单编号:表CX6312-6工艺装备报废单编号:25 / 149表CX6312-7吊具周期检验单编号:表CX6411-1过程(4M1E)监督检查记录编号:27 / 149表CX6511-1质量信息传递表编号:29 / 149表CX6511-2车间月质量考核报表填报单位:填报时刻:年月日31 / 149车间质量助理:车间主任:车间检验:表CX7211-1合同评审报告编号:33 / 149表CX7211-2合同更改记录编号:35 / 149表CX7211-3合同评审会签单编号:37 / 149表CX7211-4合同评审组成员签字表编号:39 / 149表CX7382-1首件鉴定目录表编号:制表:批准:41 / 149表CX7382-2(2-1)首件生产总结编号:43 / 149表CX7382-2(2-2)填写:批准:45 / 149表CX7382-3(2-1)首件检验总结编号:47 / 149表CX7382-3(2-2)填写:批准:49 / 149表CX7382-4首件鉴定证书编号:。
质量信息收集传递分析管理办法

质量信息收集传递分析管理办法1 目的及适用范围1.1 为规范药品质量信息的收集、传递、汇总、分析等药品质量信息管理工作,加强企业内部与质量有关的数据、资料、记录、报表、文件等收集、整理、汇总,定期开展质量分析、评价、评审,特制定本办法。
1.2 本办法适用于云南省丽江医药有限公司采购部、销售部、质管部、物流部药品入库验收、药品在库养护、药品出库复核、药品销售及售后服务过程中各环节的工作。
2 参考文件《药品管理法》《药品经营质量管理规范》《药品经营质量管理规范实施细则》3 术语3.1 质量信息收集:通过各种方法(网络信息、电话通知、传真 E-mail 等)收集有关商品质量、管理的相关信息的工作。
3.2 质量信息传递;将收集到的各种质量信息通过电脑系统或传真等方法传递给相关的部门或个人的过程。
3.3 质量信息汇总:将所收集的商品质量信息进行一个分类、汇总。
3.4 质量信息分析:定期对所有收集到的质量信息进行统计,针对质量信息的类别分别分析。
4 职责4.1 采购部4.1.1 负责将供货厂商通知的有关质量信息传递给质管部。
4.1.2 负责对质管部传递的质量信息及时的采取相应的措施。
4.2 质管部4.2.1 负责收集药品监督管理部门发布的药品质量信息。
4.2.2 负责收集各种质量信息,并转发给相应部门或个人,并对收集的所有质量信息进行统计分类及汇总。
4.2.3 负责对客户的质量查询、质量反映和质量投诉等问题,认真做好记录,填写各种报表,查明原因,分析问题,采取有效处理措施,确保药品质量。
4.3 销售部4.3.1 负责及时的向质管部反馈有利于本公司的相关质量信息。
4.3.2 负责对质管部反馈的相关质量信息的分析结果进行及时的处理与执行。
4.3.3 负责按要求发放、回收质管部所制定的《药品不良反应监测情况反馈表》(附件 1)和《经营药品质量征询意见表》(附件 2)。
5 工作程序5.1 药品质量信息收集传递5.1.1 药品质量信息内容(1)宏观质量信息:国家和医药行业有关质量政策、法令、规定等;(2)货源质量信息:供货单位的人员、设备、工艺、制度等生产质量保证能力情况;(3)竞争质量信息:同一市场的同行竞争对手的质量措施、质量水平、质量效益等;(4)内部质量信息:企业内部涉及经营与质量有关的数据、资料、记录、报表、文件等。
05质量信息反馈(沟通)管理制度

质量信息反馈(沟通)管理制度文号:QG/SSW0301.05-20071目的收集、传递、处理、反馈有关质量信息,明确其对质量体系的影响,并及时有效的进行信息的传递与利用,从而提高效率,适应变化,使客户更加满意。
2适用范围2.1适宜于本公司内部信息、外部情报的反馈沟通。
2.2适用于本公司与客户、合作伙伴、供应商、同业之间的信息交流、有效沟通。
3 职责3.1总经理负责协调处理信息交流沟通,并实施监督和协调等工作。
3.2各职能部门负责各自工作范围内信息的收集、传递与处理,并于每月末将质量管理活动的信息以月度小结的形式上报综合办公室,综合办公室集中汇总。
4 程序内容4.1质量信息的分类:(1)质量动态信息——正常运行中产生的信息。
(2)质量指令性信息——公司下达的有关质量的指令及规定。
(3)需反馈质量信息——由于产生质量偏差等原因而需要进行相互沟通的质量信息,有很高的时效性要求,要求在规定时间内完成发出、处理、反馈等过程。
4.2明确信息通报/处理的职责4.2.1本公司规定各部门需通报的质量动态信息,按规定的时限、渠道、方法传递。
4.2.2对以文件形式下达的质量指令性信息按本公司相关程序进行。
4.2.3对质量管理体系正常运行时所产生的各种信息,由各部门在月末用月度小结的形式上报综合办公室,综合办公室在《工作简报》中予以汇总。
4.2.4对于体系文件未明确规定的信息的处理,尤其是异常信息,由有关部门及时传递与之相关的部门,以便作出适当的处理。
4.2.5当出现各种紧急、意外、互相矛盾、有争议的情况而导致不能按正常渠道传递或处理时,则可由有关部门迅速送达总经理处,总经理负责协调,相关部门及时处理。
4.3 沟通方式沟通的形式可以多种多样,公司建立的每月例会是一种固定的信息沟通方式;现场碰头会、通报、报告、专题沟通协调会议也是经常采用的沟通方式;此外采取传递质量信息反馈单的方式、面谈、书面材料等方式予以沟通、传递。
4.4 信息沟通的评审总经理每年负责对内部沟通的有效性进行一次评审,提出结论和改进建议。
质量信息传递反馈表

质量信息传递反馈表
编号:MLH-ZD-005 【5-1(18】
信息名称:总局关于39批次药品不合格的通告(2017年第193号)
信息来源:国家食品药品监督管理局
收集时间:2017年12月04日
收 集 人:***
信息等级:B类
信息主体:经中国食品药品检定研究院等11家药品检验机构检验,标示为吉林省力胜制药有限公司等19家企业生产的39批次药品不合格。现将相关情况通告如下:
一、不合格产品的标示生产企业、药品品名和生产批号为:
吉林省力胜制药有限公司生产的批号为20160902、20160903、20161002、20161102的安胃片,甘肃佛仁制药科技有限公司生产的批号为150902、151101、160301、170201的安胃片,山西云鹏制药有限公司生产的批号为D150501、D150502、D160201、D160602的安胃片,山西汾河制药有限公司生产的批号为170202的吡拉西坦片,山东仁和堂药业有限公司生产的批号为160601的吡拉西坦片,大同市云岗制药有限公司生产的批号为161214的硫酸庆大霉素颗粒,丹东宏业制药有限公司生产的批号为20160404、20160702的硫酸庆大霉素碳酸铋胶囊,上海全宇生物科技确山制药有限公司生产的批号为1605051的硫酸庆大霉素碳酸铋胶囊,太极集团重庆桐君阁药厂有限公司生产的批号为17030008的龙胆泻肝片,山东齐都药业有限公司生产的批号为1C16120305的羟乙基淀粉130/0.4氯化钠注射液,山东华鲁制药有限公司生产的批号为D17021802、D17012504、D17021601、D16102201、D17012402的羟乙基淀粉130/0.4氯化钠注射液,焦作联盟医用材料股份有限公司生产的批号为20160501的曲安奈德新霉素贴膏,上海金不换兰考制药有限公司生产的批号为20160506的曲克芦丁片,六安华源制药有限公司生产的批号为161120022-A的替硝唑氯化钠注射液,天津儿童药业有限公司生产的批号为20160502的头孢克洛颗粒,焦作市银河药业有限公司生产的批号为20160310、20160405、20160407、20160409、20160506的头孢拉定颗粒,广西邦琪药业集团有限公司生产的批号为160327、160525的头孢拉定颗粒,辽宁丹生生物制药有限公司生产的批号为20160801的胰酶肠溶片,陕西中医学院制药厂生产的批号为160701、17A01的银翘解毒合剂。不合格项目包括含量测定、脆碎度、装量差异、溶出度、微生物限度、可见异物、效价测定、性状等(详见附件)。
CNAS17025样品传递、报告发放记录表模版记录

样品 处理
样品处 理人签名 发放
数量
发放 人签名
检测报告
接受 数量
接受 签名
□良好 □有
□封样
□不良 □无
□交委托
□良好 □有
□不良 □无
□封样
□交委托
□良好 □有
□不良 □无
□封样
□交委托
□良好 □有
□不良 □无
□封样
□交委托
□良好 □有
□不良 □无
□封样
□交委托
□良好 □有
□不良 □无
□封样
□交委托
样品接受信息
接受 日期
接受 样品 数量 状态
样品 编号
□良好
□不良
□良好
□不良
□良好
□不良
□良好Biblioteka □不良□良好□不良
□良好
□不良
□良好
□不良
□良好
□不良
□良好
□不良
记录 号:
接收 人签名
接受 日期
XX有限公司 样品传递、报告发放记录表
检测人员确认信息
检毕后相关信息
接受 数量
状态
编号
检测结果 提交日期
检测确 认签名
□良好 □有
□不良 □无
□封样
□交委托
□良好 □有
□不良 □无
□封样
□交委托
□良好 □有
□不良 □无
□封样
□交委托
存档 存档 数量 人签名
表单编号:
质量管理体系的沟通和信息传递

质量管理体系的沟通和信息传递在现代企业运作中,一个成功的质量管理体系是至关重要的。
质量管理体系的有效执行依赖于沟通和信息传递的良好运作。
本文将讨论质量管理体系中沟通和信息传递的重要性,并提供几种有效的方法来确保这些过程的顺利进行。
一、沟通在质量管理体系中的重要性质量管理体系的顺利运行需要各个环节之间的协调和合作。
而沟通是实现这种协调和合作的关键工具。
沟通不仅能够提供必要的信息,还可以确保所有相关方都了解他们的职责和任务。
只有在有效沟通的基础上,企业才能实现各个环节之间的无缝连接,从而提高质量管理的效果。
在质量管理体系中,沟通的重要性体现在以下几个方面:1. 信息共享:质量管理体系中的各个环节需要共享信息,以便及时了解最新的情况。
只有通过有效的沟通,各个部门之间才能共同协作,确保质量标准得以满足。
2. 意见交流:沟通为员工提供了一个表达意见和想法的平台。
员工的积极反馈和建议对于改进质量管理体系至关重要。
3. 错误预防:通过沟通,各个环节之间的交流可以帮助及时发现和解决问题,从而避免错误的发生,并提高质量管理的效率。
二、信息传递的重要性质量管理体系需要准确、及时地传递信息,以确保所有相关方都能了解他们的角色和任务。
信息传递的有效性对于质量管理体系的顺利运行至关重要。
以下是信息传递在质量管理体系中的重要性:1. 目标和要求:通过有效的信息传递,所有员工都可以了解和理解企业的质量目标和要求。
这有助于确保每个人都在同一个方向上努力,提高质量管理体系的一致性。
2. 流程和程序:通过传递准确的流程和程序信息,可以确保每个环节都按照规定的标准进行操作。
这有助于减少错误和不一致性。
3. 问题和改进:信息传递还可以促进问题和改进的沟通。
员工可以通过有效的信息传递向上级报告问题,并提出改进建议,从而推动质量管理体系的不断改进。
三、确保沟通和信息传递的有效方法为了确保质量管理体系中的沟通和信息传递的有效性,以下是几种可以采取的方法:1. 定期会议:组织定期会议,让各个环节的代表能够面对面地交流和沟通。
质量信息传递制度

质量信息传递制度1.引言质量信息传递制度是指在一个组织或企业中,确保质量信息的高效传递和沟通的一套规范和流程。
通过建立和执行质量信息传递制度,可以有效地提高产品质量和服务质量,保证客户满意度和持续改进。
2.目的质量信息传递制度的目的在于:确保质量信息的传达准确、及时和全面;促进跨部门和跨团队之间的紧密协作和沟通;提高对质量问题的响应速度和处理效率;建立质量信息传递的标准和评估机制。
3.主要内容3.1 质量信息来源客户反馈内部检查和审核外部审核和认证市场研究和竞争情报3.2 质量信息传递渠道定期质量报告内部会议和讨论即时沟通工具(如Slack、微信企业号等)电子邮件和文档分享平台3.3 质量信息传递流程1.收集质量信息:根据质量信息来源,进行信息收集和整理,确保信息的准确性和可靠性。
2.分发质量信息:通过适当的传递渠道,将质量信息传达给相关的部门和个人,并确保信息的及时性和全面性。
3.反馈和处理:接收质量信息的部门和个人应及时反馈处理结果,并将相关信息反馈给质量管理部门,以便进行监控和改进。
4.评估和改进:根据质量信息传递的效果和质量问题的解决情况,进行评估和改进,优化质量信息传递制度。
4.责任和权限在质量信息传递制度中,各部门和个人应承担以下责任和权限:质量管理部门:负责建立和监督质量信息传递制度,检查和评估质量信息的传递效果;信息收集部门:负责收集和整理质量信息,确保信息的准确性和完整性;负责人和员工:负责及时传递质量信息,合理处理和解决质量问题。
5.质量信息传递制度的优势提高交流效率:通过明确的传递流程和沟通渠道,确保质量信息的快速传达和响应,提高交流效率。
集中管理信息:通过建立质量信息传递制度,集中管理质量信息,方便监控和分析质量问题的趋势和原因。
优化决策和改进:质量信息传递制度为决策者提供了准确和及时的质量信息,有助于优化决策和持续改进。
加强团队协作:质量信息传递制度促进了部门和个人之间的沟通和协作,加强团队合作意识和质量意识。
质量信息传递表
):填表日期:
注:此表一式两份,各单位及直属项目部于每月18日前报技术质量部质量管理科一份,自存一份。
电话
上岗证号
2
项目经理
电话
传真
质量经理(技术负责)
电话
质检员
电话
上岗证号
填表人:填表日期:
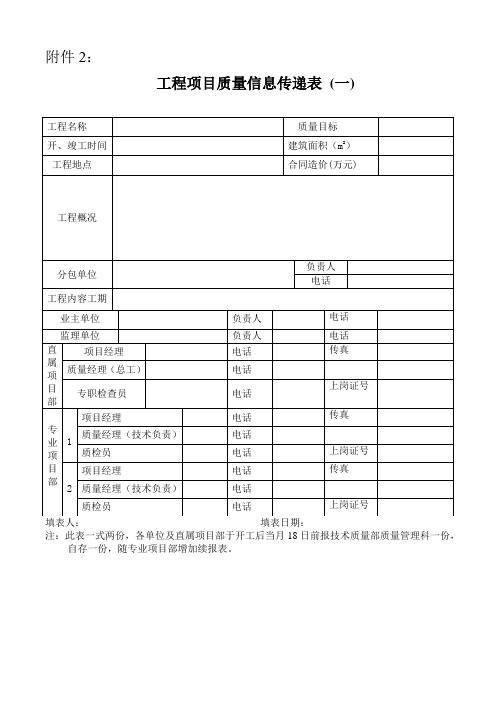
注:此表一式两份,各单位及直属项目部于开工后当月18日前报技术质量部质量管理科一份,自存一份,随专业项目部增加续报表。
工程项目质量信息传递表(二)
施工单位:编号:
工程项目名称
本月已完施工工序、检验批、分项、分部工程质量情况:
附件2:
工程项目质量信息传递表(一)
工程名称
质量目标
开、竣工时间
建筑面积(m2)
工程地点
合同造价(万元)
工程概况
分包单位
负责人
电话
工程内容工期
业主单位
负责人
电话
监理单位
负责人
电话
直
属
项
目
部
项目经理
电话
传真
质量经理(总工)
电话
专职检查员
电话
上岗证号
专
业
项
目
部
1
项目经理
电话
传真
质量经理(技术负责)
电话
质检员
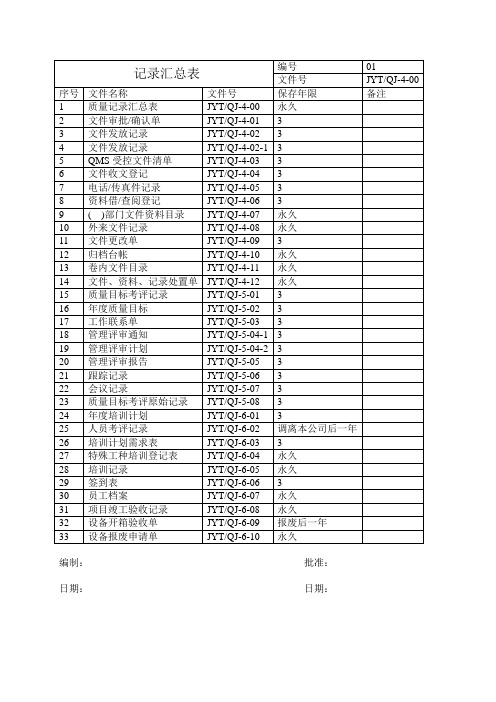
质量记录汇总表
3
120
取样送检单
JYT/QJ-8-14
3
121
检验录
JYT/QJ-8-15
3
122
过程监控记录
JYT/QJ-8-16
3
123
产品质量验收月报表
JYT/QJ-8-17
3
124
不合格品通知单
JYT/QJ-8-18
3
125
不合格品台帐
JYT/QJ-8-19
3
126
质量事故报告单
JYT/QJ-8-20
JYT/QJ-7-28
3
81
在制品
JYT/QJ-7-29-1
永久
82
不合格证
JYT/QJ-7-29-2
永久
83
合格标签
JYT/QJ-7-29-3
永久
84
待处理标签
JYT/QJ-7-29-4
永久
85
待检标签
JYT/QJ-7-29-5
永久
86
材料卡
JYT/QJ-7-29-6
永久
87
仓库发货记录
JYT/QJ-7-30
日期:日期:
记录汇总表
编号
03
文件号
JYT/QJ-4-00
序号
文件名称
文件号
保存年限
备注
67
合格供方名单
JYT/QJ-7-19
永久
68
供方评价表
JYT/QJ-7-20
永久
69
供方台帐
JYT/QJ-7-20-1
永久
70
采购单
JYT/QJ-7-21
3
71
生产管理记录表格大全1.doc

生产管理记录表格大全1 记录表格格式受控状态:分发号:目录1.质量管理体系文件更改单(表CX4231)(5)2.管理评审报告(表CX5611-1)(6)3.评审组成员签字表(表5611-2)(7)4.设备购置申请单(表CX6311-1)(8)5.设备维修、三保验收单(表CX6311-2)(9)6.工艺装备设计申请单表(CX6312-1)(10)7.(工艺装备加工申请单表CX6312-2)(11)8. 工艺装备验收单(表CX6312-3)(12)9.工艺装备周期检验单(表CX6312-4)(13)10.工艺装备返修单(表11.工艺装备报废单(表CX6312-6)(15)12.吊具周期检验单(表CX6312-7)(16)13.过程(4M1E)监督检查记录(表CX6411-1)(17)14.质量信息传递表(表CX6511-1)(18)15.车间月质量考核报表(表CX6511-2)(19)16.合同评审报告(表CX7211-1)(20)17.合同更改记录(表CX7211-2)(21)18.合同评审会签单(表CX7211-3)(22)19.合同评审组成员签字表(表CX7211-4)(23)20.首件鉴定目录表(表CX7382-1)(24)21.首件生产总结(表22.首件检验总结(表CX7382-3)(27)23.首件鉴定证书(表CX7382-4)(29)24.鉴定组成员签字表(表CX7382-5)(30)25.采购产品检验请托单(表CX7411-1)(31)26.紧急放行单(表CX7411-2)(32)27.代料单(表CX7411-3)(33)28.供方产品质量保证能力评价记录(表CX7411-4)(34)29.合格供方名录(表CX7411-5)(35)30.产品交接清单(表CX7511-1)(36)31.技术通知单(表CX7511-2)(38)32.试件交接清单(表33.技术问题处理单(表CX7511-4)(40)34.工艺问题处理单(表CX7511-5)(41)35.特殊过程确认表(表CX7511-6)(42)36.试制和生产准备状态检查报告(表CX7512-1)(43)37.工艺审查意见表(表CX7513-1)(48)38.固体推进剂性能预示评审报告(表CX7514-1)(49)39.转批单(表CX7531-1)(51)40.质量复查报告单(表CX7571-1)(52)41.产品质量复查报告(表CX7571-2)(53)42.型号产品质量复查问题统计表(表CX7571-3)(57)43.产品质量评审证书(表。
质量环境职业健康安全管理体系内外部沟通一览表(范本)

其他信息
适时或定期
相关单位
各部门
编制:审核:批准:
质量环境职业健康安全管理体系
内外部沟通一览表
内部沟通
外部沟通
沟通内容
沟通时机
沟通对象
沟通方式
负责部门
沟通内容
沟通时机
沟通对象
沟通方式
负责部门
各项工作的职责和权限
文件发布前/工作安排前/适时
相关部门
文件发布、资料传递、会议交流
主管职能部门/体系部
市场信息、顾客信息
制定年度经营计划前/适时
客户
调查/网络信息平台/文件资料传递
质量部、体系部、开发部、总经办
行业协会要求和期望等信息
每年例行的组织环境理解调查分析/适时
行业协会
总经办
数据统计信息
按文件要求
相关部门
统计信息责任部门
其他信息
适时或定期
相关单位
总经办
审核与评审方法
审核与评审实施前及完成后
各部门
体系部、总经办
绩效信息
按文件要求
相关部门
绩效统计部门
变更信息
发布前
相关部门
质量环境职业健康安全管理体系内外部沟通一览表内部沟通外部沟通沟通内容沟通时机沟通对象沟通方式负责部门沟通内容沟通时机沟通对象沟通方式负责部门各项工作的职责和权限文件发布前工作安排前适时相关部门文件发布资料传递会议交流主管职能部门体系部市场信息顾客信息制定年度经营计划前适时客户调查网络信息平台文件资料传递营销部体系文件信息文件发布前每年定期培训适时各部门文件发布培训宣贯会议交流宣传公告栏内部刊物资料传递文件发布部门法律法规等要求法律法规等要求实施前的培训宣贯学习适时政府相关机构网站获取学习培训会议政府组织资料传递体系部人力资源部通知通告决议纪要联络计划等文件发布前培训宣贯适时各部门外部提供方要求和期望等信息每年例行的组织环境理解调查分析适时外部提供方调查面谈文件资料传递培训技术交流采购部过程改进的要求文件发布前实施前相关部门过程改进提出部门股东要求和期望等信息每年例行会议适时股东会议交流文件资料传递等人力资源部内部沟通外部沟通沟通内容沟通时机沟通对象沟通方式负责部门沟通内容沟通时机沟通对象沟通方式负责部门产品过程的符合信息按文件要求相关部门文件发布资料传递会议交流质量部体系部开发部总经办行业协会要求和期望等信息每年例行的组织环境理解调查分析适时行业协会总经办数据统计信息按文件要求相关部门统计信息责任部门其他信息适时或定期相关单位总经办审核与评审方法审核与评审实施前及完成后各部门体系部总经办绩效信息按文件要求相关部门绩效统计部门变更信息发布前相关部门变更提出部门其他信息适时或定期相关单位各部门编制
全套最新质量管理记录表

全套最新质量管理记录表
前言
质量管理是现代企业发展过程中必不可少的一环。
严格按照质量管理标准执行对于企业的运营和维护,以及产品的质量保障有着非常重要的影响。
为了帮助企业更好地实现质量管理,本文将详细介绍一整套最新的质量管理记录表,以供企业使用。
质量管理记录表
1. 产品检测记录表
产品名称工单号检测日期生产日期检测人员检测
A产品001 2021-01-01 2020-12-28 张三合格
B产品002 2021-01-02 2020-12-29 李四不合格
C产品003 2021-01-03 2020-12-30 王五合格
2. 原材料检测记录表
原材料名称检测日期生产日期供应商检测人员检测
A原材料2021-01-01 2020-12-28 供应商A 张三合格
B原材料2021-01-02 2020-12-29 供应商B 李四合格
C原材料2021-01-03 2020-12-30 供应商C 王五不合格
3. 设备保养记录表
设备名称保养日期保养人员保养内容
设备A 2021-01-01 张三更换零件
设备B 2021-01-02 李四清洁设备
设备C 2021-01-03 王五检修设备
4. 安全检查记录表
检查日期检查人员检查内容是否存在隐患
2021-01-01 张三电气设备检查是
2021-01-02 李四化学品储存检查否
2021-01-03 王五机械设备检查是
以上是一整套最新的质量管理记录表,可应用于各种企业,涵盖了企业中常见的质量管理记录。
企业可根据自己的实际情况进行相应的修改和调整。
希望本文能够对企业质量管理有所帮助。
(模板)GSP质量记录表格汇总之一【竖排】

文件会稿单文件借(查)阅登记表文件销毁申请单文件收回销毁记录ABYY-ZR008-00 文件名称: 文号或编码:《药品经营质量管理规范》内部评审和公司质量管理体系审核计划ABYY-ZR011-00按照国家《药品经营质量管理规范》的要求以及公司制度规定,公司应组织人员对每年度的质量管理体系进行审核以及对《药品经营质量管理规范》在我公司的实施情况进行内部评审。
公司《质量管理制度》中的“质量管理体系审核制度”的7.2条具体规定:公司的质量管理体系审核应“每年进行一次,按照公司质量管理制度规定进行。
”同时还明确了,在进行质量管理体系审核时“同时实施《药品经营质量管理规范》的内部评审”。
200 年度体系审核和“GSP”评审计划安排如下:一.检查时间:二.检查人员:三.检查内容:1.质量管理体系运行状况;2. 《药品经营质量管理规范》实施情况;四.评审时间:五.评审地点:六.评审内容:1.质量体系运行情况;2.本公司经营方式和经营范围; *04013.组织机构与管理职责; 0501-07024.质量管理制度执行情况; *0801- *08025.人员与培训教育情况; 1001-17026. 健康体检 1601-16027.经营和仓储设施、设备运行状态; 1801-25018.进货质量管理; 2701-34019.入库验收质量管理;*3501-351310. 不合格药品管理; 4001-400511.药品保管与储存; 3601、*4101-411112.药品在库养护 3701、4201-420913.药品出库管理 4301-450114. 药品运输管理 4601-490215.药品销售和售后服务工作; 5001--570216.存在问题的整改及预防措施。
七.评审方式:会议评审。
八.评审部门:公司质量领导小组。
九.评审结果:报告形式。
四川省XXX医药有限公司质量管理部年月日《药品经营质量管理规范》实施情况内部评审公司质量管理体系年度审核审批表ABYY-ZR012-00编制时间:年月日四川省XXX医药有限公司质量管理体系评审记录表ABYY-ZR013-00不合格项通知书ABYY-ZR014-00 通知部门:编号:通知发出部门:GSP内部评审小组整改检查:质量管理部年月日整改实施报告ABYY-ZR015-00 GSP内部评审小组:编号:报告部门:经办人:质量信息传递、反馈表ABYY-ZR017-00建档日期:存档编号:ABYY-ZR018-00质量管理工作随笔四川省XXX医药有限公司四川省XXX医药有限公司质量管理工作随笔日期:事件:处理与结果:日期:事件:处理与结果:日期:事件:处理与结果:日期:事件:处理与结果:制度执行情况监督检查记录ABYY-ZR019-00制度执行情况监督检查记录整改通知单药品不合格报告、确认单四川省XXX医药有限公司药品不合格报告、确认单药品拒收通知单ABYY-ZR024-00四川省XXX医药有限公司药品拒收通知单药品质量复检通知单ABYY-ZR025-00。
《质量信息收集传递分析管理办法》

《质量信息收集传递分析管理办法》第一篇:质量信息收集传递分析管理办法质量信息收集传递分析管理办法1目的及适用范围1.1为规范药品质量信息的收集、传递、汇总、分析等药品质量信息管理工作,加强企业内部与质量有关的数据、资料、记录、报表、文件等收集、整理、汇总,定期开展质量分析、评价、评审,特制定本办法。
1.2本办法适用于云南省丽江医药有限公司采购部、销售部、质管部、物流部药品入库验收、药品在库养护、药品出库复核、药品销售及售后服务过程中各环节的工作。
2参考文件《药品管理法》《药品经营质量管理规范》《药品经营质量管理规范实施细则》3术语3.1质量信息收集。
通过各种方法(网络信息、电话通知、传真e-mail等)收集有关商品质量、管理的相关信息的工作。
3.2质量信息传递;将收集到的各种质量信息通过电脑系统或传真等方法传递给相关的部门或个人的过程。
3.3质量信息汇总。
将所收集的商品质量信息进行一个分类、汇总。
3.4质量信息分析。
定期对所有收集到的质量信息进行统计,针对质量信息的类别分别分析。
4职责4.1采购部4.1.1负责将供货厂商通知的有关质量信息传递给质管部。
4.1.2负责对质管部传递的质量信息及时的采取相应的措施。
4.2质管部4.2.1负责收集药品监督管理部门发布的药品质量信息。
4.2.2负责收集各种质量信息,并转发给相应部门或个人,并对收集的所有质量信息进行统计分类及汇总。
4.2.3负责对客户的质量查询、质量反映和质量投诉等问题,认真做好记录,填写各种报表,查明原因,分析问题,采取有效处理措施,确保药品质量。
4.3销售部4.3.1负责及时的向质管部反馈有利于本公司的相关质量信息。
4.3.2负责对质管部反馈的相关质量信息的分析结果进行及时的处理与执行。
4.3.3负责按要求发放、回收质管部所制定的《药品不良反应监测情况反馈表》(附件1)和《经营药品质量征询意见表》(附件2)。
5工作程序5.1药品质量信息收集传递5.1.1药品质量信息内容(1)宏观质量信息:国家和医药行业有关质量政策、法令、规定等;(2)货源质量信息:供货单位的人员、设备、工艺、制度等生产质量保证能力情况;(3)竞争质量信息:同一市场的同行竞争对手的质量措施、质量水平、质量效益等;(4)内部质量信息。
