16分光光度法测定络合物稳定常数
分光光度法测定络合物的组成及稳定常数

分光光度法测定络合物的组成及稳定常数分光光度法测定络合物的组成及稳定常数(综合型)实验⽬的1、掌握分光光度法测定络合物组成及稳定常数的基本原理和⽅法。
2、计算络合反应的标准⾃由能变化。
3、学会使⽤分光光度计。
实验原理溶液中⾦属离⼦M 和配位体L 形成MLn 络合物。
其反应式为:MLn nL M =+,当达到平衡时,其络合稳定常数为:n L M MLn K ]][[][= ……… (1-1)式中:K 为络合物的稳定常数,][MLn 、][M 、][L 分别为络合平衡时络合物、⾦属离⼦和配位体的浓度(严格的说(1-1)式中各浓度值应以活度来代替),n 为络合物的配位数。
显然,如果通过实验能测得(1-1)式中右边各项的浓度及n 值,则就能算得K 值。
本实验采⽤分光光度法来测定这些参数。
1.分光光度法的实验原理让可见光中各种波长的单⾊光分别地、依次透过溶液,其中某些波长的光即被吸收,使得透过的光形成了吸收谱带(或称吸收曲线),因⽽可以对不同的物质进⾏鉴定分析,这是定性分析的基础。
根据朗伯—⽐⽿定律,⼊射光强0I 与投射光强I 之间有如下关系:klc e I I -=0……… (1-2)D klc II ==0ln ……… (1-3)式中:D 称为光密度(或吸光度);k 为吸光系数,对于⼀定溶质,溶剂及⼀定波长的⼊射光k 为常数;c 为溶液的浓度;l 为⽐⾊⽫(液层)厚度;0I I 称透光率。
从(1-3)式看出,在固定液层厚度l 和⼊射光波长的条件下,光密度D 与溶液浓度成正⽐。
选择⼊射光波长,使它对被测物质即具有⼀定的灵敏度,⼜使溶液中其它物质的⼲扰为最⼩,做被测物质的C D -标准⼯作曲线,然后测定被测溶液的光密度,根据光密度的⼤⼩即可在标准⼯作曲线上求得相应的浓度值,这是定量分析的基础。
2.络合物组成的测定本实验采⽤等摩尔连续变化法测定络合物的组成,其原理如下:在保持总摩尔数不变的情况下,依次改变体系中两组分摩尔分数的⽐值,配制⼀系列摩尔分数不同的溶液,测量这⼀系列溶液的光密度D 值。
聚乙烯亚胺-金属络合物的稳定常数及配位数的测定

Vol.33高等学校化学学报No.122012年12月 CHEMICAL JOURNAL OF CHINESE UNIVERSITIES 2633~2637聚乙烯亚胺鄄金属络合物的稳定常数及配位数的测定黄佳华1,2,弓振斌1,3,林继军2,段华玲2(1.厦门大学近海海洋环境科学国家重点实验室,2.海洋与地球学院,3.环境与生态学院,厦门361005)摘要 将聚合物络合超滤(PC⁃UF)技术与电感耦合等离子体质谱(ICP⁃MS)结合,利用化学理论计算模型,建立了测定聚乙烯亚胺(PEI)与金属离子络合稳定常数及平均配位数的方法.将该方法用于PEI 与Cd 2+的络合过程.配制不同浓度比的PEI 和Cd 2+的混合溶液,待络合反应平衡后,用超滤离心管离心分离高分子PEI⁃Cd 络合物,自由离子Cd 2+及其小分子络合物渗滤至滤液中;用10mL 体积分数为3%稀硝酸将滤膜上截留的PEI⁃Cd 络合物解离,离心得到Cd 2+的稀硝酸溶液;用ICP⁃MS 分别测定2次超滤后滤液中Cd 2+的浓度,利用化学理论模型进行计算,得到PEI⁃Cd 络合物的稳定常数和平均配位数.pH =4.0~5.9时,PEI⁃Cd 络合平衡的研究结果表明,稳定常数和平均配位数均随pH 值的增大而增大,较低程度的质子化可使PEI 与Cd 2+的络合能力增强,络合稳定常数增大.关键词 聚乙烯亚胺;络合稳定常数;配位数;超滤技术;电感耦合等离子体质谱中图分类号 O657.63;O614.24 文献标识码 A doi :10.7503/cjcu20120405收稿日期:2012⁃04⁃26.基金项目:厦门大学近海海洋环境科学国家重点实验室自主创新项目(批准号:MELRI0703)资助.联系人简介:弓振斌,男,博士,教授,主要从事分析化学和环境化学研究.E⁃mail:zbgong@ 聚合物络合超滤(PC⁃UF)技术利用聚合物与金属离子络合形成尺寸较大的高分子络合物,超滤时无法通过滤膜而被截留,而未络合的离子由于其空间体积小于滤膜孔径而渗滤至滤液中,从而实现分离的目的.该技术在去除或回收工业废水中的金属离子方面已被广泛应用[1~4].聚乙烯亚胺(PEI)因其良好的水溶性㊁化学稳定性以及其分子链上大量的胺基,成为使用PC⁃UF 技术进行过渡金属的分离[5]㊁金属元素回收[6]以及海水中痕量金属元素与基体的分离[7]等研究中常用的聚合物.聚合物与金属离子形成络合物的稳定常数及配位数等基础数据是聚合物分离㊁富集或回收金属元素等过程最佳条件选择的基础[1,8,9],有助于从理论上探讨PC⁃UF 技术的应用前景.但迄今关于溶液中PEI 与金属元素形成络合物(PEI⁃M 络合物)的稳定常数及平均配位数等数据的研究报道较少,Juang 等[10]对络合反应机理进行了研究;也有关于个别元素形成络合物的稳定常数的报道[10~13].水溶液中聚合物与金属络合反应稳定常数的测定方法主要有电位滴定法[11,12,14,15]㊁分光光度法[16]以及超滤分离法[10,13].电位滴定法测定PEI⁃M 络合物的稳定常数和配位数的方法是向已知浓度的PEI 和金属混合溶液中滴加标准的碱溶液,记录碱溶液滴定的体积和溶液的pH 值,结合生成函数(Bjerrum 函数)计算得到数据[11,12],该方法测定过程和计算比较繁琐.利用超滤将聚合物㊁金属络合物与其它金属相分离,根据计算公式求得稳定常数的方法称为超滤分离法,应用该方法测定PEI⁃M 络合物的稳定常数和配位数的研究尚存在未考虑OH -的影响[13]和直接设定配位数的值来求得稳定常数[10,13]等不足.Juang 等[10]采用超滤分离法结合计算模型测定了不同浓度比的PEI 和Cu 2+条件下PEI⁃Cu 络合物的稳定常数和平均配位数,其结果存在较大差别.因此,有必要发展更简单㊁准确且可靠的测定方法.本文通过建立化学理论计算模型,利用PC⁃UF 技术和电感耦合等离子体质谱(ICP⁃MS),提出了一种测定PEI⁃M 络合物稳定常数和平均配位数的方法.并将其用于测定PEI⁃Cd 2+络合物的稳定常数和平均配位数.该方法简单㊁准确,适用于测定PEI 与不同金属离子形成的络合物.4362高等学校化学学报 Vol.33 1 实验部分1.1 试剂与仪器质量分数为50%的聚乙烯亚胺(平均分子量M w=750000,美国Sigma⁃Aldrich公司)的水溶液; 1000mg/L Cd2+标准储备溶液(国家标准物质中心);硝酸㊁醋酸和醋酸钠(优级纯,德国Merck公司); HAc⁃NaAc缓冲溶液浓度为0.02mol/L.实验用水为Milli⁃Q超纯水(18.2MΩ㊃cm).15mL超滤离心管(美国Millipore公司),其核苷酸截留分子量(MWCO)为10000;5810R型台式高速离心机(德国Eppendorf公司);THZ⁃82型恒温振荡水浴箱(金坛市富华仪器有限公司).7700x型ICP⁃MS(美国Agilent Technologies公司),工作参数:射频功率1500W,采样深度8.0mm,冷却气流速15.0L/min,辅助气流速1.0L/min,载气流速0.8L/min,补偿气流速0.3L/min;AR35⁃FM04EX微流雾化器(澳大利亚Glass Expansion公司),恒温2℃,样品提升量0.5mL/min;测定结果为3次重复测定取平均值,标准校正曲线进行定量.1.2 实验过程将15mL超滤离心管在体积分数为2%硝酸中浸泡24h后,用水淋洗3次,再用水浸泡24h后,置于洁净操作台内风干㊁备用.实验中使用的低密度聚乙烯瓶(LDPE)㊁聚四氟乙烯瓶(PTFE)及其它器皿均按照文献[17]中的洗涤步骤洗涤后备用.移取100mL一定pH值的0.02mol/L HAc⁃NaAc缓冲溶液于LDPE瓶中,加入适量PEI溶液和Cd2+标准溶液,置于25℃恒温水浴箱中振荡反应30min后,移取10mL混合溶液至15mL超滤离心管,离心15min(6000r/min),用3mL同一pH值缓冲液淋洗超滤离心管内壁后㊁离心,合并2次滤液并转移至容量瓶中定容;更换滤液收集管后,再用10mL3%硝酸分2次淋洗超滤离心管内壁㊁离心,以将Cd2+从PEI⁃Cd络合物中完全解离并转移至稀硝酸溶液中,合并2次滤液并转移至容量瓶中定容.使用ICP⁃MS分别测定2次收集于容量瓶中的镉浓度.改变溶液的pH值,以研究溶液酸度变化对PEI 与Cd络合反应平衡的影响.2 结果与讨论2.1 溶液中的络合反应化学理论模型的建立二价金属离子(M2+),如Cd2+,Cu2+,Co2+,Ni2+和Pb2+等,可与PEI分子中的胺基发生络合作用[10,11].若溶液中仅含Cd2+,当加入PEI后,溶液中发生的反应主要有PEI与Cd2+的络合㊁PEI的质子化以及金属氢氧络合物的形成[10];为了控制溶液pH值,实验采用HAc⁃NaAc缓冲溶液,故还存在Cd2+与Ac-的络合反应.在上述反应中,PEI与Cd2+的络合反应[Cd2++n⥫⥬PEI Cd(PEI)n]为主反应,反应常数即为形成PEI⁃Cd络合物的稳定常数(K PEI⁃Cd):K PEI⁃Cd=[Cd(PEI)n]/[Cd2+]㊃[PEI]n(1)式中,[Cd2+]和[Cd(PEI)n]分别为络合反应平衡时,溶液中以自由离子和PEI⁃Cd络合物形式存在的镉的浓度;[PEI]为络合反应平衡时,未形成PEI⁃Cd络合物且未被质子化的中性胺基的浓度;n为溶液中Cd2+与PEI分子中配位的胺基个数,即PEI⁃Cd络合物的配位数.溶液中存在副反应,如PEI质子化㊁Cd2+与OH-或Ac-的络合反应,反应方程分别为PEI+H⥫⥬+PEI⁃HCd2++i OH⥫⥬-Cd(OH)iCd2++j Ac⥫⥬-Cd(Ac)j上述反应方程式中,PEI⁃H表示PEI分子中的1个胺基与H+的质子化反应,其浓度[PEI⁃H]是PEI分子中质子化胺基的浓度.各副反应的反应常数分别为K PEI⁃H=[PEI⁃H][PEI][H+](2)K Cd⁃OH =[Cd(OH)i ][Cd 2+][OH -]i (3)K Cd⁃Ac =[Cd(Ac)j ][Cd 2+][Ac -]j (4)变换式(1)~(4)可得:lg [Cd (PEI)n ][Cd 2+]+[Cd(OH)i ]+[Cd(Ac)j ]=n lg[PEI]+lg K PEI⁃Cd -lg(K Cd⁃OH [OH -]i +K Cd⁃Ac [Ac -]j +1)(5)设y =[Cd (PEI)n ][Cd 2+]+[Cd(OH)i ]+[Cd(Ac)j ],则上式简化为lg y =n lg[PEI]+lg K PEI⁃Cd -lg(K Cd⁃OH [OH -]i +K Cd⁃Ac [Ac -]j +1)(6)式(5)中,[Cd 2+]+[Cd(OH)i ]+[Cd(Ac)j ]表示主㊁副反应达到平衡时,未形成PEI⁃Cd 络合物的镉的浓度,即Cd 2+,Cd(OH)i 和Cd(Ac)j 3种形态浓度之和,亦即实验中第一次超滤时滤液中镉的总浓度.式(5)中左边各项可通过2次超滤后所得滤液以及ICP⁃MS 测定求得;K Cd⁃OH 和K Cd⁃Ac 为常数[12,18,19];[PEI]为溶液中未被质子化的中性胺基的浓度,是与pH 值相关的变量,可通过文献[19]查找K PEI⁃H 进行计算.以式(5)中左边比值的对数为纵坐标,以lg[PEI]为横坐标进行线性拟合,则待测PEI⁃Cd 络合物的稳定常数(K PEI⁃Cd )可由拟合直线的截距求得,斜率为PEI⁃Cd 络合物的平均配位数n .实验涉及的超滤膜分离过程基于以下假设:(1)Cd 2+,小分子Cd⁃OH 和Cd⁃Ac 络合物与超滤膜之间无相互作用,即它们在超滤过程中不会被滤膜截留,全部进入滤液中[1,13],并且实验中控制溶液pH<6,几乎不形成Cd⁃OH 络合物;(2)超滤膜对PEI 分子和PEI⁃Cd 络合物的截留效率均约为100%,即它们在超滤过程中完全被滤膜截留.实验中使用的PEI 的平均分子量(M w =750000)与超滤膜对核苷酸截留分子量(MWCO =10000)之比为75∶1,远大于理论上超滤过程对膜选择的要求[3,20];而PEI⁃Cd 络合物与PEI 分子量相近,理论上能被完全截留.利用上述理论模型设计如下实验:使用超滤离心管对形成络合物的金属离子与溶液中以自由离子形态(Cd 2+)或小分子络合物[Cd(OH)i ,Cd(Ac)j ]存在的金属进行分离.形成的PEI⁃Cd 络合物用稀硝酸解离后,络合物中的金属重新转化为自由离子形态.通过测定2次滤液中镉的浓度,得到[Cd(PEI)n ]和[Cd 2+]+[Cd(OH)i ]+[Cd(Ac)j ]的比值.上述步骤简便㊁快速,不仅可使各种形态金属元素按需分离,也方便使用ICP⁃MS 进行准确测定.2.2 pH 值对PEI⁃Cd 络合反应平衡的影响Fig.1 Effect of pH value on complexation equilibrium Initial concentration of Cd 2+:50μg /L;total ion strength:0.20mol /L.pH 值对PEI 和Cd 2+络合反应平衡的影响通过PEI 分子中胺基的质子化反应来实现[3,21,22].为保证PEI 与Cd 2+的络合反应在固定的pH 值条件下进行,实验选用HAc⁃NaAc 缓冲体系(离子强度I =0.20mol /L),分别将溶液的pH 值控制为4.0,5.0,5.5和5.9,考察溶液pH 值对PEI⁃Cd 络合反应平衡的影响.由图1可见,pH 值对Cd 2+与PEI 络合反应平衡的影响显著.pH 值无论为4.0,或为5.0,5.5和5.9时,尽管大部分PEI 以质子化形式存在,但随PEI 加入量增加,中性胺基的量也增大,以Cd 2+,Cd(OH)i 和Cd(Ac)j 等简单离子形态存在的金属元素的浓度逐渐减少,而更多以PEI⁃Cd 络合物形态存在.不同pH 值时,lg y 与lg[PEI]均呈良好的线性关系,说明式(5)的化学理论模型是正确的.研究结果表明,pH 值对PEI 的质子化影响明显,pH =3.0时只有0.00001%的胺基未发生质子化,pH 为5.0时只有0.001%未质子化,pH 为7.0时仍有99.91%质子化[12].实验条件下(pH =4.0~5.9),PEI 质子化程度相当严重,PEI 的质子化在5362 No.12 黄佳华等:聚乙烯亚胺⁃金属络合物的稳定常数及配位数的测定客观上使PEI 参与副反应而阻碍了PEI 分子中中性胺基与Cd 2+的络合.由于PEI 分子中的胺基对各种金属离子的络合能力存在差异,通过调节溶液pH 值达到分离各种金属离子的目的.2.3 PEI⁃Cd 络合物稳定常数的测定依照2.1节中的化学理论模型及超滤和ICP⁃MS 测定方法,实验中采用下述2种方法测定PEI⁃Cd 络合物稳定常数:(1)在50μg /L Cd 2+溶液中加入不同浓度的PEI,得到一系列不同Cd 2+/PEI 浓度比的混合溶液,按照实验步骤进行络合反应,测定络合反应平衡时溶液中的[Cd (PEI)n ]和[Cd 2+]+[Cd(OH)i ]+[Cd(Ac)j ],依照式(5)处理数据并进行线性拟合,求得PEI⁃Cd 络合物的稳定常数和平均配位数;(2)在90mg /L PEI 溶液中加入不同量的Cd 2+,得到一系列不同Cd 2+/PEI 浓度比的混合溶液,按照实验步骤操作,测定络合反应平衡时溶液中[Cd(PEI)n ]和[Cd 2+]+[Cd(OH)i ]+[Cd(Ac)j ]的比值,利用方法(1)得到的平均配位数和式(5)计算得到PEI⁃Cd 络合物的稳定常数.在25℃,pH =4.0时,依照上述2种方法测定的PEI⁃Cd 络合物的稳定常数见表1.结果表明,上述2种方法测得的PEI⁃Cd 络合物的稳定常数一致,可采用其中任一种方法测定稳定常数.Table 1 Complexation stability constant of PEI⁃Cd complex at pH =4.0(25℃,I =0.20mol /L )Initial concentration Concentration at equilibrium(measured or calculated)Reference data Calculated value [Cd 2+]/(μg㊃L -1)[PEI]/(mg㊃L -1)108[PEI]/(mol amine㊃L -1)y1010[OH -]/(mol㊃L -1)[Ac -]/(mol㊃L -1)K Cd⁃OH [OH -]i K Cd⁃Ac [Ac -]j K PEI⁃H [H +]n lg K PEI⁃Cd 5025 1.880.1810.030 1.47104.490.997.085070 5.270.3610.030 1.47104.490.997.085014010.500.7910.030 1.47104.490.997.085022016.60 1.2010.030 1.47104.490.997.085033024.80 2.1710.030 1.47104.490.997.082090 6.770.4510.030 1.47104.490.99 6.994090 6.770.4610.030 1.47104.490.997.016090 6.770.3910.030 1.47104.490.99 6.938090 6.770.4010.030 1.47104.490.99 6.94 表2列出了25℃下,pH 为4.0~5.9时PEI⁃Cd 络合物的稳定常数以及文献[11~13]报道的结果.可见,在此pH 范围内,PEI⁃Cd 络合物的稳定常数随着pH 值的增大而增大,平均配位数也随着pH 值的增大而变大,即随着溶液酸度变化,配位数可能是1或者2甚至更大,这与文献[10,11,14]结果一致;尽管PEI 平均分子量㊁测定方法和所利用的理论模型等与文献[11~13]存在差异,实验测得的稳定常数与文献值相当接近,而且测定精度较高,标准偏差为0.09~0.11,说明实验建立的化学理论模型和测定方法是合理㊁可靠的.Table 2 Comparison of PEI⁃Cd complexation stability constants and coordinating numbersCondition lg K PEI⁃Cd n Reference Method pH =4.0,25℃,I =0.20mol /L 7.08±0.100.99This study Ultra⁃filtration pH =5.0,25℃,I =0.20mol /L7.95±0.06 1.14This study Ultra⁃filtration pH =5.5,25℃,I =0.20mol /L 8.62±0.11 1.33This study Ultra⁃filtration pH =5.9,25℃,I =0.20mol /L 8.96±0.09 1.41This study Ultra⁃filtration 1.0mol /L NaNO 3,25℃8.57[11]Potentiometric titration 1.0mol /L KCl,25℃11.0[12]Potentiometric titration pH =6.0 6.062[13]Ultrafiltration 综上所述,利用所建立的化学理论模型,结合PC⁃UF 技术与ICP⁃MS 方法,测定了PEI⁃Cd 络合物在pH =4.0~5.9时的稳定常数和平均配位数.结果表明,在此pH 值范围内,PEI⁃Cd 络合物的稳定常数随pH 值的增大而增大,这与PEI 分子中的胺基在不同pH 值时的质子化程度有关.本文方法简单㊁快速㊁可靠,还可应用于除镉以外其它金属元素与PEI 形成的络合物稳定常数㊁平均配位数的测定.参 考 文 献[1] Juang R.S.,Liang J.F..J.Membr.Sci.[J],1993,82(1/2):163 174[2] Strathmann H..Separ.Sci.Tech.[J],1980,15(4):1135 11526362高等学校化学学报 Vol.33 [3] Volchek K.,Krentsel E.,Zhilin Y.,Shtereva G.,Dytnersky Y..J.Membr.Sci.[J],1993,79(2/3):253 272[4] Rumeau M.,Persin F.,Sciers V.,Persin M.,Sarrazin J..J.Membr.Sci.[J],1992,73(2/3):313 322[5] Juang R.S.,Chiou C.H..J.Membr.Sci.[J],2000,177(1/2):207 214[6] Canizares P.,Perez A.,Camarillo R..Desalination[J],2002,144(1 3):279 285[7] LIN Ji⁃Jun(林继军),DUAN Hua⁃Ling(段华玲),GONG Zhen⁃Bin(弓振斌).Chin.J.Anal.Chem.(分析化学)[J],2011,39(6):906 910[8] Morlay C.,Cromer M.,Mouginot Y.,Vittori O..Talanta[J],1998,45(6):1177 1188[9] Morlay C.,Cromer M.,Mouginot Y.,Vittori O..Talanta[J],1999,48(5):1159 1166[10] Juang R.S.,Chen M.N..Industrial and Engineering Chemistry Reseach[J],1996,35(6):1935 1943[11] Jarvis N.V.,Wagener J.M..Talanta[J],1995,42(2):219 226[12] Kobayashi S.,Hiroishi K.,Tokunoh M.,Saegusa T..Macromolecules[J],1987,20(7):1496 1500[13] Kadiolu S.I.,Yilmaz L.,Ozbelge H.O..Separ.Sci.Tech.[J],2009,44(11):2559 2581[14] Gregor H.P.,Luttinger L.B.,Loebl E.M..J.Phys.Chem.[J],1955,59(1):34 39[15] Nishikawa H.,Tsuchlda E..J.Phys.Chem.[J],1975,79(19):2072 2076[16] Wall F.T.,Gill S.J..J.Phys.Chem.[J],1954,58(12):1128 1130[17] Achterberg E.P.,Holland T.W.,Bowie A.R..Anal.Chim.Acta[J],2001,442(1):1 14[18] Wuhan University(武汉大学).Instrument Analysis,Version 4th(仪器分析,第四版)[M],Beijing:Higher Education Press,2000:328[19] ZHANG Han⁃Qi(张寒琦),TIE Yuan(铁元),WANG Da⁃Ning(王大宁),ZOU Ming⁃Qiang(邹明强),CHEN Chao(陈超).The BriefHandbook of Analytical Chemistry(分析化学简明手册)[M],Changchun:Jilin University Press,1996:115[20] CHEN Gui⁃E(陈桂娥),YAN Jian(阎剑),ZHANG Hai⁃Bin(张海滨),XU Zhen⁃Liang(许振良).Journal of East China University ofScience and Technology(Natural Science Edition)(华东理工大学学报,自然科学版)[J],2007,33(2):167 171[21] Rivas B.L.,Pooley S.A.,Pereira E.D.,Cid R.,Luna M.,Jara M.A.,Geckeler K.E..J.Appl.Poly.Sci.[J],2005,96(1):222 231[22] Cojocaru C.,Zakrzeska⁃Tranadel G.,Jaworska A..J.Hazard.Mater.[J],2009,169(1 3):599 609Measurement of Complexation Stability Constant and Coordinating Number of Poly (ethylenimine )with MetalsHUANG Jia⁃Hua 1,2,GONG Zhen⁃Bin 1,3*,LIN Ji⁃Jun 2,DUAN Hua⁃Ling 2(1.State Key Laboratory of Marine Environmental Science ,2.College of Ocean and Earth Sciences ,3.College of the Environment and Ecology ,Xiamen University ,Xiamen 361005,China )Abstract A rapid and accurate method using polymer complexation ultra⁃filtration(PC⁃UF)technique and inductively coupled plasma mass spectrometry(ICP⁃MS)for the measurement of the complexation stability con⁃stant and the average coordination number of poly(ethylenimine)(PEI)groups participating in the complex formation of PEI with metal ions was proposed.The method was applied to determine the stability constant and the average coordination number of PEI and Cd 2+complex.Firstly the mixture of various initial concentration ratios of PEI and Cd 2+solution were prepared,respectively,then the mixture reacted until the complexation equilibrium reached,and at last Cd 2+and small components were permeated into the solution and PEI⁃Cd com⁃plex was hold back with centrifugal ultra⁃filtration kit.Then ultra⁃filtration followed was completed so as to de⁃compose PEI⁃Cd complex and obtain Cd 2+species using 10mL 3%(volume fraction)HNO 3.With the help of chemical model inferred in the study,the complexation stability constant and the average coordinating number of PEI⁃Cd could be calculated.Effect of pH value(pH =4.0 5.9)on the equilibrium was investigated.The results showed that the complexation stability constant and the average coordinating number of PEI⁃Cd became larger as pH value increases.This may due to the protonation of PEI reduces as pH values increase,then the binding ability of PEI with metals become stronger.Keywords Poly(ethylenimine);Complexation stability constant;Coordinating number;Ultrafiltration tech⁃nique;Inductively coupled plasma mass spectrometry (Ed.:I ,S ,K )7362 No.12 黄佳华等:聚乙烯亚胺⁃金属络合物的稳定常数及配位数的测定。
双等色点分光光度法测定络合物稳定常数

双等色点分光光度法测定络合物稳定常数梁维安3 秦美芹 张震宇 邹时复(山东大学化学系,济南250100)摘 要 利用两种实验设计方案,获得了连续变化法吸收光谱中两个等色点,由这两个波长下吸光度计算出有关物种的摩尔吸光系数及平衡组份浓度,进而计算出络合物稳定常数。
关键词 双等色点,分光光度法,稳定常数 2001206204收稿;2001212220接受1 引 言当金属离子M 与配位体R 形成络合物MR n 时,若能测定出各个组分的平衡浓度[M]、[R]、[MR n ],则可以直接计算络合物稳定常数。
当R 及MR n 为有色组分(对光有吸收)时,由溶液吸光度A 计算平衡浓度[R]及[MR n ]的前提是要知道R 及MR n 的摩尔吸光系数εR 及ε。
等色点[1]是获得有关物种摩尔吸光系数的有效手段,而且当实验设计不同时,还可以得到不同的等色点,从而得到不同波长处有关物种的摩尔吸光系数。
本文采用两种实验设计方案,获得了两个等色点,测得两个等色点波长处R 及MR n 的摩尔吸光系数,记为εR1、εR2、ε1、ε2。
测定同一溶液在这两个波长处的吸光度值,分别为:A 1=εR1[R]+ε1[MR n ](1)A 2=εR2[R]+ε2[MR n ](2)由(1)、(2)式构成的方程组可解出[R ]及[MR n ],再由物料关系求出[M ],进而计算络合物稳定常数。
2 理论部分———等色点的获得2.1 由等摩尔连续变化法获得第一个等色点等摩尔连续变化法(又称job 法)[2]可用于测定络合物组成,该方法配制的一系列溶液中,金属离子M 及配位体R 的分析浓度同时变化,但二者总和不变,即:C M +C R =C 0(其中C R =C 0X ,C M =C 0(1-X ),X =C R P C 0。
X 为摩尔分数)。
其中一部分溶液(C R >nC M )吸收光谱相交于一点,形成等色点,如图1中曲线1~4所示(λ1=448.2nm ),另一部分溶液(C R >nC M )吸收光谱不交于该点(图1中曲线5~10所示)。
物理化学实验教学大纲

物理化学实验教学大纲《物理化学实验》教学大纲(2006.5修订)课程编码:课程名称:学分:总学时:一、本课程的地位、作用和目的与要求:物理化学实验(包括结构化学实验)是化学教育专业一门重要的基础实验课,通过实验课使学生加深对物理化学(含结构化学)原理的理解,培养学生实验研究能力和创新精神。
其目的使学生系统掌握基本的物理化学实验研究方法和基本技术,培养学生掌握物理化学实验及结构化学实验的基本知识和方法,训练学生使用仪器的操作技能,培养学生观察现象、正确记录和处理数据的能力,实践能力,全面提高学生素质。
要求学生完成实验20个,写出实验报告,并对实验进行讨论。
在做完实验的基础上参加实验考试。
考核方式一般可采用实验前的预习、实验操作、实验报告相结合,进行综合考核。
二、本课程教学基本要求本大纲提出22个实验项目可供选择。
要求学生完成实验20个,在选题时要兼顾到热力学、动力学、电化学、表面现象与胶体、结构化学等几个部分。
建议实验分配如下:热力学7个,动力学4个,电化学4个,表面现象与胶体3个,结构化学2个。
写出实验报告,并对实验进行讨论。
在做完实验的基础上参加实验考试。
考核方式一般可采用实验前的预习、实验操作、实验报告相结合,进行综合考核。
实验教学内容及学时分配素。
3燃烧热的测定必做6通过实验进一步明确燃烧热的定义,恒压燃烧热与恒容燃烧热的区别,以及用量热法测量燃烧热的基本原理。
了解氧弹式量热计的原理与构造,各部件的名称以及主要部件的作用、使用方法。
了解气体钢瓶的使用方法、注意事项,学会氧气减压阀的使用方法及原理。
熟悉用氧弹卡计测萘的恒容燃烧热的实验方法、步骤。
验证 3 了解积分熔解热和微分熔解热6 液体饱和蒸汽压的测定(学时)必做6程式的使用条件。
初步掌握真空减压系统装置和真空泵的构造,了解各种真空度的范围及获得的方法,熟悉福廷式气压计的构造、原理、使用;掌握等压计的构造、作用原理及使用方法。
学会测量CCl4于各温度下的饱和蒸气压。
络合物稳定常数测定的仪器分析方法

THANKS
感谢观看
络合物稳定常数测定的仪 器分析方法
• 引言 • 络合物稳定常数测定原理 • 络合物稳定常数测定方法 • 仪器分析方法实验步骤 • 仪器分析方法注意事项 • 络合物稳定常数测定展望
01
引言
络合物稳定常数测定的意义
络合物稳定常数测定是研究络合物在溶液中的稳定性和存在形式的重要手段,对 于了解络合物的性质、反应机理和络合物的应用具有重要意义。
通过络合物稳定常数测定,可以了解络合物的稳定性与络合物的组成、配位体的 性质、络合物的浓度等因素之间的关系,有助于深入理解络合物的反应机制和反 应动力学。
络合物稳定常数测定的应用
在化学反应工程中,络合物稳定常数测 定可用于研究络合物的生成和分解过程, 优化化学反应的条件,提高化学反应的
效率和产率。
靠性。
实验过程中应注意保持实验环 境的清洁和卫生。
数据处理与分析注意事项
实验数据应及时记录和处 理,避免遗漏和误差。
在数据分析过程中,应注 意排除异常值和离群值, 避免其对结果的影响。
ABCD
数据处理时应采用合适的 统计方法和图表形式,以 便更好地理解和分析数据。
数据分析结果应进行合理 的解释和推断,为后续研 究和应用提供有价值的参 考。
络合物稳定常数的值越大,表示络合物越稳定,越不容易离 解。
络合物稳定常数的影响因素
金属离子的性质
金属离子的性质如电荷、半径、 电子构型等对络合物稳定常数有 显著影响。
配位体的性质
配位体的性质如电荷、半径、电 子密度、空间构型等也会影响络 合物的稳定性。
温度
温度对络合物稳定常数的影响较 大,一般来说,温度升高会导致 络合物离解程度增加,稳定常数 减小。
甘氨酸亚铁稳定常数的检测方法及意义 鲍宏云

甘氨酸亚铁稳定常数的检测方法及意义鲍宏云甘氨酸亚铁稳定常数的检测方法及意义-鲍宏云《饲料工业》2021年第33卷第8期有机微量元素甘氨酸亚铁稳定常数的检测方法及意义鲍宏云许甲平邓志刚吴亚斌冯一凡(上海德邦牧业有限公司,上海200240)氨基酸亚铁作为一种新型饲料添加剂,以其良好的稳定性、高效的生物利用率广泛应用到饲料添加剂领域。
甘氨酸亚铁产品优次的评定指标主要有螯合率、稳定常数及络合强度。
其中稳定常数是评判甘氨酸亚铁稳定性的重要指标。
文中就甘氨酸亚铁稳定常数的检测方法及检测意义作一综述,为广大消费者选择优质甘氨酸亚铁提供技术支持。
1甘氨酸亚铁的稳定常数平衡常数所指的就是螯合物中螯合剂(配位体)对金属离子的亲和力。
金属螯合物中的金属元素的利用情况依赖于它的平衡常数[1-2]。
如果平衡常数过高,则其中的金属元素在胃肠道环境中易离解成金属离子;如果平衡常数过低,则当机体须要时,螯合物无法及时释放出来金属元素,导致机体就可以稀释却无法有效率利用其中的金属元素。
氨基酸螯合铁的平衡常数通常在4~10之间,既有助于螯合物的稀释和运输,当动物机体须要时,金属离子又能够有效率而快速地与配位体拆分,从螯合物中转化成可供机体利用。
甘氨酸亚铁的平衡常数为4.3,有助于动物机体对铁的稀释利用。
2甘氨酸亚铁平衡常数的检测方法稳定常数是评判甘氨酸亚铁稳定性的重要指标。
对于甘氨酸亚铁来说,使用定性和定量方法检测稳定常数是决定其质量的重要判定标准。
2.1甘氨酸亚铁稳定性定性检测方法热重法、x射线绕射可以用作检测氨基酸铁络合物液态样品中有没有化氢态元素存有,但呼吸困难用作液体样品的检测。
化学电解变色反应也能够检测至络合物的存有,这种方法操作方式直观,应用领域范围广。
2.1.1热重法物质受热时,发生化学反应,质量也就随之改变,测量物质质量的变化就可以研究其变化过程。
热重法(tg)[3]就是在程序控制温度下,测量物质质量与温度第一关被系的一种技术。
分光光度实验

实验一 配合物组成和稳定常数的测定一、目的学习连续变化光度法测定络合物组成和稳定常数的基本原理和实验方法。
二、原理连续变化法是测定络合物组成及其稳定常数常用的方法之一。
如果金属离子M 与络合剂L 形成络合物ML ,我们可制备一系列溶液,其中络合剂的浓度C L 和金属离子的浓度C M 之和,即总浓度C 为一个常数。
C L +C M =C (常数)或(C L /C )+(C M /C )=1实验时,选择ML 最大吸收波长,在该波长处L 和M 都不吸收。
改变C L 和C M 的相对比例,测量这一系列溶液的吸光度,并对络合剂浓度与总浓度之C L /C 作图即得三角形的曲线,如图。
把三角形两边延长相交,从交点处的浓度比,即可求出络合物的组成。
若络合物的组成为MLn ,则配位数n 可以从以下式求得:n=C L /C M =(C L /C )/[1-(C L /C )]如图中求得C L /C =0.5,则n=1,该络合物组成为ML 。
连续变化法从图中可以看出,在实验测得的最大吸光度A 处,络合剂与金属离子的浓度比与络合物中的络合比完全相同。
此时络合物有一定程度的离解,络合剂与金属离子在溶液中均不过量。
延长线交点的吸光度A m 为络合物完全不离解时应具有的吸光度值。
A m 与A 之间有一定偏差,偏差愈小,说明络合物离解愈小,即络合物愈稳定。
据此可以计算出络合物的稳定常数。
络合物在溶液中存在着下列平衡M+L ML该络合物的稳定常数为[M][L][ML]=K (1)根据比尔定律,溶液的吸光度与络合物的浓度成正比,则有C[ML]/=m A A (2) 式中C =C L =C M ,又[M]=[L]=C -[ML]=C [1-(A /A m )] (3)将(2)(3)代入(1)得C A A A A K m m 2)]/(1[)/(-= (4)本实验是测定磺基水杨酸-铁络合物的组成及稳定常数,实验在0.1 mol·L -1 HClO 4 溶液中进行,络合物为紫红色。
实验十一 配位化合物的组成和稳定常数的测定

配位化合物的组成和稳定常数的测定
随着科学技术的发展,配合物在科学研究和生产实践中显示出越来越重要的意义, 配合物不仅在化学领域里得到广泛的应用,并且对生命现象也具有重要的意义。人体内 各种酶(生物催化剂)的分子几乎都含有以配合状态存在的金属元素。配位化学与有 机、分析等化学领域以及生物化学、药物化学、化学工业都有着密切的关系,应 用非常广泛。 配位化学的研究有一整套的物理实验方法,如测定稳定常数可以采用 pH 法、电位 法、极谱法、分光光度法、溶剂萃取法、离子交换法等,这些方法对于配合物的组成、 结构和构象的研究是十分有效的。 我国化学家陈荣悌还报道了利用高效液相色谱法来测 定配位化合物稳定常数的新方法。 从上世纪 40 年代起,人们开始涉足于生物配合物的研究,陆续报道了各种生命金 属与各种 α-氨基酸、生物配体、羧肽酶和碳酸酐酶配合物的稳定常数。从这些研究中得 到了许多有关生物配体的新信息。到了 60 年代,配合物的研究方法又有了新的发展。 一方面出现了全新的物理方法, 如 M?ssbauer(穆斯堡尔)谱; 另一方面对原有的方法作了 改进,研究范围进一步扩大,如 Raman(拉曼)光谱采用了激光源,提高了光谱强度,使 有色配合物的研究成为可能;核磁共振谱因位移试剂的应用,提高了分辨率。这些方法 被应用于生物体内酶的结构和催化反应的研究以及化学模拟的研究。
3.测定吸光度 在 500nm 波长下分别测定上述溶液的吸光度,将所得数据记录于表 11-1。以吸光 度对磺基水杨酸的摩尔分数作图。 从所得的等摩尔系列图中找出最大吸收处的的配位体摩尔分数(XL)和金属离子摩 尔分数(1-XL) ,由公式(1)计算得配合物的组成;由公式(2)计算得配合物的解离 度;据公式(3)计算得配合物的表观稳定常数。
' K稳
配合物的稳定常数的测定
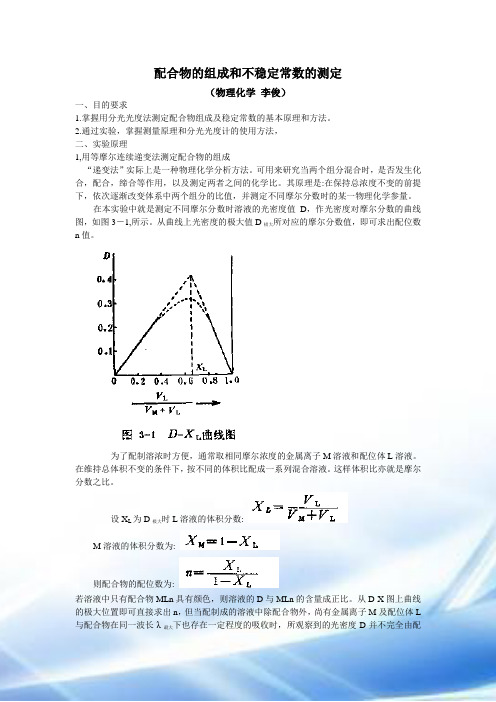
配合物的组成和不稳定常数的测定(物理化学李俊)一、目的要求1.掌握用分光光度法测定配合物组成及稳定常数的基本原理和方法。
2.通过实验,掌握测量原理和分光光度计的使用方法,二、实验原理1,用等摩尔连续递变法测定配合物的组成“递变法”实际上是一种物理化学分析方法。
可用来研究当两个组分混合时,是否发生化合,配合,缔合等作用,以及测定两者之间的化学比。
其原理是:在保持总浓度不变的前提下,依次逐渐改变体系中两个组分的比值,并测定不同摩尔分数时的某一物理化学参量。
在本实验中就是测定不同摩尔分数时溶液的光密度值D,作光密度对摩尔分数的曲线图,如图3-1,所示。
从曲线上光密度的极大值D极大所对应的摩尔分数值,即可求出配位数n值。
为了配制溶浓时方便,通常取相同摩尔浓度的金属离子M溶液和配位体L溶液。
在维持总体积不变的条件下,按不同的体积比配成一系列混合溶液。
这样体积比亦就是摩尔分数之比。
设X L为D极大时L溶液的体积分数:M溶液的体积分数为:则配合物的配位数为:若溶液中只有配合物MLn具有颜色,则溶液的D与MLn的含量成正比。
从D-X图上曲线的极大位置即可直接求出n,但当配制成的溶液中除配合物外,尚有金属离子M及配位体L 与配合物在同一波长λ最大下也存在一定程度的吸收时,所观察到的光密度D并不完全由配合物MLn的吸收所引起,必须加以校正。
所以选择适当的波长范围,仅使配合物MLn有吸收,M和L都不吸收或极少吸收。
2.配合物平衡常数的测定假定配合物中心离子浓度不变,而渐增加配位体浓度,随着配位体浓度的改变,中心离子被配成MLn,溶液的光密度值D不断升高。
当中心离子被完全配合后,如继续增加配位体的浓度,则溶液的光密度值D趋于恒定,如图3-2。
设配合物在稀溶液中有如下解离平衡存在:最初浓度平衡浓度式中,n-配位数,已由实验确定;a-解离度:C-配合物未解离时的浓度(在本实验中亦为M完全配合时的配合物浓度)。
式中Dm 是M 完全被配合时溶液的光密度值,Dn 是L 与M 摩尔比为n 时溶液的光密度,此时虽达平衡,但M 未被完全配合。
分光光度法测定替米沙坦

分光光度法测定替米沙坦黄艳丽【摘要】用分光光度法研究了替米沙坦与茜素的荷移反应,提出了测定替米沙坦的荷移分光光度法。
在丙酮溶剂中,替米沙坦和茜素形成的络合物的最大吸收波长为548nm,两者的组成比为1比2。
替米沙坦质量浓度在16~240mg·L^-1范围内服从比耳定律,表观摩尔吸光率为2.34×10^3L·mol^-1·cm^-1。
采用此法分别测定了替米沙坦胶囊和片剂中替米沙坦的含量,所得测定值与文献报道值相符。
用标准加入法做方法的精密度和回收试验,测得回收率为99.5%(胶囊)和99.8%(片剂)。
%As studied by spectrophotomety, a complex with composition ratio of 11 to 2 was formed by the charge-transfer reaction between telmisartan and alizarin, having its absorption maximum at the wavelength of 548 nra Linear relationshiop between values of absorbance and mass concentration of telmisartan was obtained in the range of 16--240 mg. L^-1 , with apparent molar absorptivity of 2. 34× 10^3L . mol^-1, cm^-1. Based on these facts, a method of spectrophotometric determination of teimisartan was proposed and used in the analysis of drug samples of telmisartan capsules and tablets for their telmisartan contents, giving results in consistency with those values given in literature. Tests for precision and recovery were performed by standard and 99.8%for the tablets.【期刊名称】《理化检验-化学分册》【年(卷),期】2012(048)007【总页数】3页(P818-819,822)【关键词】分光光度法;替米沙坦;茜素;荷移反应【作者】黄艳丽【作者单位】辽宁医学院,锦州121001【正文语种】中文【中图分类】O657.32替米沙坦是一种口服起效的、特异性血管紧张素Ⅱ受体(AT1型)拮抗剂,与血管紧张素Ⅱ受体AT1亚型(已知的血管紧张素Ⅱ作用位点)呈高亲和性结合,该结合作用持久,但无任何激动剂效应,临床上主要用于轻中度高血压治疗[1]。
分光光度法测的络合物的稳定常数

实验六 分光光度法测的配合物的稳定常数一、目的与要求1.掌握连续法测定配合物组成及稳定常数的方法; 2.掌握分光光度计的使用方法; 3.用分光光度法中的连续变化法测的Fe +3与钛铁试剂形成配合物的组成及稳定常数。
二、预习与思考1.了解连续法测的配合物组成及稳定常数的基本原理; 2.预习7200型分光光度计的构造原理和使用方法; 3.思考(1) 怎样求配位数n ?如何计算配合物稳定常数?(2) 测定λmax 的目的是什么?如何决定配合物最大吸收波长? (3) 使用分光光度计时应注意什么?比色皿大小如何选择? 三、实验原理溶液中金属离子M 和配位体L 形成配合物,其反应式为:n ML nL M −→←+当达到络合平衡时:n ML n M LC K C C=(6.1)式中:K 为配合物稳定常数;C M 为络合平衡时金属离子的浓度(严格应为活度);C L 为络合平衡时的配位体浓度;C MLn 为络合平衡时的配合物浓度;n 为配合物的配位数。
配合物稳定常数不仅反映了它在溶液中的热力学稳定性,而且对配合物的实际应用,特别是在分析化学方法中具有重要的参考价值。
显然,如能通过实验测得公式(6.1)中右边各项浓度及n 值,则就能算得K 值。
本实验采用分光光度来测定上列这些参数。
1. 分光光度法的实验原理:让可见光中各种波长单色光分别、依次透过有机物或无机物的溶液,其中某些波长的光即被吸收,使得透过的光形成吸收谱带。
如图П-6-1所示,这种吸收谱带对于结构不同的物质具有不同的特性,因而就可以对不同产物进行鉴定分析。
根据比尔定律,一定波长的入射光强I 0 与透射光强I 之间的关系:kcd e I I -=0 (6.2)式中:K 为吸收系数,对于一定溶质、溶剂及一定波长的入射光K 为常数,C 为溶液浓度,d 为盛样溶液的液槽的透光厚度。
由(6.2)式可得:kcd II =0ln(6.3) cd k A I I A I I 303.2,lg ,00==则得:令称透射比。
物理化学实验教学大纲

《物理化学实验》教学大纲(2006.5修订)课程编码:课程名称:学分:总学时:一、本课程的地位、作用和目的与要求:物理化学实验(包括结构化学实验)是化学教育专业一门重要的基础实验课,通过实验课使学生加深对物理化学(含结构化学)原理的理解,培养学生实验研究能力和创新精神。
其目的使学生系统掌握基本的物理化学实验研究方法和基本技术,培养学生掌握物理化学实验及结构化学实验的基本知识和方法,训练学生使用仪器的操作技能,培养学生观察现象、正确记录和处理数据的能力,实践能力,全面提高学生素质。
要求学生完成实验20个,写出实验报告,并对实验进行讨论。
在做完实验的基础上参加实验考试。
考核方式一般可采用实验前的预习、实验操作、实验报告相结合,进行综合考核。
二、本课程教学基本要求本大纲提出22个实验项目可供选择。
要求学生完成实验20个,在选题时要兼顾到热力学、动力学、电化学、表面现象与胶体、结构化学等几个部分。
建议实验分配如下:热力学7个,动力学4个,电化学4个,表面现象与胶体3个,结构化学2个。
写出实验报告,并对实验进行讨论。
在做完实验的基础上参加实验考试。
考核方式一般可采用实验前的预习、实验操作、实验报告相结合,进行综合考核。
实验教学内容及学时分配1.物理化学实验绪论(4课时)[目的要求]1、实验要求(预习、操作等)、考核评分方法、安全防护、实验室规则。
2、误差的基本概念、误差分析、有效数字及其计算规则。
3、实验报告的要求和格式、数据的记录和表达(列表、作图、数学方程)。
[实验内容](1)物理化学实验绪论(2)误差分析(3)数据处理实验一恒温槽的装配和性能测试(4学时)[目的要求]1.了解恒温槽的构造及恒温原理,初步掌握装配和调试技术;2.掌握温差温度计的调节和使用;3.绘制恒温槽灵敏度曲线T-t。
[实验内容]装配恒温槽并调试及测定灵敏度。
实验二燃烧热的测定(6学时)[目的要求]1.了解氧弹量热计构造原理, 掌握氧弹量热计的实验操作技术;2.掌握燃烧热的测定技术;3.了解QP、QV差别和相互关系;[实验内容]用氧弹量热计测量萘的燃烧热。
物化实验复习

液体饱和蒸气压的测定(12分/3题)1.测定液体饱和蒸汽压的方法有哪些?答:(1) 饱和气流法:在一定温度、压力下,把干燥气体缓慢通过待测液体,使气流为该液体的蒸汽所饱和。
然后用某种物质将气流中该液体的蒸汽吸收,知道了一定体积的气流中蒸汽的质量,便可计算出蒸汽的分压,这个分压就是该温度下待测液体的饱和蒸汽压。
此法一般适用于蒸汽压比较小的液体。
(2) 动态法:在不同外界压力下,测定液体的沸点。
(3) 静态法:将待测液体放在一个封闭体系中,在不同温度下,直接测量饱和蒸汽压。
此法准确率较高,一般适用于蒸汽压比较大(200×105~1×105)的液体。
本实验采用静态法测定乙醇的饱和蒸汽压。
2.克劳修斯—克拉贝龙方程在什么条件下才适用?答:①:液体的摩尔体积V l与气体的摩尔体积V g相比可略而不计;②:忽略温度对摩尔蒸发热△vap H m的影响,在实验温度范围内可视其为常数;③:气体可视为理想气体。
3. 等压计U型管中的液体起什么作用?冷凝器起什么作用?为什么可用液体本身做U型管封闭系统?答:(1)U型管作用:①封闭气体,防止空气进行AB弯管内;②作等压计用以显示U 型管两端液面上的压力是否相等。
(2)将U型管内封闭液蒸气冷凝,防止其“蒸干”。
(3)封闭液作用是封闭和作等压计,可用液体本身作封闭液。
若用其他液体作封闭液,则平衡时a球上方的气体为封闭液蒸汽和乙醇蒸汽的混合气体,测定结果偏高。
4.开启旋塞放空气入体系内时,放得过多应如何办?实验过程中为什么要防止空气倒灌?答:①:必须重新排除净AB弯管内的空气。
②:AB弯管空间内的压力包括两部分:一是待测液的蒸汽压;另一部分是空气的压力。
测定时,必须将其中的空气排除后,才能保证B管液面上的压力为液体的蒸汽压。
5.如果升温过程中液体急剧气化,该如何处理?缓慢放入空气,使系统压力慢慢升高,以保持等压计两液面平齐,以免使等压计内的乙醇急剧沸腾,使液封量减少。
物化实验思考题2018

物化实验思考题一、燃烧热的测定1.指出ΔrHm=ΔrUm+∑νB(g)RT 公式中各项的物理意义。
在苯甲酸和萘的燃烧反应中∑νB(g)各为多少?2.实验测得的温度差为何要用雷诺作图法校正?除此外,还有哪些误差影响测量的结果?3.详细说明该实验中哪些部分属于体系?二、分光光度法测络合物稳定常数1. 为什么要控制溶液的pH?2. 为什么要在λmax下,测定络合物的消光值D?为什么所测的消光值D要进行校正?详细说明如何校正?3. 溶液的消光值D为负值是否正常现象?哪些因素可能使消光值出现负值?三、金属相图1. 在本实验室的实验条件下,可否用加热曲线作相图,为什么(以自己的实验数据加以说明)?2. 详细说明含20%Sn和含61.9%Sn的样品在冷却过程中的相态变化。
3. 在所测样品中,哪些样品的水平线段不明显,说明出现这种现象的原因。
四、蔗糖水解1. 如何从实验结果,分析说明蔗糖水解反应为一级反应?影响反应速率常数的因素有哪些?2. 本实验中,蔗糖、葡萄糖、和果糖的比旋光度[α]D20分别为+66.6o、+52.5o、-91.9o,随着水解反应的进行,溶液的旋光性以及旋光度数据将如何变化?3. 恒温槽现有水温为32o C,如果要在40 o C恒温,写出详细的操作步骤。
4. 测定旋光度过程中,为什么前10次的时间间隔为2分钟而后10次的时间间隔为5分钟?五、乙酸乙酯皂化反应1. 为什么本实验要在恒温下进行?而且氢氧化钠与乙酸乙酯溶液混合前要预先恒温?2. 如何从实验结果验证乙酸乙酯皂化反应为二级反应?3. 各溶液在恒温和操作过程中为什么要盖好盖子?4. 被测溶液的电导率是哪些离子的贡献?反应进程中溶液的电导率如何变化?为什么?六、BZ振荡反应1. 本实验测得的数据是电动势随时间的周期性变化,其实质主要是什么电对电位随时间的变化?2. 在电势随时间变化的曲线中,波峰和波谷对应的溶液是什么颜色?为什么?3. 在本实验中,控制振荡的物种是什么?在每一个周期中,电势从波谷上升到波峰时,该物种浓度如何变化?。
物化实验分光光度法测定络合物的稳定常数实验报告

分光光度法测定络合物的稳定常数Ⅰ. 目的要求一、掌握用分光光度法测定络合物组成及稳定常数的基本原理和方法;二、学会使用72型分光光度计。
Ⅱ. 基本原理溶液中金属离子M和配位体L形成络合物ML n,其反应式为M + L ML n。
当达到络合平衡时,该络合物的稳定常数为:(1)式中:K为络合物稳定常数;C M 为络合平衡时金属离子的浓度(严格应为活度);C L为络合平衡时的配位体浓度;C MLn为络合平衡时的络合物浓度;n为络合物的配位数。
络合物稳定常数不仅反映了它在溶液中的热力学稳定性,而且对络合物的实际应用,特别是在分析化学方法中具有重要的参考价值。
显然,如能通过实验测得公式(1)中右边各项浓度及n值,则就能算得K 值。
本实验采用分光光度来测定上列这些参数。
1. 分光光度法的实验原理:让可见光中各种波长单色光分别、依次透过有机物或无机物的溶液,其中某些波长的光即被吸收,使得透过的光形成吸收谱带。
如图1所示,这种吸收谱带对于结构不同的物质具有不同的特性,因而就可以对不同产物进行鉴定分析。
根据比尔定律,一定波长的入射光I0与透射光强I之间的关系:I= I0e-kcd(2)式中:k为吸收系数,对于一定溶质、溶剂及一定波长的入射光k为常数,c为溶液浓度,d为盛样溶液的液槽的透光厚度。
由(2)式可得:(3)I0/I称为透射比,令D=2.303lg(I0/I),则得D=kcd (4)从公式可看出:在固定液槽厚度d和入射光波长的条件下,光密度D与溶液浓度c成正比,选择入射光的波长,使它对物质既有一定的灵敏度,又使溶液中其它物质的吸收干扰为最小。
作光密度D对被测物质c的关系曲线,测定未知浓度物质的吸光度,即能从D~c关系上求得相应的浓度值,这是光度法的定量分析的基础。
图1 吸收谱带2. 等摩尔数连续递变法测定络合物的组成通常在络合反应中常伴有颜色的明显变化,根据这一特点可用分光光度法测,例如Fe3+与钛铁试剂[C6H2(OH)2(SO3Na)2]在不同pH的溶液中定其组成及K稳形成不同配位数的络合物,测定该络合物的组成可用浓比递变法,这种方法的要点是先配置一系列总摩尔数不变,但体系中两个组分的摩尔分数比值依次改变的溶液,为了方便常用相同浓度的金属离子M溶液与配位体L溶液,在保持总体积不变的条件下,按不同体积比配置一系列溶液,因而这些混合溶液中Fe3+与钛铁试剂总浓度不变,当混合溶液中二者的分子比(即体积比)相当于络合物组成时,溶液中络合物浓度最高,溶液的颜色也最深,因此用分光光度计测出各份溶液的吸光度D ,利用D 对各溶液的体积比作图,则从曲线的最高点所对应的体积比即可求出络合物的组成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例:以下三种复杂化合物 AgCl·2NH3 CuSO4·4NH3 KCl·MgCl2·6H2O
溶于水后: 溶于水后: AgCl·2NH3 → [Ag(NH3)2]+ + ClCuSO4·4NH3 →[Cu(NH3)4]2++SO42KCl·MgCl2·6H2O → K+ +Mg2++3Cl- + 6H2O
编 号 VM/ mL VR/ mL
1
2
3
4
5
6
7
8
9
12.00
3.00
4.00
5.00
6.00
7.00
8.00
9.00 10.00
10.00
9.00
8.00
7.00
6.00
5.00
4.00
3.00
2.00
1.00 0.00
3.测定系列溶液吸光度。 测定系列溶液吸光度。 测定系列溶液吸光度 (λ=500nm,b=1cm,以蒸馏水为空白 = , ,以蒸馏水为空白)
2+
[Cu(NH3)4]2+
[Ag(NH3)2]+
[Fe (CN)6 ]3-
配合物的组成
[Cu (NH3) 4 ] SO4 中 外 配 配 界 位 心 位 离 体 体 子 数 K3 [Fe (CN) 6 ] 中 配 配 外 心 位 位 界 离 体 体 子 数
内界
内界
1.中心离子:配合物中占据中心位置正离子 中心离子: 中心离子 或原子。又称形成体。 或原子。又称形成体。 2.配位体:与中心离子配合的离子或分子称 配位体: 配位体 为配位体。 为配位体。如H2O、NH3、CN- 、 、 Cl-、F- 等。 3. 配位原子:在配位体中,直接与中心离子 配位原子:在配位体中, 配位的原子称为配位原子。 配位的原子称为配位原子。 中的O 如 H2O中的 ,NH3中的 N。 中的 。
Kf 称为配离子的稳定常数 称为配离子的稳定常数 稳定常数,Kf 越大, 越大, 配离子越稳定。 配离子越稳定。
实验目的
1. 了解分光光度法测定溶液中配位化合物的组 成及稳定常数的原理和方法; 成及稳定常数的原理和方法; 2.测定当 测定当pH<2.5时,磺基水杨酸合铁的组成及 测定当 时 其稳定常数; 其稳定常数; 3.学会使用分光光度计。 学会使用分光光度计。 学会使用分光光度计
基本操作
1. 溶液的配制 2. 吸量管的使用操作 3. 容量瓶的使用操作 4. 721型分光光度计的使用 型分光光度计的使用
2. 吸量管(移液管)的使用操作 吸量管(移液管)
3. 容量瓶的使用操作
型分光光度计的使用方法: 型分光光度计的使用方法 检查仪器的电源线连接及各个调节旋钮的起始 ①4. 721型分光光度计的使用方法: 位置,并将“灵敏度调节旋钮”调至“ 档 位置,并将“灵敏度调节旋钮”调至“1”档。 开启电源开关,指示灯亮。 波长手轮” ②开启电源开关,指示灯亮。用“波长手轮”将 波 长调至工作波长(500nm)处。 长调至工作波长( 处 仪器预热20分钟 打开试样室盖, 分钟。 ③仪器预热 分钟。打开试样室盖,光门立即自 动关闭。 动关闭。 旋钮” 使显示为“ ④调“0%T旋钮”,使显示为“00.0”;盖上舱盖, 旋钮 ;盖上舱盖, 光 门自动打开;将参比溶液置于光路中。调 门自动打开;将参比溶液置于光路中。 旋钮” 使显示为“ “100%T旋钮”,使显示为“100.0”; 旋钮 ; 将待测溶液推入光路, 指针显示器” ⑤将待测溶液推入光路,“指针显示器”上显示 的
单基配位体: 单基配位体:配位体中只有一个原子与中心 离子配位。 离子配位。H2O、NH3、CN-、 、 Cl-、F- 等是单基配位体。 等是单基配位体。 多基配位体: 多基配位体:一个配位体中有两个或两个以 上的配位原子与中心离子配位, 上的配位原子与中心离子配位 称为多基配位体。 称为多基配位体。 乙二胺、乙二胺四乙酸(EDTA). 如C2O42--、乙二胺、乙二胺四乙酸 乙二胺(en): NH2—CH2—CH2—H2N : 乙二胺
实验内容
1.配制 配制0.0010mol·L-1NH4Fe(SO4)2和0.0010mol·L-1 配制 磺基水杨酸溶液各100mL; 磺基水杨酸溶液各 (pH偏离 用H2SO4或NaOH进行调节 偏离2用 进行调节) 偏离 进行调节 2.配制系列溶液 配制系列溶液; 配制系列溶液 在干净、干燥的烧杯中进行; ①在干净、干燥的烧杯中进行 两位同学一组; ②两位同学一组 为了减少误差,同一种溶液由同一位同 ③为了减少误差 同一种溶液由同一位同 学移取。 学移取。
配合物:含有配离子(配位单元)的 配合物:含有配离子(配位单元) 化合物称为配合物。 化合物称为配合物。
AgCl·2NH3、 CuSO4·4NH3是配合物 , 、 复盐。 KCl·MgCl2 ·6H2O 称为复盐。 称为复盐
NH3 NH3 Cu2+ NH3 NH3 [ NH3 Ag+ NH3 ]+
实验原理
磺基水杨酸与Fe 磺基水杨酸与 3+离子可以形成稳定的配位 化合物,其组成随溶液pH值的不同而改变 值的不同而改变。 化合物,其组成随溶液 值的不同而改变。在 pH=2~3、4~9、9~11时,磺基水杨酸与 3+ ~ 、 ~ 、 ~ 时 磺基水杨酸与Fe 能分别形成三种不同颜色、不同组成的配离子: 能分别形成三种不同颜色、不同组成的配离子: pH=2~3,为紫红色配合物; = 配合物; , 紫红色配合物 红色配合物 pH=4~9,生成红色配合物; = ,生成红色配合物; pH=9~11,生成黄色配合物 = 黄色配合物 ,生成黄色
本实验采用等摩尔连续变化法通过分光 本实验采用等摩尔连续变化法通过分光 等摩尔连续变化法 光度计测定配位化合物的组成。具体操作时, 光度计测定配位化合物的组成。具体操作时, 取用摩尔浓度相等的金属离子溶液和配位体溶 按照不同的体积比(即摩尔数之比 即摩尔数之比)配成一 液,按照不同的体积比 即摩尔数之比 配成一 系列溶液,测定其吸光度值。以吸光度值A 系列溶液,测定其吸光度值。以吸光度值 为 纵坐标,体积分数( 即摩尔分数。式中:VM为 纵坐标,体积分数( 即摩尔分数。式中: 金属离子溶液的体积, 金属离子溶液的体积,VL为配位体溶液的体 为横坐标作图, 积)为横坐标作图,将曲线两边的直线部分延 为横坐标作图 长相交于B点 最大。 长相交于 点,B点对应的吸光度值 AB 最大。 点对应的吸光度值 由B点对应的摩尔分数值可计算配离子中金属 点对应的摩尔分数值可计算配离子中金属 离子与配位体的摩尔数之比,即可求得配离子 离子与配位体的摩尔数之比, MLn 中配位体的数目 。 中配位体的数目n
本实验是测定pH=2~3时所形成的紫红色 ~ 时所形成的紫红色 本实验是测定 磺基水杨酸合铁(Ⅲ 配离子的组成及其稳定常数 配离子的组成及其稳定常数。 磺基水杨酸合铁 Ⅲ)配离子的组成及其稳定常数。 实验中通过加入一定量的HClO4溶液来控制溶液 实验中通过加入一定量的 pH值 由于所测溶液中磺基水杨酸是无色的, 的pH值。由于所测溶液中磺基水杨酸是无色的, Fe3+溶液的浓度很小,也可认为是无色的,只有 溶液的浓度很小,也可认为是无色的, 磺基水杨酸合铁(Ⅲ 配离子 配离子(MRn)是有色的。 是有色的。 磺基水杨酸合铁 Ⅲ)配离子 是有色的
使用注意事项: 使用注意事项: ①每台仪器所配套的比色皿,不能与其它仪器 每台仪器所配套的比色皿, 上的比色皿单个调换; 上的比色皿单个调换; 取放比色皿时,只能用手拿毛玻璃面 毛玻璃面; ②取放比色皿时,只能用手拿毛玻璃面;擦试 比色皿外壁溶液时,只能用镜头纸;比色皿 比色皿外壁溶液时,只能用镜头纸; 内盛放的溶液不能超过其高度的4/5; 内盛放的溶液不能超过其高度的 ;比色皿 透光玻璃面通过光 放入比色皿框中时,应使透光玻璃面 放入比色皿框中时,应使透光玻璃面通过光 路。 比色皿要先用去蒸馏水冲洗, ③比色皿要先用去蒸馏水冲洗,再用待测溶液 冲洗2~ 遍 冲洗 ~3遍。
4.配位数 直接与中心离子配位的配位原子 配位数: 配位数 的数目叫做中心离子的配位数。 的数目叫做中心离子的配位数。 例: [Cu (NH3)4]SO4 [Cu(en)2]2+ K3 [Fe (CN)6 ] [Zn(EDTA)]2Cu2+ 的配位数为 4 Cu2+ 的配位数为 4 Fe3+ 的配位数是 6 Zn2+的配位数是 6
O 草酸根: 草酸根
O
‖ ‖
—O—C—C—O—
乙二胺四乙酸(EDTA) 乙二胺四乙酸( ) HOOC—CH2 CH2—COOH N—CH2CH2—N HOOC—CH2 CH2—COOH
多基配位体与中心离子配位后形成的配 合物具有环状结构 环状结构, 合物具有环状结构,例:[Cu(en)2]2+ H2C—H2N Cu H2C—H2N 两个五员环 NH2—CH2 NH2—CH2
1. 如果溶液中同时有几种不同组成的有色配合物存 在,能否用本实验方法测定它们的组成和稳定常 为什么? 数?为什么? 为什么 2. 实验中测定的每份溶液的 值是否需要一致 如不 实验中测定的每份溶液的pH值是否需要一致 值是否需要一致?如不 一致对结果有何影响? 一致对结果有何影响? 3. 实验中加入一定量的 实验中加入一定量的HClO4溶液,其目的是什么 溶液,其目的是什么? 4. 为什么说溶液中金属离子的摩尔数与配位体摩尔 数之比正好与配离子组成相同时,配离子的浓度 数之比正好与配离子组成相同时, 为最大? 为最大? 5. 使用比色皿时,为什么不能用滤纸擦透光面,而 使用比色皿时,为什么不能用滤纸擦透光面, 只能用镜头纸擦? 只能用镜头纸擦
根据朗伯 比尔 根据朗伯-比尔 朗伯 (Lambert-Beer)定律, 定律, 定律 有色溶液的吸光度与 溶液的浓度和液层厚 度成正比。 度成正比。当液层厚 度不变时, 度不变时,吸光度只 与溶液浓度成正比: 与溶液浓度成正比:
