浮游植物的采集
浮游动植物采样方法

浮游动植物采样方法
一、浮游植物定量
用1L的塑料瓶,直接在采样点装满水,加10-15ml的鲁哥试剂,摇匀。
鲁哥试剂即将6g碘化钾溶于20ml水中,待其完全溶解后,将4g碘充分摇动,待其完全溶解后,定容至100ml,即配成鲁哥氏液。
二、浮游植物定性
定性样品用孔径约0.064 mm的25号浮游生物网在水面下约0.5 m处以适当的速度作“∞”字形来回拖动1~3 min,获得的浓缩样,放入50ml的白色方瓶中,添加适量的鲁哥氏液固定。
三、浮游动物定量
表层取水样10L(中层和底层取20L水样)过25号浮游生物网,获得的浓缩样,放入50ml的白色方瓶中,4%添加的福尔马林溶液。
福尔马林溶液即40%的甲醛与蒸馏水按照1:9的比例混合配制而成。
四、浮游动物定性
定性样品用孔径约0.064 mm的25号浮游生物网在水面下约0.5 m处以适当的速度作“∞”字形来回拖动1~3 min,获得的浓缩样,放入50ml的白色方瓶中,添加适量的鲁哥氏液固定。
浮游植物采集与监测

监测意义
最重要的初级生产者 水中溶解氧的主要供应者 能量流动、物质循环和信息传递 浮游植物的种类组成、群落结构和丰度变化,直接影 响水体水质、系统内能量流、物质流和生物资源变动。 应用: 1)水质监测和环境评价 2)生态学研究 藻类是反映水体环境质 3)水环境治理和修复 量的重要生物指标 4)渔业生产力估算 5)其它:例如法医鉴定、空气污染程 度指示等
现场记录
采集时间
Hale Waihona Puke 采集地点 采集深度 水温 pH 气候条件
常规理化参数
透明度盘
样品固定
1. 鲁哥氏液 作用:浮游生物定量样品的固定及染色。 配方:碘化钾20克,溶于200毫升含冰醋 酸20毫升的蒸馏水中,溶解后加入碘10 克,溶解后贮存于密闭的棕色试剂瓶中。 用量:1L+ 10毫升鲁哥氏液。 长期保存时,再加入福尔马林液 2. 福尔马林液 作用:浮游生物定性样品的固定 配方: 90 mL 40%甲醛 +10mL甘油 用量:100毫升水样+10毫升福尔马林液
计数框内若干长条中藻类 的数量。
3. 目镜视野法 利用显微镜目镜视野来 选取计数面积。
目镜视野法计数
计数的视野数目应根据浮游植物数量的多少来确定,一 般为100-500个视野,使所得计数值在300以上 同一样品的两片计数结果与其均数之差距如果不大于其 均数的15%,这两个相近的均数即可视为计数结果。
注意事项: 确定某种计数方法后,不要轻易改变,以确保结果的可比性。 计数前应对样品定性观察,以熟悉主要种类及其形态特征。 如遇到浮游植物个体或细胞一部分位于计数区内,可统一规定。 计数单位可以用个体或细胞表示。 采用细胞数表示时, 1. 单细胞藻类直接计数; 2. 群体或丝状藻类采用估算的方法; 3. 水华优势种类如微囊藻,则需要使其散开后计数。
浮游植物的采集 计数与定量方法

。如下面的不浓浓缩缩体积稀与释 水透明度(体现水的肥瘦)之间关系大致如下, 仅供参考。
瘦中 肥
透明度 >1m 老水 特老水
>50cm
>30cm
<30cm <20cm 浓2缩020/的3/27标准是以每个视野里有十几个藻类为宜。
三、计数方法
将浓缩沉淀后水样充分摇匀后,立即用0.1ml吸量管吸出0.1ml样品,注入
体积公式计算细胞体积。细胞体积的毫升数相当于细胞重量的克数。
这样体积值(μm-3)可直接换算为重量值(109μm-3)可直接换算
为重量值(109μm-3≈1毫克鲜藻重)。
下列体积公式,可供计算生物量时参考:
圆锥体:V=1/3лR2h
圆柱体:V=лR2h
球 体:V=4/3лR3
椭圆体:V=4/3ab2л(a为长轴半径,b为短轴半径)
0 . 1 ml 计 数 框 内 ( 计 数 框 的 表 面 积 最 好 是 2 0 × 2 0 ㎜ 2 ) , 小 心 盖 上 盖 玻 片 (
22×22㎜2),在盖盖玻片时,要求计数框内没有气泡,样品不溢出计数框。
然后在14×40或16×40倍显微镜下计数。即在400-600倍显微镜下计数。每
瓶标本计数两片取其平均值,每片大约计算50~100个视野,但视野数可按浮
入虹吸管内,管口应始终低于水面,虹吸时流速流量不可过大,吸至澄 清液1/3时,应控制流速,使其成滴缓慢留下为宜。
采水时,每瓶样品必须贴上标签,标签上药剂在采集的时间、地点、 采水体积等,其他详细内容应另行做好记录,以备查对,避免错误。
1000m浓l 缩30的ml 体5积0 m视l 浮100游ml 植物的多少而定。也可根据水的肥瘦确定浓缩体积
浮游植物采集与定性定量分析

0.1毫升样品的数量就是将实际看到的每个视野 物种数量乘以2000倍。
第3行
第5行 第8行
总的物种数=
实际看到的物
种数×10/3
3. 水滴法
镜检:根据1毫升的水相当于20滴水,用移液管 取1滴水样,转移至计数框,全部计数。
总数量的计算:假如1升浮游植物水样定容至30 毫升,那么总数量=30÷(1÷20)×计算所得个数
样品采集:首先进行水平面设点和垂直分层,然后 用1升
采水器采集1升水样,加鲁格氏液15毫升,转移 至沉降器沉 淀 24~48小时,通过虹吸法获得浓缩的定 量样品,定容至
50毫升
样品固定:添加3~5毫升甲醛溶液
2. 定性分析 采集:用 25 号浮游生物网在水面以下呈 “∞” 来
回拖行,将所采集水样保存于小方瓶(50毫升)
浮游植物采集与定性定量分析 2019.03.18
蓝藻门 裸藻门 淡 水 种 类 绿藻门 隐藻门 硅藻门 黄藻门
甲藻门 轮藻门
金录水体理化 指标
确定采样层次
(福尔马林/碘液)
样品固定
定性样品采集
(25#,64 μm)
定量样品采集
(1L+10L)
(定性、定量)
室内分析
1. 定量分析
固定:添加3-5毫升甲醛溶液保存。
定量计数方法 视野法 行格法 水滴法
0.1ml计数框
移液枪取样0.1毫升 均匀分布于计数框 对部分视野进行镜检 计数该部分视野的数量
换算整个计数框的数量
计数框的面积是400 mm2,而显微镜的视野面 积是固定值。 显微镜视野面积的计算:某型号显微镜的视场 数 为 20 , 那 么 在 高 倍 镜 下 的 实 际 视 场 直 径 为 20/40=0.5mm , 高 倍 镜 下 的 视 野 面 积 为 3.14*0.25*0.25≈0.2 mm2。
4.实验四__浮游植物采集和定量

采样次数:可以每月一次,一般每季度采样一次,最少 要春季和夏末秋初各采一次。
鲁哥氏液配置方法:将6克碘化钾溶于20 ml水中,待其 完全溶解后,加入4克碘充分摇动,待碘全部溶解后 定容到100 ml。固定浓度为1L水样加10-15 ml鲁哥试
标本编号
站号
层次(m)
采水量(L)
浓缩体积(ml) 计数体积(ml)
调查时间: 年 月 日
种属名
计数(个)
平均 数量
第一片 第二片 (个) (个/L)
硅藻种数(个) 甲藻种数(个) 其他种数(个)
数量(个) 数量(个) 数量(个)
思考题 :
1.在浮游植物浮游 植物种类和数量
显微镜计数方法选择:
采用行格法或镜头法,确定计数行格 和镜头内的浮游植物种类和数量。行格法 一般每片计数3、5、8行/列中的植物;镜 头法必须确定观察镜头(即视野光圈)的 直径/面积,通过随机移动镜头,计数所有 镜头内的藻类。
行格法按照计数玻片上的格子确定技术范围, 玻片样品池长x宽=20mmx20mm,即每列长x宽=20mmx2mm
在400-600倍的显微镜下观察计数,每个水样标本计数两 次(二片),取其平均值,一每片计数100个视野,但具 体观察的视野数以样品中浮游植物多少而酌情增减,如果 平均每个视野有十几个时,数50个视野就够了,如果平均 每个视野有5-6个时,就需数100个视野;如果平均每个视 野不超过1-2个时,要数200个视野以上。
于其均数的±15%,这两个相近的值的均数即可视为
浮游动物和浮游植物调查方法

个视野有十几个时,数50个视野就够了,如果平
均每个视野有5-6个时,就需数100个视野;如果平 均每个视野不超过1-2个时,要数200个视野以上,
数横条,最少不少于5条具体可自行掌握。 总之不论数视野还是数横条,每片计数到 的溪流植物总数应达到200个(低浓度时)500个(高浓度时)以上。 同一样品的二片计数结果与其均数之差距 如果不大于其均数的10%,这两个相近的值 的均数即可视为计数结果。
在器壁的可能性,然后静置沉淀24-48小时候。再 用乳胶管或橡皮管利用虹吸原理小心地抽出上都
不含藻类的清液。一般约剩下20-40毫升沉淀物转
入30或50毫升的定量瓶中,用上述清液冲洗沉淀
器2-3次,洗液仍倒入定量瓶中使水量恰好达到30
或50毫升。然后贴上标签,标签上要记载采集时 间、地点、采水量、池号和样品号等。
例:计数第一个片为250个,计数第二片为 246个 则两片的均数为(250+246)/2=248 均数与第一片之差:248-250= -2 均数与第二片之差:248-246=2 则:-2/248= -0.0081即 -0.81% 2/248=+0.0081 即 0.81% 因为0.81%<10%,所以上述相近值的均数应 视为计数结果。
七、数量计算: 1、定性 2、定量结果 浮游植物定量:
使用的工具有:带有0.1毫升刻度的小吸管,容量 为0.1毫升的计数框(面积20ⅹ20毫米2)和具有移
动台的显微镜。
经0.1毫升吸管吸水0.1毫升于方框内,盖上盖玻片, 如果框内无气泡亦无水液溢出,即表示容量标准 适合,检查三次均适合,此半数框即可使用。每 次计数时用的盖玻片应用碱水或肥皂水洗净备用。
4.实验四__浮游植物采集和定量

四、实验内容 :
3.沉淀与浓缩
虹吸动作要十分仔细、小心。开始时虹吸管一端放在 沉淀器内约三分之二处,另一端套接在已经用手挤压 出空气的橡皮球上,然后轻轻松手并移开橡皮球使清 液流出,为了避免漂浮水面的一些微小藻类进入虹吸 管而被吸走,管口应始终低于水面。虹吸管内清液的 活动不宜过快,可用手指轻捏管壁以控制流量,当吸 到原水样的3/5以上时,应使清液一滴一滴地流下。 吸出的清液要用一洁净的器皿装盛,以便在浓缩过程 在出故障时,可重新倒入沉淀器中浓缩,不必新采水。
5. 计数:计数一定体积内的浮游 植物种类和数量
显微镜计数方法选择:
采用行格法或镜头法,确定计数行格 和镜头内的浮游植物种类和数量。行格法 一般每片计数3、5、8行/列中的植物;镜 头法必须确定观察镜头(即视野光圈)的 直径/面积,通过随机移动镜头,计数所有 镜头内的藻类。
行格法按照计数玻片上的格子确定技术范围, 玻片样品池长x宽=20mmx20mm,即每列长x宽=20mmx2mm
用前可浸入70%的酒精中,用时取出,用细 绢拭净,计数框用前以薄绸布拭净,用毕以 水弄湿后轻拭或用水冲净。
取样计数时应注意以下方面: 将浓缩沉淀后水样充分摇匀(倒转摇)后,立即用0.1ml
吸量管吸出0.1ml样品,注入0.1ml计数框内,小心盖上 盖玻片(20×20㎜2),在盖盖玻片时,要求计数框内没 有气泡,样品不溢出计数框。然后在显微镜下计数。
3、透明度盘 4、广口瓶(标本瓶)
4.浮游植物定量:
5.浮游动物定量:
四、实验内容 :
1.采样点的选择。
海洋采样点的选择应与环境监测站相一致,或根据污染、 赤潮发生范围等确定采样点。 2.采样层次、采水量及采样次数。
水深15m以内的浅海,采表(水下0.5m)、底两层;水 深大于15m,采表、中、底(距底0.5m)三层。
浮游植物的采集、计数与定量方法PPT教学课件

几个时数50个视野就可以了。同一样品的两片计算结果和平均数之差如不大
于其均数的±15%,其均数视为有效结果,否则还必须测第三篇,直至三片
平均数与相近两数之差不超过均数的15%为止,这两个相近值的平均数,即
可视为计算结果。
在计数过程中,常碰到某些个体一部分在视野中,另一部分在视野外,这
时可规定出在视野上半圈者计数,出现在下半圈者不计数。数量最好用细胞
第三环节 揣摩意象,领略意境
—理解作品
• 克服了文字障碍,理顺了句子关系,明白了 诗句的大意,再读起作品,注意力就不会受到 疑难字句的羁绊,想象力也不会因句意不通而 阻隔,思维便可以摆脱字面而进入画面了,就 有能力形成整体印象,或分解出一个个意象, 进而再联系起来,统合起来,对作品作出一个 客观的完整的认识。这就是解释作品。其基本 原则是忠于原作,追求本意。如叶老所说: “就是明白作者的意思情感,不误会,不缺漏, 作者表达些什么,就完全领会他那些什么。”
通过对这一个个意象的把握及联缀,我们就可以 把这首词的整体意境描述为:上阙写作者酒后望月 驰思,对天上人间的无限感慨;下阙写辗转不寐思 念亲人,又感悟到万事万物自古难全的道理,由此 得以自慰和宽解,并表达对亲人的美好祝愿。
圆锥体:V=1/3лR2h 圆柱体:V=лR2h 球 体:V=4/3лR3 椭圆体:V=4/3ab2л(a为长轴半径,b为短轴半径) 圆台体:V=1/3лH( R12 + R22 R1 R2 ) 长方体与正方体ab×h或a3
硅藻细胞的计算通式:V=壳面面积×带面平均高度 不规则性藻类可分可为几个部分计算。
第一章浮游植物的采集、计数 与定量方法
浮游植物(Phytoplankon)又称浮游藻类,是水中悬浮生活的若 干种藻类的总称。
浮游动植物调查方法

浮游动植物调查方法1.方法与原理1.1采样点水体中浮游生物的分布不是很均匀的,通常因水体形态、深度、水源几出口、风、光照以及其他环境条件而差异,因此必须选择有代表性的地点进行采样。
在一般情况下,湖泊的湖湾和中心部分,沿岸有水草区和无水草区浮游生物的种类和数量都有不同。
当有风引起水流时,浮游生物多聚集在水流冲击的下风向一侧,总量较高。
此外,水源入口处,不同时间各水层的光照和温度条件下浮游生物的种类和数量都会有所不同。
采样点的数目根据水体的具体条件而定。
水体面积大的,条件复杂的,采样点要多些;要有较高人力、时间和经费等条件允许的,采样点也可以多些。
1.2采集采集工具主要有采集网和采水器。
当一般定性采集时,可站在船舱内或甲板上,将采集网系在竹竿或木棍前端,放入水中作∞形循回拖动(网口上端不要露出水面),拖动速度不要超过0.3米/秒。
如若拖动太快,水在网内会发生回流,将使网内的浮游生物冲到网外。
当一般定量采集时,各种类型的采水器均可使用,但一定要能分层采水。
在水深不超过10米的水体采样时,可用自制的采水器。
采水器可以采集到那些易从网孔中漏失的微小浮游生物。
但因采集水量有限,很难采到密度较稀和游动能力强的较大类型种类。
1.3固定和保存采到的样品必须在5分钟以内加以固定。
常用的固定液有福尔马林、刘哥氏液、甘油—福尔马林保存液、Rodhe碘固定液。
福尔马林为含有40%甲醛的药品。
一般按每100毫升水样加入约4毫升福尔马林(含1.6%甲醛),也就是说用4%福尔马林固定。
1.4浓缩化学沉淀法:所才水样用福尔马林加以固定静置1—2昼夜使之沉淀,用宏吸管吸去上面清夜,将下层包括沉淀物的浓液移入小容器中,再静置沉淀。
必要时可反复进行,直到浓缩到10—50毫升为止。
1.5观察与鉴定对所采到的浮游生物种类进行全面的种的鉴定,是一项难度和工作量都很大的工作,常常需要各方面的专家协同进行。
种类鉴定可采用检索表和图鉴相结合的方法。
浮游生物的采集与鉴定

在 中倍 显 微 镜 下 计数 两 片
Z
取其 平 均值
标 本名 称等
2 2
.
以 便 镜 检时 观察
水 中原 生 动 物 的 个 体数 计算 公 式 如下
:
:
浮 游 动物 的 采 集
2
根据 浮 游 动物 的 大 小
、
采集 方 法 可 分
,
N Z一 4 0 0 n
为
种
.
:
一 是采 集 方法 与 浮游 植物 的 采集 方 法 相 同
。
、
定量 瓶
、
吸 量管
、
、
计数 框
载 玻片
。
盖 玻片
、
纱布
蓝藻 门 硅藻 门 硅藻 门 金藻 门
甲藻 门 甲藻 门
8
3 l l Z Z s 3 Z Z l
1 2
实验 药 品
鲁哥 氏 液
甲醛 固 定 液
,
2
2 1
.
标本的采集
浮游 植 物 的采 集
。
.
用 采水 器 采水
4
,
采 用 五 点 采水 和 分 层
,
有 些 也 可 以直 接 利 用 光
所示 )
表 属名
1
合 作 用 和 渗透 作 用 维 持 自 身的 生 命 活动 与 鉴定
1
1 1
.
本 文 以西 南 大 学 荣
、
对 水 体 中 的 浮 游 生 物 进 行采 集
分析
/ ) 个 体数 ( / 个 L
3
x x x x x x x x x x x x x x
,
计算 刃 个 视 野 中不 同 浮
I
浮游动植物调查方法

浮游动植物调查方法1.方法与原理1.1采样点水体中浮游生物的分布不是很均匀的,通常因水体形态、深度、水源几出口、风、光照以及其他环境条件而差异,因此必须选择有代表性的地点进行采样。
在一般情况下,湖泊的湖湾和中心部分,沿岸有水草区和无水草区浮游生物的种类和数量都有不同。
当有风引起水流时,浮游生物多聚集在水流冲击的下风向一侧,总量较高。
此外,水源入口处,不同时间各水层的光照和温度条件下浮游生物的种类和数量都会有所不同。
采样点的数目根据水体的具体条件而定。
水体面积大的,条件复杂的,采样点要多些;要有较高人力、时间和经费等条件允许的,采样点也可以多些。
1.2采集采集工具主要有采集网和采水器。
当一般定性采集时,可站在船舱内或甲板上,将采集网系在竹竿或木棍前端,放入水中作∞形循回拖动(网口上端不要露出水面),拖动速度不要超过0.3米/秒。
如若拖动太快,水在网内会发生回流,将使网内的浮游生物冲到网外。
当一般定量采集时,各种类型的采水器均可使用,但一定要能分层采水。
在水深不超过10米的水体采样时,可用自制的采水器。
采水器可以采集到那些易从网孔中漏失的微小浮游生物。
但因采集水量有限,很难采到密度较稀和游动能力强的较大类型种类。
1.3固定和保存采到的样品必须在5分钟以内加以固定。
常用的固定液有福尔马林、刘哥氏液、甘油—福尔马林保存液、Rodhe碘固定液。
福尔马林为含有40%甲醛的药品。
一般按每100毫升水样加入约4毫升福尔马林(含1.6%甲醛),也就是说用4%福尔马林固定。
1.4浓缩化学沉淀法:所才水样用福尔马林加以固定静置1—2昼夜使之沉淀,用宏吸管吸去上面清夜,将下层包括沉淀物的浓液移入小容器中,再静置沉淀。
必要时可反复进行,直到浓缩到10—50毫升为止。
1.5观察与鉴定对所采到的浮游生物种类进行全面的种的鉴定,是一项难度和工作量都很大的工作,常常需要各方面的专家协同进行。
种类鉴定可采用检索表和图鉴相结合的方法。
浮游植物的采集计数和定量方法

浮游植物的采集计数和定量方法浮游植物是水生态系统中重要的底层生物类群,对于水质评价、生态监测以及环境保护都具有重要的意义。
因此,准确、高效地采集、计数和定量浮游植物是水环境研究的关键步骤。
下面将介绍浮游植物的采集计数和定量方法。
一、浮游植物的采集方法:1.根据采样目的和特定环境条件选择合适的采样方法,常用的采样方法有以下几种:(1)铁丝网挡截式采样:在浮游植物出现较为集中的水域使用,将铁丝网固定在一个框架上,让水流通过铁丝网,实现浮游植物的挡截和收集。
(2)网捞式采样:适用于浮游植物密度较高的水域,用网捞将浮游植物从水中捞出。
(3)浮游植物捕集器的采集:常用的浮游植物捕集器有浮游植物网式捕集器、浮游植物漏斗捕集器、浮游植物湖泊型捕集器等。
2.采样前要选择合适的采样点,宜选择浮游植物密度较高的水域进行采样。
采样容器要先用水冲洗,尽量不带有任何异物,以避免对采样物质的污染。
3.采集浮游植物时应避免过度搅荡水体,以防浮游植物的破碎和污染。
4.采集样本时要注意保持样本的完整性,以确保后续的计数和分析的精确性。
二、浮游植物的计数方法:1.显微镜计数法:将采样的浮游植物样本放入显微镜下,通过目视计数的方式,记录不同种类的浮游植物数量。
2.染色计数法:采用一些常见的染色剂(如碘酒、卡内基氏溴酸可乐定等)将浮游植物样本染色后,在显微镜下对染色后的样本进行计数。
3.流式细胞仪计数法:利用流式细胞仪可以对样本中的细胞进行高效、自动化的计数和分析。
三、浮游植物的定量方法:1.干重法:将采集回来的样本在高温下干燥至恒定重量后,通过测量干物质的质量差值计算浮游植物的生物量。
2.叶绿素-a含量测定法:通过提取样本中的叶绿素-a,利用比色法测定其叶绿素-a的含量。
然后根据叶绿素-a的含量可以推算出浮游植物的生物量。
3.DNA分子量法:通过提取样本中的DNA,利用分子生物学技术测定其DNA的分子量。
再根据已建立的浮游植物DNA分子量和生物量的线性关系,可以推算出浮游植物的生物量。
浮游动植物的采集和标本保存

浮游动植物的采集和标本保存一、采集用具25号筛绢浮游生物网,13号筛绢浮游生物网,吸管,标本瓶(50毫升小塑料瓶、玻璃吸管和200毫升塑料广口瓶),标本夹,吸水纸,台纸,镊子,采集刀,塑料桶等,固定液:鲁哥氏液(即I一IK溶液)、福尔马林(甲醛)。
浮游生物网制作方法如下:①规格。
网口直径为20厘米,网袋长60厘米,网底应安装一个带阀门的集中杯。
网袋的质地为尼龙筛绢。
筛绢的号码及网孔大小,随采集对象的大小而定。
采集大型浮游动物时,用13号(0.112mm)筛绢,采集小型浮游藻类时,用25号(0.064mm)筛绢。
②制作方法。
取3~4毫米粗的铜丝或铅丝作一个直径20厘米的网口,用以支撑网口始终张开。
用金属或玻璃制作一个带阀门的集中杯(或购买),用来收集过滤到的浮游藻类。
在网袋的上下口处接一段白布,使筛绢不与金属直接接触,以免磨损筛绢。
网袋缝合处也应加缝2厘米长的白布条,以加固缝合处。
二、采集方法淡水生物分布很广,其中大多数生活在各种不同的水体中,此外还有些生活在潮湿的土壤表面、树皮、墙壁及石壁上,极少数种类生于长年积雪的高山上;少数种类与其它动植物共生;或寄生在别的生物体中。
因此,各种藻类在其具体的生活状态、藻体的大小、生活环境及每年的发生时期都有很大差异。
因此,采集浮游生物首先需要对以上情况有基本了解,以便确定相应的采集方法。
1.浮游藻类这些藻类个体微小,单细胞或群体,没有鞭毛,完全借水力漂浮在水中或具鞭毛在水体中仅有微弱的运动能力,采集这些藻类可视具体情况进行采集。
①在水面较大、较深的水体中,应用25号浮游生物网采集。
采集时应把网没入水面下并以大八字形(∞)来回缓缓捞取。
水色较清、藻类数量少时可多捞一会,反之可少捞一会。
最后将网垂直提出水面,打开底管阀门,把标本液注入标本瓶中。
特别应注意作好记录,编号并在标本瓶上贴好标签。
在定量采集时分别取水体上、中、下层水在水桶中混合均匀,然后取200毫升装入广口塑料瓶中。
GB/T14518浮游植物的采集

GB/T14518浮游植物的采集
不同水体,不同种类的藻类在个体上有很大差异,仅仅用数量就很难评价。
这就要求,浮游植物的定量工作,必须以测算生物量为日标。
选择采样点的原则是,采样点在平面上的分布要有代表性。
根据调查的目的而定。
般要求湖心、库心、江心必须采样,有条件时采样点可适当多设一些,如大的湖湾、库湾、河流的上、中、下游水体的沿岸带、浅水区等也要设点采集。
凡水深不超过2米者,可于采样点水下0.5m处采水,
水深2~10米以内,应距底0.5米处另采一个样,
水深超过10米时。
应于中层增采一个水样。
1.池塘:样点可设在距岸边1m处。
水深小于2m时采一中
层水样。
若水深大于2m时,最好采上、中、下层水样。
亚表层:水下20cm左右。
中层:水体中间部分。
下层:离底20cm左右
2.水库及河流:样点可设在上、中、下游。
上游:设十个点(亚表层或中层)
中游:水在2-3米深时设一个点,采2个样(上中层和中下层)
下游:设2-3个样点。
中心点3个样(上、中、下层),
两测点各一个样(中层)。
浮游生物采样
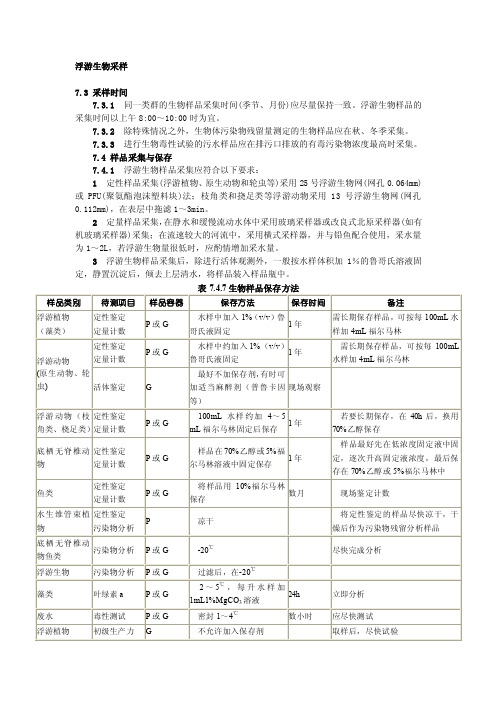
浮游生物采样
7.3 采样时间
7.3.1同一类群的生物样品采集时间(季节、月份)应尽量保持一致。
浮游生物样品的采集时间以上午8:00~10:00时为宜。
7.3.2除特殊情况之外,生物体污染物残留量测定的生物样品应在秋、冬季采集。
7.3.3进行生物毒性试验的污水样品应在排污口排放的有毒污染物浓度最高时采集。
7.4 样品采集与保存
7.4.1浮游生物样品采集应符合以下要求:
1定性样品采集(浮游植物、原生动物和轮虫等)采用25号浮游生物网(网孔0.064mm)或PFU(聚氨酯泡沫塑料块)法;枝角类和挠足类等浮游动物采用13号浮游生物网(网孔0.112mm),在表层中拖滤1~3min。
2定量样品采集,在静水和缓慢流动水体中采用玻璃采样器或改良式北原采样器(如有机玻璃采样器)采集;在流速较大的河流中,采用横式采样器,并与铅鱼配合使用,采水量为1~2L,若浮游生物量很低时,应酌情增加采水量。
3浮游生物样品采集后,除进行活体观测外,一般按水样体积加1%的鲁哥氏溶液固定,静置沉淀后,倾去上层清水,将样品装入样品瓶中。
表B.16浮游生物分析记录表
样品来源
样品类型 共 页第
页
分析人员:
年 月 日 校核: 年 月 日 审核: 年 月 日
表B.17生物种类统计记录表
样品来源 样品类型 共 页第
页
分析人员:年月日校核:年月日审核:年月日。
浮游植物取样测定规范

水体浮游植物分析规范参考淡水生物资源调查技术规范DB43/T 432-2009➢水层设置水深小于3m时,只在中层采样,混合均匀水体,可以只采表层(0.5m)水样;水深3m~6m时,在表层、底层采样,其中表层水在离水面0.5m处,底层水在离泥面0.5m处;水深6m~10m时,在表层、中层、底层采样;水深大于10m时,在表层、5m、10m水深层采样,10m以下除特殊需要外一般不采样,对于深水湖泊,取样的水层可以将取样间隔加大,如0m,10m,20m,50m, 100m。
➢采样定量样品在定性采样之前用采水器采集,每个采样点取水样1L,贫营养型水体应酌情增加采水量。
泥沙多时需先在容器内沉淀后再取样。
分层采样时,取各层水样等量混匀后取水样1L。
大型浮游植物定性样品用25号浮游生物网在表层缓慢拖曳采集,注意网口与水面垂直,网口上端不要露出水面。
➢固定浮游植物样品立即用鲁哥氏液固定,用量为水样体积的1%~1.5%。
如样品需较长时间保存,则需加入37%~40%甲醛溶液,用量为水样体积的4%。
现行的一些规律性的方法为:取水样,500ml,加入5ml鲁格,虹吸到30-50ml,加入1ml甲醛。
➢水样的沉淀和浓缩固定后的浮游植物水样摇匀倒入固定在架子上的1L沉淀器中,2h后将沉淀器轻轻旋转,使沉淀器壁上尽量少附着浮游植物,再静置24h。
充分沉淀后,用虹吸管慢慢吸去上清液。
虹吸时管口要始终低于水面,流速、流量不能太大,沉淀和虹吸过程不可摇动,如搅动了底部应重新沉淀。
吸至澄清液的1/3时,应逐渐减缓流速,至留下含沉淀物的水样20mL~25(或30~40)mL,放入30(或50)mL的定量样品瓶中。
用吸出的少量上清液冲洗沉淀器2次~3次,一并放入样品瓶中,定容到30(或50)mL。
如样品的水量超过30(或50)mL,可静置24 h后,或到计数前再吸去超过定容刻度的余水量。
浓缩后的水量多少要视浮游植物浓度大小而定,正常情况下可用透明度作参考,依透明度确定水样浓缩体积见表3,浓缩标准以每个视野里有十几个藻类为宜。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
三、计数方法 将浓缩沉淀后水样充分摇匀后,立即用0.1ml吸量管吸出0.1ml样品,注入 0.1ml计数框内(计数框的表面积最好是20×20㎜ 2 ),小心盖上盖玻片( 22×22㎜2),在盖盖玻片时,要求计数框内没有气泡,样品不溢出计数框。 然后在14×40或16×40倍显微镜下计数。即在400-600倍显微镜下计数。每 瓶标本计数两片取其平均值,每片大约计算50~100个视野,但视野数可按浮 游植物的多少而酌情增减,如平均每个视野不超过1~2个时,要数200个视野 以上,如果平均每个视野有5~6个时要数100个视野,如果平均每个视野有十 几个时数50个视野就可以了。同一样品的两片计算结果和平均数之差如不大 于其均数的±15%,其均数视为有效结果,否则还必须测第三篇,直至三片 平均数与相近两数之差不超过均数的15%为止,这两个相近值的平均数,即 可视为计算结果。 在计数过程中,常碰到某些个体一部分在视野中,另一部分在视野外,这 时可规定出在视野上半圈者计数,出现在下半圈者不计数。数量最好用细胞 表示,对不宜用细胞数表示的群体或丝状体,可求出其平均细胞数。 计算时优势种类尽可能鉴别到属,注意不要把浮游植物当作杂质而漏计。 计数时可按下列格式记录,然后再进行整理计算。 视野数 种 类 第一片 第二片 正 小球藻 正正 正正 正 衣 藻 正 正 正正 小环藻 正 正
四、数量与生物量的计算: 1.一升水中的浮游植物的数量(N)可用下列公式计算:
Cs V N = × × Pn Fs Fn U
式中:Cs — 计数框体积(㎜2),一般为400㎜2。 Fs — 每个视野的面积(㎜2),лR2,视野半径r可用台微尺测出 (一定倍数下)。 Fn — 计数过的视野数。 V — 一升水样经沉淀浓缩后的体积(ml) U — 计数框的体积(ml)为0.1ml。 Pn — 计数出的浮游植物个数。 如果计数框、显微镜固定不变,Fn、V、U也固定不变,公式中的 Cs V ( Fs Fn × U )可视为常数,此常数用K表示,则上述公式可 简化为:N=K×Pn。 Pn代表某种藻类的个数,计算结果N只表示一升水中这种藻类的 数量;Pn若代表各种藻类的总数,计算结果N则表示一升水中浮游 植物的总数。前者若求浮游植物数量将各计算结果相加即可。
在以往的调查中,人们往往只注重浮游植物的种类 或数量,对其生物量则重视不够。其原因在于:1、浮游 植物生物量测算繁琐;2、对生物量与数量之间的本质差 别认识不足。由于不同水体,不同种类的藻类在个体上 有很大差异,仅仅用数量就很难评价不同水体饵料生物 的丰欠。这就要求,浮游植物的定量工作,必须以测算 生物量为目标。 不同的调查方法,有时会得出不同的结果。关于浮 游生物的采集、计数与定量方法采用下列方法。
⑴池塘:样点可设在距岸边1m处。水深小于2m时采一中 层水样。若水深大于2m时,最好采上、中、下层水样。 亚表层:水下20cm左右。 中 层:水体中间部分。 下 层:离底20cm左右。 ⑵水库及河流:样点可设在上、中、下游。 上游:设十个点(亚表层或中层) 中游:水在2-3米深时设一个点,采2个样(上中层和中 下层) 下游:设2-3个样点。中心点3个样(上、中、下层), 两测点各一个样(中层) ⑶湖泊:中心区设一点。进水口和出水口也应设点。
3.采样量及采样次数 每一个采样点应采水1000ml。若系一般性调查,可将各 层采的水等量混合,取1000ml混合水样固定;或者分层采 水,分别计数后取平均值。分层采水可以了解每一采样点 各层水中浮游植物的数量和种类。 采 得 水 样 后 立 即 加 入 1 0 - 1 5 ml 鲁 哥 氏 液 ( Lugol’s solution)固定,鲁哥氏液即将6克碘化钾溶于20ml水中, 待其完全溶解后,加入4克碘充分摇动,待碘全部溶解后定 容到100ml即配成鲁哥氏液。泥沙多时沉淀后再取水样。 采样次数可多可少。有条件时还可逐月采样一次,一般 情况可下及采样一次,最低限度应在春季、夏季末、秋初 各采样一次。
二、沉淀浓缩: 上述水样,摇匀后倒入1000ml圆柱形沉淀器中沉淀24小时,沉淀器可 用1000ml的瓶子代替。用虹吸管小心抽出上面不含藻类的“清液”。剩 下30-50ml沉淀物转入50ml的定量瓶中;再用上述虹吸出来的“清液” 少许冲洗三次沉淀器,冲洗液转入定量瓶中。凡以碘液固定的水样固定 的水样,瓶塞要拧紧。还要加入2-4%的甲醛固定液(福尔马林),即 每100ml样品需另加4ml福尔马林,以利于长期保存。浓缩时切不可搅动 底部,万一动了应重新静止沉淀,为不是漂浮水面的某些微小生物等进 入虹吸管内,管口应始终低于水面,虹吸时流速流量不可过大,吸至澄 清液1/3时,应控制流速,使其成滴缓慢留下为宜。 采水时,每瓶样品必须贴上标签,标签上药剂在采集的时间、地点、 采水体积等,其他详细内容应另行做好记录,以备查对,避免错误。 1000ml 30 ml 50 ml 100 ml 浓缩的体积视浮游植物的多少而定。也可根据水的肥瘦确定浓缩体积 不浓缩 稀释 。如下面的浓缩体积与水透明度(体现水的肥瘦)之间关系大致如下, 仅供参考。 瘦中 肥 透明度 >1m >50cm >30cm 老水 特老水 <30cm <20cm 浓缩的标准是以每个视野里有十几个藻类为宜。
2.生物量一般按体积来换算。这是因为浮游植物个体积小,直 接称重较困难,且其细胞比重多接近于1。可用形态相近似的几何 体积公式计算细胞体积。细胞体积的毫升数相当于细胞重量的克数。 这样体积值(μm-3)可直接换算为重量值(109μm-3)可直接换算 为重量值(109μm-3≈1毫克鲜藻重)。 下列体积公式,可供计算生物量时参考: 圆锥体:V=1/3лR2h 圆柱体:V=лR2h 球 体:V=4/3лR3 椭圆体:V=4/3ab2л(a为长轴半径,b为短轴半径) 圆台体:V=1/3лH( R12 + R 22 + R 1 + R 2 ) 长方体与正方体ab×h或a3 硅藻细胞的计算通式:V=壳面面积×带面平均高度 不规则性藻类可分可为几个部分计算。
一、采样: 1. 采水器:各种采水器均可,一般浅水(<10m)湖泊 可用玻璃瓶采水器,深水 湖泊或水库必须用颠倒采水 器。北原式采水器或有机玻璃采水器。 2.采样点的选择及采样层次的确定 选择采样点的原则是,采样点在平面上的分布要有代表性 。一般要求湖心、库心、江心必须采样,有条件时采样点可 适当多设一些,如大的湖湾、库湾、河流的上、中、下游水 体的沿岸带、浅水区等也要设点采集。 凡水深不超过2米者,可于采样点水下0.5m处采水,水深2 ~10米以内,应距底0.5米处另采一个样,水深超过10米时 。应于中层增采一个水样。一般来说池塘、水库、湖泊、河 流的样点及采水求出这种藻类个体重 的平均值,一般都制成附表供查找。此平均值乘上一升税 种该种藻类的数量,即得到一升水中这种藻类的生物量 (mg/L)。 由于同一种类的细胞大小可能有较大的差别,同一属内 的差别就更大了,因此必须实测每次水样中主要种类(即 优势种)的细胞大小并计算平均重量,其他种类可以参考 附表计算。 藻类的生物量可直接作为初级生产力的一种指标,根据 几次定期测算的现存量之差亦可估计出生产量。 定量结果应列出总生物量、各门生物量、优势种属。在 条件许可时还可以用较简单的测定叶绿素法,来对照或代 替生物量。但叶绿素法不能反映种类组成情况。
第一章 浮游植物的采 集、计数与定 量方法
浮游植物(Phytoplankon)又称浮游藻类,是水中悬浮生活的若 干种藻类的总称。 浮游植物及其生产力是水生态系统的重要成员与重要功能之一, 是鱼类天然饵料的重要组成部分。由于浮游植物对环境的变化十分 敏感,故在环境监测中,也有重要作用。 我国淡水养殖的主要对象是鲢、鳙鱼类,它们的天然饵料常以浮 游植物为主。我们知道,不同类型的水体或同一水体的不同季节, 藻类的组成是不相同的,各种藻类的相对量在不断地变化。这种变 化是有一定的趋势的,这以后要专题介绍。就鲢鳙而言,藻类又有 易消化种类和不易消化种类之分,一般说来,硅藻门、金藻门、甲 藻门中种类易于消化,而蓝藻门、绿藻门、裸藻门中的多数种类难 于消化。因此,在鱼类生长季节,研究水中藻类组成和现存量( Standing crop),可为养殖鱼类的合理投放提供重要的科学依据。 同时为水生态研究及利用提供了有用的资料。 浮游植物的现存量,指的是某一瞬间单位水体中所存在的浮游植 物的量。这个量有两种表示方法,用数目单位表示成为密度,一般 用万个/升为单位,五、六十年代用之;用重量单位(mg/L)表示 的现存量称为生物量(Biomass)。70年代以来被广泛使用。
