红外特征谱图
红外谱图-各官能团的特征吸收是谱图的基础

例9:
1) 800 对位取代
CH3
CH2CH3
例10 : 1) 不:0 2)3340, 1100 醇 3)借助其它方法
CH3CH2 CH CH3 OH
例11: 1)不:4 2)3000,1600,1500 苯 3)3300(×),1250,1050
芳香脂肪醚
4)750,邻位取代
OCH3 CH3
3)1710 cm1,C=O,
2820,2720 cm1,醛基
1)不饱和度:(8228)2=5
大于4, 一般有苯环,C6H5
4)结合化合物的分子式 此化合物为间甲基苯甲醛
2)3000 cm1以上,不饱和 C-H 伸缩
CH3
可能为烯,炔,芳香化合物
1600,1580 cm1,含有苯环
指纹区780,690 cm1,间位取代苯
CH C CH2OH
例3 C7H8O 1) 不饱和度: (7228)2=4 可能含有苯环
2) 3000 cm1 以上, 以及 1600,1500 cm1 表明含有苯环(-C6H5 770,700 cm1 表明苯环取代为单取代
3) 分子式为C7H8O,除去苯环(-C6H5),取代基为CH3O, 苯甲醚(?) 苯甲醇(?) 3300 cm1(),1250,1040 cm1() 芳香脂肪醚C-O的吸收 表明此化合物为苯甲醚
LASER
SAMPLE
eE
SPECTROMETER
拉曼光谱技术具有非破坏性、几乎不需要样品制备, 可直接测定气体、液体和固体样品,并且可用水作 溶剂,因此在含水溶液、不饱和碳氢化合物、药品、 聚合物结构、生物和无机物质等的分析方面比红外 光谱分析法优越。
AYdC#fD$hF&jH(kJ-mL0oN1qP3sR5uS7wU9y W
红外光谱 2

810-800 850-840 870-855
870
H 3000
CC 1600,1500
H
~ 743cm1
H 767,692 ~ 900
弯曲H 79(2 单峰)
四、各类化合物的红外特征光谱
4. X—H 弯曲振动区
指纹区(1300~600 cm-1 ) ,较复杂。
(1)-CH3,1380(强),特征吸收,可以用来 判断有无甲基的存在。
(2)-CH3的不对称弯曲和-CH2的剪式弯曲重叠: 1460
(3)-C-(CH3)2:两个甲基的弯曲振动相互 耦合,使1380的峰分裂为双峰:1370/1380;
注意:可判断有无醇、酚、羧酸等官能团。
(4)胺
-N—H 3700~3100 cm-1 -N—H 3500~3700 cm-1(游离) -N—H 3400~3100 cm-1(缔合)
注意:与—OH的伸缩谱带重叠,不易区 分。
2、三键伸缩:2500~1900 cm-1 (1)RC≡CH (2100~2140 cm-1 ) (2)C=C=C:1950 cm-1 (3)-N≡N:2310~2135 cm-1 特点:谱带较少
810-800 850-840 870-855
870
(1) 单取代
γ φ-H(双峰) ~ 750cm-(1 强) ~ 700cm-(1 较强)
(2) 双取代
γ φ-H ~ 750cm-1 (强,单峰) → 与单取代峰位重叠
γ φ -H(三峰) 810 ~ 750cm-(1 强) 725 ~ 680cm-(1 较强) 900 ~ 860cm-(1 中强)
(完整版)红外主要官能团对应谱图

主要基团的红外特征吸收峰基团振动类型波数(cm-1)波长(μm)强度备注一、烷烃类CH伸CH伸(反称)CH伸(对称)CH弯(面内)C-C伸3000~28432972~28802882~28431490~13501250~11403.33~3.523.37~3.473.49~3.526.71~7.418.00~8.77中、强中、强中、强分为反称与对称二、烯烃类CH伸C=C伸CH弯(面内)CH弯(面外)单取代双取代顺式反式3100~30001695~16301430~12901010~650995~985910~905730~650980~9653.23~3.335.90~6.137.00~7.759.90~15.410.05~10.1510.99~11.0513.70~15.3810.20~10.36中、弱中强强强强强C=C=C为2000~1925 cm-1三、炔烃类CH伸C≡C 伸CH弯(面内)CH弯(面外)~33002270~21001260~1245645~615~3.034.41~4.767.94~8.0315.50~16.25中中强四、取代苯类CH伸泛频峰骨架振动(CC)CH弯(面内)CH弯(面外)3100~30002000~16671600±201500±251580±101450±201250~1000910~6653.23~3.335.00~6.006.25±0.086.67±0.106.33±0.046.90±0.108.00~10.0010.99~15.03变弱强三、四个峰,特征确定取代位置单取代邻双取代间双取代对双取代1,2,3,三取代1,3,5,三取代1,2,4,三取代﹡1,2,3,4四取代﹡1,2,4,5四取代﹡1,2,3,5四取代﹡五取代CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)770~730770~730810~750900~860860~800810~750874~835885~860860~800860~800860~800865~810~86012.99~13.7012.99~13.7012.35~13.3311.12~11.6311.63~12.5012.35~13.3311.44~11.9811.30~11.6311.63~12.5011.63~12.5011.63~12.5011.56~12.35~11.63极强极强极强中极强强强中强强强强强五个相邻氢四个相邻氢三个相邻氢一个氢(次要)二个相邻氢三个相邻氢与间双易混一个氢一个氢二个相邻氢二个相邻氢一个氢一个氢一个氢五、醇类、酚类OH伸OH弯(面内)C—O伸O—H弯(面外)3700~32001410~12601260~1000750~6502.70~3.137.09~7.937.94~10.0013.33~15.38变弱强强液态有此峰OH伸缩频率游离OH分子间氢键分子内氢键OH弯或C—O伸伯醇(饱和)仲醇(饱和)叔醇(饱和)酚类(ФOH)OH伸OH伸OH伸(单桥)OH弯(面内)C—O伸OH弯(面内)C—O伸OH弯(面内)C—O伸OH弯(面内)Ф—O伸3650~35903500~33003570~3450~14001250~1000~14001125~1000~14001210~11001390~13301260~11802.74~2.792.86~3.032.80~2.90~7.148.00~10.00~7.148.89~10.00~7.148.26~9.097.20~7.527.94~8.47强强强强强强强强强中强锐峰钝峰(稀释向低频移动*)钝峰(稀释无影响)六、醚类C—O—C伸1270~1010 7.87~9.90 强或标C—O伸脂链醚脂环醚芳醚(氧与芳环相连)C—O—C伸C—O—C伸(反称)C—O—C伸(对称)=C—O—C伸(反称)=C—O—C伸(对称)CH伸1225~10601100~1030980~9001270~12301050~1000~28258.16~9.439.09~9.7110.20~11.117.87~8.139.52~10.00~3.53强强强强中弱氧与侧链碳相连的芳醚同脂醚O—CH3的特征峰七、醛类(—CHO)CH伸C=O伸CH弯(面外)2850~27101755~1665975~7803.51~3.695.70~6.0010.2~12.80弱很强中一般~2820及~2720cm-1两个带饱和脂肪醛α,β-不饱和醛芳醛C=O伸C=O伸C=O伸~1725~1685~1695~5.80~5.93~5.90强强强八、酮类OC C=O伸C—C伸泛频1700~16301250~10303510~33905.78~6.138.00~9.702.85~2.95极强弱很弱脂酮饱和链状酮α,β-不饱和酮β二酮芳酮类Ar—CO C=O伸C=O伸C=O伸C=O伸C=O伸1725~17051690~16751640~15401700~16301690~16805.80~5.865.92~5.976.10~6.495.88~6.145.92~5.95强强强强强C=O与C=C共轭向低频移动谱带较宽二芳基酮1-酮基-2-羟基(或氨基)芳酮脂环酮四环元酮五元环酮六元、七元环酮C =O 伸C =O 伸C =O 伸C =O 伸C =O 伸1670~1660 1665~1635~1775 1750~1740 1745~1725 5.99~6.02 6.01~6.12~5.63 5.71~5.75 5.73~5.80 强强强强强九、羧酸类(—COOH )OH 伸C =O 伸OH 弯(面内)C —O 伸OH 弯(面外)3400~2500 1740~1650 ~1430 ~1300 950~9002.94~4.00 5.75~6.06 ~6.99 ~7.69 10.53~11.11中强弱中弱在稀溶液中,单体酸为锐峰在~3350cm -1;二聚体为宽峰,以~3000cm -1为中心脂肪酸R —COOH α,β-不饱和酸芳酸C =O 伸C =O 伸C =O 伸1725~1700 1705~1690 1700~16505.80~5.88 5.87~5.91 5.88~6.06强强强氢键十、酸酐链酸酐C =O 伸(反称)C =O 伸(对称)C —O 伸1850~1800 1780~1740 1170~1050 5.41~5.56 5.62~5.75 8.55~9.52 强强强共轭时每个谱带降20 cm-1环酸酐(五元环)C =O 伸(反称)C =O 伸(对称)C —O 伸1870~1820 1800~1750 1300~1200 5.35~5.49 5.56~5.71 7.69~8.33 强强强共轭时每个谱带降20cm-1十一、酯类C OR OC =O 伸(泛频)C =O 伸C —O —C 伸~3450 1770~1720 1280—1100~2.90 5.65~5.81 7.81~9.09弱强强多数酯C =O 伸缩振动正常饱和酯α,β-不饱和酯δ-内酯γ-内酯(饱和)β-内酯C =O 伸C =O 伸C =O 伸C =O 伸C =O 伸1744~1739 ~1720 1750~1735 1780~1760 ~1820 5.73~5.75 ~5.81 5.71~5.76 5.62~5.68 ~5.50 强强强强强十二、胺NH 伸NH 弯(面内)C —N 伸NH 弯(面外)3500~3300 1650~1550 1340~1020 900~650 2.86~3.03 6.06~6.45 7.46~9.80 11.1~15.4 中中强伯胺强,中;仲胺极弱伯胺类仲胺类叔胺类NH 伸(反称、对称)NH 弯(面内)C —N 伸NH 伸NH 弯(面内)C —N 伸C —N 伸(芳香)3500~3400 1650~1590 1340~1020 3500—3300 1650—1550 1350—1020 1360~10202.86~2.94 6.06~6.29 7.46~9.80 2.86—3.03 6.06—6.45 7.41—9.80 7.35~9.80中、中强、中中、弱中极弱中、弱中、弱双峰一个峰十三、酰胺(脂肪与芳香酰胺数据类似)NH伸C=O伸NH弯(面内)C—N伸3500~31001680~16301640~15501420~14002.86~3.225.95~6.136.10~6.457.04~7.14强强强中伯酰胺双峰仲酰胺单峰谱带Ⅰ谱带Ⅱ谱带Ⅲ伯酰胺仲酰胺叔酰胺NH伸(反称)(对称)C=O伸NH弯(剪式)C—N伸NH2面内摇NH2面外摇NH伸C=O伸NH弯+C—N伸C—N伸+NH弯C=O伸~3350~31801680~16501650~16201420~1400~1150750~600~32701680~16301570~15151310~12001670~1630~2.98~3.145.95~6.066.06~6.157.04~7.14~8.701.33~1.67~3.095.95~6.136.37~6.607.63~8.335.99~6.13强强强强中弱中强强中中两峰重合两峰重合十四、氰类化合物脂肪族氰α、β芳香氰α、β不饱和氰C≡N伸C≡N伸C≡N伸2260~22402240~22202235~22154.43~4.464.46~4.514.47~4.52强强强十五、硝基化合物R—NO2 Ar—NO2NO2伸(反称)NO2伸(对称)NO2伸(反称)NO2伸(对称)1590~15301390~13501530~15101350~13306.29~6.547.19~7.416.54~6.627.41~7.52强强强强。
醇、酚红外图谱分析

3229 分子间氢键展 宽的 O-H 伸缩
3023 芳基 C-H 伸 缩振动
1336 O-H 弯曲振动
754 C-H 面外伸缩振 动
图 4 苯酚红外波谱图
---精品---
(3)在醇类化合物中强极性的 C-O 键的伸缩振动在 1000--1130 产生强吸收峰,其
中,伯醇 1050 ,仲醇 1100 ,叔醇 1130 ,酚 1200 。
表 1 醇、酚特征吸收位置
强 基团类型 峰位/
度
归属与注释
醇(非极性 1300-1000 s
稀溶液中)
C-O 键的极性很强,故强度强,图中最强的吸收
羟基(醇、酚)红外谱图特征总结: 1, 结构
2, 特征吸收带:
(1)醇、酚以游离态存在时(浓度低于 0.005 度吸收带。
),在 3650--3590 范围内中等强
游离态羟基伸缩振动的频率:伯醇(3640 )>仲醇(3630 )>叔醇(3620 )
>酚(3620 ) (2)由于羟基是强极性基团,由于氢键的作用,醇、酚通常都是以缔合状态存在,吸收 带向低频区位移,二聚体 3450--3550 、多聚体 3200--3400 ,且峰型变宽。
-3640
w
游离-OH 的尖峰
伯醇
-1050
s
C-O 峰宽
1350-1260 m
O-H 峰宽
仲醇
-3630
w
游离-OH 的尖峰
---精品---
-1100
s
1350-1260 m
3615
w
叔醇
1150
s
1410-1310 m
3610
w
酚(非极性
红外光谱谱图解析完整版

X—Y伸缩, X—H变形振动区
2020/4/1
2、确定分子官能团和基团的吸收峰
(1) X—H伸缩振动区(4000 2500 cm-1 ) ① —O—H 3650 3200 cm-1 确定 醇、酚、酸 在非极性溶剂中,浓度较小(稀溶液)时,峰形尖锐,强吸收;
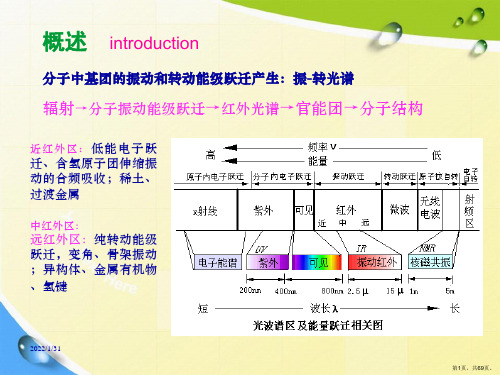
中红外区: 远红外区:纯转动能 级跃迁,变角、骨架 振动;异构体、金属 有机物、氢键
2020/4/1
一、认识红外光谱图
2020/4/1
1、红外光谱图
峰强:Vs(Very strong): 很强;s(strong):强; m(medium):中强; w(weak):弱。 峰形:表示形状的为宽峰、尖峰 、肩峰、双峰等类型
变形振动 亚甲基
2020/4/1
甲基的振动形式
伸缩振动 甲基:
对称 υs(CH3) 2870 ㎝-1
变形振动 甲基
2020/4/1
对称δs(CH3)1380㎝-1
不对称 υas(CH3) 2960㎝-1
不对称δas(CH3)1460㎝-1
二、解析红外光谱图
2020/4/1
一个未知化合物仅用红外光谱解析结构是十分困难的。一般在光谱解析
前,要做未知物的初步分析 红外光谱谱图的解析更带有经验性、灵活性。 解析主要是在掌握影响振动频率的因素及各类化合物的红外特征吸收谱
带的基础上,按峰区分析,指认某谱带的可能归属,结合其他峰区的相关 峰,确定其归属。
在此基础上,再仔细归属指纹区的有关谱带,综合分析,提出化合物的 可能结构。
必要时查阅标图谱或与其他谱(1H NMR,13C NMR,MS)配合, 确证其结构。
2020/4/1
红外光谱谱图解析

11:35:06
(一)了解样品来源及测试方法
要求样品纯度98%以上 尽可能地从下面几个方面详尽了解样品的情况: ①样品的来源——合成方法或从何种动、植物体中提取而来; ②样品的纯度、颜色、气味、沸点、熔点、折射率、样品物态、灼烧后 是否残留灰分等; ③样品的化学性质; ④元素分析结果,相对分子质量或质谱提供的分子离子峰,并由此求出 分子式; ⑤红外光谱测定条件和制样方法及所用仪器分辩率。
-(CH2)nn
11:35:06
a)由于支链的引入,使CH3的对称变形振动发生变化。 b)C—C骨架振动明显
H C C H3 C H3
C H3 C
CH3 δ
s
C—C骨架振动
1385-1380cm-1
1372-1368cm-1 1391-1381cm-1 1368-1366cm-1 1405-1385cm-1
1~650cm-1。大多数有机化合物及许多无机化合物的化学键振动均 落在这一区域 。
11:35:06
3、分子中基团的基本振动形式 basic vibration of the group in molecular
(1)两类基本振动形式
伸缩振动 亚甲基:
变形振动
亚甲基
11:35:06
甲基的振动形式
11:35:06
2、确定分子官能团和基团的吸收峰
(1) X—H伸缩振动区(4000 2500 cm-1 ) ① —O—H 3650 3200 cm-1 确定 醇、酚、酸
在非极性溶剂中,浓度较小(稀溶液)时,峰形尖锐,强吸收; 当浓度较大时,发生缔合作用,峰形较宽。
注意区分 —NH伸缩振动: 3500 3100 cm-1
11:35:06
(完整版)红外主要官能团对应谱图

主要基团的红外特征吸收峰基团振动类型波数(cm-1)波长(μm)强度备注一、烷烃类CH伸CH伸(反称)CH伸(对称)CH弯(面内)C-C伸3000~28432972~28802882~28431490~13501250~11403.33~3.523.37~3.473.49~3.526.71~7.418.00~8.77中、强中、强中、强分为反称与对称二、烯烃类CH伸C=C伸CH弯(面内)CH弯(面外)单取代双取代顺式反式3100~30001695~16301430~12901010~650995~985910~905730~650980~9653.23~3.335.90~6.137.00~7.759.90~15.410.05~10.1510.99~11.0513.70~15.3810.20~10.36中、弱中强强强强强C=C=C为2000~1925 cm-1三、炔烃类CH伸C≡C 伸CH弯(面内)CH弯(面外)~33002270~21001260~1245645~615~3.034.41~4.767.94~8.0315.50~16.25中中强四、取代苯类CH伸泛频峰骨架振动(CC=ν)CH弯(面内)CH弯(面外)3100~30002000~16671600±201500±251580±101450±201250~1000910~6653.23~3.335.00~6.006.25±0.086.67±0.106.33±0.046.90±0.108.00~10.0010.99~15.03变弱强三、四个峰,特征确定取代位置单取代邻双取代间双取代对双取代1,2,3,三取代1,3,5,三取代1,2,4,三取代﹡1,2,3,4四取代﹡1,2,4,5四取代﹡1,2,3,5四取代﹡五取代CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)CH弯(面外)770~730770~730810~750900~860860~800810~750874~835885~860860~800860~800860~800865~810~86012.99~13.7012.99~13.7012.35~13.3311.12~11.6311.63~12.5012.35~13.3311.44~11.9811.30~11.6311.63~12.5011.63~12.5011.63~12.5011.56~12.35~11.63极强极强极强中极强强强中强强强强强五个相邻氢四个相邻氢三个相邻氢一个氢(次要)二个相邻氢三个相邻氢与间双易混一个氢一个氢二个相邻氢二个相邻氢一个氢一个氢一个氢。
有机化合物的红外光谱

游离 3700~3500 cm-1 s(尖) 缔合 3450~3200 cm-1 vs (较宽)
伯胺双峰,仲胺单峰,叔胺无峰。
(4) v N-H(酰胺)
伯酰胺
3450~3225 cm-1 s(略宽),双峰
仲酰胺
~3330 cm-1
s (略宽)单峰,
δN-H 倍频峰 3070 cm-1 (w) 伯酰胺双峰,仲酰胺单峰,叔酰胺无峰。
烃类化合物中,vC-H频率与C原子杂化状态有关,
杂化C原子的s成分比例越高,其电负性越大,则相
应C-H键长越短,力常数越大,vC-H频率越高。
烷烃
烯烃
炔烃
C 杂化态
sp3
sp2
sp
C-H 键长 0.1095nm 0.1071nm 0.1058nm
K/N.cm-1 4.7
5.1
5.9
波数/cm-1 2960~2850 3100~3000 ~3300
υ H C C R
C C 2140-2100cm-1 (弱)
υ R1 C C R2 C C 2260-2190 cm-1 (弱)
c)C-H 变形振动(1000-700 cm-1 )
面内变形(=C-H)1400-1420 cm-1 (弱)
面外变形(=C-H) 1000-700 cm-1 (有价值)
异丙基 δ s : 约 1385,1375cm-1,m ,等强度双峰。 叔丁基 δ s : 约 1395,1365cm-1,m ,双峰,前弱后强。
(2)醇的 C-O 伸缩振动:约1000~1200cm-1 ,vs,宽。 (3)酚的C-O 伸缩振动: 约1100~1300cm-1, vs,宽,
有时裂分为双峰。 (4)醚的C-O伸缩振动: 约1050~1280cm-1,vs,较宽。 (5)酯的C-O伸缩振动: 约1000~1300cm-1,vs,宽。 (6)羧酸的C-O伸缩振动: 约1250cm-1,vs、v、m,宽。 (7)酸酐的C-O伸缩振动: 约1000~1250cm-1,vs,宽。
红外光谱谱图解析
C-H,N-H,O-H
1500
1000 500
指纹区
第27页,共69页。
三、各类化合物的红外光谱特征
2022/1/31
第28页,共69页。
1、烷烃(CH3,CH2,CH)(C—C,C—H )
3000cm-
1
δas1460 cm-1
重
CH3
叠
δs1380 cm-1
CH2 δs1465 cm-1
CH2 r 720 cm-1(水平摇摆)
⑤红外光谱测定条件和制样方法及所用仪器分辩率。
2022/1/31
第9页,共69页。
(二)计算不饱和度
定义: 不饱和度是指分子结构中达到饱和所缺一价元素的“对”数。如:乙烯 变成饱和烷烃需要两个氢原子,不饱和度为1。 计算: 可按下式进行不饱和度的计算:
UN= (2 + 4n6 + 3n5 + 2n4 + n3 – n1 )/ 2 n6,n5, n4 , n3 , n1 分别为分子中六价,五价,……,一价元素数目。 作用: 由分子的不饱和度可以推断分子中含有双键,三键,环,芳环的数目 ,验证谱图解析的正确性。 例: C9H8O2 UN = (2 +29 – 8 )/ 2 = 6
2022/1/31
第10页,共69页。
(三)从特征频率区中确定主要官能团取代基
与一定结构单元相联系的、在一定范围内出现的化学键振动频率——基团特征频率( 特征峰);
例: 2800 3000 cm-1 —CH3 特征峰; 1600 1850 cm-1 —C=O 特征峰;
基团所处化学环境不同,特征峰出现位置变化:
在判断存在某基团时,要尽可能地找出其各种相关吸收带,切不可仅根据某 一谱带即下该基团存在的结论。
常见高分子红外光谱谱图解析

C=C 伸缩振动 苯环-C=C- 弯曲振动
-CH 弯曲振动 单取代苯环 =CH 面内变形 (反式1,4)-CH=CH- 面外变形 单取代苯环 =CH 面外变形
13 / 24
10.聚氯乙烯[ ―CH2―CHCl― ]
2970 cm-1 2911
1426 cm-1 1334、1254 cm-1
对称伸缩
不对称伸缩
弯曲
1 / 24
弯曲型 XY2:
不对称伸缩
对称伸缩
面内弯曲(剪式)
面内摇摆 平面型 XY3:
面外摇摆
卷曲
对称伸缩
不对称伸缩
面内弯曲
面外弯曲 角锥型 XY3:
对称弯曲
不对称弯曲
2 / 24
面内摇摆
4)聚合物红外光谱的特点 1、组成吸收带 2、构象吸收带 3、立构规整性吸收带 4、构象规整性吸收带 5、结晶吸收带
-CH3 不对称伸缩振动 -CH2- 不对称伸缩振动 -CH2- 对称伸缩振动
C N 伸缩振动
C=C 伸缩振动 -CH2- 弯曲振动
-CH3 弯曲振动 (3,4-)> C=CH2 面外变形 (顺式1,4-)-CH=CH2- 面外变形
11 / 24
8.聚苯乙烯
3082、3059、3025、3000 cm-1 2923 cm-1 2849 cm-1
1085、1015 cm-1 830 cm-1
>C=O 伸缩振动 苯环-C=C- 弯曲振动
-C(CH3)2 弯曲振动 -C-O-C- 伸缩振动 苯环-C=C- 弯曲振动 对位取代苯环 =CH 面内变形 对位取代苯环 =CH 面外变形
15 / 24
13.聚对苯二甲酸乙二醇酯
红外光谱图
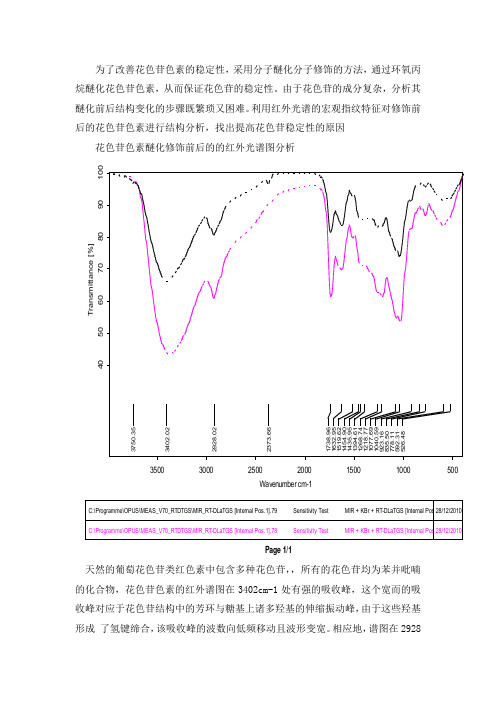
为了改善花色苷色素的稳定性,采用分子醚化分子修饰的方法,通过环氧丙烷醚化花色苷色素,从而保证花色苷的稳定性。
由于花色苷的成分复杂,分析其醚化前后结构变化的步骤既繁琐又困难。
利用红外光谱的宏观指纹特征对修饰前后的花色苷色素进行结构分析,找出提高花色苷稳定性的原因花色苷色素醚化修饰前后的的红外光谱图分析C:\Programme\OPUS\MEAS_V70_RTDTGS\MIR_RT-DLaTGS [Internal Pos.1].79 Sensitivity Test MIR + KBr + RT-DLaTGS [Internal Pos.1] C:\Programme\OPUS\MEAS_V70_RTDTGS\MIR_RT-DLaTGS [Internal Pos.1].78 Sensitivity Test MIR + KBr + RT-DLaTGS [Internal Pos.1]28/12/201028/12/20103750.353402.022928.022373.661738.961632.951519.621454.901435.951394.611268.741218.771077.691040.59923.16835.50778.11592.31526.48500100015002000250030003500Wavenumber cm-1405060708090100T r a n s m i t t a n c e [%] Page 1/1天然的葡萄花色苷类红色素中包含多种花色苷,,所有的花色苷均为苯并吡喃的化合物,花色苷色素的红外谱图在3402cm-1处有强的吸收峰,这个宽而的吸收峰对应于花色苷结构中的芳环与糖基上诸多羟基的伸缩振动峰,由于这些羟基形成 了氢键缔合,该吸收峰的波数向低频移动且波形变宽。
相应地,谱图在2928cm-1处的吸收峰是由糖环中亚甲基的伸缩振动引起的;而1738,1632,1519,1454,1435cm-1则对应花色苷苯并吡喃的芳环和杂环的骨架振动。
红外光谱谱图解析

(六)确证解析结果 按以下几种方法验证 1、设法获得纯样品,绘制其光谱图进行对照,但必须考虑 到样品的处理技术与测量条件是否相同。 2、若不能获得纯样品时,可与标准光谱图进行对照。当谱 图上的特征吸收带位置、形状及强度相一致时,可以完全确 证。当然,两图绝对吻合不可能,但各特征吸收带的相对强 度的顺序是不变的。 常见的标准红外光谱图集有Sadtler红外谱图集、Coblentz 学会谱图集、API光谱图集、DMS光谱图集。
中红外区: 远红外区:纯转动能 级跃迁,变角、骨架 振动;异构体、金属 有机物、氢键
16:14:47
一、认识红外光谱图
16:14:47
1、红外光谱图
峰强:Vs(Very strong): 很强;s(strong):强; m(medium):中强; w(weak):弱。 峰形:表示形状的为宽峰、尖峰 、肩峰、双峰等类型
16:14:47
1、红外光谱信息区
常见的有机化合物基团频率出现的范围:4000 670 cm-1 依据基团的振动形式,分为四个区: (1)4000 2500 cm-1 X—H伸缩振动区(X=O,N,C,S) (2)2500 2000 cm-1 三键,累积双键伸缩振动区 (3)2000 1500 cm-1
CH
16:14:47
υ (C-H)
3080 cm-1 3030 cm-1
共轭 2220 2230 cm-1 仅含C、H、N时:峰较强、尖锐; 有O原子存在时;O越靠近C N,峰越弱;
(3) 双键伸缩振动区( 2000 1500 cm-1 )
① RC=CR’ 1620 1680 cm-1 强度弱, R=R’(对称)时,无红外活性。
②单核芳烃 的C=C键伸缩振动(1626 1650 cm-1 )
各类化合物的红外光谱特征讲解

H 990 cm-1 H 910 cm-1 (强) H
2:1850-1780 cm-1
H 890 cm-1(强)
2:1800-1780 cm-1
H C C R
2:1375-1225 cm-1 (弱)
R1 C C R 2
有机化工产品分析
对比
烯烃顺反异构体
有机化工产品分析
实例分析
υ
AS (N=O)=1565-1545cm
-1
υ
υ 芳香族 υ
S (N=O)=1385-1350cm
-1
-1
AS (N=O)=1550-1500cm S
-1 =1365-1290cm (N=O)
有机化工产品分析
有机化工产品分析
谢谢
υ
(C-O)
1050 cm-1 1100 cm-1 1150 cm-1 1200 cm-1
α 支化:-15 cm-1 α 不饱和:-30 cm-1
有机化工产品分析
—OH基团特性
分子间氢键: 双分子缔合(二聚体)3550-3450 cm-1 多分子缔合(多聚体)3400-3200 cm-1 分子内氢键:
有机化工产品分析
3515cm-1
2895 cm-1 0.01M 0.1M 0.25M 1.0M
2950cm-1
3640cm-1
3350cm-1 乙醇在四氯化碳中不同浓度的IR图
有机化工产品分析
有机化工产品分析
有机化工产品分析
4、 醚(C—O—C)
脂族和环的C-O-C 芳族和乙烯基的=C-O-C 脂族 R-OCH3 υ 芳族 Ar-OCH3 υ
(C=C)峰
H C C R R1 C C R2
红外光谱谱图解析

C H3 C C H3 CH
3
08:31:12
CH3 δ s C—C骨架振动
1385-1380cm-1
1155cm-1
1:1
1372-1368cm-1
1170cm-1
1391-1381cm-1 1368-1366cm-1
1405-1385cm-1 1372-1365cm-1
4:5 1195 cm-1
正庚烷
正十二 烷
正二十八 烷
1500 1400 1300cm-1 1500 1400 1300 cm-1 1500 1400 1300cm-1
08:31:12
08:31:12
2、 烯烃,炔烃
CH
CH 伸
CC 缩
CC 振
a)C-H 伸缩振动(> 3000 cm-1)
动
CH 变
形
振 动
H CH H C H C CH2
当浓度较大时,发生缔合作用,峰形较宽。
注意区分 —NH伸缩振动: 3500 3100 cm-1
08:31:12
3515cm-1
2895 cm-1
3640cm-1
3350cm-1
2950cm-1
08:31:12
乙醇在四氯化碳中不同浓度的IR图
0.01M
0.1M 0.25M 1.0M
②饱和碳原子上的—C—H
在判断存在某基团时,要尽可能地找出其各种相关吸收带,切不可仅 根据某一谱带即下该基团存在的结论。
同理,在判断某种基团不存在时也要特别小心,因为某种基团的特征 振动可能是非红外活性的,也可能因为分子结构的原因,其特征吸收变 得极弱。 (五)提出结构式 如果分子中的所有结构碎片都成为已知(分子中的所有原子和不饱和 度均已用完),那么就可以推导出分子的结构式。在推导结构式时,应 把各种可能的结构式都推导出来,然后根据样品的各种物理的、化学的 性质以及红外光谱排除不合理的结构。
