同位素 同素异形体 同系物 同分异构体和同种物质的比较概念辨析
同位素 同系物 同素异形体 同分异构的概念

同位素同系物同素异形体同分异构的概念《同位素、同系物、同素异形体、同分异构:化学世界里的奇妙概念》嘿,同学们!今天我想和大家聊聊化学里超级有趣的几个概念,就是同位素、同系物、同素异形体和同分异构。
这几个东西就像魔法一样,让化学的世界变得超级神秘又好玩呢!先说说同位素吧。
我就把同位素想象成是一群长得特别像的兄弟姐妹。
大家都知道原子吧,原子就像一个小小的世界,里面有原子核,原子核里有质子和中子。
同位素呢,就是质子数相同,但是中子数不一样的原子。
这就好比是同一家族里的兄弟姐妹,虽然长得很像,都姓同一个姓(质子数相同嘛,就像同一个家族的姓),可是体重不一样(中子数不同,就像体重不同啦)。
比如说氢元素,就有氕、氘、氚这几种同位素。
氕就像是最瘦的那个小弟弟,只有一个质子,没有中子;氘呢,就像是稍微胖一点的哥哥,有一个质子和一个中子;氚就像是最胖的那个哥哥,有一个质子和两个中子。
这些同位素啊,虽然有点小差别,但是它们的化学性质几乎是一样的呢。
我就想啊,这是不是就像双胞胎或者多胞胎,虽然有点细微差别,可还是很相似呢?你们说,这是不是很神奇?再来说说同系物。
同系物就像是一列长长的火车,一节一节的车厢很相似。
在化学里,同系物是指结构相似,分子组成上相差一个或若干个“CH₂”原子团的有机化合物。
就好比我们搭积木,每多一块“CH₂”的积木,就像是多了一节车厢。
比如说甲烷(CH₄)和乙烷(C₂H₆),乙烷就比甲烷多了一个“CH₂”,它们就像同系物这个大家族里的两个成员。
这些同系物呢,它们的化学性质也很相似,就像同一列火车的车厢都有相似的功能一样。
我想啊,这就好像是我们的家族里,一辈一辈的人有相似的地方。
爷爷和爸爸很像,爸爸和我也很像,但是每一代又有一点小变化,就像同系物之间相差“CH₂”一样。
同素异形体可就更有趣啦!我把同素异形体想象成是超级英雄的不同变身。
同素异形体就是由同一种元素组成的不同单质。
比如说碳元素,它就有金刚石、石墨和C₆₀这几种同素异形体。
同位素 同素异形体 同系物 同分异构体和同种物质的比较概念辨析
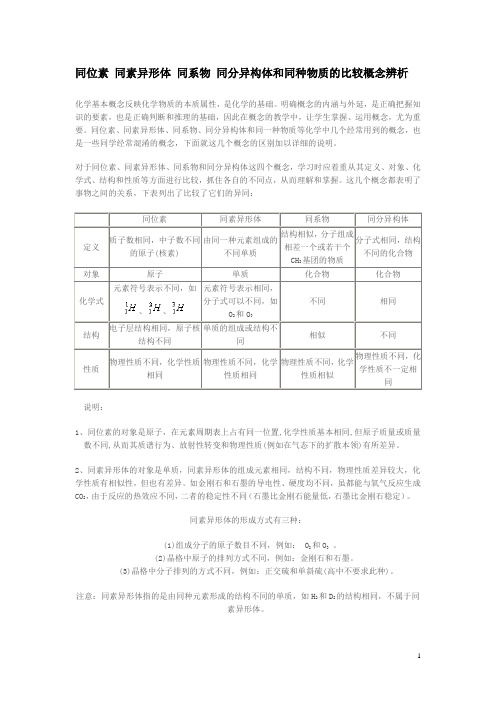
同位素同素异形体同系物同分异构体和同种物质的比较概念辨析化学基本概念反映化学物质的本质属性,是化学的基础。
明确概念的内涵与外延,是正确把握知识的要素,也是正确判断和推理的基础,因此在概念的教学中,让学生掌握、运用概念,尤为重要。
同位素、同素异形体、同系物、同分异构体和同一种物质等化学中几个经常用到的概念,也是一些同学经常混淆的概念,下面就这几个概念的区别加以详细的说明。
对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:、、说明:1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如: O2和O3。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体。
3、同系物的对象是有机化合物,属于同系物的有机物必须结构相似,在有机物的分类中,属于同一类物质,通式相同,化学性质相似,差异是分子式不同,相对分子质量不同,在组成上相差一个或若干个CH2原子团,相对分子质量相差14的整数倍,如分子中含碳原子数不同的烷烃之间就属于同系物。
(1)结构相似指的是组成元素相同,官能团的类别、官能团的数目及连接方式均相同。
同系物同位素同素异形体同分异构体的举例

同系物同位素同素异形体同分异构体的举例同系物、同位素、同素异形体、同分异构体是化学中常用的概念,用来描述化学物质在分子结构上的差异。
下面将以具体实例为例,细致解释这四个概念的含义和应用。
同系物是指具有相同或相近分子式的化合物。
它们在分子构造上有着相似但不完全相同的特点。
例如,酚类化合物对苯酚、间酚和邻酚,它们的分子式都是C6H6O,但它们的分子结构和性质有所不同。
另一个例子是醇类化合物,如乙醇、异丙醇等都是同系物。
同位素是指原子核中质子数相同、中子数不同的同位素体系。
例如,氢气的同位素有氘(氢的同位素,质子数为1,中子数为1)和氚(质子数为1,中子数为2)。
同一元素的不同同位素有时会导致其物理和化学性质的差异。
同素异形体是指由同一组原子组成,但分子结构不同的同素体。
常见的例子是热带硬脂酸的两种异构体。
正硬脂酸和癸二酸,化学式都是C17H34O2,但它们的分子结构和物理性质有所不同。
另一个例子是异构烯烃,如顺式-丁烯和反式-丁烯都是C4H8的同素异形体。
同分异构体是指分子式相同,但结构略有不同的化合物。
例如,异丁烷和2-甲基丁烷,它们的分子式都是C4H10,但它们的分子结构不同。
另一个例子是异构酮,如丙酮和乙酸酯,它们的分子式都是C3H6O,但它们在分子结构上有所不同。
这四个概念在化学中有着广泛的应用。
首先,通过研究同系物,可以了解不同化合物之间的相似性和差异性,为合成新的化合物提供参考。
其次,同位素的使用在放射性同位素示踪、核能利用和碳定年等方面具有重要意义。
同素异形体和同分异构体的研究可以深入了解化学反应机制,对有机合成和药物设计有着重要的指导作用。
总结起来,同系物、同位素、同素异形体和同分异构体是用来描述化学物质在分子构造上的差异的重要概念。
通过研究和区分这些概念,我们能够更好地理解化学物质的性质和行为,从而为新化合物的合成和应用提供指导。
同位素,同素异形体,同分异构体,同系物的概念[资料]
![同位素,同素异形体,同分异构体,同系物的概念[资料]](https://img.taocdn.com/s3/m/9b341b253868011ca300a6c30c2259010202f34d.png)
同位素的表示符号同位素是具有相同原子序数的同一化学元素的两种或多种原子之一,在元素周期表上占有同一位置,化学行为几乎相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
同位素的表示是在该元素符号的左上角注明质量数,例如碳14,一般用14C而不用C14。
自然界中许多元素都有同位素。
同位素有的是天然存在的,有的是人工制造的,有的有放射性,有的没有放射性。
同一元素的同位素虽然质量数不同,但他们的化学性质基本相同(如:化学反应和离子的形成),物理性质有差异[主要表现在质量上(如:熔点和沸点)]。
自然界中,各种同位素的原子个数百分比一定。
同位素是指具有相同核电荷但不同原子质量的原子(核素)称为同位素。
在19世纪末先发现了放射性同位素,随后又发现了天然存在的稳定同位素,并测定了同位素的丰度。
大多数天然元素都存在几种稳定的同位素。
同种元素的各种同位素质量不同,但化学性质几乎相同。
同素异形体,是相同元素组成,不同形态的单质。
如碳元素就有金钢石、石墨、无定形碳等同素异形体。
同素异形体由于结构不同,彼此间物理性质有差异;但由于是同种元素形成的单质,所以化学性质相似。
同分异构体:化学上,同分异构体是一种有相同化学式,有同样的化学键而有不同的原子排列的化合物。
简单地说,化合物具有相同分子式,但具有不同结构的现象,叫做同分异构现象;具有相同分子式而结构不同的化合物互为同分异构体。
很多同分异构体有相似的性质。
同系物定义化学上,我们把结构相似,组成上相差1个或者若干个某种原子团的化合物互称为同系物。
多用于有机化合物。
旧定义(在比较旧的化学书上可能存在这个概念)化学上,我们把结构、化学性质、通式相似,组成上相差1个或者若干个CH2原子团(系差)具有相同官能团的化合物统称为同系物。
“五同”的辨析与判断

“五同”的辨析与判断“五同”是指同位素、同素异形体、同系物、同分异构体、同种物质,下面从若干方面对这五个概念实行分析、比较,以加深对五个概念的理解与理解,掌握判断的方法和技巧。
一.“五同”的概念1.同位素:质子数相同质量数(或中子数)不同的原子互称同位素。
2.同素异形体:同种元素形成多种不同单质的现象叫做同素异形现象,同种元素形成的不同单质互为同素异形体。
3.同系物:结构相似,在分子组成上相差一个或若干个CH 2原子团的物质互称为同系物。
4.同分异构体:化合物具有相同的分子式,但具有不同的结构式的现象,叫做同分异构现象。
具有同分异构现象的化合物互称为同分异构体。
5.同种物质:组成和结构都相同的物质。
三.“五同”的分类与判断 1.同位素多数元素都存有同位素,如1 1H 2 1H 3 1H , 12 6C 13 6C 146C , 少数元素不存有同位素,如钠、氟等元素不存有同位素。
同位素要求质子数相同且中子数不同。
如果质子数中子数都相同,则为同种原子。
同位素适用于原子之间,不适用于分子、离子等微粒。
例1.下列各组微粒中互为同位素的一组的是 ( )A. D 与2 1HB. 质量数均为40的两原子C. 3 1H 与1 1H +D. 16O 、17O 、18O答案:D解析:A 项中D 与2 1H 为同种原子;B 项中质量数相同能够是同种原子,也能够是不同元素的不同原子,如4019K 和40 20Ca 质量数均为40 ;C 项中原子与离子不能互为同位素;D 项为氧元素的三种不同原子,质子数相同,均为8,中子数不同,分别为8、9、10,互为同位素。
2.同素异形体形成方式有三种:(1)组成分子的原子数不同 如氧气(O 2)和臭氧 (O 3)(2) 晶体中原子的排列方式不同 如金刚石与石墨(3)晶格中分子的排列方式不同 如斜方晶硫与单斜晶硫红磷和白磷的形成方式复杂,分子中原子的数目不同,而原子的排列方式也不同。
同素异形体适用于单质,元素相同且性质不同。
同位素、同素异形体、同系物、同分异构体和同种物质的比较

1同位素是针对原子来说的,指质子数相同而中子数不同的原子,如D和H2同分异构体是指分子式相同而结构不同的化合物,如丁烷和异丁烷3同系物是指有机物中差一个CH2的物质,如烷4同素异形体是指单质,如O2,O3。
红磷白磷同位素是具有相同原子序数的同一化学元素的两种或多种原子之一,在元素周期表上占有同一位置,化学行为几乎相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
同位素的表示是在该元素符号的左上角注明质量数,例如碳14,一般用14C而不用C14。
自然界中许多元素都有同位素。
同位素有的是天然存在的,有的是人工制造的,有的有放射性,有的没有放射性。
同一元素的同位素虽然质量数不同,但他们的化学性质基本相同(如:化学反应和离子的形成),物理性质有差异[主要表现在质量上(如:熔点和沸点)]。
自然界中,各种同位素的原子个数百分比一定。
同位素是指具有相同核电荷但不同原子质量的原子(核素)称为同位素。
在19世纪末先发现了放射性同位素,随后又发现了天然存在的稳定同位素,并测定了同位素的丰度。
大多数天然元素都存在几种稳定的同位素。
同种元素的各种同位素质量不同,但化学性质几乎相同。
同素异形体,是相同元素组成,不同形态的单质。
如碳元素就有金钢石、石墨、无定形碳等同素异形体。
同素异形体由于结构不同,彼此间物理性质有差异;但由于是同种元素形成的单质,所以化学性质相似。
同分异构体:化学上,同分异构体是一种有相同化学式,有同样的化学键而有不同的原子排列的化合物。
简单地说,化合物具有相同分子式,但具有不同结构的现象,叫做同分异构现象;具有相同分子式而结构不同的化合物互为同分异构体。
很多同分异构体有相似的性质。
同系物定义同系物定义同系物定义同系物定义化学上,我们把结构相似,组成上相差1个或者若干个某种原子团的化合物互称为同系物。
多用于有机化合物。
旧定义(在比较旧的化学书上可能存在这个概念)化学上,我们把结构、化学性质、通式相似,组成上相差1个或者若干个CH2原子团(系差)具有相同官能团的化合物统称为同系物。
高中化学 同位素 同素异形体 同系物 同分异构体和同种物质的比较概念辨析 新人教版
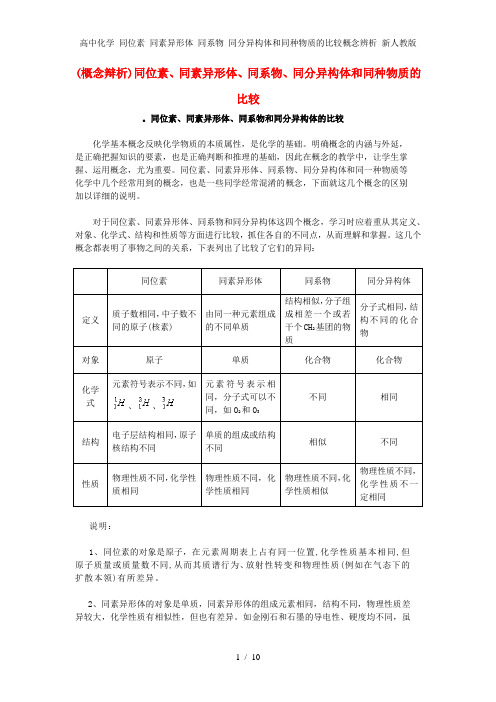
(概念辩析)同位素、同素异形体、同系物、同分异构体和同种物质的比较。
同位素、同素异形体、同系物和同分异构体的比较化学基本概念反映化学物质的本质属性,是化学的基础。
明确概念的内涵与外延,是正确把握知识的要素,也是正确判断和推理的基础,因此在概念的教学中,让学生掌握、运用概念,尤为重要。
同位素、同素异形体、同系物、同分异构体和同一种物质等化学中几个经常用到的概念,也是一些同学经常混淆的概念,下面就这几个概念的区别加以详细的说明。
对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:同位素同素异形体同系物同分异构体定义质子数相同,中子数不同的原子(核素)由同一种元素组成的不同单质结构相似,分子组成相差一个或若干个CH2基团的物质分子式相同,结构不同的化合物对象原子单质化合物化合物化学式元素符号表示不同,如、、元素符号表示相同,分子式可以不同,如O2和O3不同相同结构电子层结构相同,原子核结构不同单质的组成或结构不同相似不同性质物理性质不同,化学性质相同物理性质不同,化学性质相同物理性质不同,化学性质相似物理性质不同,化学性质不一定相同说明:1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如: O2和O3。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
同分异构体,同位素,同系物,同素异形体的定义

同分异构体,同位素,同系物,同素异形体的定义In the field of chemistry, there are several terms thatrefer to different forms or variations of the same chemical element. These terms include: isotopes, allotropes, isomers, and isobars. While they may sound similar, each of these terms carries a specific meaning in the context of chemistry.在化学领域中,有几个词汇用于指代同一种化学元素的不同形式或变异。
这些术语包括:同位素、同素异构体、同分异构体和同质庄稼。
尽管它们听起来很相似,但每个术语在化学的上下文中都有着特定的含义。
Let's start with isotopes. Isotopes are atoms of the same element that have different numbers of neutrons in their nuclei. This means that while isotopes have the same number of protons and electrons, they differ in their atomic mass. For example, carbon-12 and carbon-14 are both isotopes of carbon, as they have the same number of protons (6) but different numbers of neutrons (6 and 8 respectively).让我们先从同位素开始。
同位素同分异构体同素异形体同系物的比较

有机化学1、有机化合物的基本特征2、简单分类3、命名4、同分异构体同位素、同分异构体、同素异形体、同系物的比较定义化学式结构或分子特点性质式同位素同素异形体同系物同分异构体同系物:结构相似,相差n 个 CH2原子团。
同分异构体:分子式相同,结构不同的有机物。
请同学们设计一个表格,小结官能团异构通式物质类别举例C n H2nC n H2n-2C n H2n-6C n H2n+2OC n H2n OC n H2n O2C n H2n-6 OC6H12O6C12H22O11C n H2n+1NO21.已知二甲苯有三种同分异构体,则四氯苯有______ 种同分异构体 .2.一氯戊烷中含有两个“— CH3”的结构为____ 种 .3. C11H16的苯的同系物中 ,只含有一个支链 , 且支链上含有两个“—CH3”的结构有四种 , 写出其结构简式 .4.已知将中的c与d 原子交换位置 ,可以得到另一种物质 :.的烯烃同分异构体有____种.5.下列有机物与溴(Br 2) 发生成反应 ,加成产物各有多少种1 : 1.C4H8的加6.与 H2发生 1:4加成反应时 , 其产物有 ______ 种 .7.C4H4有多种同分异构体 , 它们分别具有以下特征 , 试写出相应的同分异构体的结构简式 .(1)A 为链状结构 , 可以由两分子的乙炔加成而得 , A 为 ________.(2)B 为平面结构 , 与溴水发生 1 : 1 加成反应 , 加成方式有两种 , 但加成产物只有一种 . B 为__________ .(3)C为正四面体,每个C原子分别与另三个 C 原子通过单键相连. 则 C 为_________ .8.C6H6有两种常见的同分异构体, A为苯 , B 是具有空间立体结构的图形 , 写出它们的结构简式 .C 8H8有两种同分异构体 , A 是具有空间立体结构的立方烷 , B 是芳香烃 , 写出它们的结构简式 .9.在下列物质中:属于同系物的是答:---------- 属于同种物质的是 --------- ,属于同分异构体的是--------10.篮烷的化学式为C10H 12,其结构如图,则其一氯代物有【】种。
同位素-同素异形体-同系物-同分异构体的异同

张浩祥对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:同位素:质子数相同,中子数不同的原子(核素)对象原子同素异形体:由同一种元素组成的不同单质。
对象单质同系物; 结构相似,分子组成相差一个或若干个CH2基团的物质对象化合物同分异构体: 分子式相同,结构不同的化合物对象化合物说明:1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如:O2和O3 。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体。
3、同系物的对象是有机化合物,属于同系物的有机物必须结构相似,在有机物的分类中,属于同一类物质,通式相同,化学性质相似,差异是分子式不同,相对分子质量不同,在组成上相差一个或若干个CH2原子团,相对分子质量相差14的整数倍,如分子中含碳原子数不同的烷烃之间就属于同系物。
(1)结构相似指的是组成元素相同,官能团的类别、官能团的数目及连接方式均相同。
结构相似不一定是完全相同,如CH3CH2CH3和(CH3)4C,前者无支链,后者有支链,但二者仍为同系物。
(2)通式相同,但通式相同不一定是同系物。
同系物 同分异构体 同位素 同素异形体的区别

1、同系物:结构相似,分子组成相差一个或若干个CH2原子的物质CH4和CH2H6
2、同分异构体:化合物具有相同的分子式,但具有不同结构(这个需要结构式)
*一个是物质不同*一个是结构不同
A同系物就是结构相似,分子式相差一个或多个CH2 的物质,在有机物中存在,如烷烃
B同分异构体就是化学式一致,但是结构式排布不一致的两种物质
C同位素就是在一种元素中存在着质子相同,中子数不同的数种核素(上面的“水和重水”的说法是不对的),如氢元素中的氕、氘、氚
D同素异型体就是构成的元素相同,但由于原子排列不同,形成不同性质的物质,如O2 和O3。
同位素、同素异形体、同系物、同分异构体和同种物质的比较
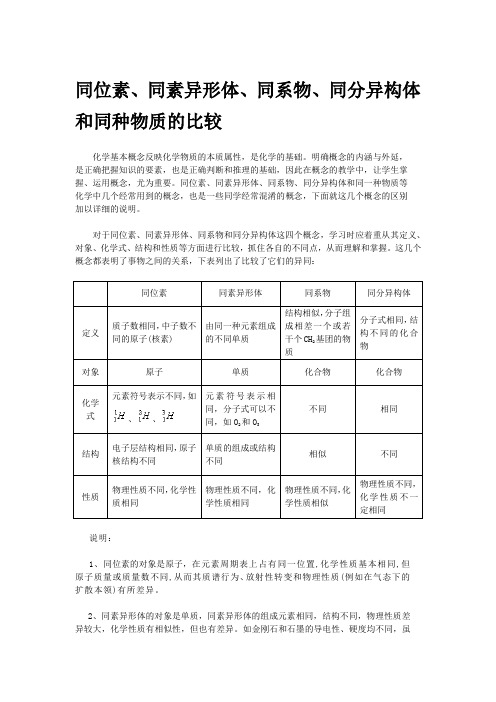
同位素、同素异形体、同系物、同分异构体和同种物质的比较化学基本概念反映化学物质的本质属性,是化学的基础。
明确概念的内涵与外延,是正确把握知识的要素,也是正确判断和推理的基础,因此在概念的教学中,让学生掌握、运用概念,尤为重要。
同位素、同素异形体、同系物、同分异构体和同一种物质等化学中几个经常用到的概念,也是一些同学经常混淆的概念,下面就这几个概念的区别加以详细的说明。
对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:同位素同素异形体同系物同分异构体定义质子数相同,中子数不同的原子(核素)由同一种元素组成的不同单质结构相似,分子组成相差一个或若干个CH2基团的物质分子式相同,结构不同的化合物对象原子单质化合物化合物化学式元素符号表示不同,如、、元素符号表示相同,分子式可以不同,如O2和O3不同相同结构电子层结构相同,原子核结构不同单质的组成或结构不同相似不同性质物理性质不同,化学性质相同物理性质不同,化学性质相同物理性质不同,化学性质相似物理性质不同,化学性质不一定相同说明:1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如: O2和O3。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
核素同位素等概念辨析

元素、核素、同位素、同素异形体的比较
元素
核素
同位素
本质
质子数相同的所有原子总称
具有一定质子数和中子数的一种原子
质子数相同、中子数不同的核素之间互称
对象
同类原子
原子
原子
举例
所有的氕氘氚核素(原子)称为氢元素
1H、2H、3H称为氢元素的三种核素
12C、14C;1H、2H、3H等互称同位素
(3)化合物分子组成越复杂,同分异构体越多,如CH4、C2H6、C3H8无同分异构体,丁烷(C4H10)有2种同分异构体,戊烷(C5H12)有3种同分异构体,己烷(C6H14)有5种同分异构体。同分异构现象是有机物种类繁多的主要因素之一。
特别提示 结构不同,分子式相同是判断化合物是否是同分异构体的依据。 结构不同分两种情况:①属于同类物质但分子中原子的连接顺序不同;②分子式相同但不属于同类型物质。同分异构体的分子式相同,因此其相对分子质量相同,但相对分子质量相同的化合物不一定互为同分异构体,如NO和C2H6。
X
A
Z
——元素符号
质量数 ——
质子数 —— (荷电荷数)
中子数:N=Leabharlann -Z质量数(A)=质子数(Z)+中子数(N)
写出C-12、C-13、D、T的原子组成式
6C
12
1H
1H
2
3
6C
13
1.同系物 在分析烷烃的通式时发现相邻的烷烃都相差一个CH2原子团。像这种结构相似,分子组成上相差一个或若干个CH2原子团的物质互称为同系物,例如,甲烷、乙烷、丙烷等互为同系物。
同素异形体
同种元素形成的不同单质之间互称
同位素,同素异形体,同分异构体,同系物的概念

同位素的表示符号同位素是具有相同原子序数的同一化学元素的两种或多种原子之一,在元素周期表上占有同一位置,化学行为几乎相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
同位素的表示是在该元素符号的左上角注明质量数,例如碳14,一般用14C而不用C14。
自然界中许多元素都有同位素。
同位素有的是天然存在的,有的是人工制造的,有的有放射性,有的没有放射性。
同一元素的同位素虽然质量数不同,但他们的化学性质基本相同(如:化学反应和离子的形成),物理性质有差异[主要表现在质量上(如:熔点和沸点)]。
自然界中,各种同位素的原子个数百分比一定。
同位素是指具有相同核电荷但不同原子质量的原子(核素)称为同位素。
在19世纪末先发现了放射性同位素,随后又发现了天然存在的稳定同位素,并测定了同位素的丰度。
大多数天然元素都存在几种稳定的同位素。
同种元素的各种同位素质量不同,但化学性质几乎相同。
同素异形体,是相同元素组成,不同形态的单质。
如碳元素就有金钢石、石墨、无定形碳等同素异形体。
同素异形体由于结构不同,彼此间物理性质有差异;但由于是同种元素形成的单质,所以化学性质相似。
同分异构体:化学上,同分异构体是一种有相同化学式,有同样的化学键而有不同的原子排列的化合物。
简单地说,化合物具有相同分子式,但具有不同结构的现象,叫做同分异构现象;具有相同分子式而结构不同的化合物互为同分异构体。
很多同分异构体有相似的性质。
同系物定义化学上,我们把结构相似,组成上相差1个或者若干个某种原子团的化合物互称为同系物。
多用于有机化合物。
旧定义(在比较旧的化学书上可能存在这个概念)化学上,我们把结构、化学性质、通式相似,组成上相差1个或者若干个CH2原子团(系差)具有相同官能团的化合物统称为同系物。
烷烃中的甲烷、乙烷、丁烷等,他们相差n个CH2,互为同系物。
又比如(假设存在,只是为了说明)CH2O、C2H4O2、C3H6O3,他们相差n个CH2O,也互为同系物。
同位素、同素异形体、同系物、同分异构体

同位素、同素异形体、同系物、同分异构体同位素、同素异形体、同系物、同分异构体这四个概念都带有一个同字。
分别对应同一元素的不同原子、同一元素形成的不同单质、组成结构和性质相似的有机物、分子组成相同但结构不同的物质。
对于同一种物质本文没有列入讨论。
同位素是指质子数相同而中子数不同的同一种元素的不同原子互称为同位素。
把具有一定数目的质子和一定数目的中子的一种原子叫做核素。
同位指核素的质子数相同,在周期表中占有相同的位置。
同位素中又有放射性同位素,化学书籍所列相对原子质量多数含有小数就是大都存在同位素的缘故。
相对于同位素,还有人提出同量素概念,是指质子数和中子数都不同但质量数相同的核素。
高考要求是理解同位素概念,看懂并会写核素表示式,计算元素相对原子质量。
由于这个知识点题目相对容易,仅在第一年课标卷即2007年第9题出现,难度系数0.89,所以以后再也没有出现。
同素异形体在初中九年级教材叙述为由同种元素形成的不同单质。
大体可分为三类:物质中原子的排列不同,按照高中讲解是连接方式不同,如金刚石和石墨;分子中的原子个数不同,氧气和臭氧;连接方式和分子中原子个数都不同,如红磷和白磷。
中学阶段理解同素异形体存在于第ⅣA碳、ⅤA磷、ⅥA氧的理由。
这样才有助于记忆且同时理解其性质。
硅元素原子核外电子有3层,半径大,原子之间另一种键合时彼此键合能力弱,这既是含硅化合物远不及碳的原因,也是其同素异形体不易存在的理由。
同理由于氮原子之间可以以氮氮三键结合成为稳定的氮气分子,因此也是极难成为其他形式的单质。
至于氧的同素异形体可以与碳相类比,当然高考题中曾经以信息介绍硫的同素异形体S8,笔者意见作为特例记忆合适。
至于卤族,由于其最外层7个电子,以共用一对电子成为稳定结构,当然不必形成其他形式结合的同素异形体,还有Ⅰ、Ⅱ为金属元素,可认为没有其他形式的单质,ⅢA族的铝也是金属。
这样理解记忆即可。
同素异形体物理性质和化学性质均有不同,其中物理性质差别较为明显,如熔、沸点和气味明显不同;化学性质也有不同,如石墨较金刚石稳定,臭氧比氧气氧化性强,白磷在空气中可以自燃。
同系物和同分异构体同素异形体同位素表格对比

同系物和同分异构体同素异形体同位素表格对比
同素异形体是由同种元素组成的不同单质的互称;同位素是质子数相同而中子数不同的同一元素的不同原子的互称;同分异构体是分子式相同而结构式不同的化合物的互称;同系物是结构相似,在分子组成上相差一个或若干个CH2原子团的物质。
同素异形体,同位素,同分异构体,同系物的区分:
1、研究对象不同
同系物和同分异构体研究的是化合物;同素异形体研究的是单质;同位素研究的是原子。
2、结构不同
同位素的电子层结构相同,原子核结构不同;同素异形体的单质的组成或结构不同;同系物的结构相似;同分异构体的结构相同。
3、性质不同
同位素的物理性质不同,化学性质相同;同素异形体的物理性质不同,化学性质相同;同系物的物理性质不同,化学性质相似;同分异构体的物理性质不同,化学性质不一定相同。
4、化学式不同
同位素的元素符号表示不同;同素异形体的元素符号表示相同,分子式可以不同;同系物的化学式不同;同分异构体的化学式相同。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
同位素同素异形体同系物同分异构体和同种物质的比较概念辨析化学基本概念反映化学物质的本质属性,是化学的基础。
明确概念的内涵与外延,是正确把握知识的要素,也是正确判断和推理的基础,因此在概念的教学中,让学生掌握、运用概念,尤为重要。
同位素、同素异形体、同系物、同分异构体和同一种物质等化学中几个经常用到的概念,也是一些同学经常混淆的概念,下面就这几个概念的区别加以详细的说明。
对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。
这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同:、、说明:1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。
2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。
如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。
同素异形体的形成方式有三种:(1)组成分子的原子数目不同,例如: O2和O3。
(2)晶格中原子的排列方式不同,例如:金刚石和石墨。
(3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。
注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体。
3、同系物的对象是有机化合物,属于同系物的有机物必须结构相似,在有机物的分类中,属于同一类物质,通式相同,化学性质相似,差异是分子式不同,相对分子质量不同,在组成上相差一个或若干个CH2原子团,相对分子质量相差14的整数倍,如分子中含碳原子数不同的烷烃之间就属于同系物。
(1)结构相似指的是组成元素相同,官能团的类别、官能团的数目及连接方式均相同。
结构相似不一定是完全相同,如CH3CH2CH3和(CH3)4C,前者无支链,后者有支链,但二者仍为同系物。
(2)通式相同,但通式相同不一定是同系物。
例如:乙醇与乙醚它们的通式都是C n H2n+2O,但他们官能团类别不同,不是同系物。
又如:乙烯与环丁烷,它们的通式都是C n H2n,但不是同系物。
(3) 在分子组成上必须相差一个或若干个CH2原子团。
但分子组成上相差一个或若干个CH2原子团的物质却不一定是同系物,如CH3CH2Br和CH3CH2CH2Cl都是卤代烃,且组成相差一个CH2原子团,但二者不是同系物。
(4)同系物具有相似的化学性质,物理性质有一定的递变规律,如随碳原子个数的增多,同系物的熔、沸点逐渐升高;如果碳原子个数相同,则有支链的熔、沸点低,且支链越对称,熔、沸点越低。
如沸点:正戊烷>异戊烷>新戊烷。
同系物的密度一般随着碳原子个数的增多而增大。
4、同分异构体的对象是化合物,属于同分异构体的物质必须化学式相同,结构不同,因而性质不同。
具有“五同一异”,即同分子式、同最简式、同元素、同相对原子式量、同质量分数、结构不同。
属于同分异构体的物质可以是有机物,如正丁烷和异丁烷;可以是有机物和无机物,如氰酸铵和尿素;也可以是无机物,如[Pu(H2O)4]Cl3和[Pu(H2O)2Cl2]·2H2O·Cl。
在有机物中,很多物质都存在同分异构体,中学阶段涉及的同分异构体常见的有以下几类:(1)碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
如C5H12有三种同分异构体,即正戊烷、异戊烷和新戊烷。
(2)位置异构(官能团位置异构):指官能团或取代基在在碳链上的位置不同而造成的异构。
如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。
(3)类别异构(又称官能团异构):指官能团不同而造成的异构,如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦芽糖等。
(4)其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。
各类有机物类别异构体情况:⑴ C n H2n+2:只能是烷烃,而且只有碳链异构。
如CH3(CH2)3CH3、CH3CH(CH3)CH2CH3、C(CH3)4⑵ C n H2n:单烯烃、环烷烃。
如CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2、、⑶ C n H2n-2:炔烃、二烯烃、环烯烃。
如:CH≡CCH2CH3、CH3C≡CCH3、CH2=CHCH=CH2、⑷ C n H2n-6:芳香烃(苯及其同系物)。
如:、、⑸ C n H2n+2O:饱和脂肪醇、醚。
如:CH3CH2CH2OH、CH3CH(OH)CH3、CH3OCH2CH3⑹ C n H2n O:醛、酮、环醚、环醇、烯基醇。
如:CH3CH2CHO、CH3COCH3、CH2=CHCH2OH、、、⑺ C n H2n O2:羧酸、酯、羟醛、羟基酮。
如:CH3CH2COOH、CH3COOCH3、HCOOCH2CH3、HOCH2CH2CHO、CH3CH(OH)CHO、CH3COCH2OH⑻ C n H2n+1NO2:硝基烷、氨基酸。
如:CH3CH2NO2、H2NCH2COOH⑼ C n(H2O)m:糖类。
如: C6H12O6:CH2OH(CHOH)4CHO、CH2OH(CHOH)3COCH2OHC12H22O11:蔗糖、麦芽糖。
例1、下列各组物质中,两者互为同分异构体的是( )。
①CuSO4?3H2O和CuSO4?5H2O ②NH4CNO和CO(NH2)2③ C2H5NO2和NH2CH2COOH④[Pu(H2O)4]Cl3和[Pu(H2O)2Cl2] ?2H2O?ClA、①②③B、②③④C、②③D、③④解析:同分异构体是分子式相同,但结构不同。
CuSO4?3H2O和CuSO4?5H2O组成就不同,不是同分异构体;NH4CNO和CO(NH2)2分子式相同,二者结构不同,互为同分异构体;C2H5NO2和NH2CH2COOH,前者是硝基化合物,后者是氨基酸,分子式相同,属于类别异构;[Pu(H2O)4]Cl3和[Pu(H2O)2Cl2] ?2H2O?Cl,前者表示四个水分子直接和Pu相结合,后者中是两分子的水和两个氯离子与Pu相结合,所以结构不同,互为同分异构体。
正确选项为B。
例2、下列各组物质,其中属于同系物的是( )。
(1)乙烯和苯乙烯 (2)丙烯酸和油酸 (3)乙醇和丙二醇(4)丁二烯与异戊二烯 (5)蔗糖与麦芽糖A.(1)(2)(3)(4) B.(2)(4)C.(1)(2)(4)(5) D.(1)(2)(4)解析:同系物是指结构相似,即组成元素相同,官能团种类、个数相同,在分子组成上相差一个或若干个CH2原子团,即分子组成通式相同的物质。
乙烯和苯乙烯,后者含有苯环而前者没有;丙烯酸和油酸含有的官能团都是双键和羧基,而且数目相同所以是同系物;乙醇和丙二醇官能团的数目不同;丁二烯与异戊二烯都是共轭二烯烃,是同系物;蔗糖和麦芽糖是同分异构体而不是同系物。
正确选项为B。
例3、有下列各组微粒或物质:CH3A、O2和O3B、C和 CC、CH3CH2CH2CH3和 CH3CH2CHCH3H Cl CH3D、Cl—C—Cl和Cl—C—HE、CH3CH2CH2CH3和CH3—CH—CH3H H(1)组两种微粒互为同位素;(2)组两种物质互为同素异形体;(3)组两种物质属于同系物;(4)组两物质互为同分异构体;(5)组两物质是同一物质。
解析:这道题主要是对几个带“同字”概念的考查及识别判断能力。
A项为都由氧元素形成的结构不同的单质,为同素异形体。
B项为质子数相同,中子数不同的原子,属于同位素。
C项均为烷烃结构,分子组成上相差一个CH2原子团,属于同系物。
D项均为甲烷的取代产物,因而是立体结构,是同种物质。
D项的分子式相同,结构不同(碳链异构),是同分异构体。
正确选项为:(1)B (2)A (3)C (4)E (5)D例4.如果定义有机物的同系列是一系列结构简式符合: (其中n=0、1、2、3……)的化合物。
式中A、B是任意一种基团(或氢原子),w为2价的有机基团,又称为该同系列的系差。
同系列化合物的性质往往呈现规律性变化。
下列四组化合物中,不可称为同系列的是:A.CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3B.CH3CH=CHCHO CH3CH=CHCH=CHCHO CH3(CH=CH)3CHOC.CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH2CHClCH3D.ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3解析:此题是95年全国高考题,也是一个信息题,信息中给出了一个新的概念同系列。
在课堂上我们学习过同系物这一概念。
这就形成了两个非常相近的概念,需要我们在理解新信息的基础上,进行对比、辨析,然后运用解题。
同系物是指结构相似,在分子组成上相差一个或若干个CH2原子团的物质。
而同系列是指结构相似,在结构上相差一个或若干个重复结构单元的物质。
据此可迅速作出判断,正确选项为C。
练习:1.在热核反应中没有中子辐射,作为能源时不会污染环境。
月球上的储量足够人类使用1000年,地球上含量很少。
和两者互为()A.同素异形体B.同位素C.同系物D.同分异构体解析:和的质子数相同,中子数不同,二都均为原子,互为同位素。
答案: B2.美国和墨西哥研究人员将普通纳米银微粒分散到纳米泡沫碳(碳的第五种单质形态)中,得到不同形状的纳米银微粒,该纳米银微粒能有效杀死艾滋病病毒(HIV-1)。
纳米泡沫碳与金刚石的关系是学科网A.同素异形体 B.同分异构体 C.同系物 D.同位素学科网解析:因纳米泡沫碳是碳的第五种单质形态,而金刚石也是碳的一种单质同体,所以二者是由同种元素形成的结构不同的单质,故为同素异形体。
答案:A3.下列各对物质中属于同分异构体的是()。
A.C与 CB.O2与O3解析:A是同位素,B是同素异形体,C是同一物质,D是同分异构体。
答案:D4.下列各组物质中,互为同系物的是()。
A. —OH与—CH3B. HCOOCH3与CH3COOC3H7C. —CH=CH2与CH3—CH=CH2D. C6H5OH与C6H5CH2OH解析:A项二者相差一个氧原子,不是同系物。
B项均为酯,结构相似,又分子组成上相差一个CH2原子团,属于同系物。
C项不是同一类别的有机物,结构不相似,不是同系物。
D项的C6H5OH 是苯酚,C6H5CH2OH是苯甲醇,不是同一类别的,结构不相似,不是同系物。
