铁的氢氧化物
铁的氢氧化物 铁盐和亚铁盐

自主学习·必备知识
互动探究·关键能力
评价检测·素养提升
互动探究·关键能力
探究点一 氢氧化亚铁的制备
情境探究 Fe(OH)2具有强的还原性,极易被空气中的氧气氧化为Fe(OH)3,因此实验室在 制备Fe(OH)2时,要注意隔绝空气。常采取以下方法:
自主学习·必备知识
互动探究·关键能力
评价检测·素养提升
自主学习·必备知识
互动探究·关键能力
评价检测·素养提升
判一判 1.FeSO4溶液在空气中长久放置后显棕黄色 ( √ ) 2.向FeCl3溶液中滴加KSCN溶液后产生红色沉淀( ✕ ) 3.用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2 ( ✕ ) 4.既可通过复分解反应,又可通过化合反应生成Fe(OH)3( √ )
互动探究·关键能力
评价检测·素养提升
1.Fe3+和Fe2+的检验
Fe3+
Fe2+
实验操作
实验现象 离子方程式 结论
溶液变成③ 红 色
无明显现象
Fe3++3SCN- Fe(SCN)3
—
Fe3+遇SCN-显红色,可利用此现象检验Fe3+ Fe2+和SCN-不反应
的存在
自主学习·必备知识
2.Fe3+和Fe2+的转化
自主学习·必备知识
互动探究·关键能力
评价检测·素养提升
2.防止Fe(OH)2氧化的方法 (1)将配制溶液的蒸馏水煮沸。 (2)将盛有NaOH溶液的胶头滴管尖端插入盛有亚铁盐溶液的试管底部,并慢 慢挤出NaOH溶液。 (3)在亚铁盐溶液中充入保护气,如H2、N2、稀有气体等。 (4)在亚铁盐溶液上面加保护层,如苯、植物油等。
高中化学优质课铁的氢氧化物

——知识来源:顾翼东 主编.化学词典.上海: 上海辞书出版社.1989.第637页.
制备氢氧化铁和氢氧化亚铁
每小组 • 2位同学选择试剂分别制备氢氧化铁和氢氧化亚铁 • 2位同学在“智叟”搜索相关特征信息并记录
纯净 【交流讨论】你们制得了
的氢氧化铁和氢氧化亚铁吗?
文献法查找氢氧化亚铁变色的原因
• 根据给定的多篇文献,通过分组讨论探究 氢氧化亚铁变色原因,并提取出相应的观 点,探讨证明的方法。
p770《无机化学》下册 第四版 (北京师范大学 华中师范大学 南京师范大学 无机化学教研室 编) (1981年12月第一版 2003年1月第4版 铁的氧化物的多种价态 【推测】铁的氢氧化物的价态、种类 【搜索】通过智叟搜索铁的氢氧化物的性质
【资料1】氢氧化铁iron hydroxide
• 教师是课程的设计师、引导者和协作者, 可以给予学生适度的帮助
• 互联网+新信息技术设备+新的教育理念
铁的氢氧化物
• 氢氧化亚铁 Fe(OH)2 白 色 灰绿色
• 氢氧化铁 Fe(OH)3 红褐色
难点:
① Fe(OH)2的白色很难观察到 ② 灰绿色的物质是什么?
高一上化学铁的氢氧化物与铁盐(精讲)(解析版)
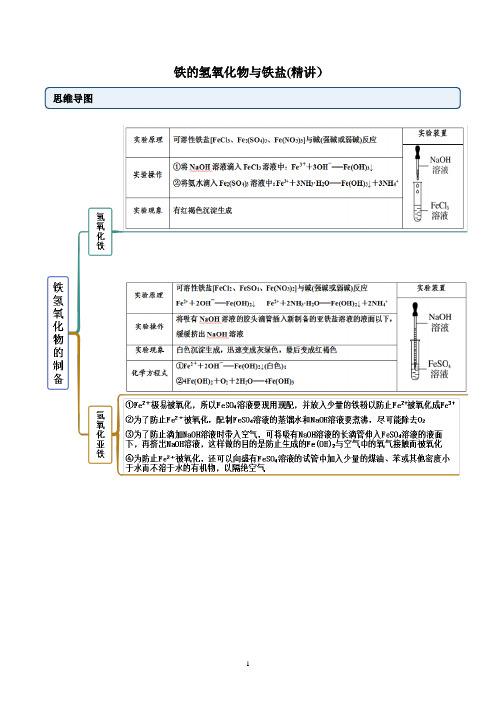
铁的氢氧化物与铁盐(精讲)思维导图常见考点考点一铁的氢氧化物【例1】有关铁的氢氧化物的说法中,错误的是A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化转变为红褐色固体B.Fe(OH)2具有还原性,在空气中易被氧化为Fe(OH)3C.Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解D.Fe(OH)3胶体呈红褐色、透明,能产生丁达尔现象【答案】A【解析】A.Fe(OH)2是一种白色固体,不稳定,在空气中易被氧化转变为红褐色固体Fe(OH)3:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故A错误;B.Fe(OH)2具有还原性,在空气中易被氧化为Fe(OH)3,故B正确;C.Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解为相应的氧化物和水,故C正确;D.Fe(OH)3胶体呈红褐色、透明,能产生丁达尔现象,故D正确;故选A。
【例1-2】(2022·山西太原·高一期末)在实验室里用以下方法制备并较长时间保存Fe(OH)2,能成功的是A.B.C.D.【答案】C【解析】A.NaOH溶液加入时会带入氧气,会氧化氢氧化亚铁变为氢氧化铁,不能成功得到氢氧化亚铁,故A不符合题意;B.氯化铁和氢氧化钠溶液反应生成氢氧化铁沉淀,不能得到氢氧化亚铁沉淀,故B不符合题意;C.装置是利用铁和稀硫酸现制FeSO4,并用产生的H2赶走试管和溶液中的氧气,故C符合题意;D.氯化亚铁和氢氧化钠溶液反应生成氢氧化亚铁沉淀,胶头滴管伸入到液面以下,暂时隔绝氧气,但是不能较长时间保存Fe(OH)2,故D不符合题意。
综上所述,答案为C。
【一隅三反】Fe(OH)沉淀,下列说法不正确的是1.(2022·河北邯郸·高一期末)用如图装置可以制备2A.该实验应该先打开C,一段时间后再关闭CB.实验完成时,在A容器中得到白色沉淀FeSO溶液中,最终得到红褐色沉淀C.如果将NaOH溶液直接滴入4D.本实验制备的氢氧化亚铁可以相对较长时间保持白色状态【答案】B【解析】铁和稀硫酸反应生成硫酸亚铁和氢气,生成的氢气排出装置内的空气,关闭止水夹后,利用产生气体的压强将生成的硫酸亚铁压入到B容器中生成白色沉淀。
铁的氢氧化物有两种FeOH

这是因为白色的氢氧化亚铁被空 气中的氧气氧化成了红褐色的氢 氧化铁。反应的化学方程式分别 为:
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4 4Fe(OH)2+O2+2H2O=4Fe(OH)3
思考与交流
既然Fe(OH)2 容易被空气中的氧气氧化,那么 在制备Fe(OH)2时应采取哪些措施防止其被 氧化?
(2)将溶解亚铁盐的蒸馏水煮沸(除去溶解的氧气);
A、在亚铁盐溶液液面上加隔氧剂(如加 入苯等密度比水小,而又不溶于水的有机溶
剂).装置如下图所示.
由于苯的液封作用,防止了生成的
Fe(OH)2被氧化,因而可较长时间观察到白 色Fe(OH)2沉淀.
B、特殊装置
• 思考:如何操作止水 夹,才能得Fe(OH)2沉 淀,并保存较长时间?
当堂训练:
1.将下列四种化合物溶于稀盐酸,滴
加硫氰化钾溶液没有颜色变化的是:
(A )
A.FeS C.FeCl3
B.Fe2O3 D.Fe2(SO4)3
当堂训练
• 2、判断下列说法正确与否。
(1)铁元素有+2、+3价,故铁的氧化物
只有FeO和Fe2O3两种.
( ×)
(2)铁的氧化物都为黑色固体. ( × )
(3)向FeCl3溶液中加入KSCN溶液,溶液 立刻变成血红色,而非沉淀. ( √ )
(5)FeO在空气中易被氧化为Fe2O3. ( × )
当堂训练:
• 3、除去下列物质中所含的杂质(括号内为杂质),将选 用的试剂和分离方法填在题后的横线上,并写出有关反 应的离子方程式.
• (1)Fe2O3[Fe(OH)3]_加__热_.2_F_e_(O_H_)_3 _==_=_F_e2_O_3_+_3_H_2O_; • (2)Fe2O3(Al2O3)_加2_O_入H_过-_=量_=_=的2_NA_al_OO_2H-+_溶_H液_2O_,_过_滤__._A_l2_O_3;+
考点梳理:铁的氧化物与氢氧化物

转 解析
变式训练
【变式】能正确表示下列反应的离子方程式是( D ) 。
A.浓盐酸与铁屑反应:2Fe+6H+===2Fe3++3H2↑
B.钠与 CuSO4 溶液反应:2Na+Cu2+===Cu↓+2Na+
C.NaHCO3 溶液与稀 H2SO4 反应:CO23—+2H+===H2O+CO2↑
D . 向 FeCl3 溶 液 中 加 入 Mg(OH)2 : 3Mg(OH)2 + 2Fe3 +
===2Fe(OH)3+3Mg2+
转 解析
分析产物、拆分及反应原理是否正确等
【思维启迪】把Na加入到CuSO4溶液中看到的现象?其 反应实质是什么?NaHCO3的拆分是否正确?
真题演练
【真题】 (2014·山东理综,9)等质量的下列物质与足量
+3
+2,+3
稳定性
不稳定
稳定
稳定
与H+反应的 FeO+2H+=== 离子方程式 Fe2++H2O
Fe2O3+6H+=== 2Fe3++3H2O
Fe3O4+8H+ === Fe2++ 2Fe3++4H2O
2. 铁的氢氧化物
色态
Fe(OH)2 白色 固体
Fe(OH)3 红褐色 固体
与盐酸反 Fe(OH)2+2H+
铁的氧化物与氢 氧化物
考点强化: 铁的氧化物与氢氧化物
➢ 1.考点精讲 ➢ 2.典例剖析 ➢ 3.变式训练 ➢ 4.真题演练
考点精讲
1.铁的氧化物
化学式 俗名
颜色状态
FeO 黑色 粉末
Fe2O3 铁红
红棕色粉末
Fe3O4 磁性氧化铁
黑色晶体 (有磁性)
溶解性
难溶于水
【知识解析】铁、铁的氧化物和铁的氢氧化物
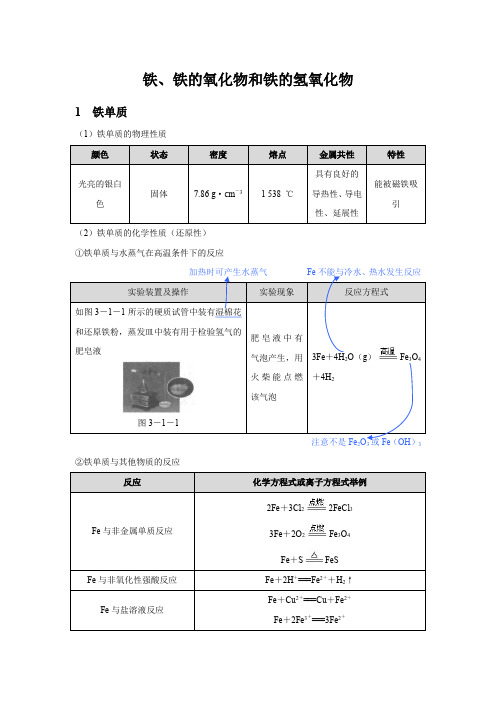
铁、铁的氧化物和铁的氢氧化物1 铁单质(1)铁单质的物理性质(2)铁单质的化学性质(还原性)①铁单质与水蒸气在高温条件下的反应如图3-1-1所示的硬质试管中装有湿棉花和还原铁粉,蒸发皿中装有用于检验氢气的肥皂液图3-1-13Fe+4H2O(g)Fe3O4+4H2②铁单质与其他物质的反应2Fe+3Cl22FeCl33Fe+2O2Fe3O4Fe+S FeS教材延伸(1反应生成Fe 3O 4和H 2CO 和H 2。
(2)从铁与Cl 2、O 2、S 的反应中铁元素化合价的变化情况可以比较Cl 2、O 2、S 的氧化性强弱,即氧化性:Cl 2>O 2>S 。
2 铁的氧化物(1)铁的常见氧化物的性质及用途名师提醒(1)FeO 不稳定,在空气里受热,能迅速被氧化成Fe 3O 4。
(2)“朱门酒肉臭”中的“朱门”是指以Fe 2O 3为原料制备的油漆漆制的门。
(3)Fe 3O 4有固定的组成,属于纯净物,不是混合物。
Fe 3O 4可看成FeO ·Fe 2O 3,所以在书写其与硝酸的反应方程式时可看成硝酸将其中的二价铁氧化成三价铁。
(4)在高温条件下,Fe 与Fe 2O 3可以发生反应,当铁足量时发生反应Fe +Fe 2O 33FeO ,当铁不足时发生反应Fe+4Fe2O33Fe3O4。
(2)铝热反应【实验操作】①把两张圆形滤纸分别折叠成漏斗状套在一起,使四周都是四层。
把内层“纸漏斗”取出,在底部剪一个小孔,用水润湿,再与另一“纸漏斗”套在一起,架在铁架台的铁圈上,干燥使反应完全②把5 g炒干的三氧化二铁粉末和2 g铝粉混合均匀,放在“纸漏斗”中,在混合物上面加③用燃着的木条点燃镁条,观察现象。
【实验记录】热,火星四射;③“纸漏斗”Al与Fe2O3反应,置换出铁,反应方程式为2Al +Fe2O3Al2O3+2Fe教材延伸铝热反应3 铁的氢氧化物(1)Fe (OH )2与Fe (OH )3的性质比较不稳定[比Fe (OH )2稳定],受热易分解,2Fe (OH )3Fe 2O 3+3H 2O(2)Fe (OH )2在空气中转化为Fe (OH )3Fe (OH )2中铁元素的化合价为+2,具有还原性。
考点15铁的氢氧化物-

考点15 铁的氢氧化物【知识梳理】一、铁的氢氧化物化学式Fe(OH)2Fe(OH)3色态白色固体红褐色固体溶解性难溶于水难溶于水与盐酸反应Fe(OH)2+2H+=== Fe2++2H2O Fe(OH)3+3H+=== Fe3++3H2O受热分解—2Fe(OH)3=====△Fe2O3+3H2O制法可溶性亚铁盐与碱反应:Fe2++2OH-===Fe(OH)2↓可溶性铁盐与碱反应:Fe3++3OH-=== Fe(OH)3↓二者的关系空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3二、Fe(OH)2的制备(1)有机覆盖层法将吸有NaOH溶液的胶头滴管插到液面以下,并在液面上覆盖一层苯或煤油(不能用CCl4),以防止空气与Fe(OH)2接触发生反应,如图1所示。
(2)还原性气体保护法用H2将装置内的空气排尽后,再将亚铁盐与NaOH溶液混合,这样可长时间观察到白色沉淀,如图2所示。
(3)电解法用铁作阳极,电解NaCl(或NaOH)溶液,并在液面上覆盖一层苯(或煤油),如图3所示。
【核心归纳】1.FeO和Fe3O4与HNO3反应时,除考虑与H+的反应外,还考虑Fe2+被HNO3氧化成Fe3+。
2.Fe2O3、Fe3O4、Fe(OH)3与HI反应时,除考虑与H+的反应外,还考虑Fe3+被I-还原为Fe2+。
【对点例题】例1.(2023·河南河南·高一阶段练习)下列各图示中能较长时间看到Fe(OH)2白色沉淀的是()A.①②③B.①②④C.①②③④D.②③④【答案】B【解析】Fe(OH)2在空气中很容易被氧化为红褐色的Fe(OH)3,发生4Fe(OH)2+O2+2H2O = 4Fe(OH)3。
要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。
①、②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2 处在氢气的保护中;③无法避免氧气与氢氧化亚铁的反应;④中液面加苯阻止了空气进入,能较长时间看到白色沉淀,选B。
铁的单质、氧化物、氢氧化物课件2022--2023学年高一上学期化学人教版(2019)必修第一册

_黑__色___晶体
都__不____溶于水,也___不___与水发生反应
常用作油漆、涂料、油 具有磁性,是一种常 —
墨和橡胶的红色颜料 用的磁性材料
(2)化学性质 ①稳定性:FeO不稳定,在空气里受热,能迅速被氧化成________。
碱性 ②与酸反应:FeO和Fe2O3是______氧化物,与盐酸反应的离子方程式分别为 ________________________,___________________________。
FeO+2H+===Fe2++H2O
Fe2O3+6H+===2Fe3++3H2O
Fe3O4
2.铁的氢氧化物 (1)制备
制备Fe(OH)2
制备Fe(OH)3
操作
现象
生成白色絮状沉淀,迅速变为__灰__绿__ 色,最终变为__红__褐__色
生成__红__褐__色沉淀ห้องสมุดไป่ตู้
有关反应 Fe2++2OH-=== Fe(OH)2↓,
名称 化学式 铁元素的化合价
氧化亚铁 __F_eO___ +2价
氧化铁 ___F_e2_O_3 __
+3价
四氧化三铁 __F_e_3O_4 __
+2价、+3价
名称 俗名 色、态 溶解性 用途
氧化亚铁 —
氧化铁 __铁_红___
四氧化三铁 ___磁_性__氧_化_铁____
黑色粉末
_红_棕__色____粉末
第三章 铁—金属材料
第一节铁及其化合物
第一课时铁的单质、氧 化物、氢氧化物
目录 CONTENT
一、铁的单质 二、铁的氧化物
三、铁的氢氧化物
课前导入
一、铁的单质
自然界中铁的存在形式
铁、铁的氧化物和铁的氢氧化物-PPT课件

第1节 铁的多样性
第2课时 铁、铁的氧化物和铁的氢氧化物
---
1.根据生产、生活中的应用实例或通过实验探究,能从宏观和微 观相结合的视角认识铁及其氧化物的主要性质。
探究1
探究2
素养脉络
随堂检测
铁的氧化物、氢氧化物的性质 问题探究 在学习铁及其化合物的性质时,同学们做了以下两个实验。已知 苯是一种不溶于水的有机溶剂,密度比水的小。
探究1
探究2
素养脉络
随堂检测
(1)图甲实验中生成的产物是Fe3O4,可以写成FeO·Fe2O3的形式, 那么Fe3O4是混合物吗?
探究1
探究2
素养脉络
随堂检测
知识归纳 (1)常温下,Fe与H2O不反应。但在水、空气中的O2等的共同作 用下,Fe却很容易被腐蚀。铁不能与热水反应,但在高温下,Fe能
与 H2O(g)反应 3Fe+4H2O(g) Fe3O4+4H2。
(2)铁单质中铁元素的化合价为0价,铁单质具有还原性,能与具有 氧化性的物质发生反应。
FeO
俗名
—
颜色、状态 黑色粉末
水溶性
难溶
铁元素 化合价
+2 价
与稀盐酸或稀
硫酸反应(写离 子方程式)
FeO+2H+ Fe2++H2O
Fe2O3 铁红 红棕色粉末 难溶
+3 价
Fe3O4 磁性氧化铁 黑色晶体 难溶
+2、+3 价
铁的氢氧化物及其盐

铁的氢氧化物及其盐(一)铁的氢氧化物化学式 Fe(OH)2 Fe(OH)3 色态 白色固体 红褐色固体 溶解性 难溶于水难溶于水与盐酸 反应 Fe(OH)2+2H +===Fe 2++2H 2OFe(OH)3+3H +===Fe 3++3H 2O受热 分解 —2Fe(OH)3=====△Fe 2O 3+3H 2O制法 可溶性亚铁盐与强碱溶液反应:Fe 2++2OH -===Fe(OH)2↓可溶性铁盐与强碱溶液反应:Fe 3++3OH -===Fe(OH)3↓[注意] ①空气中,Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3,现象是白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式为4Fe(OH)2+O 2+2H 2O===4Fe(OH)3。
①制备Fe(OH)2时要避开O 2的环境。
(二)亚铁盐和铁盐 1.亚铁盐 (1)氧化性与还原性含有Fe 2+的溶液呈浅绿色,Fe 2+既有氧化性,又有还原性,Fe 2+与Zn 、Cl 2反应的离子方程式分别为Fe 2++Zn===Fe +Zn 2+、2Fe 2++Cl 2===2Fe 3++2Cl -。
(2)可水解 保存或配制FeSO 4时常加入少量H 2SO 4的理由是(写离子方程式)Fe 2++2H 2OFe(OH)2+2H +。
2.铁盐 (1)氧化性 含有Fe 3+的溶液呈棕黄色,Fe 3+具有氧化性,Fe 3+与Fe 、Cu 反应的离子方程式分别为2Fe 3++Fe===3Fe 2+、2Fe 3++Cu===2Fe 2++Cu 2+。
(2)特性含有Fe 3+的盐溶液遇到KSCN 时变成红色。
(3)可水解①利用Fe 3+易水解的性质,实验室可将FeCl 3饱和溶液滴入沸水中制取氢氧化铁胶体,反应的化学方程式:FeCl 3+3H 2O=====△Fe(OH)3(胶体)+3HCl 。
②利用Fe 3+易水解的性质,工业上常用调节pH 方法除去溶液中的铁离子。
铁的氢氧化物

Fe(OH)3+3HCl=FeCl3+3H2O
Fe(OH)2+3HCl=FeCl3+3H2O 氢氧化铁的加热: 2Fe(OH)3=Fe2O3+H2O
习
题
某溶液中可能存在Mg2+、Fe2+、Fe3+,加 入NaOH溶液,开始时有白色絮状沉淀生 成,白色沉淀迅速变成灰绿色,最后变成 红褐色,下列结论正确的是( D )
A、一定有Fe2+,一定没有Fe3+、Mg2+
B、一定有Fe3+存在,可能没有Fe2+、Mg2+ C、一定有Fe3+,可能有Fe2+,一定没有Mg2+ D、一定有Fe2+,可能有Mg2+,一定没有Fe3+
FeSO4溶液
然后滴入FeSO4 溶液,振荡。 白色 灰绿色 红褐色
(白色)
Fe2++2OH-=Fe(OH)2
NaOH溶液
4Fe(OH)2+O2+2H2O=4Fe(OH)3
实验现象分析:
氢氧化亚铁制备实验改进方案
方案一:
氢氧化亚铁制备实验改进方案
方案二:
铁的氢氧化物与酸的反应离子方程式:
§3.2几种重要的金属化合物
铁的氢氧化物
主讲人:岑灵
【学习目标】
能用化学方程式和离子方程式表示铁的氢
氧化物的制备和转化
一、氢氧化铁的制备 在试管中加入少量FeCl3溶液,然后滴入
NaOH溶液。
FeCl3+3NaOH=Fe(OH)3 +3NaCl
Fe3++3OH-=Fe(OH)3
பைடு நூலகம்
铁的单质、氧化物、氢氧化物课件

与酸 __F_e_(O__H_)2_+__2_H_+__=_=_=_Fe_2_+_+__2_H__2O____ F_e_(_O_H_)_3_+__3_H_+_=_=_=_F_e_3_+_+__3_H_2_O__ 反应
铁及其氧化物的性质
材料一:铁陨石在化学成分上除Ni和Fe外,还含有Co、S、P、Cu、Cr、 Ga、Ge和Ir等元素。有少数铁陨石还含有硅酸盐包体。铁陨石与地球岩 石十分相似,所以一般很难鉴别。 材料二:从上世纪70年代开始,珍品陨石的价格就已经与黄金相差无几 。 陨石最终的价值高低,要综合陨石的材质、结构、纹理等一起来评 定,稀有陨石则可达到每克万元以上。
方法二中湿棉花的作用 ________提__供__反__应__所__需__水__蒸__气__________________
掌握铁的氧化物的性质 1.阿尔法磁谱仪又译为反物质太空磁谱仪,我国科学家为磁谱仪倾注 了大量心血,磁谱仪已随航天飞船升入太空,开始了探索宇宙中是否存 在“反物质”的研究工作。根据你所学的知识推测用于制造阿尔法磁谱 仪的核心部件的材料是FeO、Fe2O3、Fe3O4中的哪一种?
氢氧化亚铁的制备
【注意】(1)氢氧化亚铁制备时所用水如不煮沸,其中会有氧气,制得的 氢氧化亚铁易被氧化; (2)制得的氢氧化亚铁不能接触氧气等具有氧化性的物质,否则会被氧化 变为红褐色。
随堂训练
有人设计出一种在隔绝空气条件下钠与FeSO4溶液反应的方法以验证反应 实质。实验时,往100mL的大试管中先加40mL煤油,取3粒米粒大小的金 属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液 面至橡胶塞,并夹紧弹簧夹(如图)。仔细观察,回答下列问题:
氢氧化亚铁的制备
制备Fe(OH)2时防氧化措施 (1)将配制溶液的蒸馏水煮沸,驱除溶液中的氧气。 (2)将盛有NaOH溶液的胶头滴管尖端插入试管的亚铁盐溶液底部,并慢慢 挤出NaOH溶液。 (3)在亚铁盐溶液上面充入保护气,如H2、N2、稀有气体等。 (4)在亚铁盐溶液上面加保护层,如苯、植物油等。
铁的氢氧化物

反应的离子方程式:
2Fe(OH)3===Fe2O3+H2O
性质: Fe(OH)3具有不稳定性
小结
1、铁的氢氧化物的制备: Fe(OH)3、 Fe(OH)2 2、铁的氢氧化物的化学性质:和酸反应以及 Fe(OH)3的加热
课后思考
既然 Fe(OH)2 在空气中容易被氧化,因此 在制备的时候看到Fe(OH)2 的时间很短, 那如果我们想要较长时间的观察到它,可 以采取什么措施呢?
Fe2++2OH-=Fe(OH)2↓ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
学与问
1、Fe(OH)2 和Fe(OH)3都能与酸反应,你 能写出它们分别与酸反应的离子方程式吗?
Fe(OH)3+3H+=O
性质:都具有碱性
2、加热Fe(OH)3时,它会有什么现象呢?
实验3-9
观察并描述现象
实验现象
FeCl3溶液 加NaOH溶液
立即有红褐色 沉淀生成
FeSO4溶液
生成的白色絮状沉 淀迅速变成灰绿色, 最后变为红褐色
思考:为什么在FeSO4溶液中加入NaOH溶液时会出现这
种现象?
反应的离子方程式
Fe3++3OH-=Fe(OH)3↓
白色的Fe(OH)2被 空气中的氧气氧 化成了红褐色的 Fe(OH)3
铁的氢氧化物

实验室制备
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各 滴入NaOH溶液。观察并描述发生的现象。
NaOH溶液
NaOH溶液
FeCl3溶液 制备氢氧化铁
FeSO4溶液 制备氢氧化亚铁
NaOH溶液
实 验 室 制 备 Fe(OH)3
FeCl3溶液
现象:产生红褐色沉淀。
FeCl3+3NaOH=Fe(OH)3↓+3NaCl Fe3++3OH-=Fe(OH)3↓ (红褐色沉淀)
夹之前的实验步骤是 检验试管B出口处排出的氢气的纯度,当 。 排出的H2 纯净时,再夹紧止水夹。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由
是
试管A中反应生成的H2充满了试管A和试管B,。且外
界空气不容易进入。
Fe(OH)2、 Fe(OH)3 小结
FeCl3溶液
FeSO4溶液
加入NaOH 溶液现象
与酸反应 用途
FeO+2HCl ===FeCl2 + H2O
Fe2O3+6HCl ===2FeCl3+3H2O
油漆、涂料及
—
炼铁原料
Fe3O4+8HCl ===2FeCl3+ FeCl2+4H2O
制磁铁及 炼铁原料
03 铁的氢氧化物
1.实验室制备 2.制备氢氧化亚铁实验装置的改进 3.氢氧化亚铁和氢氧化铁性质比较
第三章 铁 金属材料
3.1铁及其化合物(二)
——铁的氢氧化物
铁的单质回顾
铁的单质小结
与非金属反应
与足量的 与足量的
Cl2 等强氧化剂反应被氧化为+3 价 S、I2 等弱氧化剂反应被氧化为+2 价
铁 与非氧化性酸反应(如稀硫酸、盐酸)被氧化为+2 价 与盐溶液反应,如 Fe+Cu2+===Fe2++Cu
