最新精细1111第四组乙酰苯胺的合成
有机化学实验-实验4 乙酰苯胺的制备

【注意事项】
1. 装置要严密,先小火微回流, 然后逐渐升温至 105℃, 蒸出大部分水和 剩余的乙酸,温度下降表明反应结束,停火。
2. 保证反应时间 1 h 左右。 3. 彻底冷却后再抽滤,尽量减少水的用量,以减少产品的损失。
实验仪器与药品
分馏柱(三种)、蒸馏烧瓶、接液管、直形冷凝管、铁架台、铁架、待分馏液体、 温度计、电热套和烧瓶。
实验步骤
(1) 分馏装置的安装。 (2) 加料,液体体积不超过烧瓶容量的二分之一,同时加入几粒沸石。 (3) 加热,根据液体的沸点选择合适的热浴加热,浴温缓慢而均匀的上升。控
制浴温使蒸汽环缓慢而均匀的上升,调节流出液体的速度为 2-3 秒钟一滴。 (4) 分段收集镏分,并称量各段镏分的质量。
2. 向反应瓶中加入 5 mL 新蒸的苯胺、7.4 mL 冰醋酸和少量锌粉(0.1 g), 摇匀。
3. 开始加热,保持反应液微沸约 10 min , 然后逐渐升温,维持在 100~105 ℃。 反应 30 min 后可适当升温至 110 ℃,蒸出大部分水和剩余的乙酸,温度出现波 动时,可认为反应结束。
2. 在过滤溶液中大颗粒干燥剂时,可以在漏斗颈部放入少量的棉花或者玻 璃毛代替滤纸。如果溶液中的颗粒细小或者颗粒具有粘性,应该使溶液静止,先 过滤上部澄清液,最后把沉淀转移到滤纸上,其目的是加快过滤速度。
减压过滤(抽气过滤)
优点:过滤和洗涤速度快,固液分离完全,滤出的固体容易干燥。
实验仪器与药品
抽滤瓶、布氏漏斗、滤纸、剪刀、橡皮塞、玻璃塞、烧杯、真空泵、缓冲瓶、固 液混合物。
【课堂提问内容】
乙酰苯胺的合成

乙酰苯胺的合成一、教学要求:1、学习乙酰苯胺的原理、方法和作用。
2、学习分馏操作的原理和技术。
3、熟悉重结晶的操作技术。
4、掌握产物的分离提纯原理和方法5、练习产品熔点的测定方法6、熟悉减压抽滤、洗涤等基本操作二、预习内容:1、分馏操作的原理和技术2、电热套的正确使用3、重结晶4、熔点的测定5、减压抽滤三、基本操作:四、实验原理:胺的酰化在有机合成中有着重要的作用。
作为一种保护措施,一级和二级芳胺在合成中通常被转化为它们的乙酰基衍生物以降低胺对氧化降解的敏感性,使其不被反应试剂破坏;同时氨基酰化后降低了氨基在亲电取代反应(特别是卤化)中的活化能力,使其由很强的第Ⅰ类定位基变为中等强度的第Ⅰ类定位基,使反应由多元取代变为有用的一元取代,由于乙酰基的空间位阻,往往选择性的生成对位取代物。
用冰醋酸为酰化剂制备乙酰苯胺。
芳胺可用酰氯、酸酐或与冰醋酸加热来进行酰化,使用冰醋酸试剂易得,价格便宜,但需要较长的反应时间,适合于规模较大的制备。
酸酐一般来说是比酰氯更好的酰化试剂。
用游离胺与纯乙酸酐进行酰化时,常伴有二乙酰胺[ArN(COCH3)2]副产物的生成。
但如果在醋酸-醋酸钠的缓冲溶液中进行酰化,由于酸酐的水解速度比酰化速度慢得多,可以得到高纯度的产物。
但这一方法不适合于硝基苯和其它碱性很弱的芳胺的酰化。
表乙酰苯胺物理参数五、实验步骤:在50ml圆底烧瓶中加入5ml新蒸馏的C6H5NH2(0.05mol)、7.5mlCH3COOH(0.1mol)及少许锌粉(约0.1g)(思考题1,2)。
依次安装分馏柱、蒸馏头、温度计、接液管,接液管伸入10ml 小量筒内,收集蒸出的水和乙酸。
用电热套将溶液缓慢加热,使反应物保持微沸约15min。
然后逐渐升高温度,保持温度计读数在105℃左右(思考题3),约经过45min,反应生成的水及部分醋酸可蒸出(约4ml)。
当温度计的读数下降时,反应即达终点,停止加热。
在不断搅拌下,将反应物趁热慢慢倒入盛有100ml冷水的烧杯中(思考题4),继续搅拌,充分冷却,使粗乙酰苯胺成细粒状完全析出。
乙酰苯胺的合成

乙酰苯胺的合成班级:生工111班姓名:穆旭学号:1108110352一、试验目的:1、了解以苯胺、醋酸为原料制备乙酰苯胺的原理和方法。
2、掌握重结晶提纯产品的基本原理和操作方法。
二、反应原理:主反应:CH3COOH+C6H5NH2→CH3CONHC6H5+H2O副反应:CH3COOH+C6H5NH2→CH3CO ONH3C6H5伯、仲胺可与酰卤、酸酐或羧酸作用,生成酰胺,该反应称为胺的酰基化反应。
在实际操作中,通常是将羧酸与胺按一定比例混合后加热即可。
在反应时,胺与羧酸作用先生成铵盐,在加热条件下胺的羧酸盐脱水生成酰胺。
本实验采用苯胺与冰醋酸加热回流反应以制取乙酰苯胺。
三、主要药品:苯胺(d=1.022) 5.1g 5ml (0.055mol)冰醋酸7.8g 7.4ml (0.13mol)活性炭四、试验步骤:1、苯胺的蒸馏苯胺极易氧化,在空气中放置会变成红色,使用前必须重新蒸馏除去其中的杂质。
由于苯胺有毒性,因此必须在通风橱中蒸馏,切忌接触皮肤。
2、乙酰苯胺的制备在50ml圆底烧瓶中,加入5ml新蒸的苯胺,7.4ml醋酸和1~2粒沸石。
装上一支短的Vigrux分馏柱,柱顶插一支150℃的温度计。
用一个小量筒收集醋酸溶液,装置图略。
将圆底烧瓶放在石棉网上用小火加热沸腾。
控制火焰使反应物保持持续逐渐升温,使柱顶温度在100~105℃左右。
约经1小时后,反应生成的水及过量的醋酸完全蒸出。
当温度计读数发生下降,或锥形瓶内出现白雾时,表示反应已达到终点,停止加热。
在搅拌下,趁热将反应物倒入100ml冷水中过滤、挤压,使乙酰苯胺呈颗粒状析出。
冷却后抽滤,并用5~10ml水洗涤粗产物以除去残留的酸液。
把粗产物放入60~100ml热水中(视产品量酌情加入水量),加热至沸腾。
如仍有大量的未溶解的油珠,应补加热水直至有少量油珠存在为止。
稍冷后加入少量活性炭,继续加热,并搅拌,煮沸1~2分钟,趁热用保温漏斗或预先预热好的布氏漏斗过滤。
乙酰苯胺的制备

整理台面
实验结束
清理水槽
关窗、关电
离开实验室
乙酰苯胺的制备
乙酰苯胺小常识
磺酰类 药物中 间体
稳定剂
染料中 间体
乙酰苯胺
青霉素G 的培养 基 橡胶硫 化促进 剂
乙酰苯胺的制备
基础化学实验中心 山东省省级实验教学示范中心
乙酰苯胺的制备
6.4 数据处理
乙酰苯胺的制备
7 思考题
1. 本实验采用哪些措施来提高乙酰苯胺的 产率? 2. 反应时,为什么要控制分馏柱上端的温
度在105℃左右?温度过高会有什么结果? 3. 常用的酰化试剂有哪些?苯胺乙酰化的
作用是什么?乙酰苯胺的制备来自乙酰苯胺的红外光谱乙酰苯胺的制备
备注
数据签字 清洗并归还仪器
乙酰苯胺的制备
3 实验装置
当反应的物质量 不是很多时,可 以省略掉
乙酰苯胺的制备
4 药品及物理常数
名称 分子 量 性状 熔点 (℃) 沸点 (℃) 密度 溶解度
水
1.02 16 3.6
乙 醇
∞
乙 醚
∞
苯胺
93.12
无色、刺 激性气味 的液体、 有毒 无色刺激 性液体 白色有光 泽鱼鳞状 晶体
-6.2
有机化学实验
基础化学实验中心 山东省省级实验教学示范中心
乙酰苯胺的制备
Preparation of acetanilide
乙酰苯胺的制备
1 2 3
实验目的 实验原理 实验装置 药品及物理常数 实验流程图 实验步骤 思考题
4 5
6 7
乙酰苯胺的制备
1 实验目的
1.了解酰化反应的原理和酰化剂的使用。 2. 巩固分馏的原理及实验操作。 3. 巩固重结晶的原理及操作方法。 4. 了解乙酰苯胺类化合物的用途。
乙酰苯胺的制备

乙酰苯胺的制备在有机化学实验中,乙酰苯胺的制备是一个经典且重要的实验。
乙酰苯胺是一种重要的有机合成中间体,广泛应用于染料、药物等领域。
下面,让我们一起来了解一下乙酰苯胺的制备过程。
一、实验目的通过实验,我们要掌握乙酰苯胺的制备原理和方法,熟悉重结晶的操作技术,学会使用分馏装置,并进一步巩固回流、过滤、干燥等基本实验操作。
二、实验原理乙酰苯胺的制备是通过苯胺与乙酸在加热的条件下发生酰化反应来实现的。
反应方程式如下:C₆H₅NH₂+ CH₃COOH → C₆H₅NHCOCH₃+ H₂O这个反应是一个可逆反应,为了提高乙酰苯胺的产率,我们需要采取一些措施。
一方面,我们可以增加反应物的浓度,比如使用过量的乙酸;另一方面,我们可以及时除去反应生成的水,促使反应向正方向进行。
在实验中,我们通过分馏装置来除去反应生成的水。
三、实验仪器与试剂1、仪器:圆底烧瓶、分馏柱、直形冷凝管、温度计、锥形瓶、布氏漏斗、抽滤瓶、电热套等。
2、试剂:苯胺、冰醋酸、锌粉、活性炭。
四、实验步骤1、苯胺的处理由于苯胺在空气中容易被氧化,所以在使用前需要进行处理。
将苯胺倒入圆底烧瓶中,加入几粒沸石,装上分馏装置,在石棉网上用小火加热进行蒸馏,收集 180 185℃的馏分。
2、乙酰苯胺的制备在装有回流冷凝管和温度计的 250 mL 圆底烧瓶中,加入新蒸馏过的苯胺 5 mL、冰醋酸 75 mL 以及少许锌粉。
锌粉的作用是防止苯胺在反应过程中被氧化。
然后,用小火加热回流 1 小时。
在加热过程中,要保持温度在 105℃左右,通过分馏柱不断地将生成的水蒸出。
反应结束后,将反应液趁热倒入盛有 100 mL 冷水的烧杯中,搅拌,使乙酰苯胺结晶析出。
3、抽滤、洗涤与干燥用布氏漏斗进行抽滤,收集乙酰苯胺晶体。
用少量冷水洗涤晶体,以除去残留的酸液。
将晶体转移到表面皿上,自然晾干或在红外灯下烘干,得到粗产品。
4、重结晶为了得到更纯净的乙酰苯胺,我们需要对粗产品进行重结晶。
乙酰苯胺的合成方法

乙酰苯胺的合成方法乙酰苯胺的合成方法1.1分馏法制备乙酰苯胺这种方法是利用分馏装置制备乙酰苯胺。
将反应物依次加入圆底烧瓶中,然后接上分馏柱,在柱口插入温度计,蒸出的水和醋酸用锥形瓶收集,在加热时,温度计读数维持在110℃,当反应结束后,趁热搅拌着将反应物倒入装有冷水的烧杯中,然后冷却静置抽滤,得到粗产品用水重结晶,最后用称量法计算干燥后产品的产率。
利用分馏法制备乙酰苯胺的产率为20.7%,其产率不高。
尽管装置中的分馏柱能够将生成的水从其中移去,但分馏柱不是根据特殊实验条件加工的,所以它不能绝对遵循实验意图,另外在反应体系中,由于高的反应温度,一般分馏柱在规定时间内很难分馏出正确比例的水和醋酸,这样致使反应物比例失调,使产率减少甚至实验失败。
在这个反应中,苯胺极易氧化,因此产品多为浅棕色和黄色并成块状,要不断的重结晶,这样使得乙酰苯胺产率减少。
苯胺是有毒化学品,在分馏过程中如果温度太高,过量的混合蒸汽没有液化挥发出来,能够对环境和人造成危害,而且未完全转化的苯胺很难回收。
1.2 回流法制备乙酰苯胺回流法是利用回流装置合成乙酰苯胺。
将反应物依次加入圆底烧瓶中,装上直型冷凝管,用小火加热回流,反应完成后,趁热搅拌着将反应物倒入装有水的烧杯中,冷却静置抽滤,重结晶,也能够将反应物趁热倒进冰水中,在其中冷却一定时间使的温度降低,从而提高乙酰苯胺产率。
这个反应利用苯胺与过量的冰醋酸回流合成乙酰苯胺,但它需较长时间回流,产量不高,并且产品成色不好。
在工业制备过程中,需对其加热6~8h以上。
还可以用适量的苯胺、乙酸酐、冰醋酸和少量的锌粉回流合成,另外苯胺、冰醋酸和乙酸酐可以一起回流制备乙酰苯胺。
这两种回流法都用乙酸酐作为酰化剂,它使得反应不易控制且成本较高。
利用回流法合成乙酰苯胺反应时间对产率的影响比较大,当反应时间为40,60,90min时,其平均产率分别为43%,63%,64%。
在反应中由于产物中水不能及时除去,从而影响了反应物的产率。
乙 酰 苯 胺 的 合 成
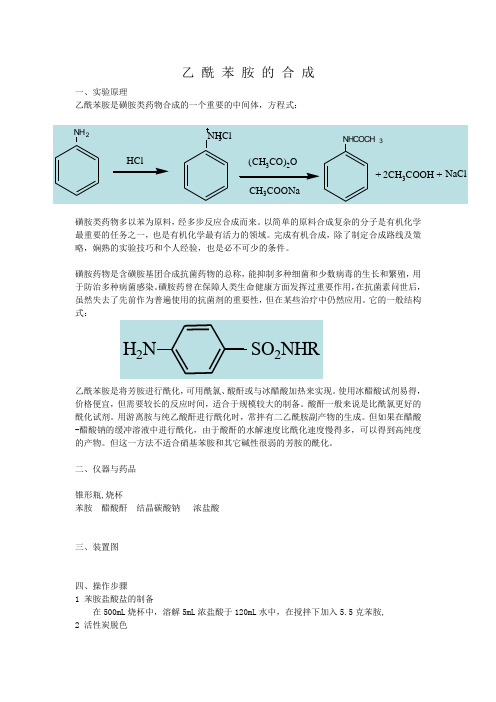
乙 酰 苯 胺 的 合 成一、实验原理乙酰苯胺是磺胺类药物合成的一个重要的中间体,方程式:磺胺类药物多以苯为原料,经多步反应合成而来。
以简单的原料合成复杂的分子是有机化学最重要的任务之一,也是有机化学最有活力的领域。
完成有机合成,除了制定合成路线及策略,娴熟的实验技巧和个人经验,也是必不可少的条件。
磺胺药物是含磺胺基团合成抗菌药物的总称,能抑制多种细菌和少数病毒的生长和繁殖,用于防治多种病菌感染。
磺胺药曾在保障人类生命健康方面发挥过重要作用,在抗菌素问世后,虽然失去了先前作为普遍使用的抗菌剂的重要性,但在某些治疗中仍然应用。
它的一般结构式:乙酰苯胺是将芳胺进行酰化,可用酰氯、酸酐或与冰醋酸加热来实现。
使用冰醋酸试剂易得,价格便宜,但需要较长的反应时间,适合于规模较大的制备。
酸酐一般来说是比酰氯更好的酰化试剂。
用游离胺与纯乙酸酐进行酰化时,常拌有二乙酰胺副产物的生成。
但如果在醋酸-醋酸钠的缓冲溶液中进行酰化,由于酸酐的水解速度比酰化速度慢得多,可以得到高纯度的产物。
但这一方法不适合硝基苯胺和其它碱性很弱的芳胺的酰化。
二、仪器与药品锥形瓶,烧杯苯胺 醋酸酐 结晶碳酸钠 浓盐酸三、装置图四、操作步骤1 苯胺盐酸盐的制备在500mL 烧杯中,溶解5mL 浓盐酸于120mL 水中,在搅拌下加入5.5克苯胺, 2 活性炭脱色待苯胺溶解后,再加入少量活性炭(约1克),将溶液煮沸5分钟,趁热滤去活性炭及其它不溶性杂质。
3 苯胺的酰化将滤液转移到500mL锥形瓶中,冷却至50℃,加入7.3mL醋酸酐,摇振使其溶解后,立即加入事先配制好的9克结晶醋酸钠溶于20mL水的溶液,充分摇振混合。
4 冷却结晶然后将混合物置于冰浴中冷却,使其析出结晶。
5 分离提纯减压过滤,用少量冷水洗涤,干燥后称重,产量约5-6克。
为保证纯度,再用水进行一次重结晶。
6 纯度检验熔点113-114℃。
乙酰苯胺的制备

乙酰苯胺的制备在化学实验和工业生产中,乙酰苯胺是一种常见且重要的有机化合物。
它不仅在医药领域有着广泛的应用,例如用于合成磺胺类药物,还在染料制造等行业中发挥着重要作用。
接下来,让我们一起深入了解乙酰苯胺的制备方法。
制备乙酰苯胺的原料通常为苯胺和乙酸酐。
苯胺是一种具有特殊气味的无色油状液体,而乙酸酐则是一种具有刺激性气味的无色透明液体。
首先,在反应容器中加入一定量的苯胺。
这里需要注意的是,苯胺具有毒性,操作时要在通风良好的环境中进行,并佩戴适当的防护装备,如手套和护目镜。
然后,缓慢地滴加乙酸酐。
滴加的速度要控制好,不能太快,否则可能会导致反应过于剧烈,甚至引发危险。
在滴加过程中,要不断搅拌溶液,以使反应物充分混合,提高反应的均匀性和效率。
反应过程中会释放出热量,这是一个放热反应。
为了控制反应温度,防止温度过高导致副反应的发生,通常会将反应容器置于冷水浴中进行冷却。
反应完成后,将反应混合物倒入大量的水中。
此时,乙酰苯胺会以固体的形式析出。
接下来进行过滤操作,以分离出固体的乙酰苯胺。
过滤得到的固体乙酰苯胺往往还含有一些杂质,需要进一步进行提纯。
常见的提纯方法是重结晶。
选择一种合适的溶剂,将乙酰苯胺溶解在其中,然后通过加热使溶液饱和。
接着慢慢冷却溶液,乙酰苯胺会再次结晶析出,而杂质则留在溶液中。
经过多次重结晶,可以得到纯度较高的乙酰苯胺。
在整个制备过程中,实验条件的控制至关重要。
例如,反应温度、反应物的比例、滴加速度等都会对反应的产率和产物的纯度产生影响。
反应温度过高,可能会导致副产物的生成,从而降低乙酰苯胺的产率和纯度;反应温度过低,则反应速度会变慢,影响生产效率。
反应物苯胺和乙酸酐的比例也需要严格控制。
如果苯胺的量过多,会导致乙酸酐反应不完全,造成原料的浪费;如果乙酸酐的量过多,不仅会增加成本,还可能会引入过多的杂质。
此外,滴加速度的快慢也会影响反应的进行。
滴加速度过快,容易使局部反应过于剧烈,产生不良影响;滴加速度过慢,则会延长反应时间,降低生产效率。
乙酰苯胺的制备实验报告

乙酰苯胺的制备实验报告实验目的,通过苯胺和乙酸酐的反应,制备乙酰苯胺,并通过结晶纯化得到纯品。
实验原理,乙酰苯胺是一种重要的有机合成中间体,其制备方法有多种途径,其中一种是通过苯胺和乙酸酐的酰胺化反应制备。
在这个反应中,苯胺和乙酸酐在酸性条件下发生酰胺化反应,生成乙酰苯胺。
然后通过结晶纯化,得到纯品。
实验步骤:1. 将苯胺溶解在稀盐酸中,使其变成盐酸盐。
2. 加入适量的乙酸酐,然后在恒温条件下搅拌反应。
3. 反应结束后,用碱性溶液中和盐酸,使得生成的乙酰苯胺析出。
4. 过滤析出物,用冷水洗涤,然后晾干,得到乙酰苯胺。
实验结果:通过上述步骤,我们成功制备了乙酰苯胺。
经过结晶纯化后,得到了白色结晶固体,纯度较高。
实验讨论:乙酰苯胺是一种重要的有机合成中间体,其制备方法简单,成本较低,适用于工业生产。
在本实验中,我们通过苯胺和乙酸酐的反应,制备了乙酰苯胺,并通过结晶纯化得到了纯品。
实验过程中需要注意控制反应条件,避免过量的乙酸酐使用,以免产生副产物。
此外,结晶纯化的过程中需要注意溶剂的选择和晶体的生长条件,以获得高纯度的产物。
结论:本实验成功制备了乙酰苯胺,并通过结晶纯化得到了纯品。
该实验为有机合成中间体的制备提供了一种简单有效的方法,具有一定的应用价值。
实验中遇到的问题及解决方法:在实验过程中,由于反应条件的控制不当,导致产物纯度不高,需要通过多次结晶纯化来提高纯度。
解决方法是在反应过程中严格控制反应条件,确保反应物的充分反应,避免副产物的生成。
实验改进方向:为了进一步提高乙酰苯胺的纯度,可以尝试改变反应条件,如改变反应温度、溶剂的选择等,以寻求更优的合成条件。
在本实验中,我们成功制备了乙酰苯胺,并通过结晶纯化得到了纯品。
该实验为有机合成中间体的制备提供了一种简单有效的方法,具有一定的应用价值。
通过本次实验,我们对有机合成反应有了更深入的了解,也为今后的实验工作提供了宝贵的经验。
乙酰苯胺的合成

乙酰苯胺的合成一、实验原理苯胺可以与乙酰氯、乙酸酐或冰醋酸作用,生成乙酰苯胺。
苯胺与乙酸酐反应是实验室常用的方法,且得到产物纯度高、产量高。
用乙酸作乙酰化试剂反应平缓,虽然反应周期长,但乙酸价格便宜,操作方便。
One,PrincipleThe aniline may with the acetyl chloride, second grade acid anhydride or the glacial acetic acid function, the production monoacetylaniline. The aniline and the second grade acid anhydride response are the laboratory commonly used methods, and obtains the product purity to be high, the output is high. Makes the acetylize reagent response with the ethanoic acid to be gentle, although the response cycle is long, but the ethanoic acid price is cheap, ease of operation.二、仪器与药品仪器:圆底烧瓶,冷凝管,抽滤装置,烧杯,表面皿,吸量管,滤纸。
药品:苯胺,冰醋酸。
Two,Equipments and MaterialsEquipments:The round flask, prolongs, pulls out filters the installment, the beaker, the watch glass, the pipette, the filter paper.Materials:Aniline, glacial acetic acid.三、详细操作步骤(sop)①加料:新蒸过苯胺,冰醋酸;②回流:40分钟;③结晶:倒入冷水中,冷却,减压抽滤;④去酸液:蒸馏水洗;⑤重结晶:热水溶解,加热至沸,稍冷,搅拌煮沸,趁热减压过滤;⑥晾干、称重:减压抽滤,测熔点。
乙酰苯胺的制备

乙酰苯胺的制备在有机化学的领域中,乙酰苯胺是一种常见且重要的化合物。
它不仅在实验室中经常被合成和研究,在工业生产中也有着广泛的应用,例如用于制造染料、药物等。
接下来,让我们详细了解一下乙酰苯胺的制备过程。
制备乙酰苯胺,通常会采用苯胺和乙酸作为主要的原料。
苯胺是一种具有特殊气味的无色油状液体,而乙酸则是我们日常生活中常见的醋的主要成分。
首先,在一个配备有搅拌装置、回流冷凝管和温度计的三口烧瓶中,加入一定量的苯胺和适量的乙酸。
这里需要注意的是,苯胺具有一定的毒性,在操作过程中要做好防护措施,避免直接接触皮肤和吸入其蒸气。
然后,缓慢地向烧瓶中滴加少量的浓磷酸作为催化剂。
滴加的速度要控制好,以免反应过于剧烈导致冲料等危险情况的发生。
接下来,开始加热混合物。
加热的温度要控制在适当的范围内,一般在 100 110 摄氏度之间。
在加热的过程中,要不断地搅拌,使反应物能够充分混合,反应均匀进行。
随着反应的进行,我们可以观察到混合物的颜色逐渐变深,并且有水分不断地被蒸出。
这是因为反应会生成水,而通过蒸馏的方式将水及时移除,有利于反应向生成乙酰苯胺的方向进行。
反应一段时间后,停止加热,让反应混合物自然冷却至室温。
此时,会发现瓶内有固体析出。
接下来进行过滤操作,将析出的固体与溶液分离。
过滤时可以使用布氏漏斗和抽滤瓶,以提高过滤的效率。
得到的固体粗产物还需要进行进一步的提纯。
通常采用重结晶的方法,选择合适的溶剂(如乙醇水混合溶剂),将粗产物溶解在热溶剂中,然后缓慢冷却使乙酰苯胺重新结晶析出。
在整个制备过程中,有几个关键的要点需要特别注意。
一是原料的纯度和用量要准确控制,这直接影响到反应的产率和产物的纯度。
二是反应条件的控制,包括温度、搅拌速度、滴加速度等,这些因素都会对反应的进程和结果产生重要的影响。
三是实验操作的规范性和安全性,要严格遵守实验室的安全规则,正确使用实验仪器和设备。
乙酰苯胺的制备不仅仅是一个简单的实验操作,它还蕴含着丰富的化学原理和实验技巧。
乙酰苯胺的制备 第四组:

2.乙酰苯胺重结晶
(1)取2g粗乙酰苯胺,放于150mL锥形瓶中,加入70mL水。 (2)石棉网上加热至沸,并用玻棒不断搅动,使固体溶解。 (3)这时若有尚未完全溶解的固体,可继续加入少量热水,至完全溶解后,再多加2-3mL 水(总量约90mL)。 (4)移去火源,稍冷后加入少许活性炭,稍加搅拌继续加热微沸5-10min。 (5)事先在烘箱中烘热无颈漏斗,过滤时趁热从烘箱中取出,把漏斗安置在铁圈上,于漏 斗中放一预先叠好的折叠滤纸,并用少量热水润湿,将上述热溶液通过折叠滤纸,迅速地滤 入150mL烧杯中。每次倒入漏斗中的液体不要太满;也不要等溶液全部滤完后再加。 (6)在过滤过程中,应保持溶液的温度。为此将未过滤的部分继续用小火加热以防冷却。 待所有的溶液过滤完毕后,用少量热水洗涤锥形瓶和滤纸。 (7)滤毕,用表面皿将盛滤液的烧杯盖好,放置一旁,稍冷后,用冷水冷却以使结晶完全。 如要获得较大颗粒的结晶,可在滤完后将滤液中析出的结晶重新加热使溶,于室温下放置, 让其慢慢冷却。 (8)结晶完成后,用布氏漏斗抽滤(滤纸先用少量冷水润湿,抽气吸紧),使结晶与母液 分离,并用玻塞挤压,使母液尽量除去。拔下抽滤瓶上的橡皮管(或打开安全瓶上的活塞), 停止抽气。 (9)加少量冷水至布氏漏斗中,使晶体润湿(可用刮刀使结晶松动),然后重新抽干,如 此重复1-2次,最后用刮刀将结晶移至表面皿上,摊开成薄层,置空气中晾干或在干燥器中 干燥。 (10)测定干燥后精制产物的熔点,并与粗产物熔点作比较,称重并计算收率。
性状:白色有光泽片状结晶或白色结晶粉末,在水中再结晶析出呈 正交晶片状。无臭或略有苯胺及乙酸气味。 熔点:114.3℃ 沸点:304℃ 闪点:173.9℃ 自燃点:546℃ 折光率:1.5860 相对密度:1.2190(15/4℃) 稳定性:在空气中稳定。 溶解情况:溶解度:水0.46(20℃)、0.56(25℃)、0.84(50℃)、 5.5(100℃);乙醇36.9(20℃),甲醇69.5(20℃),氯仿3.6 (20℃),微溶于冷水,溶于热水、甲醇、乙醇、乙醚、氯仿、丙 酮、甘油和苯等,不溶于石油醚。 其它:可燃,呈中性或极弱碱性。遇酸或碱性水溶液易分解成苯胺 及乙酸。
乙酰苯胺的制备

乙酰苯胺的制备在化学实验和工业生产中,乙酰苯胺是一种非常重要的有机化合物。
它不仅在染料、药物和香料等领域有着广泛的应用,而且其制备过程也是有机化学中的一个经典实验。
接下来,让我们详细了解一下乙酰苯胺的制备方法。
乙酰苯胺的制备通常采用苯胺和乙酸作为主要原料,通过酰化反应来实现。
在这个过程中,需要用到一些试剂和仪器,如苯胺、冰醋酸、锌粉、分馏柱、温度计、圆底烧瓶、冷凝管等。
首先,在圆底烧瓶中加入一定量的苯胺和冰醋酸。
苯胺具有特殊的气味,是一种无色油状液体,而冰醋酸则是常见的有机酸。
这里加入的苯胺和冰醋酸的比例需要严格控制,通常苯胺和冰醋酸的摩尔比约为 1:12 至 1:15。
加入原料后,再向烧瓶中投入少量锌粉。
锌粉在这里起到防止苯胺氧化的作用。
然后,装上分馏柱和温度计,并将整个装置连接到冷凝管上。
接下来,开始加热反应混合物。
在加热的过程中,需要控制温度缓慢上升。
这是因为温度过高可能会导致副反应的发生,从而影响产物的纯度和产率。
一般来说,将温度控制在 100 至 110 摄氏度之间较为合适。
随着反应的进行,会有水分不断蒸出。
这是因为乙酸与苯胺反应会生成水,而通过分馏柱将生成的水及时分离出去,可以促使反应向生成乙酰苯胺的方向进行。
反应一段时间后,停止加热。
待反应混合物冷却至室温后,将其倒入大量的冷水中。
这时,乙酰苯胺会结晶析出。
然后进行过滤,收集析出的固体。
为了得到更纯净的乙酰苯胺,还需要对其进行重结晶操作。
选择合适的溶剂,如乙醇水混合溶剂,将粗产物溶解在其中,然后加热使其溶解,再缓慢冷却,使乙酰苯胺重新结晶。
经过重结晶后的乙酰苯胺,再次过滤、干燥,就可以得到纯度较高的乙酰苯胺产品。
在整个制备过程中,有几个关键的注意事项。
首先,实验所用的仪器必须干燥,因为水的存在可能会影响反应的进行。
其次,加热时温度的控制至关重要,要避免温度过高或过低。
另外,在处理反应产物和进行分离提纯的操作中,要注意安全,避免接触到有害物质。
乙酰苯胺的合成

乙酰苯胺的合成一、教学要求:1、学习乙酰苯胺的原理、方法和作用。
2、学习分馏操作的原理和技术。
3、熟悉重结晶的操作技术。
4、掌握产物的分离提纯原理和方法5、练习产品熔点的测定方法6、熟悉减压抽滤、洗涤等基本操作二、预习内容:1、分馏操作的原理和技术2、电热套的正确使用3、重结晶4、熔点的测定5、减压抽滤三、基本操作:四、实验原理:胺的酰化在有机合成中有着重要的作用。
作为一种保护措施,一级和二级芳胺在合成中通常被转化为它们的乙酰基衍生物以降低胺对氧化降解的敏感性,使其不被反应试剂破坏;同时氨基酰化后降低了氨基在亲电取代反应(特别是卤化)中的活化能力,使其由很强的第Ⅰ类定位基变为中等强度的第Ⅰ类定位基,使反应由多元取代变为有用的一元取代,由于乙酰基的空间位阻,往往选择性的生成对位取代物。
用冰醋酸为酰化剂制备乙酰苯胺。
芳胺可用酰氯、酸酐或与冰醋酸加热来进行酰化,使用冰醋酸试剂易得,价格便宜,但需要较长的反应时间,适合于规模较大的制备。
酸酐一般来说是比酰氯更好的酰化试剂。
用游离胺与纯乙酸酐进行酰化时,常伴有二乙酰胺[ArN(COCH3)2]副产物的生成。
但如果在醋酸-醋酸钠的缓冲溶液中进行酰化,由于酸酐的水解速度比酰化速度慢得多,可以得到高纯度的产物。
但这一方法不适合于硝基苯和其它碱性很弱的芳胺的酰化。
表乙酰苯胺物理参数五、实验步骤:在50ml圆底烧瓶中加入5ml新蒸馏的C6H5NH2(0.05mol)、7.5mlCH3COOH(0.1mol)及少许锌粉(约0.1g)(思考题1,2)。
依次安装分馏柱、蒸馏头、温度计、接液管,接液管伸入10ml 小量筒内,收集蒸出的水和乙酸。
用电热套将溶液缓慢加热,使反应物保持微沸约15min。
然后逐渐升高温度,保持温度计读数在105℃左右(思考题3),约经过45min,反应生成的水及部分醋酸可蒸出(约4ml)。
当温度计的读数下降时,反应即达终点,停止加热。
在不断搅拌下,将反应物趁热慢慢倒入盛有100ml冷水的烧杯中(思考题4),继续搅拌,充分冷却,使粗乙酰苯胺成细粒状完全析出。
乙酰苯胺的制备(精选文档)

(4)在某些情况下,酰化可以避免氨基与其它功能基或试剂(如RCOCl,-SO2Cl,HNO2等)之间发生不必要的反应。
作为氨基保护基的酰基基团可在酸或碱的催化下脱除。
芳胺的乙酰化试剂选择:
芳胺可用酰氯、酸酐或冰醋酸加热来进行酰化,使用冰醋酸试剂易得,价格便宜,但需要较长的反应时间,适合于规模较大的制备。
苯胺乙酰化的必要性:
(1)作为一种保护措施,将一级和二级芳胺(就是伯胺和仲胺)在合成中转化为其乙酰衍生物,降低芳胺对氧化性试剂的敏感性,使其不被反应试剂破坏,
(2)氨基经酰化后,降低了氨基在亲电取代反应(特别是卤化)中的活化能力,使其由很强的第I类定位基变成中等强度的第I类定位,使反应由多元取代变为有用的一元取代。
6.不可以用过量的水处理乙酰苯胺。乙酰苯胺于不同温度在100g水中的溶解度为:0.56g(25℃)、3.5g(80℃)、18g(100℃);乙醇:36.9g(20℃)甲醇:69.5g(20℃)氯仿:3.6g(20℃)。乙酰苯胺在水中的含量为5.2%时,重结晶效率好,乙酰苯胺重结晶产率最大。在体系中的含量稍低于5.2%,加热到83.2℃时不会出现油相,水相又接近饱和溶液,继续加热到100℃,进行热过滤除去不溶性杂质和脱色用的活性炭,滤液冷却,乙酰苯胺开始结晶,继续冷却至室温(20℃),过滤得到的晶体乙酰苯胺纯度很高,可溶性杂质留在母液中。。一个经验的办法是按操作步骤给出的产量5g(初做的学生很难达到),估计需水量为100ml,加热至83.2℃,如果有油珠,补加热水,直至油珠溶完为止。个别同学加水过量,可蒸发部分水,直至出现油珠,再补加少量水即可。
乙酰苯胺的制备
一、实验目的
1.掌握苯胺乙酰化的原理和方法,
乙酰苯胺的合成方法

乙酰苯胺的合成方法1.1分馏法制备乙酰苯胺这种方法是利用分馏装置制备乙酰苯胺。
将反应物依次加入圆底烧瓶中,然后接上分馏柱,在柱口插入温度计,蒸出的水和醋酸用锥形瓶收集,在加热时,温度计读数维持在110℃,当反应结束后,趁热搅拌着将反应物倒入装有冷水的烧杯中,然后冷却静置抽滤,得到粗产品用水重结晶,最后用称量法计算干燥后产品的产率。
利用分馏法制备乙酰苯胺的产率为20.7%,其产率不高。
尽管装置中的分馏柱能够将生成的水从其中移去,但分馏柱不是根据特殊实验条件加工的,所以它不能绝对遵循实验意图,另外在反应体系中,由于高的反应温度,一般分馏柱在规定时间内很难分馏出正确比例的水和醋酸,这样致使反应物比例失调,使产率减少甚至实验失败。
在这个反应中,苯胺极易氧化,因此产品多为浅棕色和黄色并成块状,要不断的重结晶,这样使得乙酰苯胺产率减少。
苯胺是有毒化学品,在分馏过程中如果温度太高,过量的混合蒸汽没有液化挥发出来,能够对环境和人造成危害,而且未完全转化的苯胺很难回收。
1.2 回流法制备乙酰苯胺回流法是利用回流装置合成乙酰苯胺。
将反应物依次加入圆底烧瓶中,装上直型冷凝管,用小火加热回流,反应完成后,趁热搅拌着将反应物倒入装有水的烧杯中,冷却静置抽滤,重结晶,也能够将反应物趁热倒进冰水中,在其中冷却一定时间使的温度降低,从而提高乙酰苯胺产率。
这个反应利用苯胺与过量的冰醋酸回流合成乙酰苯胺,但它需较长时间回流,产量不高,并且产品成色不好。
在工业制备过程中,需对其加热6~8 h 以上。
还可以用适量的苯胺、乙酸酐、冰醋酸和少量的锌粉回流合成,另外苯胺、冰醋酸和乙酸酐可以一起回流制备乙酰苯胺。
这两种回流法都用乙酸酐作为酰化剂,它使得反应不易控制且成本较高。
利用回流法合成乙酰苯胺反应时间对产率的影响比较大,当反应时间为40,60,90 min 时,其平均产率分别为43%,63%,64%。
在反应中由于产物中水不能及时除去,从而影响了反应物的产率。
乙酰苯胺的制备

化学与环境学院之水城攒孽创作有机化学实验陈述实验名称乙酰苯胺的制备【实验目的】1、掌握苯胺乙酰化反应的原理和实验操纵;2、掌握分馏柱的作用机理和用途。
【实验原理】(包含反应机理)芳香族伯胺的芳环和氨基都容易起反应,在有机合成上为了呵护氨基,往往先把它乙酰化为乙酰苯胺,然后进行其他反应,最后水解去乙酰基。
制备乙酰苯胺经常使用的方法可用芳胺与酰氯、酸酐或用冰醋酸等试剂进行酰化反应。
其中与酰氯反应最激烈,酸酐次之,冰醋酸最慢。
采取酰氯或酸酐作为酰化剂,反应进行较快,但原料价格较贵,采取冰醋酸作为酰化剂,反应较慢,但价格廉价,操纵方便,适用于规模较大的制备。
本实验是用冰醋酸作乙酰化试剂:苯胺与冰醋酸的反应是可逆反应,为防止乙酰苯胺的水解,提高产率,采取了将其中一个生成物——水在反应过程中不竭移出体系及反应物醋酸过量的方法破坏平衡,使平衡向右移动。
因此,要求实验装置既能反应又能进行蒸馏。
由于水与反应物冰醋酸的沸点相差不大,必须在反应瓶上装一个刺形分馏柱,使水和醋酸的混合气体在分馏柱内进行多次汽化和冷凝,使这两种气体得到分离,从而减少醋酸蒸出,包管水的顺利蒸出。
【主要试剂及物理性质】【仪器装置】1、主要仪器:刺型分馏柱、温度计、冷凝管、锥形瓶、尾接管、布氏漏斗、真空循环水泵2、实验装置:分馏装置抽滤装置【实验步调及现象】【实验结果】理论产量:m(乙酰苯胺)=n(乙酰苯胺)M(乙酰苯胺)=n(苯胺)M(乙酰苯胺)=0.11*实际产量:产率:11.2/14.87*100%=75.3%【实验讨论】1、为什么苯胺原本是无色澄清溶液,但加入反应时会呈黄色?答:由于苯胺被氧化:2、因乙酰苯胺熔点较高,稍冷即会固化,因此,反应结束后须立即倒入事先准备好的水中。
否则凝固在烧瓶中难以倒出。
3、产率只有75.3%,有哪些原因导致?答:①在20℃下,100mL水可以溶解0.46g,在抽滤以及结晶的过程中有所损失;②在抽滤的过程中,有产品残留在烧杯壁上,很难刮下;③由于反应温度较难控制,有少量乙酰苯胺被蒸出,使产量减少,产率下降。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.乙酸
(1)、健康危害 侵入途径:吸入、食入、经皮吸收。 吸入后对鼻、喉和呼吸道有刺激性。对眼有强烈刺激作用。皮肤接触,
轻者出现红斑,重者引起化学灼伤。误服浓乙酸,口腔和消化道可产生 糜烂,重者可因休克而致死。 慢性影响:眼睑水肿、结膜充血、慢性咽炎和支气管炎。长期反复接触, 可致皮肤干燥、脱脂和皮炎。 (2)、毒理学资料及环境行为 毒性:属低毒类。 急性毒性:LD503530mg/kg(大鼠经口);1060mg/kg(兔经 皮);LC505620ppm,1小时(小鼠吸入);人经口1.47mg/kg,最低中毒量, 出现消化道症状;人经口20~50g,致死剂量。 亚急性和慢性毒性: 人吸入200~490mg/m3×7~12年,有眼睑水肿,结膜充血,慢性咽炎, 支气管炎。 致突变性:微生物致突变:大肠杆菌300ppm(3小时)。 姊妹染色单体交换:人淋巴细胞5mmlo/L。 生殖毒性:大鼠经口最 低中毒剂量(TDL0):700mg/kg(18天,产后),对新生鼠行为有影响。大 鼠睾丸内最低中毒剂量(TDL0):400mg/kg(1天,雄性),对雄性生育指 数有影响。 危险特性:其蒸气与空气形成爆炸性混合物,遇明火、 高热能引起燃烧爆炸。与强氧化剂可发生反应。 燃烧(分解)产物: 一氧化碳、二氧化碳。
和骨髓增生。反复接触可发生紫绀。对皮肤有刺激性,可致皮炎。能抑制中 枢神经系统和心血管系统,大量接触会引起头昏和面色苍白等症。 二、毒理学资料及环境行为 毒性:属低毒类。 急性毒性:LD50800mg/kg(大鼠经口);1210mg/kg(小鼠经口);人经口 50mg/kg,最低致死剂量。 危险特性:遇明火、高热可燃。受高热分解,产生有毒的氮氧化物。 燃烧(分解)产物:一氧化碳、二氧化碳、氧化氮。 三、包装储运 采用内层塑料袋、外层麻袋或帆布袋包装,每袋净重50kg。贮存在阴凉、干 燥、通风处,防火、防潮。用汽车或火车运输均可。按有毒化学品规定贮运。
实验装置
【实验步骤】
1.用冰醋酸为酰化试剂制备乙酰苯胺
(1)在50mL圆底烧瓶中,加入10mL苯胺、15mL冰醋酸及少许锌 粉(约0.1g),装上一短的剌形分馏柱,其上端装一温度计,支 管通过支管接引管与接受瓶相连,接受瓶外部用冷水浴冷却。
(2)将圆底烧瓶在石棉网上用小心加热,使反应物保持微沸约 15min。
苯胺(99%) 690Kg (工业级)
冰醋酸
500Kg(工业级)
苯胺价格
9610元/t
冰醋酸价格 285元/t
生产成本:0.690×9610+0.500×285=6773.4元
质量产率:1÷(0.690+0.500)×100%=84.03%
对环境的影响
一、健康危害 侵入途径:吸入、食入。 健康危害:吸入对上呼吸道有刺激性。高剂量摄入可引起高铁血红蛋白血症
斗中放一预先叠好的折叠滤纸,并用少量热水润湿,将上述热溶液通过折叠滤纸,迅速地滤 入150mL烧杯中。每次倒入漏斗中的液体不要太满;也不要等溶液全部滤完后再加。 (6)在过滤过程中,应保持溶液的温度。为此将未过滤的部分继续用小火加热以防冷却。 待所有的溶液过滤完毕后,用少量热水洗涤锥形瓶和滤纸。 (7)滤毕,用表面皿将盛滤液的烧杯盖好,放置一旁,稍冷后,用冷水冷却以使结晶完全。 如要获得较大颗粒的结晶,可在滤完后将滤液中析出的结晶重新加热使溶,于室温下放置, 让其慢慢冷却。 (8)结晶完成后,用布氏漏斗抽滤(滤纸先用少量冷水润湿,抽气吸紧),使结晶与母液 分离,并用玻塞挤压,使母液尽量除去。拔下抽滤瓶上的橡皮管(或打开安全瓶上的活塞), 停止抽气。 (9)加少量冷水至布氏漏斗中,使晶体润湿(可用刮刀使结晶松动),然后重新抽干,如 此重复1-2次,最后用刮刀将结晶移至表面皿上,摊开成薄层,置空气中晾干或在干燥器中 干燥。 (10)测定干燥后精制产物的熔点,并与粗产物熔点作比较,称重并计算收率。
控制乙酸酐的用量,使苯 胺与乙酸酐物质的量 1:1—1:1.1之间,尽量避 免副产物的产生。
控制乙酸的用量,乙酸量 太少,溶液中乙酰苯胺的 浓度相对较大,与少量水 容易结晶;乙酸量太多, 造成浪费。
可采用抽虑的方法: 缩短过滤时间;乙酸 的气味通过抽虑抽气, 被水泵中的水稀释带 出。
生产成本
工业化生产的只有一种方法即苯胺乙酸乙酰化法,其它 的几种现在是实验室制法。苯胺乙酸乙酰化每生产1t 乙酰苯胺消耗:
急救措施
皮肤接触:立即脱去被污染的衣着,用肥皂水和清水 彻底冲洗皮肤。就医。 眼睛接触:立即提起眼睑, 用大量流动清水或生理盐水彻底冲洗至少15分钟。就 医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通 畅。如呼吸困难,给输氧。如呼吸停止,立即进行人 工呼吸。就医。
食入:误服者用水漱口,给饮牛奶或蛋清。就医。 灭火方法:二氧化碳、干粉、1211灭火剂、砂土。禁
(3)然后逐渐升高温度,当温度计读数达到100℃左右时,支管即 有液体流出。维持温度在100-110℃之间反应约1.5h,生成的水及 大部分醋酸已被蒸出,此时温度计读数下降,表示反应已经完成。
(4)在搅拌下趁热将反应物倒入200mL冰水中,冷却后抽滤析出的 固体,用冰水洗涤。
(5)粗产物用水重结晶,产量9-10g,熔点113-114℃。 纯粹乙酰苯胺的熔点为114.3℃,为白色结晶体。
精细1111第四组乙酰苯 胺的合成
乙酰苯胺简介
乙酰苯胺,学名N-苯(基)乙酰胺,白色有光 泽片状结晶或白色结晶粉末,是磺胺类药物的 原料,可用作止痛剂、退热剂、防腐剂和染料 中间体。
结构式:
【实验试剂】
10.2g(10mL,0.11mol)苯胺(自备), 15.7g(15mL,0.26mol)冰醋酸,锌粉
2.乙酰苯胺重结晶
(1)取2g粗乙酰苯胺,放于150mL锥形瓶中,加入70mL水。 (2)石棉网上加热至沸,并用玻棒不断搅动,使固体溶解。 (3)这时若有尚未完全溶解的固体,可继续加入少量热水,至完全溶解后,再多加2-3mL
水(总量约90mL)。 (4)移去火源,稍冷后加入少许活性炭,稍加搅拌继续加热微沸5-10min。 (5)事先在烘箱中烘热无颈漏斗,过滤时趁热从烘箱中取出,把漏斗安置在铁圈上,于漏
设计实验中问题成因分析及解决方案
问题
问题(1)
问题(2)
问题(3)
产生原因 解决方法
当乙酸酐过量时,可能发 生进一步取代反应,在N 上取代两个乙酰基。
乙酰苯胺常温时溶于冰乙 酸,但在水中的溶解度较 小,因此当乙酸的量相对 较小时,过滤时溶液遇滤 纸上漏斗上的水易形成结 晶而导致堵塞。
因为乙酸有刺激性气 味,如果过滤时间过 长,酰胺反应产生乙 酸以及加入的乙酸就 会散发到空气中污染 环境。
