第14章取代反应和缩合反应1
有机化学基础知识点整理胺的亲电取代反应与缩合反应

有机化学基础知识点整理胺的亲电取代反应与缩合反应有机化学基础知识点整理——胺的亲电取代反应与缩合反应胺是有机化合物中含有氨基(NH2)基团的一类化合物。
胺的亲电取代反应以及缩合反应是有机化学中重要的反应类型。
我们将在本文中对胺的亲电取代反应和缩合反应进行详细的整理和讨论。
一、胺的亲电取代反应亲电取代反应是有机化学中常见的反应类型,它涉及到一个亲电子试剂与胺发生反应,产生新的化学键。
胺的亲电取代反应的机理主要有两个:亲核取代和电子转移。
1. 亲核取代亲核取代是指亲电子试剂中的亲核试剂攻击胺分子中的亲电子中心,并与之形成新的化学键。
常见的亲电取代试剂包括卤素、醇、水和卤代烷等。
以卤代烷为例,当卤代烷与胺反应时,胺中的氮原子亲电子性强,易被卤代烷中的卤素攻击,形成适当的胺盐。
此时,胺盐可以通过加热、浓碱等条件来回复到相应的胺。
2. 电子转移电子转移是指亲电子试剂中的亲电子离子或亲电子原子与胺分子中的电子对发生重新分配,形成新的化学键。
常见的电子转移试剂包括亚硝酸、叔丁基过氧化物等。
以亚硝酸为例,亚硝酸在反应中会发生电子转移,并与胺分子中的氨基发生作用,形成相应的亚硝基化合物。
这种反应常用于合成具有特定化学活性的化合物。
二、胺的缩合反应胺的缩合反应是指两个或更多胺分子之间发生的反应,其中一个分子失去一个氨基(NH2)基团,而另一个分子失去一个氢原子,形成一个新的分子。
1. 胺与醛/酮的缩合反应胺与醛或酮的缩合反应又称为Mannich反应。
在反应中,胺中的亲电子中心攻击醛分子中的羰基,生成一个中间体,然后中间体失去一个氨基和一个氢原子,形成缩合产物。
Mannich反应在有机合成中广泛应用,可以合成多种具有生物活性的化合物,如药物和天然产物。
2. 胺与羧酸的缩合反应胺与羧酸的缩合反应通常需要在酸性条件下进行。
胺中的亲电子攻击羧酸中的羰基,形成酰胺化合物。
此反应也被称为酰胺合成反应。
酰胺化合物是有机化学中重要的结构单元,广泛存在于药物和生命体系中。
有机化学第十四章

COOC2H5 CH3COCH2COOC2H5 + C2H5OH COCH2COOC2H5
两种产物在性质上有较大差别, 两种产物在性质上有较大差别,可分离
分子内Claisen 酯缩合(Dieckmann狄克曼缩合) 酯缩合( 狄克曼缩合) 分子内 狄克曼缩合
CH2CH2COOC2H5 CH2CH2COOC2H5 O
C2H5C O + CH2COOC2H5 CN CH3
乙酸铵-乙酸
C6H6
CH3 C2H5
C C COOC2H5 CN 85%
CHO
+
CH2(COOH)2
哌啶,95~100℃ ℃ -H2O
CH C(COOH)2
- CO2
CH CHCOOH (80%~95%)
五、Michael加成 加成
O + CH2(COOC2H5)2 C2H5ONa C2H5OH CH(COOC2H5)2 90% (C2H5)3N,叔丁醇 叔 O
三、丙二酸二乙酯的合成及应用
1、制备 、
CH2COONa Cl
NaCN
CH2COONa CNOC H 2 5
腈化反应
水解、 水解、成酯反应
2、应用 、 (1)制备取代乙酸(一取代或二取代): )制备取代乙酸(一取代或二取代): 脱H+,生成钠盐 生成钠盐
步2
制备甲基酮或烷基取代酸: 制备甲基酮或烷基取代酸:
①稀OH -,②H+,③∆ 酮式分 解 ①40%OH-,②H+,③∆ 酸式分解
CH3 CH3COCCOOC2H5 CH2CH2CH3
CH3 CH3COCHCH2CH2CH3
CH3 CH3CH2CH2CHCOOH
第十四章 羧酸衍生物 酰基碳上的亲核取代反应
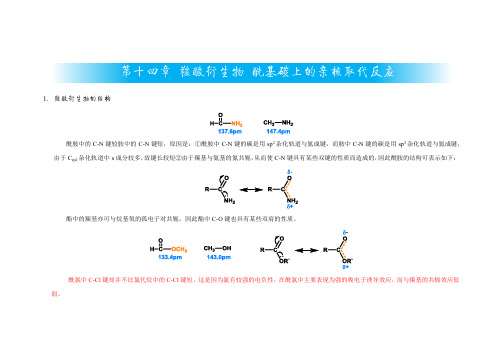
第十四章羧酸衍生物酰基碳上的亲核取代反应1.羧酸衍生物的结构酰胺中的C-N键较胺中的C-N键短,原因是:①酰胺中C-N键的碳是用sp2杂化轨道与氮成键,而胺中C-N键的碳是用sp3杂化轨道与氮成键,由于C sp2杂化轨道中s成分较多,故键长较短②由于羰基与氨基的氮共轭,从而使C-N键具有某些双键的性质而造成的,因此酰胺的结构可表示如下:酯中的羰基亦可与烷基氧的孤电子对共轭,因此酯中C-O键也具有某些双肩的性质。
酰氯中C-Cl键却并不比氯代烷中的C-Cl键短,这是因为氯有较强的电负性,在酰氯中主要表现为强的吸电子诱导效应,而与羰基的共轭效应很弱。
酰胺、酯、酰氯的共振式如下:在酰胺中具有相反电荷的偶系结构是主要的,酯中次之,而在酰氯中这种偶极结构很少。
2.羧酸衍生物的物理性质低级酰氯与酸酐是有刺激气味的液体。
高级的为固体。
低级酯具有芳香的气味,存在于水果中,可用作香料。
十四碳以下的甲酯/乙酯均为液体。
酰胺除甲酰胺外,均是固体,只是因为分子中形成氢键,如果氮上的氢逐个被取代,则氢键缔合减少,因此脂肪族的N-取代酰胺常为液体。
酰氯和酯的沸点因分子中没有缔合,比相应的羧酸低,酸酐与酰胺的沸点,比相应的羧酸高。
(乙酰氯bp:51℃乙酸酐bp:140℃乙酸乙酯bp:77℃乙酰胺bp:222℃)酰氯和酸酐不溶于水,低级的遇水分解;酯在水中的溶解度很小;低级的酰胺可溶于水,N,N-二甲基甲酰胺和N,N-二甲基乙酰胺是很好的非质子性溶剂,可与水以任何比例混合。
乙酸乙酯是很好的有机溶剂,大量用于油漆工业。
3.羧酸衍生物的反应1)酰基碳上的亲核取代反应①酰基碳上的亲核取代反应概述基团离去能力的次序是:I- > Br- > Cl- > -OCOOR > -OR > -OH > -NH2(氨基的碱性比氢氧根强)不管是酸催化还是碱催化的机理,羧酸衍生物亲核取代反应性顺序都是:卤酐醛酮(活泼)酯酸胺腈(较稳定)②羧酸衍生物的水解——形成羧酸a)酰卤的水解在羧酸衍生物中,酰卤的水解速率很快,低分子酰卤水解很猛烈,如乙酰氯在湿空气中会发烟,这是因为乙酰氯水解产生盐酸。
有机化学第二版(高占先)(全14章答案完整版)_第8-14章(1)

有机化学第二版(高占先)(全14章答案完整版)_第8-14章史上最全的《有机化学第二版(高占先)》全14章答案完整版!!其中包括各种判断题、推断题、思考题以及合成题的答案!!Ps:亲!给好评,有送财富值哦! #^_^!!第8章卤代烃8-2 完成下列各反应式。
(CH3)3CBr C2H5OH(CH3)2C=CH2+CH3CH=CH2HBr+O OCH3CH2CH2CH3CH2CH2CNNaCN(1)(2)(CH3)2CHCH=CH2Br+500℃(CH3)2CCH=CH2Br H2O(CH3)2C=CHCH2Br +(CH3)2CCH=CH2OH(CH3)2C=CHCH2OH +(3)NaCNKOH25(4)(5)(6)ClCH=CHCH2Cl CH3+ClCH=CHCH23OBrBrBrCNCH2CHCH3BrCH=CHCH3CH3 Br2NH3(l)CH3NH2CH32+ClCl NO2NaOH-H2OOHClNO2ZnCl2(HCHO + HCl)+CH2ClMgCH2MgCl CH2COOH ClCH2CHCH2CH2CH3PhCH2MgClCH3+PhCH2CH2CHCH2CH2CH3CH3(7)(8)(9)(10)3RC CLi(11)RC CR'RC CCOOHRC CCH2CH2OHCHBr3BrBr(12)8-3写出下列反应主要产物的构型式。
C2H5CH 3NaI+CC2H5CH3NaSCH3+(S N2)(S N2)(S N2)CH3I2(CH2)4CH3HH2OCH3HCH2(CH2)4CH3HOCBrCH2CH2CH3CCH2CH3H2Lindar催化剂CHCCH2CH2CH3H(1)(2)(3)(4)3KOH253H3t-BuOKt-BuOH, △H3CPh PhHC6H5H3C H6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H BrCH2CH3H BrC2H5CH325Znt-BuOK(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-4比较下列每对亲核取代反应,哪一个更快,为什么(1)B>A (亲核性C2H5O->C2H5OH)(2)A>B (烯丙型卤代烃活泼)(3)B>A (极性非质子溶剂有利于S N2反应)(4)A>B (亲核性-SH>-OH)(5)A>B (亲核性硫比氮强)(6)B>A (离去能力I->Cl-)8-5卤代烷与NaOH在H2O-C2H5OH溶液中进行反应,指出哪些是S N2机理的特点,哪些是S N1机理的特点(1)产物发生Walden转化; S N2(2)增加溶剂的含水量反应明显加快; S N1(3)有重排反应产物; S N1(4)反应速率明显地与试剂的亲核性有关; S N2(5)反应速率与离去基的性质有关; S N2和S N1(6)叔卤代烷反应速度大于仲卤代烷。
教学课件:第十四章-1-3-二羰基化合物

要点二
详细描述
二羰基化合物可以通过一系列的反应,如氧化、还原、取 代等,合成出多种药物,如抗生素、抗癌药物、抗病毒药 物等。这些药物在医疗领域中发挥着重要的作用,对于治 疗各种疾病、保障人类健康具有重要意义。
在香料合成中的应用
总结词
二羰基化合物在香料合成中也有着广泛的应用,能够 合成出多种具有特殊香味的化合物。
究。
新应用探索
鼓励寻找二羰基化合物的新用 途,特别是在绿色化学和可持 续发展方面的应用。
教学改进
提出了一些关于如何改进二羰基 化合物教学的建议,以帮助学生 更好地理解和掌握这一主题。
跨学科整合
提倡将二羰基化合物与其他化 学主题进行跨学科整合,以提
供一个更全面的学习视角。
THANKS
感谢观看
羧酸酯的脱羧
总结词
羧酸酯的脱羧是制备二羰基化合物的另一种常用方法,通过加热或使用催化剂可以将羧酸酯脱羧生成 二羰基化合物。
详细描述
在加热或催化剂的作用下,羧酸酯中的酯基会发生脱羧反应,生成一个碳碳双键和二氧化碳,再通过 氧化等手段将碳碳双键转化为羰基,从而得到二羰基化合物。该方法条件温和,适用于大多数羧酸酯 的转化,但反应过程中可能伴随有副反应的发生。
详细描述
香料工业中,二羰基化合物可以通过一系列的反应, 如酯化、取代等,合成出各种香料,如香豆素、香兰 素等。这些香料在食品、化妆品等领域中广泛应用, 能够为人们的生活带来美好的体验。
在染料合成中的应用
总结词
二羰基化合物在染料合成中也有着重要的应用,能够合 成出多种具有优良性能的染料。
详细描述
染料工业中,二羰基化合物可以通过一系列的反应,如 偶联、氧化等,合成出各种染料,如偶氮染料、蒽醌染 料等。这些染料在纺织、皮革等领域中广泛应用,能够 为纺织品和皮革制品带来鲜艳的色彩和优良的性能。
第14章_β-二羰基化合物和有机_[1]...
![第14章_β-二羰基化合物和有机_[1]...](https://img.taocdn.com/s3/m/489a41b68762caaedd33d446.png)
不含α-H的酯如草酸二乙酯、甲酸酯、碳酸二乙酯 苯甲酸酯等在酰化反应中可分别引入-COCO2C2H5, -CHO, -COOC2H5, -COPh基团。
2. 酰基化反应
使用草酸酯得到的产物既是β-酮酯,又是α-酮 酯。由于α-酮酯在加热时可脱去羰基,为合成取 代丙二酸酯及相关化合物提供一条方便的途径。
3. 迈克尔加成反应
活泼氢化合物在催化量碱(常用醇钠,季铵碱及 苛性碱等)作用下与α, β-不饱和化合物发生1, 4-加成的反应称为Michael加成反应。
催化量 C2H5ONa + CH2=CHCCH3 C2H5OH O O (H5C2O2C) 2CH CH2CH2CCH3
CH2(CO2C2H5)2
COOC2H5 C2H5ONa PhCH2CO2C2H5 + COOC2H5 COOC2H5 C CO2C2H5 O 178° C
Ph HC
PhCH(COOC2H5)2
Ph HC
COOC2H 5 C CO 2C 2H 5 O
H 3O+
COOH Ph CH C COOH - CO2 O
PhCH2COCOOH
CH 3 O O
2-甲基-1,3-环戊二酮
练习14.2
14.1.2 β-二羰基化合物活泼氢的酸性
• β-二羰基化合物的两个羰基之间的α-氢原子的 酸性,由于其相应阴离子的共振稳定化而大大增 强。 pKa在9~13之间。 在碱的作用下,活性亚甲基上的质子具有酸性,易 脱去形成二羰基碳负离子或烯醇负离子,存在着酮 式和烯醇式的互变异构。
+ NaX
C
OC2H5 + C2H5OH
二烃基乙酰乙酸酯
α-烃基乙酰乙酸乙酯的应用
有机化学:第十四章 羰基α-取代反应和缩合反应

?
?
Kinetic enolate
Thermodynamic enolate Generally:
低温有利于形成动力学产物 高温则主要得到热力学产物
强碱有利于形成动力学控制的少取代烯醇负离子。 酸性有利于形成热力学控制的多取代烯醇。 对于弱碱条件下则影响因素会更多,选择性不高。
O CH3
O
CH3
第十四章
羰基α-取代反应和缩合反应
Reaction at the α-Carbon of Carbonyl Compounds
一定的酸性
O
CC
H 带部分正电 被亲核试剂进攻 加成
羰基化合物的结构特征之一: 羰基C=O可以接受亲核试剂的进攻,发生亲核加成反应、亲 核取代反应。
Nucleophilic Addition to the Carbonyl Group
(PhH的pKa 为~44 )
2、互变异构(Keto-Enol Tautomerism) 中性条件下,羰基化合物存在酮式和烯醇式互变 ——体现了α-H的活性
O C H3C CH3
OH C H2C CH3 0.00025%
[烯醇] 平衡常数: K=
[醛或酮]
酸和碱均可催化这一互变异构过程 酸催化条件下,羰基氧首先质子化,吸电子作用进一步增强,促 进α-H的离去,加速达到平衡
OH O CH2=CCH2COC2H5
R CO
R'
NC H R'' MgX
3、先加成后消去--酸或碱催化 如:胺、
HO H
氨及氨的衍生物
NaO3S H
注意:
以上反应除与有机金属化合物的反应之外, 均为平衡过程 讨论参数:平衡常数
有机化学基础知识点取代反应的机理和规律

有机化学基础知识点取代反应的机理和规律有机化学是研究有机物(含碳元素)的合成、性质和结构等方面的科学。
在有机化学中,取代反应是一种常见的反应类型,它涉及到一个原子或基团取代另一个原子或基团的过程。
了解取代反应的机理和规律是掌握有机化学基础知识的重要一环。
一、取代反应的机理1. 亲核取代反应机理亲核取代反应是指一个亲核试剂(如NH3、Br-等)攻击一个有机化合物中的亲电中心,使其离开并被亲核试剂取代的反应。
亲核试剂中的亲核部分在反应中发挥了重要作用。
亲核取代反应机理主要包括以下几个步骤:(1)亲核试剂攻击:亲核试剂中的亲核部分与有机化合物中的亲电中心发生攻击反应,形成一个中间体。
(2)中间体重排:中间体发生重排反应,使得取代基得以稳定排列。
(3)离去基离去:离去基离开中间体,并与溶剂或离去基之间形成新的化学键。
(4)生成产物:最后生成的产物是一个被亲核试剂取代了一个原有基团的化合物。
2. 亲电取代反应机制亲电取代反应是指一个亲电试剂(如H+, Br+, AlCl3等)攻击一个有机化合物中的亲核中心,使其离开并被亲电试剂取代的反应。
亲电试剂中的亲电部分在反应中发挥了重要作用。
亲电取代反应机制主要包括以下几个步骤:(1)亲电试剂攻击:亲电试剂中的亲电部分与有机化合物中的亲核中心发生攻击反应,形成一个中间体。
(2)中间体重排:中间体发生重排反应,使得取代基得以稳定排列。
(3)离去基离去:离去基离开中间体,并与溶剂或离去基之间形成新的化学键。
(4)生成产物:最后生成的产物是一个被亲电试剂取代了一个原有基团的化合物。
二、取代反应的规律1. Sn1和Sn2反应Sn1反应和Sn2反应是亲核取代反应中的两种常见机制。
Sn1反应是典型的两步反应,第一步是亲电离子形成,第二步是亲核试剂攻击。
Sn2反应是典型的一步反应,在反应中,亲核试剂直接攻击有机化合物中的亲电中心,并与离去基同时发生。
Sn1反应适用于三级卤化合物等离子体生成较容易的化合物;Sn2反应适用于一级卤化合物等亲电离子形成较困难的化合物。
大学有机化学课件第十四章 杂环化合物

邢其毅主编 基础有机化学 下册 高等教育出版社 1983 年 花文廷编著 杂环化学 北京大学出版社 1995 年
青霉素 V
磺胺噻唑(ST)是磺胺类药物的一种,用作肠道消炎药。2-巯基苯并噻唑是一种重要的 橡胶硫化促进剂。
H2N
N
SO2NH
S
磺胺噻唑
N SH
S
2-巯基苯并噻唑
第三节 六元杂环
一、吡啶的结构和性质
1.吡啶的结构 在吡啶分子中,碳原子与氮原子均以sp2杂化,形成了六个σ链,每个原子还均有一个
含一个电子的p轨道,相互交差形成一个闭合的共轭体系,此体系的π电子数为 6,符合 4n+2 规律,故具有芳香性,但是氮原子上还有一个sp2杂化轨道上有一对未成键电子,易与质子 结合,所以吡啶具有碱性。吡啶的pKb=8.75,碱性比苯胺(pKb=9.40)强。
O
CHO Zn4O0-0。CCr2O3
H2 , Ni O
O
呋喃
四氢呋喃(THF)
五、噁唑、噻唑、咪唑和吲哚的性质
N
N
N
O
S
N H
N H
噁唑
噻唑
咪唑
吲哚
(oxazole)
(thiazole)
(imidazole)
(indole)
以咪唑为例来讨论含二个杂原子的五元环的结构,咪唑环上五个原子都采用sp2杂化,
糠醛
糠醛是重要的化工原料,它的主要反应和用途有:
(二) 羧酸衍生物

Nu-:进攻的亲核试剂,即H2O、ROH、NH3、RNH2或R2NH等。
L-:离去基团,即X、-OOCR 、-OR、-NH2、-NHR或-NR2
总的反应速度和两步反应的速度都有关系,但第一步更为重要。酰基中羰基碳原子是sp2杂化,三个σ键是平面形分布。羰基碳上如果连有吸电子基团,将增加羰基碳的正电性,有利于亲核试剂的进攻;反之,如果连有供电子基团,将不利于亲核试剂的进攻。亲核加成生成的中间体,其碳原子为sp3杂化,即四面体结构。如果原来羰基碳原子上连接的基团过于庞大,在四面体结构中就显得过于拥挤而不利于反应进行。上述电子效应和空间效应都将对第一步的反应速度有所影响。第二步反应易否进行,取决于离去基团L-的碱性,碱性越弱,越易离去。羧酸衍生物各离去基团离去的难易次序为:
在有机合成中酯的还原是使羧酸间接转变为伯醇的重要方法,因为羧酸的还原比酯困难。
14.8.3 α-氢化反应
羧酸衍生物分子中的α-氢由于受羰基影响(σ-π超共轭和吸电诱导效应),比较活泼,与醛酮相似,在一些碱性试剂催化下可以发生缩合反应。在有机合成中酯缩合反应应用较多。
由于酯的α-H酸性小于醛酮,也小于酰氯(但大于酰胺),所以酯缩合用的碱是醇钠或其他碱性催化剂(如氨基钠)而不是氢氧化钠的水溶液。酯在强碱作用下发生分子间的缩合反应,称为(Claisen)酯缩合反应,在制备β-二羰基化合物时很有用。
一般克莱森酯缩合反应是在两个相同的酯之间进行。虽然我们可以进行混合酯的交叉缩合反应,即采用两种不同的酯,但产物太复杂,没有实用价值,除非一个酯有α-氢,一个酯没有α-氢,才有制备意义。例如草酸乙酯、苯甲酸酯、甲酸酯等都是不含α-氢的酯,可用于交叉酯缩合反应。这时产物比较纯。
己二酸酯和庚二酸酯在醇钠作用下主要是发生分子内的酯缩合反应,称为狄克曼(Dieckmann) 缩合反应,生成环状的β-酮酸酯。
教学重点:苯环上亲核取代反应、芳香族重氮盐的性质和应用、胺的

P h N H 2
2、碱性还原:芳香族硝基化合物在锌粉和氢氧化钠条件
下,可以被还原成氢化偶氮苯及其衍生物
PhNO2
NaOH Zn
PhNHNHPh
H3C
NO2 NaOH Zn
CH3
NHNH CH3
3、苯环上的亲核取代反应
Cl NO2
OHH2O
OH NO2
1、历程
C l
C l N u
N O 2 N u-
R N H 2
1、制备:含有的-H羰基化合物在TsOH条件下与二级胺作用
O
O
O
TsOH
+
N
N
H
2、应用:活化羰基的邻位,引入烷基
3、例题从己二酸合成
O
O
N
1)RX
2)H3O+
CH2Ph
O R
14.3 重氮和偶氮化合物
1、所连基团均为烷基时为重氮化合物
P hNNP h
C H 3 C H 3 H 3 CCNNCC H 3
C H 3 C H 3
2、其中一个为烃基时为偶氮化合物
NN
P hNNP h
重氮甲烷
C H 3 C H 3
H 3 CCNNCC H 3
NN
C H 3 C H 3
氯化重氮苯 苯基重氮磺酸钠
14.3.1 芳香族重氮化反应
芳香族的胺与亚硝酸作用可以在低温下得到芳香族的重氮盐
ArNH2 + NaNO2 HCl ArN2+Cl-
N H 2
+H 2S O 4
N +H 3H S O 4 -
N H 2
180-190oC
4、硝化反应
有机化学第十四章-二羰基化合物

有机化学第十四章-二羰 基化合物
第十四章 -二羰基化合物
(4):分子内酯缩合——成环
作业5(4)
成环
(3)酮与酯在乙醇钠作• 常用丙酮或其他甲基酮和酯缩合来合成 -二酮。
• 注意:与羟醛缩合反应不同(稀碱条件下,生成 ,-不饱和醛)。P286
(4)克诺文格尔缩合反应 *——制备,-不饱和酸
• 醛、酮还可以和-二羰基化合物(一般是丙二酸及 其衍生物),在弱碱(氨或胺)作用下缩合:
•烯醇负离子的共振式:
• 由于有烯醇式的存在,所以叫烯醇负离子;又由于亚 甲基上也带有负电荷,反应往往发生在此碳原子上, 所以这种负离子也称为碳负离子。
14.2 -二羰基化合物碳负离子的反应
主 要
• 碳负离子的反应类型: (1)与卤烷反应:即羰基碳原子的烷基化或烷基化反应 (2)与羰基化合物反应:常称为羰基化合物和-二羰基化合 物的缩合反应;当与酰卤或酸酐作用可得酰基化产物; (3)与, -不饱和羰基化合物的共轭加成反应或1,4-加成 反应.
与“三乙”可再 反应合成二酮!
(5) 与酰卤或酸酐作用——羰基亲核加成-消除反应
例:与酰氯的反应(得到酰基化产物)
NaH
•在 非 质 子 溶 液中进行
• 酮式分解得:-二酮
• 在合成上乙酰乙酸乙酯更多的用来合成 酮类。(合成羧酸时,常有酮式分解)
补充7
与酰卤作用
• 酮式分解得:-二酮
补充8
第十四章有机合成与相关有机反应小结介绍

1o 醇 2o 醇(R' = H) 3o 醇
NaOEt / HOEt
CO2Et O CH3
Michael 加成,分子内醇醛缩合。
5. 己二酸和庚二酸受热后则同时发生失水和脱羧, 生成:
五元环酮和六元环酮
O C OH C OH O △ O H2C H2C H2C H2 C H2 C O C OH C OH O △ O
H2C H2C
H2 C H2 C
O RMgBr BrZnCH2 OEt
酰氯、酸酐、酯
C C
二、 成环反应
1. 狄尔斯-阿尔德(Diels-Alder)反应
G W + G G G G
(六元环)
G W
W
2. 分子内傅瑞德尔-克拉夫茨(Friedel-Crafts)反应 (五元、六元环的合成)
Cl AlCl3
O G O O AlCl3 G HO
SN2
O (1) R C C Na (2) H 2O R' R
高级炔烃
OH C C CH2CH R'
SN2
b-炔基醇
炔基负离子
(1) R'
O C
OH R"(H) R C C C R"(H)
亲核试剂
(2) H2 O
亲核加成
R' a-炔基醇(炔丙型醇)
有机化学第14章 β-二羰基化合物
工业上乙酰乙酸乙酯可用二乙烯酮与乙醇作用制得:
乙酰乙酸乙酯为无色具有水果香味的液体,沸点181℃(稍有分解),
微溶于水,可溶于多种有机溶剂。乙酰乙酸乙酯对石蕊呈中性,但能 溶于稀氢氧化钠溶液。它不发生碘仿反应。
2.乙酰乙酸乙酯的性质
乙酰乙酸乙酯可在稀碱(或稀酸)的作用下,水解生成乙酰乙酸,
后者在加热的条件下,脱羧生成酮。这种分解称为酮式分解,可用
键形成一个稳定的六元环,另一方面烯醇式羟基氧原子上的未共用
电子对与碳碳双键和碳氧双键是共轭体系,发生了电子的离域,降 低了分子的能量的缘故。
酮—烯醇互变异构现象在羰基化合物中较为普遍,但它们的烯
醇式含量是不同的。
(在室温条件下)
14.2 乙酰乙酸乙酯的合成及应用
1.乙酰乙酸乙酯的合成
乙酰乙酸乙酯可用Claisen酯缩合反应合成。乙酸乙酯在强碱 (如乙醇钠、金属钠等)的催化下缩合,然后酸化,即可得到乙酰乙 酸乙酯。
曾讨论过烯醇式和酮式的互变异构现象。
但β-二羰基化合物的烯醇式结构却具有一定的稳定性。如β-
丁酮酸乙酯(又称为乙酰乙酸乙酯,俗称三乙),通常是以酮式和烯
醇式两种异构体的混合物形式存在的。
这种能够互相转变的两种异构体之间存在的动态平衡现象就 称为互变异构现象。
乙酰乙酸乙酯的两种异构体,可在较低的温度下,用石英容器精馏
反应式表示为:
另外,乙酰乙酸乙酯如与浓碱共热,则α-和β-碳原子之间的键
发生断裂,生成两分子乙酸盐。一般β-羰基酸都发生此反应,这种
分解称为酸式分解。
乙酰乙酸乙酯分子中亚甲基上的氢原子比较活泼,与醇钠等强碱
作用,可以生成钠的衍生物,后者可与卤代烷发生取代反应,生成烷
基取代的乙酰乙酸乙酯;在需要时还可以生成二烷基取代的乙酰乙酸 乙酯,使用更强的碱如叔丁醇钾替代乙醇钠进行反应效果更好。
第十四章含氮有机化合物

第一胺
第二胺 第三胺
季胺盐
特点:a. 产物是混合物给分离提纯带来了困难。 b. 卤代烃一般用伯卤代烃。 c. 控制条件:使用过量的氨,则主要制得伯胺;
使用过量的卤代烃,则主要得叔胺和季铵盐。
4. 酰基化
O H3C C X +
RNH2
R2 NH R3 N
RNHCOCH3
R2NCOCH3
(-) H+
+
第十四章 含氮有机化合物
硝基化合物
分子中含有—NO2官能团的化合物统称为硝基化合物。 硝基化合物可看成是烃分子中的一个或几个氢原子被硝基 取代的结果。
一、分类
按烃基不同
脂肪族硝基化合物,如: CH3NO2
芳香族硝基化合物,如:
NO2
按硝基数目
一硝基化合物 多硝基化合物,如: O2N
CH3 NO2
一个杂化轨道中含有孤对电子。
N
H
H
H
氨的结构
氨:键长/nm N-H 0.1008
键角 ∠HNH 107.3°
N H
H3C H
甲胺的结构
甲胺:键长/nm
N-H 0.1011 N-C 0.1474
键角
∠HNH 105.9° ∠HNC 112.9°
N CH3 H3C CH3
三甲胺的结构
三甲胺:键长/nm N-C 0.147
键角 ∠CNC 108°
① 形状为锥形
② 具有孤对电子是亲核试剂 ③ 若N原子上连有三个不同基团,是手性分子, 理论上应存在对映体。
R1
N
N
CH3 H3C
C2H5 H
H C2H5
R2 R3
④芳胺
N
第14章 β-二羰基化合物(答案)

1第十四章 β-二羰基化合物【重点难点】1.乙酰乙酸乙酯(1) 熟练掌握乙酰乙酸乙酯的制备 Claisen 酯缩合法。
CH 3C O CH 2OOC 2H 53+25CH 3COOC 2H 52①②注意:①反应条件:强碱性条件(如RONa );②反应发生在α-碳原子上,原料为碳原子数>3的一元酸生成的酯时, 产物有支链;RCH 2C O CH C OOC 2H 5RCH 2C OOC 2H 53+252①③分子内酯缩合——Dieckmann 反应。
①②OC OOC 2H 5CH 2CH 2CH 2CH 2C OOC 2H 5C OOC 2H 53+C 2H 5ONa(2) 熟练掌握乙酰乙酸乙酯在合成上的应用主要用于合成甲基酮、二酮、酮酸、环酮等。
②①①CH 3C OCH RR'CH 3C OCH 2RCH 3C O C R'COOH CH 3C OCH COOH 稀H +OH -+-CH 3C O C R'C OOC 2H 5C 2H 5ONa (or NaH)C 2H 5ONaCH 3C O CH C O OC 2H 5CH 3C O CH 2OOC 2H 5RXR'X①①②②2.丙二酸二乙酯(1) 熟练掌握丙二酸二乙酯的制备2CH 3COOH 2CH 2COOH -CH 2COO -NaCNCH 2COO-24CH 3CH 2OH CH 2(COOC 2H 5)2(2) 熟练掌握丙二酸二乙酯在合成上的应用主要用于制备乙酸的α-烷基或 -二烷基取代物,二元羧酸、环烷酸。
①②RXC 2H 5ONa R'X-+OH -+稀C 2H 5ONa CH(COOH)2R R CH 2COOHC(COOC 2H 5)2R R'C(COOH)2R R'CHCOOHRR'CH 2(COOC 2H 5)2①①①②②②R CH(COOC 2H 5)2▲3.Michael 加成掌握Michael 加成规律,能写出产物的结构。
第十四章羰基α–取代反应和缩合反应--

一、a- 氢的酸性及烯醇、烯醇负离子形成
3. Formation of enolate LDA
---二异丙基氨基锂 lithium diisopropylamide ---强碱,但是是弱亲核试剂 ---可以令羰基化合物定量转化为烯醇 ---从丁基锂制备
一、a- 氢的酸性及烯醇、烯醇负离子形成
3. Formation of enolate
——弱碱NaOH,RONa作用下,反应可逆进行,烯醇负离 子含量低
——强碱如LDA作用下,可以定量地转化为烯醇负离子
O + OH
pKa=17
O + H2O
<0.1% pKa=15.7
O +
pKa=17
CH(CH3)2 LiN
CH(CH3)2
OLi +
~100%
CH(CH3)2 HN
CH(CH3)2
pKa=35
O CH3
O CH3
B O
CH3
H
O
O
CH3
CH3
动力学控制产物
热力学控制产物
强碱有利于形成动力学控制的少取代烯醇负离子。 酸性有利于形成热力学控制的多取代烯醇负离子。 对于弱碱条件下则影响因素会更多,选择性不高。
LDA
动力学控制产物 热力学控制产物
O
LDA THF -78o
OLi +
80
OLi 20
动力学控制产物 热力学控制产物
一、a- 氢的酸性及烯醇、烯醇负离子形成
例题与习题: 指出下列每一对化合物,哪一对是互变
异构体,哪一对是共振极限式。如果是互变异构体, 请表示出平衡有利于哪一方?
(1) CH3CH2CH2CHO
有机化学14章-二羰基

-
OC2H5
O
-
CH2 C OEt + C2H5OH pKa = 15.9
O
O
-
O
2) H3C
C OC2H5
O-
+
-
CH2 C OEt
H3C C CH2 C OC2H5 OC2H5
O
O
O
3)H3C C CH2 C OC2H5 OC2H5
O O
H3C C CH2 C OC2H5 + C2H5O
pKa = 11
生成两分子的乙酸盐。一般β-羰基酸都发生此反应,这种 分解称为酸式分解
O H3C C
O CH2 C OC2H5 KOH, EtOH
2CH3COO
-
H+
2CH3COOH
二、乙酰乙酸乙酯的合成及应用
O H3C C CH2
O C OC2H5
成酸水解
成酮水解
烃化和酰化
O H3C C CH2 O H3C C CH O C OC H + NaOEt 2 5 O C OC H + RX 2 5 H3C H3C O C CH R O C CH O C OC2H5 + H3C O
其它含活泼亚甲基的化合物
二、乙酰乙酸乙酯的合成及应用
1. 乙酰乙酸乙酯可用Claisen 酯缩合反应合成
O
2 CH3COC2H5
1) NaOC2H5/C2H5OH
O
O
2) CH3COOH, H2O
H3C C CH2 C OC2H5 + C2H5OH
反应机理
O
O 1) CH3COC2H5 pKa = 24.5
O H3C C CH O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、a - 氢酸性与烯醇、烯醇负离子形成
3、 Keto-Enol Tautomerism (互变异构)
中性条件下,羰基化合物存在酮式和烯醇式互变
——体现了a-H的活性
一、a - 氢酸性与烯醇、烯醇负离子形成
3、 Keto-Enol Tautomerism (互变异构)
酸和碱均可催化这一互变异构平衡的达到 ——碱性条件下,碱夺取a -H形成烯醇负离子
O C C H
BH2
C
O C
C 烯醇负离子
O C
烯醇负离子由于羰基的共轭作用得以稳定
羰基化合物的结构与反应特征
——烯醇中的C-C双键接受亲电试剂进攻,发生a –卤代反应; 醛酮、羧酸和酰卤可以发生该反应 ——烯醇负离子作为亲核试剂,进攻卤代烃的缺电子碳,则 发生亲核取代反应;进攻羰基碳则发生亲核加成反应;
一、a - 氢酸性与烯醇、烯醇负离子形成
3、 Keto-Enol Tautomerism (互变异构)
酸催化条件下,羰基氧首先质子化,吸电子作用进一 步增强,然后脱去a –H形成烯醇
一、a - 氢酸性与烯醇、烯醇负离子形成
例题与习题 指出下列每一对化合物,哪一对是互变异 构体,哪一对是共振极限式。如果是互变 异构体,请表示出平衡有利于哪一方?
Y C N
R1 R2
C O
Ph3P CR1R2
C C
C O Y
Nu
C O Nu
+
Y
羰基化合物的结构与反应特征
羰基化合物的结构特征之二: ——羰基C=O的吸电子作用使得a-H具有明显 的酸性,在碱性条件下可以离解,生成烯醇 负离子,从而成为亲核试剂,进攻羰基碳或 卤代烃,发生亲核加成反应、亲核取代反应。
O
OH O C C C
- H2O
O C C C
C
C
O
加成-缩合
O
共轭加成
-羟基酮
a, -不饱和酮
Aldol-缩合 Michael 加成
O 1, 5-二羰基化合物 Robinson成环
本章主要内容
一、a - 氢的酸性与烯醇、烯醇负离子的形成
二、 a-卤代反应
三、 Aldol加成和Aldol缩合
一、a - 氢酸性与烯醇、烯醇负离子形成
2、Formation of Enolate 酸性条件下将形成烯醇,而不是烯醇负离子
O CH3 O CH3
B
O CH3 H
O CH3
OH CH3
动力学控制产物
热力学控制产物
强碱有利于形成动力学控制的少取代烯醇负离子。 酸性条件则有利于形成热力学控制的多取代烯醇 弱碱条件下,影响因素会更多,选择性不高。
第十四章
Reaction at the a - Carbon of Carbonyl Compounds
羰基α–取代反应和缩合反应
羰基化合物的结构与反应特征
羰基化合物的结构特征之一: ——羰基C=O,可以接受亲核试剂的进攻,发 生亲核加成反应、亲核取代反应。
C O
Nu E
C OE Nu
C O
H2NY
O C O C
R- C l
C
C 烯醇负离子
亲核取代 O C 亲核加成
C R
O C
烷基化反应
OH O C C C
Aldol-反应 羟醛反应
X-X
亲电取代
-羟基酮
O C C X
a卤代反应
羰基化合物的结构与反应特征
——烯醇负离子作为亲核试剂,发生亲核加成的产 物可以脱水缩合形成a, -不饱和羰基化合物;烯醇 负离子还可以与a, -不饱和羰基化合物反应生成1, 5-二羰基化合物。 1, 5-二羰基化合物进一步发生分 子内缩合就形成环状结构。
1. Aldol addition and aldol condensation
O RCHCR O RCH2CR an electrophile
a nucleophile
-hydroxyaldehyde Aldol addition -hydroxyketone
Aldol condensation
Aldol condensation
三、Aldol加成和Aldol缩合
1. Aldol addition and aldol condensation
Mechanism for the aldol addtion
三、Aldol加成和Aldol缩合
1. Aldol addition and aldol condensation
COOH SOCl2
COCl
EtOH
COOEt
(CH3)2CHCH2COOH
PBr3
(CH3)2CHCH2COBr
EtOH
(CH3)2CHCH2COOEt
(CH3)CHCH2COOH
(CH3)CHCHCOOH Br P(cat.)
Br2
EtOH H+
(CH3)CHCHCOOEt Br
三、Aldol加成和Aldol缩合
LDA
O
LDA THF -78 C
o
OLi +
OLi 99:1
动力学控制产物 热力学控制产物
O OLi + OLi 80:20
LDA THF -78oC
—— low temperature, give kinetic enolate —— high temperature, give thermodynamic enolate
二、a – 卤代反应
(1)Aldehyde and ketone二、a Nhomakorabea– 卤代反应
(1)Aldehyde and ketone 碱催化机理:
O H H3C C CH2
Ⅰ
OH
慢
O H3C C CH3
O H3C C CH2
X-X
O H3C C CH2X
Ⅱ
-X
比较I和II,由于卤素的吸电子作用,II中连卤素碳上氢 的酸性增强,更容易形成烯醇负离子,反应难以停留 在一卤代阶段,将进一步发生多卤代反应。 如果原料是甲基酮,则将发生进一步反应,并断键生成 卤仿。
O (1) CH3CCH2CH3
O O
OH CH2=CCH2CH3
OH O
OH CH3C=CHCH3
(2) CH3CCH2COC2H5 OH O
CH2=CCH2COC2H5 O OH
CH3C=CHCOC2H5
CH3CCH=COC2H5
一、a - 氢酸性与烯醇、烯醇负离子形成
4、烯醇硅醚的形成 LDA作用下形成的负离子与三甲基氯硅烷反 应生成烯醇硅醚
(1) CH3CH2CH2CHO CH3CH2CH=CHOH
(2) CH3CH2CHCH=CH2
CH3CH2CH=CHCH2
(3) CH3CH2CH2N
O O
CH3CH2CH=N
OH O
酮式
(4) O
烯醇式
OH
一、a - 氢酸性与烯醇、烯醇负离子形成
例题与习题 预测下列每组化合物,哪一个烯醇负 离子是主要的(动力学控制产物)
二、a – 卤代反应
(1)Aldehyde and ketone
O H OH H3C C CH2X Ⅱ O H3C C CHX2 Ⅲ O H3C C CX3 Ⅳ
OH OH
O H3C C CH2X
O H3C C CH2
X-X -X
O H3C C CX2
O H3C C CX2
X-X -X
O H3C C CX3 OH + CHX3
Br2 ( excess) NaOH Br2 ( 2 mol ) NaOH
(CH3)3CCOOH + O Br Br
CHBr3
CH2CH3
(2) 羧酸及酰卤 Hell-Volhard-Zelinski reaction (HVZ reaction)
二、a – 卤代反应
二、a – 卤代反应
例题与习题 完成下列反应
O (1) CH3CCH2CH3 CH3 (2) RONa O RONa O-Na+ CH2=CCH2CH3 CH3 O Na
+
O-Na+ CH3C=CHCH3 CH3 RONa O-Na+
一、a - 氢酸性与烯醇、烯醇负离子形成
例题与习题 预测下列每组化合物中,哪一个烯醇结构 较稳定,即为热力学控制烯醇?
例题与习题 请写出下列反应的产物
O
OH CHO
-
CHO
CHO
H OH
OHCHO
OH
CHO
CHO
CHO
+
O H3CC
EtONa 20 C
0
CH CHCO
三、Aldol加成和Aldol缩合
2. The mixed aldol addition
When one of the aldehyde or ketone has no a-H, and with one excess starting material, one product could be mainly obtained.
O H C C H LDA C O C C 烯醇负离子 (CH3)3SiCl OSi(CH3)3 C O C
C
二、a – 卤代反应
烯醇或烯醇负离子具有C-C双键,可以接受亲电试剂进 攻,发生亲电取代反应。酸碱催化机理有所不同。
二、a – 卤代反应
(1)Aldehyde and ketone 酸催化下 —— 得一卤代物。 —— 反应性:RCOCHR2 > RCOCH2R > RCOCH3 碱催化下 —— 得多卤代物 —— RCOCH3 and RCH(OH)CH3发生卤仿反应 —— 反应性: RCOCH3 > RCOCH2R > RCOCHR2
