第十一章氨基化及芳胺基化
医用有机化学第11章_胺-2011

(二)胺的命名 比较复杂的胺,常以烃类作母体,氨基作为取 代基来命名。例如:
CH3-CH-CH2-CH-CH3 NH2 CH3 CH3CH2-CH-CH2CH2CH2CH3 NHCH2CH3
2-氨基-4-甲基戊烷
3-( N-乙氨基)庚烷
(二)胺的命名 二元胺的命名:
NH2CH2CH2NH2 NH2(CH2)6NH2
内容提要:
一、胺的分类与命名
二、胺的结构
三、胺的物理性质(自学)
四、胺的化学性质
五、苯丙胺类药物与生源胺的概念(自学)
六、重氮盐与偶氮化合物
七、重氮盐的反应
一、胺的分类与命名 (一)胺的分类 胺可以看作是氨的烃基衍生物,根据氨分子 中氮上氢原子被烃基取代的数目分为: NH3 氨 NH4Cl RNH2 伯胺 NH4OH R2NH 仲胺 R4N+XR3N 叔胺 R4N+OH
(一)胺的碱性与成盐
一些胺(氨)在水溶液中的pKb值
NH3 (CH3)2NH CH3NH2 (CH3)3N pKb 4.76 3.27 3.38 4.21 C6H5NH2 (CH3CH2)2NH (CH3CH2)3N CH3CH2NH2 pKb 9.38 3.06 3.25 3.36
在水溶液中胺的碱性强弱次序为: 1° 脂肪胺(2°> 3°) > 氨 > 芳胺
CH3NH2·HCl
甲胺盐酸盐 (盐酸甲铵) (CH3)4N+Cl氯化四甲基铵 tetramethylammonium
CH3CH2NH2·AcOH
乙胺醋酸盐 (醋酸乙铵) (CH3)3N+(C2H5)OH氢氧化三甲基乙基铵 trimethylethylammonium
chloride
hydroxide
胺基化工艺考试知识点

胺基化工艺考试知识点一、判断题1、经过变电站母线或变压器向下一个变电站输送的功率,称为穿越功率。
O(V)2、故障情况下,1OkV环网采用合环运行方式。
()(x)3、电缆敷设过程中应有良好的联动控制装置以保证整个过程匀速牵引。
()(。
)4、室内电气装置或设备发生火灾时应尽快拉掉开关切断电源,并及时正确选用灭火器进行扑救。
()(V)5、安装有保护器的单芯电缆通过过负荷电流后,定期检查阀片有无击穿或烧熔现象。
()(X)6、距罐壁15m范围内的消火栓不计入罐区可用数量。
(√)7、金属储罐避雷装置接地电阻冲击电阻不大于10欧姆。
(√)8、多个安全阀共用一条进口管道时,进口管道的截面积不小于这些安全阀的进口截面积总和。
(V)9、减压阀是指通过阀瓣的节流,将进口压力降至某一需要的出口压力,并能在进口压力及流量变动时,利用介质本身能量保持出口压力基本不变的阀门。
(X)10、用液氨进行胺基化反应的缺点是:操作压力高,过量的液氨较难再以液态氨的形式回收。
(√)11、电缆固定用部件不得采用铁丝扎带。
O(V)12、测温光纤全线贯通,单点损耗小于0∙02dB°()(√)13、冷缩电缆终端的收缩依靠低温下的热胀冷缩收缩。
()(χ)14、工程竣工验收完成后半个月内,施工单位必须将工程资料整理齐全送交监理单位和运行单位进行资料验收和归档。
()(χ)15、电力电缆排管敷设时,应采用金属护套电缆。
()(x)16、说明送电电缆在电网中的作用并标志送、受电端位置的图纸,称为系统接线图。
()(√)17、可燃性气体、蒸汽与空气或氧气形成混合物发生的爆炸,称为气体混合物爆炸。
(√)18、当发生化学品泄漏事故,对于气体泄漏物,可以采取喷雾状水、释放惰性气体等措施,降低泄漏物的浓度或燃爆危害。
(√)19、乙睛是一种具有芳香气味的无色液体。
该物料具有毒性很容易燃烧。
(√)20、液氨储存区设置可燃气体报警仪(X)21、干粉灭火器材压力指示处于红区时还可以继续使用。
2023年胺基化工艺参考题库含答案7

2023年胺基化工艺参考题库含答案(图片大小可自由调整)第1卷一.全能考点(共50题)1.【判断题】减压蒸馏塔设置塔釜真空度低限报警。
2.【判断题】在进行离心过滤时,若离心机转动困难或无法转动,可用手帮其转动。
3.【判断题】热不可能自动地、不付代价地从低温物体传到高温物体。
4.【单选题】《化学品安全标签编写规定》GB15258-2009于()起实施。
A、2010年5月1日B、2000年5月1日C、1999年1月1日5.【判断题】乙炔瓶的皮重是钢瓶、多孔填料、瓶阀的质量与溶剂的规定充装量之和。
6.【单选题】安全阀多次开启,其整定压力的偏差值是()。
A、整定压力偏差B、出口压力偏差C、开启压力偏差7.【判断题】根据《灭火器维修与报废规程》(GA95-2007)要求,水基型灭火器报废年限是6年。
8.【判断题】检修活板门如果门上装有铰链,应属于不能脱钩的型式。
9.【单选题】可燃液体立式储罐距防火堤内堤脚线不应小于罐壁高度的()。
A、一半B、三分之一C、三分之二10.【单选题】家畜类原料常用的清洗加工方法有:里外翻洗法、盐醋搓洗法、热水烫洗法、刮剥洗涤法、()和清水漂洗法等。
A、灌醋浸渍法B、灌碱去脂法C、灌酒去腥法D、灌水冲洗法11.【单选题】动土作业是指挖土、打桩、钻探、坑探、地锚入土深度在()。
A、0.5m以上B、0.8m以上C、1m以上12.【判断题】有毒气体、蒸气是以能达到“立即危及生命或健康的浓度(IDLH)”处作为泄漏发生后最初30min内的急性中毒区的边界,或通过气体监测仪监测气体浓度变化来决定扩散区域。
13.【判断题】对机械作用敏感的物质,应轻取轻放、避免震动或摩擦。
14.【单选题】抢险灭火过程的消防水,污染成分复杂,任其汇入()管网,将严重污染地下水和地表水。
A、雨水B、污水C、生活水15.【单选题】携气式呼吸防护器包括氧气呼吸器、化学生氧呼吸器、液态氧呼吸器和()。
A、供气式全面罩B、空气呼吸器C、过滤式呼吸器16.【单选题】2005年吉化“11.13”双苯厂爆炸事故,造成()污染。
第一章有机合成反应理论介绍

σ络合物和Π络合物确实能够稳定的存在,有 些稳定的σ络合物可以制备,并能在低温条件 下分离出来:
(3)亲电取代反应历程
芳香族亲电取代的两步反应历程可以简单表示 如下:
第一步
σ络合物
第二步
芳香族亲电取代在生成σ络合物、 Π络合物以 及最终产物的过程中,能量变化如图所示:
σ络
合
Π络
物
合物
加成产物 取代产物
诱导效应一般以氢为比较标准,诱导效应 的强弱可以通过测量偶极距得知或通过其 他参数的测量来估量。下表列有不同诱导 效应的各种取代基。
(B)共轭效应 是由共轭体系内取代基引起的共轭 体系的电子云密度的变化,因而对分子的偶极矩 产生影响。取代苯中的取代基的p轨道与苯环上 碳原子的p轨道相互重叠,电子发生较大范围的 离域使整个分子的电子云密度分布发生变化,即 可产生共轭效应。重叠得越多,共轭效应越强。 凡取代基通过共轭效应供给苯环电子的,称为给 电子共轭效应(+C),如NH2、Cl、0H、OR、 OCOR等;凡取代基移走苯环电子的,称为吸电 子共轭效应(-C),如NO2、CN、COOH、 CHO、COR等。Ar取代基具有两种效应。
影响产物异构体比例的因素除了第一个 取代基的性质外,还有其他一些因素,如反 应温度、空间效应、催化剂、亲电试剂、反 应的可逆性等对取代反应的速度和进入苯环 的位置均有一定的影响。
(A)反应温度 升高温度可以促使磺化和 C—烷基化成为可逆反应。温度对不可逆亲电 取代产物异构体比例也有影响,以硝基苯在 不同温度下的再硝化为例,升高温度 ,主要 产物间二硝基的生成量将减少,见表:
SN1反应能量变化图
1.1.2 影响反应的因素
(1)烷基结构 电子效应 SN1
(2)立体化学和重排
芳胺类药物的分析专
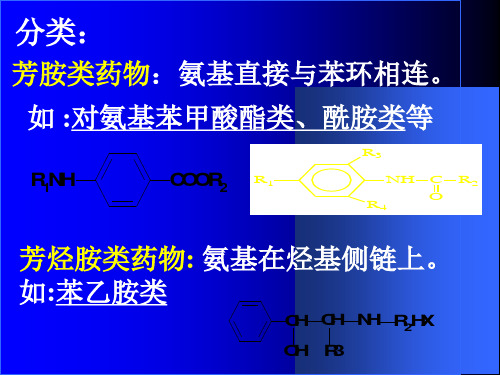
典型UV参数 lmin lmax ls Almax E1cm 1%
(4)UV
盐酸布比卡因 ChP(2005) [鉴别] 取本品,精密称定,按干燥品计算,加mol/L盐酸溶液制成每1ml中含mg的溶液,照分光光度法(附录ⅣA)测定,在263nm与271nm的波长处有最大吸收;其吸收度分别为~与~。
⑤ 判断 在254nm波长紫外灯下观察,供试品溶液如显杂质斑点,与对照溶液的主斑点比较,不得超过其大小与颜色。
(3).对氨基酚 制备中乙酰化不完全或贮存不当发生水解都能引入对氨基酚 ☆检查原理: 对氨基酚在碱性条件下,与亚硝基铁氰化钠作用,生成蓝色络合物,与对照液比较判断对氨基酚的限量。
检查方法 对照法
⑤ 与重金属离子反应
a.与铜离子的反应
b.与钴盐反应
(1)重氮化-偶合反应 具有潜在的芳伯氨基,水解或还原后,可发生重氮化-偶合反应。 例如:对乙酰氨基酚
对乙酰氨基酚 ChP(2005) [鉴别] 取本品约g,加稀盐酸5m1,置水浴中加热40分钟,放冷;取m1,滴加亚硝酸钠试液5滴,摇匀,用水3ml稀释后,加碱性β-萘酚试液2m1,振摇,即显红色。
等可使氨基的碱性降低,重氮化反应速 度加快。
A2. 当在苯环上有供电基时, 则使反应速度降低。如 等。
供电基能使氨基碱性增强,这样氨 基成盐的机会就增大,游离芳伯胺 的浓度就减小,所以反应速度就慢。
(1)K1
(2)ቤተ መጻሕፍቲ ባይዱ2
∵ K1 ≈ 300 K2 加入KBr,可增大被测溶液中NO+的浓度,所以能加快重氮化反应速度
苯乙胺类药物的基本结构
*
具有脂烃胺侧链,属于芳烃胺类药物。 多数在苯环上有1~2个羟基取代基。
有机化学(高鸿宾 第四版)第九章__氨基化

NH3
ArCOONH2
H2O
ArCONH2 NaOH
H2 cat R1
NaBrO
ArNH2
(4)还原胺化法
R1 O R2(H)
+
NH2R R2(H)
NHR
9.1 概述
2.氨基化反应的目的
制备脂肪族伯、仲、叔胺及季铵盐
ClCH2CH2Cl +
N(C2H5)3 + ClCH2
H2O NH3 ~2MPa
(1)液氨 (1)液氨
氨的物性: ①常温常压下是气体 ②压力下可溶解许多液态有机化合物
适用范围: ①有机化合物在反应温度下是液态 ②氨解反应要求在无水有机溶液中进行 缺点: ①操作压力高, ②过量的液氨较难再以液态氨的形式回收。
Cl CN NH2 NH3(liquid) CN
液氨主要用于需要避免水 解副反应的氨基化过程。
•③减少对设备的腐蚀
HX + NH3
腐蚀
NH4X
3.温度
温度升高→反应速度加快 氧化副反应速度加快; NH3的溶解度降低,反应压力增加。 有时为了加快氨解速度或为了减少卤基水解副反应,需要使用 浓度更高的氨水。但使用浓度更高的氨水时,在相同的温度下, 压力要提高很多。如下表: 温度/oC 10 20 压力/Mpa
CH3 CH CH3
• •
间硝基甲苯的还原法的缺点:在甲苯的一硝化产物 中,间位体的含量只有4%左右, 间甲酚的氨解法:原料间甲酚是由间甲基异丙苯的 氧化酸解法制得。
二.萘酚衍生物的氨解
机理
1.Bucherer(布赫尔)反应
H H C=C加成 O H H H SO3NH4 酮式加成物 H H C=O加成 OH 2 NH SO3NH4 H H H SO3NH4 胺式加成物 -2NH4HSO3 H H OH SO3NH4 醇式加成物
6.2 芳胺基化

+
O
Br
二、芳香族羟基物的胺基化
如:2-萘酚与苯胺及少量苯胺盐酸盐在催 化剂HCl的存在下,于200-260℃ 常压回 ℃ 流,可得到N-苯基-2-苯胺(防老剂J)
三、芳胺的芳胺基化
反应需在酸性催化剂存在下进行,常用的酸 性催化剂有HCl、H2SO4、NaHSO3等。 性催化剂有HCl、H2SO4、NaHSO3等。 若是两种不同的芳胺进行氨基化反应,应使 沸点较低的芳胺过量,以缩短反应时间,促 使另一种芳胺反应完全。
第二节 芳胺基化
芳胺基化是指芳胺与卤化物、酚类、 芳磺酸、芳胺等含活泼基团的芳香族化合 物作用,制取二芳胺的反应。
一、芳香族卤化物的芳胺基化ห้องสมุดไป่ตู้
反应中常加入缚酸剂氧化镁、碳酸钠、 乙酸钠等,以中和酸性
对于不太活泼的芳胺,则加一 价铜盐或铜粉催化,又称乌尔曼反 应。
O NH2 SO3Na NH2 O Na2CO3 CuCl O NH NH2 SO3Na
NH2 KOH,230
NH
+
HO3S
NH2
NH2 H2SO4
HO3S
NH
+
+
NH3
四、芳环上磺酸基的芳胺基化 杂环和蒽醌环上磺酸基比较容易置 换,苯和萘环上较难置换,在氢氧化钠 和氢氧化钾存在下,不断除去反应生成 的水,才可实现苯和萘环上磺酸基的芳 胺基化。加入KF、KCl、Na2CO3或K2CO3, 可加快反应速率。
SO3Na
芳香胺药物的分析

O S O
CH3CONH
NHCOCH3
醋氨苯砜
CH3
NHCOCH2N(C2H5)2 CH3
HCl
盐酸利多卡因
CH3 NHCO CH3
C4H9 N HCl
盐酸布比卡因
2、主要化学性质
(1)水解后显芳伯氨基特性:本类药物均具
有芳酰氨基结构,在酸性溶液中可水解为具芳
伯氨基的化合物,并显芳伯氨基特性反应。 水解反应的速度与分子结构有关: 对乙酰氨基酚(对位取代)> 贝诺酯(对位取代)> 利多卡因、布多卡因(邻位2个取代基)
HCl 、
3、盐酸丁卡因 :无重氮化反应,分子中 有芳香第二胺结构可与亚硝酸钠作用, 生成 N - 亚硝基化合物。
CH3(CH2)3NH COOCH2CH2N(C2H5)2 HCl
盐酸丁卡因 NaNO2 (乳白色)
H
(二)三氯化铁反应 对乙酰氨基酚的结构中具有酚羟
基,与三氯化铁试液作用,即显蓝 紫色。
盐酸利多卡因
对氨基苯甲酸酯类
黄色 H+ 硝酸汞 Δ 红或橙黄色
(四)水解产物的反应
1、盐酸普鲁卡因的鉴别试验
盐酸普鲁卡因 NaOH
普鲁卡因 油状物
对氨基苯甲酸钠 二乙氨基乙醇 (使湿润的红色石蕊试 纸变兰色)
对氨基苯甲酸钠 HCl 对氨基苯甲酸(白色 )
27.28mg的C13H20N2O2· HCl。
H2N
COOCH 2CH 2N(C 2H5)2 + NaNO2 + 2HCl
N
N Cl
COOCH 2CH 2N(C 2H5)2
+ NaCl + 2H2O
氨解反应

6.1 概述
1. 定义:
含各种不同官能团的有机化合物在胺化剂的作用下 生成胺类化合物的过程。 利用胺化剂将已有取代基置换成氨(或芳氨基)的反 应Ar(R)-NH2
+
HY
Y= -X、-OH、-NO2、-SO3H、-CO-、Ar-H。
2. 胺化剂 液氨、氨水、尿素、氨盐(NH3的来源)及有 机胺。
[NH3] ↑
T ↑ (B)搅拌
}
溶解度 ↑
反应特点:非均相;放热反应。
间歇式: 机械搅拌。 连续式: 管道中流体呈湍流状态。
(4)温度
(A)对反应速度的影响 温度升高,增加ArX在氨水中的溶解度,同时 提高反应速率常数。提高反应速度。 邻硝基氯苯
4682 logk邻 7.20 0.01 T
第6章
氨解反应
Ammonolysis reaction
目的与要求
1.了解氨解反应的概念、分类和氨解的目的 2. 理解卤素氨解反应的机理,掌握苯炔氨解反应历程 3. 掌握羟基化物的氨解反应 4. 了解磺基及硝基化合物的氨解反应
主要内容
• 有机卤化物的氨解
• 羟基化物的氨解 • 羰基化物的氨解 • 磺基及硝基化物的氨解 • 直接氨解 重点、难点 • 芳香族卤代烃氨解理论 • 脂肪族伯胺的制备
(B)
Cl KNH2, NH3 - HCl 48% 52% NH2 NH2 +
(C)发生Diels-Alder反应
OH Diels-Alder反应 O O H+ MeOH
苯炔产生时存在呋喃,导致生成Dield-Alder加成体,很易 被酸催化,使环裂解成1-酚萘。
间溴苯甲醚在液氨中用氨基钾或氨基钠处 理时,得到间氨基苯甲醚,是因为苯炔历程中 所生成的两种中间体苯炔和NH2-反应都进攻间 位,因为各种炔都是间位带有正电荷。
第十一章 胺

NH 2
NHC CH 3
H3O
NO 2
NO 2
苯胺不能直接硝化,因为硝酸能把苯胺氧
化成苯醌。所以必须先将氨基“保护”起来, 再进行硝化反应。
磺酰化反应:(兴斯堡(Hinsberg)反应)
伯胺和仲胺能与磺酰氯作用生成磺酰胺,叔胺 因氮上无氢而无此反应。例如:
SO2Cl + NH2 SO2 NH
英文命名:
普通法:烃基+amine,或者是烃名称去-e
+amine.例如: methylamine(methanamine) 甲胺
二乙胺 苯胺
diethylamine(N-ethyl ethanamine)
benzenamine(aniline)
苄胺
benzylamiቤተ መጻሕፍቲ ባይዱe
N-甲基-N-乙基苯胺 N-methyl-N-ethyl aniline
3、季铵碱
R4N+OH-是典型的离子化合物,其碱性相当
于NaOH或KOH,是一种强碱。 所以,各类胺的碱性强弱为: 季铵碱 > 脂肪胺 > 氨 > 芳香胺
季铵碱能与酸作用生成季铵盐:
R4N OH + HCl
R4N Cl
+ H2O
季铵碱以外的胺都是弱碱,可与酸反应成
盐,其盐遇强碱又游离出原来的胺,所以 可以利用这一性质分离、提纯胺。
综合这些因素,当烷基相同时,仲胺的碱性 最强,伯胺和叔胺次之。
2、芳香胺的碱性
苯胺的碱性比氨小得多。因为氮上的未共用 电子对与苯环有共轭作用,使其电子云密度 降低,从而使其碱性大大减弱。
如碱性强弱顺序:苯胺
> 二苯胺 > 三苯胺 若苯环上有取代基,其碱性可以归纳为: 给电子基团使碱性增强,吸电子基团使碱 性减弱。如,碱性强弱顺序为: 对甲基苯胺 > 苯胺 > 对硝基苯胺
最新医用有机化学第11节-胺-教学讲义ppt课件

(CH3)3N+(C2H5)OH氢氧化三甲基乙基铵 trimethylethylammonium
hydroxide
(二)胺的命名
比较复杂的胺,常以烃类作母体,氨基作为取 代基来命名。例如:
C H 3 - C H - C H 2 - C H - C H 3 N H 2 C H 3
C H 3 C H 2 - C H - C H 2 C H 2 C H 2 C H 3 N H C H 2 C H 3
Solution:
Name the following:
N-methylethanamine
(or Ethyl methyl amine)
N-Ethyl-N-methylcyclohexylamine
Tricyclohexylamine
N-methylpyrrolidine
Diisopropylamine
N,N-二甲基苯胺
N-甲基-N-乙基苯胺
N,N-dimethylaniline N-ethyl-N-methylaniline
(二)胺的命名
胺盐和季铵化合物的命名:
CH3NH2·HCl C H 3 C H 2 N H 2 · A cO H
甲胺盐酸盐 (盐酸甲铵)
乙胺醋酸盐 (醋酸乙铵)
(CH3)4N+Cl氯化四甲基铵 tetramethylammonium
大多数芳胺具有毒性,苯胺可以导致再生障碍 性贫血,通过吸入,食入或透过皮肤吸收而致中 毒,食入0.25 mL就严重中毒。
β– 萘胺与联苯胺是能够引起恶性肿瘤的物质。
四、胺的化学性质 (一)胺的碱性与成盐
N
R
R
R
N H
H
氨基化反应

表9-2。
• 优点 ?
• 缺点 ?
6.2 羟基化合物的氨解
某些胺类,若通过硝基还原或其他方 法制备并不经济,而相应的羟基化合物供 应充分时,则羟基化合物的氨解过程就具 有很大意义。
羟基化合物的氨解为可逆过程:
ROH + NH3 RNH2 + H2O
6.2 羟基化合物的氨解
>60%NaOH, 190℃ NaO3S
0.3~0.4MPa
—NH2
NaO3S
NaOH
—NH2
SO3H
盐析
SO3Na
—NH2
HO3S
H2SO4
—NH2
ONa
OH
6.2 羟基化合物的氨解
b. r酸(2-氨基-8-萘酚-6-磺酸),偶氮染料中间体
SO3H
—OH 98%H2SO4
—OH
40℃
20%发烟H2SO4 60~80℃
均为偶氮染料中间体
OH
ClSO3H, 0~10℃ 硝基乙苯或三氯乙烯
SO3H OH NH3+NH4HSO3
150℃,0.9MPa
羟基吐氏酸
SO3H NH2
吐氏酸
6.2 羟基化合物的氨解
SO3H
HO3S
—NH2 SO3·H2SO4
35~110℃
SO3H —NH2
SO3H
HO3S
H2O 110~125℃
• 可用于醇、苯、萘和蒽醌系羟基化合 物的氨解,反应历程和操作方法各不相同。
6.2.1 醇羟基的氨解
6.2.2 芳环上羟基的氨解
•
苯系酚类的氨解
•
酚类的芳氨基化
•
2023年胺基化工艺参考题库含答案4

2023年胺基化工艺参考题库含答案(图片大小可自由调整)第1卷一.全能考点(共50题)1.【判断题】针对风险种类多、可能发生多种事故类型编制的应急预案为现场处置方案。
2.【判断题】便携式木梯和便携式金属梯梯脚底部应坚实,可以垫高使用。
3.【单选题】压力容器操作人员应定时、定点、()巡回检查。
A、定人员B、定线C、定设备4.【单选题】根据GB50160、GB50016规定,胺基化生产装置为()。
A、甲类B、乙类C、丙类5.【单选题】《生产安全事故报告和调查处理条例》规定,较大事故,是指造成(),或者10人以上50人以下重伤,或者1000万元以上5000万元以下直接经济损失的事故。
A、5人以上10人以下死亡B、3人以上10人以下死亡C、4人以上10人以下死亡6.【判断题】放热反应的胺基化反应釜,在反应一开始就要用降温水降温,防止温度失控。
7.【单选题】进入受限空间作业气体采样规定符合要求的是()。
A、采样点应有代表性B、随机设置采样点C、设备的开孔处8.【判断题】正压式空气呼吸器的供给阀设有旁路开关以备急用,逆时针转动红色旁路阀转钮即打开旁路阀,系统以一定流量向面罩输气,佩戴者应立即退出危险场所。
9.【判断题】干粉灭火器材压力指示处于红区时还可以继续使用。
10.【判断题】纺织物类防护服,按照穿透时间、耐静压性能分为一级、二级、三级。
12.【单选题】空气呼吸器日常检查内容不包括()A、外观、压力、面罩B、气密性C、介质13.【单选题】易燃或可燃液体的饱和蒸汽压越高,其闪点(),火灾危险性越大。
A、越低B、越高C、低于28℃14.【单选题】重大危险源是指长期地或临时地生产、加工、搬运、使用或储存危险物质,且危险物质的数量等于或超过()的单元。
A、大量B、小量C、临界量15.【单选题】一级负荷中特别重要的负荷,除由()个电源供电外,尚应增设应急电源,并严禁将其它负荷接入应急供电系统。
A、1B、2C、316.【单选题】过滤是防护器材更换周期规定不正确的是()。
芳胺类药物分析

1片+稀HCl 24ml + H2O
+ 0.4%NaOH10ml + H2O
1000ml 精密量取5ml
100ml λ257nm测定A。
W×1/1000×5/100×100=C (g/100ml) W(g) = 200 ×C; C = A/715
∴ 溶出度=W/标示量×100%>80%为合格
(四)比色法 中性条件下的重氮化反应
Ê ä (min) ±¼
GITC
HO HO H N CH3
CH3 HO GITC
五、含量测定
(一)亚硝酸钠滴定法 Ar-NH2、Ar-NHCOR、Ar-NO2均可采用此法
Ch.P中的苯佐卡因、盐酸普鲁卡因和盐酸普鲁卡
因胺及其制剂可直接采用本法、醋氨苯砜及注射液水 解后用本法。
NHCOR + H2O
解生成醋酸,在硫酸中与乙醇反应,发出醋酸乙酯香
味。
3.酚羟基特性:对乙酰基酚有游离酚羟基;醋氨苯砜 酸水解有酚羟基,可与FeCl3发生显色反应,可相互
区别。
4.弱碱性:利多卡因和布比卡因烃胺侧链有叔胺氮, 显碱性,可与生物碱沉淀剂发生沉淀反应,可相互 区别。
5.与金属离子发生沉淀反应:利多卡因和布比卡因酰
FeCl3 CON(OH)CH CH2N(C2H5)2 2
NH2 Fe
CON(OH)CH CH2N(C2H5)2 2 紫红,暗棕色,棕黑色 3
CONHCH2CH2N(C2H5)2
3. 与汞离子反应
盐酸利多卡因 + H2NO3 + Hg(NO3)2
对氨基苯甲酸酯 + H2NO3 + Hg(NO3)2
黄色
红色或橙黄色
(四) 水解产物反应
ullmann氨基化反应

ullmann氨基化反应Ullmann氨基化反应是一种重要的有机合成方法,可以将芳香化合物与胺基化合物反应,形成新的芳香胺化合物。
本文将详细介绍Ullmann氨基化反应的原理、反应条件以及反应机制。
一、Ullmann氨基化反应的原理Ullmann氨基化反应是通过芳香化合物上的卤素原子与胺基化合物发生取代反应,生成新的芳香胺化合物。
该反应可以在碱性条件下进行,常用的碱剂有碳酸钠、碳酸钾等。
二、Ullmann氨基化反应的反应条件1. 反应物:芳香化合物和胺基化合物,其中芳香化合物通常是含有卤素取代基的芳香化合物,如溴苯、氯苯等;胺基化合物可以是各种胺类化合物,如苯胺、二甲胺等。
2. 反应溶剂:常用的溶剂有N,N-二甲基甲酰胺(DMF)、二氯甲烷(DCM)等。
3. 碱剂:常用的碱剂有碳酸钠、碳酸钾等。
4. 反应温度:一般在室温下进行,也可以在加热条件下进行。
5. 反应时间:反应时间一般较长,需要几个小时到几天不等。
三、Ullmann氨基化反应的反应机制Ullmann氨基化反应的反应机制主要分为两步:芳香化合物的卤素原子离去和胺基化合物的亲核加成。
1. 芳香化合物的卤素原子离去:在碱性条件下,卤素原子与碱剂发生反应,形成相应的卤素离子。
然后,卤素离子与芳香化合物发生亲电取代反应,卤素原子离去,生成芳香碳正离子。
2. 胺基化合物的亲核加成:芳香碳正离子与胺基化合物发生亲核加成反应,胺基化合物中的氨基亲核攻击芳香碳正离子,形成新的碳-氮键,生成芳香胺化合物。
四、Ullmann氨基化反应的应用Ullmann氨基化反应在有机合成领域具有广泛的应用。
通过该反应可以合成各种芳香胺化合物,这些化合物在医药、农药、染料等领域具有重要的应用价值。
同时,该反应还可以用于合成具有特殊功能的有机分子,如荧光染料、金属有机框架等。
总结:Ullmann氨基化反应是一种重要的有机合成方法,可以合成各种芳香胺化合物。
该反应的原理是通过芳香化合物上的卤素原子与胺基化合物发生取代反应,生成新的芳香胺化合物。
精细有机合成化学与工艺学第9章氨基化

125℃,5h
NH2
SO3H
190℃,4h
OH
J酸
2024/10/13
26
9.3 卤素的氨解 9.3.1卤代芳烃的氨解(芳环上卤基的氨解)
Cl
NH2 Cl
NH2
200~230℃,7MPa
液氨,NaNH2
30% NH3, 0.1molCu+
-33℃
Cl
NH2
170~190℃,3MPa
NO2
30% NH3
-H2O 脱水
CH3 CH
NH
+H2 加氢
CH3CH2NH2
2024/10/13
9
•仲胺的生成
H OH
CH3CH2NH2
+CH3CHO 加成胺化
CH3CH2
N
CH
CH3 -H2O CH3CH2-N=CHCH3 +H2 (CH3CH2)2NH
•叔胺的生成
(CH3CH2)2NH
+CH3CHO 加成胺化
碱的形式
按苯炔历程进行 亲核试剂
注意:邻位氢原子是生成苯炔中间体的必要因素。
2024/10/13
30
卤代芳烃氨解反应的基本特征:
1、芳环上电子云密度越低,反应越容易进行;芳环上的吸电子基 团越强,离去基团越容易离去,反应越容易进行; 2、卤素不同,反应活性不同。 3、吸电基团会使芳环上电子云密度减小,且主要影响邻、对位; 4、卤代芳烃上吸电基团较弱时反应难于进行,必须借助于催化剂 才能进行,催化剂多用不同价态的铜。
(CH3CH2)2
N
OH CH CH3 -H2O (CH3CH2)2-N-CH=CH2 +H2 (CH3CH2)3N
氨解反应

氨解反应氨解反应是指含各种不同官能团的有机化合物在胺化剂的作用下生成胺类化合物的过程。
氨解反应包括卤素的氨解、羰基化合物的氨解、羟基化合物的氨解、磺基及硝基的氨解和直接氨解。
1定义氨解反应是指含各种不同官能团的有机化合物在胺化剂的作用下生成胺类化合物的过程。
可氨解的基团:-X,―OH,―SO3H,―CO―,Ar―H。
胺化剂:液氨、氨水、尿素、铵盐(NH3的来源)及有机胺。
合成胺类化合物的方法:反应类型,还原、氨解,水解,加成和重排。
芳胺的两大制法,硝基还原(经济、方便)和芳环卤素氨解。
包括:卤素的氨解、羟基化合物的氨解、羰基化合物的氨解、磺基及硝基的氨解和直接氨解。
2卤素的氨解7.2.1 反应理论根据反应物的活泼性的差异,可分为非催化氨解和催化氨解(1) 非催化氨解:对于活泼的卤素衍生物,如芳环上含有硝基的卤素衍生物,用氨水处理时,就可以使卤素被氨基置换。
虽然不含磺基的芳香化合物在氨水中很难溶解,但大多数反应仍能在水相中进行,因为随着温和氨浓度的提高,氯化物在氨水中的溶解度会增大。
ClNO2+NH3NH3ClNOO慢快-ClNH3NO2NH2NO2-H反应历程X +ArNH2NH2ArX NO2NO2NHAr反应属于SN2历程,双分子亲核取代反应,首先是带有未共用电子对的氨分子向芳环与氯相连的碳原子发生亲核进攻,得到带有极性的中间加成物,此加成物迅速转化为铵盐,并恢复环的芳香性,最后脱掉质子,得到产物。
第一步氨基衍生物的生成是决速步骤。
+HXNO2动力学方程式:dc/dt = k c’式中c’为二硝基氯苯的浓度,当NH3大大过量时,为假一级反应。
反应历程的证明:通过一系列具有不同离去基团的卤素衍生物与同一亲核试剂反应反应的速度相比,如2,4-二硝基卤代苯和哌啶反应:XO2NNO2+NHNHO2NNO2X当X为F、Cl、Br、I时,反应相对速率为:3300,4.3,4.3,1.0。
证明C-X键的断裂对反应速率没有影响,否则C-X键的断裂为决速步骤,C-I的键最弱,反应速率为VRI>VBr>VRCl>VF。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NH2
200~230℃, 7MPa 30%NH3. 0.1g离 子 Cu+
+ NH4Cl NH2
170~190℃, 3~3.5 MPa
+ NH4Cl NO2
NH2
115~120℃,常 压 30%NH3
NO2 NO2
+ NH4Cl
• 上述氨解反应的活泼顺序为:
Cl NO2 Cl Cl NO2 O2N NO2 NO2
1
• 3. 氨基置换硝基
• 反应按加成—消除反应历程进行。
NO2 O2N NO2 + NH2 NO2 N H NO2
• 硝基苯、硝基甲苯等未被活化的硝基不能作为离 去基团发生亲核取代反应。
1
• 4.氨基置换磺酸基
• 磺酸基的氨解也属于亲核取代反应。磺酸基被氨 基取代只限于蒽醌系列,蒽醌环上的磺酸基由于 受到羟基的活化作用,容易被氨基置换。其反应 历程如下:
• 1.氨基置换卤原子
• 按照卤素衍生物的活泼性的差异,可将氨基置换 卤原子的反应分为非催化氨解和催化氨解两类。
– (1)非催化氨解
• 其反应历程属于亲核置换反应。 • 对于活泼的卤素衍生物,如芳环上含有硝基的卤 素衍生物,通常以氨水为氨解剂,可使卤素被氨 基置换。例如,邻或对硝基氯苯与氨水溶液加热 时,氯被氨基置换反应按下式进行:
2
• 3. 反应温度
• 升高温度可以增加有机物在氨水中的溶解度和加 快反应速度,对缩短反应时间有利。但是温度过 高,会增加副反应,甚至出现焦化现象,同时压 力也将升高。
2
• 4. 搅拌
• 对于间歇设备都要求安装有效的搅拌装置,连续 管式反应器则要求控制流速使反应物料呈湍流状 态。
2
第三节 氨解方法
5
ClCH 2CH 2Cl
OH
+ +
2 NH 3 H2
100 ~180℃
H 2NCH 2CH 2NH 2
+
2 H-Cl
NH 2
NH 3 H-NH 2
+
H-OH H2 CH=NH Cat
O H 3C C H H 3C
H C OH NH 2 -H-OH H 3C CH 3-CH 2-NH 2
O
+
NH3
用卤卤代烃来氨 主要氨要氨解 用酚酚和醇来氨
2
• ★一、卤代烃氨解
• 由于脂肪胺的碱性大于氨,反应生成的胺容易与 卤烷继续反应,所以用此方法合成脂肪胺时,产 物常为混合物。
RX RX RX
NH3 RNH2 R2NH
HX RNH2 . HX R2NH . HX R3N .
• 芳香卤化物的氨解反应比卤代烷困难的多,往往 需要强烈的条件(高温、催化剂和强氨解剂)才 能进行反应。芳环上带有吸电子基团时反应容易 进行。
+
+
[ ArCl Cu(NH3)2 ] +
+ Cl -
• 此反应是分两步进行的:第一步是催化剂与氯化 物反应生成正离子络合物,这是反应的控制阶段; 第二步是正离子络合物与氨、氢氧根离子等迅速 反应生成产物苯胺及副产苯酚等的同时又产生铜 氨离子。 • 研究表明在氨解反应中反应速度与铜催化剂和氯 衍生物的浓度成正比,而与氨水的浓度无关。全 部过程的速度不决定于氨的浓度,但主、副产物 的比例决定于氨、OH-的比例。
NO 2 NO 2 NH 2
NH2 OH 碱性
NO 2
NO 2
NO2
NH2 OH
NO2
碱性
NH2
3
• 2. 通过水解制胺
• 通过异氰酸酯、脲、氨基甲酸酯以及N-取代酰亚 胺的水解,可以获得纯伯胺;由氰酰胺、对亚硝 基-N,N-二烷基苯胺以及季亚铵盐的水解,则可 得到纯仲胺。
3
• 3. 通过加成制胺
3
• 酸式法是将芳香族原料在浓硫酸介质中(有时是 在钒盐和钼盐的存在下)与羟胺在100~160℃反 应直接向芳环上引入氨基的方法。如:
ArH + NH2OH ArNH2 + H2O
• 它是一个亲电取代反应,当引入一个氨基后,反 应容易进行下去。可以在芳环上引入多个氨基。
3
• 碱式法是指在碱性介质中用羟胺进行的氨基化反 应,属于亲核取代反应。
OH
H2N
+
N H N-苯 基 -2-萘 胺, 防老剂
+
H-OH
OH NaO3S OH
NH3 .(NH4 )HSO3
OH HO3S NH2
2
• J酸与苯胺在NaHSO4 存在下,于104 ~ 106℃反 应40 小时,可得到染料中间体苯基J酸。
SO3H
NH 2
NH 2
SO3H
NH
+
OH J 酸
NaHSO4 OH 苯 基 J酸
HCl/CH3OH
CH3COCH2CH2 N(C2 H5 )2
62%~ 70%
3
• ★4.通过分子重排制胺
• 霍夫曼重排:当羧酰胺与次溴酸钠(或 NaOH+Br2)作用时,首先生成异氰酸酯,不经 分离进一步水解得到伯胺。
RCONH2
NaOBr
R N
C O
水解
RNH2
3
• 利用霍夫曼重排反应制胺的优点是:产率高,产 物纯。工业生产中常用于染料中间体的生产。例 如:
+
NH 3
2
• 2. 醇的氨解
• 大多数情况下醇的氨解要求较强烈的反应条件, 需要加入催化剂(如Al2O3)和较高的反应温度。
H2/CuO. Cr2O3 220~235℃
ROH + HN(CH3)2
RN(CH3)2
(收 率 96~97%)
式中:R= C8H17 ; C12H25 ; C16H33
2
液氨,有机溶剂 高温、高压
NH2 CN NO2 + NH4Cl
4
– 2.氨水
• 为了减少和避免氨水在贮存运输中的挥发损失, 工业氨水的浓度一般为25%。 • 对于液相氨解过程,氨水是最广泛使用的氨解剂。 它的优点是操作方便,过量的氨可以用水吸收而 循环使用,适用面广。氨水的缺点是对某些芳香 族被氨解物溶解度小,水的存在有时会引起水解 副反应。所以,工业生产中常常采用较浓的氨水 作氨解剂,并适当降低反应温度。
–(1)不饱和化合物与胺的反应
CH2 CH2 + H N H
Na 100℃,压力下
N CH2CH2
3
–(2)环氧乙烷或乙撑亚胺与胺或氨的反应
CH2 CH2 + NH3 O CH2 NH CH2 + RNH2
CH2 OH
CH2 NH2
CH2 NHR
CH2 NH2
3
–(3)氨甲基化反应
CH3COCH3 + [ CH2 O ]n + (C2 H5 )2 NH
O + NH 3 OH NH + NH 2 + O NH + H2O
1
• 某些萘酚衍生物在酸式亚硫酸盐存在下,在较温 和的条件下与氨水作用转变为萘胺衍生物的反应, 称为布赫勒(Bucherer)反应。Bucherer反应主 要用于从2-萘酚磺酸制备2-萘胺磺酸。其反应可 表示如下:
OH
NaHSO3
第十一章 氨基化及芳胺基化
1
第一节 概述
• 一、氨解反应及其重要性
• 氨解指的是氨与有机物发生复分解反应而生成伯 胺的反应。 • 合成胺类化合物目的: • 胺类化合物是一类重要的有机化工产品,具有广 泛的用途,除可用作矿石浮选外,还广泛用于表 面活性剂工业。此外,胺类也是一类重要的有机 中间体,通过它可制得阳离子表面活性剂或相转 移催化剂等,某些芳胺与光气反应制成的异氰酸 酯是合成聚氨酯的重要单体。
*
-X*
-
*
+ NH2
NH2
NH3
NH2
+ NH2
1
• 2. 氨基置换羟基
• 羟基被置换成氨基的难易程度与羟基转化成酮式 (即醇式转化成酮式)的难易程度有关。一般来 说,转化成酮式的倾向性越大,则氨解反应越容 易发生。 • 例如:苯酚与环己酮的混合物,在Pd-C催化剂存 在下,与氨水反应,可以得到较高收率的苯胺。
1
• (3)用氨基碱氨解
Cl
*
KNH2 , NH3
-HCl
NH 2
*
*
+
48% 52%
NH 2
• 该反应按苯炔历程进行,首先发生消除反应,氨 基负离子形成氨和负碳离子,负碳离子再失去卤 离子而形成苯炔,产生的苯炔迅速与亲核试剂加 成,产生负碳离子。该反应历程表示如下:
*
X H
+ NH2
*
X + NH3
Cl
Cl
≈
<<
NO2
<
NO2
<
1
• 2. 氨解剂
• 每摩尔有机氯化物进行氨解时,理论上需要氨的 量是2摩尔,实际上氨的用量要超过理论量的好 几倍或更多。 • 原因:加大氨水用量,可以增加作用物在氨水中 的溶解量,改善反应物的流动性,提高反应速度, 减少仲胺副产,以及降低反应生成的氯化铵对设 备的高腐蚀性。但是用量过多,会增加回收负荷 和降低生产能力。 • 为了加快氨解速度,有利于伯胺较完全,减少副 产物,降低反应温度,提高生产能力,还可选用 比较浓的氨水。
+ NH3
NH 2
+ H2O
1
• 该反应是可逆反应。其羟基被置换的难易符合以 下规律: • (1)当羟基处于1位时,2位和3位的磺基对氨解 反应起阻碍作用,而4位上存在的磺基则使反应 容易进行; • (2)当羟基处于2位时,3位和4位的磺基对氨解 起阻碍作用,而1位的磺基则能使氨解反应容易 进行; • (3)当羟基与磺基不在同一环上时,磺基对羟 基的氨解影响很小。
