2,7-二辛基[1]苯并噻吩并[3,2-b]苯并噻吩在Cu(100)上的吸附生长以及能级结构演化_0530
加氢裂化技能大赛的题库

加氢裂化技能大赛的题库(一)理论试题部分填空题1从未转化油的烃类组成分析,未转化油中富含烷烃和环烷烃。
2劣质催化裂化柴油加氢改质提高十六烷值的化学原理就是对影响柴油十六烷值的主要组分----多环芳烃进行芳环饱和及选择性开环并控制反应的苛刻度。
3加氢精制反应是指杂原子烃中杂原子的脱除反应以及不饱和烃的加氢饱和反应。
4噻吩及其衍生物(如噻吩、苯并噻吩、二苯并噻吩)的加氢脱硫反应活性,按反应活性从高到低排列的顺序是:噻吩>苯并噻吩>二苯并噻吩5石油馏分的氮含量一般随馏分沸点的升高而增加,在较轻的馏分中,单环、双环杂环化合物占支配地位,而稠环含氮化合物则浓集在较重馏分中。
6对石油馏分中多环杂环含氮化合物的加氢活性的研究表明,杂环(五员环、六员环)如三环、双环、单环,三种杂环含氮化合物加氢活性从高到低的顺序是:三环>双环>单环。
7氮化物HDN反应过程所涉及的三类反应是杂环的加氢饱和、芳环加氢饱和以及C-N的氢解反应。
当然不是所有的氮化物都涉及这三类反应,因分子结构不同,可能分别涉及其中之一、二或全部。
8石油的热加工过程中,金属组分促进焦炭的生成。
9直馏石油馏分加氢裂化原料中的不饱和烃主要是芳烃,基本上不含烯烃。
10下列芳烃化合物的加氢反应式及相应的平衡常数与温度的关联式:芳烃化合物反应式平衡常数表达式萘C10H8←→C10H12㏒K=6460/T-12.4环已烷基苯C10H16←→C10H22㏒K=11750/T-22.39菲C14H10←→C14H12㏒K=2600/T-6.11从上述各反应的平衡常数表达式可以得知芳烃加氢反应的平衡常数随温度的升高而下降。
11对双环以上芳烃的加氢反应的热力学分析表明,对于多环芳烃的加氢反应提高操作压力十分必要,而为了能在热力学更为有利的低温下反应,必须开发加氢活性更高的新催化剂。
12对环烷烃的加氢反应,大量的研究表明,环烷烃在加氢裂化催化剂上的反应主要是脱烷基、六员环的异构和开环反应。
噻吩及其衍生物

摘要噻吩类杂环化合物应用较多的是其衍生物,该类化合物发展在我国处在起步阶段,大多数产品尚属空白,还没有产量规模化、品种系列化的生产厂家。
α-噻吩衍生物广泛应用于合成医药、农药、染料、化学试剂和高分子助剂等,重要的衍生物有噻吩-α-乙酸、α-氯甲基噻吩、α-乙酰噻吩和噻吩-α-甲醛,噻吩-α-乙酸是目前用量最大的噻吩衍生物,全球用量在1000t/a左右。
β-噻吩衍生物有特殊的活性,主要用于合成医药和农药。
大多数β-噻吩衍生物是以β-甲基噻吩为原料合成的、重要的衍生物有β-甲基噻吩、β-噻吩甲醛、噻吩-β-乙酸乙酯和β-溴噻吩等,β-噻吩衍生物是高附加值产品,例如 -噻吩甲醛的售价为86万元/t,2-(邻硝基苯胺基)-5-甲基-β-氰基噻吩的售价为1.2万元/kg。
人们发现噻吩类杂环化合物已有几十年的历史,但真正广泛应用却只有十几年。
噻吩类杂环化合物应用较多的是其衍生物,其中α位噻吩衍生物又较β位用量大、品种多。
β位衍生物结构新颖,在很多领域有特殊用途,品种和用量正快速增长。
噻吩类化合物在我国处在起步阶段,大多数品种尚属空白,还没有产量规模化。
品种系列化的生产厂家。
噻吩噻吩又称硫杂茂、硫茂、硫代呋喃、硫杂环戊二烯。
结构式为噻吩为无色低粘度液体,微有苯味,不易发生水解、聚合反应。
噻吩是稳定的五元杂环化合物,具有芳香族化合物的性质,化学性质与苯十分相近,但却有更高的反应活性,如噻吩的氯化反应在乙酸中进行的速度是苯的100万倍,溴化反应是苯的 1000倍,但噻吩环热稳定性比苯环差,易发生开环裂解反应。
噻吩的制造方法有提取法和合成法2种。
其主要物化性质列于表1。
表1 噻吩的主要物化性质————————————————————————————————————项目指标————————————————————————————————————沸点/℃ 84.16相对密度(25/4℃) 1.0583凝固点/℃ -38.3闪点/℃ -6.7折射率(25℃) 1.5257溶解性与苯乙醇、正庚烷、丙酮、乙醚、四氯化碳等大多数溶剂混溶,不溶于水光敏性有光敏性,光照可发生碳架重排化学性质许多件质与苯相似,但比苯活泼。
聚(3-己基噻吩)-聚苯乙烯嵌段共聚物的一锅法制备

研究与开发CHINA SYNTHETIC RESIN AND PLASTICS合 成 树 脂 及 塑 料 , 2023, 40(4): 19聚噻吩及其衍生物具有良好的导电性、掺杂型的优越环境稳定性,以及作为薄膜使用时的透光性等,在有机太阳能电池[1-2]、电致发光二极管[3]、场效应晶体管[4]、生物传感器[5]等光电器件中广泛应用。
但是聚(3-己基噻吩)(P3HT)的不对称结构,高分子链中的结合位置处会由于烷基的立体排斥而形成扭曲的结构,使共轭变弱,整体导电性变差[6]。
另一方面,在聚合过程中发生了2-5′耦合(头尾相连结构)连接,在同一平面中形成了具有规则立体构象的P3HT,可以获得具有低带隙的高度共轭的聚合物[7]。
因此,基于P3HT的高分子结构改造引起关注[7-15]。
其中,在高分子一侧引入非导电高分子聚苯乙烯(PS),形成嵌段共聚物可以产生较好的改善效果[13-14]。
目前,制备P3HT与PS的嵌段共聚物(P3HT-b-PS),一般通过Suzuki反应和分阶段聚合的方法[13-14]。
前者需要P3HT一端的溴与PS一端的硼酸烷基团发生反应,所以对反应物分子的处理比较复杂;后者由于PS和P3HT使用同一催化剂进行聚合,反应活性会受影响,最终嵌段共聚物中P3HT片段和PS片段的相对分子质量及其分布控制较难。
有报道[15]在制备P3HT与PS“刷子”共聚物的研究时,提出了在PS苯环上引入部分催化剂Ni活性中心,通过这些活性中心催化P3HT与PS的DOI:10.19825/j.issn.1002-1396.2023.04.05聚(3-己基噻吩)-聚苯乙烯嵌段共聚物的一锅法制备樊亚娟,刘承先,李东升,刘长春(常州工程职业技术学院 化工与制药工程学院,江苏 常州 213164)摘要:采用具有聚苯乙烯高分子链为配位基团的聚合催化剂,催化2,5-二溴-3-己基噻吩单体进行Kumada 缩聚反应,利用一锅法制备了聚(3-己基噻吩)-聚苯乙烯嵌段共聚物。
聚并二噻吩-吡咯并吡咯二酮主要成分-解释说明

聚并二噻吩-吡咯并吡咯二酮主要成分-概述说明以及解释1.引言1.1 概述概述部分的内容:聚并二噻吩-吡咯并吡咯二酮是一种具有重要应用潜力的有机聚合物,也是一类半导体材料。
它是由并二噻吩和吡咯并吡咯二酮两种单体构建而成的共轭聚合物,具有良好的电子传输性能和稳定的化学性质。
聚并二噻吩-吡咯并吡咯二酮的独特结构使其具有许多优异的性质。
首先,它具有较低的能隙,意味着能够吸收可见光以及近红外光谱范围内的光线。
这种特性使得聚并二噻吩-吡咯并吡咯二酮在光电器件领域具有广泛的应用前景,例如太阳能电池、光电传感器等。
其次,聚并二噻吩-吡咯并吡咯二酮还表现出良好的电子传输性能。
它具有良好的载流子迁移率和导电性,可以在聚合物自身的分子链中形成连续的π共轭体系,从而实现电子的有效传输。
因此,聚并二噻吩-吡咯并吡咯二酮在有机场效应晶体管、有机发光二极管和有机薄膜晶体管等器件中得到广泛应用。
此外,聚并二噻吩-吡咯并吡咯二酮还具有优异的化学稳定性和热稳定性。
这使得它能够在不同环境下保持其性能,并且具有较长的使用寿命。
这种化学稳定性还使得聚并二噻吩-吡咯并吡咯二酮可以在化学传感器和生物传感器等领域中应用。
总之,聚并二噻吩-吡咯并吡咯二酮作为一种重要的有机聚合物材料,具有良好的电子传输性能、光吸收性能和化学稳定性。
它在光电器件、有机晶体管和传感器等领域具有广泛的应用前景,对于提高器件性能和开拓新型功能材料具有重要意义。
1.2文章结构文章结构部分的内容可以如下编写:1.2 文章结构本文将按照以下结构进行叙述和讨论。
第一部分是引言部分,主要包括概述、文章结构、目的和总结四个方面。
在概述部分,我们将介绍聚并二噻吩-吡咯并吡咯二酮作为一种重要的有机材料的背景和意义。
文章结构部分将呈现本文的整体架构和各个部分的内容安排。
目的部分将明确本文的研究目标和动机。
最后,在总结部分将对本文的主要内容和结论进行概括和总结。
第二部分是正文,包括了四个主要要点的讨论。
Van Leusen (范勒森)反应综述

Van Leusen (范勒森)反应综述摘要 Van leusen 反应是指利用Van Leusen 试剂实现的的有机合成及方法。
Van Leusen 试剂是一类黄酰甲基异腈的化合物,其中最简单最常用最重要的是(对甲苯磺酰基)甲基异睛。
它的英文缩写名为TosMIC 。
由于此试剂的分子结构特殊性,它能发生多种类型的反应。
本文重点以TosMIC 为例,对Van Leusen 试剂和Van leusen 反应进行综述。
关键字 Van leusen 反应 TosMIC1 C-C 键的连接反应受到对甲苯磺酰基团和异腈集团拉电子能力的影响,TosMIC 分子中的亚甲基具有较高的酸性。
所以TosMIC 的亚甲基在取代反应中具有非常高的反应活性,烷基化是其最主要的的取代反应。
与其它活性亚甲基化合物反应不同,TosMIC 的活性亚甲基烷基化反应的最后产物取决于甲苯磺酰基和异腈基后续的转化。
S NCOO活性亚甲基(对甲苯磺酰基)甲基异腈(TosMIC )的结构如式:通过该反应可以得到多一节碳的的羰基,亚甲基或者N-甲基等产物,这就构造了Van leusen 反应的独特性。
NCTsTs RR 112.R R 21orNHR 2R 1OR 2R 11.1 TosMIC 的单烷基化反应TosMIC 单取代烷基化衍生物除了直接由取代的甲基甲酰胺脱水而得外,还可以通过 TosMIC 与烷基化试剂直接取代反应是最常用的方法。
在通常的烷基化反应条件下,TosMIC 与等物质的量的无位阻的卤代烃反应得到的是单烷基化和双烷基化的混合物,研究发现:使用相转移催化剂在20%~50%的NaOH 水溶液中反应,可以选择性的得到单烷基化合物[3],如式:OO使用多卤化合物作为烷基化试剂时,通过恐慌只TosMIC 与底物的用量比例,任然可以高效的完成多个单烷基化反应[4]。
Bu-tOMeTsNC TsNC1.2 TosMIC 的双烷基化反应TosMIC 与过量的烷基化试剂反应,便可得到相同取代基的双烷基化产物。
生物脱硫综述

煤炭生物脱硫的研究现状及前景摘要日益严格的环保要求,使低耗高效、环保的洁净煤技术研究也更迫切,而煤炭生物脱硫技术利用嗜硫微生物脱除煤炭中硫,极具环保经济意义,是目前和将来煤炭脱硫的研究重点。
本文分析了煤炭生物脱硫技术的发展背景及研究进展。
同时介绍了煤炭微生物脱硫技术的种类,即生物浸出脱硫、表面处理浮选法、微生物选择性絮凝法,从而将煤中的可燃硫转变为不可燃硫,进而减少二氧化硫的排放。
概述了微生物脱硫技术的特点、机理、方法、脱硫菌种、主要影响因素及现存问题,最后根据煤炭生物脱硫的研究现状对其做了前景展望。
关键词:生物脱硫,脱硫机理,无机硫,有机硫The present research situation and prospects ofbiodesulfurization of coalAbstractThe increasingly tougher requirement of environment has made the clean coal technology research which is low consume efficient and environmentally friendly more urgent. And the biodesulfurization technology of coal using thiophilic bacteria to remove sulfur in coal is of most environmental economic significance.It has been the concentration of coal desulfurization current and in the future. This paper analyzes the background and the development of the biological desulfurization technology of coal and introduce the variety at the same time.The technology includes biology leaching desulfurization, surface treatment flotation method, and microbial selective flocculation. In those ways the flammable sulfur in coal can turn to be nonflammable, which decrease the SO 2 emission.The characteristics, mechanism and the methods, desulfurization strains, major influential elements and existing problems have also been summarized in this paper.At last, the prospect of the biodesulfurization technology of coal has been made according to its current situation Key words:biodesulfurization , mechanism of desulfurization, inorganic sulfur,organic sulfur.矿物燃料是当今世界的主要能源,其中的煤炭资源蕴藏量占总能源的75%以上。
噻吩基结构

噻吩基结构1. 介绍噻吩是一种含硫的芳香化合物,具有类似苯环的结构,但其中一个碳原子被一个硫原子取代。
噻吩分子的化学式为C4H4S,属于五元杂环化合物。
噻吩基结构是指噻吩分子中的噻吩环及其相邻的原子或基团,这些结构对噻吩的物理性质和化学性质具有重要影响。
2. 噻吩基结构的特点噻吩基结构的特点主要表现在以下几个方面:2.1 单独的噻吩环噻吩分子中的噻吩环由一个硫原子和四个碳原子组成,具有平面结构。
噻吩环中的碳原子和硫原子之间的键长较短,硫原子和邻近的碳原子之间的键长较长。
噻吩环的共面性和键长差异使得噻吩分子具有特殊的共轭结构和一系列特殊的物理性质。
2.2 共轭π电子体系噻吩分子中的噻吩环具有共轭π电子体系。
噻吩分子中的碳原子和硫原子上的p 轨道可以重叠形成π电子体系,这种重叠使得噻吩分子具有特殊的电子能级结构和吸收光谱特性。
噻吩分子的共轭π电子体系还赋予了其特殊的电导性质和反应活性。
3. 噻吩基结构的应用由于噻吩基结构的特殊性质,噻吩化合物在许多领域都有重要的应用:3.1 作为染料和颜料噻吩化合物在染料和颜料工业中得到广泛应用。
由于噻吩分子内部的共轭π电子体系和噻吩环的共轭特性,噻吩染料和颜料通常具有鲜艳、稳定的颜色,并且对光和热的稳定性较好。
3.2 作为有机光电材料噻吩基结构可以用于制备有机光电材料,如有机太阳能电池、有机发光二极管(OLED)等。
噻吩化合物的共轭π电子体系使其具有较好的电子传导性能和光电转换能力,因此在光电子学领域具有广泛应用前景。
3.3 成为有机合成的重要中间体噻吩基结构可以作为有机合成的重要中间体,用于构建其他有机化合物的骨架。
通过对噻吩基结构的官能团修饰和反应控制,可以合成具有特殊结构和功能的化合物,广泛应用于医药、农药、粘合剂等领域。
4. 噻吩基结构的合成方法噻吩基结构的合成方法主要有以下几种:4.1 醛缩法醛缩法是噻吩基结构的常用合成方法之一。
该方法通过醛和硫作用产生亚硫醇,然后经过缩合反应得到噻吩。
苯并二噻吩(bdt)结构式

苯并二噻吩(bdt)结构式苯并二噻吩(BDT)是一种典型的碳杂环化合物,由碳、氮、氧三个元素构成,其结构由两个苯圆环组成,内环内连接有一个噻吩峰,外环连接有一个双键。
苯并二噻吩(BDT)具有均相性和不可溶性,因此在液相中以大量分散微滴状存在。
1. 官能团结构:苯并二噻吩(BDT)由碳、氮和氧三个元素构成,具有两个苯环,内环中连接有一个噻吩峰,外环连接有一个双键。
由于氮中的电子密度与碳、氮的电子密度有所不同,因此可以形成多种不同的官能团结构。
2. 均相性:因苯并二噻吩(BDT)具有高氯官能团结构,具有均相性,而且不溶性,无论是溶剂平衡之间,还是溶液中成膜的渗透性都有较强的稳定性。
3. 化学稳定性:苯并二噻吩(BDT)具有较高的热稳定性,在高温下能够发生轻微的加成和烷基化改性,但是在常温下几乎不易发生化学变化。
4. 共混结构:苯并二噻吩(BDT)具有广泛的共混性,可以与石油、油性有机溶剂和水及其他有机溶剂相混,从而形成介于液相和固相之间的新态结构,如极性混合物、非晶态纳米晶体等。
5. 新型质量单元:与传统有机结构相比,苯并二噻吩(BDT)在研究中有其独特之处,它具有较高的表面张力和分子性能,并能形成新型结构和质量单元,从而促进研究者提出新的应用。
6. 合成方法:苯并二噻吩(BDT)的合成主要有二步法、三步法和多步法三种,其中二步法是一种最常用的形式,主要是通过亚甲基锡实验,将苯圆环和噻吩碱基通过酯交换反应酯化而成。
7. 应用:苯并二噻吩(BDT)具有良好的热稳定性和共混性,使其在电子工程、催化、材料科学、光学等领域具有重要的应用价值,具体涉及高分子材料、环境保护、光学材料、配体设计、新能源材料等。
苯并噻吩及其衍生物(可编辑)

苯并噻吩及其衍生物////0>. 化学通报 2005 年第 68 卷 w055 苯并噻吩及其衍生物李建源周新锐赵德丰大连理工大学精细化工国家重点实验室大连 116012摘要苯并噻吩BT 、二苯并噻吩DBT 及其衍生物是杂环化合物的重要组成部分。
其一般有芳香性,稳定性较高,是较难脱除的一类有机硫,在石油脱硫的研究中占据举足轻重的位置。
同时,它们存在各种不同的反应能力, 是重要的有机合成中间体, 在农药、医药、染料等领域有着重要的应用。
本文对苯并噻吩和二苯并噻吩的结构特征、合成方法及其主要衍生物的合成、性质等作了介绍。
关键词苯并噻吩二苯并噻吩衍生物Benzothiophene and its DerivativesLi Jianyuan ,Zhou Xinrui ,Zhao DefengState Key Laboratory of Fine Chemicals, Dalian University of Technology, Dalian 116012Abstract Benzothiophene, dibenzothiophene and their derivatives are important parts of heterocycliccompounds. They are commonly aromatic character with high stability, being a kind of organic sulfur whichare difficult to be removed. Meanwhile, they are intermediates in organic synthesis, such as pharmaceutical 、dyestuff et al. In this paper, the structural characteristics, synthesis methods and property of benzothiophene 、dibenzothiophene and their derivatives have been discussedKey words Benzothiophene, Dibenzothiophene, Derivatives苯并噻吩、二苯并噻吩及其衍生物为芳香性杂环化合物, 是重油、减压馏分油及渣油中的主[1]要硫化物。
苯并噻吩_精品文档

苯并噻吩苯并噻吩是一种重要的有机化合物,其分子结构由苯环和噻吩环相连而成。
它具有许多独特的特性和广泛的应用领域。
本文将介绍苯并噻吩的化学性质、合成方法、物理性质以及其在光电器件中的应用等方面。
1. 化学性质苯并噻吩的分子式为C8H6S,分子量为134.21 g/mol。
它是一种无色至淡黄色的固体,具有较高的熔点和沸点。
其化学性质活泼,容易与其他化合物发生反应。
例如,苯并噻吩与氧气反应会产生苯并噻吩的氧化产物。
它还能够被氯化合物氯化,生成苯并噻吩的氯代产物。
此外,苯并噻吩还能够在一定条件下与酸、碱和金属反应。
2. 合成方法苯并噻吩的合成方法主要有两种:Hantzsch合成和Heck反应合成。
Hantzsch合成是指通过酮类或酰胺与α-氨基酮或α-氨基酮酸盐反应得到苯并噻吩。
该反应的基本步骤包括酮类与α-氨基酮酸盐的缩合、还原和内酰胺解环等。
Heck反应合成苯并噻吩则是通过钯催化的烯丙基化反应实现的。
该反应需要催化剂钯以及碱性条件,反应的底物通常是芳香化合物和卤代烯烃。
3. 物理性质苯并噻吩的物理性质有一定的特点。
它是一种无色至淡黄色的晶体,具有较高的熔点和沸点。
苯并噻吩的溶解度在不同溶剂中有所差异,通常在有机溶剂中具有较好的溶解度。
此外,苯并噻吩在光谱学、热分析和电化学等方面也有一些特殊的性质。
4. 应用领域苯并噻吩在有机光电器件领域有广泛的应用。
由于其优异的光电性能,苯并噻吩被广泛用作有机太阳能电池和有机发光二极管的材料。
其分子结构的特殊性能使得苯并噻吩具有快速的电子传输和电子注入能力,从而能够提高光电器件的效率和性能。
此外,苯并噻吩还有着其他的应用潜力。
例如,它可以用作荧光探针和染料,用于生物医学和生物化学研究中。
另外,苯并噻吩还可以用于合成其他有机化合物,如药物和功能材料等。
综上所述,苯并噻吩是一种重要的有机化合物,具有较高的化学活性和特殊的物理性质。
它的合成方法多样,广泛应用于光电器件等领域。
苯并噻吩

苯并噻吩基本信息中文名称苯并噻吩分类化学外文名称Benzothiophene分子式C8H6S简介:白色叶片状结晶。
有萘样气味。
能随水蒸气苯并噻吩(BT)及其衍生物是杂环化合物的重要组成部分。
其一般有芳香性,稳定性较高,是较难脱除的一类有机硫,在石油脱硫的研究中占据举足轻重的位置。
同时,它们存在各种不同的反应能力,是重要的有机合成中间体,在农药、医药、染料等领域有着重要的应用。
物理性状1. 性状:白色叶片状结晶。
有萘样气味。
能随水蒸气挥发。
2. 密度(g/mL,25/4℃):1.14843. 相对蒸汽密度(g/mL,空气=1):未确定4. 熔点(ºC):325. 沸点(ºC,常压):2216. 沸点(ºC,5.2kPa):未确定7. 折射率:1.63748溶解性:易溶于乙醇,溶于乙醚、丙酮和一般有机溶剂,不溶于水。
溶于浓硫酸呈樱桃红色,加热后消失。
存储方法密封于阴凉、干燥处保存。
确保工作间有良好的通风设施。
密封保存。
远离火源,储存的地方远离氧化剂。
合成方法工业上主要由粗萘中提取。
也可用苯乙烯或乙苯与硫化氢合成或由噻吩和苯环缩合制得。
苯并噻吩衍生物:(1)3-甲醛苯并噻吩:英文名称:Benzo[b]thiophenc-3-carboxaldehyde,分子式:C9H6OS;CAS[5381-20-4],常温下为淡黄色或类白色固体,熔点57~59℃。
用于制备俘精酸酐类、杂环丙酮类、叠氮乙烯基苯并噻唑类、N-羟基脲、B-杂环-氨基酸类、吡碇并喹喔啉等化合物,用作光致变色材料、抗肿瘤剂a2肾上腺素能激动剂、LEA-1拮抗剂、Pab1抑制剂、抗癫痫药、抗病毒剂、PTPs抑制剂和抗菌剂等。
是一种很重要的医药中间体,市场需求量大,且需求面广,目前主要是国外需求量较大,国内市场也逐渐有需求,现在开发该产品正是时候,开发潜力较大(2)二苯并噻吩:英文名称:dibenzothiophene,中文名称二苯并噻吩,CAS NO. 132-65-0,中文别名:二苯并噻吩的结构式英文名称Dibenzothiophene,英文别名 Biphenylensulfide; Diphenylene sulphide,EINECS 205-072-9,分子式 C12H8S分子量 184.26性质:针状结晶。
二苯并噻吩的合成方法

二苯并噻吩的合成方法
嘿,朋友们!今天咱来聊聊二苯并噻吩的合成方法。
这玩意儿听起来挺高深莫测的吧?哈哈,别担心,听我慢慢道来。
你看啊,就好比咱做饭,得有各种食材和步骤才能做出美味佳肴,合成二苯并噻吩也是这么个道理。
有一种常见的方法是通过苯和噻吩来搞。
就好像搭积木一样,把苯和噻吩这两块“积木”按照一定的方式拼接起来。
先把苯和噻吩准备好,然后在合适的条件下让它们发生反应。
这条件就好比火候,得掌握好啦,不然可就搞砸了。
还有一种方法呢,是利用其他的化合物来转化。
这就像变魔术一样,把一种东西变成另一种东西。
但这可不是随便变变就行的,得有特定的条件和催化剂帮忙。
催化剂就像是魔术里的那根神奇魔杖,能让反应顺顺利利地进行。
那你说,这合成二苯并噻吩难不难?当然难啦!但咱可不能被难倒呀,对吧?就像爬山,虽然山高路险,但只要一步一个脚印,总能爬到山顶。
在合成的过程中,可不能马虎大意哦。
每一个细节都得注意到,温度啦、压力啦、反应时间啦,这些都能影响到最终的结果。
这就好比你走在路上,稍微不注意就可能摔跤,那多不划算呀!
而且啊,不同的方法有不同的优缺点。
就像每个人都有自己的性格一样,有的方法可能反应快,但成本高;有的方法可能成本低,但步骤繁琐。
那我们就得根据自己的实际情况来选择合适的方法啦。
想想看,当我们经过一番努力,终于成功合成出二苯并噻吩的时候,那得多有成就感呀!就像农民伯伯看着自己丰收的庄稼一样,心里美滋滋的。
所以呀,朋友们,别害怕困难,大胆去尝试合成二苯并噻吩吧!只要我们用心去做,就一定能成功。
加油哦!。
气味阈值——精选推荐

⽓味阈值序号化合物名称⽓味阈值(µg/kg)青蟹♂青蟹♀梭⼦蟹♂梭⼦蟹♀河蟹♂河蟹♀风味描述1 苯⼄烯730 - 0.01 - <0.01 - - 树脂、花⾹⾹⽓2 1-丁醇5000 <0.01 <0.01 <0.01 - - - 温和的杂醇油⽓息,并带有酒⾹3 戊醇4000 0.05 0.01 0.01 0.02 <0.01 0.01 ⾯包⾹、酒⾹、果⾹4 ⼰醇2500 <0.01 - <0.01 <0.01 - <0.01 青⾹、果⾹、醇⾹、甜⾹、醚⾹5 1-⾟烯-3-醇 1 8.64 4.47 - 4.42 - 3.37 蘑菇⾹、青⾹、蔬菜⾹6 庚醇 3 0.76 - - - - - 新鲜、轻淡的油脂⽓息,并带有酒⾹7 2-⼄基-1-⼰醇270000 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 蘑菇⾹⽓8 ⾟醇120 0.05 0.01 - 0.03 - 0.03 强烈的油脂⽓味,并带有柑橘、玫瑰⽓味9 3-甲基丁醛 1 2.81 8.67 - 4.92 - - 稀释后具有愉快的⽔果⾹⽓10 戊醛20 9.79 2.23 2.33 7.17 0.38 1.17 稀释后具有果⾹、⾯包⾹11 ⼰醛4500 0.01 <0.01 <0.01 <0.01 <0.01 0.01 青⾹、叶⾹、果⾹、⽊⾹12 庚醛 3 - 5.58 - - - 0.30 稀释后具有类似甜杏、坚果⾹⽓13 ⾟醛0.7 - 17.62 - - 1.45 - ⾼度稀释下具有类似甜橙、蜂蜜样⾹⽓14 壬醛 1 17.17 15.00 14.27 16.50 4.82 16.45 蜡⾹、柑橘⾹、脂肪⾹、花⾹15 癸醛 1 - 12.85 - - - - 蜡⾹、柑橘⾹、花⾹16 3-⼰酮50000 <0.01 - - <0.01 - - 甜⾹、果⾹、蜡⾹⽓味17 3-羟基-2-丁酮800 0.01 - - - <0.01 0.02 甜⾹、奶制品⾹,并带有脂肪的油腻⽓息18 6-甲基-5-庚烯-2-酮50 0.36 0.28 0.26 0.29 0.02 0.11 果⾹,霉⾹,酮⾹19 ⼄酸丁酯66 - 0.07 - - - - 强烈的⽔果⾹⽓,近似于⽣梨、⾹蕉⾹⽓20 愈创⽊酚10 0.49 - 1.02 0.38 0.17 0.33 ⾟⾹、药⾹、⽊⾹以及烟熏味21 苯酚5900 <0.01 <0.01 <0.01 - <0.01 <0.01 酚样、药⾹⽓22 4-甲基苯酚55 0.03 0.01 - 0.05 - - 强烈的类似苯酚⾹⽓以及烟草酚⾹23 糠醛3000 <0.01 <0.01 - <0.01 <0.01 <0.01 ⾯包⾹、焦糖⾹,带有焙烤⾷品⽓味24 2-甲基呋喃酮1000 0.01 - 0.01 0.01 <0.01 0.01 甜的、杏仁、烤⾹、烟熏⾹25 2,5-⼆甲基吡嗪1800 0.01 - - - - - 坚果⾹、花⽣、脂肪⾹26 2,3,5-三甲基吡嗪9000 <0.01 - - - - - 坚果⾹、⼟⾖、可可、蔬菜样⽓味27 吡啶2000 0.05 - 0.03 0.03 0.01 0.02 强烈的、鱼样⾹⽓,胺味道28 吲哚140 0.03 - - - - - 稀释到⼀定浓度后,具有花⾹29 2-⼄酰基噻唑10 0.59 0.43 0.84 0.22 0.24 0.51 爆⽟⽶、烤麦⽚⾹、烤⾁、坚果⾹30 三甲胺0.5 100.00 100.00 100.00 85.67 100.00 100.0031 ⼆甲基三硫化物0.01 - - - 100.00 - - 槟榔⾹、硫⾹序号保留指数(RI)化合物相对含量(%)感觉阈值(µg/kg)相对⽓味活度值(ROA V)含氧杂环化合物 6.873 868 2-甲基呋喃0.278 953 2-⼄基呋喃 1.2913 1115 2-丁基呋喃0.318 1233 2-戊基呋喃 2.87 6[6] 2.66 24 1310 2-⼰基呋喃0.1142 1525 2-⾟基呋喃0.359 1826 3-苯基呋喃0.8262 1901 5-丁基-⼆氢-2(3H)-呋喃酮0.5265 2013 ⼆氢-5-戊基-2(3H)-呋喃酮0.2769 2239 2,3-⼆氢-3,5-⼆羟基-6-甲基-4(H)-吡喃-4-酮0.0470 2243 3,5-⼆氢-2-甲基-4(H)-吡喃-4-酮0.0472 >2400 2(H)-4-羟基-2(3H)-呋喃酮0.04吡嗪化合物 4.2517 1198 吡嗪0.09 60[6]0.01 23 1300 2,5-⼆甲基吡嗪 2.14 1.8[6] 6.60 25 1314 2,6-⼆甲基吡嗪 1.18 200[6]0.03 31 1385 2-⼄基-5-甲基吡嗪0.04 100[6]<0.01序号保留指数(RI)化合物相对含量(%)感觉阈值(µg/kg)相对⽓味活度值(ROA V)41 1514 顺-2-甲基-6-(1-丙烯基)-吡嗪0.1845 1554 正戊基吡嗪0.09 1000[6]<0.01 47 1591 2-异戊基-6-甲基吡嗪0.1349 1629 2,5-⼆甲基-3-异戊基吡嗪0.4醇类化合物97 943 ⼄醇0.21 100000[6]<0.01 20 1263 戊醇 1.93 4000[6]<0.01 28 1356 ⼰醇0.21 250[6]<0.0135 1429 庚醇 1.71 3[6] 3.1736 1437 1-⾟烯-3-醇0.56 1[6] 3.1138 1450 壬醇0.33 50[6]0.04 44 1547 1-⾟醇 4.05 110[6]0.20醛类化合物49.155 912 3-甲基丁醛0.69 0.2[6]19.176 916 2-甲基丁醛0.13 1[6]0.72 9 979 戊醛 1.03 20[6]0.29 12 1078 ⼰醛12.06 4.5[6]14.8915 1164 2-甲基-2-戊烯醛0.0516 1180 庚醛0.82 3[6] 1.52 21 1270 ⾟醛 4.94 0.7[6]39.21 26 1323 反-2-庚烯醛0.15 13[6]0.06 32 1391 壬醛16.16 1[6]89.78 34 1419 反-2-⾟烯醛 1.04 3[6] 1.93 40 1508 苯甲醛 2.46 350[6]0.04 43 1529 反-2-壬烯醛0.79 0.08[6]54.86 46 1568 5-甲基糠醛0.16 20[6]0.04 50 1633 反-2-癸烯醛 2.7 0.3[6]50.0052 1660 2-正丁基-2-⾟烯醛0.1953 1691 反,反-2,4-壬⼆烯醛0.28 0.09[6]17.2855 1743 2-⼗⼀烯醛 3.1656 1759 反,顺-2,4-癸⼆烯醛0.2958 1802 反,反-2,4-癸⼆烯醛0.91 0.07[6]72.22 64 1946 ⾁⾖蔻醛0.23 14[6]0.09 67 2124 ⼗六醛0.91酯类化合物 1.3651 1646 正⼰酸⼄酯 1 1[6] 5.5660 1867 2-氧代壬酸甲酯0.371 >2400 邻苯⼆甲酸⼆异丁酯0.06酸类化合物 2.1337 1441 ⼄酸 1.37 22000[6]<0.01 66 2022 ⾟酸0.08 3000[6]<0.01 68 2127 壬酸0.26 3000[6]<0.01序号保留指数(RI)化合物相对含量(%)感觉阈值(µg/kg)相对⽓味活度值(ROA V)73 >2400 ⼗四酸0.1 10000[6]<0.0174 >2400 ⼗六烷酸0.32 10000[6]<0.01酮类化合物 6.4614 1132 5-甲基-2-⼰酮 1.7522 1284 1-羟基-2-丙酮 1.2927 1336 6-甲基-5-庚烯-2-酮0.08 50[6]0.01 29 1369 反-3-⾟烯-2-酮0.2233 1402 反,反-3,5-⾟⼆烯-2-酮0.8839 1491 2-癸酮 1.4348 1612 2-⼗⼀烷酮0.31 7[6]0.25 54 1735 2-戊基-2-环戊烯-1-酮0.2461 1875 反,反-3,5-壬⼆烯-2-酮0.26含硫化合物 111 1062 ⼆甲基⼆硫醚0.48 0.06[7]44.44 30 1380 ⼆甲基三硫醚0.09 0.005[6]100.00 63 1906 2-⼰基噻吩0.43碳氢化合物7.441 701 庚烷 2.602 801 ⾟烷 4.504 901 壬烷0.1710 1002 癸烷0.0619 1238 苯⼄烯0.06 730[6]0.02 57 1800 ⼗⼋烷0.05编号化合物名称(µg/kg)相对⽓味活度值(ROA V)⽓味特征黄鱼鳗鱼鳕鱼鲳鱼马鲛鱼1 ⼄醇100000 - <0.01 - <0.01 0.112 1-戊烯-3-醇400 0.19 0.045 <0.01 <0.01 <0.01 果⾹、蔬菜⾹3 异戊醇250 - 0.58 <0.01 - - ⾯包、⾕物、果⾹⾹味4 戊醇4000 <0.01 - - - - ⾯包⾹、酒⾹、果⾹5 2-戊烯-1-醇40 0.54 0.09 0.02 - -6 ⼰醇2500 - <0.01 - - - 青⾹、果⾹、醇⾹、甜⾹7 庚醇 3 11.27 1.83 - 0.47 6.13 新鲜、清淡油脂⽓息、酒⾹8 1-⾟烯-3-醇 1 27.03 84.53 1.13 18.38 57.67 蘑菇⾹、青⾹、蔬菜⾹以及油腻的⽓息9 2-⼄基-1-⼰醇270000 <0.01 <0.01 <0.01 <0.01 <0.01 蘑菇⾹⽓、甜⾹味10 1-⾟醇110 - 0.04 - 0.02 - 强烈的油脂⽓味,并带有柑橘、玫瑰⽓味11 2-⾟烯-1-醇40 - 0.27 0.01 - -12 1-壬醇50 - - - 0.01 - 强烈的玫瑰、橙⼦⾹⽓,并伴有油脂⽓息13 苯⼄醇800 - 0.87 <0.01 - 0.03 风信⼦、栀⼦⾹⽓14 丙醛37 0.05 0.08 - 0.05 0.45 青⾹、可可、咖啡味15 异戊醛0.4 - 21.23 1.00 3.93 4.60 ⾼度稀释时有似苹果⾹⽓、巧克⼒⾹16 2-甲基丁醛 1 - - 0.21 0.61 - 果⾹、巧克⼒⾹、坚果⾹、青⾹17 戊醛20 2.55 0.46 <0.01 0.15 1.69 稀释后具有果⾹、⾯包⾹18 2-戊烯醛1500 - - <0.01 - - 蜡⾹、青⾹、果⾹19 ⼰醛4500 0.05 0.02 <0.01 <0.01 0.05 强烈的青⾹、草⾹、蔬菜、⽔果⾹⽓20 2-⼰烯醛17 - - 0.01 - - 青⾹、苹果、脂肪、醛⾹⾹⽓21 庚醛 3 29.91 7.99 0.24 5.37 35.38 稀释后具有类似甜杏、坚果⾹⽓22 4-庚烯醛10 1.24 0.87 0.03 0.13 1.84 青⾹、脂肪⾹⽓,低浓度奶油味道23 ⾟醛0.7 69.11 14.83 0.33 20.45 100 ⾼度稀释下具有似甜橙、油脂、蜂蜜⾹⽓24 苯甲醛 3 5.41 3.52 1.36 0.9 10.63 油腻的甜味、杏仁⾹⽓、果⾹、粉⾹⾹韵25 2,4-庚⼆烯醛10 - - 0.07 - - 青⾹、醛⾹、⽔果、鸡⾁、脂肪⾹⽓26 2-⾟烯醛 3 - - 0.05 - - ⾁⾹、脂肪、青⾹⽓27 壬醛 1 49.46 31.32 0.53 40.61 71.78 蜡⾹、甜桔⾹、脂肪⾹、花⾹28 苯⼄醛 4 - 12.17 0.04 - - 青⾹、玫瑰、花⾹、巧克⼒⾹⽓29 癸醛0.1 100 100 2.18 100 - 醛⾹、蜡⾹、脂肪、柑桔⾹⽓30 ⼗⼀醛 5 - - <0.010 0.44 - 脂肪、花⾹、柑桔⾹⽓31 2,3-丁⼆酮 2.3 - - 0.02 - - 甜的奶油、黄油⾹⽓32 2-丁酮50000 - - <0.01 - - 醚⾹、果⾹、樟脑⾹韵33 2-庚酮140 - 0.05 <0.01 - - ⾹蕉、奶酪⾹⽓及轻微的药⾹34 3-⾟酮28 0.51 <0.01 0.04 0.11 酮⾹、青⾹、蜡⾹、蔬菜⾹35 1-⾟烯-3-酮0.005 - - 22.56 - - 强烈的壤⾹、蘑菇⾹36 2,3-⾟⼆酮 2.52 12.12 8.38 0.05 4.01 7.9837 2-⾟酮50 - 0.15 - 0.03 - 酮⾹、青⾹、蜡⾹、⽜奶⾹韵38 6-甲基-5-庚烯-2-酮50 - 0.55 - - - 果⾹、霉⾹、酮⾹39 2-壬酮 5 - 0.94 0.02 0.44 0.11 果⾹、甜⾹、蜡⾹、青⾹40 2-⼗⼀酮7 - 0.54 0.01 - - 蜡⾹、果⾹、脂肪⾹41 苯⼄酮65 - 0.10 <0.01 - - 强烈⾦合欢似甜⾹⽓、杏仁⾹、甜⾹42 ⼄酸⼄酯 5 0.76 1.09 0.04 - 1.47 醚⾹、菠萝、葡萄、樱桃的果⾹43 戊酸⼄酯 1.5 - - - - 0.81 甜的果⾹、酯⾹44 ⼄苯29 0.75 - 0.02 - -45 苯酚5900 - - <0.01 - - 酚样、药⾹⽓46 2-⼄基呋喃8000 - <0.01 <0.01 <0.01 <0.01 ⾖⾹、⾯包⾹、麦芽⾹47 三甲胺0.5 - 3.02 1.43 - 0.1848 ⼆甲基⼆硫醚0.06 - - 100 - - 强烈的洋葱、⽢蓝、蔬菜⾹⽓49 吲哚140 - - <0.01 - - 稀释到⼀定浓度后,具有花⾹。
二苯并蒽结构式

二苯并蒽结构式简介二苯并蒽(dibenz[a,h]anthracene)是一种多环芳香烃类化合物,由两个苯环和一个并蒽环组成。
它的分子式为C22H14,结构式如下图所示:H H H H\ / \ /C C|| ||H--C--C--C--C--C--C--C--H| | | | | | | | |H--C--C--C--C--C--C--C--H|| ||C C/ \ / \H H H H由于二苯并蒽分子中含有大量的芳香环,具有稠杂的结构,因此其物理和化学性质独特且重要。
本文将从不同角度对二苯并蒽的结构、性质、应用等方面进行探讨。
结构芳香环二苯并蒽分子中含有若干个芳香环,包括两个苯环和一个并蒽环。
芳香环具有共轭结构,具有特殊的稳定性和电子结构。
二苯并蒽的芳香环排列紧密,使得分子具有稠密的π电子体系,有助于其在化学反应中的表现。
双键结构二苯并蒽分子中存在多个双键,这些双键的存在使得分子具有一定的反应活性。
双键结构对二苯并蒽的化学性质和反应有重要影响。
性质物理性质二苯并蒽是一种固体,具有深棕色晶体的形态。
它的熔点较高,为398-400摄氏度,热稳定性较好。
二苯并蒽几乎不溶于水,但可溶于多种有机溶剂,如苯和乙醇。
化学性质1.氧化反应:二苯并蒽分子中的芳香环可以被氧化剂氧气氧化,生成二苯并蒽的氧化产物。
这种氧化反应在大气中也会发生,导致二苯并蒽易于氧化和降解。
2.加成反应:二苯并蒽中的双键结构容易发生加成反应,与含氧、氮、硫等原子的化合物发生反应,生成相应的加合物。
这些加合物在有机合成中具有重要应用价值。
生物学活性二苯并蒽具有较强的生物学活性,尤其是在毒性方面。
由于其分子结构中含有大量的芳香环,二苯并蒽具有一定的致癌性和致突变性。
因此,二苯并蒽被广泛用作实验室中的致突变剂,用于研究致突变的机制和效应。
应用光学材料二苯并蒽具有较强的吸收和发射光谱特性,因此在光学材料领域具有重要应用。
二苯并蒽可以被用作发光二极管(LED)的发光材料,用于制备高亮度和高效率的光电器件。
稠杂环化合物的命名规则
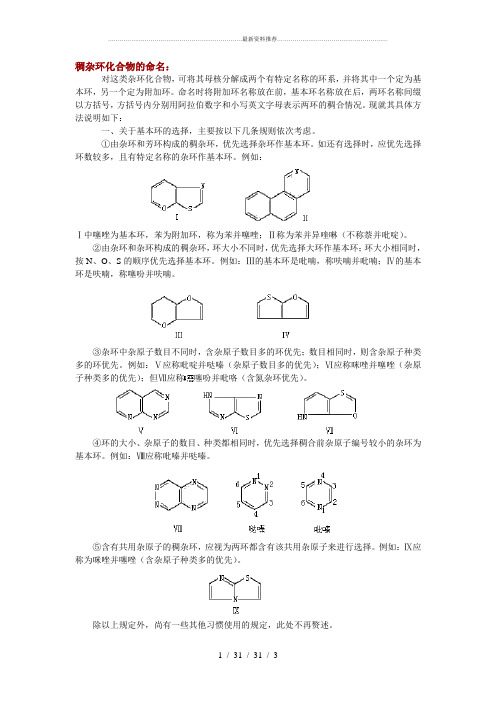
稠杂环化合物的命名:对这类杂环化合物,可将其母核分解成两个有特定名称的环系,并将其中一个定为基本环,另一个定为附加环。
命名时将附加环名称放在前,基本环名称放在后,两环名称间缀以方括号,方括号内分别用阿拉伯数字和小写英文字母表示两环的稠合情况。
现就其具体方法说明如下:一、关于基本环的选择,主要按以下几条规则依次考虑。
①由杂环和芳环构成的稠杂环,优先选择杂环作基本环。
如还有选择时,应优先选择环数较多,且有特定名称的杂环作基本环。
例如:Ⅰ中噻唑为基本环,苯为附加环,称为苯并噻唑;Ⅱ称为苯并异喹啉(不称萘并吡啶)。
②由杂环和杂环构成的稠杂环,环大小不同时,优先选择大环作基本环;环大小相同时,按N、O、S的顺序优先选择基本环。
例如:Ⅲ的基本环是吡喃,称呋喃并吡喃;Ⅳ的基本环是呋喃,称噻吩并呋喃。
③杂环中杂原子数目不同时,含杂原子数目多的环优先;数目相同时,则含杂原子种类多的环优先。
例如:Ⅴ应称吡啶并哒嗪(杂原子数目多的优先);Ⅵ应称咪唑并噻唑(杂原子种类多的优先);但Ⅶ应称噻吩并吡咯(含氮杂环优先)。
④环的大小、杂原子的数目、种类都相同时,优先选择稠合前杂原子编号较小的杂环为基本环。
例如:Ⅷ应称吡嗪并哒嗪。
⑤含有共用杂原子的稠杂环,应视为两环都含有该共用杂原子来进行选择。
例如:Ⅸ应称为咪唑并噻唑(含杂原子种类多的优先)。
除以上规定外,尚有一些其他习惯使用的规定,此处不再赘述。
二、稠合方式的表达:为了将基本环与附加环的稠合方式表达清楚,应先将两部分各自按编号原则编号,再将基本环的每条边按编号方向依次用a、b、c、d……代表,然后将附加环稠合边原子序号写在前,基本环稠合边字母写在后,二者之间用“-”隔开,一起放到两环系名称之间的方括号内。
附加环稠合边原子序号在书写时应与基本环字母次序的方向一致,两者顺序相同时小数字在前,大数字在后;反之则大数字在前,小数字在后。
例如:该化合物两环稠合边编号方向相反,命名时应使其一致,所以应称为咪唑并[2,1-b]噻唑,而不称咪唑并[1,2-b]噻唑。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
282
166
结合能/eV
164 162 结合能/eV
国家自然科学基金 (批准号: 51173205, 11334014) 和教育部留学回国人员科研启动基
金资助的课题.
†
通信作者. E-mail: mayee@
HOMO 下移,电离能则先减小后增大。下移的能带结构利于电子从界面向表面 的迁移以及空穴从表面向界面的迁移。 关键词:光电子能谱;能级结构;分子取向;薄膜生长 PACS:79.60.Jv, 68.35.bm, 79.60.-i, 73.20.-r
摘要
结合紫外光电子能谱(UPS)、X 射线光电子能谱(XPS)、原子力显微镜(AFM) 和掠入射 X 射线衍射谱(GIXRD)等实验手段系统研究了 2,7-二辛基[1]苯并噻吩 并[3,2-b]苯并噻吩(C8-BTBT)在 Cu(100)基底上的吸附、生长过程以及界面能级 结构。发现第一层的分子平躺吸附于 Cu(100)上形成稳定的物理吸附。随膜厚增 加分子取向转为直立于薄膜平面,生长模式转为岛状生长模式。分子取向的变 化导致 16Å 以后薄膜的能级结构发生变化。直立取向的分子在表面形成由内向 外的电偶极层,引起真空能级下降,功函数降低;而轨道电离的各向异性使得 分子从平躺到直立时 UPS 得到的最高占据轨道( HOMO)峰型发生变化,且 HOMO 起始边向深结合能端移动。整体上随着膜厚的增加,真空能级向下弯曲,
C 1s
(a)
100Å
S 2p
(b)
100Å 64Å
22 20 18
C/S比
(c)
强度/arb.units
64Å 32Å 16Å 8Å
D=0.22eV
32Å 16Å 8Å 4Å
D=0.20eV
16 14 12 10 8 0 20 40 60 80 100 C8-BTBT的厚度/Å
4Å
288
286
284
其迁移率有很强的各向异性[18],甚至在 π-π 堆垛方向迁移率要高于其他方向几 个量级[19]。因此器件设计应考虑使其分子排列方向有利于载流子输运过程。然 而在界面处,基底与有机分子的作用与有机分子之间的作用相互竞争,可能会 导致异于其体相排列的界面相。例如 He[20]等利用扫描隧道显微镜(STM)和原子 力学显微镜(AFM)系统研究了 C8-BTBT 在石墨烯、氮化硼衬底上的形貌和分子 取向,发现界面第一层 C8-BTBT 平躺于基底,而第二层后,分子开始竖立生长。 这种异于体相的界面相会显著影响影响载流子的输运过程。目前很多研究是基 于界面形貌对载流子输运过程的影响[21]。但是,从根本上决定界面输运过程的 是界面电子能级结构。因此,结合形貌学以及能级结构表征方法理解载流子的 输运行为,是深刻理解器件性能并且指导器件设计的根本。我们前期曾结合光 电子能谱以及形貌学测量研究了 C8-BTBT 应用于自旋器件的可能性,发现直接 生长于磁性金属 Ni 衬底上的 C8-BTBT 发生了催化脱硫反应,导致活性层成分 变化,降低了载流子迁移 [22]。因此,设计有机自旋器件时,需要考虑在磁性金 属衬底与 C8-BTBT 之间加入缓冲层以防止发生界面不可逆的化学反应。由于铜 单晶的晶格结构与晶格常数与磁性金属镍非常匹配,是很好的缓冲层材料。因 此我们研究了 C8-BTBT 在 Cu(100)上的界面吸附过程和能级结构演化。我们发 现在 Cu(100)上 C8-BTBT 没有发生催化脱硫反应,说明铜可以作为磁性电极与 C8-BTBT 之间的缓冲材料。第一层的分子平躺吸附于 Cu(100)上形成稳定的物 理吸附。随厚度增加,分子取向转为直立于薄膜平面,生长模式转为岛状生长 模式。分子取向的变化导致 16Å 以后薄膜的能级结构发生变化,整体上随着膜 厚的增加真空能级(Evac)向下弯曲,分子最高占据轨道(HOMO)下移。下移 的能带结构有利于电子从界面向表面的迁移以及空穴从表面向界面的迁移。
一 引
言
有机半导体材料是具有广阔应用前景的功能材料,近三十年来得到广泛的 研究,其良好的机械[1]、光学[2]、电学[3]和磁学[4]性能,在制备低成本、高柔性、 大面积电子器件,如有机发光二极管[5,6]、有机光伏器件[7]以及有机场效应管[8-10] 等方面有其独特的优越性。但是相比于传统硅基半导体,有机半导体材料最大 的瓶颈是其载流子迁移率比较低,如 1987 年 Koezuka[11]等利用聚噻吩得到的迁 移率只有 10-6~10-5 cm2/Vs。因此,大量的科研工作都围绕着提高载流子迁移率 而展开,比如从薄膜制备方法、合理选择材料分子结构和增加官能团等
Cu 2p
强度/arb.units
LEED
O1s 531.5eV C 1s 284.6eV
1000 800
600
400
200
结合能/eV
(网刊彩色)图 1 Ar+轰击/600℃退火前后的 Cu(100)衬底 XPS 全谱对比;插图为 Cu(100)LEED 图样 Figure.1. The XPS spectrum of Cu(100) before and after the Ar+ bombarding/annealing treatment. The inset is the LEED of Cu(100).
二 实
验
本实验中有机材料的真空沉积和光电子能谱测试是在我们自行组装的一套 超高真空系统下完成的 ,设备详述见参考文献[22]。这里简要介绍:有机分子束 蒸发腔(P < 2× 10-6 Pa)中蒸发制备的 C8-BTBT 薄膜通过径向传样腔送入分析腔(P < 2× 10-8 Pa)进行原位分析。UPS 和 XPS 中入射光与样品法向夹角均为 45° ,光 电子沿样品法线方向出射,并由半球能量分析器得到其能谱。所有测试能谱中 的电子能量都是相对于能量分析器的费米能级。 生长 C8-BTBT 之前我们对单晶衬底 Cu(100)(12 mm× 6 mm)用氩离子枪轰击 10 分钟,然后高温 600 ℃退火 1 小时。图 1 是经此处理前后基底的 XPS 全谱图 和低能电子衍射(LEED)图。可见 XPS 中处理前的 C、O 等杂质峰经处理后 已不可见,LEED 图样清晰,说明基底已经是洁净的单晶。然后将之传入有机 材料生长腔,C8-BTBT 粉末在氮化硼坩埚中加热至 114± 1℃蒸发并沉积到基底 上,衬底温度为 25±0.5ºC,通过石英晶振膜厚仪监控沉积速率,速率保持在 1~2 Å/min。每生长一定厚度的 C8-BTBT 薄膜,便传送至分析腔内进行能谱测 试,其厚度分别为 4 、 8、16 、32 、 64 和 100Å。能谱测量结束后,大气下对 100Å 的 C8-BTBT/Cu(100)进行 AFM 和 GIXRD 测试。
三 结果与讨论
1. C8-BTBT 在 Cu(100)界面的吸附过程 铜具有相当的催化特性,铜基脱硫剂在有机化工方面也有重要的用途 [23]。 含有两个噻吩单元 C8-BTBT 在 Cu(100)是否会发生脱硫反应,决定了 Cu 是否 能作为缓冲层应用于磁性金属与 C8-BTBT 之间。由于脱硫反应的产物一般是稳 定吸附于金属上的硫原子以及熔点较低的碳氢化合物,因此可以预期:如果第 一层吸附的 C8-BTBT 发生了催化脱硫反应,那么碳氢化合物由于其饱和蒸汽压 较高将蒸发到真空腔系统,而 S 原子与金属形成稳定的化学吸附物,那么 XPS 中探测到的 S 元素含量将相对增加, C 元素含量将相对减少。为此我们在 XPS 数据分析处理中扣除了 Shirley 背景并且考虑了相应元素峰的透过因子之后计算 了 C 1s 和 S 2p 峰下的面积比,由此来计算 C/S 元素比。我们发现 C/S 元素比, 在第一层 C8-BTBT 沉积到 Cu(100)上达到 4 Å 和 8 Å 厚度时,为 15:1 左右。与 C8-BTBT(化学式为:C30H40S2)中的元素比一致。随着厚度增加,这个比值略微 减少。但是整体来说, C/S 元素比在整个厚度区间维持在 15:1 左右。因此可以 初步判断,C8-BTBT 在 Cu(100)上没有发生脱硫反应。 另外,我们还可以通过考察 XPS 中 S 2p 的化学位移来判断是否发生了脱硫 反应。原子的内层电子结合能受到其所处化学环境的影响,不同的化学结合状 态会改变原子核的力场,使得电子结合能发生化学位移。如果发生了脱硫反应, XPS 能谱中 S 2p 的结合能将会发生变化。图 2(b)为 4-100Å 厚度下的 XPS 中的
[12-14]
方
面入手。目前得到的具有最高载流子迁移率的有机材料是 C8-BTBT,由 Yuan[12] 等将 C8-BTBT 与聚苯乙烯混合溶液采用简单的偏心旋涂方法制备获得,迁移率 达到 43 cm2/Vs,接近单晶硅的迁移率。结合分子自组装工艺[15,16]以及喷墨打印 技术[17]制备基于 C8-BTBT 的场效应管器件,也成为新一轮研究的热门,而这 种新型高迁移率材料也为有机自旋电子器件研究提供了取得突破进展的可能性。 一般而言,半导体器件的整体性能不仅受到各个功能层性能优劣的影响, 各个功能层之间的界面更是不容忽视的影响器件性能的重要因素。对于有机半 导体器件,有机层内分子取向、排列有序度、堆垛方式等对有机分子层内的载 流子传输产生重要影响。研究发现,含有共轭 π 键的平面有机分子形成的薄膜,
S 2p 峰。可以看到, 4-64Å 之间厚度的 C8-BTBT 能谱中 S 2p 都没有发生化学 位移,也说明了 S 原子附近的化学环境没有发生变化,也就是说界面没有发生 化学反应。膜厚 100 Å 时,S 2p 的峰向高结合能端偏移 0.20eV。但是这个偏移 不能确定是化学位移。因为我们还需要考虑 C 1s 的峰位与 S 2p 峰位的间隔。如 果发生了脱硫反应,电子云分布应该在 C 和 S 之间发生转移。因此,C 与 S 的 化学环境变化方向一般情况下是不一致的,因此其峰位移动的方向是相反的, 所以 C 1s 与 S 2p 之间的距离变化会较之他们各自的结合能变化更为显著。但是, 由图中我们可以看到,在 64 Å 之前,C 1s 与 S 2p 峰之间的距离没有明显变化。 膜厚达到 100 Å 时,S 2p 的峰向高结合能端偏移,而 C 1s 也向高结合能端偏移 0.22eV,但是 C 1s 与 S 2p 的距离仅仅变化了 0.02eV。这说明 S 2p 的这个偏移 可能是 XPS 整体谱的偏移导致的,这个整体偏移可能是由于薄膜导电性差导致 的电离过程中的电荷累积效果。 通过 C/S 比与分子元素比的一致性,以及 S 内层电子没有发生化学位移, 我们可以确认, C8-BTBT 在 Cu(100)界面上的吸附仍属于物理吸附。Ni 与 Cu 同属于过渡金属,而前期工作中我们曾在 C8-BTBT/Ni(100)的界面观察到了化 学吸附导致的脱硫反应,而本研究中没有观察到脱硫反应,这种差别的原因可 能是噻吩单元与 Ni 和 Cu 基底作用的强弱不同的原因。前人的研究表明[24,25], 噻吩在 Ni(100)和 Cu(100)上的吸附行为有很大的不同,在 Ni(100)表面噻吩发生 了作用力较强的化学吸附,噻吩内的 C-S 键有解离趋势,而在 Cu(100)表面的吸 附是作用力较弱的物理吸附。由于 C8-BTBT 与金属基底的相互作用主要集中于 噻吩单元与金属衬底的作用,因此这样的物理吸附是可以理解的,而这也说明 Cu 作为磁性衬底与 C8-BTBT 的缓冲层的可行性。
