各种液体的沸点
气体的熔沸点和液体的熔沸点

气体的熔沸点和液体的熔沸点
气体的熔沸点通常是指气体在标准大气压下的液化温度,也就是气体转变为液体的温度。
不同的气体具有不同的熔沸点,这取决于它们的分子结构和相互作用力。
例如,氧气的熔点是-218.79摄氏度,而氮气的熔点是-210摄氏度。
这些低温下的熔点使得氧气和氮气可以在液态下被储存和运输,对于工业和科学研究具有重要意义。
液体的熔沸点则是指液体转变为气体或固体的温度。
不同的液体具有不同的熔沸点,这取决于它们的分子间相互作用力和结构。
例如,水的熔点是0摄氏度,而乙醇的熔点是-114摄氏度。
液体的熔沸点对于生活中的许多方面都有重要意义,比如烹饪、工业生产和科学实验等。
总的来说,气体和液体的熔沸点是化学中重要的概念,它们不仅影响着物质在不同条件下的状态转换,也反映了物质分子间的相互作用力和性质。
对于科学研究和工程应用来说,深入理解和研究气体和液体的熔沸点具有重要的意义。
高沸点溶剂

六甲基亚膦酰三胺(HMPT)分子式:C6H18N3OP分子量:179.20CAS号:680-31-9性质:无色透明易流动的液体。
凝固点7.20℃。
沸点233℃(235℃),115℃(2.0kPa),105-107℃(1.47kPa),70-71℃(0.133kPa),66℃(67Pa)。
相对密度1.024(25/25℃),折光率1.4579。
闪点105℃。
能与水以及乙醇、乙醚和苯等有机溶剂混溶,但不溶于饱和烷烃。
它能被氯代烷从水溶液中萃取出来形成络合物。
易吸潮。
制备方法:由二甲胺与碱氯氧磷反应而得。
将二甲胺和三氯氧磷在溶剂三氧乙烯中反应,温度控制在40-60℃,反应时加入氨作为缚酸剂,与生成的氯化氢作用成为氯化铵沉淀。
反应结束后,过滤。
滤液回收三氯乙烯后用碱处理,再进行蒸馏,收集113-118℃(2.0kPa)馏分即得六甲基磷酰三胺。
无溶剂法新工艺产品纯度达99.2以上。
工业品六甲基磷酰三胺为无色或淡黄色透明液体。
催化剂级含量≥99.5%,一级品≥99.0%,二级品≥98.0%。
原料消耗定额:二甲胺2410kg/t、二氯氧磷1610kg/t、液氨430kg/t。
用途:该品是聚氯乙烯的耐候溶剂和优良的极性溶剂,对农用薄膜的耐低温防老化具有显著效果;它是一种多功能的对质子惰性的高沸点极性溶剂,作为高分子合成的溶剂如聚苯硫醚、芳香族聚酰胺的合成具有特殊效果,该品作为丙烯本体聚合的助催化剂,在乙丙橡胶中添加该品,可以提高弹体和耐油性。
六甲基磷酰三胺还用作气相色谱固定液、紫光抑制剂、火箭燃料降低冰点添加剂、化学灭菌剂。
六乙基亚膦酰三胺(HEPT)。
三甘醇,二甘醇,甘油浓硫酸,浓磷酸密度(g/mL,20/4℃):1.100 沸点(ºC,常压):189DMF,DMAc,学名二甲基乙酰胺分子式CH3CON(CH3)2,分子量:87.12,CAS号:127-19-5。
冰点-20℃,沸点166℃,96℃(10.7kPa),85-87℃(4.4kPa),74-74.5℃(3.47kPa),66-67℃(2.0kPa),62-63℃(1.6kPa),相对密度0.9366(25/4℃),0.9599(0/4℃),折射率1.4380。
水的沸点与凝点

水的沸点与凝点水是地球上最常见的物质之一,我们每天都与水密切接触。
水的沸点和凝点是水的物理特性之一,它们对我们的生活和科学研究都具有重要意义。
一、沸点的定义和测定沸点是指在标准大气压下,液体开始转变为气体的温度。
对于水来说,沸点是指水从液态转变为气态的温度。
在常温常压下,水的沸点为100摄氏度(摄氏度是国际上常用的温度单位),相应的华氏度为212华氏度。
沸点的测定可以通过开放系统和封闭系统两种方法实现。
在开放系统中,液体置于开放容器中加热,当液体的温度达到沸点时,液体表面会不断产生气泡,直至完全变为气体。
而在封闭系统中,液体、气体和水蒸气处于平衡状态,通过调整压力和温度,测定沸点。
二、沸点的影响因素水的沸点受到多种因素的影响,包括大气压力、溶质浓度和海拔高度等。
随着海拔的升高,大气压力下降,水的沸点也会相应降低。
这是因为沸点与水分子的蒸发速率有关,当大气压力较低时,水的蒸发速率加快,沸点降低。
此外,当向水中溶解某些物质时,会使水的沸点升高。
这是因为溶质与水分子形成了更多的分子间相互作用力,降低了水分子的蒸发速率,使沸点升高。
三、凝点的定义和测定凝点是指在标准大气压下,气体开始转变为液体的温度。
对于水来说,凝点是指水从气态转变为液态的温度。
在常温常压下,水的凝点为0摄氏度,相应的华氏度为32华氏度。
凝点的测定方法与沸点类似,可以使用开放系统和封闭系统两种方法。
在开放系统中,将气体在冷却的过程中,当温度降低到凝点时,气体会逐渐凝结成液体。
在封闭系统中,当液体、气体和水蒸气达到平衡状态时,测得的温度即为凝点。
四、沸点和凝点的应用水的沸点和凝点对于日常生活和科学研究具有广泛的应用。
在日常生活中,我们使用沸腾水来煮食物、沏茶或者洗涤。
了解水的沸点可以帮助我们控制加热的时机和温度,以保证食物的熟透或者茶的香气浓郁。
在科学研究中,水的沸点和凝点也被广泛应用。
通过测量不同物质的沸点和凝点,可以了解物质的性质和纯度,并在化学合成、制药和环境监测等领域提供参考数据。
十种沸点超过200℃的溶剂理化性质总结

十种沸点超过200℃的溶剂理化性质总结-标准化文件发布号:(9556-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII列举十种高沸点液体(>200℃),简单列出其理化性质,以及对金属盐的溶解能力:1、苯甲醇沸点:205 ℃密度:1.045 g/ml(25℃)水溶性:4.29 g/100mL(20℃)性质与用途、以及金属盐溶解性::①有极性,低毒,蒸汽压低,因此用作醇类溶剂。
可燃,可与乙醇、乙醚、苯、氯仿等有机溶剂混溶。
②苯甲醇不宜久贮,它在空气中能缓慢氧化为苯甲醛和苯甲醚。
③用作色谱分析试剂,也用于有机合成。
与卤化磷和氢卤酸反应生成卤化苄。
卤化苄和苯甲醇都是苄基(苯甲基)化试剂。
④可通过氯化苄与碳酸钾或碳酸钠长时间加热水解而得;或苯甲醛的甲醇溶液与氢氧化钠液在65~75℃下反应而得。
⑤能溶解Na,与其发生酸碱反应。
2、二甲酸酯(DBE)沸点:196~225 ℃密度:1.19 g/ml(25℃)水溶性:/性质与用途、以及金属盐溶解性::①DBE是由三种二价酸酯组成的混合物,是丁二酸二甲酯,戊二酸二甲酯和已二酸二甲三种良好环境溶剂的组合。
②低毒、低味、含水量低、使用安全;良好的稳定性,自然存放不会产生氧化和分解;沸点高,馏程长,可帮助调节整个溶剂系统的挥发速率③极好的溶解力,与聚氯酯树脂、丙烯酸树脂、聚酯树脂、醇酸树脂、环氧树脂等相溶性良好。
④生产时,先由甲醇同混和的二元酸反应,然后精馏分离成不同的产品。
3、苯甲酸乙酯沸点:212 ℃密度:1.045 g/ml(25℃)水溶性:insoluble性质与用途、以及金属盐溶解性::①无色液体,溶于乙醇、乙醚、石油醚、丙二醇、矿物油和大多数非挥发性油,不溶于水和甘油。
②用作溶剂及香料辅助剂,也用于有机合成:用作纤维素酯、纤维素醚、树脂类的溶剂、适用于香蕉、樱桃、梅子、葡萄等香精以及烟用和酒用香精中。
③由苯甲酸和乙醇在无水硫酸铝和微量硫酸存在下酯化而制备。
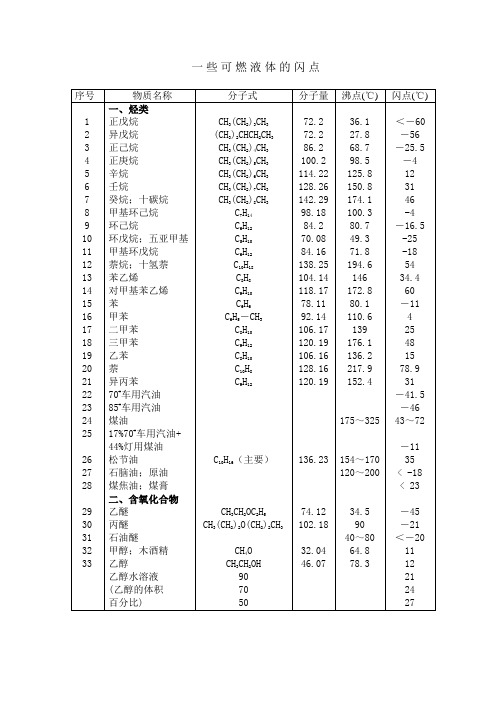
可燃液体沸点闪点表
50
51
52
53
54
55
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
丙醇;正丙醇
异丙醇
丁醇;正丁醇
1-戊醇;正戊醇
2-戊醇;仲戊醇
1-己醇;正己醇
2-己醇;仲己醇
乙醛;醋醛
丙酮
2-丁酮
2-戊酮;甲基丙基酮
3-戊酮;二乙基甲酮
2-己酮
甲基戊基甲酮
乙酰丙酮;戊二酮
环己酮
丁醛;正丁醛
甲酸甲酯
甲酸乙酯
乙酸甲酯
乙酸乙酯
乙酸丙酯
乙酸丁酯
乙酸戊酯
乙酸正己酯
异丁酸乙酯
丙烯酸甲酯
丙烯酸乙酯
1,2-环氧丙烷
二恶烷
呋喃
丁烯醛(巴豆醛)
丙烯醛
四氢呋喃
乙酸;醋酸
三、含卤化合物
氯代丁二烯
1,2一二氯乙烷
1,2一二氯丙烷
3-氯丙稀
2-氯丙烯
C3H8O
C3H8O
C4H10O
C5H12O
C5H12O
C6H14O
114.19
100.11
98.14
72.11
60.05
74.08
74.08
88.10
102.13
116.16
130.19
144.21
116.16
86.09
100.11
58.08
88.11
68.07
70.09
56.06
十种沸点超过200℃的溶剂理化性质总结

列举十种高沸点液体(>200℃),简单列出其理化性质,以及对金属盐的溶解能力:1、苯甲醇沸点:205 ℃密度:1.045 g/ml(25℃)水溶性:4.29 g/100mL(20℃)性质与用途、以及金属盐溶解性::①有极性,低毒,蒸汽压低,因此用作醇类溶剂。
可燃,可与乙醇、乙醚、苯、氯仿等有机溶剂混溶。
②苯甲醇不宜久贮,它在空气中能缓慢氧化为苯甲醛和苯甲醚。
③用作色谱分析试剂,也用于有机合成。
与卤化磷和氢卤酸反应生成卤化苄。
卤化苄和苯甲醇都是苄基(苯甲基)化试剂。
④可通过氯化苄与碳酸钾或碳酸钠长时间加热水解而得;或苯甲醛的甲醇溶液与氢氧化钠液在65~75℃下反应而得。
⑤能溶解Na,与其发生酸碱反应。
2、二甲酸酯(DBE)沸点:196~225 ℃密度:1.19 g/ml(25℃)水溶性:/性质与用途、以及金属盐溶解性::① DBE是由三种二价酸酯组成的混合物,是丁二酸二甲酯,戊二酸二甲酯和已二酸二甲三种良好环境溶剂的组合。
②低毒、低味、含水量低、使用安全;良好的稳定性,自然存放不会产生氧化和分解;沸点高,馏程长,可帮助调节整个溶剂系统的挥发速率③极好的溶解力,与聚氯酯树脂、丙烯酸树脂、聚酯树脂、醇酸树脂、环氧树脂等相溶性良好。
④生产时,先由甲醇同混和的二元酸反应,然后精馏分离成不同的产品。
3、苯甲酸乙酯沸点:212 ℃密度:1.045 g/ml(25℃)水溶性:insoluble性质与用途、以及金属盐溶解性::①无色液体,溶于乙醇、乙醚、石油醚、丙二醇、矿物油和大多数非挥发性油,不溶于水和甘油。
②用作溶剂及香料辅助剂,也用于有机合成:用作纤维素酯、纤维素醚、树脂类的溶剂、适用于香蕉、樱桃、梅子、葡萄等香精以及烟用和酒用香精中。
③由苯甲酸和乙醇在无水硫酸铝和微量硫酸存在下酯化而制备。
④苯甲酸乙酯的金属盐溶解性较好,能与多种金属盐和氯化锡、三氯化铝、氯化钛、碘化镁、五氯化锑等形成结晶性复合物,但不太稳定,在空气中易分解。
液体的沸腾条件

液体的沸腾条件液体的沸腾条件是指将液体加热到一定温度,使其发生快速蒸发的过程。
沸腾是液体从液态向气态的相变过程,也是一种热传导的形式。
在本文中,将详细介绍液体沸腾的条件以及与之相关的概念和现象。
首先,我们来了解液体的分子结构和运动状态对沸腾的影响。
液体是由分子组成的,而在液体中,分子之间会通过相互作用力进行吸引和排斥,保持着一定的有序结构。
当液体加热时,分子的平均动能会增加,分子之间的距离也会增大。
当液体温度升高到一定程度时,分子的动能能够克服相互作用力,分子间距增大到一定程度,液体发生沸腾。
其次,液体的沸腾与大气压强也有关系。
沸腾是液体在饱和蒸汽压等于大气压时发生的现象。
饱和蒸汽压是指液体表面上方单位面积的蒸气分子数与液体表面上单位面积的液体分子数之比。
当液体加热,液体中分子的动能增加,一部分液体分子能够克服表面张力和大气压强将其挽留在液面,从而形成蒸汽。
当饱和蒸汽压等于大气压时,液体的沸腾就会开始。
沸点是指在某一特定的大气压力下,液体开始沸腾的温度。
不同液体的沸点是不同的,这是由于不同液体的分子之间相互作用力和分子结构不同所导致的。
通常情况下,液体沸点的增加与该液体的分子间相互作用力增强有关。
例如,氨的沸点较低是因为氨分子之间的相互作用力较弱,而水的沸点较高是因为水分子之间的氢键相互作用力较强。
除了温度和大气压力,沸腾还受其他因素的影响。
例如,液体的表面性质和容器的形状和材质等。
液体的沸腾通常发生在液体的表面,因此液体的表面性质可以影响沸腾的速率和形态。
如果液体的表面张力较高,液体分子从液体内部挥发出来的能量就较大,沸腾速率也会较高。
此外,容器的形状和材质也会对沸腾产生影响。
例如,容器的底部形状越平整,液体分子扩散到液体表面的距离越短,从而促进沸腾。
在实际应用中,沸腾是常用的分离、加热和加工液体的方法之一。
利用液体沸腾的原理,可以将液体中的杂质、溶解物质和揮发性组分高效地分离出来。
此外,沸腾还是许多加热和反应过程的基础。
大气压与水的沸点对照表
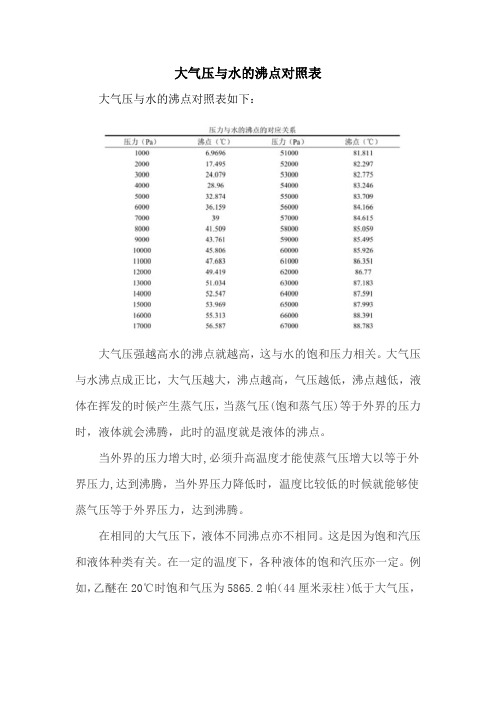
大气压与水的沸点对照表
大气压与水的沸点对照表如下:
大气压强越高水的沸点就越高,这与水的饱和压力相关。
大气压与水沸点成正比,大气压越大,沸点越高,气压越低,沸点越低,液体在挥发的时候产生蒸气压,当蒸气压(饱和蒸气压)等于外界的压力时,液体就会沸腾,此时的温度就是液体的沸点。
当外界的压力增大时,必须升高温度才能使蒸气压增大以等于外界压力,达到沸腾,当外界压力降低时,温度比较低的时候就能够使蒸气压等于外界压力,达到沸腾。
在相同的大气压下,液体不同沸点亦不相同。
这是因为饱和汽压和液体种类有关。
在一定的温度下,各种液体的饱和汽压亦一定。
例如,乙醚在20℃时饱和气压为5865.2帕(44厘米汞柱)低于大气压,
温度稍有升高,使乙醚的饱和汽压与大气压强相等,将乙醚加热到35℃即可沸腾。
液体中若含有杂质,则对液体的沸点亦有影响。
液体中含有溶质后它的沸点要比纯净的液体高,这是由于存在溶质后,液体分子之间的引力增加了,液体不易汽化,饱和汽压也较小。
要使饱和汽压与大气压相同,必须提高沸点。
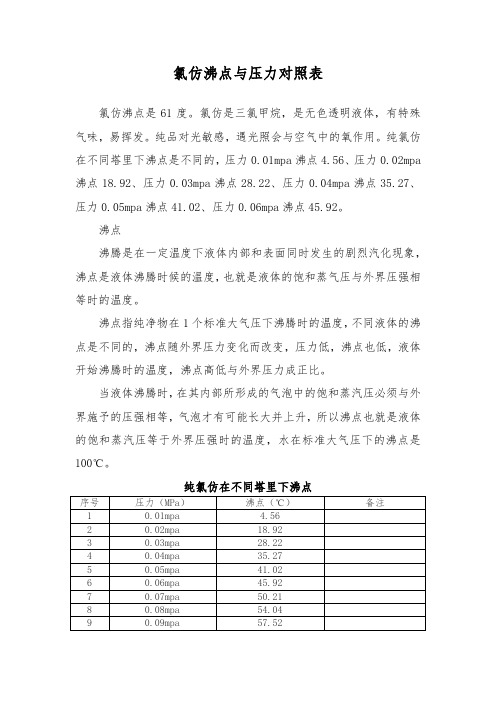
氯仿沸点与压力对照表
氯仿沸点与压力对照表
氯仿沸点是61度。
氯仿是三氯甲烷,是无色透明液体,有特殊气味,易挥发。
纯品对光敏感,遇光照会与空气中的氧作用。
纯氯仿在不同塔里下沸点是不同的,压力0.01mpa沸点4.56、压力0.02mpa 沸点18.92、压力0.03mpa沸点28.22、压力0.04mpa沸点35.27、压力0.05mpa沸点41.02、压力0.06mpa沸点45.92。
沸点
沸腾是在一定温度下液体内部和表面同时发生的剧烈汽化现象,沸点是液体沸腾时候的温度,也就是液体的饱和蒸气压与外界压强相等时的温度。
沸点指纯净物在1个标准大气压下沸腾时的温度,不同液体的沸点是不同的,沸点随外界压力变化而改变,压力低,沸点也低,液体开始沸腾时的温度,沸点高低与外界压力成正比。
当液体沸腾时,在其内部所形成的气泡中的饱和蒸汽压必须与外界施予的压强相等,气泡才有可能长大并上升,所以沸点也就是液体的饱和蒸汽压等于外界压强时的温度,水在标准大气压下的沸点是100℃。
纯氯仿在不同塔里下沸点。
乙酸水溶液的沸点

乙酸水溶液的沸点乙酸(化学式:CH3COOH)是一种常见的有机化合物,也是一种常见的醋酸。
由于其在水中的溶解度较高,因此乙酸水溶液是一种常见的溶液。
在本文中,我们将讨论乙酸水溶液的沸点及其影响因素。
沸点是指在特定的温度和压力条件下,液体转化为气体的温度。
对于乙酸水溶液,它的沸点取决于其中乙酸的浓度。
纯乙酸的沸点约为118℃,而溶于水中的乙酸沸点则会有所降低。
通常情况下,乙酸浓度越高,其水溶液的沸点也会越高。
乙酸是一种极性分子,其分子内部存在着产生了的共价键极性。
当乙酸溶解于水中时,水分子与乙酸分子通过氢键相互作用。
这种氢键的形成导致水溶液中的乙酸分子之间的距离变得更近。
因此,水分子与乙酸分子之间的相互吸引力增强,需要更多的热量才能将其转化为气体。
所以,乙酸水溶液的沸点相对于纯乙酸而言要提高。
除了乙酸的浓度,环境因素对乙酸水溶液的沸点也会产生影响。
其中一个主要的因素是压力。
在大气压下,乙酸水溶液的沸点约为100℃。
然而,当压力降低时,沸点也会相应下降。
这是因为压力越低,液体分子越容易获得足够的动能,从而转化为气体。
此外,溶质的存在也可以影响乙酸水溶液的沸点。
溶质可以改变液体中的物质浓度,从而改变了液体分子之间的相互作用。
例如,当向乙酸水溶液中添加盐类时,盐类的离子可以干扰乙酸分子之间的氢键作用,导致乙酸分子更容易转化为气体。
因此,乙酸水溶液中存在溶质时,沸点会降低。
总之,乙酸水溶液的沸点取决于其中乙酸的浓度以及环境因素如压力和溶质的存在。
乙酸浓度越高,沸点也会相应提高;压力越低,沸点也会下降;溶质的存在也会降低沸点。
这些因素的综合影响导致了乙酸水溶液的沸点在不同条件下的变化。
同时,需要注意的是,本文所提及的乙酸水溶液的沸点是在常规的大气压下的情况下讨论的。
在高海拔地区或者低压环境中,由于压力较低,乙酸水溶液的沸点会相应降低。
相反,在高压环境中,乙酸水溶液的沸点会升高。
乙酸水溶液的沸点特性对许多实际应用具有重要意义。
各种液体的沸点共13页word资料

液氨-33.35特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性液态二氧化硫-10.08溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒甲胺-6.3是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺7.4是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似乙醚34.6微溶于水易溶与盐酸与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性戊烷36.1与乙醇、乙醚等多数有机溶剂混溶低毒性二氯甲烷39.75与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强二硫化碳46.23微溶与水,与多种有机溶剂混溶麻醉性,强刺激性溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大丙酮56.12与水、醇、醚、烃混溶低毒,类乙醇,但较大11-二氯乙烷57.28与醇、醚等大多数有机溶剂混溶低毒、局部刺激性氯仿61.15与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性甲醇64.5与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性,四氢呋喃66优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷68.7甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。
麻醉性,刺激性三氟代乙酸71.78与水乙醇乙醚丙酮苯四氯化碳己烷混溶溶解多种脂肪族芳香族化合物111-三氯乙烷74.0与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂四氯化碳76.75与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中毒性最强乙酸乙酯77.112与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性乙醇78.3与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性丁酮79.64与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,丙酮苯80.10难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性环己烷80.72与乙醇、高级醇、醚、丙酮、烃、氯代烃、高级脂肪酸、胺类混溶低毒,中枢抑制作用名人堂:众名人带你感受他们的驱动人生马云任志强李嘉诚柳传志史玉柱乙睛81.60与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒异丙醇82.40与乙醇、乙醚、氯仿、水混溶微毒,类似乙醇12-二氯乙烷83.48与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌乙二醇二甲醚85.2溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。
异戊烷沸点与压力对照表

异戊烷沸点与压力对照表异戊烷是一种有机化合物,其化学式为C5H12。
它是一种无色、可燃的液体,在常温下呈现出较低的沸点。
本文将以异戊烷的沸点与压力对照表为基础,探讨其沸点与压力之间的关系,并解释其中的原因。
在进行实验时,我们可以通过改变压力来观察异戊烷的沸点变化。
下面是一份异戊烷沸点与压力对照表,供参考:压力(atm)沸点(摄氏度)0.5 -11.71.0 11.71.5 28.22.0 39.12.5 47.93.0 55.0从上表可以看出,随着压力的增加,异戊烷的沸点也相应升高。
这是由于压力增加会影响分子间的相互作用力,从而改变了液体分子的动能。
当压力较低时,分子之间的相互作用力较弱。
在这种情况下,分子更容易逃逸从而转变为气体,所以异戊烷的沸点较低。
随着压力的增加,分子之间的相互作用力增强,使得分子更难以逃逸,因此沸点逐渐升高。
异戊烷的沸点与压力之间存在着一定的关系。
根据气体状态方程,沸点与压力之间的关系可以通过以下公式来描述:沸点= A × ln(压力) + B其中,A和B是常数。
根据实验数据,可以通过线性回归分析来确定A和B的值。
然而,在本文中我们将避免使用这种公式。
除了压力,还有其他因素也会影响异戊烷的沸点。
其中最重要的因素是分子间的相互作用力。
分子间的相互作用力越强,沸点也越高。
这是因为在高沸点下,分子之间的相互作用力能够克服分子的动能,使得液体保持在液态状态。
分子的分子量和分子结构也会对沸点产生影响。
较大的分子通常会有更高的沸点,因为它们之间的相互作用力更强。
而分子结构的不同也会导致沸点的差异。
例如,链状分子和环状分子之间的相互作用力不同,因此它们的沸点也会有所不同。
需要注意的是,沸点与压力之间的关系并不是线性的。
随着压力的继续增加,沸点的增加速率会逐渐减小,最终趋于一个极限值。
这是因为在极高的压力下,分子间的相互作用力已经足够强大,能够抵抗住分子的动能,使液体保持在液态状态。
液氮沸点与压力对照表

液氮沸点与压力对照表液氮是指在常压下,氮气经过冷却而形成的液体状态。
液氮的沸点在常温下约为-196℃,是常见的低温液体之一。
液氮具有很多独特的性质,如低温、无色、无味等。
由于其低温特性,液氮被广泛应用于各个领域,如冷冻食品、超导材料、医疗保健等。
液氮的沸点与压力之间存在着一定的关系。
根据气体状态方程,液体的沸点与压力成正比。
当液体的压力增加时,其沸点也会相应增加。
液氮的沸点与压力之间的对照关系可通过实验测得并整理成对照表。
以下是液氮沸点与压力对照表的一部分内容:压力(kPa)沸点(℃)100 -196200 -190300 -185400 -180由上表可见,随着液氮的压力增加,其沸点也呈现出增加的趋势。
这是由于液氮分子间的相互作用力增强,需要更高的能量来克服分子间的吸引力而使液氮转变为气态。
液氮的沸点与压力之间的关系也可以通过理论计算得出。
根据气体状态方程PV=nRT,其中P为压力,V为体积,n为物质的摩尔数,R 为气体常数,T为温度。
当液氮从液态转变为气态时,体积增大,因此根据状态方程可以推导出液氮的沸点与压力之间的关系。
液氮的沸点与压力的关系也受到一些其他因素的影响。
例如,液氮的纯度、容器的材质和形状等都会对其沸点产生一定的影响。
此外,液氮的沸点也会受到周围环境温度的影响。
在高温环境下,液氮的沸点会相应升高。
液氮的沸点与压力之间存在着一定的关系,通过实验测得并整理成对照表可以清晰地展现出这种关系。
液氮的沸点随着压力的增加而增加,这是由于液氮分子间的相互作用力增强所致。
液氮沸点与压力的关系对于研究和应用液氮具有重要意义,深入了解这种关系可以更好地利用液氮的特性和性质。
戊烷的沸点

戊烷的沸点沸点即指液体在加热过程中,当温度达到一定值时,液体由均匀态转化为蒸汽状态的过渡温度,也叫液体汽化点。
沸点是物质特性之一,对于研究物质性质及溶解性质及矿物质的合成等有重要意义。
戊烷(乙烷)的沸点是25.7℃,既热板的沸点介于正戊烷和己烷之间,也称为烯,是一种重要的天然烃类物质。
戊烷(乙烷)是一类特殊的烃,它在无水环境下互联制成液体,其本质是由多个戊烷分子组成的大分子化合物,具有非常活跃的反应活性,而且容易分解。
它是一种通用的有机化学品,被广泛应用于新药的合成,也被用于有机试剂的制备等。
它的沸点比正烷(丁烷)高,比己烷(辛烷)低,沸点为25.7℃。
戊烷(乙烷)的沸点决定了它的热特性和其他性质,决定了它的分子结构与形状,而沸点也是用於分离和分析混合物中组分的重要参数。
两种烃类物质互相混合时,混合物的沸点要低于两者沸点相加,有利于分离出不同的烃类物质。
沸点的具体值也可以衡量有机分子的稳定性,常温下比较高的沸点表示分子间结合较强,分子稳定性较高。
戊烷(乙烷)的沸点也受到分子形状和大小的影响,属於长链烷烃,它的分子弯曲度越大,沸点就越高;分子越大沸点也越高。
这是因为分子形状和大小决定了分子间结合形式与密度,同时也影响了液体在加热过程中汽化能力,也决定了液体所需要的能量。
此外,戊烷(乙烷)的沸点还受到温度和压力的影响,随着温度的升高,物质的分子动能增大,进而促使液体由液体转换为蒸汽,从而使液体的汽化能力提高,沸点也随之升高;随着压力的增加液体的汽化能力降低,沸点就会降低。
戊烷(乙烷)的沸点受多种因素的影响,而确定其沸点值又能有助于我们更加清楚的研究其物理化学性质。
它被广泛应用于混合物的分离,新药的合成等领域,能为相关工作提供技术支持。
此外,它的沸点也是测定各类有机化学反应的重要参数,是研究其他物理性质的重要参考。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
液氨-33.35℃特殊溶解性:能溶解碱金属和碱土金属剧毒性、腐蚀性液态二氧化硫-10.08溶解胺、醚、醇苯酚、有机酸、芳香烃、溴、二硫化碳,多数饱和烃不溶剧毒甲胺-6.3是多数有机物和无机物的优良溶剂,液态甲胺与水、醚、苯、丙酮、低级醇混溶,其盐酸盐易溶于水,不溶于醇、醚、酮、氯仿、乙酸乙酯中等毒性,易燃二甲胺7.4是有机物和无机物的优良溶剂,溶于水、低级醇、醚、低极性溶剂强烈刺激性石油醚不溶于水,与丙酮、乙醚、乙酸乙酯、苯、氯仿及甲醇以上高级醇混溶与低级烷相似乙醚34.6微溶于水,易溶与盐酸.与醇、醚、石油醚、苯、氯仿等多数有机溶剂混溶麻醉性戊烷36.1与乙醇、乙醚等多数有机溶剂混溶低毒性二氯甲烷39.75与醇、醚、氯仿、苯、二硫化碳等有机溶剂混溶低毒,麻醉性强二硫化碳46.23微溶与水,与多种有机溶剂混溶麻醉性,强刺激性溶剂石油脑与乙醇、丙酮、戊醇混溶较其他石油系溶剂大丙酮56.12与水、醇、醚、烃混溶低毒,类乙醇,但较大1,1-二氯乙烷57.28与醇、醚等大多数有机溶剂混溶低毒、局部刺激性氯仿61.15与乙醇、乙醚、石油醚、卤代烃、四氯化碳、二硫化碳等混溶中等毒性,强麻醉性甲醇64.5与水、乙醚、醇、酯、卤代烃、苯、酮混溶中等毒性,麻醉性,四氢呋喃66优良溶剂,与水混溶,很好的溶解乙醇、乙醚、脂肪烃、芳香烃、氯化烃吸入微毒,经口低毒己烷68.7甲醇部分溶解,比乙醇高的醇、醚丙酮、氯仿混溶低毒。
麻醉性,刺激性三氟代乙酸71.78与水,乙醇,乙醚,丙酮,苯,四氯化碳,己烷混溶,溶解多种脂肪族,芳香族化合物,1,1-三氯乙烷74.0与丙酮、、甲醇、乙醚、苯、四氯化碳等有机溶剂混溶低毒类溶剂四氯化碳76.75与醇、醚、石油醚、石油脑、冰醋酸、二硫化碳、氯代烃混溶氯代甲烷中,毒性最强乙酸乙酯77.112与醇、醚、氯仿、丙酮、苯等大多数有机溶剂溶解,能溶解某些金属盐低毒,麻醉性乙醇78.3与水、乙醚、氯仿、酯、烃类衍生物等有机溶剂混溶微毒类,麻醉性丁酮79.64与丙酮相似,与醇、醚、苯等大多数有机溶剂混溶低毒,毒性强于丙酮苯80.10难溶于水,与甘油、乙二醇、乙醇、氯仿、乙醚、、四氯化碳、二硫化碳、丙酮、甲苯、二甲苯、冰醋酸、脂肪烃等大多有机物混溶强烈毒性环己烷80.72与乙醇、高级醇、醚、丙酮、烃、氯代烃、高级脂肪酸、胺类混溶低毒,中枢抑制作用名人堂:众名人带你感受他们的驱动人生马云任志强李嘉诚柳传志史玉柱乙睛81.60与水、甲醇、乙酸甲酯、乙酸乙酯、丙酮、醚、氯仿、四氯化碳、氯乙烯及各种不饱和烃混溶,但是不与饱和烃混溶中等毒性,大量吸入蒸气,引起急性中毒异丙醇82.40与乙醇、乙醚、氯仿、水混溶微毒,类似乙醇1,2-二氯乙烷83.48与乙醇、乙醚、氯仿、四氯化碳等多种有机溶剂混溶高毒性、致癌乙二醇二甲醚85.2溶于水,与醇、醚、酮、酯、烃、氯代烃等多种有机溶剂混溶。
能溶解各种树脂,还是二氧化硫、氯代甲烷、乙烯等气体的优良溶剂吸入和经口低毒三氯乙烯87.19不溶于水,与乙醇.乙醚、丙酮、苯、乙酸乙酯、脂肪族氯代烃、汽油混溶有机有毒品三乙胺89.6水:18.7以下混溶,以上微溶。
易溶于氯仿、丙酮,溶于乙醇、乙醚易爆,皮肤黏膜刺激性强丙睛97.35溶解醇、醚、DMF、乙二胺等有机物,与多种金属盐形成加成有机物高毒性,与氢氰酸相似庚烷98.4与己烷类似低毒,刺激性、麻醉性水100略略硝基甲烷101.2与醇、醚、四氯化碳、DMF、等混溶麻醉性,刺激性1,4-二氧六环101.32能与水及多数有机溶剂混溶,仍溶解能力很强微毒,强于乙醚2~3倍甲苯110.63不溶于水,与甲醇、乙醇、氯仿、丙酮、乙醚、冰醋酸、苯等有机溶剂混溶低毒类,麻醉作用硝基乙烷114.0与醇、醚、氯仿混溶,溶解多种树脂和纤维素衍生物局部刺激性较强吡啶115.3与水、醇、醚、石油醚、苯、油类混溶。
能溶多种有机物和无机物低毒,皮肤黏膜刺激性4-甲基-2-戊酮115.9能与乙醇、乙醚、苯等大多数有机溶剂和动植物油相混溶毒性和局部刺激性较强乙二胺117.26溶于水、乙醇、苯和乙醚,微溶于庚烷刺激皮肤、眼睛丁醇117.7与醇、醚、苯混溶低毒,大于乙醇3倍乙酸118.1与水、乙醇、乙醚、四氯化碳混溶,不溶于二硫化碳及C12以上高级脂肪烃低毒,浓溶液毒性强乙二醇一甲醚124.6与水、醛、醚、苯、乙二醇、丙酮、四氯化碳、DMF等混溶低毒类辛烷125.67几乎不溶于水,微溶于乙醇,与醚、丙酮、石油醚、苯、氯仿、汽油混溶低毒性,麻醉性乙酸丁酯优良有机溶剂,广泛应用于医药行业,还可以用做萃取剂一般条件毒性不大吗啉128.94溶解能力强,超过二氧六环、苯、和吡啶,与水混溶,溶解丙酮、苯、乙醚、甲醇、乙醇、乙二醇、2-己酮、蓖麻油、松节油、松脂等腐蚀皮肤,刺激眼和结膜,蒸汽引起肝肾病变氯苯131.69能与醇、醚、脂肪烃、芳香烃、和有机氯化物等多种有机溶剂混溶低于苯,损害中枢系统,乙二醇一乙醚135.6与乙二醇一甲醚相似,但是极性小,与水、醇、醚、四氯化碳、丙酮混溶低毒类,二级易燃液体对二甲苯不溶于水,与醇、醚和其他有机溶剂混溶一级易燃液体二甲苯138.5~141.5不溶于水,与乙醇、乙醚、苯、烃等有机溶剂混溶,乙二醇、甲醇、2-氯乙醇等极性溶剂部分溶解一级易燃液体,低毒类间二甲苯139.10不溶于水,与醇、醚、氯仿混溶,室温下溶解乙睛、DMF等一级易燃液体醋酸酐140.0邻二甲苯144.41不溶于水,与乙醇、乙醚、氯仿等混溶一级易燃液体N,N-二甲基甲酰胺153.0与水、醇、醚、酮、不饱和烃、芳香烃烃等混溶,溶解能力强低毒环己酮155.65与甲醇、乙醇、苯、丙酮、己烷、乙醚、硝基苯、石油脑、二甲苯、乙二醇、乙酸异戊酯、二乙胺及其他多种有机溶剂混溶低毒类,有麻醉性,中毒几率比较小环己醇161与醇、醚、二硫化碳、丙酮、氯仿、苯、脂肪烃、芳香烃、卤代烃混溶低毒,无血液毒性,刺激性N,N-二甲基乙酰胺166.1溶解不饱和脂肪烃,与水、醚、酯、酮、芳香族化合物混溶微毒类糠醛161.8与醇、醚、氯仿、丙酮、苯等混溶,部分溶解低沸点脂肪烃,无机物一般不溶有毒品,刺激眼睛,催泪N-甲基甲酰胺180~185与苯混溶,溶于水和醇,不溶于醚一级易燃液体苯酚(石炭酸)181.2溶于乙醇、乙醚、乙酸、甘油、氯仿、二硫化碳和苯等,难溶于烃类溶剂,65.3℃以上与水混溶,65.3℃以下分层高毒类对皮肤、黏膜有强烈腐蚀性,可经皮吸收中毒1,2-丙二醇187.3与水、乙醇、乙醚、氯仿、丙酮等多种有机溶剂混溶低毒,吸湿,不宜静注二甲亚砜189.0与水、甲醇、乙醇、乙二醇、甘油、乙醛、丙酮乙酸乙酯吡啶、芳烃混溶微毒,对眼有刺激性邻甲酚190.95微溶于水,能与乙醇、乙醚、苯、氯仿、乙二醇、甘油等混溶参照甲酚NN-二甲基苯胺193微溶于水,能随水蒸气挥发,与醇、醚、氯仿、苯等混溶,能溶解多种有机物抑制中枢和循环系统,经皮肤吸收中毒乙二醇197.85与水、乙醇、丙酮、乙酸、甘油、吡啶混溶,与氯仿、乙醚、苯、二硫化碳等男溶,对烃类、卤代烃不溶,溶解食盐、氯化锌等无机物低毒类,可经皮肤吸收中毒对甲酚201.88参照甲酚参照甲酚N-甲基吡咯烷酮202与水混溶,除低级脂肪烃可以溶解大多无机,有机物,极性气体,高分子化合物毒性低,不可内服间甲酚202.7参照甲酚与甲酚相似,参照甲酚苄醇205.45与乙醇、乙醚、氯仿混溶,20℃在水中溶解3.8%(wt)低毒,黏膜刺激性甲酚210微溶于水,能于乙醇、乙醚、苯、氯仿、乙二醇、甘油等混溶低毒类,腐蚀性,与苯酚相似甲酰胺210.5与水、醇、乙二醇、丙酮、乙酸、二氧六环、甘油、苯酚混溶,几乎不溶于脂肪烃、芳香烃、醚、卤代烃、氯苯、硝基苯等皮肤、黏膜刺激性、惊皮肤吸收硝基苯210.9几乎不溶于水,与醇、醚、苯等有机物混溶,对有机物溶解能力强剧毒,可经皮肤吸收乙酰胺221.15溶于水、醇、吡啶、氯仿、甘油、热苯、丁酮、丁醇、苄醇,微溶于乙醚毒性较低六甲基磷酸三酰胺233(H M T A)与水混溶,与氯仿络合,溶于醇、醚、酯、苯、酮、烃、卤代烃等较大毒性喹啉237.10溶于热水、稀酸、乙醇、乙醚、丙酮、苯、氯仿、二硫化碳等中等毒性,刺激皮肤和眼乙二醇碳酸酯238与热水,醇,苯,醚,乙酸乙酯,乙酸混溶,干燥醚,四氯化碳,石油醚,CCl4中不溶毒性低二甘醇244.8与水、乙醇、乙二醇、丙酮、氯仿、糠醛混溶,与乙醚、四氯化碳等不混溶微毒,经皮吸收,刺激性小丁二睛267溶于水,易溶于乙醇和乙醚,微溶于二硫化碳、己烷中等毒性环丁砜287.3几乎能与所有有机溶剂混溶,除脂肪烃外能溶解大多数有机物甘油290.0与水、乙醇混溶,不溶于乙醚、氯仿、二硫化碳、苯、四氯化碳、石油醚食用对人体无毒。
