第13章 波谱学基础知识
波谱总复习
波谱总复习一.名词解释:1.饱和:低能态与高能态核数趋于相等,吸收信号完全消失。
2. 驰豫:高能态的原子核不发射原来所吸收的能量由高能态回到低能态的过程。
(非辐射)3. 自旋一晶格驰豫(纵向驰豫):高能态的核自旋体系与其周围的环境之间的能量交换过程。
4. 自旋-自旋驰豫(横向驰豫):一些高能态的自旋核把能量转移给同类的低能态核,同时一些低能态的核获得能量跃迁到高能态,因而各种取向的核的总数并没有改变,全体核的总能量也不改变。
5. 屏蔽效应(Shielding effect)核外电子在与外加磁场垂直的平面上绕核旋转时将产生一个与外加磁场相对抗的第二磁场,使原子核实际所受磁场减弱,这种作用叫做电子的屏蔽效应。
hv(频率)=△E=2μ(磁矩)H0(1-σ)6. 屏蔽常数σ( shielding constant)电子屏蔽作用大小,取决于核外电子云密度,即化学环境。
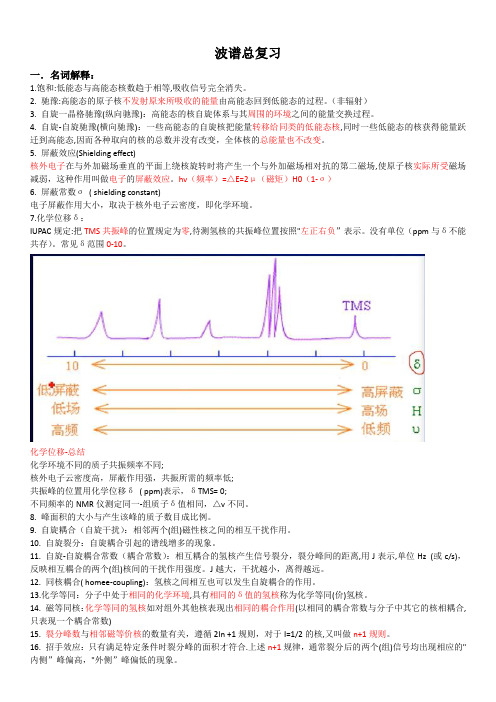
7.化学位移δ:IUPAC规定:把TMS共振峰的位置规定为零,待测氢核的共振峰位置按照"左正右负”表示。
没有单位(ppm与δ不能共存)。
常见δ范围0-10。
化学位移-总结化学环境不同的质子共振频率不同;核外电子云密度高,屏蔽作用强,共振所需的频率低;共振峰的位置用化学位移δ( ppm)表示,δTMS= 0;不同频率的NMR仪测定同一-组质子δ值相同,△v不同。
8. 峰面积的大小与产生该峰的质子数目成比例。
9. 自旋耦合(自旋干扰):相邻两个(组)磁性核之间的相互干扰作用。
10. 自旋裂分:自旋耦合引起的谱线增多的现象。
11. 自旋-自旋耦合常数(耦合常数):相互耦合的氢核产生信号裂分,裂分峰间的距离,用J表示,单位Hz (或c/s),反映相互耦合的两个(组)核间的干扰作用强度。
J越大,干扰越小,离得越远。
12. 同核耦合( homee-coupling):氢核之间相互也可以发生自旋耦合的作用。
13.化学等同:分子中处于相同的化学环境,具有相同的δ值的氢核称为化学等同(价)氢核。
波谱分析知识点

波谱分析(spectra analysis)波谱分析的内涵与外延:定义:利用特定的仪器,测试化合物的多种特征波谱图,通过分析推断化合物的分子结构。
特定的仪器:紫外,红外,核磁,质谱,(X-射线,圆二色谱等)特征波谱图: 四大谱;X-射线单晶衍射,圆二色谱等化合物:一般为纯的有机化合物分子结构:分子中原子的连接顺序、位置;构象,空间结构仪器分析(定量),波谱分析(定性)综合性、交叉科学(化学、物理、数学、自动化、计算机)作用:波谱解析理论原理是物理学,主要应用于化学领域(天然产物化学和中药化学、有机化学、药物化学等),在药物、化工,石油,食品及其它工业部门有着广泛的应用;分析的主要对象是有机化合物。
第一章紫外光谱(ultraviolet spectra,UV)一、电磁波的基本性质和分类1、波粒二象性光的三要素:波长(λ),速度(c),频率 (v)电磁波的波动性电磁波的粒子性光速 c:c=3.0×10^10 cm/s 波长λ :电磁波相邻波峰间的距离。
用nm,μm,cm,m 等表示频率v:v=c/ λ,用 Hz 表示。
光子具有能量,其能量大小由下式决定:E = hν = hc/λ (式中E为光子的能量,h为普朗克常数,其值为6.624× 10-34j.s )2、分子的能量组成(能级图)E 分子= E平+ E转+ E振+E电子能量大小: E转< E振< E电子X-射线衍射紫外-可见光谱红外光谱微波吸收谱核磁共振谱内层电子能级跃迁外层电子分子振动与转动分子转动电子自旋核自旋X-射线远紫外近紫外可见近红外中红外远红外微波无线电波0.1~1nm 4~200nm 200~400nm400~800nm0.8~2.5um25~400um0.04~25cm25~1000cm 紫外光谱远紫外(4~200nm):又叫真空紫外区近紫外(200~400nm):又叫石英紫外区,最为常用。
电子跃迁类型的影响σ→σ*跃迁:150nm左右,真空紫外区n→σ*跃迁:一般小于200nm 弱吸收,ε约100π→π*跃迁:160~180nm(孤立双键),>200nm (共轭双键)强吸收,ε约104n→π*跃迁:200~400nm 弱吸收,ε约1002.3.表示方法和常用术语发色团:广义上讲,是分子中能吸收紫外光或可见光的结构系统。
波谱学复习资料

n-π跃迁
π-π*跃迁
在环己烷中测定该化合物的紫外光谱时,得到两个数据(λmax): 245nm 、308nm ,如果调PH值12左右时,又会在323nm处出现吸收峰,试解释产生 这种现象的原因。 由于烯醇互变现象:245nm 酮式结构的n-π跃迁
官能团区:4000~1300cm-1 4000-2500cm-1: X-H(X:C,N,O,S)单键的伸缩振动区。 2500-2000cm-1: 叁键和累积双键伸缩振动区 2000-1500cm-1: 双键伸缩振动区 1500-1300cm-1: 弯曲振动, 单键(除X-H)的伸缩振动 指纹区: 1300~600cm-1
异丙基1380 cm-1峰分裂成强度相差小的两个峰。叔丁基, 1380 cm-1峰分裂成强度不等的两个峰(由甲基间的振动偶合产 生)。
4、C-H面内摇摆振动:800-720cm-1,判断脂肪烷-(CH2)n-的碳链 长度有用: n=1:785-770cm-1; n=2:743-734cm-1 n=3:729-726; n>4:在720 cm-1
νC=O1715 cm-1 1690 cm-1
O C CH3
O CH2=CH-C-CH=CH2
1660 cm-1
O C
νC=O 1690 cm-1
1670 cm-1
共轭体系越大,νC=O降得越多。
32
B、
炔键C、 νC≡C振动吸收峰强度的大小比较为: D、
CH3—C≡C-CH2F > CH3—C≡C-CH2Cl > CH3—C≡C—CH2CH(CH3)2 CH3—C≡C-CH2Cl > CH3—C≡C—CH2CH(CH3)2 > CH3C≡CCH3
第13章波谱学基本知识

13
6
第6页,共94页。
第一节 紫外-可见光谱
一 、基本原理和基本概念
二、影响紫外光谱的因素 三、紫外光谱的应用
13
7
第7页,共94页。
(一)Lambert-Beer定律
A=εcl=lg1/T
13
8
第8页,共94页。
(二)UV谱图
横坐标:λ/nm 纵坐标: A
见P353图13-2
13
9
第9页,共94页。
γC-H
0
4000 3500 3000 2500 2000 1800 1600 1400 1200 1000 800 600 400
1-辛炔
13
45
第45页,共94页。
4、芳烃
100
3100~3010
0
4000
νC-H
2960~2850
3500 3000 2500
1380
~
1600
βC-H
1460
n→π*跃迁(R带)
λ>250nm;ε<100.
π →π*跃迁(K带)
ε≈ 104 ,并随共轭双键的增多而增大. λ随共轭双键的增多而增长.
13
14
第14页,共94页。
乙烯: λmax=162nm(ε≈ 104 )
1,3-丁二烯: λmax=217nm(ε=2.1× 104 )
苯:
E1 带 E2带
2000 1800 1600 1400 1200 1000 800 600 400
辛烷
13
43
第43页,共94页。
2、烯烃
100
0 4000
3100~3010 νC=C-H
第13章 波谱学基础知识

13 15
• Waves composed of undulating electrical fields and magnetic fields. • Wave that consists of both electric and magnetic variation.
13
16
2.The properties of electromagnetic waves
13
53
H0
H0 自旋轴
m=+ ½
回旋轴
回旋轴
m=- ½
1H自旋核在外磁场中的两种取向示意图
13 54
核磁共振( nuclear magnetic resonance,NMR) :
在垂直于H0方向外加一个电磁场, 当电磁波的能量和核磁能级差相等 时,处于低能级的多余的磁核吸收 电磁波能量而跃迁到高能级的现象。
100
724~722 2260~ 2190 1460 1380 (-CH2-)n
νc=c 2960~2850
3310~3300
0 4000 3500 3000 2500
βC-H
700~600
νC-H
γC-H
2000 18001600 1400 1200 1000800 600 400
第十三章 波谱学基本知识

CH3(CH2)10CH3
2500
2000
1500
-1
1000
500
/cm
十二烷的红外光谱
27
T % 愈小,吸光度就愈强,谱带强度就愈大。 根据T %,谱带强度大致分为: 很强吸收带(vs) 强吸收带(s) T %<10 10<T %<40
中强吸收带(m) 弱吸收带(w)
宽吸收带(b)
40 < T %<90 T % > 90
13
银纳米棒的UV-Vis谱图(波长λ /nm; 吸光度(A))
1.6 12 min 10 min 8 min 6 min 4 min 2 min 1.2
Absorbance
0.8
0.4
300
400
500
600
700
800
Wavelength(nm)
最大吸收波长(λmax)与分子结构
最 大 吸 收 波 长 (λmax) 电子的跃迁类型 分子结构
第十三章 有机波谱学基础
第十三章 有机波谱学基础
有机化合物结构鉴定中最常用的四大谱:
紫外-可见光谱 (UV-vis) 红外光谱(IR)
取样少 速度快 结果准
核磁共振谱(NMR)
质谱(MS)
UV-vis、IR、NMR是基于样品对电磁波的吸收而得
到的谱,MS是基于检测不同质量分子碎片离子而得 到的谱,不属于波谱范畴.
β-胡萝卜素:吸收蓝色 光呈现互补色:
橙
590~620
500~560
560~590
绿
480~500
黄
青
白
紫
400~430
青蓝
460~480
黄色
波谱考试知识点

1.不同物质的λmax有时可能相同,但εmax不一定相同;2.有机化合物的紫外—可见吸收光谱,是其分子中外层价电子跃迁的结果(三种):σ电子、π电子、n电子外层电子吸收紫外或可见辐射后,就从基态向激发态(反键轨道)跃迁。
主要有四种跃迁所需能量ΔΕ大小顺序为:n→π*< π→π*< n→σ*< σ→σ*3.σ→σ*跃迁所需能量最大,σ电子只有吸收远紫外光的能量才能发生跃迁。
饱和烷烃的分子吸收光谱出现在远紫外区(吸收波长λ<200nm,只能被真空紫外分光光度计检测到)。
如甲烷的λ为125nm,乙烷λmax为135nm。
n→σ*跃迁所需能量较大。
吸收波长为150~250nm,大部分在远紫外区,近紫外区仍不易观察到。
含非键电子的饱和烃衍生物(含N、O、S和卤素等杂原子)均呈现n →σ*跃迁。
如一氯甲烷、甲醇、三甲基胺n →σ*跃迁的λ分别为173nm、183nm 和227nm。
π→π*跃迁所需能量较小,吸收波长处于远紫外区的近紫外端或近紫外区,摩尔吸光系数εmax一般在104L·mol-1·cm-1以上,属于强吸收。
不饱和烃、共轭烯烃和芳香烃类均可发生该类跃迁。
如:乙烯π→π*跃迁的λ为162 nm,εmax为: 1×104 L·mol-1·cm-1。
n →π*跃迁需能量最低,吸收波长λ>200nm。
这类跃迁在跃迁选律上属于禁阻跃迁,摩尔吸光系数一般为10~100L·mol-1 ·cm-1,吸收谱带强度较弱。
分子中孤对电子和π键同时存在时发生n →π*跃迁。
丙酮n →π*跃迁的λ为275nm εmax为22 L·mol-1·cm -1(溶剂环己烷)。
4.生色团:最有用的紫外—可见光谱是由π→π*和n→π*跃迁产生的。
这两种跃迁均要求有机物分子中含有不饱和基团。
这类含有π键的不饱和基团称为生色团。
第13章-IR-UV

红外吸收峰的强弱表示:vs,很强;s,强; 红外吸收峰的强弱表示: 很强; , m,中强;w,弱;vw,很弱;v,强度不定 ,中强; , 很弱; ,
26
三,各类化合物的红外光谱举例
(一)烃类化合物 1. 烷烃 C-H 伸缩振动(2800~3000 cm-1 ) 伸缩振动( ~ C-H 弯曲振动(1465 – 1340 cm1 ) 弯曲振动(
成键的 O-H 键的面外 弯曲振动
丁酸的红外光谱
41
5. 酯 饱和脂肪族酯(除甲酸酯外 饱和脂肪族酯 除甲酸酯外) 除甲酸酯外 C=O 吸收 1750 ~ 1735 cm1 区域 饱和酯 C-C(=O)-O 1210 ~ 1163 cm1 区域
强吸收
乙酸苯酯
A
C D E B F G 饱和 C H O C C O
2-苯基丙醛 苯基丙醛
A 3077,3040 B 2985,2941 C 2825,2717 芳 C H 饱和 C H 醛 C H
C
2-戊酮 戊酮
A,B,C A B C 2955,2930,2866 D 1725
D 饱和C-H 饱和
C O
4. 羧酸 羧酸二聚体: 羧酸二聚体 3300 ~ 2500 cm1 O-H 伸缩吸收 宽,强) 伸缩吸收(宽 强 ~1720 cm1 C=O 吸收 1320 ~ 1210 cm1 1440 ~ 1395 cm1 920 cm1 C-O 伸缩 O-H 弯曲振动
27
十二烷 十二烷
CH3 : 2962 νas 2872 νs CH2: 2926 νas 2853 νs
CH3 : 1450 νas 1375 νs CH2: 1465 νs
2. 烯烃
1-庚烯红外光谱
有机波谱知识课件

• 分子对紫外光或可见光的吸收是基于分子的价电 子在不同电子能级上的跃迁。
• 紫外吸收光谱又称为电子光谱。但和原子光谱 不同,紫外光谱并不是一个纯的电子光谱,在电
子跃迁过程中同时伴随有振动和转动能级的跃迁。
•
因此,紫外光谱并非原子光谱式的线光谱,
而是由多个吸收波长极为相近的吸收线组成的带
• 非共轭的不饱和化合物 • 非共轭的不饱和化合物中所含的不饱键虽可产
生跃迁,但相应的吸收带仍在远紫外区,不能被 应用于结构分析。
有机波谱知识课件
• 含共轭体系的脂肪族化合物 • 当分子中存在共轭体系时,成键轨道和
反键轨道间的能级差变小,吸收波长总是 高于200nm,且吸收强度也增强。这是紫外 吸收光谱法研究的重点。
键轨道间的跃迁,因轨道间的能级差最大,所需 的能量最高,相应的吸收峰波长较短,一般为 150-160 nm,即在真空紫外(远紫外光)区。
有机波谱知识课件
• π→π*跃迁是不饱和键中的π电子吸收能 量跃迁到π*反键轨道的跃迁,其所需能量 较要小,吸收峰波长一般为160-180nm,仍 在远紫外光区。
动过程中必须有瞬间偶极矩的改变。 • 对称分子:没有偶极矩,辐射不能引起共振,
无红外活性。 如:N2、O2、Cl2 等。 非对称分子:有偶极矩,红外活性。
• 分子的振动可近似看为一些用弹簧连接的小球 的运动。
有机波谱知识课件
• 任意两个相邻的能级间的能量差为: •
• •
• K化学键的力常数,与键能和键长有关, m为双原子的折 合质量 m =m1m2/(m1+m2)
有机波谱知识课件
• F. X-H面内弯曲振动及X-Y伸缩振动区(14751000cm-1)
波谱分析知识点

波谱分析(spectra analysis)波谱分析的内涵与外延:定义:利用特定的仪器,测试化合物的多种特征波谱图,通过分析推断化合物的分子结构。
特定的仪器:紫外,红外,核磁,质谱,(X-射线,圆二色谱等)特征波谱图: 四大谱;X-射线单晶衍射,圆二色谱等化合物:一般为纯的有机化合物分子结构:分子中原子的连接顺序、位置;构象,空间结构仪器分析(定量),波谱分析(定性)综合性、交叉科学(化学、物理、数学、自动化、计算机)作用:波谱解析理论原理是物理学,主要应用于化学领域(天然产物化学和中药化学、有机化学、药物化学等),在药物、化工,石油,食品及其它工业部门有着广泛的应用;分析的主要对象是有机化合物。
第一章紫外光谱(ultraviolet spectra,UV)一、电磁波的基本性质和分类1、波粒二象性光的三要素:波长(λ),速度(c),频率 (v)电磁波的波动性电磁波的粒子性光速 c:c=3.0×10^10 cm/s 波长λ :电磁波相邻波峰间的距离。
用nm,μm,cm,m 等表示频率v:v=c/ λ,用 Hz 表示。
光子具有能量,其能量大小由下式决定:E = hν = hc/λ (式中E为光子的能量,h为普朗克常数,其值为6.624× 10-34j.s )2、分子的能量组成(能级图)E 分子= E平+ E转+ E振+E电子能量大小: E转< E振< E电子X-射线衍射紫外-可见光谱红外光谱微波吸收谱核磁共振谱内层电子能级跃迁外层电子分子振动与转动分子转动电子自旋核自旋X-射线远紫外近紫外可见近红外中红外远红外微波无线电波0.1~1nm 4~200nm 200~400nm400~800nm0.8~2.5um25~400um0.04~25cm25~1000cm 紫外光谱远紫外(4~200nm):又叫真空紫外区近紫外(200~400nm):又叫石英紫外区,最为常用。
电子跃迁类型的影响σ→σ*跃迁:150nm左右,真空紫外区n→σ*跃迁:一般小于200nm 弱吸收,ε约100π→π*跃迁:160~180nm(孤立双键),>200nm (共轭双键)强吸收,ε约104n→π*跃迁:200~400nm 弱吸收,ε约1002.3.表示方法和常用术语发色团:广义上讲,是分子中能吸收紫外光或可见光的结构系统。
波谱学
各类官能团的特征吸收峰
4000~2400cm-1(主要为Y-H伸缩振动吸收) 官能团 吸收频率(cm-1) _______________________________________________________ -醇,酚 3650~3600(自由) OH3500~3200(分子间氢键) -羧酸 NHCH-
指纹区1500~400cm-1 (某些键的伸缩和C-H弯曲振动吸收)
官能团 吸收频率(cm-1) ______________________________________________ -NO2 1565~1545和1385~1360 C O (醇,酚,羧酸,酯,酸酐) 1300~1000 胺 1350~1000 伸缩 C N 酰胺 1420~1400 1460和1380 CH3 (C-H面内弯曲) CH2 1465(C-H面内弯曲)
speБайду номын сангаасtroscopy, NMR) 质谱 (Mass Spectroscopy, MS)
UV、IR、NMR都属于吸收光谱。
吸收光谱原理: 1. 每种能量状态的量子化;
2. 当△E=hν,分子吸收能量发生跃迁。
• 光是一种电磁波,其波长、频率 υ 和光速 C 之间有 如下关系: λυ= C 或 υ= C/λ 式中; C=3*1010cm.s-1 ; υ 的单位为周 / 秒( c.s-1 )或 赫兹(Hz);λ的单位可用nm、cm、μm等。 • 在光谱学中,常用波数 =1/λ,单位为cm-1. 光的能量和频率(或波长λ)之间有如下关系: E=hυ 或 E= hc/λ 式中h为普朗克常数,h=6.63*10-3J.s-1
伸缩νC-H
内弯βC-H
外弯γC-H
νX-H 伸缩振动:
大学有机化学课件 波谱知识基础
而同一类型的基团在不同物质中所处的化学
几种常见官能团的红外吸收频率
键型
C-H =C-H ≡C-H C-C C=C C≡C C=O 化合物类型 烷烃 烯烃及芳烃 炔烃 烷烃 烯烃 炔烃 醛 酮 酸及酯 酰胺 醇及酚
氢键结合的醇及酚
-OH -NH2 C-X
胺 氯化物 溴化物
吸收峰位置 2960~2850 3100~3010 3300 1200~700 1680~1620 2200~2100 1740~1720 1725~1705 1770~1710 1690~1650 3650~3610 3400~3200 3500~3300 750~700 700~500
MR)的应用最为广泛。
一、基本原理
自旋磁矩
图7-7 氢核在外加磁场中的两种自旋状态
可见,在一定磁场强度 式中: 自旋能级差是一定的。 在外加磁场H0中,氢核的两种自旋态发生能 γ— 质 子 的 特 征 常 数 , 此时,如果用能量为hυ 级分裂。其能级差(ΔE)与外加磁场的强度 称 磁旋比; =△E的电磁波照射,可 (H0)成正比: h—普朗克常数; H0—外加磁场的强度。 使质子吸收能量,从能 量低的能级跃迁到能量
RO
R R' R CH3 NCH3 R R'
H R' O H
吗啡的结构 确定经过了 吗啡 150年
可卡因 海洛因
O
C CH3
R'O
CH3 17 CH3 H
3
胆固醇的结 构确定经过 了近百年
H
5
H
HO
6 胆固醇(cholesterol)
物理法
物理法即是利用物理原理设计制造的仪器,把此仪器用于 化学分析来确定有机化合物的结构。 波谱即是测定有机化合物结构时最重要的物理方法 。 此 法具有取样量极少、速度快和结果准确等优点,可大大简 化鉴定过程,为研究和确定有机化合物的结构提供强有力 的依据。 波谱法中最常用的包括四大谱,即紫外光谱(ultraviolet s pectroscopy,UV)、红外光谱(infrared spectroscopy,I R)、核磁共振谱(nuclear magnetic resonance spectrosco py,NMR)和质谱(mass spectroscopy,MS)。
波谱分析知识点
. 波谱分析(spectra analysis)波谱分析的内涵与外延:定义:利用特定的仪器,测试化合物的多种特征波谱图,通过分析推断化合物的分子结构。
特定的仪器:紫外,红外,核磁,质谱,(X-射线,圆二色谱等)特征波谱图: 四大谱;X-射线单晶衍射,圆二色谱等化合物:一般为纯的有机化合物分子结构:分子中原子的连接顺序、位置;构象,空间结构仪器分析(定量),波谱分析(定性)综合性、交叉科学(化学、物理、数学、自动化、计算机)作用:波谱解析理论原理是物理学,主要应用于化学领域(天然产物化学和中药化学、有机化学、药物化学等),在药物、化工,石油,食品及其它工业部门有着广泛的应用;分析的主要对象是有机化合物。
第一章紫外光谱(ultraviolet spectra,UV)一、电磁波的基本性质和分类1、波粒二象性光的三要素:波长(λ),速度(c),频率 (v)电磁波的波动性电磁波的粒子性光速 c:c=3.0×10^10 cm/s 波长λ:电磁波相邻波峰间的距离。
用 nm,μm,cm,m 等表示频率v:v=c/ λ,用 Hz 表示。
光子具有能量,其能量大小由下式决定:E = hν= hc/λ (式中E为光子的能量,h为普朗克常数,其值为6.624×10-34j.s )2、分子的能量组成(能级图)E 分子= E平+ E转+ E振+E电子能量大小: E转< E振< E电子紫外光谱远紫外(4~200nm):又叫真空紫外区近紫外(200~400nm):又叫石英紫外区,最为常用。
电子跃迁类型的影响σ→σ*跃迁:150nm左右,真空紫外区n→σ*跃迁:一般小于200nm 弱吸收,ε约100π→π*跃迁:160~180nm(孤立双键),>200nm (共轭双键)强吸收,ε约104n→π*跃迁:200~400nm 弱吸收,ε约1002.3.表示方法和常用术语发色团:广义上讲,是分子中能吸收紫外光或可见光的结构系统。
《有机化学》第十三章 有机波普学基础 - 副本

伸缩振动: 改变键长的振动
(Stretching vibration , ν)
弯曲振动: 改变键角的振动
(Bending vibration, δ)
人民卫生电子音像出版社
上页 下页 首页 22
第十三章 有机波谱学基础 第三节 红外光谱(一、基本原理)
以亚甲基为例说明分子中化学键不同 的振动形式所产生的不同红外吸收峰。
图例3 香芹酮的紫外光谱图
人民卫生电子音像出版社
上页 下页 首页 10
第十三章 有机波谱学基础 第二节 紫外光谱(一、基本原理)
三类分子轨道:
σ轨道(σ键电子。分为σ和σ*)
π轨道(π键电子。分为π和π*)
非键轨道(n):未共用对电子
n
价电子按能量最低原理填入成键 轨道中,反键轨道能量较高,基态时是 空着的。电子从低能级向高能级跃迁时, 所需能量与光波频率相匹配时,就吸收 光能而跃迁。价电子跃迁所需能量在紫 外及可见光区。
光子的能量和波动性:
E = hν = hc/λ (h:plank 常数) c = λ·ν , σ = 1/ λ = ν /c λ:波长, ν:频率, c:光速, σ:波数
波长越短 频率越高 能量越大
邓健 制作 夏淑贞 审校
上页 下页 首页 3
第十三章 有机波谱学基础 第一节 吸收光谱的一般原理
不同能量的光谱相对于分子的不同运动
邓健 制作 夏淑贞 审校
上页 下页 首页 21
第十三章 有机波谱学基础 第三节 红外光谱(一、基本原理)
一、红外光谱的基本原理
在真实分子中, 原子处于不断的运动之中。这种运动可 分为两大类:一是振动, 包括键的伸缩振动和弯曲振动; 二是转动, 即原子沿着键轴作相对的转动。红外光谱就是 由分子吸收红外光后,引起振动能级的跃迁而得到的。
有机化学第13章有机波谱学基础

Hale Waihona Puke 机波谱学基础一、吸收光谱的一般原理 二、紫外光谱
三、红外光谱 四、核磁共振谱
第一节
吸收光谱的一般原理
吸收光谱:
当某一波长的电磁波照射某有机物时, 如果其能量恰好等于某运动状态的两个 能级之差,分子就吸收电磁波,从低能 级跃迁到较高能级。将不同波长与对应 的吸光度做图,即可得到吸收光谱。
第一节
1,3-丁二烯的紫外光谱图
丙烯醛紫外光谱
CH2=CH
ε
λmax=218nm ππ* λmax=320nm nπ*
150 200 300 λ(nm)
C=O H
ππ* 吸收峰在较短波长一端,为强吸收;
nπ* 吸收峰在较长波长一端,为弱吸收。
第二节
紫外光谱(UV)
二、紫外光谱在有机结构分析中的应用 随着共轭体系的延长,紫外吸收会向长 波方向移动,强度增大,可判断分子中共 轭程度。
峰位、峰强、峰形判断化合物中是
否存在某些官能团,与标准图谱对
照可推断未知物的结构
第三节
红外光谱(IR)
一、红外光谱的基本原理
有机分子中化学键的键长、键角不是 固定不变的,而是像用弹簧连接起来 的一组小球,整个分子在不停振动。
有机分子能吸收波长为2.5~25μm(波 数() 为4000~400cm-1)的红外光, 引起 分子的振动和转动。故称红外光谱。
σ=1/λ=υ/c
波数的单位是cm-1,定义为电磁波在1cm 行程中振动的次数。
该式表明波数σ 与波长成反比,与v 成
正比。
第一节
吸收光谱的一般原理
二、分子运动形式与对应的光谱范围 在分子光谱中,根据电磁波的波长() 划分为几个不同的区域,如下图所示:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A Very Useful Chemical Software
• Chemoffice 2004 ChemDraw Ultra 8.0 Chem3D Ultra 8.0
2
ChemDraw Ulrtra 8.0
3
ChemNMR H-1 Estimation
4 .0
NH2
6 .4 6
6 .4 6
V0
电子能级: △E=1~20ev
E0 V1 V0
振动能级: △E=0.05~1ev
18
分子吸收光谱(Absorption spectra)的 产生 分子吸收光谱分类(按分子内能变化 形式): 分子转动光谱:远红外及微波区域 键振动光谱:中红外区域2.5-15um 电子运动光谱:可见-紫外区域(200800nm)
29
红移现象:由于取代基或溶剂的影响使最大吸收峰 向长波方向移动的现象称为红移现象。 蓝移现象:由于取代基或溶剂的影响使最大吸收峰 向短波方向移动的现象称为蓝移现象。 增色效应:使值增加的效应称为增色效应。
减色效应:使值减少的效应称为减色效应。
30
二、影响紫外光谱的因素
1.共轭效应
2.空间效应 3.溶剂效应
51
3. 官能团在红外光谱图中的位置
红外光谱基本区域
X Z -H 单 键 的 伸缩振动区
C≡ C C≡ N
双键伸缩 振动区
指 纹 区
52
三、 各类化合物的红外光谱
表13-3 各类有机化合物的特征吸收频率
化学键 C -H C -H C -H C -H C=C CC 化合物类型 烷烃 烯烃 芳香烃 炔烃 烯烃 炔烃 芳香烃 频 率 范 围 c m -1 2 8 5 0 -2 9 6 0 , 1 3 5 0 -1 4 7 0
2. Lambert-Beer定律
A=εcl=lg1/T
ε:摩尔吸收系数 c: 摩尔浓度 l: 吸收池厚度(cm)
22
3.电子跃迁能量示意图
E
σ* * π
n π σ
比较能量大小
23
实用 的两 种跃 迁
*
n →
n
① λ→* ~150nm (饱和烃) n→ ② n→ζ* λn→* ~200nm, ε~102, 弱. (C—X,C—O, C— N 孤对电子) ③ π→π* 隔离π键: λ <200nm
25
乙烯: λmax=162nm(ε≈ 104 ) (远紫外区)
1,3-丁二烯: λmax=217nm(ε=2.1× 104 )
(近紫外区)
丙烯醛的UV (180图13-3)
26
λmax 218 nm π→π*(共轭)
ε
λmax 320 nm n→π*
CH2=CH-CH=O
丙烯醛的紫外光谱
λ / nm
6
7
1HNMR(hydrogen
nuclear magnetic resonance spectra)
8
IR(infrared spectra)
9
Structure determination X-ray
O O O N O N
diethyl 1,2,3,6tetrahydro-1,3diphenylpyrimidine4,5-dicarboxylate
1. 红外光谱的分类
名称 λ / μm
/cm-1
1280~4000 4000~400 400~20
0.78~2.5 近红外区(泛频区) 中红外区(基本转动-振动区) 2.5~25 25~500 远红外区(骨架振动区)
=
1/λ
43
2.红外光谱图
横坐标:上线:波长(l)下线:波数() 纵坐标:透光率(%) 波数范围:4000~400cm-1 (4000~1500cm-1为特征频率区) (1500 ~400cm-1为指纹区) 峰的强度:s、m、w
15
2.The properties of electromagnetic waves
• All electromagnetic waves have the same speed in a vacuum, a speed expressed by the letter c (the speed of light) and equal to about 186,000 miles (or 300,000 kilometers) per second. • wave /particle duality
λmax =290nm ε=2700
37
3.溶剂效应
溶剂效应随着溶剂极性的增大, π- π*跃迁产生的吸收带(K带) 发生红移,而n- π*跃迁产生的 吸收带(R带)发生蓝移的现象。
38
三、紫外光谱的应用
1. 定性鉴别
2. 结构的确定 3. 定量分析
39
结构的确定
双键位置与顺反式的确定 例1:β-水芹烯双键位置的确定
• c = λν
• E=hν
16
3.光与分子能量的变化 • 分子的内能:
分子的转动、键的振动、电子的运动等 能量
• 光使分子内能变化的条件: △E=hν • 分子内能变化的形式: △E= △Ee+ △Ev + △Er
17
•分子内能变化示意图
V2
E1 V1 E
V2
转动能级: △E=10-4~0.05ev
References
1. 2. 3. 4. 5. 6. 7. 8. 邢其毅等编 《基础有机化学》 John McMurry “Fundamentals of Organic Chemistry” 中山大学有机化学精品课程 其它大学精品课程 http://riodb01.ibase.aist.go.jp/sdbs/cgibin/direct_frame_top.cgi(Spectral Database for Organic Compounds SDBS ) General Chemistry
→
→
共轭π键: l> 200nm
>104, 强带 (K带)
24
4. 各类化合物的电子跃迁
•部分饱和有机化合物(如C-Br、C-I、CNH2)可以在远紫外区有n*和*跃迁。 •具有-共轭和n -共轭的不饱和有机化合 物可以在近紫外区出现*跃迁和n -*跃 迁吸收。
49
•氢键对吸收峰的影响——使波数减小、 波数范围变宽。 例:不同浓度的正丁醇在氯苯溶液 中羟基的吸收光谱。
50
例:正丁醇在氯苯溶液中羟基的吸收光谱
100 (a)
100
单 体
二缔合 体
(b)
(c)
多缔 合体
(d)
0
3600 3400 3200 3600 3400 3200
(a)1.4% (b)3.4% (c)7.1% (d)14.3%
31
1.共轭效应 • π-π共轭 随着共轭体系的延长,紫外吸收向 长波方向移动, 且强度增大(π→π*), 每增加一个共轭双键,λmax 增加 30~50nm。
32
H-(CH=CH)n-H的紫外光谱
33
• n-π共轭 λmax/nm的增值
体系 X-C=C NR2 40 OR 30 SR 45 Cl 5 Br
14
10-14 10-12 10-10 10-8 10-6
宇 宙 线 Γ 射 线 χ 紫 射 线 外 可 见 光
10-4 10-2
红 外 微 波
100
102
104 波长/m
无 线 电 108 106 104 频率/Hz
1022 1020 1018 1016 1014
1012 1010
电磁波谱(参见178表13-1)
3 0 2 0 -3 0 8 0 (m ), 6 7 5 -1 0 0 0
3 0 0 0 -3 1 0 0 (m ),6 7 5 -8 7 0 3300 1 6 4 0 -1 6 8 0 (v ) 2 1 0 0 -2 2 6 0 (v ) 1 5 0 0 , 1 6 0 0 (v )
53
续上表 各类有机化合物的特征吸收频率
19
第二节 紫外-可见光谱
一 、基本原理 二、影响紫外光谱的因素 (增加)
三、紫外光谱的应用
20
一 、基本原理 1. UV谱图(见P215/179图13-1)
横坐标:λ/nm 纵坐标: A
紫外吸收光谱的波长范围是100-400nm,其 中100-200nm 为远紫外区,200-400nm为 近紫外区,一般的紫外光谱是指近紫外区, 近紫外光区(氘灯,2H)。 400~800nm 为可见光区(钨灯) 。 21
34
•σ- π共轭对吸收峰的影响:
CH2=CH-CH=CH2 λmax =217 nm CH2=CH-CH=CH –CH3 λmax =222nm
结论:共轭效应使λ及ε均增大。
35
2.空间效应
空间效应:由于空间位阻而使紫外吸 收光谱发生改变的现象。
H
H
H
H
问题13-2(2)
36
H
H
H
H
λmax =280nm ε=1400
48
2.决定分子振动频率的主要因素:
• • • 折合质量(m1+m2)/m1m2越大,波数 (频率)越大; 键数越多,波数越大;
νC≡C>νC=C>νC-C ;νC=O > νC-O 。
键的极性越大,波数越大。 RCHO的C=O吸收峰:~1720cm-1 RCOCC H2
C H2
C H( C H 3 ) 2
C H( C H 3 ) 2
λmax =222nm
40
本次课要求
§1 理解吸收光谱的产生原理 §2 会应用UV确定简单化合物的结构
