【课件-有机化学】_专题习题课_
有机化学课件(药学专业)-习题课
邻苯二甲酸酐
3-乙基-4-硝基苯酚
17.
O
O
O
18.
CH 3 CH =CH CH 2 CH 2 CHO
丁二酸酐
4-己烯醛
19 .
21.
CH 3 CH 2 CH 2 NCH 2 CH 3 CH 3
20.
Br C C Cl
Cl H
甲基乙基丙基胺
CH 3 Br H H Br C2 H5
Z-1,2-氯-1-溴乙烯 22.
28.酰卤和酸酐是常用的酰化剂。 29. 重氮盐的重氮基被取代的反应又叫放氮反应, 偶联反应又叫留氮反应。 30.与HO-NO作用生成致癌物的是叔胺。 31.糖尿病人的尿液能与费林试剂作用,产生砖红 色沉淀。 32. -D-甘露糖和-D-甘露糖既是非对映异构体, 又是端基异构体。 33.呋喃、噻吩、吡咯的亲电取代反应往往需在温 和条件下进行。 34.嘌呤是由咪唑环与嘧啶环稠合而成的有机化合 物。
四、完成下列反应式 1.
CH 2 CHCH 2 CH 3 Cl NaO H,C 2 H 5 O H
2.
NaOH,C 2 H 5 OH
(CH 3 ) 2 CH CHBrCH 3
3.
H 3C H Br
ROOR
4.
O
5.
(CH 3 ) 2 CHO H
H 2 SO 4 65℃
CHO
OCH 3
浓NaOH
6.
CH 2 C OOH
(2R,3S)-2-氯-3-溴戊烷
3-羧基-3-羟基戊二酸
11.
CH O OH
12 .
N CH 2 CH 3 CH 3
2-羟基苯甲醛
N-甲基-N-乙基苯胺
13 .
胡宏纹版《有机化学》课件及习题答案

子数,用正、异、新表示同分异构体。
例如:CH3-CH2-CH2-CH2-CH3
CH3 CH CH2-CH3
CH3 CH3 C CH3
正戊烷
CH3
异戊烷
CH3
新戊烷
南京大学基础学科教育学院 南京大学化学化工学院
基础有机化学
二、 烷基 烷基:烷烃分子中去掉一个氢原子而剩下的原子团称为烷基。
烷基
名称
CH3CH3CH2CH3CH2CH2(CH3)2CHCH3CH2CH2CH2(CH3)2CHCH2CH3CH2CH(CH3)-
CH3 CH2
CH3 选择正确
CH2 CH3 选择错误
(1)从最接近取代基的一端开始,将主链碳原子用1、2、3……
南京大学基础学科教育学院 南京大学化学化工学院
基础有机化学
有机化学是一门迅速发展的学科
有机合成化学 天然有机化学 生物有机化学 金属与元素有机化学 物理有机化学 有机分析化学
药物化学 香料化学 农药化学 有机新材料化学 ...... 等学科
生命科学 材料科学 环境科学 化学生物学 能源、工业、农业 ...... 等方面
1. 选择主链(母体)
(1)选择含碳原子数目最多的碳链作为主链,支链作为取代基。
(2)分之中有两条以上等长碳链时,则选择支链多的一条为主
链。
例如:
CH3
CH3-CH2 CH CH CH2-CH3
CH3-CH2-CH CH CH CH-CH 3
CH2 CH CH3 选择错误 CH3 CH3
选择正确
2. 碳原子的编号
三、 伯、仲、叔、季碳原子
在烃分子中仅与一个碳相连的碳原子叫做伯碳原子(或
一级碳原子,用1°表示)
有机化学专题1有机化学基础ppt课件

A.无机物
B.烃
C.高分子化合物
D.有机物
HC S
S CH
C=C
HC
CH
S
S
7、科学家致力于二氧化碳的“组合转化”技 术研究,把过多的二氧化碳转化为有益于 人类的物质,如将CO2与H2混合,在一定 条件下以1:3的比例发生反应,生成某种 重要的化工原料和水,该化工原料可能是
(B )
A.烷烃
B.烯烃
1.硅氧烷和丙烯酸酯的共聚物(硬) 2.聚甲基丙烯酸羟乙酯(软)
液晶显示器
课堂练习:
1.在人类已知的化合物中,种类最多的是
A、过渡元素形成的化合物 B、第ⅢA族元素形成的化合物
C
C、第ⅣA族元素形成的化合物
D、第ⅦA族元素形成的化合物
2.下列物质不属于有机物的是
A.碳酸
B.汽油
A
C.蔗糖
D.合成纤维
棉花、淀粉、纤维素和蛋白质、天然橡胶等。
有机化合物
各种材料: 合成纤维、合成树脂、合成橡胶等
二有机化学的发展:阅读:课本2页思考
1、有机化学成为一个独立的分支是始 于谁提出了有机化学的概念?
19世纪初瑞典化学家贝采利乌斯提出 有机化学的概念(P2:图1-1)
2、打破无机化学和有机化学界限的化 学家是谁?他用什么物质的变化证明?
(3)导电功能的高分子材料
人工膝关节
人工心脏瓣膜
这张不起眼的“白纸”就是填补国内空白的高科 技“人造皮肤”。这种“人造皮肤”能帮助伤口尽 快恢复。比如烧烫伤,把水泡的水放出,用药 清洗后,将“人造皮肤”敷贴在伤口上,很快“人 造皮肤”就和人的身体长在一起,成了真的皮肤。
角膜接触镜,俗称隐形眼镜。目前大量使用的 软质隐形眼镜。隐形眼镜常用以下材料制成:
有机化学总复习例题精选精品PPT课件
_____C_H__3_C_O__O_H______. _____H__C_O__O_C__H_3___________
10.(TCE97-5)结构不同的二甲基氯苯的数目有
H3C
CH3 C CH3 CH3
CH3 CH3 H3C C C CH3
CH3 CH3
12.(TCE95.25)化合物A,学名邻羟基苯甲酸;俗名水杨酸;其 结构式如下.
OH
C OH O
(1)将A跟哪种物质的溶液反应可得到一钠盐(其化学式为
C7H5O3Na)?
C
A.氢氧化钠 B.硫化钠 C.碳酸氢钠 D.氯化钠
(2)醛A的异构体甚多,其中属于酯类化合物. 而且结 构式中有苯环结构的异构体就有6个,它们是
O C O CH3
O
HC O
CH3
O
HC O
O C CH3
O
CH3
O
HC O
CH3
O
C
H
O CH2
7.(MCE94)根据以下叙述,回答第18题和19题 萘的分子结构式可以表示为
或
两者是等同的.苯并[a]芘是强致癌物质(存在于烟 灰.煤焦油.燃烧烟草的烟雾和内燃机中). 它的分 子由五个苯环并合而成,其结构式可以表示为I或II 式.这两者也是等同的,现有结构式A─D,其中
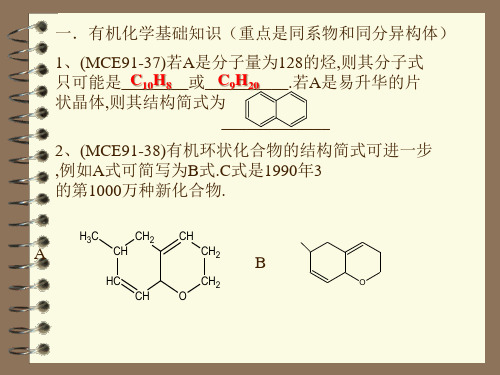
一.有机化学基础知识(重点是同系物和同分异构体)
1、(MCE91-37)若A是分子量为128的烃,则其分子式 只可能是__C_1_0H__8__或__C_9_H__20____.若A是易升华的片 状晶体,则其结构简式为
有机化学课堂练习及部分参考答案PPT课件

A.
C CH
CH 3
B.
CH 2CH 3
COOH
C.
COOH
O C
D.
O
C O
CH 3
CH 3
E.
脱氢
18
结构推导习题参考答案
CH 3
3 、 A . CH 3 CH 2 C CH 3
OH
B . CH 3 CH
CH 3 C CH 3
CH 3
C . CH 3 CH C CH 3
OH OH
19
结构推导习题参考答案
14
结构推导习题
11、已知D—醛糖A和B均有旋光性,但 与过量苯肼作用生成不同的糖脎;如果 以硝酸氧化A和B,则分别可得五碳二 元羧酸C和D,但C和D均不具有旋光性。 试写出A、B、C、D的费歇尔投影式。
15
结构推导习题
12、已知D—木糖与D—来苏糖都是戊醛糖,
与苯肼作用生成相同的糖脎。又知D—来苏糖
有机化学
课堂练习
1
思考题:如何分离苄醇、苯酚和苯甲酸?
练习题:
现有苯胺、苄醇、对甲苯酚混合物, 试设计一分离方案分离之。
2
例一: Br
Br
的制备
Br
例二:
Br
Br
Br
的制备
例三:
CN 的制备
*讲义402-403页练习题14、15
3
思考题:
1、试标出α-萘酚、β-萘酚与重氮盐发生偶联 反应时的偶联位置。
10
结构推导习题
7、化合物A的分子式为C5H6O3,它 能与乙醇作用得到两个结构异构体B 和C,B和C分别与氯化亚砜作用后 再加入乙醇,则两者生成同一化合 物D。试推测A、B、C、D的结构。
第二学期有机化学习题课

(CH3)2CHCH CH2 + H
Cl (CH3)2C CHCH3
H
(CH3)2CHCHCH3 Cl
(CH3)2CCH2CH3 Cl
Cl (CH3)2CCH2CH3
第二十一页,共33页。
AlCl3 + CH3CH2CH2Cl
CH CH3 CH3
亲电取代---碳正离子重排
CH3CH2CH2Cl + AlCl3 _ AlCl4 CH3CH2CH2
第三十三页,共33页。
C(CH3)3
(A) CH3CH2CH2 (B) CH3CHCH3 (C) CH3CCH3 (D) CH3
CH3
5、将下列碳正离子按稳定性由大到小排序(BCAD)
6、下列化合物与Br2加成,由快到慢排序 (BCA)
(A) CF3CH CH2 (B) CH3CH CH2 (C) CH2 CH2
第七页,共33页。
7、将下列烯烃按稳定性由大到小排列成序(BACD) 8、下列化合物与HBr加成活性由大到小排序 (DBAC)
CH2CH2Cl
CHClCH3
A.
B.
C.
Cl
C2H5
17、下列化合物按SN1反应由快到慢排序 (BAC)
A.苄基溴 B. α-苯基乙基溴 C. β-苯基乙基溴
18、下列化合物在NaI/丙酮中反应由快到慢排序 (ABDC)
A. 3-溴-1-丁烯 B. 正溴丁烷 C. 1-溴-1-丁烯 D. 2-溴丁烷
环氧乙烷酸性开环
CH3 CH CH2 H CH3 CH CH2
O CH3OH
CH3 CH
O H CH2 - H
OCH3 OH H
CH3 CH CH2 OH
有机化学课件(李景宁主编)第14章_含氮有机化合物习题

浓 NaOH CHO + CHO + CH 3 KMnO 4 KOH N K COOH COOH N COOH COOH KMnO 4 N O CH 2OH 稀 OH
-
+ O COOH
CH 3COCH 3
O
CH=CH COCH 3
碳水化合物
一、三个单糖和过量苯肼作用后,得到同样晶形的脎,其中一个
CHO
3、化合物A(C8H17N)其NMR中无双峰,A与2molCH3I反应后再与 湿的Ag2O作用,并加热生成B(C10H21N),再重复以上反应则生成 三甲胺及1,4—辛二烯和1,5—辛二烯,给出A、B 的结构并写出有 关反应方程式。
4、化合物A(C6H13O2N)有旋光性,A与HNO2作用放出N2,与 NaHCO3作用放出CO2,A与HNO2的水溶液作用生成B(C6H12O3), B仍有旋光性,B与浓H2SO4作用于脱水生成C(C6H10O2),C能使 KMnO4溶液褪色,与酸性KMnO4作用并加热则生成草酸和2—甲基丙 酸,写出A、B各对映异构体的Fisher投影式,并用R/S命名法命名, 写出C的结构式。
A 伯胺
B 仲胺
C 叔胺
D 都可以
)
7、下列化合物能溶于稀盐酸的是( A 苯胺 B 苯酚 C 苯甲酸
D 乙酰苯胺
8、下列化合物碱性最强的是( ) A CH 3COO-+NH4 C CH3CONH2 A 5%盐酸水溶液 B CH3(CH2)3NH2 D H2NCH2COOH ) D银氨溶液 B 苯磺酰氯和NaOH C 乙酸酐
9、能区分苯胺和N-甲基苯胺的是(
10、反应C6H5NH2 + H2SO4(1mol) A
SO3H NH2
有机化学习题课(1-3章)

➢若环上连有支链时,支链作为取代基,其所在位次即 是环上碳原子的位次号,最后将取代基的位次和名称放 在“螺”之前。
16
桥环烷烃的命名:
和螺环烷烃的相似。
不同之处:
✓环上的编号是从一个桥头碳原子开始,沿最 长的桥到另一个桥头碳原子,再沿次长的桥编 回到开始的桥头碳原子,最短桥上的碳原子最 后编号。 ✓各桥的碳原子数由大到小分别用数字表示。
其中,CH3OCH3的C-O-C键角不是180°。
5
九、化合物按碳架和官能团分类(P23)
(1)脂肪族 卤代烷 (2)脂肪族 羧酸
(3)杂环族,四氢吡咯 (4)脂环族,酮
(5)芳香族,醚
(6)芳香族,醛
(7)脂肪族,胺
(8)脂肪族,炔
(9)脂环族,醇
例如: 呋喃
呋喃甲醛 (糠醛)
吡啶
(参见第十七章)
24
1、烯炔的命名——特别注意两点
① 所有烯炔的名称中主链的碳数必须放在烯前。 ② 若双键和三键处于相同的位次供选择时,优先给 双键最低编号。 例如:
1-戊烯-4-炔
25
习题 3.1 命名下列化合物(P73)
(1)
(2)
2,5-二甲基-3-己烯
2,6-二甲基-4-辛烯
(3)
3-己炔 (二乙基乙炔)
(1)E>A>B>C>D
(2)F>G>E>H>D>C>B>A
(3)D>B>C>A 14
第二章 脂环烃
命名规则不清
15
螺环烷烃命名:
➢两个碳环共有的碳原子称为螺原子,以螺作为词头, 按成环的碳原子总数称为“某烷”。
高等有机化学 课件-中国药科大学 练习题答案

练习题一、名词解释1、三线态卡宾(Triplet carbene)卡宾是H2C: 及其取代衍生物的通称,也叫碳烯,含有一个电中性的二价碳原子,该碳原子上有两个未成键的电子,属于中性活泼中间体,通常由含有容易离去基团的分子消去一个中性分子而形成。
三线态卡宾的碳原子为sp杂化,生成的两个杂化轨道分别与其他原子形成σ键,而未参与杂化的两个p轨道中各有一个未成键电子,自旋平行。
2、前线分子轨道(Frontier Molecular Orbital)原子轨道线性组合形成分子轨道,在填充有电子的分子轨道中,能量最高的轨道叫最高占有分子轨道(HOMO);在未填充电子的分子轨道中,能量最低的分子轨道叫最低未占分子轨道(LUMO)。
HOMO与LUMO能量接近,HOMO上的电子被束缚得最松弛,最容易激发到能量最低的LUMO中去,组成新轨道,HOMO和LUMO是决定一个体系发生化学反应的关键,被称为前线分子轨道。
3、协同反应(Concerted reaction)是指反应过程中旧键的断裂和新键的形成同步进行,反应的过程中不产生离子或自由基等活性中间体,只有过渡态的动力学基元反应。
如周环反应、协同亲核取代反应(S N2)、协同消除反应(E2)等。
4、逆合成分析(Retrosynthesis)有机合成路线设计的基本方法,其实质是将目标化合物(Target Molecule)合理地分割成简单的合成子(Synthon),反推出合成所需的基本化学原料。
基本要求是反应步骤少,反应产率高,起始原料简便易得,有合适且合理的反应方法和反应机理作保证。
5、合成砌块(Synthetic block)带有较复杂官能团的合成原料称合成砌块。
6、不对称合成(Asymmetric synthesis)不对称合成即手性合成,将一种含前手性中心、前手性轴或前手性面的非手性化合物,与光学纯的化合物(手性试剂)反应形成新的光活性化合物,是对映选择合成的一种有效方法,文献上常叫“不对称合成”,属于立体选择反应。
有机化学习题课(1-9章)

e
a
反式异构体
e a
顺式异构体
反式异构体
e
e
顺式异构体 e e
反式异构体
不是最稳定构象
a
反式异构体
不是最稳定构象
e
COOH prefers an equatorial position more (1.41 kcal mol-1) than does Br (0.55 kcal mol-1).
反式异构体
X=卤素,磺酸基 一级,二级(三级发生消除反应)
酯的水解
三级卤代烷烃
② 醛酮的氢化物还原反应
2. 醇类的氧化反应
一级醇趋向于被过度氧化成羧酸
(3R,4S)-3,4 一级醇 醛 二级醇 酮
P265习题30. 评价下列每一种可能的醇的合成是好的,不太好的或者毫无价值的。
构体
相同
结构异构体
构象异构体
结构异构体
立体异构体(对映异构)
构象异构体
立体异构体(对映异构)
P169 32.对于下列每对结构,指出两者关系。
等同的分子
等同的分子 (手性碳,通过R/S绝对构型来判断。 两者均为R型)
结构异构体
对映异构体(手性碳,通过R/S绝对构型来判断。 前者为R型,后者为S型)
7.醚的制备 ① Williamson醚合成法(制混醚)
用烷氧基负离子和一级卤代烷烃或者磺酸酯在SN2条件下反应
② 无机酸的方法
③ 分子内Williamson反应合成环醚 ( SN2反应机理:立体专一性)
邻位交叉(×)
邻位交叉(×) 反位交叉(√) 亲核剂从离去基团反面进攻亲电的碳原子
P309习题39. 用醇和卤代烷烃制备下列醚的最好合成方法。
有机化学-习题课

一、 饱和烃 一、选择题1. 环己烷(Ⅰ)、正己烷(Ⅱ)、2-甲基戊烷(Ⅲ)的沸点由高到低的次序为: (A )Ⅰ>Ⅱ>Ⅲ (B)Ⅲ>Ⅱ>Ⅰ (C) Ⅱ>Ⅲ>Ⅰ (D) Ⅱ>Ⅰ>Ⅲ2. 3,3-二甲基戊烷(Ⅰ)、正庚烷(Ⅱ)、2-甲基庚烷(Ⅲ)、正戊烷(Ⅳ)、2-甲基己烷(Ⅴ)的沸点由高到低的次序为:(A)Ⅰ>Ⅱ>Ⅲ>Ⅳ>Ⅴ (B)Ⅱ>Ⅲ>Ⅳ>Ⅴ>Ⅰ (C)Ⅲ>Ⅱ>Ⅴ>Ⅰ>Ⅳ (D)Ⅳ>Ⅴ>Ⅰ>Ⅱ>Ⅲ 3. 烷烃分子中,σ键之间的夹角一般最接近于: (A) (B) 1200 (C) 1800 (D) 9004.下列各式中,含有5个伯C 、1个仲C 、1个叔C 、1个季C 的结构式是:(A) CH 3C CHCH 2CH 3CH 3CH 3CH 3(B) CH 3CHCH 3CH 3CH 3CH 3(C) CH 3CCH 2CH 2CH 2CH 3CH 33(D) CH 3CH 2CHCH 2CH 3CH 3CH 3甲基丁烷与溴在光照下反应的主要产物是:(A) CH 3CHCH 2CH 2BrCH 3(B) (CH 3)2CHCHCH 3Br(C) CH 22CH 3BrCH 3(D) (CH 3)2CCH 2CH 3Br6.在下列哪种条件下能发生甲烷氯代反应(A)甲烷与氯气在室温下混合 (B)先将氯气用光照射再迅速与甲烷混合 (C)甲烷与氯气均在黑暗中混合 (D)甲烷用光照射,在黑暗中与氯气混合 7.下面四个氯代反应哪个不宜用作实验室制取纯净的氯代化合物(A)环丙烷的氯代 (B)乙烷的氯代 (C)异丁烷的氯代 (D)新戊烷的氯代 8.烷烃分子中碳原子中的几何形状是:(A )四面体形 (B)平面四边形 (C)线形 (D)金字塔形 9.下列己烷的同分异构体中哪种能得到5种单氯代产物 (A) (CH 3)2CHCH(CH 3) (B) CH 3CH 2CH 2CH 2CH 2CH 3(C) CH 3CH 22CH 3CH 3(D) CH 3CH 2CH 2CH(CH 3)210.(CH 3)2CHCH 2CH 3+ Br 2光最易被溴代的氢原子为:(A)伯氢原子 (B)仲氢原子 (C)叔氢原子 (D)没有差别 11.石油醚是实验室中常用的有机溶剂,它的成分是什么(A )一定沸程的烷烃混合物 (B) 一定沸程的芳烃混合物 (C)醚类混合物 (D)烷烃和醚的混合物12.光照下,烷烃卤代反应的机理是通过哪一种中间体进行的(A )碳正离子 (B)自由基 (C)碳负离子 (D)协同反应,无中间体 13. 分子式为C 6H 14的烷烃的异构体数目为:(A)4种 (B)5种 (C)6种 (D)7种14. 三元环张力很大,甲基环丙烷与5%KMnO 4水溶液或Br 2/CCl 4反应,现象是:(A)KMnO 4和Br 2都褪色 (B)KMnO 4褪色,Br 2不褪色 (C)KMnO 4和Br 2都不褪色 (D)KMnO 4不褪色,Br 2褪色15.下列环烷烃中加氢开环最容易的是:(A)环丙烷 (B)环丁烷 (C)环戊烷 (D)环己烷 16. 甲基环戊烷在光照下一元溴代的主产物是:Br Br3CH 3(A)(B)(C)(D)17.分子式为C 5H 10的环烷烃的构造异构体数目是: (A)4种 (B)5种 (C)6种 (D)7种 18.正庚烷(Ⅰ)、正己烷(Ⅱ)、正辛烷(Ⅲ)、2-甲基戊烷(Ⅳ)、2,2-二甲基丁烷(Ⅴ)、正癸烷(Ⅵ)的沸点由高到低的次序为:(A) Ⅰ>Ⅱ>Ⅲ>Ⅳ>Ⅴ>Ⅵ (B)Ⅱ>Ⅵ>Ⅲ>Ⅳ>Ⅴ>Ⅰ (C) Ⅵ>Ⅲ>Ⅰ>Ⅱ>Ⅳ>Ⅴ (D)Ⅳ>Ⅴ>Ⅰ>Ⅵ>Ⅱ>Ⅲ 19.下列几种烷烃中,沸点最低的是:( ) (A) 正己烷 (B) 2-甲基戊烷 (C) 2,2-二甲基丁烷 (D) 正庚烷二、完成下列反应式1.2CH 3?+Br 2 CH 3+HBr?3、(CH 3)3CH +Br 2hv127C ?4、CH 3光照?+ Br 2+ H 2Ni?05、6、+ H 2? + ?7.三、推测结构题分子式为C 5H 12的烃,其三种异构体在300o C 时分别氯代,(A)得到三种不同的一氯代物,(B)只得到一种一氯代物,(C)可得到四种不同的一氯代物,试推测A 、B 、C 的构造式。
《有机化学第四版》习题答案和课件 第15章__有机含氮化合物

15.2.1 胺的分类和命名
命名: ① 习惯命名法:适用于简单胺。
CH3NH2
¬« ¡©
(CH3CH2)2NH
¡¡© « ¡« ª©
NH2
(HOCH2CH2)3N
¡¡¡© «
② 系统命名法:适用于复杂胺。
CH3 NH2 CH3-CH-CH2-CH-CH2-CH3
2-¡¡-4-©¡¡¡ ¬ù ªù é
Zn+NaOH
NH2
¡¡ª ¡ Zn+NaOH
NH-NH
¡¡¡¡ª ¡
第十五章 有机含氮化合物 ③ 选择性还原
or NH4HS ¡ 4)2S2 (NH
Na ¡ 2S2 ¡
NH2 NH2
O2N NO2
OH NO2 NO2
Fe+HCl
NO2 NO2
(NH4)2S
NH2 NO2
OH
OH NO2
Na2S C2H5OH,
第十五章 有机含氮化合物 15.1.4 芳香族硝基化合物的化学性质 (1) 还原 硝基化合物被还原的最终产物是胺。还原剂、介质不同时,还原产物不同。
NO2
[H]
NO
[H]
NHOH
[H]
NH2
硝基苯
亚硝基苯
[H]
N-羟基苯胺
苯胺
[H] :LiAlH4 , H2/Cu , H2/Pt , Fe+HCl , SnCl2+HCl
第十五章 有机含氮化合物 15.1 芳香族硝基化合物 芳环上的一个或多个氢原子被硝基取代后的化合物为芳香族硝基 化合物。例如:
CH3 NO2 CH(CH3)2 2-硝基-4-异丙基甲苯 O 2N NO2 2,4,6-三硝基甲苯 (TNT) 2-硝基萘 CH3 NO2 NO2
2021届高考化学专题复习有机化学基础(第六课时) 课件

溶于溶剂,制成饱和
重
溶液,趁热过滤
结
晶
残渣
滤液
冷却,结晶,
(不溶性杂质如) 何洗涤结
过滤,洗涤
晶?如何检
高温溶解、
母验液结晶洗净
趁热过滤、
与否?
低温结晶 (可溶性杂质和部
分被提纯物)
晶体 (产品)
考考点点二:六有、机研物究的有鉴机定物要的靠谱一般方法
洗涤沉淀或晶体的方法:用胶头滴管 往晶体上加蒸馏水直至晶体被浸没, 待水完全流出后,重复两至三次,直 至晶体被洗净。
考点二:漏斗、容量瓶
充分析出乙酰水杨酸固体
生成可溶的乙酰水杨酸钠
重结晶 60
考点二:有机物的鉴定要靠谱
BD
AD BrCH2CH2Br
2
13
考点考三点:六官、能研团究的有性质机物的一般方法
1.烷烃—氧化、分解、裂化裂解、取代
考点考三点:六官、能研团究的有性质机物的一般方法
考点二:有机物的鉴定要靠谱
蒸馏、重结晶、萃取、色谱
研究有机化合物的基本步骤 粗品 分离、提纯 纯品
元素定量分析确定实验式 测定相对分子质量确定分子式 波谱分析确定结构式(确定官能团)
考考点点二:六有、机研物究的有鉴机定物要的靠谱一般方法
欲用96%的工业酒精制取
蒸
无水乙醇?
馏
加入生石灰,再蒸馏
不纯固体物质
有机化学基础复习
第六课时
2021.2.22
考点一:有机反应的类型
1.消去反应—只下不上
(氯代烃的消去—氢氧化钠 醇)(乙醇的消去 浓硫酸)
2.加成反应—只上不下
(烯烃、炔烃、苯的加成—氢气、卤化氢、、水分子、卤素单质)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4.20
OCH3
+C>-I
4.47
2. 醇的酸性
醇在水溶液中的酸性次序为:
H2O
CH3OH
CH3CH2OH
(CH3)2CHOH
(CH3)3COH
pKa
15.7
16
17
18
19
如果在醇分子中引入具有-I效应的原子或基团,其酸 性将明显增强。
CH3CH2OH
pKa
17
N CCH2OH 5.6
3. 酚的酸性 酚的酸性比醇强,但比羧酸弱。
诱导效应:
中心碳原子连有强吸电子基时,将使碳负离子的稳定
性增加。
(F3C)3C
F3C
CH3
中心碳原子连有供电子基时,将使碳负离子的稳定性
降低。
CH3
RCH2
R2CH
R3C
共轭效应:
中心碳原子与π键直接相连时,其未共用电子对因与
π键共轭而离域,从而使碳负离子的稳定性增加。
(C6H5)3C
(C6H5)2CH
CH2C6H5
= CH3
+N
CH2CH C6H5
CH2 Cl
(R)-氯化甲基烯丙基苄基苯基铵
如果给出的是Fischer投影式,其构型的判断:
若最小基团位于竖线上,从平面上观察其余三个基团
由大到小的顺序为顺时针,其构型仍为“R”;反之,其 构
型“若S”最。小基团位于横线上,从平面上观察其余三个基团
由大到小的顺序为顺时针,其构型仍为“S”;反之,其构
一、酸碱性的强弱问题 化合物酸碱性的强弱主要受其结构的电子效应、
杂化的影响。
1.羧酸的酸性
(1) 脂肪族羧酸 连有-I效应的原子或基团,使酸性增强;连有+I效应
的原子或基团,使酸性减弱。
O2NCH2COOH FCH2COOH ClCH2COOH
BrCH2COOH ICH2COOH
pKa 1.23
诱导效应与距离成反比。
CH3CH2CH2COOH 4.82
(2) 芳香族羧酸
一般来说,在芳环上引入吸电子基团,使酸 性增强;引入供电子基团使酸性减弱。
对位取代芳香酸的酸性同时受诱导效应和共轭 效应的影响。
COOH
COOH
COOH
COOH
NO2
Cl
H
-I、-C 效应 -I>+C
pKa
3.42
3.99
CH3COOH
OH
CH3CH2OH
pKa 4.76
9.98
17
取代酚的酸性取决于取代基的性质和取代基在苯环
上所处的位置。
苯环上连有-I、-C基团使酚的酸性增强;连有+I、 +C基团使酸性减弱。
OH
OH
OH
OH
OH
NO2 O2N
NO2
CH3
NO2
NO2
NO2
pka 10.26
10.0
7.15
4.09
0.25
2.66
2.86
2.90
3.16
-I效应↑,酸性↑。
Cl3CCOOH
pKa
0.65
Cl2CHCOOH 1.29
ClCH2COOH 2.66
诱导效应具有加和性。
CH3COOH 4.76
CH3CH2CHCOOH Cl
pKa 2.84
CH3CHCH2COOH Cl
CH2CH2CH2COOH Cl
4.06
4.52
H
+
HNH H
H H
O H
H
O
H
H
O
H
+
CH3 N H H
H H
O H
H
O
CH3 + H N
CH 3
H
H
O H H
O H
CH 3
+
H
CH3 N H O
CH 3
H
H
(2) 芳胺的碱性
在水溶液中芳胺的碱性较 NH3 弱。
芳胺碱性的强弱次序为: PhNH2
Ph2NH
Ph3N
取代芳胺的碱性强弱与取代基的性质有关。当苯环上 连有供电子基团时,将使碱性增强;连有吸电子基团时, 将使碱性减弱。
不同位次CH,3CH首2C5C先HHC344H遇CH到2CC2位H2H3C次H3√最小2,者5-二,甲定基为-4-“异最丁基低庚系烷列”。 CH2CH(CH3)2 56 2. “优先基团后列出”——当主碳链上有多个取代基,
在命名时这些基团的列出顺序遵循“较优基团后列出”的 原
则,较优基团的确定依据是“次序规则”。
有机化学习题课
一、内容 有机化合物的命名。 基本概念与理化性质比较。 完成反应式。
二、系统命名法
系统命名的基本方法是:选择主要官能团 → 确定主 链位次 → 排列取代基列出顺序 → 写出化合物全称。
要点: 1. “最低系列”——当碳链以不同方向编号,得到两 种
或两种以上不同的编号序列时,则顺次逐项比较各序列的
3. 分子中同时含双、叁键化合物
(1) 双、叁键处于不同位次——取双、叁键具有最小 位次的编号。
(CH3)2CHCH2CHC CH
CH=CHCH3
3-异丁基-4-己烯-1-炔
(2) 双、叁键处于相同的编号,选择双键以最低编号。
CH C CH CH CH2 CH3
3-甲基-1-戊烯-4-炔
三、立体异构体的命名
1. Z / E 法——适用于所有顺反异构体。 按“次序规则”,两个‘优先’基团在双键同侧的构 型Z型为;反之,为E型。
↑H C=C H↑↑H C=C H↑
CH3(CH2)4
CH2
(CH2)7COOH
(9Z,12Z)-9,12-十八碳二烯酸
2. R / S 法——该法是将最小基团放在远离观察者的 位置,在看其它三个基团,按次序规则由大到小的顺序, 若为顺时针为R;反之为 S 。
型“R”。
COOH Br OH
CH3 S-型
CH3
CH3 H
C=C
CH H OH
COOH
Br
CH3
OH
R-型
(2R,3Z)-3-戊烯-2-醇
基本概念与理化性质比较
有机化学中的基本概念内容广泛,很难规 定一个确切的范围。这里所说的基本概念主要 是指有机化学的结构理论及理化性能方面的问 题,如: 电子理论中诱导效应和共轭效应的概念 分子的手性 酸碱性 稳定性 反应活性等。
NH2
NH2
NH2
NH2
OCH3
+C I
pkb
8.71
结论:
Cl
NO2
I +C
I、 C
9.38
10.54
13.02
脂肪胺
NH3
芳胺
三、反应活性中间体的稳定性问题
1. 电子效应的影响 取代基的电子效应包括诱导效应和共轭效应。它们将 对活性中间体—— 碳正离子、碳负离子和碳自由基的稳 定性产生影响 。凡能使电荷分散的因素,都将使稳定性 增加。
C6H5CH2
2. 化学反应速率
(1) 自由基取代反应: 反应的难易取决于活性中间体烃基自由基的稳定性, 烃基自由基越稳定,其反应速率越快,
5. 胺的碱性 (1) 脂肪胺的碱性
在气相或不能形成氢键的溶剂中:
(CH3)3N
(CH3)2NH
CH3NH2
NH3
在水溶液中:
NH3 pkb 4.76
(CH3)2NH 3.27
CH3NH2 3.38
(CH3)3N 4.21
胺在水溶液中的碱性是电子效应、溶剂化效应和空间
效应综合影响的结果。
H
O
H HO
