1992年上海高考化学试卷
1992高考化学试题

1992年全国普通高等学校招生统一考试 上海 化学试题第Ⅰ卷原子量:H -1 C -12 O -16 Na -23 Cl -35.5 Fe -56一、选择题(本题共40分)1下列物质的分子式,错误的是A 重晶石BaCO 3B 石膏O 2H CaSO 24⋅C 皓矾O H 7ZnSO 24⋅D 萤石CaF 22下列物质中,有固定沸点的是A 碘酒B 花生油C 油酸D 福尔马林3医用的生理食盐水的浓度是A75% B35~40% C3~5% D0.9%4医生建议患甲状腺肿大的病人多食海带,这是由于海带中含有丰富的 A 碘元素 B 铁元素 C 钾元素 D 锌元素5血红蛋白分子量约为68000,已知其中含铁元素0.33%,则平均每个血红蛋白分子中的铁原子个数为A 5 B4 C3 D26同温同压下,由H 1和H 2组成的两种气体单质,如果质量相同,下述说法错误的是A 体积之比为2:1B 原子个数之比为2:1C 密度之比为1:2D 质子数之比为1:17居里夫人发现的镭是主族元素,它的最外层电子排布是7s 2,下列有关它的描述中错误的是A 在化合物中只呈现+2价B 氢氧化物呈两性C 原子半径在本族元素中最大D 单质与水反应能放出氢气8下列叙述正确的是A 离子化合物中可能含有共价键B 构成分子晶体的微粒一定含有共价键C 共价化合物中可能含有离子键D 非极性分子中一定含有非极性键9下列晶体中,金属键最强的是A 钠B 镁C 铝D 硅10化学反应C(固)+H 2O(气) CO(气)+H 2(气)-Q 达到平衡,下列叙述正确的是A 升高温度,正反应速度增大,逆反应速度减小,平衡向正反应方向移动B 加入固体炭,平衡向正反应方向移动C 加入水蒸气使容器内压强增大,平衡向逆反应方向移动D 扩大容器的容积,平衡向正反应方向移动11在0.1 摩/升醋酸溶液中加入少量0.1摩/升盐酸,下列叙述正确的是A CH 3COOH 的电离度增大,+H 离子浓度增大B 电离平衡向生成CH 3COOH 方向移动,+H 离子浓度减小C CH 3COOH 的电离度减小,pH 值减小D 电离平衡向生成-COO CH 3、+H 离子方向移动,pH 值减小12已知:CH 4(气)+2O 2(气)CO 2(气)+2H 2O(液)+Q 12H 2(气)+O 2(气) 2H 2O(气)+Q 22H 2(气)+O 2(气) 2H 2O(液)+Q 3常温下取体积比为4:1的甲烷和氢气的混和气体11.2升(已折合成标准状况),经完全燃烧后恢复常温,则放出的热量为A0.4Q 1 + 0.05Q 3 B0.4Q 1 + 0.05Q 2C0.4Q 1 + 0.1Q 3 D0.4Q 1 + 0.2Q 213下列各组物质常温下能大量共存的是A Ca(OH)2B Na2O2C FeSO4、O2D Na2S、Cl214有一胶体溶液,在电泳实验中其胶粒向阴极移动,对这种胶体溶液进行下列处理,不发生凝聚的是A加硫酸钠溶液B加热C加硅酸胶体D加氢氧化铁胶体15实验室适宜用排水集气法收集的可燃性气体是A硫化氢B乙稀C一氧化氮D氧气16以下根据实验现象的推断,正确的是A能使润湿的碘化淀粉试纸变蓝的气体一定是氯气B能使石蕊试液呈紫色的溶液一定呈中性C在潮湿空气中能形成白雾的气态氢化物一定是氯化氢D溶于水能形成无色溶液的棕色气体一定是二氧化氮17下列物质与水反应,能放出单质气体的是A氟气B碳化钙C二氧化氮D氧化钙18下列情况能通过置换反应得到铁的是A铜与氯化亚铁溶液常温下混和B一氧化碳通过灼热的三氧化二铁C氢气通入硫酸亚铁溶液D铝和四氧化三铁混和加热至高温19下列说法正确的是A煤的干馏是物理变化B石油裂解的目的主要是为了得到更多的汽油C石油分馏能得到不同沸点范围的产物D石油裂化主要得到的是乙烯、丙烯等20在铁制品上镀以一定厚度的锌层,以下方案设计正确的是A锌作阳极,镀件作阴极,溶液中含有锌离子B铂作阴极,镀件作阳极,溶液中含有锌离子C铁作阳极,镀件作阴极,溶液中含有亚铁离子D锌作阴极,镀件作阳极,溶液中含有锌离子二、选择题(本题共15分)21原子序数小于18的八种连号元素,它们单质的熔点随原子序数增大而变化的趋势如图所示。
1992年全国普通高等学校招生统一考试(上海卷)物理试题

1992年全国普通高等学校招生统一考试(上海卷) 考生注意:1.全卷共七大题,在120分钟内完成。
2.第五、六、七题要求写出必要的文字说明、方程式和重要的演算步骤.只写出最后答案,而未写出主要演算过程的,不能得分。
有数字计算的问题,答案中必须明确写出数值和单位。
一、(32分)单项选择题。
每小题4分.每小题只有一个正确答案,把正确答案前面的字母填写在题后的方括号内。
选对的得4分:选错的或不答的;得0分;选了两个或两个以上的,得4分.填写在方括号外的字母,不作为选出的答案。
1.U 23892经3次α衰变和2 次β衰变,最后得到的原子核中的质子数为A . 92B .88C .138D . 2262.电阻R 1和R 2并联在电路中时,通过R 1的电流强度是通过R 2 的电流强度的n 倍,则当R 1和R 2串联在电路中时,R 1两端的电压U 1与R 2两端的电压U 2之比21U U 为 A .n B.n 2 C .n 1 D .21n3.图中a 、b 为输入端,接交流电源,c 、d 为输出端,则输出电压大于输入电压的电路是4.根据玻尔理论,在氢原子中,量子数n 越大,则( )A .电子轨道半径越小B .核外电子速度越小C .原子能级的能级越小D .原子的电势能越小5.如图所示,闭合导线框的质量可以忽略不计,将它从图示位置匀速拉出匀强磁场.若第一次用0.3秒时间拉出,外力所做的功为W 1,通过导线截面的电量为q 1;第二次用0.9秒时间拉出,外力所做的功为W 2,通过导线截面的电量为q 2,则( )A .W 1<W 2,q 1 <q 2B .W 1 <W 2,q 1 =q 2C .W 1 >W 2,q 1 =q 2D .W 1 >W 2,q 1>q 26.如图所示,S 点为振源,其频率为100赫兹,所产生的横波向右传播,波速为80米/秒,P 、Q是波传波途径中的两点,已知SP =4.2米,SQ =5.4米,当S通过平衡位置向上运动时,则A .P 在波谷,Q 在波峰B .P 在波峰,Q 在波谷C .P 、Q 都在波谷D .P 通过平衡位置向上运动,Q 通过平衡位置向下运动7.图中A 为电磁铁,C 为胶木盘,A 和C (包括支架)的总质量为M ,B 为铁片,质量为m ,整个装置用轻绳挂于O 点.当电磁铁通电,铁片被吸引上升的过程中,轻绳上拉力F 的大小为A .F =mgB .Mg <F <(M +m )gC .F =(M +m )gD .F >(M +m )g8.图表示一条光线由空气射到半圆形玻璃砖表面的圆心O 处,在玻璃砖的半圆形表面镀有银反射面。
1992年全国化学竞赛试题及参考答案

1992年全国化学竞赛试题及参考答案
佚名
【期刊名称】《化学教育》
【年(卷),期】1992(000)002
【摘要】无
【总页数】1页(P50)
【正文语种】中文
【相关文献】
1.中国化学会第22届全国高中学生化学竞赛(决赛)理论试题参考答案 [J],
2.2006年全国高中学生化学竞赛理论试题参考答案 [J], 上海化学化工学会;复旦大学化学系
3.2005年全国高中学生化学竞赛决赛理论试题参考答案与评分标准 [J],
4.2003年全国高中学生化学竞赛决赛理论试题参考答案 [J], 武汉大学化学学院;湖北省化学化工学会命题组
5.1993年全国化学竞赛试题及参考答案(1993年1月上海) [J],
因版权原因,仅展示原文概要,查看原文内容请购买。
1992年高考化学第二卷

1992年全国高考化学试题第Ⅱ卷共45分(相当于150分制的67分)可能用到的数据原子量H1 C12 N14 O16 Na23 S32四、(本题包括2小题,共11分)28.(2分)Cu+在酸性溶液中不稳定,可发生自身氧化-还原反应生成Cu2+和Cu.现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,而没有其它试剂.简述如何用最简便的实验方法来检验CuO经氢气还原所得到的红色产物中是否含有碱性氧化物Cu2O.29.(9分)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现.这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出.进行此实验,所用的仪器及导管如图.根据要求填写下列空白:(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是 .(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是 .(3)仪器①的橡皮塞上应有个孔,原因是 .(4)实验时,仪器①中除观察到红光外还有现象.(5)实验需用约10%H2O2溶液100毫升,现用市售30%(密度近似为1克/厘米3)H2O2来配制,其具体配制方法是.(6)实验时仪器①中ClO 与H2O2反应的离子方程式是.五、(本题包括4小题,共10分)30.(2分)配平下列化学方程式:31.(2分)气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键的关系如下图所示.请将图中,你认为是配位键的斜线上加上箭头.32.(2分)在金刚石的网状结构中,含有由共价键形成的碳原子环,其中最小的环上有 (填数字)个碳原子,每个碳原子上的任意两个C—C键的夹角都是 (填角度).33.(4分)某待测液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、NH 4+等离子,进行如下实验(所加酸、碱、氨水、溴水都是过量的)。
1996年上海化学高考试题及答案

1996年全国普通高校招生统一考试上海化学试卷第I 卷(共70分)说明:1. 在无机化学反应中“=”与“→”通用,在有机化学反应中,一律用“→”表示。
2. 物质的浓度与摩尔浓度通用,单位统一用mol / L表示。
3. 原子量(即相对原子质量)H-1 N-14 O -16 Na-23 Mg-24 Al-23S-32 Cl-35.5 K-39 Ca-40 Fe-56 Cu-64 Ba-137一、选择题(本题共30分),每小题2分,只有一个正确选项1.下列物质中,不含结晶水的是(B)A. 芒硝B. 大理石C. 明矾D. 生石膏2.下列过程中,共价键被破坏的是( D )A. 碘升华B. 溴蒸气被木炭吸吸C. 酒精溶于水D. HCl气体溶于水解析:在某种变化过程中,化学键是否被破坏,一是看该变化是物理变化还是化学变化,若是化学变化,化学键肯定被破坏。
因此,也可以看物质的微粒是否有变化。
如氯化氢气体溶于水,生成盐酸中不再是HCl分子,而是H+和Cl-,原来H原子与Cl原子间的共价键遭到破坏。
另一则是要看晶体类型,对于分子晶体来说,发生的物理变化过程并不破坏化学键,它破坏的是分子间作用力,如A、B、C,因为它们都是分子晶体。
3.下列电子式书写错误的是(A)4.随着卤素原子半径的增加,下列递变规律正确的是(B)A. 单质的熔沸点逐渐降低B. 卤素离子的还原性逐渐增强C. 气态氢化物的稳定性逐渐增强D. 单质的氧化性逐渐增强解析:卤素原子半径的增加,也就是原子序数增加,单质的熔沸点逐渐升高,氧化性逐渐减弱,卤素离子的还原性逐渐增强,气态氢化物的稳定性则逐渐减弱。
5.下列物质有固定元素组成的是( D )A. 空气B. 石蜡C. 氨水D. 二氧化氮气体解析:有固定元素组成的物质,可以是由一种元素组成的单质(元素的游离态),或由不同种元素组成的化合物(元素的化合态),即是纯净物,而非混合物。
空气、石蜡和氨水都是混合物,只有二氧化氮气体是纯净物,才有固定元素的组成。
1992年全国初中毕业升学化学试题精选和解答

1992年全国初中毕业升学化学试题精选和解答【1992年全国初中毕业升学化学试题精选及解答】
一、选择题
1.有关物质的变化,以下说法对的是()
A. 合成反应能使其原来的元素成分发生不可逆变化
B. 分解反应会使物质的组成一定发生变化
C. 化学反应会使物质内部分子结构发生变化
D. 过程中不改变物质的原来成分
答案:A
2.下列句子中,哪一个是错误的()
A.冰沙冷却时,水分子作用于乙醇分子
B.水和乙醇不能溶解
C.当乙醇和水混合时,发生化学反应
D.乙醇汽液与冰沙混合时,只会发生物理反应
答案:B
3.从下列反应中选出反应方程式和名称()
A.2H2O2——>2H2O+O2 水解
B.2KClO3——>2KCl+3O2 氧化
C.C6H12O6——>2C2H5OH+2CO2 燃烧
D.2KCl+3O2——>2KClO3 氯化
答案:D
4.一定体积的气体,压强增大一倍,其体积()
A.减少一倍
B.按原来体积保持不变
C.增大一倍
D. 不能确定
答案:A
二、问答题
1.什么是物质的变化?
物质的变化是指物质内部原子或分子组合的改变。
包括物质分解和组合、物理变化、化学变化等。
物质的变化会导致能量的变化,这种能量变化是一种反应,也是一种化学反应。
1992年全国普通高等学校招生考试化学三南

1992年试题(湖南、云南、海南三省用题)第Ⅰ卷相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 P 31 S 32 Cl 35.5 Ca 40 Ba137 一、选择题(本题包括5小题,每小题2分,共10分。
每小题只有一个选项符合题意。
)1.下列物质中属于纯净化合物的是A.福尔马林B.干冰C.凡士林D.石墨2.下列关于Fe(OH)3胶体的说法不正确的是A.Fe(OH)3溶液与硅酸胶混和将产生凝聚现象B.Fe(OH)3胶体粒子在电场影响下将向阳极运动C.Fe(OH)3胶体微粒不停地作布朗运动D.光线通过Fe(OH)3溶胶时会发生丁达尔现象3.既有离子键又有共价键和配位键的化合物是A.NH4NO3B.NaOH C.H2SO4D.H2O4.在炼铁、制玻璃和制水泥三种工业生产中,都需要的原料是A.生石灰B.石灰石C.石英D.纯碱5.下列所述情况可能引起水污染的是:①城市生活污水的任意排放;②农业生产中农药、化肥使用不当;③海上油轮石油泄漏;④工业生活中废液、废渣、废气的排放A.只有①③B.只有①④C.只有②④D.①②③④二、选择题(本题包括10小题,每小题3分,共30分。
每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该小题0分;若正确答案包括两个选项,只选一个且正确的给1分,选两个且都正确的给3分。
但只要选错一个,该小题就为0分。
)6.元素X的原子获得3个电子或元素Y的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的正确的分子式为A.Y3X2B.X2Y3 C.X3Y2D.Y2X37.能够使醋酸溶液的pH值和醋酸的电离度都减小的是A.滴加少量H2SO4溶液B.加入少许水稀释C.滴加少量NaOH溶液D.加入少许CH3COONa晶体8.下列各组中的两种物质通常都可作为还原剂使用的是A.SO2、H2SO4 B.Cl2、FeCl3C.H2、CO D.Br2、HNO39.能正确表示下列反应的离子方程式是A.碳酸钙跟醋酸反应 CaCO3 + 2 H+== Ca+2+ H2O + CO2↑B.铁跟稀盐酸反应 Fe + 2 H+ == Fe+2+ H2↑C.碘化钾溶液跟适量溴水反应 I-+ Br2 == 2 Br-+ ID.铁跟硫酸铜溶液反应 Cu+2+ Fe == Fe+2+ Cu10.下列物质跟氢氧化钠溶液不能发生反应的是A.Mg(OH)2B.Al(OH)3C.CO D.SO211.中和相同体积相同、pH值的Ba(OH)2、NaOH和NH3·H2O三种稀溶液,所用相同浓度盐酸的体积分别为V1、V2和V3,则A.V3>V1==V2B.V3>V2>V1C.V1>V2>V3D.V3<V1==V2 12.下列方法可用于制备卤化氢气体的是A.NaCl与浓硝酸加热制备HCl B.NaF与浓硫酸加热制备HFC.NaBr与浓磷酸加热制备HBr D.NaI与浓硫酸加热制备HI13.在某无色透明溶液中,三种离子能大量共存的是A.NH+4、AlO-2、Na+B.Al+3、OH-、Na+C.Ca+2、Cl-、Na+D.Na+、CO-23、Cl-14.用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中正确的是A.酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸B.锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的NaOH溶液C.滴定时,没有逐出滴定管下口的气泡D.读数时,视线与滴定管内液体的凹液面最低处保持水平15.R代表第三周期元素,若它的原子最外电子层上只有一个不成对电子,则关于R的正确说法是A.常温常压下,R的单质都不能跟水剧烈作用B.常温常压下,R的单质中有的可能是强氧化剂C.R的氧化物中,有的可能是两性氧化物D.R的氧化物的分子式一定是R2O三、选择题(本题包括10小题,每小题4分,共40分。
1992年高考上海化学试题和参考答案

1992年高考上海化学试题和参考答案相对原子质量 H —l C —12 N —14 O —16 S 一32 Cl —35.5Fe —56 Cu —64第1卷(共55分)一、 选择题(本题共40 分,每题只有一个正确选项)1.下列物质的俗名与分子式不相符合的是A . 电石 CaC 2B . 冰晶石 Na 3AlF 6C . 萤石 MgF 2D . 石灰石 CaCO 32.下列仪器∶①集气瓶 ②量筒 ③ 烧杯 ④表面皿 ⑤蒸发皿 ⑥ 容量瓶 ⑦烧瓶,能用酒精灯加热的是A . ②③⑤B . ③⑥⑦C . ①③④D . ③⑤⑦3.下列变化属于物理变化的是A . 氧气在放电条件下变成臭氧B . 加热胆矾成白色无水硫酸铜C . 漂白的草帽久置与空气中变黄D . 氢氧化铁胶体加入硫酸镁产生沉淀4.关于同温同压下等体积的CO 2 和CO 的叙述∶① 质量相等 ② 密度相等 ③ 所含分子个数相等 ④ 所含碳原子个数相等。
其中正确的是A . ①②③④B . ②③④C . ③④D . ③5.下列各组气体中,既可以用浓硫酸又可用碱石灰干燥的是A . CO 、H 2、CH 4B . H 2、O 2、Cl 2C . CO 、O 2、H 2SD . SO 2、NH 3、CH 46、核内中子数为N 的R 2+的离子,质量数为A ,则n 克它的氧化物中所含质子的物质的量为A . 16+A n (A -N +8)B . 16+A n (A -N +10)C . (A -N +2)D .A n (A -N +6) 7.对某弱酸稀溶液加热时,下列叙述错误的是A . 弱酸的电离度增大B . 弱酸分子的浓度减少C . 溶液的[OH -]增大D . 溶液的导电性增强8.下列性质中,可以证明某化合物内一定存在离子键的是A . 可溶于水B . 具有较高的熔点C . 水溶液能导电D . 熔融状态能导电9、下列叙述正确的是A . P 4和NO 2都是共价化合物B . CCl 4和NH 3都是以极性键结合的极性分子C . 在CaO 和SiO 2晶体中,都不存在单个小分子D . 甲烷的分子是对称的平面结构,所以是非极性分子10.a 元素的阴离子;b 元素的阴离子和c 元素的阳离子具有相同的电子层结构。
九二年高考化学真题

九二年高考化学真题一、选择题1. 下列物质受余电子制约不成立的是()A. NaB. ClC. O2D. SO22. 硝酸在光照条件下分解,下列关于分解的说法不正确的是()A. 有无水分的影响有关B. 用铜、银、铝等金属瓶不易发生爆炸,C. 光照条件有利于分解D. 分解物是氮和氧的二氧化氮3. 下列材料做铝制成的最适合是()A. 饮料罐头B. 防腐蚀件C. 电线的绝缘层D. 金属屋顶4. 甲醇假定为无色气体,其氧化反应式为2CH3OH+302-2CO2+4H2O,当2.0l的甲醇气体完全燃烧后沿等温线收缩得到0.8l氧气,那么对于温度是()A.0℃ B.100℃ C.200℃ D.400℃5. 点燃折叠好的明矾纸,经加热变化有()A. 物理变化B. 化学变化C. 电解质构成物D. 口水腐蚀消失6. 下列说法正确的是()1. NO+O2→NO22. 3NO2+1/2O2→2NO23. 2NO2+2H2O→HNO3+HNO24. P(NO2)=p(NO)^2A. ①②B. ②③C. ①③D. ①②③7. 在鱼及植物体内为氨的来源是()A.鳃B. 肝C. 肾D. 脾8. HDn→H3PO4 作为磷酸的转化,氢的价格是多少?A. 900单位B. 1000单位C. 1100单位D.1200单位9. 氧化剂的特性方便的是()A. 使易有机质B. 脱氢C. 将物质氧化D. 适应酸性时10. 下列在化学反应(A)=p(B)p(C)为()A. 2CO2=2CO+2O2B. 2CO+2O2=2CO2C. 2NO+O2=2NO2D. 2H2O=H2+2O2二、判断题1. 单质元素可以分为两类。
2. 氢氧化钠在溶液中可以三种颜色。
3. 雨涨古城文物的威胁。
三、简答题1. 请简单解释溶液中的粘度。
2. 请解释片晶材料反应没有中心对称。
3. 1927年奥斯汀勋章制作需要用化学胶处理。
四、综合题1. 请根据以下位置情况用文字描述A 、B 、C 三个之间的传统关系。
1988上海高考化学试题及答案

1988上海高考化学试题及答案1988年上海高考化学试题一、选择题(每题2分,共20分)1. 下列元素中,属于碱金属元素的是:A. 锂(Li)B. 钠(Na)C. 钾(K)D. 铷(Rb)2. 根据元素周期表,下列元素中原子半径最大的是:A. 氧(O)B. 硫(S)C. 氯(Cl)D. 氩(Ar)3. 化学反应中,下列哪种物质不是氧化剂?A. 氧气(O2)B. 氯气(Cl2)C. 硝酸(HNO3)D. 氢气(H2)4. 下列化合物中,属于共价化合物的是:A. 氯化钠(NaCl)B. 氧化镁(MgO)C. 硫酸(H2SO4)D. 氢氧化钠(NaOH)5. 根据化学平衡原理,下列条件中不能使反应速率加快的是:A. 增加反应物浓度B. 升高温度C. 增加催化剂用量D. 减少生成物浓度6. 根据酸碱中和反应原理,下列物质中属于酸的是:A. 碳酸钠(Na2CO3)B. 硫酸(H2SO4)C. 氢氧化钠(NaOH)D. 硝酸铵(NH4NO3)7. 根据质量守恒定律,下列反应中生成物的质量总和等于反应物的质量总和的是:A. 2H2 + O2 → 2H2OB. C + O2 → CO2C. 4Fe + 3O2 → 2Fe2O3D. 2H2O → 2H2 + O28. 下列物质中,不属于电解质的是:A. 氯化钠(NaCl)B. 硫酸(H2SO4)C. 水(H2O)D. 乙醇(C2H5OH)9. 根据溶液的pH值,下列溶液中属于碱性溶液的是:A. pH = 1B. pH = 7C. pH = 14D. pH = 310. 下列物质中,属于高分子化合物的是:A. 葡萄糖(C6H12O6)B. 淀粉(C6H10O5)nC. 尿素(CO(NH2)2)D. 醋酸(CH3COOH)答案:1. B2. D3. D4. C5. D6. B7. A8. D9. C10. B二、填空题(每空1分,共20分)11. 根据电子排布规律,元素的原子序数为11的元素是______。
1992年高考化学试题和参考答案

1992年高考化学试题和参考答案第Ⅰ卷可能用到的数据原子量:H 1 C 12 N 14 O 16 F 19 Na 23 S 32 Cl 35.5 Ar 40 Xe 131对数值lg2=0.301 lg3=0.477 lg5=0.699一、选择题(每小题1分,共5分。
每小题只有一个....选项符合题意。
)1.在炼铁、制玻璃、制水泥三种工业生产中,都需要的原料是()(A)纯碱(B)石灰石(C)石英(D)粘土2.下列情况可能引起大气污染的是①煤的燃烧;②工业废气的任意排放;③燃放鞭炮;④飞机、汽车尾气的排放()(A)只有①②(B)只有②④(C)只有①②③(D)①②③④3.下列分子中,属于含有极性键的非极性分子的是()(A)H2O (B)Cl2(C)NH3(D)CCl44.下列晶体中,不属于原子晶体的是()(A)干冰 (B)水晶(C)晶体硅(D)金刚石5.用pH试纸测定某无色溶液的pH值时,规范的操作是()(A)将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较(B)将溶液倒在pH试纸上,跟标准比色卡比较(C)用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较(D)在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较参考答案:1.B2.D3.D4.A5.C二、选择题(每小题2分,共32分。
每小题有一个或两个.....选项符合题意。
若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,每选对一个给1分,但只要选错一个,该小题就为0分.)6.在同温同压下1摩氩气和1摩氟气具有相同的()(A)质子数(B)质量(C)原子数(D)体积7.用N A表示阿佛加德罗常数.下列说法正确的是()(A)1摩钠作为还原剂可提供的电子数为N A(B)标准状况(0℃,101.3千帕)下,22.4升氯气中所含的氯原子数为N A(C)16克氧气中所含的氧原子数为N A(D)18克水所含的电子数为8N A8.最近,科学家研制得一种新的分子,它具有空心的类似足球状结构,分子式为C60.下列说法正确的是()(A)C60是一种新型的化合物(B)C60和石墨都是碳的同素异形体(C)C60中含离子键(D)C60的分子量是7209.用R代表短周期元素,R原子最外层的p亚层上的未成对电子只有2个.下列关于R的描述中正确的是()(A)R的氧化物都能溶于水(B)R的最高价氧化物所对应的水化物都是H2RO3(C)R的都是非金属元素(D)R的氧化物都能与NaOH溶液反应10.下列物质容易导电的是(A)熔融的氯化钠(B)硝酸钾溶液(C)硫酸铜晶体(D)无水乙醇11.在某温度下反应ClF(气)+F2(气) ClF3(气) +268千焦在密闭容器中达到平衡.下列说法正确的是()(A)温度不变,缩小体积,ClF的转化率增大(B)温度不变,增大体积,ClF3的产率提高(C)升高温度,增大体积,有利于平衡向正反应方向移动(D)降低温度,体积不变,F2的转化率降低12.在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质,其质量比为()(A)3:1 (B)1:3 (C)1:2 (D)2:113.下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是()(A)在氧化-还原反应中,甲原子失去的电子比乙原子失去的电子多(B)同价态的阳离子,甲比乙的氧化性强(C)甲能跟稀盐酸反应放出氢气而乙不能(D)将甲、乙作电极组成原电池时,甲是负极14.用石墨作电极,电解1摩/升下列物质的溶液,溶液的pH值保持不变的是()(A)HCl (B)NaOH (C)Na2SO4(D)NaCl15.若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是()(A)SO42-(B)S2-(C)CO32-(D)Cl-16.等体积混和0.10摩/升盐酸和0.06摩/升Ba(OH)2溶液后,溶液的pH值等于()(A)2.0 (B)12.3 (C)1.7 (D)12.017.某温度下,在体积一定的密闭容器中适量的NH3(气)和Cl2(气)恰好完全反应.若反应产物只有N2(气)和NH4Cl(固),则反应前后容器中压强比应接近于()(A)1:11 (B)11:1 (C)7:11 (D)11:718.能正确表示下列反应的离子方程式是( )(A)在碳酸氢钙溶液中加入盐酸:HCO 3-+H +=CO 2↑+H 2O(B)把金属铁放入稀硫酸中:2Fe+6H +=2Fe 3++3H 2↑(C)向氯化亚铁溶液中通入氯气:Fe 2++Cl 2=Fe 3++2Cl -(D)硫化钠水解:S 2-+2H 2O=H 2S↑+2OH -19.合成氨反应为:3H 2+N 22NH 3,其反应速率可以分别用ν(H 2)、ν(N 2)、ν(NH 3)(摩/升·秒)表示,则正确的关系式是( )(A)ν(H 2)= ν(N 2)= ν(NH 3) (B) ν(N 2)=3ν(H 2)(C) νν(NH 3)=23νH 2 (D) ν(H 2)=3ν(N 2)20.甲、乙两种化合物都只含X 、Y 两种元素,甲、乙中X 元素的百分含量分别为30.4%和25.9%.若已知甲的分子式是XY 2,则乙的分子式只可能是( )(A)XY (B)X 2Y (C)X 2Y 3 (D)X 2Y 521.已知丁基共有四种.不必试写,立即可断定分子式为C 5H 10O 的醛应有( )(A)3种 (B)4种 (C)5种 (D)6种参考答案: 6.A 、D 7.A 、C 8.B 、D 9.C 10.A 、B 11.A 12.C 13.C 、D14.C 15.B 、C 16.D 17.B 18.A 19.D 20.D 21.B三、选择题(每小题3分,共18分.每小题只有一个....选项符合题意.) 22.设计了四种制备气体的方案:①加热稀硫酸和乙醇制备乙烯;②加热稀盐酸和二氧化锰制备氯气;③用稀硫酸和大理石制备二氧化碳;④用稀硝酸和硫化亚铁制备硫化氢.不宜采用的方案有哪些?( )(A)只有①和②(B)只有②和③ (C)只有③和④ (D)①②③④23.不用其它试剂,限用化学方法区别下列两组内的四瓶溶液( )①FeCl 3、BaCl 2、MgSO 4、Al 2(SO 4)3;②Al 2(SO 4)3、盐酸、BaCl 2、K 2CO 3(A)只有①组可以 (B)只有②组可以(C)两组都可以 (D)两组都不可以24.相同温度、相同摩尔浓度的四种溶液:①CH 3COONa 、②NaHSO 4、③NaCl 、④按pH 值由大到小的顺序排列,正确的是( )(A)④>①>③>② (B)①>④>③>②(C)①>②>③>④ (D)④>③>①>②25.用1升1.0摩/升NaOH 溶液吸收0.8摩CO 2,所得溶液中的CO 32-和HCO 3-的摩尔浓度之比约是( )(A)1:3 (B)2:1 (C)2:3 (D)3:226.在一定条件下,CO 和CH 4燃烧的热化学方程式分别为( )2CO(气)+O2(气)=2CO2(气)+566千焦CH4(气)+2O2(气)=CO2(气)+2H2O(液)+890千焦由1摩CO和3摩CH4组成的混和气在上述条件下完全燃烧时,释放的热量为(A)2912千焦(B)2953千焦(C)3236千焦(D)3867千焦27.在一定体积的容器中,加入1.5摩氙气和7.5摩氟气,于400℃和2633千帕压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5摩氟气.则所得无色晶体产物中,氙与氟的原子个数比是()(A)1:2 (B)1:3 (C)1:4 (D)1:6参考答案:22.D 23.B 24.A 25.A 26.B 27.C第Ⅱ卷可能用到的数据原子量H1 C12 N14 O16 Na23 S32四、(本题包括2小题,共11分)28.(2分)Cu+在酸性溶液中不稳定,可发生自身氧化-还原反应生成Cu2+和Cu.现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,而没有其它试剂.简述如何用最简便的实验方法来检验CuO经氢气还原所得到的红色产物中是否含有碱性氧化物Cu2O.29.(9分)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现.这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出.进行此实验,所用的仪器及导管如图.根据要求填写下列空白:(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是.(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是.(3)仪器①的橡皮塞上应有个孔,原因是.(4)实验时,仪器①中除观察到红光外还有现象.(5)实验需用约10%H2O2溶液100毫升,现用市售30%(密度近似为1克/厘米3)H2O2来配制,其具体配制方法是.(6)实验时仪器①中ClO与H2O2反应的离子方程式是.参考答案:28.取少量该红色产物放入稀硫酸,(振荡)若溶液变为蓝色,说明产物中有Cu2O;若溶液不变色,说明产物中无Cu2O.29.(1)③②⑤(2)②⑤⑥④①(3)2,使瓶内外压强相等(4)冒气泡(1分)(5)用量筒量取33(或34)毫升30%H2O2溶液加入烧杯中,再加入67(或66)毫升水(或加水稀释至100毫升),搅拌均匀(6)ClO-+H2O2=Cl-+O2↑+H2O五、(本题包括4小题,共10分)30.(2分)配平下列化学方程式:31.(2分)气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键的关系如下图所示.请将图中,你认为是配位键的斜线上加上箭头.32.(2分)在金刚石的网状结构中,含有由共价键形成的碳原子环,其中最小的环上有(填数字)个碳原子,每个碳原子上的任意两个C—C键的夹角都是(填角度).33.(4分)某待测液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、NH 4+等离子,进行如下实验(所加酸、碱、氨水、溴水都是过量的)。
试题92年全国高考化学

92年全国高考化学试题第 I 卷可能用到的数据原子量:H1 C12 N14 O16 Mg24 Al27 S32 Cl35.5 Fe56Cu64 Na23 Zn65 Ag108 Sn119 Ba137 Cr52一、选择题(本题共有10小题,每小题2分,共20分。
)1.下列溶液在常温下能跟镁反应生成氢气的是:( )(A)NaCl (B)NH4Cl (C)NaOH (D)Na2CO32.下列仪器不允许用酒精灯加热的是:( )(A)表面皿(B)蒸馏烧瓶(C)蒸发皿(D)坩埚3.向FeCl3和BaCl2的酸性混和溶液中。
通入SO2气体,有白色沉淀生成,此沉淀是:( )(A)BaSO4(B)FeS (C)BaSO3 (D)S4.下列微粒不含有孤对电子是:( )(A)OH-(B)Cl- (C)H+ (D)NH35.H+离子与H2O分子反应生成H3O+离子,它们之间的相互作用是:( )(A)分子间的作用 (B)非极性共价键 (C)离子键(D)配位键6.某主族元素的原子,M层上有一个半充满的亚层(即该亚层的每个轨道只有1个电子)。
这种原子的质为( )(A)只能是7 (B)只能是15 (C)是11或15 (D)是11或137.安全火柴盒的侧面所涂的物质是一种混和物,其中含有:( )(A)白磷和三硫化二锑等(B)红磷和三硫化二锑等(C)氯酸钾、二氧化锰和硫等(D)硝酸钾、二氧化锰和硫等8.下列有关稀有气体的描述不正确的是:( )①原子的最外电子层都有8个电子;②其原子与同周期第ⅠA、ⅡA族阳离子具有相同的核外电子排布;③有些希有气体能跟某些物质反应;④原子半径比同周期ⅤⅡA族元素原子的大。
(A)只有①(B)①和③(C)①和②(D)②和④9.将质量相等的下列各物质完全酯化时,需醋酸质量最多的是:( )(A)甲醇(B)乙二醇(C)丙醇(D)甘油10.X是一种烃,它不能使KMnO4溶液褪色。
0.5摩的X完全燃烧时,得到27克水和67.2升CO2(标准状况)。
1992年全国统一高考化学试卷

1992年全国统一高考化学试卷一、选择题(每小题1分,共5分.每小题只有一个选项符合题意.)1.(1分)(2012秋•金家庄区校级期末)在炼铁、制玻璃、制水泥三种工业生产中,都需要的原料是()A.纯碱 B.石灰石C.石英 D.粘土2.(1分)(2012秋•郑州校级期末)下列情况可能引起大气污染的是①煤的燃烧;②工业废气的任意排放;③燃放鞭炮;④飞机、汽车尾气的排放()A.只有①②B.只有②④C.只有①②③ D.①②③④3.(1分)(2006春•平顶山期末)下列分子中,属于含有极性键的非极性分子的是()A.H2O B.Cl2C.NH3D.CCl44.(1分)(2013秋•蒙山县校级期末)下列晶体中,不属于原子晶体的是()A.干冰 B.水晶 C.晶体硅D.金刚石5.(1分)(2007•宣威市校级模拟)用pH试纸测定某无色溶液的pH值时,规范的操作是()A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较B.将溶液倒在pH试纸上,跟标准比色卡比较C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较二、选择题(每小题2分,共32分.每小题有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,每选对一个给1分,但只要选错一个,该小题就为0分.)6.(2分)在同温同压下1摩氩气和1摩氟气具有相同的()A.质子数B.质量 C.原子数D.体积7.(2分)用NA表示阿佛加德罗常数.下列说法正确的是()A.1摩钠作为还原剂可提供的电子数为NAB.标准状况(0℃,101.3千帕)下,22.4升氯气中所含的氯原子数为NAC.16克氧气中所含的氧原子数为NAD.18克水所含的电子数为8NA8.(2分)(2013秋•金阊区校级期中)最近,科学家研制得一种新的分子,它具有空心的类似足球状结构,分子式为C60.下列说法正确的是()A.C60是一种新型的化合物B.C60和石墨都是碳的同素异形体C.C60中含离子键D.C60的分子量是7209.(2分)(2012春•西宁期末)用R代表短周期元素,R原子最外层的p亚层上的未成对电子只有2个.下列关于R的描述中正确的是()A.R的氧化物都能溶于水B.R的最高价氧化物所对应的水化物都是H2RO3C.R的都是非金属元素D.R的氧化物都能与NaOH溶液反应10.(2分)下列物质容易导电的是()A.熔融的氯化钠 B.硝酸钾溶液C.硫酸铜晶体D.无水乙醇11.(2分)(2013春•绿园区校级期末)在某温度下反应ClF(气)+F2(气)ClF3(气)+268千焦在密闭容器中达到平衡.下列说法正确的是()A.温度不变,缩小体积,ClF的转化率增大B.温度不变,增大体积,ClF3的产率提高C.升高温度,增大体积,有利于平衡向正反应方向移动D.降低温度,体积不变,F2的转化率降低12.(2分)(2010秋•姜堰市期末)在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质,其质量比为()A.3:1 B.1:3 C.1:2 D.2:113.(2分)(2012春•桃城区校级期末)下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是()A.在氧化﹣还原反应中,甲原子失去的电子比乙原子失去的电子多B.同价态的阳离子,甲比乙的氧化性强C.甲能跟稀盐酸反应放出氢气而乙不能D.将甲、乙作电极组成原电池时,甲是负极14.(2分)(2011秋•南昌期末)用石墨作电极,电解1摩/升下列物质的溶液,溶液的pH 值保持不变的是()A.HCl B.NaOH C.Na2SO4D.NaCl15.(2分)若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是()A.SO42﹣B.S2﹣C.CO32﹣D.Cl﹣16.(2分)等体积混和0.10摩/升盐酸和0.06摩/升Ba(OH)2溶液后,溶液的pH值等于()A.2.0 B.12.3 C.1.7 D.12.017.(2分)(2012秋•荆州区校级期中)某温度下,在体积一定的密闭容器中适量的NH3(气)和Cl2(气)恰好完全反应.若反应产物只有N2(气)和NH4Cl(固),则反应前后容器中压强比应接近于()A.1:11 B.11:1 C.7:11 D.11:718.(2分)(2012春•宁乡县校级月考)能正确表示下列反应的离子方程式是()A.在碳酸氢钙溶液中加入盐酸:HCO3﹣+H+=CO2↑+H2OB.把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑C.向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl﹣D.硫化钠水解:S2﹣+2H2O=H2S↑+2OH﹣19.(2分)(2012秋•诸暨市校级期中)合成氨反应为:3H2+N22NH3,其反应速率可以分别用νH2、νN2、νNH3(摩/升•秒)表示,则正确的关系式是()A.νH2=νN2=νNH3B.νN2=3νH2 C.νNH3=νH2D.νH2=3νN220.(2分)(2014春•东湖区校级期末)甲、乙两种化合物都只含X、Y两种元素,甲、乙中X元素的百分含量分别为30.4%和25.9%.若已知甲的分子式是XY2,则乙的分子式只可能是()A.XY B.X2Y C.X2Y3D.X2Y521.(2分)(2012秋•中牟县期末)已知丁基共有四种.不必试写,立即可断定分子式为C5H10O 的醛应有()A.3种B.4种C.5种D.6种三、选择题(每小题3分,共18分.每小题只有一个选项符合题意.)22.(3分)设计了四种制备气体的方案:①加热稀硫酸和乙醇制备乙烯;②加热稀盐酸和二氧化锰制备氯气;③用稀硫酸和大理石制备二氧化碳;④用稀硝酸和硫化亚铁制备硫化氢.不宜采用的方案有哪些?()A.只有①和②B.只有②和③C.只有③和④D.①②③④23.(3分)不用其它试剂,限用化学方法区别下列两组内的四瓶溶液:①FeCl3、BaCl2、MgSO4、Al2(SO4)3;②Al2(SO4)3、盐酸、BaCl2、K2CO3()A.只有①组可以B.只有②组可以C.两组都可以D.两组都不可以24.(3分)(2007秋•秦皇岛期末)相同温度、相同摩尔浓度的四种溶液:①CH3COONa、②NaHSO4、③NaCl、④按pH值由大到小的顺序排列,正确的是()A.④>①>③>②B.①>④>③>②C.①>②>③>④D.④>③>①>②25.(3分)(2012春•巴彦淖尔校级期末)用1升1.0摩/升NaOH溶液吸收0.8摩CO2,所得溶液中的CO32﹣和HCO3﹣的摩尔浓度之比约是()A.1:3 B.2:1 C.2:3 D.3:226.(3分)(2014秋•泉州校级期中)在一定条件下,CO和CH4燃烧的热化学方程式分别为:2CO(气)+O2(气)=2CO2(气)+566千焦CH4(气)+2O2(气)=CO2(气)+2H2O(液)+890千焦由1摩CO和3摩CH4组成的混和气在上述条件下完全燃烧时,释放的热量为()A.2912千焦B.2953千焦C.3236千焦D.3867千焦27.(3分)(2012春•内蒙古校级期末)在一定体积的容器中,加入1.5摩氙气和7.5摩氟气,于400℃和2633千帕压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5摩氟气.则所得无色晶体产物中,氙与氟的原子个数比是()A.1:2 B.1:3 C.1:4 D.1:6四、(本题包括2小题,共11分)28.(2分)Cu+在酸性溶液中不稳定,可发生自身氧化﹣还原反应生成Cu2+和Cu.现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,而没有其它试剂.简述如何用最简便的实验方法来检验CuO经氢气还原所得到的红色产物中是否含有碱性氧化物Cu2O.29.(9分)(2015春•滨州校级期末)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现.这是因为通气后混和液中产生的ClO﹣被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出.进行此实验,所用的仪器及导管如图.根据要求填写下列空白:(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是.(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是.(3)仪器①的橡皮塞上应有个孔,原因是.(4)实验时,仪器①中除观察到红光外还有现象.(5)实验需用约10%H2O2溶液100毫升,现用市售30%(密度近似为1克/厘米3)H2O2来配制,其具体配制方法是.(6)实验时仪器①中ClO﹣与H2O2反应的离子方程式是.五、(本题包括4小题,共10分)30.(2分)配平下列化学方程式:31.(2分)气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键的关系如下图所示.请将图中,你认为是配位键的斜线上加上箭头.32.(2分)在金刚石的网状结构中,含有由共价键形成的碳原子环,其中最小的环上有(填数字)个碳原子,每个碳原子上的任意两个C﹣C键的夹角都是(填角度).33.(4分)(2010春•东昌府区校级月考)某待测液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、NH 4+等离子,进行如下实验(所加酸、碱、氨水、溴水都是过量的).根据实验结果:(1)判定待测液中有无Ba2+、Ca2+离子,并写出理由.答:.(2)写出沉淀D的分子式:.(3)写出从溶液D生成沉淀E的反应的离子方程式:.六、(本题包括3小题,共12分)34.(4分)(2011秋•下城区校级期末)卤代烃在氢氧化钠存在的条件下水解,这是一个典型的取代反应.其实质是带负电的原子团(例如OH﹣等阴离子)取代了卤代烃中的卤原子.例如:CH3CH2CH2﹣Br+OH﹣(或NaOH)→CH3CH2CH2﹣OH+Br﹣(或NaBr)写出下列反应的化学方程式:(1)溴乙烷跟NaHS反应:.(2)碘甲烷跟CH3COONa反应:.(3)由碘甲烷、无水乙醇和金属钠合成甲乙醚(CH3﹣O﹣CH2CH3):.35.(5分)(2012春•洋县校级月考)A是一种酯,分子式是C14H12O2.A可以由醇B跟羧酸C发生酯化反应得到.A不能使溴(CCl4溶液)褪色.氧化B可得到C.(1)写出A、B、C结构简式:A B C(2)写出B的两种同分异构体的结构简式,它们都可以跟NaOH反应.和.36.(3分)羧酸酯RCOOR′在催化剂存在时可跟醇R″OH发生如下反应(R′,R″是两种不同的烃基):此反应称为酯交换反应,常用于有机合成中.在合成维纶的过程中,有一个步骤是把聚乙酸乙烯酯转化成聚乙烯醇,这一步就是用过量的甲醇进行酯交换反应来实现的.(1)反应中甲醇为什么要过量?.(2)写出聚乙烯醇的结构简式:.(3)写出聚乙酸乙烯酯与甲醇进行酯交换反应的化学方程式:.七、(本题包括2小题,共12分)37.(4分)(2012秋•会泽县校级月考)某温度下22%NaNO3溶液150毫升,加100克水稀释后浓渡变成14%.求原溶液的摩尔浓度.38.(8分)写出H2S燃烧反应的化学方程式.1.0升H2S气体和a升空气混和后点燃,若反应前后气体的温度和压强都相同(20℃,101.3千帕),试讨论当a的取值范围不同时,燃烧后气体的总体积V(用含a的表达式表示.假定空气中氮气和氧气的体积比为4:1,其它成分可忽略不计).1992年全国统一高考化学试卷参考答案与试题解析一、选择题(每小题1分,共5分.每小题只有一个选项符合题意.)1.(1分)(2012秋•金家庄区校级期末)在炼铁、制玻璃、制水泥三种工业生产中,都需要的原料是()2.(1分)(2012秋•郑州校级期末)下列情况可能引起大气污染的是①煤的燃烧;②工业废气的任意排放;③燃放鞭炮;④飞机、汽车尾气的排放()3.(1分)(2006春•平顶山期末)下列分子中,属于含有极性键的非极性分子的是()4.(1分)(2013秋•蒙山县校级期末)下列晶体中,不属于原子晶体的是()5.(1分)(2007•宣威市校级模拟)用pH试纸测定某无色溶液的pH值时,规范的操作是()A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较B.将溶液倒在pH试纸上,跟标准比色卡比较C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较二、选择题(每小题2分,共32分.每小题有一个或两个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,每选对一个给1分,但只要选错一个,该小题就为0分.)6.(2分)在同温同压下1摩氩气和1摩氟气具有相同的()n=7.(2分)用NA表示阿佛加德罗常数.下列说法正确的是()A.1摩钠作为还原剂可提供的电子数为NAB.标准状况(0℃,101.3千帕)下,22.4升氯气中所含的氯原子数为NAC.16克氧气中所含的氧原子数为NA=结合分子组成判断;结合分子的组成判断;结合原子构成判断.8.(2分)(2013秋•金阊区校级期中)最近,科学家研制得一种新的分子,它具有空心的类似足球状结构,分子式为C60.下列说法正确的是()A.C60是一种新型的化合物B.C60和石墨都是碳的同素异形体C.C60中含离子键9.(2分)(2012春•西宁期末)用R代表短周期元素,R原子最外层的p亚层上的未成对电子只有2个.下列关于R的描述中正确的是()A.R的氧化物都能溶于水B.R的最高价氧化物所对应的水化物都是H2RO3C.R的都是非金属元素10.(2分)下列物质容易导电的是()11.(2分)(2013春•绿园区校级期末)在某温度下反应ClF(气)+F2(气)ClF3(气)+268千焦在密闭容器中达到平衡.下列说法正确的是()A.温度不变,缩小体积,ClF的转化率增大B.温度不变,增大体积,ClF3的产率提高C.升高温度,增大体积,有利于平衡向正反应方向移动12.(2分)(2010秋•姜堰市期末)在NO2被水吸收的反应中,发生还原反应和发生氧化反应的物质,其质量比为()13.(2分)(2012春•桃城区校级期末)下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是()A.在氧化﹣还原反应中,甲原子失去的电子比乙原子失去的电子多B.同价态的阳离子,甲比乙的氧化性强C.甲能跟稀盐酸反应放出氢气而乙不能14.(2分)(2011秋•南昌期末)用石墨作电极,电解1摩/升下列物质的溶液,溶液的pH 值保持不变的是()15.(2分)若某溶液跟甲基橙作用呈红色,则下列离子在该溶液中浓度不可能很大的是()2﹣2﹣2﹣﹣16.(2分)等体积混和0.10摩/升盐酸和0.06摩/升Ba(OH)2溶液后,溶液的pH值等于()=17.(2分)(2012秋•荆州区校级期中)某温度下,在体积一定的密闭容器中适量的NH3(气)和Cl2(气)恰好完全反应.若反应产物只有N2(气)和NH4Cl(固),则反应前后容器中压强比应接近于()A.1:11 B.11:1 C.7:11 D.11:718.(2分)(2012春•宁乡县校级月考)能正确表示下列反应的离子方程式是()A.在碳酸氢钙溶液中加入盐酸:HCO3﹣+H+=CO2↑+H2OB.把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑C.向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl﹣2﹣﹣19.(2分)(2012秋•诸暨市校级期中)合成氨反应为:3H2+N22NH3,其反应速率可以分别用νH2、νN2、νNH3(摩/升•秒)表示,则正确的关系式是()A.νH2=νN2=νNH3B.νN2=3νH2 C.νNH3=νH2D.νH2=3νN2ν20.(2分)(2014春•东湖区校级期末)甲、乙两种化合物都只含X、Y两种元素,甲、乙中X元素的百分含量分别为30.4%和25.9%.若已知甲的分子式是XY2,则乙的分子式只可能是()21.(2分)(2012秋•中牟县期末)已知丁基共有四种.不必试写,立即可断定分子式为C5H10O 的醛应有()三、选择题(每小题3分,共18分.每小题只有一个选项符合题意.)22.(3分)设计了四种制备气体的方案:①加热稀硫酸和乙醇制备乙烯;②加热稀盐酸和二氧化锰制备氯气;③用稀硫酸和大理石制备二氧化碳;④用稀硝酸和硫化亚铁制备硫化氢.不宜采用的方案有哪些?()A.只有①和②B.只有②和③C.只有③和④D.①②③④23.(3分)不用其它试剂,限用化学方法区别下列两组内的四瓶溶液:①FeCl3、BaCl2、MgSO4、Al2(SO4)3;②Al2(SO4)3、盐酸、BaCl2、K2CO3()24.(3分)(2007秋•秦皇岛期末)相同温度、相同摩尔浓度的四种溶液:①CH3COONa、②NaHSO4、③NaCl、④按pH值由大到小的顺序排列,正确的是()A.④>①>③>②B.①>④>③>②C.①>②>③>④D.④>③>①④25.(3分)(2012春•巴彦淖尔校级期末)用1升1.0摩/升NaOH溶液吸收0.8摩CO2,所得溶液中的CO32﹣和HCO3﹣的摩尔浓度之比约是()26.(3分)(2014秋•泉州校级期中)在一定条件下,CO和CH4燃烧的热化学方程式分别为:2CO(气)+O2(气)=2CO2(气)+566千焦CH4(气)+2O2(气)=CO2(气)+2H2O(液)+890千焦由1摩CO和3摩CH4组成的混和气在上述条件下完全燃烧时,释放的热量为()27.(3分)(2012春•内蒙古校级期末)在一定体积的容器中,加入1.5摩氙气和7.5摩氟气,于400℃和2633千帕压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5摩氟气.则所得无色晶体产物中,氙与氟的原子个数比是()四、(本题包括2小题,共11分)28.(2分)Cu+在酸性溶液中不稳定,可发生自身氧化﹣还原反应生成Cu2+和Cu.现有浓硫酸、浓硝酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,而没有其它试剂.简述如何用最简便的实验方法来检验CuO经氢气还原所得到的红色产物中是否含有碱性氧化物Cu2O.29.(9分)(2015春•滨州校级期末)将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现.这是因为通气后混和液中产生的ClO﹣被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出.进行此实验,所用的仪器及导管如图.根据要求填写下列空白:(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是③②⑤.(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是②⑤⑥④①.(3)仪器①的橡皮塞上应有2个孔,原因是使瓶内外压强相等.(4)实验时,仪器①中除观察到红光外还有冒气泡现象.(5)实验需用约10%H2O2溶液100毫升,现用市售30%(密度近似为1克/厘米3)H2O2来配制,其具体配制方法是用量筒量取33毫升30%H2O2溶液加入烧杯中,再加入67毫升水,搅拌均匀.(6)实验时仪器①中ClO﹣与H2O2反应的离子方程式是ClO﹣+H2O2=Cl﹣+O2↑+H2O.五、(本题包括4小题,共10分)30.(2分)配平下列化学方程式:31.(2分)气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键的关系如下图所示.请将图中,你认为是配位键的斜线上加上箭头.32.(2分)在金刚石的网状结构中,含有由共价键形成的碳原子环,其中最小的环上有6(填数字)个碳原子,每个碳原子上的任意两个C﹣C键的夹角都是109°28′(填角度).33.(4分)(2010春•东昌府区校级月考)某待测液中可能含有Fe 2+、Fe 3+、Ag +、Al 3+、Ba 2+、Ca 2+、NH 4+等离子,进行如下实验(所加酸、碱、氨水、溴水都是过量的).根据实验结果:(1)判定待测液中有无Ba 2+、Ca 2+离子,并写出理由.答: 含有Ba 2+、Ca 2+离子中的一种或两种,因为BaSO 4不溶于水,CaSO 4微溶于水 .(2)写出沉淀D 的分子式: Fe (OH )3 .(3)写出从溶液D 生成沉淀E 的反应的离子方程式: CO 2+3H 2O+2AlO 2﹣═2Al (OH )3↓+CO 32﹣或CO 2+2H 2O+AlO 2﹣═Al (OH )3↓+HCO 3 .六、(本题包括3小题,共12分)34.(4分)(2011秋•下城区校级期末)卤代烃在氢氧化钠存在的条件下水解,这是一个典型的取代反应.其实质是带负电的原子团(例如OH﹣等阴离子)取代了卤代烃中的卤原子.例如:CH3CH2CH2﹣Br+OH﹣(或NaOH)→CH3CH2CH2﹣OH+Br﹣(或NaBr)写出下列反应的化学方程式:(1)溴乙烷跟NaHS反应:C2H5Br+NaHS→C2H5SH+NaBr.(2)碘甲烷跟CH3COONa反应:CH3I+CH3COONa→CH3COOCH3+NaI.(3)由碘甲烷、无水乙醇和金属钠合成甲乙醚(CH3﹣O﹣CH2CH3):2C2H5OH+2Na→2C2H5ONa+H2↑,C2H5ONa+CH3I→CH3﹣O﹣C2H5+NaI.35.(5分)(2012春•洋县校级月考)A是一种酯,分子式是C14H12O2.A可以由醇B跟羧酸C发生酯化反应得到.A不能使溴(CCl4溶液)褪色.氧化B可得到C.(1)写出A、B、C结构简式:A B C(2)写出B的两种同分异构体的结构简式,它们都可以跟NaOH反应.和.,不饱和度为=9的结构简式为结构简式为的结构简式为故答案为:,)苯甲醇的同分异构体中,、、故答案为:、36.(3分)羧酸酯RCOOR′在催化剂存在时可跟醇R″OH发生如下反应(R′,R″是两种不同的烃基):此反应称为酯交换反应,常用于有机合成中.在合成维纶的过程中,有一个步骤是把聚乙酸乙烯酯转化成聚乙烯醇,这一步就是用过量的甲醇进行酯交换反应来实现的.(1)反应中甲醇为什么要过量?使平衡向右移动,酯交换反应完全.(2)写出聚乙烯醇的结构简式:.(3)写出聚乙酸乙烯酯与甲醇进行酯交换反应的化学方程式:.的加聚反应产物,结构简式为故答案为:故答案为:七、(本题包括2小题,共12分)37.(4分)(2012秋•会泽县校级月考)某温度下22%NaNO3溶液150毫升,加100克水稀释后浓渡变成14%.求原溶液的摩尔浓度.==3.0mol38.(8分)写出H2S燃烧反应的化学方程式.1.0升H2S气体和a升空气混和后点燃,若反应前后气体的温度和压强都相同(20℃,101.3千帕),试讨论当a的取值范围不同时,燃烧后气体的总体积V(用含a的表达式表示.假定空气中氮气和氧气的体积比为4:1,其它成分可忽略不计).22S+2H22SO22S+2H22SO等于﹣=1+22S+2H 2V=1+(升)。
上海高考化学真题──电化学
上海高考化学真题──电化学1992─17、有a、b、c、d四种金属,将a和b用导线连接起来,浸入电解质溶液中,b 不易腐蚀。
将a、d分别投入等浓度盐酸中,d比a反应剧烈。
将铜浸入b的盐溶液中,无明显变化。
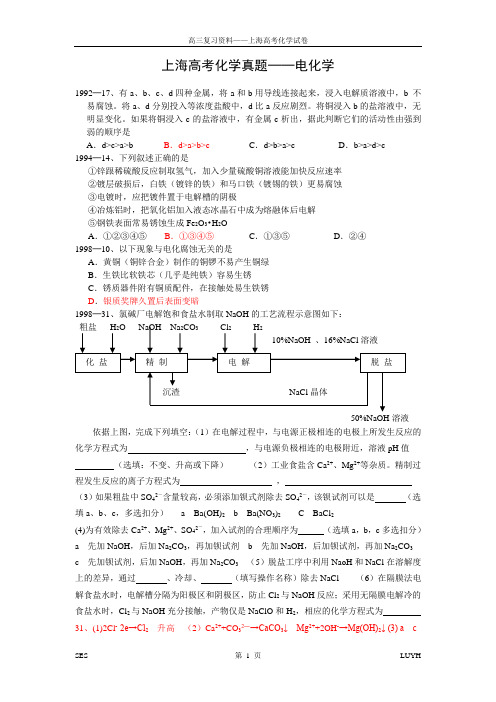
如果将铜浸入c的盐溶液中,有金属c析出,据此判断它们的活动性由强到弱的顺序是A.d>c>a>b B.d>a>b>c C.d>b>a>c D.b>a>d>c1994─14、下列叙述正确的是①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率②镀层破损后,白铁(镀锌的铁)和马口铁(镀锡的铁)更易腐蚀③电镀时,应把镀件置于电解槽的阴极④冶炼铝时,把氧化铝加入液态冰晶石中成为熔融体后电解⑤钢铁表面常易锈蚀生成Fe2O3•H2OA.①②③④⑤B.①③④⑤C.①③⑤D.②④1998─10、以下现象与电化腐蚀无关的是A.黄铜(铜锌合金)制作的铜锣不易产生铜绿B.生铁比软铁芯(几乎是纯铁)容易生锈C.锈质器件附有铜质配件,在接触处易生铁锈D.银质奖牌久置后表面变暗1998─31、氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:50%NaOH溶液依据上图,完成下列填空:(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为,与电源负极相连的电极附近,溶液pH值(选填:不变、升高或下降)(2)工业食盐含Ca2+、Mg2+等杂质。
精制过程发生反应的离子方程式为,(3)如果粗盐中SO42―含量较高,必须添加钡式剂除去SO42―,该钡试剂可以是(选填a、b、c,多选扣分) a Ba(OH)2 b Ba(NO3)2 C BaCl2(4)为有效除去Ca2+、Mg2+、SO42―,加入试剂的合理顺序为(选填a,b,c多选扣分)a 先加NaOH,后加Na2CO3,再加钡试剂b 先加NaOH,后加钡试剂,再加Na2CO3c 先加钡试剂,后加NaOH,再加Na2CO3(5)脱盐工序中利用NaoH和NaCl在溶解度上的差异,通过、冷却、(填写操作名称)除去NaCl (6)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为31、(1)2Cl--2e→Cl2升高(2)Ca2++CO32―→CaCO3↓ Mg2++2OH-→Mg(OH)2↓ (3) a c(4)b c (5) 蒸发 过滤 (6) NaCl+H 2O −−→−电解H 2↑+Cl 2↑+2NaOH2000─8、随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是A .利用电池外壳的金属材料B .防止电池中汞、镉和铅等重金属离子对土壤和水源的污染C .不使电池中渗泄的电解液腐蚀其他物品D .回收其中石墨电极2002─16、某学生想制作一种家用环保型消毒液发生器,用石墨作电极 电解饱和氯化钠溶液,通电时,为使Cl 2被完全吸收,制得有较强杀菌能力的消毒液,设计了如图的装置,则对电源电极名称和消毒液的主要成分判断正确的是A .a 为正极,b 为负极;NaClO 和NaClB .a 为负极,b 为正极;NaClO 和NaClC .a 为阳极,b 为阴极;HClO 和NaClD .a 为阴极,b 为阳极;HClO 和NaCl2003─16、右图是电解CuCl2溶液的装置,其中c 、d 为石墨电极。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1992年全国普通高等学校招生统一考试上海化学试题第1卷(共55分)一、选择题(本题共40 分,每题只有一个正确选项)1、下列物质的俗名与分子式不相符合的是 A 电石CaC2 B 冰晶石Na3AlF6C 萤石MgF2D 石灰石CaCO32、下列仪器:①集气瓶②量筒③烧杯④表面皿⑤蒸发皿⑥容量瓶⑦烧瓶,能用酒精灯加热的是 A ②③⑤ B ③⑥⑦ C ①③④ D ③⑤⑦3、下列变化属于物理变化的是A 氧气在放电条件下变成臭氧B 加热胆矾成白色无水硫酸铜C 漂白的草帽久置与空气中变黄D 氢氧化铁胶体加入硫酸镁产生沉淀4、关于同温同压下等体积的CO2和CO的叙述:①质量相等②密度相等③所含分子个数相等④所含碳原子个数相等。
其中正确的是A ①②③④B ②③④C ③④D ③5、下列各组气体中,既可以用浓硫酸又可用碱石灰干燥的是A CO、H2、CH4B H2、O2、Cl2C CO、O2、H2SD SO2、NH3、CH46、核内中子数为N的R2+的离子,质量数为A,则n克它的氧化物中所含质子的物质的量为 A n(A-N+8)/(A+16) B n(A-N+10)/(A+16)C (A-N+2)D n(A-N+6)/A7、对某弱酸稀溶液加热时,下列叙述错误的是A 弱酸的电离度增大B 弱酸分子的浓度减少C 溶液的[OH-增大D 溶液的导电性增强8、下列性质中,可以证明某化合物内一定存在离子键的是A 可溶于水B 具有较高的熔点C 水溶液能导电D 熔融状态能导电9、下列叙述正确的是 A P4和NO2都是共价化合物B CCl4和NH3都是以极性键结合的极性分子C 在CaO和SiO2晶体中,都不存在单个小分子D 甲烷的分子是对称的平面结构,所以是非极性分子10、a元素的阴离子;b元素的阴离子和c元素的阳离子具有相同的电子层结构。
已知a的原子序数大于b的原子序数。
则a、b、c三种离子半径大小的顺序是A a>b>cB b>a>cC c>a>bD c>b>a11、过氧化氢的沸点比水高,但受热容易分解。
某试剂厂先制得7-8%得过氧化氢溶液,再浓缩成30%得溶液时,可采用适宜的方法是A 常压蒸馏B 减压蒸馏C 加生石灰常压蒸馏D 加压蒸馏12、乙酸蒸气能形成二聚分子:2CH3COOH(气)==(CH3COOH)2(气)+Q。
现欲测定乙酸的分子量,应采用的条件为A 高温低压B 低温高压C 低温低压D 高温高压13、某氮的氧化物和CO在催化剂的作用下充分反应,生成氮气和CO2。
若测得N2和CO2的物质的量之比为1:2,则该氮的氧化物是A N2OB NOC NO2D N2O514、在下列离子方程式中正确的是A 醋酸和小苏打溶液反应:H++HCO-3=CO2↑+H2OB 硫氢化钠的水解:HS-+H2O==H3O++S2-C 铁与三氯化铁溶液反应:Fe+Fe3+=2Fe2+D 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑15、下列各组离子中,能PH=1 的溶液中大量共存的是A MnO-4、K+、Na+、SO2-4B K+、Na+、AlO2-、Cl-C Cl-、NH+4、Mg2+、NO3-D Ba2+、K+、S2-、SO2-416、下列反应中属于非氧化还原反应的是A 3CuS+8HNO3=3Cu(NO3)2+2NO↑+3S↓+4H2OB 3Cl2+6KOH=5KCl+KClO3+3 H2OC 3H2O2 +2KcrO2+2KOH =2 K2CrO4+4 H2OD 3CCl4+K2Cr2O7=2 CrO2Cl2+3COCl2+2KCl17、有a、b、c、d四种金属,将a和b用导线连接起来,浸入电解质溶液中,b 不易腐蚀。
将a、d分别投入等浓度盐酸中,d比a反应剧烈。
将铜浸入b的盐溶液中,无明显变化。
如果将铜浸入c的盐溶液中,有金属c析出,据此判断它们的活动性由强到弱的顺序是 A d>c>a>b B d>a>b>c C d>b>a>c D b>a>d>c18、在氧化还原反应3S+6KOH=K2SO3+2K2S+3H2O中,被氧化和被还原的硫原子数之比为A 1:2 B 2:1 C 1:1 D 3:219、下列各组物质中:①Cl2O7HClO ②SO2H2SO4③NO2HNO3④SiO2H2SiO3⑤Mn2O7HMnO4,前者是后者的酸酐,正确的是A ②③B ③④C ④⑤D ①③④20、将体积都为10L、PH值都为3 的醋酸和盐酸,加水稀释至a毫升和b毫升,测得稀释后溶液的PH值均为5,则稀释后溶液的体积A a=b=100mlB a=b=1000mlC a<bD a>b二、选择题(本题共15分,每题只有一个正确选项)21、在氢硫酸溶液中加入少量下列溶液:①O2②Cl2③SO2④CuSO4,能使溶液PH值减小的是A ①③ B ②④ C ②③④ D ①22、下列叙述正确的是 A 久置于空气中的NaOH溶液,加盐酸时有气体产生B 50ml 12mol/l的浓盐酸与足量的二氧化锰反应,都生成氯气0.15molC 在常温下,浓硫酸不与铜反应,是因为铜被钝化D 少量CO2通入浓的氯化钙溶液中有白色沉淀生成24、右图为装有活塞的密闭容器,内盛22.4ml的一氧化氮,若通入11.2L氧气(气体体积均在标准状况下测定)保持温度和压强不变,则容器内的密度 A 等于1.369克/升 B 等于2.054克/升D 在1.369克/升和2.054克/升之间 D 大于2.054克/升NO25、在甲、乙、丙、丁四个烧杯内分别放入0.1mol的钠、氧化钠、过氧化钠和氢氧化钠,然后各加入100ml水,搅拌,使固体完全溶解。
则甲、乙、丙、丁溶液的质量百分比浓度大小的顺序是 A 甲<乙<丙<丁B丁<甲<乙=丙C 甲=丁<乙=丙D 丁<甲<乙<丙三、选择题(15分,每题有一个或两个正确选项)26、以下气体因与人体血液中的血红蛋白作用而引起中毒的是A NOB COC NH3D HClE Cl227、某单质能与浓硝酸反应,若参加反应的单质与硝酸的物质的量之比为1:4,则该元素在反应中所显示的花盒价可能是 A +1 B +2 C +3 D +4 E +528、把质量为m克的铜铜灼烧变黑,立即放入下列物质中,能使铜丝变红,且质量还是m克的是 A 稀硫酸 B C2H5OH C 稀硝酸 D CH3COOH E CO29、将20毫升NO2和NH3的混合气体,在一定条件下充分反应,化学方程式是6NO2+8NH3=7N2+12H2O,已知参加反应的NO2比NH3少2毫升(气体均在相同条件下测定),则原混合气体中NO2和NH3的物质的量之比为A3:2 B 2:3 C 3:7 D 3:4 E 92:5130、燃烧下列混合气体,所产生的CO2 的量一定小于燃烧相同质量的丙稀所产生的CO2的是 A 丁烯、丙稀 B 乙炔、乙烯 C 乙炔、丙烷 D 乙烯、丙炔 E 乙炔、环丙烷四、(本题共18分)31、0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5千焦热量,其热化学方程式是,又已知:H2O(液)=H2O(气)-44千焦,则11.2升(标准状况)乙硼烷完全燃烧时生成气态水时放出的热量为千焦。
32、配平下列氧化还原反应的化学方程式:()Fe(OH)3+()NaOH+()Cl2=()Na2FeO4+()NaCl+()H2O电子转移的总数为33、A、B、C、D四种短周期元素的原子序数依次递增。
A、D同族,B、C同周期.A、B组成的化合物甲为气体,其中A、B原子数之比为4:1 ,由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子数之比为1:1,丙中为2:1,由D、C组成的两种化合物丁和戊都为固态,丁中D、C原子数之比为1:1,戊中为2:1。
写出分子式甲乙丙丁戊写出B元素的最高价氧化物跟丁反应的化学方程式34、(1)CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在氯化铜的水溶液中存在如下平衡:【Cu(H2O)4】2++4Cl-=【Cu(Cl)4】2-+4H2O,现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采取的方法:①②(2)在2SO2+O2==2SO3的平衡体系中,加入18O构成的氧气,当平衡发生移动后,SO2中18O的百分含量(填增加、减少、不变)其原因是五、(本题共24分)以六水合氯化镁为原料制备无水氯化镁。
已知:MgCl2。
6H2O晶体在空气中加热时,释出部分结晶水,同时生成Mg(OH)Cl或MgO,在干燥HCl的气流中加热能制得无水氯化镁。
可选用的药品有:MgCl2。
6H2O晶体,NaCl(固体),KClO3(固体),MnO2,浓硫酸,浓HCl,稀NaOH溶液。
仪器见下图(装置可重复使用)回答下列问题:(1)组装氯化氢气体发生应选用的仪器是(用A、B、C等填入)有关的化学反应式是(2)按HCl气流方向,其余装置的连接顺序是(用1、2、3、等表示)(3)各装置中放的药品是A B C D E( 4)B装置的作用是,B中能观察到的现象是36、由短周期元素构成的常见离子,它们组成A、B、C、D四种物质,分别溶于水,已知:(1)A、C的焰色反应为黄色(2)取A、B溶液,分别加入BaCl2溶液,均生成白色沉淀,再加入稀硝酸,A中白色沉淀溶解,并产生能使澄清石灰水变浑浊的无色无臭的气体,而B中无变化。
(3)在D的稀溶液中加入AgNO3溶液和稀硝酸,有白色沉淀生成。
(4)在D溶液中滴加C溶液,生成白色沉淀,继续滴加C,白色沉淀消失。
(5)A、B、C溶液的物质的量浓度相等,当A、B溶液以体积比1:2混合时,生成无色气体,B、C溶液以1:2体积比混合时也生成无色气体,此气体能使湿润的红色石蕊试纸变蓝。
如果均以1:1混合,两者都不生成气体。
写出分子式:A B C D写出D溶液中不断滴入C溶液所发生反应的离子方程式。
六、(本题共20分)37、以下第(1)、(2)小题可以有一个或两个选项,用编号填入空格。
(1)市场即将禁用的卫生球(俗称樟脑丸),它的主要成分属,来源于A醇类 B 脂肪烃类 C 芳香族类 D 酯类 E 石油 F 煤G 天然气(2)下列有机物:A 1-丙醇 B 丙烯 C 苯酚,能发生消去反应的是能发生加成反应的是,在空气中容易被氧化的是。
(3)1 体积某烃的蒸气燃烧生成的CO2比水蒸气少1体积(在相同状况下测定),0.1mol 摩该烃燃烧,其燃烧产物全部被碱石灰吸收,碱石灰增重39克,该烃的分子式为若它的一氯取代物有三种,则该烃可能的结构简式为38、水蒸气跟灼热的焦炭反应,生成A和P的混合气体,它是合成多种有机物的原料气。
