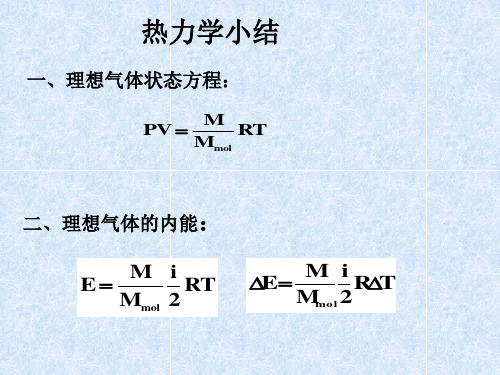
大学物理热力学总习题课共31页文档
热力学习题课超经典 共24页PPT资料
1、求Ta、Tb、Tc。 2、求气体在ab和bc 过程中吸收的热量, 气体内能的变化各如 何? 3、气体在abc过程中 最高温度如何?
P(105Pa)
1.5 b
1a
0.5
c
0 1 2 3 V(10-3m3)
P(105Pa)
1.5 b
1、由 PV M RT 1 a
Mmol
0.5
求出求Ta、Tb、Tc。 0 1
T
Skn (玻氏熵公式)
热力学第二定律的实质:一切与热现象有 关的实际宏观过程都是不可逆的。
无摩擦的准静态过程才是可逆的
熵增加原理:孤立系统内部所发生的过程 总是向着状态几率增大的方向进行
= 可逆过程
孤立系统 dS0 > 不可逆过程
例:0.1mol的单原子理想气体,经历一准 静态过程abc,ab、bc均为直线。
(A) (1)过程中吸热,(2) 过程中放热.
√(B) (1)过程中放热,(2) 过程p中吸热.
(C) 两种过程中都吸热. (D) 两种过程中都放热.
a
(2)
分析: 作一循环a(1)ba, 这是逆循环.
(1)
b
W<0, △E=0, Q<0,
O
V
(1)过程中放热;
同理可得(2) 过程中吸热。
练习13 第四题 容积为10L的盒子以速度 v=200m/s匀速运动,容器中充有质量为50g 温度为18C的氢气,设盒子突然停止,气体 的全部定向运动动能都变为气体分子热运动 动能,容器与外界没有热交换,则达到热平 衡后,氢气的温度将增加——K;氢气的压强将 增加 —— Pa
c
2 3 V(10-3m3)
2、a
b,
M QabMmoC lV(TbTa) E
大学物理-热学习题课(ppt模板)

(二)热力学 1、功、热量、内能 W PdV (过程量)
Q Mc T2 T1 (过程量) M E T CVm T2 T1 (状态量)
2、热力学第一定律及其应用 等值过程 Q, E 和 W 的计算 见附表
附表:
Q
等温 过程 等压 过程 等体 过程
V2 M RT ln V1 M CP,m T M CV ,m T
(2)从状态B到达状态C,气体的熵变为 TC dQ TC C pdT TC 5 R 9 SBC C p ln ln TB T TB T TB 2 2
2.5 8.31 1.504 31.25 J K
1
得 T 274.37K
熵变:0C 冰
0C 水
dQ 1 S1 dQ T T 1 1 m2 L 12.23J K T 0C 的水 274.37 K 的水 m2 c2 dT dQ S 2 T T T 1 m2 c 2 ln 0.21J K T1
T2 卡诺逆循环 T1 T2
Q1
Q1
4、热力学第二定律的两种表述
克劳修斯 “热量不能自动的 从低温物体传向高温物体” 开尔文 “其唯一效果是热全部转 变为功的过程是不可能的” 5、可逆过程和不可逆过程 ★6、熵的计算与熵增加原理
dQ S 2 S1 T 可逆
三、计算 1、孤立系统中 m1 0.5kg, T1 276K
的水,和 m2 0.01kg, T2 273K 的冰 混合后冰全部融化 求(1)达到平衡时的温度 3 1 (2)系统的熵变( L 334 10 J kg ) 解:平衡时温度为 T
m1c1 T1 T m2 L m2 c2 T T2
(完整word版)大学物理学热力学基础练习题

大学物理学》热力学基础、选择题A)b1a 过程放热、作负功,B)b1a 过程吸热、作负功,C)b1a过程吸热、作正功,D)b1a 过程放热、作正功,【提示:体积压缩,气体作负功;三个过程中a 和b 两点之间的内能变化相同,bca 线是绝热过程,既不吸热也不放热,b1a过程作的负功比b2a过程作的负功多,由Q W E知b2a过程放热,b1a过程吸热】13-2.如图,一定量的理想气体,由平衡态A 变到平衡态B,且他们的压强相等,即P A P B。
问在状态A 和状态B 之间,气体无论经过的是什么过程,气体必然(A )对外作正功;(B )内能增加;(C)从外界吸热;(D )向外界放热。
【提示:由于TA T B,必有EA E B;而功、热量是过程量,与过程有关】13-3.两个相同的刚性容器,一个盛有氢气,一个盛氦气(均视为刚性理想气体),开始时它们的压强和温度都相同,现将3 J 的热量传给氦气,使之升高到一定的温度,若氢气也升高到同样的温度,则应向氢气传递热量为()A)6J ;(B)3J;(C)5J;(D)10J 。
13-4.有人想象了如图所示的四个理想气体的循环过程,则在理论上可以实现的是13-1 .如图所示,bca 为理想气体的绝热过程,b1a 和b2a 是任意过程,则上述两过程中气体做功与吸收热量的情况是()b2a 过程放热、作负功;b2a 过程放热、作负b2a 过程吸热、作负功;b2a 过程吸热、作提示:等体过程不做功,有Q E ,而EMMmolR T,所以需传5 J 】2【提示: (A ) 绝热线应该比等温线陡,( B )和( C )两条绝热线不能相交】13-5.一台工作于温度分别为 327℃和 27℃的高温热源与低温热源之间的卡诺热机,一个循环吸热 2000J ,则对外做功( )( A ) 2000 J ; (B ) 1000 J ;(C ) 4000 J ;(D ) 500 J 。
【卡诺热机的效率为 1T 2,W,可求得 1300 50% ,则W Q 1000J 】T 1Q60013-6.根据热力学第二定律()A )自然界中的一切自发过程都是不可逆的;B )不可逆过程就是不能向相反方向进行的过程;C )热量可以从高温物体传到低温物体,但不能从低温物体传到高温物体;D )任何过程总是沿熵增加的方向进行。
大学物理热学习题课

dN m 32 4 ( ) e Ndv 2kT
v2
对于刚性分子自由度 单原子 双原子 多原子
i tr
(1)最概然速率
2kT 2 RT RT vp 1.41 m
(2)平均速率
i=t=3 i = t+r = 3+2 = 5 i = t+r = 3+3 =6
6、能均分定理
8kT 8 RT RT v 1.60 m
M V RT ln 2 M mol V1
QA
绝热过程
PV 常量
M E CV T M mol
(2)由两条等温线和两条绝热线 组成的循环叫做 卡诺循环。 •卡诺热机的效率
Q0
Q2 T2 卡诺 1 1 Q1 T1
M P1V1 P2V2 A CV T M mol 1
E 0
•热机效率
A Q1 Q2
M E CV T M mol M Q C P T M mol
A Q1 Q2 Q2 1 Q1 Q1 Q1
A=P(V2-V1) 等温过程
A
E 0
Q1 Q2 •致冷系数 e W Q1 Q2
热机效率总是小于1的, 而致冷系数e可以大于1。
定压摩尔热容
比热容比
CP ( dQ )P dT i2 i
8、平均碰撞次数 平均自由程
z
2d v n
2
CV •对于理想气体:
Cp
v z
1.热力学第一定律
1 2 2d n
二、热 力 学 基 础
Q ( E2 E1 ) A dQ dE dA
准静态过程的情况下
4. 摩尔数相同的两种理想气体 一种是氦气,一种是氢气,都从 相同的初态开始经等压膨胀为原 来体积的2倍,则两种气体( A ) (A) 对外做功相同,吸收的热量 不同. (B) 对外做功不同,吸收的热量 相同. (C) 对外做功和吸收的热量都不 同. (D) 对外做功和吸收的热量都相 同. A=P(V2-V1)
大学物理化学1-热力学第一定律课后习题及答案

热力学第一定律课后习题一、是非题下列各题中的叙述是否正确?正确的在题后括号内画“√”,错误的画“⨯”。
1.在定温定压下,CO2由饱和液体转变为饱和蒸气,因温度不变,CO2的热力学能和焓也不变。
( )2. d U = nC V,m d T这个公式对一定量的理想气体的任何pVT过程均适用。
( )3. 一个系统从始态到终态,只有进行可逆过程才有熵变。
( )4. 25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。
( )5. 稳定态单质的∆f H(800 K) = 0。
( )二、选择题选择正确答案的编号,填在各题后的括号内:1. 理想气体定温自由膨胀过程为:()。
(A)Q > 0;(B)∆U < 0;(C)W <0;(D)∆H = 0。
2. 对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定的值的是:( )。
( A ) Q;( B ) Q+W;(C ) W( Q = 0 );( D ) Q( W = 0 )。
3. pVγ = 常数(γ = C p,m/C V,m)适用的条件是:( )(A)绝热过程;( B)理想气体绝热过程;( C )理想气体绝热可逆过程;(D)绝热可逆过程。
4. 在隔离系统内:( )。
( A ) 热力学能守恒,焓守恒;( B ) 热力学能不一定守恒,焓守恒;(C ) 热力学能守恒,焓不一定守恒;( D) 热力学能、焓均不一定守恒。
5. 从同一始态出发,理想气体经可逆与不可逆两种绝热过程:( )。
( A )可以到达同一终态;( B )不可能到达同一终态;( C )可以到达同一终态,但给环境留下不同影响。
6. 当理想气体反抗一定的压力作绝热膨胀时,则:( )。
( A )焓总是不变;(B )热力学能总是增加;( C )焓总是增加;(D )热力学能总是减少。
7. 已知反应H2(g) +12O2(g) ==== H2O(g)的标准摩尔反应焓为∆r H(T),下列说法中不正确的是:()。
《大学物理》热力学基础练习题及答案解析

《大学物理》热力学基础练习题及答案解析一、简答题:1、什么是准静态过程?答案:一热力学系统开始时处于某一平衡态,经过一系列状态变化后到达另一平衡态,若中间过程进行是无限缓慢的,每一个中间态都可近似看作是平衡态,那么系统的这个状态变化的过程称为准静态过程。
2、从增加内能来说,做功和热传递是等效的。
但又如何理解它们在本质上的差别呢?答:做功是机械能转换为热能,热传递是热能的传递而不是不同能量的转换。
3、一系统能否吸收热量,仅使其内能变化? 一系统能否吸收热量,而不使其内能变化?答:可以吸热仅使其内能变化,只要不对外做功。
比如加热固体,吸收的热量全部转换为内能升高温度;不能吸热使内能不变,否则违反了热力学第二定律。
4、有人认为:“在任意的绝热过程中,只要系统与外界之间没有热量传递,系统的温度就不会改变。
”此说法对吗? 为什么?答:不对。
对外做功,则内能减少,温度降低。
5、分别在Vp-图、Tp-图上,画出等体、等压、等温和绝热过程的曲线。
V-图和T6、 比较摩尔定体热容和摩尔定压热容的异同。
答案:相同点:都表示1摩尔气体温度升高1摄氏度时气体所吸收的热量。
不同点:摩尔定体热容是1摩尔气体,在体积不变的过程中,温度升高1摄氏度时气体所吸收的热量。
摩尔定压热容是1摩尔气体,在压强不变的过程中,温度升高1摄氏度时气体所吸收的热量。
两者之间的关系为R C C v p +=7、什么是可逆过程与不可逆过程答案:可逆过程:在系统状态变化过程中,如果逆过程能重复正过程的每一状态,而且不引起其它变化;不可逆过程:在系统状态变化过程中,如果逆过程能不重复正过程的每一状态,或者重复正过程时必然引起其它变化。
8、简述热力学第二定律的两种表述。
答案:开尔文表述:不可能制成一种循环工作的热机,它只从单一热源吸收热量,并使其全部变为有用功而不引起其他变化。
克劳修斯表述:热量不可能自动地由低温物体传向高温物体而不引起其他变化。
9、什么是第一类永动机与第二类永动机?答案:违背热力学第一定律(即能量转化与守恒定律)的叫第一类永动机,不违背热力学第一定律但违背热力学第二定律的叫第二类永动机。
大学物理第五版-热力学习题课

RT VP 1.41 M mol
物理意义:表示分布在VP附近小区 间内的分子数最多。
4
(2)算术平均速率:分子速率的算术平均值。
ò¥
V = vf (v)dv = 1.6
RT
用于计算分子间的距离
0
M mol
(3)方均根速率:分子速率平方平均值的平方根。
v 2 v 2 f vdv
0
v2
v2 f vdv 1.73
请看例题
15
练习. 一定质量的理想气体,进行如图所示的循环过程
已知气体在状态A的温度为 300K,求:
(1)气体在状态B、C的温度
(2)各过程气体对外作的功
(3)经过整个循环过程,气体 从外界吸收的总热量
解:由图知 PA 300Pa ; PB Pc 100Pa ;
VB 3m3
VA Vc 1m3
(约80亿次)
12
第13章 提要
1、热力学第一定律及其应用 (1)准静态过程的功
V2
W = ò PdV V1
(2)热力学第一定律 Q = D E + W 微变过程 dQ = dE + dW 迈耶公式 CP,m = CV ,m + R
13
2、循环过程和卡诺循环
(1) 循环过程的特点 E 0
热机效率h =
dN N
4
m
2 KT
3
2
mv2
e 2KT
v2dv
f
v dV
3
f v : 麦克斯韦速率分布函数
dN f v NdV 速率在v~v+dv区间内的分子数
v2
f vdv
dN
速率在v1~v2区间内的分子数占分子
大学物理习题解答第三章热力学

第三章热力学本章提要1.准静态过程系统连续经过得每个中间态都无限接近平衡态得一种理想过程。
准静态过程可以用状态图上得曲线表示。
2.内能系统内所有分子热运动动能与分子之间相互作用势能得与,其数学关系式为内能就是态函数。
3.功功就是过程量。
微分形式:积分形式:4.热量两个物体之间或物体内各部分之间由于温度不同而交换得热运动能量。
热量也就是过程量。
5.热力学第一定律热力学第一定律得数学表达式:热力学第一定律得微分表达式:由热力学第一定律可知,第一类永动机就是不可能造成得。
6.理想气体得热功转换(1)等体过程:热量增量为或(2)等压过程:热量增量为因则(3)等温过程:热量增量为因则(4)绝热过程:根据热力学第一定路可得则或在绝热过程中理想气体得p、V、T三个状态参量之间满足如下关系:7.热容量等体摩尔热容量:等压摩尔热容量:对于理想气体,若分子自由度为i,则迈耶公式:比热容比:8.焓在等压过程中,由热力学第一定律可得由于,上式可写为如果令焓就是一个态函数。
9.循环过程正循环得热机效率逆循环得致冷系数10.卡诺循环由两个等温过程与两个绝热过程构成得循环。
正循环得效率逆循环得效率11.热力学第二定律开尔文表述:不可能制成一种循环动作得热机,只从单一热源吸收热量,使之全部转变为有用得功,而其她物体不发生任何变化。
克劳修斯表述:热量不可能自动地从低温物体传向高温物体,而不引起其她得变化。
统计意义:一个不受外界影响得孤立系统,其内部所发生得过程总就是由热力学概率小得宏观状态向热力学概率大得宏观状态进行,即从有序向无序得状态发展。
12.克劳修斯熵克劳修斯熵表达式熵增加原理:在孤立系统内,当热力学系统从一个平衡态到达另一个平衡态时,它得熵永远不减少。
如果过程不可逆,系统得熵增加;如果过程可逆,系统得熵不变。
13.玻耳兹曼熵玻耳兹曼熵表达式熵得微观本质:熵得多少就是系统微观状态数目多寡得标志。
思考题3-1 (1)热平衡态与热平衡有何不同?(2)热平衡与力学中得平衡有何不同?答:(1)一个孤立系统得各种宏观性质(如温度、压强、密度等)在长时间内不发生任何变化,这样得状态称为热平衡态。
大学物理化学1-热力学第一定律课后习题及答案

热力学第一定律课后习题一、是非题下列各题中的叙述是否正确正确的在题后括号内画“”,错误的画“”。
1.在定温定压下,CO因温度不变,2由饱和液体转变为饱和蒸气,CO2的热力学能和焓也不变。
( )2. d U = nC V,m d T这个公式对一定量的理想气体的任何pVT过程均适用。
( )3. 一个系统从始态到终态,只有进行可逆过程才有熵变。
( )4. 25℃时H2(g)的标准摩尔燃烧焓等于25℃时H2O(g)的标准摩尔生成焓。
( )5. 稳定态单质的f H(800 K) = 0。
( )二、选择题选择正确答案的编号,填在各题后的括号内:1. 理想气体定温自由膨胀过程为:()。
(A)Q > 0;(B)U < 0;(C)W < 0;(D)H = 0。
2. 对封闭系统来说,当过程的始态和终态确定后,下列各项中没有确定的值的是:( )。
( A ) Q; ( B ) Q+W; (C ) W( Q= 0 );( D ) Q( W = 0 )。
3. pV = 常数( = C p,m/C V,m)适用的条件是:( )(A)绝热过程; ( B)理想气体绝热过程;( C )理想气体绝热可逆过程; (D)绝热可逆过程。
4. 在隔离系统内:( )。
( A ) 热力学能守恒,焓守恒; ( B ) 热力学能不一定守恒,焓守恒;(C ) 热力学能守恒,焓不一定守恒; ( D) 热力学能、焓均不一定守恒。
5. 从同一始态出发,理想气体经可逆与不可逆两种绝热过程:( )。
( A )可以到达同一终态;( B )不可能到达同一终态;( C )可以到达同一终态,但给环境留下不同影响。
6. 当理想气体反抗一定的压力作绝热膨胀时,则:( )。
( A )焓总是不变; (B )热力学能总是增加; ( C )焓总是增加; (D )热力学能总是减少。
7. 已知反应H2(g) +1O2(g) ==== H2O(g)的标准摩尔反应焓为2T),下列说法中不正确的是:()。
大学物理 热学习题课

1
Va 1 Tb ( ) Ta 424 K Vb
VcTb Tc 848 K Vb
1
c
bc为等压过程,据等压过程方程 Tb / Vb = Tc / Vc 得
O
d a Vb Vc Va V
cd为绝热过程,据绝热过程方程
TcVc
TdVd , (Vd Va )
1
第10章
理想气体模型
气体分子运动论
统计假设
k
PV vRT
P P 2 n 3 kT k k 2 3 T E
M i E RT 2
dN f ( v ) dv N
麦克丝韦 分布率
v2
3RT
vp
2 RT
8RT
v
z 2d 2 v n
v 1 z 2d 2 n
Nf ( v )dv
v0
v0
f ( v )dv
v d N vNf (v) d v
v0—— ∞间的分子数 v0—— ∞间的分子的速率和
v0
dN Nf ( v )dv
v0
v0
vdN vNf ( v )dv
v0
(3) 多次观察一分子的速率,发现其速率大于v0 的 几率= ———。 dN N v v 所求为v0—— ∞间的分子 f (v)dv 数占总分子数的百分比 N N v
M i RT 2 M i RT 2
吸收热量Q
M i RT 2
摩尔热容C
CV i R 2
等容 等压 等温
p/T=C V/T=C pV=C
pVγ=C1 Vγ-1T=C2 pγ-1T-γ=C3
大学物理答案第七章热力学基础-习题解答

展望
学习方法建议
多做习题,提高解题能力 和综合分析能力。
加强理论学习,深入理解 热力学的物理意义和数学 表达。
关注学科前沿,了解热力 学在最新科研和技术中的 应用。
THANK YOU
感谢聆听
•·
热力学第一定律是能量守恒定律 在热学中的具体表现,它指出系 统能量的增加等于传入系统的热 量与外界对系统所做的功的和。
功的计算:在封闭系统中,外界 对系统所做的功可以通过热力学 第一定律进行计算,这有助于理 解系统能量的转化和利用。
能量平衡:利用热力学第一定律 ,可以分析系统的能量平衡,判 断系统是否处于热平衡状态。
热力学第二定律
热力学第二定律
描述了热力过程中宏观性质的自然方向性,即不可能把热量从低温物体传到高温物体而不引起其它变 化。
表达式
不可能通过有限个步骤将热量从低温物体传到高温物体而不引起其它变化。
03
热力学基础习题解答
热力学第一定律的应用
热量计算:通过热力学第一定律 ,可以计算系统吸收或放出的热 量,进而分析系统的能量变化。
热力学第二定律的应用
01
02
热力学第二定律指出,自
•·
发过程总是向着熵增加的
方向进行,即不可逆过程
总是向着宏观状态更混乱
、更无序的方向发展。
03
04
05
熵增加原理:根据热力学 第二定律,孤立系统的熵 永不减少,即自发过程总 是向着熵增加的方向进行 。
热机效率:利用热力学第 二定律,可以分析热机的 效率,探讨如何提高热机 的效率。
100%
制冷机效率的影响因素
制冷机效率受到多种因素的影响 ,如制冷剂的性质、蒸发温度和 冷凝温度、压缩机和冷却剂的流 量等。
(完整版)大学物理热学习题附答案

一、选择题1.一定量的理想气体贮于某一容器中,温度为T ,气体分子的质量为m 。
根据理想气体的分子模型和统计假设,分子速度在x 方向的分量平方的平均值 (A) m kT x 32=v (B) m kT x 3312=v (C) m kT x /32=v (D) m kT x /2=v2.一定量的理想气体贮于某一容器中,温度为T ,气体分子的质量为m 。
根据理想气体分子模型和统计假设,分子速度在x 方向的分量的平均值 (A) m kT π8=x v (B) m kT π831=x v (C) m kT π38=x v (D) =x v 03.温度、压强相同的氦气和氧气,它们分子的平均动能ε和平均平动动能w 有如下关系:(A) ε和w都相等 (B) ε相等,w 不相等 (C) w 相等,ε不相等 (D) ε和w 都不相等4.在标准状态下,若氧气(视为刚性双原子分子的理想气体)和氦气的体积比V 1 / V 2=1 / 2 ,则其内能之比E 1 / E 2为:(A) 3 / 10 (B) 1 / 2 (C) 5 / 6 (D) 5 / 35.水蒸气分解成同温度的氢气和氧气,内能增加了百分之几(不计振动自由度和化学能)?(A) 66.7% (B) 50% (C) 25% (D) 06.两瓶不同种类的理想气体,它们的温度和压强都相同,但体积不同,则单位体积内的气体分子数n ,单位体积内的气体分子的总平动动能(E K /V ),单位体积内的气体质量ρ,分别有如下关系:(A) n 不同,(E K /V )不同,ρ不同 (B) n 不同,(E K /V )不同,ρ相同(C) n 相同,(E K /V )相同,ρ不同 (D) n 相同,(E K /V )相同,ρ相同7.一瓶氦气和一瓶氮气密度相同,分子平均平动动能相同,而且它们都处于平衡状态,则它们(A) 温度相同、压强相同 (B) 温度、压强都不相同(C) 温度相同,但氦气的压强大于氮气的压强(D) 温度相同,但氦气的压强小于氮气的压强8.关于温度的意义,有下列几种说法:(1) 气体的温度是分子平均平动动能的量度;(2) 气体的温度是大量气体分子热运动的集体表现,具有统计意义;(3) 温度的高低反映物质内部分子运动剧烈程度的不同;(4) 从微观上看,气体的温度表示每个气体分子的冷热程度。
大学物理热力学基础习题课

答案:B 9、下列说法中,哪些是正确的
1、可逆过程一定是准静态过程;2、准静态过程一定是可逆的 4、不可逆过程一定是非准静态过程;4、非准静态过程一定是 不可逆的。
A、(1,4);B、(2,3);C、(1,3);D、(1,2,3,4)
答案:A
10、根据热力学第二定律,下列那种说法正确
A.功可一全部转换成热,但热不可以全部转换成功 B.热可以从高温物体传递到低温物体,反之则不行
Q QBC QAB 14.9 105 J 由图得, TA TC 全过程:
E 0
W Q E 14.9 105 J
3. 图所示,有一定量的理想气体,从初状态 a (P1,V1)开始,经过一个等容过程达到压强为 P1/4 的 b 态,再经过一个等压过程达到状态 c , 最后经过等温过程而完成一个循环。求该循环 过程中系统对外做的功 A 和吸收的热量 Q .
a
T2 300 1 1 25% T1 400
c
d
300 400
T(K)
8. 一卡诺热机在每次循环中都要从温度为 400 K 的高温热源吸热 418 J ,向低温热源放 热 334.4 J ,低温热源的温度为 320 K 。如 果将上述卡诺热机的每次循环都逆向地进行, 从原则上说,它就成了一部致冷机,则该逆向 4 卡诺循环的致冷系数为 。
解:设状态 c 的体积为V2 , 由于a , c 两状态的温度相同
故
p1 p1V1 V2 4 V2 4V1
循环过程 E 0 , Q W
而在 a b 等容过程中功 W1 0 在 b c 等压过程中功
p1 p1 3 W2 V2 V1 4V1 V1 p1V1 4 4 4
大学物理热学练习题[1].ppt(精选)PPT文档共19页
![大学物理热学练习题[1].ppt(精选)PPT文档共19页](https://img.taocdn.com/s3/m/d87a99bc0b1c59eef9c7b432.png)
61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
谢谢!
Hale Waihona Puke 大学物理热学练习题[1].ppt(精选)
36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的第 三要素 。
