大学物理热力学基础习题与解答
大学物理热力学基础习题与解答

1T2 T1
[D]
p a
b b
T1
d c c T2 V
填空题
1. 要使一热力学系统的内能增加,可以通过 做功 或 传热 两种方式,或者两种
方式兼用来完成。理想气体的状态发生变 化时,其内能的增量只决定于
温度的变化 ,而与 过程 无关。
2 .一气缸内储有 10 mol 单原子分子理想气体,
在压缩过程中,外力做功 209 J,气体温度升高 1
大学物理
热力学基础
选择题
1. 有两个相同的容器,容积不变,一个盛有氦气, 另一个盛有氢气(均可看成刚性分子),它们的压 强和温度都相等。现将5J 的热量传给氢气,使氢
气温度升高,如果使氦气也升高同样的温度,则 应向氦气传递的热量是
(A) 6 J (C) 3 J
(B) 5 J (D) 2 J
[C]
ΔQ M mCvΔT
3. 对于室温下的双原子分子理想气体,在等压
膨胀的情况下,系统对外所作的功与从外
界吸收的热量之比W / Q 等于:
(A)1 / 3
(B)1 / 4
(C)2 / 5
(D)2 / 7
(D )
WpΔVmRΔT M
QΔEWm5ΔTmRΔT7mRΔT
M2 M
2M
4.热力学第一定律表明: (A)系统对外所作的功小于吸收的热量; (B)系统内能的增量小于吸收的热量; (C)热机的效率小于1; (D)第一类永动机是不可能实现的。
(P1,V1)开始,经过一个等容过程达到压强为 P1/4 的 b 态,再经过一个等压过程达到状态 c , 最后经过等温过程而完成一个循环。求该循环
过程中系统对外做的功 A 和吸收的热量 Q .
解:设状态 c 的体积为V2 , 由于a , c 两状态的温度相同
大学物理学热力学基础练习题

《大学物理学》热力学基础一、选择题13-1.如图所示,bca 为理想气体的绝热过程,b 1a 和b 2a 是任意过程,则上述两过程中气体做功与吸况是 ( )(A )b 1a 过程放热、作负功,b 2a (B )b 1a 过程吸热、作负功,b 2a 过程放热、作负功; (C )b 1a 过程吸热、作正功,b 2a 过程吸热、作负功; (D )b 1a 过程放热、作正功,b 2a 过程吸热、作正功。
【提示:体积压缩,气体作负功;三个过程中a 和b 两点之间的内能变化相同,bca 线是绝热过程,既不吸热也不放热,b 1a 过程作的负功比b 2a 过程作的负功多,由Q W E =+∆知b 2a 过程放热,b 1a 过程吸热】13-2.如图,一定量的理想气体,由平衡态A 变到平衡态B ,且他们的压强相等,即A B P P =。
问在状态A 论经过的是什么过程,气体必然 ( ) (A )对外作正功;(B )内能增加; (C )从外界吸热;(D )向外界放热。
【提示:由于ABTT <,必有AB EE <;而功、热量是过程量,与过程有关】13-3.两个相同的刚性容器,一个盛有氢气,一个盛氦气(均视为刚性理想气体),开始时它们的压强和温度都相同,现将 3 J 的热量传给氦气,使之升高到一定的温度,若氢气也升高到同样的温度,则应向氢气传递热量为 ( )(A )6J ; (B )3J ; (C )5J ; (D )10J 。
【提示:等体过程不做功,有Q E =∆,而2mol M iE R T M ∆=∆,所以需传5J 】13-4.有人想象了如图所示的四个理想气体的循环过程,则在理)不能相交】 13-5.一台工作于温度分别为327℃和( )(A )2000J ; (B )1000J ; (C )4000J ; (D )500J 。
【卡诺热机的效率为211T T η=-,W Qη=,可求得300150%600η=-=,则1000W Q J η==】13-6.根据热力学第二定律( )(A )自然界中的一切自发过程都是不可逆的; (B )不可逆过程就是不能向相反方向进行的过程;(C )热量可以从高温物体传到低温物体,但不能从低温物体传到高温物体;(D )任何过程总是沿熵增加的方向进行。
大学物理习题册答案第12单元 热力学基础
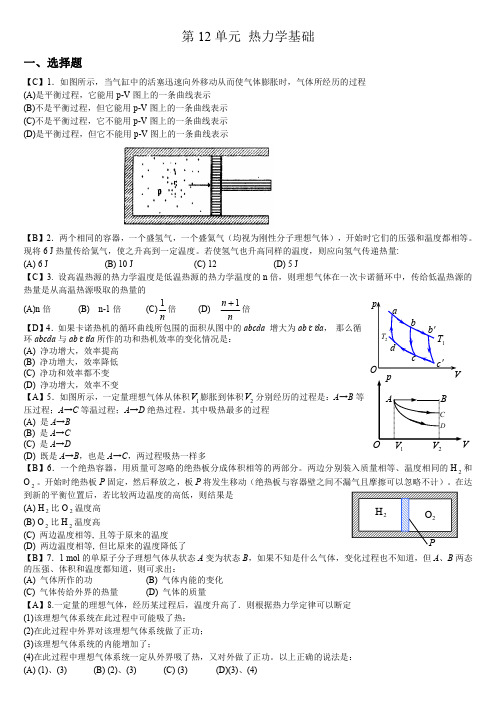
第12单元热力学基础一、选择题【C 】1.如图所示,当气缸中的活塞迅速向外移动从而使气体膨胀时,气体所经历的过程(A)是平衡过程,它能用p-V 图上的一条曲线表示(B)不是平衡过程,但它能用p-V 图上的一条曲线表示(C)不是平衡过程,它不能用p-V 图上的一条曲线表示(D)是平衡过程,但它不能用p-V图上的一条曲线表示【B 】2.两个相同的容器,一个盛氢气,一个盛氦气(均视为刚性分子理想气体),开始时它们的压强和温度都相等。
现将6J 热量传给氦气,使之升高到一定温度。
若使氢气也升高同样的温度,则应向氢气传递热量:(A)6J (B)10J (C)12(D)5J【C 】3.设高温热源的热力学温度是低温热源的热力学温度的n 倍,则理想气体在一次卡诺循环中,传给低温热源的热量是从高温热源吸取的热量的(A)n 倍(B)n-1倍(C)n 1倍(D)n n 1+倍【D 】4.如果卡诺热机的循环曲线所包围的面积从图中的abcda 增大为ab 'c 'da ,那么循环abcda 与ab 'c 'da 所作的功和热机效率的变化情况是:(A)净功增大,效率提高(B)净功增大,效率降低(C)净功和效率都不变(D)净功增大,效率不变【A 】5.如图所示,一定量理想气体从体积1V 膨胀到体积2V 分别经历的过程是:A →B 等压过程;A →C 等温过程;A →D 绝热过程。
其中吸热最多的过程(A)是A →B (B)是A →C (C)是A →D (D)既是A →B ,也是A →C ,两过程吸热一样多【B 】6.一个绝热容器,用质量可忽略的绝热板分成体积相等的两部分。
两边分别装入质量相等、温度相同的H 2和O 2。
开始时绝热板P 固定,然后释放之,板P 将发生移动(绝热板与容器壁之间不漏气且摩擦可以忽略不计)。
在达到新的平衡位置后,若比较两边温度的高低,则结果是(A)H 2比O 2温度高(B)O 2比H 2温度高(C)两边温度相等,且等于原来的温度(D)两边温度相等,但比原来的温度降低了【B 】7.1mol 的单原子分子理想气体从状态A 变为状态B ,如果不知是什么气体,变化过程也不知道,但A 、B 两态的压强、体积和温度都知道,则可求出:(A)气体所作的功(B)气体内能的变化(C)气体传给外界的热量(D)气体的质量【A 】8.一定量的理想气体,经历某过程后,温度升高了.则根据热力学定律可以断定(1)该理想气体系统在此过程中可能吸了热;(2)在此过程中外界对该理想气体系统做了正功;(3)该理想气体系统的内能增加了;(4)在此过程中理想气体系统一定从外界吸了热,又对外做了正功。
(完整版)大学物理热学习题附答案

一、选择题1.一定量的理想气体贮于某一容器中,温度为T ,气体分子的质量为m 。
根据理想气体的分子模型和统计假设,分子速度在x 方向的分量平方的平均值 (A) m kT x 32=v (B) m kT x 3312=v (C) m kT x /32=v (D) m kT x /2=v2.一定量的理想气体贮于某一容器中,温度为T ,气体分子的质量为m 。
根据理想气体分子模型和统计假设,分子速度在x 方向的分量的平均值 (A) m kT π8=x v (B) m kT π831=x v (C) m kT π38=x v (D) =x v 03.温度、压强相同的氦气和氧气,它们分子的平均动能ε和平均平动动能w 有如下关系:(A) ε和w都相等 (B) ε相等,w 不相等 (C) w 相等,ε不相等 (D) ε和w 都不相等4.在标准状态下,若氧气(视为刚性双原子分子的理想气体)和氦气的体积比V 1 / V 2=1 / 2 ,则其内能之比E 1 / E 2为:(A) 3 / 10 (B) 1 / 2 (C) 5 / 6 (D) 5 / 35.水蒸气分解成同温度的氢气和氧气,内能增加了百分之几(不计振动自由度和化学能)?(A) 66.7% (B) 50% (C) 25% (D) 06.两瓶不同种类的理想气体,它们的温度和压强都相同,但体积不同,则单位体积内的气体分子数n ,单位体积内的气体分子的总平动动能(E K /V ),单位体积内的气体质量ρ,分别有如下关系:(A) n 不同,(E K /V )不同,ρ不同 (B) n 不同,(E K /V )不同,ρ相同(C) n 相同,(E K /V )相同,ρ不同 (D) n 相同,(E K /V )相同,ρ相同7.一瓶氦气和一瓶氮气密度相同,分子平均平动动能相同,而且它们都处于平衡状态,则它们(A) 温度相同、压强相同 (B) 温度、压强都不相同(C) 温度相同,但氦气的压强大于氮气的压强(D) 温度相同,但氦气的压强小于氮气的压强8.关于温度的意义,有下列几种说法:(1) 气体的温度是分子平均平动动能的量度;(2) 气体的温度是大量气体分子热运动的集体表现,具有统计意义;(3) 温度的高低反映物质内部分子运动剧烈程度的不同;(4) 从微观上看,气体的温度表示每个气体分子的冷热程度。
大学物理2-1第九章(热力学基础)习题答案

习 题 九一系统由图示的状态a 经acd 到达状态b ,系统吸收了热量,系统对外作功。
()若过程系统对外作功 ,问有多少热量传入系统? ()当系统由沿曲线返回状态,外界对系统作功 ,试问系统是吸热还是放热? 热量是多少?[解] 由热力学第一定律A E Q +∆= 得 A Q E -=∆在<过程中,E E E a b ∆=-J A Q 19412632011=-=-= 在过程中 J A E Q 236421942=+=+∆=在过程中 J A E A E E Q b a 27884194333-=--=+∆-=+-= 本过程中系统放热。
氮气由温度为 ,压强为510013.1⨯ ()的初态等温地压缩到 510026.2⨯()。
求气体放出的热量。
[解] 在等温过程中气体吸收的热量等于气体对外做的功,所以J P P RT M m A Q mol T 3211046.321ln 30031.82ln ⨯-=⨯⨯⨯=== 即气体放热为J 31046.3⨯。
一定质量的理想气体的内能随体积的变化关系为 图上的一条过原点的直线,如图所示。
试证此直线表示等压过程。
[证明] 设此直线斜率为,则此直线方程为kv E =又随温度的关系变化式为T k T C M ME v mol'=⋅= 所以T k kV '= 因此C kk T V ='=(C 为恒量) 又由理想气体的状态方程知,C TpV'= (C '为恒量) 所以 为恒量即此过程为等压过程。
氧气由状态变化到状态所经历的过程如图所示:()沿→→路径。
()→直线。
试分别求出两过程中氧气对外作的功、吸收的热量及内能的变化。
[解] () 在→→这一过程中,做功的大小为该曲线下所围的面积,氧气对外做负功。
()()J V V P A 4352121101.81010013.1105020⨯-=⨯⨯⨯-⨯-=--=由气体的内能公式T C E V ν=和理想气体的状态方程RT pV ν=得pV i R RpViR pVC R pV C E V v 22====νν 对于氧气,所以其内能的变化为 ()()()J 103.11010013.1505102025254351122⨯-=⨯⨯⨯⨯-⨯⨯=-=∆-V p V p E 此过程吸收的热量为 ()J 104.9101.8103.1444111⨯-=⨯-⨯-=+∆=A E Q ()在从→过程中,由图知氧气对外作功为()()()()J V V p p A 43521122101.51010013.110505202121⨯-=⨯⨯⨯-⨯+⨯-=-+-= 内能的变化 ()J 103.14122⨯-=-=∆E E E吸收的热量 ()J 104.6101.5103.1444222⨯-=⨯-⨯-=+∆=A E Q单原子理想气体在压缩过程中外界对它作功,其温度上升,试求:() 气体吸收的热量与内能的增量。
《大学物理》热力学基础练习题及答案解析

《大学物理》热力学基础练习题及答案解析一、简答题:1、什么是准静态过程?答案:一热力学系统开始时处于某一平衡态,经过一系列状态变化后到达另一平衡态,若中间过程进行是无限缓慢的,每一个中间态都可近似看作是平衡态,那么系统的这个状态变化的过程称为准静态过程。
2、从增加内能来说,做功和热传递是等效的。
但又如何理解它们在本质上的差别呢?答:做功是机械能转换为热能,热传递是热能的传递而不是不同能量的转换。
3、一系统能否吸收热量,仅使其内能变化? 一系统能否吸收热量,而不使其内能变化?答:可以吸热仅使其内能变化,只要不对外做功。
比如加热固体,吸收的热量全部转换为内能升高温度;不能吸热使内能不变,否则违反了热力学第二定律。
4、有人认为:“在任意的绝热过程中,只要系统与外界之间没有热量传递,系统的温度就不会改变。
”此说法对吗? 为什么?答:不对。
对外做功,则内能减少,温度降低。
5、分别在Vp-图、Tp-图上,画出等体、等压、等温和绝热过程的曲线。
V-图和T6、 比较摩尔定体热容和摩尔定压热容的异同。
答案:相同点:都表示1摩尔气体温度升高1摄氏度时气体所吸收的热量。
不同点:摩尔定体热容是1摩尔气体,在体积不变的过程中,温度升高1摄氏度时气体所吸收的热量。
摩尔定压热容是1摩尔气体,在压强不变的过程中,温度升高1摄氏度时气体所吸收的热量。
两者之间的关系为R C C v p +=7、什么是可逆过程与不可逆过程答案:可逆过程:在系统状态变化过程中,如果逆过程能重复正过程的每一状态,而且不引起其它变化;不可逆过程:在系统状态变化过程中,如果逆过程能不重复正过程的每一状态,或者重复正过程时必然引起其它变化。
8、简述热力学第二定律的两种表述。
答案:开尔文表述:不可能制成一种循环工作的热机,它只从单一热源吸收热量,并使其全部变为有用功而不引起其他变化。
克劳修斯表述:热量不可能自动地由低温物体传向高温物体而不引起其他变化。
9、什么是第一类永动机与第二类永动机?答案:违背热力学第一定律(即能量转化与守恒定律)的叫第一类永动机,不违背热力学第一定律但违背热力学第二定律的叫第二类永动机。
大学热力学基础习题答案

大学热力学基础习题答案【篇一:《物理学基本教程》课后答案第七章热力学基础】>7-1 假设火箭中的气体为单原子理想气体,温度为2000 k,当气体离开喷口时,温度为1000 k,(1)设气体原子质量为4个原子质量单位,求气体分子原来的方均根速率v2气体离开喷口时的流速(即分子定向运动速度)大小相等,均沿同一方向,求这速度的大小,已知气体总的能量不变.分析气体动理论的能量公式表明,气体的温度是气体分子平均平动动能的量度.当气体的内能转化为定向运动的动能时,即表现为平均平动动能的减少,也就是温度的降低.解(1)由气体动理论的能量公式mv2?2v2132kt,得?3ktm?3?1.38?10?23?2000?274?1.6605?10m/s?3530.7 m/s(2)气体总的能量不变,气体内能的减少应等于定向运动动能的增量,就气体分子而言,即分子的平均平动动能的减少应等于定向运动动能的增量.若分子定向运动速度为vd,则有12mvd?232kt1?32kt2vd?3k(t1?t2)m?3?1.38?10?23?(2000?1000)?274?1.6605?10m/s?2496.6 m/s7-2 单原子理想气体从状态a经过程abcd到状态d,如图7-2所示.已知pa?pd?1.013?10 pa55,pb?pc?2.026?10 pa,vb?1.5 l,va?1 l,vc?3 l,(1)试计算气体在abcd过程中作的功,内能的变化和吸收的热量;(2)如果气体从状态d保持压强不变到a状态,如图中虚线所示,问以上三项计算变成多少?(3)若过程沿曲线从a到c状态,已知该过程吸热257 cal,求该过程中气体所作的功.分析理想气体从体积v1膨胀到体积v2的过2v程中所作的功为?p(v)dv,其量值为p?v图上 0 1 1.53 4v/lv1过程曲线下的面积.如果过程曲线下是规则的几图7-2何图形,通常可以直接计算面积获得该过程中气体所作的功.解(1)气体在abcd过程中作的功应等于过程曲线下的面积,得wabcd?s14da?sadcb?1.013?10?3?10?531.8 pa5?3?12?1.013?10?(3?1.5)?105?3pa内能改变为ed?ea? ?mm32cv,m(td?ta)?53m2m?3r(td?ta)??1?10?332pa(vd?va)?1.013?10?(4?10) j?455.9 j应用热力学第一定律,系统吸热为q?wabcd?ed?ea?531.8 j?455.9 j?987.7 j(2)气体在等压过程da中作的功为wda?pa(va?vd)?1.013?10?(1?4)?105?3j?-303.9 j内能改变为 ed?ea??455. 9j系统吸热为q?wda?ea?ed??303.9 j-455.9 j??759.8 j (3)若沿过程曲线从a到c状态,内能改变为ec?ea? ?mm32cv,m(tc?ta)?3m2mr(tc?ta)?5?332(pcvc?pava)?(2?3?1?1)?1.013?10?10 j?759.8 j应用热力学第一定律,系统所作的功为wac?qac?ec?ea?257?4.18 j-759.8 j?314.5 j7-3 2 mol的氮气从标准状态加热到373 k,如果加热时(1)体积不变;(2)压强不变,问在这两种情况下气体吸热分别是多少?哪个过程吸热较多?为什么?分析根据热力学第一定律,系统从外界吸收的热量,一部分用于增加系统的内能,另一部分用于对外作功.理想气体的内能是温度的单值函数,在常温和常压下氮气可视为理想气体,无论经过什么样的准静态过程从标准状态加热到373 k,其内能的变化都相同.在等体过程中气体对外不作功,系统从外界吸收的热量,全部用于系统的内能的增加,而在等压过程中,除增加内能外,还要用于系统对外作功,因此吸热量要多些.解(1)氮气可视为双原子理想气体,i?5.在等体过程中,系统吸热为qv?mim2r(t2?t1)?2?52?8.31?(373?273) j?4155 j(2)在等压过程中,系统吸热为qp?mi?2m2r(t2?t1)?2?72?8.31?(373?273) j?5817 j分析气体在等压过程中吸收的热量为qp?mi?2m2r(t2?t1),其中t1已知,t2可以通过气体状态方程由已知的该状态的压强和体积求出.用同样的方法可以计算内能的变化.再应用热力学第一定律计算出系统所作的功.解(1)气体在等压过程中吸收的热量为qp? ?mi?2m722r(t2?t1)?5?3i?22?10(pv2?mmrt1)?(3?10?10?1032?8.31?283) j?7928 j(2)内能的变化为e2?e1? ?52mim2r(t2?t1)?5?3i2?(pv2?mmrt1)?(3?10?10?101032?8.31?283) j?5663 j(3)应用热力学第一定律,系统所作的功为w?q?e2?e1?7928 j-5663 j?2265 j7-5 双原子理想气体在等压膨胀过程中吸收了500 cal的热量,试求在这个过程中气体所作的功.解双原子理想气体在等压膨胀过程中吸热为qp?mi?2m2r(t2?t1)?i?22p(v2?v1)所作的功为wp?p(v2?v1)?2i?2qp?25?2?500?4.18 j?597 j分析在热力学中,应该学会充分利用p?v图分析和解题.从图7-6所示的p?v图 p可以看出,ac和db过程为等体过程,ad和cb过程为等压过程.理想气体的内能是温度的 p单值函数,在常温和常压下氧气可视为理想气体,只要始末状态相同,无论经过什么样的准静态过程,其内能的变化都相同.但是气体吸o v1 v2 v图7-6收的热量和完成的功则与过程有关,在等压过程中吸收的热量为qp?mi?2m2r(t2?t1),在等体过程中吸收的热量为qv?mim2r(t2?t1),其中温度值可以利用状态方程代换为已知的压强和体积参量.解(1)经acb过程,即经等体和等压过程,气体吸热为qacb?qv?qp? ? ?i?225?22p2v2?i25i2(pcvc?pava)?i?22(pbvb?pcvc)p1v1?p2v1?352?8.2?10?3?105?3?6?10?4.5?10 j? j?6?10?3?105?3j?1500 j所作的功为wacb?wcb?p2(v2?v1)?6?10?(4.5?3)?105?3j?900 j应用热力学第一定律,系统内能改变为eb?ea?qacb?wacb?1500 j-900 j?600 j(2)经adb过程,所作的功为wadb?wad?p1(v2?v1)?8.2?10?(4.5?3)?105?3j?1230 jj 系统内能改变为 eb?ea?600【篇二:大学物理气体动理论热力学基础复习题及答案详解】>一、填空题:轮胎内空气的压强是。
大学物理 第6章 练习答案

第六章 热力学基础练 习 一一. 选择题1. 一绝热容器被隔板分成两半,一半是真空,另一半是理想气体,若把隔板抽出,气体将进行自由膨胀,达到平衡后( A ) (A) 温度不变,熵增加; (B) 温度升高,熵增加;(C) 温度降低,熵增加; (D) 温度不变,熵不变。
2. 对于理想气体系统来说,在下列过程中,哪个过程系统所吸收的热量、内能的增量和对外作做的功三者均为负值。
( C ) (A) 等容降压过程; (B) 等温膨胀过程; (C) 等压压缩过程; (D) 绝热膨胀过程。
3. 一定量的理想气体,分别经历如图1(1)所示的abc 过程(图中虚线ac 为等温线)和图1(2)所示的def 过程(图中虚线df 为绝热线) 。
判断这两过程是吸热还是放热:( A ) (A) abc 过程吸热,def 过程放热; (B) abc 过程放热,def 过程吸热; (C) abc 过程def 过程都吸热; (D) abc 过程def 过程都放热。
4. 如图2,一定量的理想气体,由平衡状态A 变到平衡状态B(A p =B p ),则无论经过的是什么过程,系统必然( B ) (A) 对外做正功; (B) 内能增加; (C) 从外界吸热; (D) 向外界放热。
二.填空题1. 一定量的理想气体处于热动平衡状态时,此热力学系统不随时间变化的三个宏观量是P V T ,而随时间变化的微观量是每个分子的状态量。
2. 一定量的单原子分子理想气体在等温过程中,外界对它做功为200J ,则该过程中需吸热__-200__ ___J 。
3. 一定量的某种理想气体在某个热力学过程中,外界对系统做功240J ,气体向外界放热620J ,则气体的内能 减少,(填增加或减少),21E E = -380 J 。
4. 处于平衡态A 的热力学系统,若经准静态等容过程变到平衡态B ,将从外界吸热416 J ,若经准静态等压过程变到与平衡态B 有相同温度的平衡态C ,将从外界吸热582 J ,所以,从平衡态A 变到平衡态C 的准静态等压过程中系统对外界所做的功为 582-416=166J 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
? ? 1? T2
T1
[D]
p a
b b?
T1
d c c? T2
V
填空题
1. 要使一热力学系统的内能增加,可以通过 做功 或 传热 两种方式,或者两种
方式兼用来完成。理想气体的状态发生变 化时,其内能的增量只决定于
温度的变化 ,而与 过程 无关。
2 .一气缸内储有 10 mol 单原子分子理想气体,
大学物理
热力学基础
选择题
1. 有两个相同的容器,容积不变,一个盛有氦气, 另一个盛有氢气(均可看成刚性分子) ,它们的压 强和温度都相等。现将 5J 的热量传给氢气,使氢
气温度升高,如果使氦气也升高同样的温度,则 应向氦气传递的热量是
(A) 6 J (C) 3 J
(B) 5 J (D) 2 J
[C]
Q ? ΔE ? W ? m 5 ΔT ? m RΔT ? 7 m RΔT
M2 M
2M
4.热力学第一定律表明: (A)系统对外所作的功小于吸收的热量; (B)系统内能的增量小于吸收的热量; (C)热机的效率小于 1; (D)第一类永动机是不可能实现的。
(D )
5. 如图所示,一定量理想气体从体积为 V1 膨胀到V2 , AB 为等压过程, AC 为等温过程, AD为绝热过程, 则吸热最多的是:
ΔQ
?
m M
CvΔT
5 ? m 5 ΔT M2
ΔQ ? m 3 ΔT M2
2. 对于理想气体系统来说,在下列过程中,哪 个过程系统所吸收的热量、内能的增量和对 外作的功三者均为负值:
(A)等容降压过程 (B)等温膨胀过程
(C)绝热膨胀过程 (D)等压压缩过程
( D)
A :W ? 0 B : ΔE ? 0 W ? 0 C : ΔQ ? 0 0 ? ΔE ? W
(A) AB 过程 (B)AC 过程 (C) AD 过程 (D)不能确定
Q ? ΔE ? W QAD ? 0 ? EAC ? 0
[A ]
6. 根据热力学第二定律判断下列哪种说法是
正确的: (A)热量能从高温物体传到低温物体,但不能
从低温物体传到高温物体;
(B)功可以全部变为热,但热不能全部变为功;
1? V1.4 ? p??V ??1.4 ?5 ?
300? V1.4?1 ? T??V ??1.4?1 ?5?
5.某理想气体在 p-V图上等温线与绝热线相交于
A点,如图。已知 A点的压强 p1 ? 2 ? 10 5 Pa ,体 积 V1 ? 0.5 ? 10?3 m3 ,而且 A点处等温线斜率与绝
O
V1 V2
V
6.一定量的理想气体从同一初态 A出发,分别经 历等压、等温、绝热三种过程由体积 V1膨胀到V2。 在上述三种过程中, 等压 过程对外作功最多;
绝热 过程对外作功最少, 等压 过程内能 增加; 绝热 过程内能减少。
Q ? ΔE ? W QAD ? 0 ? EAC ? 0
7. 以一定量的理想气体作为工作物质,在 P - T 图中经图示的循环过程。图中 a → b及 c → d为 两个绝热过程,则循环过程为 卡诺 循环,
T1 ? T2 ΔE ? 0 Q ? W ? 0
[B ]
8. 如图,一卡诺机由原来采用循环过程 a b c d a
改为采用循环过程 ab' c' da ,则循环过程 的
(A)净功增大,效率提高; (B)净功增大,效率降低; (C)净功和效率都不变; (D)净功增大,效率不变
Wabcd ? Wab' c' d
在压缩过程中,外力做功 209 J,气体温度升高 1
K,则气体内能的增量 ΔE 为
124.7 J ,
吸收的热量 Q 为 -84.35 J。
ΔE ? 10? 3 ? 8.31? 1 ? 124.7 J 2
Q ? ΔE ? W ? 124.7 J? (-209J ) ? -84.3J
3. 16 g 氧气在 400 K 温度下等温压缩,气 体放出的热量为 1152 J ,则被压缩后的气体 的体积为原体积的 1/2 倍,而压强为原来 压强的 2 倍。
热线斜率之比为 0.714。现使气体从 A点绝热膨胀
至B点,其体积 V2 ? 1? 10 ?3 m3,B点处的压强
为 7.58×104Pa 。
p
pV? ? C
d p ? ?? p
dV V
p1
A
pV ? C d p ? ? p
B
dV
? ? 1/ 0.714 ? 1.4
V
p1 p2
?
????VV12????1来自4其效率为 25% 。
p
b
a
? ? 1? T2 ? 1? 300 ? 25%
c
T1
400
d
300
400
T(K)
8. 一卡诺热机在每次循环中都要从温度为
400 K 的高温热源吸热 418 J ,向低温热源放
热 334.4 J ,低温热源的温度为 320 K 。如
果将上述卡诺热机的每次循环都逆向地进行,
Q ? ?1152 ? 16 ? 8.31? 400 ? ln V2
32
V1
V2 ? 0.5V1 p2 ? 2 p1
4.一定量的氧气,经绝热压缩过程,体积变为
原来的五分之一,若初始温度为 27?C ,压强为
1 atm ,则压缩后的压强为 9.52 atm,温度
为 571 K。
pV? ? C TV? ?1 ? C
从原则上说,它就成了一部致冷机,则该逆向
卡诺循环的致冷系数为 4
。
? ? 1? T2 ? 1? 334.4
400
418
T2 ? 320K
e ? T2 ? 320 ? 4 T1 ? T2 400 ? 320
计算题
1.1mol 氢气,在压强为 1 atm ,温度为 20 oC 时, 体积为V0 . 现使氢气分别经如下过程到达同一末态。 (1)先保持体积不变,加热使其温度升高到 80 oC, 然后令其作等温膨胀,直至体积变为原体积的两倍; ( 2 )先使其作等温膨胀至体积为原体积的两倍, 然后保持体积不变,加热到 80 oC .
(C )气体能够自由膨胀,但不能自由压缩;
(D)有规则运动的能量能够变为无规则运动的能 量,但无规则运动的能量不能够变为有规则
运动的能量。
[C]
7. 一定量理想气体,沿着图中直线状态从 a 变 到状态 b ,则在此过程中 (A) 气体对外作正功,向外界放出热量; (B) 气体对外作正功,从外界吸热; (C) 气体对外作负功,向外界放出热量; (D) 气体对外作正功,内能减少。
D:W?
m M
R(T2
? T1) ?
0
ΔE ? 0 ΔQ ? ΔE ? W ? 0
3. 对于室温下的双原子分子理想气体,在等压 膨胀的情况下,系统对外所作的功与从外 界吸收的热量之比W / Q 等于:
(A)1 / 3
(B)1 / 4
(C)2 / 5
(D)2 / 7
(D )
W ? pΔV ? m RΔT M
